一种基于毛细管电泳的细胞内的5‑氟胞嘧啶和5‑氟尿嘧啶的检测方法与流程
本发明属于细胞检测领域,特别涉及一种基于毛细管电泳的细胞内的5-氟胞嘧啶和5-氟尿嘧啶的检测方法。
背景技术:
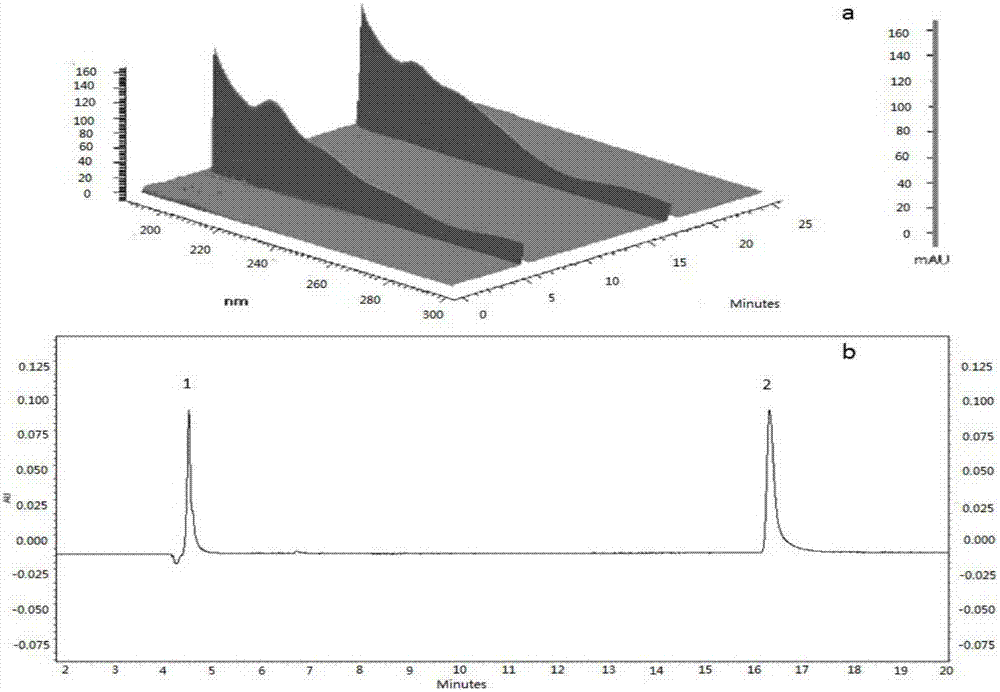
:5-氟尿嘧啶(5-fu)是尿嘧啶的同类物,尿嘧啶是核糖核苷酸的一个组分。5-氟尿嘧啶是以抗代谢物而起作用,在细胞内转化为有效的氟尿嘧啶核苷酸后,通过阻断脱氧核糖尿苷酸受细胞内胸苷酸合成酶的作用转化为胸苷酸,而干扰dna的合成,同时对rna的合成也有一定抑制作用。它在被转换成核苷酸后,被活跃分裂的组织及肿瘤所优先摄取。临床上用于多种肿瘤,如消化道肿瘤、乳腺癌、卵巢癌、绒毛膜上皮癌、宫颈癌、膀胱癌、肝癌、皮肤癌等的有效治疗,尤其对消化道癌及其他实体瘤有良好疗效。5-氟胞嘧啶(5-fc)为抑菌剂,高浓度时具杀菌作用。其作用机制在于药物通过真菌细胞的渗透酶系统进入细胞内,在真菌细胞内所具有的胞嘧啶脱氨酶的作用下转化为氟尿嘧啶。替代尿嘧啶进入真菌的核糖核酸中,从而阻断核酸的合成,导致细胞的凋亡。胞嘧啶脱氨酶是存在于大肠杆菌和真菌中的一种代谢酶,哺乳动物类细胞不含该酶,此酶若在哺乳动物细胞中表达可将原药5-氟胞嘧啶代谢为5-氟尿嘧啶从而导致细胞自杀性死亡。肿瘤治疗中的自杀基因疗法,即将编码胞嘧啶脱氨酶的基因转染肿瘤细胞,在外源施加5-氟胞嘧啶的情况下,将一定量的5-氟胞嘧啶转化为5-氟尿嘧啶,以降低直接给予5-氟尿嘧啶所发生的毒副作用。目前,对细胞外碱基进行分离,尤其是对嘌呤碱基研究得比较多,而对于从细胞内提取物中分离5-氟胞嘧啶和5-氟尿嘧啶的研究尚未进行。技术实现要素:本发明所要解决的技术问题是提供一种基于毛细管电泳的细胞内的5-氟胞嘧啶和5-氟尿嘧啶的检测方法,本发明分离效率高,样品用量少,分离时间短,分析成本低等特点,达到对细胞内的5-氟胞嘧啶和5-氟尿嘧啶的定性和定量检测,该方法有别于高效液相色谱的分离方法。本发明的一种基于毛细管电泳的细胞内的5-氟胞嘧啶和5-氟尿嘧啶的检测方法,包括:(1)用携带自杀基因fcy1的质粒转染细胞,并在培养基中添加5-氟胞嘧啶和/或5-氟尿嘧啶进行培养,然后收集细胞代谢提取物;(2)采用毛细管电泳法对细胞代谢提取物中5-氟胞嘧啶和/或5-氟尿嘧啶进行定性和定量检测,其中检测条件为:吸收波长200-220nm,浓度为30-90mm,ph8.5-10.5的硼酸盐缓冲液,分离温度采用25-35℃,分离电压20-30kv,采用压力进样,进样压力为0.5-1.5psi,进样时间10-20s。步骤(1)中自杀基因fcy1能够编码胞嘧啶脱氨酶,胞嘧啶脱氨酶能够将5-fc转化为5-fu,而哺乳动物细胞不含有能够编码胞嘧啶脱氨酶的基因;将自杀基因fcy1转入哺乳动物细胞中,并施加5-fc进行培养,构成了自杀基因系统cd/5-fc。所述步骤(1)中培养基为含有10%血清、1%双抗(青霉素、链霉素)的dmem培养基。所述步骤(1)中收集细胞代谢提取物为:收集细胞后,用细胞计数板计数,取细胞量为1×107个细胞加入四倍体积的淬灭液,4℃保存,离心,分离上清液和沉淀;细胞沉淀加入1ml提取液,枪头混匀后,冰浴10min,然后离心取上清。所述淬灭液为0.9g/l的nacl溶液;提取液为体积百分浓度为50%的乙腈。优选所述步骤(2)中毛细管电泳的检测条件为:最佳条件吸收波长210nm,浓度为60mm,ph9.5的硼酸盐缓冲液,分离温度采用30℃,分离电压25kv,采用压力进样,进样压力为1.0psi,进样时间15s。毛细管电泳检测条件的优化,吸收波长的选择:5-fc和5-fu的最大吸收波长在200~220nm之间,为获得较均衡的灵敏度,选择210nm作为检测波长。毛细管电泳检测条件的优化,缓冲溶液浓度的选择:设计了30mm,60mm和90mm三个浓度的硼酸盐缓冲液,为了获得短的迁移时间和好的分离效果,实验中选择浓度为60mm的硼酸盐缓冲溶液作为为最佳实验浓度。步骤(2)中毛细管电泳检测条件的优化,缓冲溶液ph值的选择:ph为8.5时,细胞提取物的5-fc和5-fu分离效果不好,ph为10.5时,5-fu拖尾严重,结合迁移时间和分离度随ph变化情况的考察,选择缓冲溶液的ph值为9.5。步骤(2)中毛细管电泳检测条件的优化,分离电压的选择:比较20kv,25kv,30kv,分离电压高,迁移时间减小,分离效率降低,本文采用25kv作为最佳分离电压。步骤(2)中毛细管电泳检测条件的优化,分离温度的选择:温度的影响在25~35℃范围内,温度升高迁移时间减少,但高的温度并不一定能带来好的分离效率,为得到高的分离效率,采用30℃作为最佳分离温度。步骤(2)中毛细管电泳检测条件的优化,进样条件的选择:进样压力和进样时间的增加,5-fc和5-fu与细胞提取物的峰面积都增加,然而分离效果变差,因此采用压力进样1.0psi,进样时间15s。步骤(2)中毛细管电泳对5-氟胞嘧啶、5-氟尿嘧啶的定量检测方程为:5-氟胞嘧啶5-fc的工作曲线方程为:y=620.76x+719.5;5-氟尿嘧啶5-fu的工作曲线为:y=272.31x+858.61,其中y是峰面积,x是碱基浓度。步骤(2)对毛细管电泳对5-氟胞嘧啶、5-氟尿嘧啶的定量检测的检测线,5-氟胞嘧啶5-fc为1.33μm,5-氟尿嘧啶5-fu为2.04μm。根据优化后的毛细管电泳方法对细胞代谢物中5-fc和5-fu的定性定量分析,在培养基中未添加5-fc的293t细胞,提取物中没有检测到5-fc。培养基中添加5-fc的293t细胞检测到了5-fc,但没有检测到5-fu。培养基中添加5-fc的转染fcy1基因的293t细胞提取物中检测到了5-fc和5-fu。并且5-fu的量为25.8μm。有益效果高效液相色谱的方法检测5-fu中,存在柱效低,成本高,分离效果差,分离时间长,和检测器不灵敏等缺点,而本发明分离效率高,样品用量少,分离时间短,分析成本低等特点,达到对细胞内的5-氟胞嘧啶和5-氟尿嘧啶的定性和定量检测,该方法有有效克服了高效液相色谱分离方法的缺点;本发明应用优化的毛细管电泳方法对携带自杀基因fcy1细胞模型的代谢提取物中5-fc和5-fu进行定性定量分析。附图说明图1为5-fc和5-fu的吸收波长;其中(a)为两种碱基吸收波长的三维图,(b)为两种碱基在波长为210nm处的吸收谱图;图2为缓冲溶液不同浓度的毛细管电泳谱图;其中(a)为30mm,(b)为60mm,(c)为90mm;图3为缓冲溶液不同ph值的毛细管电泳谱图;其中(a)ph8.5,(b)ph9.5,(c)ph10.5;图4为不同分离电压的毛细管电泳谱图;其中(a)20kv,(b)25kv,(c)30kv;图5为不同温度的毛细管电泳谱图;其中(a)25℃,(b)30℃,(c)35℃;图6为不同进样压力的毛细管电泳谱图;其中(a)0.5psi,(b)1.0psi,(c)1.5psi;图7为不同进样时间的毛细管电泳谱图;其中(a)10s,(b)15s,(c)20s;图8优化条件下,5-fc和5-fu与细胞提取物的毛细管电泳谱图;图9为细胞提取物中5-fc和5-fu的检测;其中(a)293t,(b)5-fc(500μm)+293t,(c)5-fc(500μm)+293t(fcy1)。注:图1-7和图9的附图中的1和2,其中1标示5-fc,2标示5-fu。具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。实施例1仪器pa800plus型毛细管电泳仪(beckmancoulterinstruments,fullerton,ca,usa),pda检测器,应用32kraratstation软件进行控制。石英毛细管有效长度44cm,毛细管内径50μm,0.22μm聚醚砜滤膜过滤器(上海安谱实验科技股份有限公司)。2、细胞培养人肾上皮细胞系293t于实验室保存和培养;dmem干粉、胎牛血清、胰酶(含edta)购自gibco公司;转染试剂lipofectamine2000购自invitrogen公司;细胞培养于10%血清、1%双抗(青霉素、链霉素)的dmem培养基中。细胞置于5%co2、37℃培养箱内培养,每2~3天传代一次,取对数生长期细胞用于实验。3、细胞转染按细胞浓度为3×105个/孔293t细胞接种在六孔培养板内,当细胞覆盖率达90%左右时,按照脂质体lipofectamine2000说明的方法将携带有编码胞嘧啶脱氨酶(cd)的fcy1基因的质粒进行细胞转染。在培养基中添加5-fc,使其达到500μmol/l的目标浓度。4、细胞代谢物提取收集细胞取出后,用细胞计数板计数,取细胞量为1×107个细胞加入四倍体积的淬灭液(0.9g/lnacl),4℃保存,离心(1000g,1min,0℃),分离上清液和沉淀;细胞沉淀加入1ml提取液(50%(v/v)乙腈,4℃),枪头混匀后,冰浴10min,然后离心(20000g,10min,0℃)取上清,-80℃冷冻保存待测。5、确定最佳分离条件(1)标准品的溶液配置与样品检测:配置一定浓度的5-氟胞嘧啶和5-氟尿嘧啶标准溶液。进样前,先开机预热20min,进行毛细管活化,活化步骤:水冲洗毛细管5min-甲醇冲洗毛细管10min-水冲洗毛细管5min-hcl(1m)冲洗毛细管10min-水冲洗毛细管5min-naoh(1m)冲洗毛细管10min-缓冲液冲洗毛细管10min。标准品,缓冲溶液及未进行转染的293t的细胞提取物均用0.22μm聚醚砜滤膜过滤器过滤,样品采用压力进样,紫外检测。(2)吸收波长的选择:根据5-fc和5-fu两种标准溶液混合后的毛细管电泳检测结果,如图1,其中1标示5-fc,2标示5-fu,以下图均为此标示方法。5-fc和5-fu在200~300nm范围内均有吸收.最大吸收波长在200~220nm之间,为获得较均衡的灵敏度.本文选择210nm作为检测波长。(3)缓冲溶液浓度的选择:实验中将5-fc和5-fu的标准溶液加入到200μl细胞提取物中,使5-fc和5-fu的终浓度为100μm,实验采用硼酸缓冲液,实验设计了30mm,60mm和90mm三个浓度的硼酸盐缓冲液。缓冲溶液浓度对物质分离的影响见图2,当硼酸盐缓冲液浓度为30mm时(图2,a),5-fc和5-fu与细胞提取物的迁移时间最短,但是分离效果差,有重叠;增大浓度至60mm和90mm时(图2,b和c),由于减弱了溶质间的相互作用,降低了样品扩散,使谱峰变得敏锐,相邻两组分的分离度增大,但90mm的缓冲溶液浓度,压缩了双电层.使zeta电位减小,电渗流降低,从而迁移速度变小,迁移时间增加,因此,为了获得短的迁移时间和好的分离效果,实验中选择硼酸盐缓冲溶液的浓度为60mm为最佳实验浓度。(4)缓冲溶液ph值的选择:图3为缓冲溶液不同ph值的毛细管电泳谱图,其中(a)ph8.5,(b)ph9.5,(c)ph10.5。5-fc和5-fu的迁移时间随ph值增大而增加。这是由于5-fc和5-fu在碱性条件下发生电离,带负电荷,其电泳方向与电渗流相反,并随ph升高其电离程度增大,因此造成碱基在毛细管中的迁移速度减小,迁移时间变长。当ph为10.5时,5-fu拖尾严重。但是当ph为8.5时,虽然出峰时间大大缩短,但是5-fc和5-fu与细胞提取物的分离效果不好。同时结合迁移时间和分离度随ph变化情况的考察,选择缓冲溶液的ph值为9.5。(5)电压对分离的影响:电压的影响在20~30kv范围内试验了电压对迁移时间的影响,实验结果如图4,其中(a)20kv,(b)25kv,(c)30kv。电压升高,迁移时间迅速减小,并对提高分离效率有利。但这并不意味着电压越高越好,在20~30kv范围内,塔板数随电压升高而增加至某一电压值。此后,随电压的进一步升高。焦耳热也随之增加,塔板数反而减少。本文采用25kv作为最佳分析电压。(6)温度对分离的影响:温度的影响在25~35℃范围内试验了温度对分离的影响,如图5,其中(a)25℃,(b)30℃,(c)35℃。温度升高将导致溶液粘度变小,使迁移速度加快,迁移时间减少。但高的温度并不一定能带来好的分离效率如图5中(c)。为得到高的分离效率,本文采用30℃作为最佳分离温度。(7)进样条件的影响:对于进样条件包括进样压力和进样时间进行了优化,如图6和图7。其中图6为进样压力的影响:(a)0.5psi,(b)1.0psi,(c)1.5psi,图7为进样时间的影响:(a)10s,(b)15s,(c)20s。在毛细管电泳中,随着进样压力和进样时间的增加,5-fc和5-fu与细胞提取物的峰面积都增加,然而随着进样压力和时间的增加,逐渐出现物质重叠,致使分离效果变差。因此本文采用进样压力1.0psi,进样时间15s。根据实验结果,确定最佳条件吸收波长210nm,浓度为60mm,ph9.5的硼酸盐缓冲液,分离温度采用30℃,分离电压25kv。采用压力进样,进样压力为1.0psi,进样时间15s。6、工作曲线及捡测限在优化条件下,5-fc和5-fu的电泳谱图见图8。从图中可以看出,5-fc和5-fu在15min内达到完全分离。表1给出了碱基的工作曲线方程及检测限。表17、细胞内5-fc和5-fu的分离和定量测定取预处理后的细胞,根据优化后的毛细管电泳方法进行分析,细胞内5-fc和5-fu的毛细管电泳检测结果如图9,其中(a)293t,(b)5-fc(500μm)+293t,(c)5-fc(500μm)+293t(fcy1)。在培养基中未添加5-fc的293t细胞,提取物中没有检测到5-fc。培养基中添加5-fc的293t细胞检测到了5-fc,但没有检测到5-fu。培养基中添加5-fc的转染fcy1基因的293t细胞提取物中检测到了5-fc和5-fu。对检测到的5-fu结果进行分析,如表2。通过实验检测,证明转染fcy1基因的293t细胞,能够使目的基因表达,并将无毒的5-fc药物转化为5-fu,发挥抑制细胞增殖的作用。表2为转染fcy1基因的细胞内将5-fc转变为5-fu的量的测定:样品5-fu(μm)n=3标准差(%)回收率(%)5-fc+hela(fcy1)25.82.196表2。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1