一种毛细管动态涂层的制备方法与流程
本发明涉及一种毛细管动态涂层的制备方法。
背景技术:
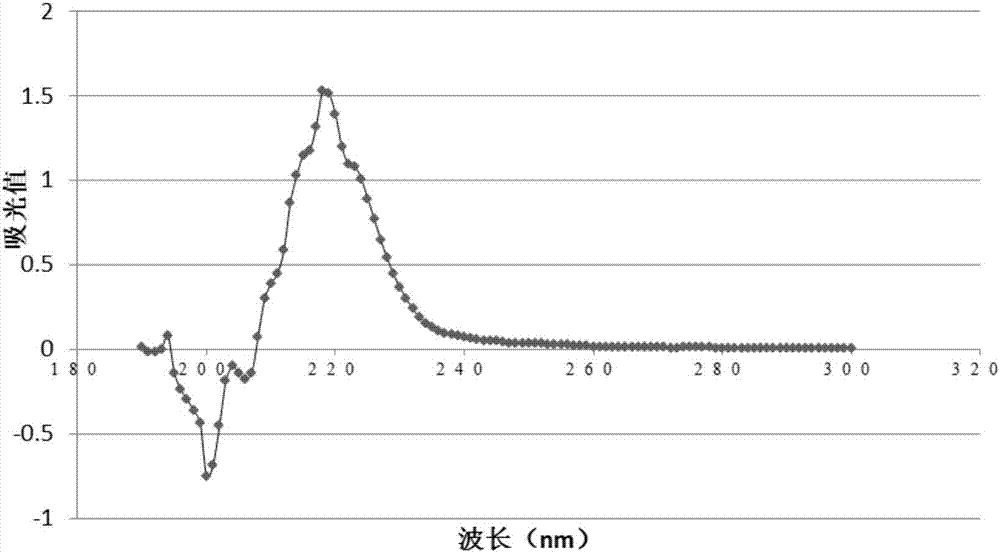
:毛细管电泳仪作为一种分离分析仪器,具备高效、快速、进样少、污染少、自动化程度高等特点,广泛应用于氨基酸、多肽、蛋白质、核酸等物质的分离。但是由于毛细管仪在电泳过程中产生的电渗流不稳定,另外,内壁的负电性和亲水性导致分析物极易被吸附,极大地影响蛋白质和多肽分离的重现性和分离效率。一般认为,蛋白质等电点在8以上或者分子量超过50kda即难以在裸露的毛细管中进行分析。为了克服毛细管壁的吸附作用,许多方法已被采用,如使用极端ph值缓冲液、添加高离子强度的电解质以及涂层技术等。前二者会限制分离的选择性并可能导致蛋白变性。涂层技术指在毛细管内壁以物理或化学方法形成不同性质的涂层。毛细管涂层的形成方法大致可以分为三类,即动态吸附、物理涂布和化学键合。化学和物理涂层法主要通过物理吸附或化学交联等方法在管壁内侧形成单分子层或交联的涂层,掩蔽毛细管内壁的负电荷,从而达到抑制吸附的目的。涂层毛细管会随使用次数的增加而受损,对应的分离重现性也相应变差。动态涂层指将涂层材料添加到缓冲液中,不断吸附到毛细管内壁,以补充管壁的解吸附材料,维持涂层稳定。因此,动态涂层具有较好的重现性和分离效果。目前文献报道的阳离子多聚物涂层材料大多需要实验室自行合成,涂层制作过程相对复杂,涂层材料耐受酸碱的能力有限,并未找到一种对所有种类蛋白质的分离都有效的普适性涂层。因此,寻求新的涂层材料,简化涂层制作技术,不断提高其分离复杂蛋白成分的能力,是毛细管动态涂层研究的一个重要方向。技术实现要素:本发明的一个目的是提供一种毛细管动态涂层的制备方法。本发明所提供的毛细管动态涂层的制备方法,包括下述步骤:1)对毛细管进行活化;2)用阳离子型聚乙烯吡咯烷酮水溶液冲洗活化后的毛细管,然后运行缓冲液进行冲洗。其中,所述阳离子型聚乙烯吡咯烷酮(cpvp)水溶液的质量-体积浓度为0.001-0.5%(g/100ml)。具体的cpvp浓度可根据使用情况进行调节。当采用cpvp动态涂层检测电渗流时,因为很低浓度cpvp即可调节电渗流,所以cpvp水溶液的质量-体积浓度选择0.001-0.25%(g/100ml)。当采用cpvp动态涂层分离蛋白时,由于抑制毛细管壁吸附需要更高浓度的cpvp,所以cpvp水溶液的质量-体积浓度选择0.1-0.5%(g/100ml)。所述缓冲液为磷酸盐缓冲液,所述磷酸盐缓冲液的浓度可为10-50mm,具体可为10mm、20mm、30mm、40mm或50mm;ph值可为3.0-8.0,具体可为ph3.0、ph6.5、ph7.0、ph7.5或ph8.0。所述用阳离子型聚乙烯吡咯烷酮水溶液冲洗毛细管的冲洗压力可为15-25psi,优选20psi,冲洗时间为10-20分钟。所述缓冲溶液的冲洗压力为可为15-25psi,优选20psi;冲洗时间为10-20分钟。为了使涂层更好的平衡,所述步骤2)中,用阳离子型聚乙烯吡咯烷酮的水溶液冲洗毛细管后运行缓冲液之前,还包括静置的步骤;所述静置的时间为4-10分钟。利用上述具有动态涂层的毛细管分离蛋白时,为了减少蛋白对毛细管壁的吸附,所述方法还包括:对所制备的动态涂层用高电压进行预分离的步骤;所述高电压为10-12kv,分离的时间为2-4分钟。本发明中所述阳离子型聚乙烯吡咯烷酮是由二甲基二烯丙基氯化铵和乙烯吡咯烷酮共聚得到的。所述阳离子化的聚乙烯吡咯烷酮的粘均分子量可为20000-25000。所述步骤1)对毛细管进行活化的方法可按照本领域常规的活化方法进行,具体步骤可参考下述方法:1mnaoh20psi冲洗15-20分钟,超纯水20psi冲洗10分钟,运行缓冲液20psi冲洗20-30分钟备用。所述运行缓冲液为磷酸盐缓冲液,所述磷酸盐缓冲液的浓度可为10-50mm,ph值可为3.0-8.0。所述阳离子型聚乙烯吡咯烷酮具体可按照如下方法制备得到:在装有磁力搅拌器、温度计和通n气管的反应器中加入一定量的二甲基二烯丙基氯化铵(diallyldimethylammoniumchloriddadmac)、乙烯吡咯烷酮(vinylpyrrolidonvp)(二者质量比为1:4)、引发剂2,2一偶氮二异丁基脒二盐酸盐(为单体质量的0.25%),加入一定量蒸馏水溶解,使vp浓度为0.5g/ml。升温至65℃,反应5h,得到胶体,加适量水溶解,然后用丙酮沉淀。滤出沉淀并真空干燥即为目标共聚物。上述方法制备得到的具有动态涂层的毛细管也属于本发明的保护范围。本发明的再一个目的是提供上述具有动态涂层的毛细管在毛细管电泳分离蛋白质中的应用。所述蛋白质优选为碱性蛋白质。所述蛋白质具体可选自下述至少两种:牛胰凝乳蛋白酶原、核糖核酸酶a、鸡心细胞色素c、肌红蛋白和伴清蛋白。所述毛细管电泳分离上述蛋白质的电泳条件为:分离电压反向12kv,检测波长214nm,毛细管温度25℃,样品托盘温度10℃,电泳时间45-50分钟。由于聚乙烯吡咯烷酮极易被水冲掉,不适合用于动态涂层,一般只能作为毛细管共价涂层材料,限制了其使用范围。而本发明采用阳离子化的聚乙烯吡咯烷酮(cationicpolyvinylpyrrolidonecpvp)作为涂层材料,对毛细管柱进行动态修饰,这种阳离子化的涂层材料能够稳定反向电渗流。同时通过对毛细管电泳运行中的各项参数进行优化,建立了一个稳定涂层制备的实验流程和技术方法,可控制电渗流、抑制管壁吸附,有效地提升毛细管电泳分离碱性蛋白的能力,分离效率最高达3.2×105。附图说明图1为实施例1制备的cpvp的紫外吸收光谱图。图2为cpvp浓度对电渗流的影响图。图3为ph值对电渗流的影响图。图4为50mmph6.5磷酸盐缓冲液电泳分离蛋白标准品混合物;其中1:伴清蛋白;2:肌红蛋白;3:牛胰凝乳蛋白酶原;4:核糖核酸酶a;5:鸡心细胞色素c。图5为不同浓度运行缓冲液电泳分离蛋白标准品混合物。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1、cpvp的制备及性能测试1.cpvp的制备依据文献报道(林媚林美玉朱炜等,阳离子型聚乙烯吡咯烷酮的制备及其负载rna性能。应用化学,2014,第31卷第6期。),合成该化合物。具体方法为:在装有磁力搅拌器、温度计和通n气管的反应器中加入一定量的二甲基二烯丙基氯化铵(diallyldimethylammoniumchloriddadmac)、乙烯吡咯烷酮(vinylpyrrolidonvp)(二者质量比为1:4)、引发剂2,2一偶氮二异丁基脒二盐酸盐(为单体质量的0.25%),加入一定量蒸馏水溶解,使vp浓度为0.5g/ml。升温至65℃,反应5h,得到胶体,加适量水溶解,然后用丙酮沉淀。滤出沉淀并真空干燥即为目标共聚物。2.cpvp的粘均测试先配置1m的氯化钠溶液500ml以上,以后所有溶剂均以此为溶剂计算。具体:称取58.5g氯化钠,加入水约970ml,最后定容为1000ml;用盐水溶液配置c1:0.01g/ml的聚合物溶液50ml(确定浓度)和c2:0.04g/ml。具体:称取cpvp0.51215g,用1m氯化钠溶解过夜,最后定容为50ml,得到浓度为c1=0.01024g/ml;称取cpvp2.01601g,用1m氯化钠溶解过夜,最后定容为50ml,得到浓度为c2=0.04032g/ml;在30℃恒温浴槽内测试,用乌式粘度计测量纯氯化钠溶液的流出时间记为t0:测量聚合物溶液c1的流出时间为t5。将c2溶液稀释配制出0.002;0.004;0.006;0.008g/ml的溶液各50ml。清洗粘度管,最后用少量被测试溶液润洗粘度管3次后再加入被测试液,测试溶液的流出时间,并对应浓度与时间。具体:量取c1溶液10ml,用盐水定容为50ml;量取c1溶液20ml,用盐水定容为50ml;量取c2溶液7.5ml,用盐水定容为50ml;量取c2溶液10ml,用盐水定容为50ml;因此各样品浓度分别为1号2.048mg/ml;2号为4.096mg/ml;3号为6.048mg/ml;4号为8.064mg/ml;cpvp的粘均分子量乌式粘度计测得不同样品浓度的比粘度、相对对数粘度分别为:外推到0浓度时的比浓增比粘度为0.01592毫升/毫克=0.01592升/克=0.1592分升/克,根据mark—houwink公式[η]=kmα,即得到粘均相对分子质量。计算cpvp相对分子质量时k=1.4x10-4,α=0.7来计算,可以得到其粘均分子量为:(0.1592/1.4x10-4)^(1/0.7)=2.3x104,因此该聚合物的相对粘均分子量约为23000。3.cpvp的紫外光谱特性测定取质量体积分数为0.5%cpvp水溶液,利用紫外分光光度计测定其在200-300nm的光吸收,获得该物质的紫外吸收光谱。其紫外吸收光谱图如图1所示。从图1可以看出,cpvp在紫外区有光吸收,最大吸收波长位于218nm,因此,在电泳过程中不宜将cpvp添加到运行缓冲液中。实施例2、制备毛细管cpvp动态涂层系统1.1蛋白标准品的制备牛胰凝乳蛋白酶原(pi9.3,分子量25000da),核糖核酸酶a(pi7.8,分子量13700da),鸡心细胞色素c(pi10.8,分子量12400da),肌红蛋白(pi7.3,分子量16700da),伴清蛋白(pi6.8,分子量77770da),均购自sigmachemicals。将5种蛋白标准品分别用去离子水配制成10mg/ml溶液,-80度长期保存,4度保存一周,用时等量混合终浓度为1mg/ml。1.2cpvp动态涂层系统分离蛋白标准品运行方法河北永年石英毛细管(40.2cm,有效长度30cm,毛细管内径50μm)。新管活化:1mnaoh20psi冲洗20分钟,超纯水20psi冲洗10分钟,运行缓冲液20psi冲洗20分钟备用。所述缓冲液为不同浓度(10-50mm)和ph值(ph=3.0,ph=6.5,ph=7.0,ph=7.5,ph=8.0)的磷酸盐缓冲液。动态涂层制备质量体积分数为0.5%的cpvp水溶液20psi冲洗10分钟,静置4分钟,运行缓冲液20psi冲洗10分钟,高电压12kv预分离2分钟。所述缓冲液为不同浓度(10-50mm)和ph值(ph=3.0,ph=6.5,ph=7.0,ph=7.5,ph=8.0)的磷酸盐缓冲液。进样样品浓度:1mg/ml,压力进样0.5psi,3秒。毛细管电泳分离电压反向12kv,检测波长214nm,毛细管温度25℃,样品托盘温度10℃,电泳时间45分钟。1.3动态涂层检测电渗流的运行方法河北永年石英毛细管(40.2cm,有效长度30cm,毛细管内径50μm)。新管活化:1nnaoh20psi冲洗20分钟,超纯水20psi冲洗10分钟,运行缓冲液20psi冲洗20分钟备用。所述缓冲液为不同浓度(10-50mm)和ph值(ph=3.0,ph=6.5,ph=7.0,ph=7.5,ph=8.0)的磷酸盐缓冲液。动态涂层制备不同浓度(0.001-0.25%)的cpvp水溶液20psi冲洗5分钟,运行缓冲液(ph=6.5,20mm磷酸盐缓冲液)20psi冲洗3分钟。进样样品浓度:0.1%(w/v)二甲基亚砜(dmso),压力进样0.5psi,5秒。毛细管电泳分离电压反向20kv,检测波长214nm,毛细管温度25℃,样品托盘温度10℃,电泳时间10分钟。1.4数据分析利用pa800plus自带的32karat软件计算理论塔板数。迁移时间相对标准偏差计算,根据公式:相对标准偏差(rsd)=标准偏差(sd)/计算结果的算术平均值(x)*100%2结果与讨论2.1cpvp浓度对电渗流的影响以ph=6.5,20mm磷酸盐缓冲液为运行缓冲液,分别检测了0.001-0.25%cpvp动态涂层浓度对电渗流的影响,结果如图2所示,cpvp的浓度为0.001-0.1%时,电渗流逐渐增大,当cpvp的浓度大于0.1%时,电渗流开始下降。2.2ph值对电渗流的影响由于磷酸盐的缓冲范围分别在ph(1.12-3.12)、(6.20-8.20),故分别选取ph3.0、ph6.5、ph7.0、ph7.5、ph8.0时的50mm磷酸盐缓冲液为运行缓冲液,以0.1%dmso水溶液为中性标记物,检测了不同ph值磷酸盐缓冲液为介质,cpvp动态涂层的电渗流。结果如图3所示,随着ph值增加,电渗流逐渐减少。2.3运行缓冲液浓度对cpvp动态涂层系统分离柱效的影响分别以不同浓度(10-50mm)ph6.5磷酸盐缓冲液为运行缓冲液,分离蛋白标准品混合物,结果见图4-5,并用32karat软件计算理论塔板数(n)定量各种蛋白的分离柱效。结果如表1所示,对于不同蛋白,其最适运行缓冲液浓度略有所不同。如牛胰凝乳蛋白酶原和核糖核酸酶a在50mm的ph6.5磷酸盐缓冲液分离柱效最高,分别可达2.9x105和1.7x105;而伴清蛋白、肌红蛋白、鸡心细胞色素c在各个浓度下分离柱效差别不大,基本维持在同样数量级。表1:运行缓冲液浓度对cpvp动态涂层系统分离柱效的影响n=32.4ph值对cpvp动态涂层系统分离柱效的影响分别选取ph3.0、ph6.5、ph7.0、ph7.5、ph8.0时的50mm磷酸盐缓冲液为运行缓冲液,电泳分离蛋白标准品混合物,并用32karat软件计算理论塔板数定量各种蛋白的分离柱效。结果如表2所示,在这些ph环境下,各种蛋白的分离柱效略有变化,其中牛胰凝乳蛋白酶原在ph8.0和ph6.5时,分离柱效可达105,而在其余ph环境中,分离柱效仅达104。表2:ph值对cpvp动态涂层系统分离柱效的影响n=32.5cpvp动态涂层系统的重现性和稳定性为了评价cpvp动态涂层系统的重现性和稳定性,分别检测重复进样时电渗流和蛋白迁移时间的变化。结果显示在不同浓度、不同ph值情况下,重复进样6次电渗流中性标记物dmso迁移时间的重现性rsd<3%(表3a)。对于蛋白标准品连续进样6次迁移时间的重现性rsd<3%,每日更换毛细管,连续进样4天,每天进样4-6次,蛋白标准品迁移时间的重现性rsd<6%(表3b),说明该动态涂层系统具有很好的重现性和稳定性。表3a:电渗流中性标记物迁移时间的重现性和稳定性cpvp浓度0.001%0.005%0.01%0.05%0.1%0.25%rsd(%)n=60.080.090.050.060.080.09ph值3.06.57.07.58.0rsd(%)n=61.050.110.480.202.67表3b:蛋白迁移时间的重现性和稳定性在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1