一种用于磷酸肽富集和分离的离心式装置的制作方法
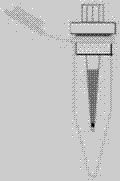
本发明涉及一种用于磷酸肽富集和分离的离心式装置,属于分析化学领域。
背景技术:
磷酸化是蛋白质最常见的翻译后修饰之一,是指由蛋白激酶催化在底物蛋白质氨基酸残基上添加共价结合的磷酸根基团。其逆反应为由蛋白磷酸酶催化的去磷酸化过程。蛋白激酶和磷酸酶独立工作,并在平衡中调节蛋白质的功能。有研究表明,在由基因编码的蛋白中,约30%会发生磷酸化。蛋白质的磷酸化和去磷酸化这一可逆过程几乎调节着生命活动的所有过程,包括细胞的增殖、发育和分化,分子识别和信号传导,神经活动,肌肉收缩,新陈代谢,肿瘤发生等。蛋白质磷酸化在1906年由洛克菲勒医学研究所的phoebuslevene首次报道,他发现了磷酸化的卵黄蛋白。然而,直到1954年,蛋白质的磷酸化过程才由burnett和kennedy报道发现。1955年fisher和krebs揭示了可逆的磷酸化过程在生物调节机制中的重要性,并因此获得了诺贝尔生理和医学奖。由于蛋白质磷酸化具有十分广泛而显著的生理意义,因此关于磷酸化的研究成为蛋白质组学领域里重要的焦点之一。质谱是目前蛋白质组翻译后修饰鉴定研究最有力的工具。然而目前以生物质谱为主要研究手段的磷酸化蛋白质组学研究还面临着一系列技术挑战:磷酸化蛋白质在生物体内含量极低,研究认为,一般在某一特定的时间,磷酸化的蛋白质相对于生物体的总体蛋白质而言,含量仅为2~3%;在质谱检测时,大量的非磷酸化肽段会对磷酸化肽段的信号造成干扰和抑制;磷酸化肽段具有负电性,在质谱分析常用的正离子模式下,离子化困难,信号会受到抑制。这些问题都给磷酸化肽段的规模化鉴定带来不小的困难。因而在对较复杂的样本进行质谱分析前,先对磷酸化肽段进行特异性的富集,提高其在样本中的含量,并去除非磷酸肽的干扰,对于提高磷酸肽的分析灵敏度和鉴定规模就显得尤为重要。目前常用的磷酸肽富集方法主要有金属氧化物亲和色谱(moac)、固相金属离子亲和色谱(imac)、离子交换色谱(sax/scx)等。金属氧化物亲和色谱的原理是利用过渡金属氧化物与磷酸根的可逆结合选择性富集磷酸化肽段,常用的金属氧化物有二氧化钛(tio2)、二氧化锆(zro2)等。二氧化钛因其富集效果好、成本较低而得到了广泛应用。但其依然存在一些问题:(1)所需样品起始量大,(2)实验步骤繁琐,极为费时费力,(3)样品分析通量有限,(4)富集鉴定结果的重现性较差。此外,由于目前使用的生物质谱仪器在扫描速度方面的局限性,富集后的磷酸肽样品一般需要经过反相色谱分离为多个馏分,进一步降低样品的复杂程度后再进行质谱分析,从而可以有效提高磷酸肽的鉴定规模。然而目前广泛采用的反相色谱柱式肽段分离模式,样本损失较大,而且需要配合液相色谱仪器使用,样品处理通量有限。
技术实现要素:
本发明的目的是提供一种用于磷酸肽富集和分离的离心式富集装置,具有快速、操作简便、便于微量样本分析和高通量的特点,可平行处理多个样品。
本发明所提供的用于磷酸肽富集和分离的离心式富集装置,包括富集枪头、分离枪头和馏分收集器;
所述富集枪头内填充有固相萃取膜片a和二氧化钛填料,所述固相萃取膜片a上覆盖有八烷基膜,所述固相萃取膜片a靠近所述富集枪头的出液口;
所述分离枪头内填充有固相萃取膜片b和c18反相填料(十八烷基硅烷键合硅胶),所述固相萃取膜片b上覆盖有十八烷基膜,所述固相萃取膜片b靠近所述分离枪头的出液口;
所述富集枪头可设置于所述分离枪头内,即以串联的方式配合;
所述富集枪头和所述分离枪头均可与所述馏分收集器配合。
上述的离心式富集装置中,所述富集枪头和所述分离枪头均为移液器枪头;
所述富集枪头可采用10μl、200μl或1000μl等不同规格,优选200μl规格的枪头;
所述分离枪头可采用10μl或200μl等不同规格,优选10μl规格的枪头。
上述的离心式富集装置中,所述富集枪头内设置一层所述八烷基膜,每层所述八烷基膜的厚度为0.2mm~0.5mm;
所述二氧化钛填料的用量可为1~10mg。
上述的离心式富集装置中,所述分离枪头内设置3层所述十八烷基膜,每层所述十八烷基膜的厚度为2mm~3mm;
所述c18反相填料的用量可为1~10mg。
上述的离心式富集装置中,所述固相萃取膜片a和所述固相萃取膜片b均可采用empore萃取膜片,其是以聚四氟乙烯(ptfe)纤维薄膜为骨架,纤维之间在有以反相硅胶为基质或以聚苯乙烯-二乙烯苯(ps-dvb)为基质的spe吸附剂颗粒。所述empore萃取膜片的大小尺寸有不同,厚度大约<1mm。
上述的离心式富集装置中,所述富集枪头和所述分离枪头均通过适配器与所述馏分收集器配合,所述适配器可为一圆柱体,具体可采用上下内径不等的圆柱体。
上述的离心式富集装置中,所述馏分收集器可为离心管,如ep管,可选用600μl、1500μl和2000μl等不同规格,优选1500μl。
本发明离心式富集装置可用于富集和分离磷酸肽,将所述富集枪头和所述分离枪头串联,以离心方式进行样品的上样、清洗、洗脱和分离,即在一个装置中完成磷酸肽的富集和反相分离,从而将二者有机结合,不仅精简了实验步骤,减少了样品损失,并降低了实验的劳动强度;而且该离心式富集分离装置可与台式离心机配合使用,一次平行处理24个样品,大大提高了样本处理通量,非常适合应用于大规模、微量临床样品的磷酸肽分析。
可按照下述步骤用于富集和分离磷酸肽:
(1)将含有磷酸肽的蛋白质酶解产物加入至所述离心式富集装置中的所述富集枪头中,然后将所述富集枪头与所述馏分收集器配合,将所述馏分收集器置于离心机中进行离心分离,即将所述磷酸肽富集于所述二氧化钛填料中;
(2)将所述富集枪头设置于所述分离枪头内,然后将所述分离枪头与所述馏分收集器配合,采用不同乙腈含量的碱性洗脱液进行梯度洗脱,通过所述馏分收集器收集梯度洗脱的流穿液,即实现对所述磷酸肽的分离。
步骤(1)中,采用台式离心机离心,使磷酸肽保留于所述二氧化钛填料中,非磷酸肽随流穿液流入所述馏分收集器中;收集所述馏分收集器中的流穿液,反复上样3次,从而达到充分富集磷酸肽的目的;在所述富集枪头中加入清洗液后离心,清洗去除吸附于tio2上的非磷酸肽。
步骤(2)中,即将所述富集枪头、所述分离枪头和所述馏分收集器串联;将富集的磷酸肽洗脱至所述分离枪头中,同时利用c18反相填料对疏水性不同的磷酸肽在乙腈含量不同的洗脱液中保留能力的差异,对磷酸肽实现反相分离。
如富集和分离小鼠肝脏蛋白质酶解产物中的磷酸肽时,可采用腈、乳酸、水和三氟乙酸(64:20:12:4,v/v)的混合液溶解样品;可采用乙腈、水和三氟乙酸(80:15:5,v/v)的混合液作为清洗液。
经过上述富集、分离后的磷酸肽样品可直接用于液相色谱-质谱联用鉴定,不需要对样品进行脱盐预处理,减少了繁琐的前处理操作造成的样本损失。同时,高ph反相分离与液相色谱-质谱联用时使用的低ph反相分离具有良好的正交性,能够有效降低富集产物的复杂程度,提高磷酸肽的质谱鉴定效果。另外,将分馏后的馏分交叉合并可将色谱保留行为差异较大的肽段混合,有效提高分馏与后续液相色谱-质谱鉴定中色谱分离的正交性。
本发明具有以下优点:
1)通过tio2富集枪头和c18反相填料分离枪头将磷酸肽的富集和反相分离有机结合,有效精简了实验步骤,减少了样品损失;
2)该装置采用高ph反相分离模式,避免了常用的scx分离中,肽段脱盐和冻干等一系列繁琐的实验操作步骤和样本损失;
3)该装置可与实验室常用的台式离心机配合使用,通过离心方式进行样品的上样、清洗、洗脱和分离,降低了实验的劳动强度和人为因素干扰,同时可实现多达24个样品的平行处理,大幅提高样品处理通量和分析的重现性;
4)该装置简单易制,成本低;
5)该装置非常适合应用于大规模、微量临床样品的磷酸肽分析,在蛋白质组翻译后修饰的富集研究中具有良好的应用潜力。
附图说明
图1为本发明离心式富集装置的富集枪头的结构示意图。
图2为本发明离心式富集装置的分离枪头的结构示意图。
图3为本发明离心式富集装置的馏分收集器的结构示意图。
图4为本发明离心式富集装置的富集枪头与馏分收集器配合时的示意图。
图5为本发明离心式富集装置的富集枪头、分离枪头与馏分收集器串联配合时的示意图。
图6为本发明离心式富集装置应用于小鼠肝脏蛋白质磷酸肽富集分离的实验流程图。
图7为利用本发明离心式富集装置进行的一次实验三个馏分的磷酸肽鉴定结果的韦恩图。
图8为利用本发明离心式富集装置重复三次实验的磷酸肽鉴定结果的韦恩图。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明提供的离心式富集装置包括富集枪头、分离枪头和馏分收集器,其中,富集枪头的结构示意图如图1所示,它采用规格为200μl的枪头,富集枪头内填充有1层覆盖有八烷基膜的固相萃取膜片1(empore,直径47nm)和2mg二氧化钛填料2,且覆盖有八烷基膜的固相萃取膜片1靠近枪头的出液口。分离枪头的结构示意图如图2所示,它采用规格为10μl的枪头,分离枪头内设有3层且覆盖有十八烷基膜的固相萃取膜片3(empore,直径47nm)和3mgc18反相填料4,且覆盖有十八烷基膜的固相萃取膜片3靠近枪头的出液口。馏分收集器的结构示意图如图3所示,它采用规格为1.5ml的ep管,其管口处设有适配器5,用于与富集枪头和分离枪头配合。富集枪头与馏分收集器配合时的示意图如图4所示,富集枪头、分离枪头和馏分收集器三者串联配合时的示意图如图5所示。
采用本发明上述离心式富集装置应用于小鼠肝脏蛋白质磷酸肽富集分离时,可按照图4所示的流程进行:
(1)小鼠肝脏蛋白质提取:取10周龄c57bl/6小鼠的肝脏于ep管中,加入配置好的尿素裂解液(9m尿素溶于20mmhepes,加入适量蛋白酶抑制剂和磷酸酶抑制剂),使用高通量组织研磨器破碎组织后将样品置于冰上,使用超声破碎仪进行蛋白质提取,取上清。
(2)小鼠肝脏蛋白质酶解肽段溶液的制备:取1mg鼠肝蛋白,用尿素裂解液稀释一倍,在溶液中加入二硫苏糖醇(dtt,终浓度4.5mm),55℃金属浴孵育30min。冰上冷却至室温后,加入碘乙酰胺(iaa,终浓度10mm),充分混匀,室温避光静置30min。稀释蛋白溶液后,按胰蛋白酶和蛋白质1:100(w/w)加入胰蛋白酶,置于37℃恒温箱中酶解过夜后,使用sep-pakc18脱盐小柱(waters)将产物肽段脱盐并冻干。酶解产物用200μl上样液(乙腈/乳酸/水/三氟乙酸,64:20:12:4,v/v)溶解。
(3)材料清洗与活化:分别使用200μl清洗液(乙腈/水/三氟乙酸,80:15:5,v/v)和200μl上样液(乙腈/乳酸/水/三氟乙酸,64:20:12:4,v/v)清洗tio2富集枪头,500g离心;分别使用200μl纯乙腈和200μl15%浓氨水平衡c18分离枪头,500g离心。
(4)上样富集:将tio2富集枪头固定于馏分收集器上(如图2所示),将肽段溶液转移至富集枪头,500g离心。收集馏分收集器中的流穿液,重复上样,共富集3次。
(5)清洗:使用200μl清洗液(乙腈/水/三氟乙酸,80:15:5,v/v)清洗去除非磷酸肽,500g离心,重复3次。
(6)洗脱、分离:将tio2富集枪头插入c18分离枪头中,将二者串联结合,并固定于新的馏分收集器中(如图3所示)。依次加入梯度洗脱液各200μl:1)15%浓氨水,500g离心;2)2%乙腈+98%(15%浓氨水),500g离心;3)5%乙腈+95%(15%浓氨水),500g离心;4)8%乙腈+92%(15%浓氨水),500g离心;5)10%乙腈+90%(15%浓氨水),500g离心;6)40%乙腈+60%(15%浓氨水),500g离心。分别收集梯度洗脱的流穿液,两两合并:2%+8%乙腈、5%+10%乙腈、0+40%乙腈,冻干后-80℃保存。
(7)质谱检测:将富集后的3个馏分均以20μl的水/甲酸(90:10,v/v)溶解,取10μl,进行质谱鉴定。质谱条件:正离子扫描模式;电喷雾电压为2.2kv,一级质谱分辨率为120000,一级agc为5.0e5,最大离子注入时间为50ms,全扫描质荷比范围为300~1400;二级质谱母离子的选择采用数据依赖模式,hcd碰撞能量设定为32%,agc为1.0e2,最大离子注入时间为250ms,动态排除时间设为18s,质谱采集时间为78min。
(8)搜库:proteomediscoverer1.4软件搜库分析,以mascot搜索引擎对数据进行检索,蛋白酶切类型选择trypsin,允许最大肽段漏切位点数设为2,一级搜索质量偏差≤15ppm,二级搜索质量偏差≤0.5da,固定修饰为carbamidomethyl(c),可变修饰为oxidation(m),acetyl(proteinn-term),phosphorylation(st)和phosphorylation(y)。肽段水平假阳性率(fdr)≤1%。
(9)磷酸肽鉴定结果:三个馏分共计鉴定到10793个磷酸化位点,对应7333个非冗余磷酸肽,富集选择性为75.8%。三个馏分的磷酸肽鉴定数量及富集选择性见表1,韦恩图见图7。同样条件下未经馏分分离,直接进行质谱鉴定只能得到3405个磷酸肽,富集选择性为74.0%,说明该分馏策略可以在保证富集选择性的前提下显著提高磷酸肽的鉴定规模。将分馏后的馏分交叉合并可将色谱保留行为差异较大的肽段混合,有效提高分馏与后续液相色谱-质谱鉴定中色谱分离的正交性,比采用顺序合并更能使肽段均匀分布在整个色谱梯度洗脱的范围内,充分利用质谱的扫描时间。使用该装置,3次重复实验分别鉴定到7333个、7587个、7962个磷酸肽,韦恩图见图8。富集选择性分别为73.1%、73.5%和69.1%。其中50.2%的磷酸肽至少在两次实验中被鉴定到,充分证明其在复杂样本磷酸化分析中的应用价值。
表1三个馏分的磷酸肽鉴定数及富集选择性
- 还没有人留言评论。精彩留言会获得点赞!