测定人尿液生物样品中的DTPA‑Zn的方法与流程
本发明属于生物医药
技术领域:
,涉及一种可靠的方法用以测定生物体例如人、大鼠给予上述dtpa-金属螯合剂后生物样品例如血、尿等中的上述金属螯合剂的含量,以评估这些金属螯合剂的治疗效果或其在体内的行为。特别地,本发明涉及一种测定人尿液生物样品中的dtpa-zn的方法。
背景技术:
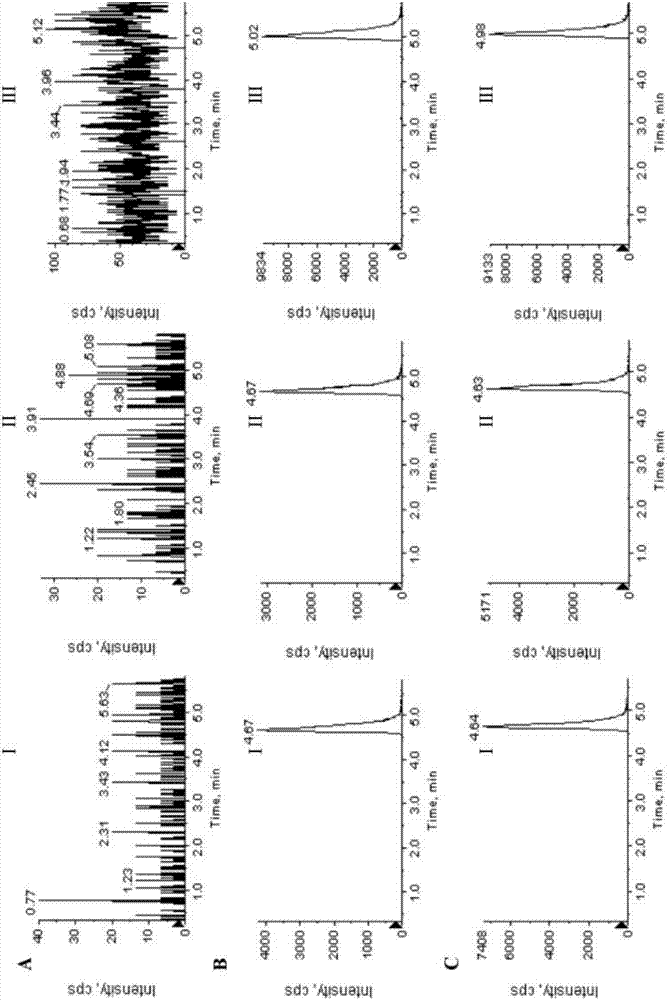
:铅污染以及铅中毒对人体健康的危害已经受到广泛关注。铅是人体非必需元素,主要通过呼吸道、消化道进入人体吸收,能够在体内蓄积,对全身各系统和器官有毒性作用,主要影响神经、消化、血液系统,铅污染和铅中毒是需要重点解决的公共卫生问题[haoft,duxq,niuym,etal.progressinresearchoftheleadintoxication[j].chinjindmed(中国工业医学杂志),2008,21:200-202.1;zhouqq,huff,xiacy,etal.studyprogressonhealthhazardsinoccupationallead-exposedworkers[j].chinjindmed(中国工业医学杂志),2013,26:353-356]。在治疗方面,依地酸二钠钙被作为首选药物用于临床[zhoujy,duanz,dengjx,etal.clinicalobservationonchronicleadpoisoningtreatedwithdifferentdosagesofcana-edta[j].occuphealthemergresue(职业卫生与应急救援),2002,20:159-160]。依地酸二钠钙治疗铅中毒有良好的疗效,但在络合铅的同时,也络合排出体内的锌、钙、锰、铁、铜等,会造成体内必需微量元素的平衡失调,出现毒副作用,最重要的毒副作用是锌缺失引起的肾损害。ca-dtpa(又可记作dtpa-ca)又名二亚乙基三胺五乙酸三钠钙盐和zn-dtpa(又可记作dtpa-zn)又名二亚乙基三胺五乙酸三钠锌盐,二者同属氨羧络合剂,于2004年8月由美国fda批准同时上市,用于进入放射性核素严重污染场所工作或停留前以及放射性核素沾染后的治疗[cadadj,levient,bakerde.pentetatecalciumtrisodium(ca-dtpa)andpentetatezinctrisodium(zn-dtpa)[j].hospitalpharmacy,2005,40:65-71]。zn-dtpa与ca-dtpa在体内能选择性地与放射性核素镧(140la)、铈(144ce)、钷(147pm)、镅(124am)、钚(239pu)等的阳离子形成稳定性的可溶性络合物,很快经肾脏排出体外,从而减少了体内放射性物质的沉积量。由于ca2+同dtpa的络合常数要小于zn2+[xuehl.thechelatortreatmentofcommonmetalintoxication[j].chemindoccupsafhealth(化工劳动保护),1989,10:22-26],ca-dtpa中dtpa更易于与核素的阳离子络合,因此其促排作用强于zn-dtpa。但毒理学研究显示,ca-dtpa易造成内源性的锌缺失,从而使得与锌有关的酶的活性受到严重的影响,其中包括dna与rna聚合酶、羧肽酶、碳酸酐酶等,可造成肝肾、肠黏膜的损伤和造血抑制等不良反应[shenby,ruantm,wudc.effectofzn-dtpaonthedecorporationofultra-uranium,ultra-plutoniumandlanthanideanditsapplication[j].foreignmedsci(raditmednuclmed)[国外医学(放射医学核医学分册)],1988,12:70-74;zhaoxc,wudc.toxicityofdtpaanditsapplicationonthedecorporationofnuclide[j].foreignmedsci(raditmed)[国外医学(放射医学分册)],1980,4:211-215]。zn-dtpa的安全性较高,虽也能造成锰和镁等微量元素的缺失,但不会引起缺锌而产生严重的毒副作用,其毒性约为ca-dtpa的1/10~1/30[zhangzy,xuxw,zhuz.pentetatezinctrisodium[j].chinpharmj(中国药学杂志),2007,42:557-558]。已有文献采用石墨炉原子吸收分光光度计法测定铅含量,考察了zn-dtpa对慢性铅中毒小鼠的促排作用[yangs,chenl,yinyy,etal.studyoftheeffectofpentetatezinctrisodiumonexcretionofleadinleadpoisonedmice[j].pharmjchinpla(解放军药学学报),2011,27:147-149],然而石墨炉原子吸收分光光度计法测定方法复杂、成本高、灵敏度低,对于例如血、尿等生物样品中的量难以满足测定要求。另外,还有文献[陈立,等,icp-ms法分析zn-dtpa对铅中毒小鼠的促排作用,药学学报(actapharmaceuticasinica)2014,49(11):1588-1592]报道,应用电感偶合等离子体质谱(icp-ms)测定生物样本中铅的浓度,考察核素促排药zn-dtpa对铅中毒小鼠的促排作用。小鼠一次性腹腔注射乙酸铅溶液,每只染铅1mg,建立急性铅中毒模型,染铅后4h腹腔注射zn-dtpa,连续给药5天。同时设正常对照组、染铅模型组、zn-dtpa与ca-dtpa联用组。每天收集尿液,在实验的第2、4和6天分别处死部分小鼠,取全血、双侧股骨、脑,消解处理后,用icp-ms测定铅含量。据信结果表明zn-dtpa能显著增加尿铅的排出,降低血液、股骨和脑组织中的铅含量。然而,由于dtpa-ca和dtpa-zn不但可以用于排除体内重金属铅,还可以排除体内的镧、铈、钷、镅、钚等重金属甚至作为临床应用药品还可用于确诊或疑似被钚、镅、钜体内污染受试者的治疗,并提高这些金属元素的清除速率。在如此广泛的应用环境下,仅仅考察铅在体内的分布和含量显然不足以评价dtpa这种金属螯合剂的体内行为。因此,本领域仍然期待有可靠的方法来测定生物体例如人、大鼠给予上述金属螯合剂后生物样品例如血、尿等中的上述金属螯合剂的含量,以评估这些金属螯合剂的治疗效果或其在体内的行为。技术实现要素:本发明的目的在于提供一种可靠的方法来测定生物体例如人、大鼠给予上述金属螯合剂后生物样品例如血、尿等中的上述金属螯合剂的含量,以评估这些金属螯合剂的治疗效果或其在体内的行为。已经出人意料的发现,使用本发明液相色谱-串联质谱(lc-ms/ms)法,能够有效的实现上述目的。特别是,本发明使用液相色谱-串联质谱(lc-ms/ms)法测定人尿液生物样品中的dtpa-zn,呈现出优异的方法学特征。本发明因此发现而得以完成。为此,本发明第一方面涉及一种测定人尿液生物样品中的dtpa-zn的方法,该方法使用液相色谱-串联质谱(lc-ms/ms)法测定经处理的人尿液生物样品中的dtpa-zn的含量,包括如下步骤:(1)生物样品的处理:(1a)取含有或不含有dtpa-zn的人尿液50μl,置于1.5ml离心管中,加内标溶液即25μg/ml的edta-zn水溶液20μl或者不加内标溶液,加入0.01%氨水900μl(不加内标时加入0.01%氨水920μl,使尿液、氨水、任选的内标溶液总体积为970μl),涡流混合3min,全部上样于固相萃取小柱上;(1b)上样后用2ml水清洗,最后用0.5ml含1%氨水的甲醇溶液洗脱;(1c)收集该洗脱液,吹干,残余物用150μl水复溶,吸取10μl进行lc-ms/ms分析;(1d)标准曲线的制备:取不同浓度的dtpa-zn标准系列溶液100μl,置于1.5ml离心管中,加入空白人尿液,涡旋3min,制备相当于浓度为10、20、50、100、200、500、1000和2000μg/ml的尿液样品;取该尿液样品50μl,并依次加入内标溶液20μl、0.01%氨水900μl,涡流混合3min,全部上样于固相萃取小柱上,接着照以上(1b)和(1c)操作,根据lc-ms/ms分析结果绘制标准曲线,该标准曲线用于计算各种样品中的目标物质含量;(2)液相色谱-串联质谱测定:(2a)提供高效液相色谱仪和串联质谱仪,所述高效液相色谱仪配备梯度泵和进样器,所述串联质谱仪配备电喷雾离子源和数据处理系统;(2b)色谱条件:所用的分析柱为shiseidoproteonavi品牌的色谱柱(其规格例如为5μm,250×4.6mmi.d.),柱前连接c18保护柱(其规格例如为4×3.0mmi.d.,例如美国phenomenex公司的保护柱),流动相为甲醇-2mm甲酸铵(例如,其中含0.03%氨水)(50:50,v/v),流速0.45ml/min;(2c)质谱条件:电喷雾离子化源(例如使用turboionspray源),负离子方式检测;喷射电压为-4000v;源温度为500℃;卷帘气(cur)为20;碰撞气(cad)为4;扫描方式为多反应监测(mrm),用于定量分析的离子反应分别为m/z454.2→m/z364.3+m/z226.6→m/z204.5(dtpa-zn,ce为45v)和m/z353.0→m/z263.0(乙二胺四乙酸二钠锌盐,ce为15v),扫描时间为150msec;(3)数据处理与分析(3a)通过上述液相色谱-串联质谱测定得到生物样品中的目标物质含量;和,任选的(3b)应用药代动力学软件(例如winnolin(phoenix6.3,美国)对所测数据进行分析,获得与药物暴露相关的选自下列的一下或多个动力学参数cmax、tmax、auc0-t和mrt0-t。根据本发明第一方面任一实施方案所述的方法,其中所述人尿液是从未给予zn-dtpa的人获得的尿液作为空白尿液样品,或者是从人给予zn-dtpa后不同时间获得的尿液作为含药尿液样品。根据本发明第一方面任一实施方案所述的方法,其中所获得的人尿液任选的被置于-20℃冰箱中冻存,以等待测定。根据本发明第一方面任一实施方案所述的方法,其中所用的内标为edta-znna2·xh2o。根据本发明第一方面任一实施方案所述的方法,其中所述固相萃取小柱在上样前,先用1ml甲醇活化,再用1ml水平衡;或者,先用2ml甲醇活化,再用2ml水平衡。根据本发明第一方面任一实施方案所述的方法,其中所述高效液相色谱仪例如是美国安捷伦公司agilent1200型液相色谱仪。根据本发明第一方面任一实施方案所述的方法,其中所述串联质谱仪例如是美国absciex公司api4000型串联质谱仪;例如其配有turboionspray离子化源以及analyst1.5数据处理系统。在本发明中,proteonavi色谱柱是一种采用在多孔球形硅胶填料表面键合丁基(c4)的高性能蛋白质-多肽分析专用色谱柱,该填料既具有硅胶类填料的高分离能力和耐压性,又具有耐酸性、抑制蛋白质的吸附等特长。该色谱柱有时以proteonavis5标示。尽管本发明分析的dtpa金属络合剂是一种典型的小分子物质,分子量远小于普通的蛋白质-多肽,然而,已经出人意料的发现,本发明仅在使用上述proteonavi色谱柱的色谱柱的条件下本发明方法才能获得优良的方法学性能。例如,在使用ymc-c18、agilentextard-c18、资生堂pakcr-18(其与本文所用proteonavi柱是同一生产商)等c18柱时,dtpa金属络合物极其难以洗脱下来,例如在使用本发明色谱条件但改用这些c18柱时dtpa-za的保留时间大于43min且拖尾严重,然而无法解释的是内标物质却并未如此严重的延长保留时间(在不同的c18柱上保留时间约在5~6min之间)。又例如,在使用zorbaxedipsr-c8、dikma钻石-c8、费罗门gemini-c8等c8柱时,dtpa金属络合物在色谱柱中不保留,即保留时间极其短暂,例如在使用本发明色谱条件但改用这些c8柱时dtpa-za的保留时间小于1.5min且与容易与溶剂等混杂在一起而无法获得有效分离。根据本发明第一方面任一实施方案所述的方法,其中所述固相萃取小柱是型号为wax的固相萃取小柱,其例如购自waters公司。watersoasiswax固相萃取小柱在商业上通常是设计作为混合型弱阴离子交换反相吸附剂,对强酸性化合物具有高的选择性和灵敏度的固相萃取小柱。已经出人意料的发现,仅在当使用上述oasiswax型固相萃取小柱的情况下,本发明方法才能获得优良的方法学性能。而当改用其它品牌的固相萃取小柱例如美国艾杰尔的cleanertpwax固相萃取小柱、stratatm-x固相萃取小柱以及甚至是同一厂商的oasismax型固相萃取小柱时,远远无法获得上述oasiswax型固相萃取小柱所获得的优良结果。例如在照下文表4结果所涉及的方法进行试验时,用上述三种其它品牌/型号的固相萃取小柱时,回收率20μg/ml、180μg/ml、1800μg/ml三种浓度回收率分别在67~73%、76~81%、79~94%范围内且各种小柱在三种不同浓度下所得rsd在9~22%范围内波动,这种不同浓度下回收率呈现巨大差异且rsd大范围波动的结果在生物样品分析中是不可接受的。另外,在进行生物样品处理时,在将样品上样到固相萃取小柱后,用含少量氨水的洗脱液进行洗脱是必要的,否则各浓度下的回收率比之于本发明下文表4回收率结果低20个百分点以上。根据本发明第一方面任一实施方案所述的方法,其中还包括如下溶液配制的一种或多种的操作:(10a)dtpa-zn储备液的配制:取浓度为100mg/ml的zn-dtpa注射剂作为dtpa-zn储备液(其可记为a1),转移至具塞试管中,-20℃冰箱冷冻保存,备用;(10b)dtpa-zn标准系列溶液的配制:将dtpa-zn储备液即a1用水稀释制成下列dtpa-zn浓度的标准系列溶液,并在4℃冰箱内保存备用:1.0×105μg/ml、1.0×104μg/ml、5.0×103μg/ml、2.5×103μg/ml、103μg/ml、500μg/ml、250μg/ml、100μg/ml、50μg/ml;(10c)dtpa-zn质控样品工作溶液的配制:将dtpa-zn储备液即a1用水稀释制成下列dtpa-zn浓度的质控样品工作溶液,并在4℃冰箱内保存备用:1.0×105μg/ml、1.0×104μg/ml、9.0×103μg/ml、1.0×103μg/ml、900μg/ml、100μg/ml、50μg/ml;(10d)内标工作溶液的配制:精密称取20.0mg内标物质edta-zn于2ml量瓶中,用水溶解并定容,配成浓度为10.0mg/ml的内标储备液(其可记为is1),-20℃冰箱冷冻保存,备用;精密吸取内标储备液(即is1)1250μl至25ml量瓶中,用水定容至刻度,得500μg/ml的内标工作溶液(is2),并在4℃冰箱内保存备用(作为内标溶液,浓度为500μg/ml);(10e)1%氨水甲醇溶液的配制:量取氨水10.0ml,甲醇990.0ml,于锥形瓶中混匀即得;根据本发明第一方面任一实施方案所述的方法,其中还包括如下血浆样品处理的一种或多种的操作:(20a)空白尿液样品的制备:取空白人尿液50μl,置于1.5ml离心管中,加入0.01%氨水920μl,涡流混合3min,全部上样于固相萃取小柱上;上样后用2ml水清洗,最后用含1%氨水的甲醇溶液0.5ml洗脱;收集洗脱液,吸取10μl与190μl水充分混匀,得到用于进行lc-ms/ms分析测定的溶液(可取10μl进行lc-ms/ms分析);(20b)零点尿液样品的制备:取空白人尿液50μl,置于1.5ml离心管中,加入内标溶液20μl,0.01%氨水900μl,涡流混合3min,全部上样于固相萃取小柱上;接着如“(20a)空白尿液样品的制备”所述进行后续操作;(20c)标准曲线的制备:取不同浓度的dtpa-zn标准系列溶液100μl(例如,取“(10b)dtpa-zn标准系列溶液的配制”中的1.0×104μg/ml、5.0×103μg/ml、2.5×103μg/ml、103μg/ml、500μg/ml、250μg/ml、100μg/ml、50μg/ml”dtpa-zn标准系列溶液各100μl),置于1.5ml离心管中,加入空白人尿液,涡旋3min,制备相当于浓度为10、20、50、100、200、500、1000和2000μg/ml的尿液样品;取尿液样品50μl,并依次加入内标溶液20μl、0.01%氨水900μl,涡流混合3min,全部上样于固相萃取小柱上;接着如“(20a)空白尿液样品的制备”所述进行后续操作;(20d)质控样品的制备取dtpa-zn质控样品工作溶液置于1.5ml离心管中,加入空白人尿液,涡旋3min,制备相当于浓度为20、180和1800μg/ml的尿液样品,取尿液样品50μl,并依次加入内标溶液20μl、0.01%氨水900μl,涡流混合3min,全部上样于固相萃取小柱上;接着如“(20a)空白尿液样品的制备”所述进行后续操作;(20e)最低定量下限样品(lloq)的制备取dtpa-zn质控样品工作溶液加至空白人尿液中,制备成10.0μg/ml的lloq样品;其余按“(20d)质控样品的制备”项下操作,并进行lc-ms/ms分析;(20f)交叉干扰试验样品的制备取dtpa-zn工作溶液40μl,置于1.5ml离心管中,加入空白人尿液,涡旋3min,制备成2000μg/ml不含内标的uloq样品;除不加内标外,其余按“(20d)质控样品的制备”项下操作,并进行lc-ms/ms分析。在本发明上述操作方法的步骤中,虽然其描述的具体步骤在某些细节上或者语言描述上与下文具体实施方式部分的实例中所描述的步骤有所区别,然而,本领域技术人员根据本发明全文的详细公开完全可以概括出以上所述方法步骤。本发明的任一方面的任一实施方案,可以与其它实施方案进行组合,只要它们不会出现矛盾。此外,在本发明任一方面的任一实施方案中,任一技术特征可以适用于其它实施方案中的该技术特征,只要它们不会出现矛盾。下面对本发明作进一步的描述。本发明所引述的所有文献,它们的全部内容通过引用并入本文,并且如果这些文献所表达的含义与本发明不一致时,以本发明的表述为准。此外,本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍然希望在此对这些术语和短语作更详尽的说明和解释,提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。dtpa金属络合剂,例如dtpa的钙金属络合剂或者dtpa的锌金属络合剂,它们的体外检测,例如在一些化学制品、制剂中的检测,仍然是目前本领域技术人员遇到的一项巨大检测难题,而它们体内生物样品中的检测难度更是远远的比体外检测困难。特别是,目前国内外都没有这些化合物体内分析的报导。dtpa的钙金属络合剂,可缩写为ca-dtpa或者dtpa-ca,其通常亦称为ca-dtpa(dtpa-cana3);dtpa的锌金属络合剂,可缩写为zn-dtpa或者dtpa-zn,其通常亦称为zn-dtpa(dtpa-znna3)。ca-dtpa、zn-dtpa以及本发明中使用到的内标物质edta-zn(为其二钠盐水合物edta-znna2·xh2o)的分子式分别为以下式a、式b和式c:其中,ca-dtpa可以静脉注射和吸入给药,分别以注射剂和粉吸入剂制剂形式提供于临床,首批样品于2004年在美国获得批准。ca-dtpa在临床上的适应症与应用为:ca-dtpa作为一种缓解放射螯合剂被用于确诊或疑似被钚、镅、钜体内污染受试者的治疗,并提高这些金属元素的清除速率。ca-dtpa的剂量与给药方面,fda的规范要求在受污染24h内给予首剂量的ca-dtpa进行治疗,24h后,建议使用zn-dtpa维持螯合治疗。螯合治疗在体内受污染后的24h内使用效果最好;在确诊或者怀疑受到污染时应及时给予螯合治疗;如若不能立刻治疗,在条件允许时应立刻给予螯合治疗。在体内污染后的一段时间螯合治疗仍然有效。放射性污染物在体内循环过程中或在间质液中时,ca的螯合效果最佳。螯合疗效随着体内污染过后放射性污染物被隔离在肝和骨中而降低。如若确诊或疑似体内污染并非由钚、镅、钜引起,需进行其他治疗。具体的给药方法是,污染途径未确定或有可能存在多途径污染时静脉注射ca-dtpa;将5ml的ca-dtpa溶液(1g/5ml)用时3-4分钟缓慢静脉推注给药,或将5ml的ca-dtpa溶液于5%葡萄糖水溶液、林格氏乳酸溶液、生理盐水中稀释成100-250ml静脉输液给药;若受试者由于吸入而受污染,24h内给予雾化的ca-dtpa可作为治疗途径使用。另外,zn-dtpa可以静脉注射和吸入给药,分别以注射剂和粉吸入剂制剂形式提供于临床,首批样品于2004年在美国获得批准。zn-dtpa在临床上的适应症与应用为:zn-dtpa适用于确诊或疑似的钚、镅、钜造成的体内污染,并加快其清除速率。zn-dtpa的剂量与给药方面,fda的规范要求,在受污染24h内给予首剂量的ca-dtpa进行治疗;在此期间ca-dtpa比zn-dtpa疗效更好;如果ca-dtpa无效,给予zn-dtpa进行首次治疗。给药第二天若额外的螯合疗法被建议给予,使用zn-dtpa进行常规治疗。若zn-dtpa无效,螯合治疗使用ca-dtpa维持。含zn的伴随矿物质补充剂应被给予。对成年人和青少年,静脉注射1g剂量的zn-dtpa;对于12岁以下的儿童,静脉注射14mg/kg的zn-dtpa,用量切勿超过1g。24h后的螯合持续治疗使用zn-dtpa,对成年人和青少年,静脉注射1g剂量的zn-dtpa,每天一次;对于12岁以下的儿童,静脉注射14mg/kg的zn-dtpa,每天一次,用量勿超过1g。dtpa的螯合治疗在体内受污染后的24h内使用效果最好。在确诊或者怀疑受到污染时应及时给予螯合治疗。如若不能立刻治疗,在条件允许时应立刻给予螯合治疗。在体内污染后的一段时间螯合治疗仍然有效。放射性污染物在体内循环过程中或在间质液中时,zn-dtpa的螯合效果最佳。螯合疗效随着体内污染过后放射性污染物被隔离在肝和骨中而降低。如若确诊或疑似体内污染并非由钚、镅、钜引起,需进行其他治疗。具体的给药方法是,污染途径未确定或有可能存在多途径污染时静脉注射zn-dtpa;将5ml的zn-dtpa溶液(1g/5ml)用时3-4分钟缓慢静脉推注给药,或将5ml的zn-dtpa溶液于5%葡萄糖水溶液、林格氏乳酸溶液、生理盐水中稀释成100-250ml静脉输液给药;若受试者仅由于吸入途径而受污染,24h内给予雾化的zn-dtpa可以作为治疗途径使用。通过建立本发明方法,为dtpa的金属螯合物在给予动物(例如大鼠、人等)后体内生物样品(例如血液、尿液、唾液等)中这些物质的含量测定提供了可能。本发明建立的分析方法具有优异的方法学性能。附图说明图1:dtpa-zn和内标edta-zn的二级全扫描质谱图;图中,(a)dtpa-zn,(b)edta-zn。图2:dtpa-zn和edta-zn的mrm色谱图;其中,a:空白尿液,b:加标空白尿液,c:给药尿液样品;图中,i、ii:代表dtpa-zn,iii:内标。图3:考察尿液中dtpa-zn和内标edta-zn交叉干扰的色谱图;图中,(a)空白尿液标准添加dtpa-zn至浓度为2000μg/ml,(b)空白尿液标准添加内标edta-zn至浓度为200μg/ml;其中,i、ii:代表dtpa-zn,iii:内标。图4:lc-ms/ms法测定尿液中dtpa-zn浓度标准曲线举例。具体实施方式本发明所提供的以下实施例仅用于解释目的而不是用于,也不应被解释为以任何方式限制本发明。本领域那些技术人员将会认识到在不超越本发明的精神或范围的情况下可对以下实施例做出常规变化和修改。本发明的一个目的在于更好地理解dtpa-zn的体内处置规律,本发明试验建立并验证了定量检测生物样品中dtpa-zn的含量的液相色谱-串联质谱(lc-ms/ms)法,同时考察dtpa-zn在人体内的药代动力学行为。1试验概述zn-dtpa(二乙基三胺五乙酸三钠锌盐,dtpa-zn)是临床上作为一种缓解放射螯合剂用于确诊或疑似被钚、镅、钜污染受试者的治疗,并提高这些金属元素的清除速率。本试验目的是通过测定人尿液中dtpa-zn浓度,评价zn-dtpa注射液在健康受试者体内的药动学行为。本报告描述了测定人尿液样品中dtpa-zn的液相色谱-串联质谱(lc-ms/ms)分析方法。2实验材料2.1药品、试剂和材料2.2溶液2.2.1dtpa-zn储备液及标准系列溶液的配制取zn-dtpa注射剂1支(500mg/5ml)作为dtpa-zn储备液(a1),转移至具塞试管中-20℃冰箱冷冻保存。按下法制备dtpa-zn标准系列溶液:将dtpa-zn储备液(a1)用水按表1所示稀释成下列浓度的标准系列溶液,并在4℃冰箱内保存备用。表1:dtpa-zn标准系列溶液的制备(水溶解并定容)溶液编号制备方法zn-dtpa浓度(μg/ml)a11.0×105a2a1溶液,100μl→1ml1.0×104a3a1溶液,50μl→1ml5.0×103a4a1溶液,25μl→1ml2.5×103a5a2溶液,100μl→1ml103a6a3溶液,100μl→1ml500a7a4溶液,100μl→1ml250a8a5溶液,100μl→1ml100a9a6溶液,100μl→1ml502.2.2dtpa-zn质控样品工作溶液的制备另按下法制备dtpa-zn储备溶液:取1支zn-dtpa注射剂(500mg/5ml)作为储备液(b1),转移至具塞试管中-20℃冰箱冷冻保存。按下法制备dtpa-zn质控样品工作溶液:将dtpa-zn储备液(b1)用水按表2所示稀释成下列浓度的质控样品工作溶液,并在4℃冰箱内保存备用。表2:dtpa-zn质量控制样品工作溶液的制备(水溶解并定容)溶液编号制备方法dtpa-zn浓度(μg/ml)b11.0×105b2b1溶液,100μl→1ml1.0×104b3b1溶液,90μl→1ml9.0×103b4b2溶液,100μl→1ml1.0×103b5b3溶液,100μl→1ml900b6b4溶液,100μl→1ml100b7b4溶液,50μl→1ml502.2.3内标工作溶液的制备精密称取edta-zn(内标)20.0mg于2ml量瓶中,用水溶解并定容,配成浓度为10.0mg/ml的储备液(is1),-20℃冰箱冷冻保存。精密吸取储备液(is1)1250μl至25ml量瓶中,用水定容至刻度,得500μg/ml的内标工作溶液(is2),并在4℃冰箱内保存备用。2.2.41%氨水甲醇溶液的制备量取氨水10.0ml,甲醇990.0ml,于锥形瓶中混匀即得。3仪器和试验条件3.1lc-ms/ms条件色谱条件:分析柱为shiseidoproteonavi柱(5μm,250×4.6mmi.d.,日本shiseido公司),c18保护柱(4×3.0mmi.d.,美国phenomenex公司),流动相为甲醇-2mm甲酸铵(含0.03%氨水)(50:50,v/v),流速为0.45ml/min。质谱条件:电喷雾离子化源,负离子方式检测;喷射电压为-4000v;源温度为500℃;卷帘气(cur)为20;碰撞气(cad)为4;扫描方式为多反应监测(mrm),用于定量分析的离子反应分别为m/z454.2→m/z364.3+m/z226.6→m/z204.5(dtpa-zn,ce为45v)和m/z353.0→m/z263.0(乙二胺四乙酸二钠锌盐,ce为15v),扫描时间为150msec。3.2主要仪器液相色谱-质谱联用仪(lc-ms/ms):api4000三重四极杆串联质谱仪(美国absciex公司),配有turboionspray离子化源以及analyst1.5数据处理系统,液相色谱系统agilent1200二元梯度泵和ctc自动进样器。bt224s型精密电子分析天平(德国sartorius公司);dmt-2500型多管漩涡混合器(杭州米欧仪器有限公司);bf-2000型氮气吹干仪(北京八方世纪科技有限公司)。3.3尿液样品处理方法3.3.1空白尿液样品的制备取空白人尿液50μl,置于1.5ml离心管中,加入0.01%氨水920μl,涡流混合3min,全部上样于固相萃取小柱上。固相萃取小柱上样前先用2ml甲醇活化,再用2ml水平衡。上样后用2ml水清洗,最后用0.5ml1%氨水甲醇溶液洗脱。收集洗脱液,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。3.3.2零点尿液样品的制备取空白人尿液50μl,置于1.5ml离心管中,加入内标溶液20μl,0.01%氨水900μl,涡流混合3min,全部上样于固相萃取小柱上。其余操作同“3.3.1”。3.3.3标准曲线的制备取dtpa-zn标准系列溶液(a2~a9溶液)100μl,置于1.5ml离心管中,加入空白人尿液,涡旋3min,制备相当于浓度为10、20、50、100、200、500、1000和2000μg/ml的尿液样品。取尿液样品50μl,并依次加入内标溶液20μl,0.01%氨水900μl,涡流混合3min,全部上样于固相萃取小柱上。其余操作同“3.3.1”。3.3.4质控样品的制备取dtpa-zn质控样品工作溶液(b3、b5、b6)250μl,置于1.5ml离心管中,加入空白人尿液,涡旋3min,制备相当于浓度为20、180和1800μg/ml的尿液样品。取尿液样品50μl,并依次加入内标溶液20μl,0.01%氨水900μl,涡流混合3min,全部上样于固相萃取小柱上。其余操作同“3.3.1”。3.3.5最低定量下限样品(lloq)的制备取dtpa-zn质控样品工作溶液(b7)250μl,加至空白人尿液中,制备10.0μg/ml的lloq样品。其余步骤按“3.3.4质控样品的制备”项下操作,并进行lc-ms/ms分析。3.3.6交叉干扰试验样品的制备取dtpa-zn工作溶液(a2溶液)40μl,置于1.5ml离心管中,加入空白人尿液,涡旋3min,制备成2000μg/ml不含内标的uloq样品。其余步骤按“3.3.4质控样品的制备”项下操作,并进行lc-ms/ms分析。取空白人尿液50μl,置于1.5ml离心管中,制备零点尿液样品,按“3.3.2零点尿液样品的制备”项下操作。3.3.7提取回收率样品的制备取6种不同来源的空白人尿液50μl,置于1.5ml离心管中,加入0.01%氨水920μl,涡流混合3min,全部上样于固相萃取小柱上。固相萃取小柱上样前先用2ml甲醇活化,再用2ml水平衡。上样后用2ml水清洗,最后用0.5ml1%氨水甲醇溶液洗脱。收集洗脱液,吸取10μl与190μl相应浓度的混合标准溶液充分混匀,取10μl进行lc-ms/ms分析。3.3.8基质效应试验样品的制备取dtpa-zn质控样品工作溶液(b3、b5、b6)10μl和内标溶液(is2)20μl,置于1.5ml离心管中,40℃氮气流吹干,用水配制成相应浓度的混合标准溶液,吸取190μl与10μl1%氨水甲醇溶液混匀后,取10μl进行lc-ms/ms分析。每一浓度进行6样本分析,获得相应的峰面积。3.3.9尿液样品稳定性试验样品的制备取质控样品工作溶液(b3、b6)100μl,置于1.5ml离心管中,加入空白人尿液,涡旋3min,制备成dtpa-zn高、低两个浓度的尿液样品,取50μl尿液样品于室温放置4h、处理后样品室温放置24h、-80℃、-20℃放置26天、经历3次冷冻-解冻循环后,每一浓度进行4样本分析。3.3.10未知样品的制备取尿液样品50μl,置于1.5ml离心管中,依次加入内标工作溶液(is2)20μl,加入0.01%氨水900μl,涡流混合3min,全部上样于固相萃取小柱上。其余操作同“3.3.1”。3.4储备液及工作溶液稳定性样品的制备3.4.1dtpa-zn储备液稳定性样品的制备测定当日按“2.2.1dtpa-zn储备液及标准系列溶液的制备”项下,取1支zn-dtpa注射剂转移至具塞试管中作为储备液a1。精密移取新鲜的dtpa-zn储备液(a1)50μl至1.0ml量瓶中,用水稀释定容得a3溶液(5.0×103μg/ml);精密移取(a3)100μl至1.0ml量瓶中,用水稀释定容得a6溶液(500μg/ml)。取新鲜制备的a6溶液10μl,置于1.5ml离心管中,加入490μl水混匀后,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。dtpa-zn储备液-20℃放置56天稳定性样品的制备:精密移取dtpa-zn储备液(a1,-20℃放置56天)50μl至1.0ml量瓶中,用水稀释定容得a3溶液(5.0×103μg/ml);精密移取(a3)100μl至1.0ml量瓶中,用水稀释定容得a6溶液(500μg/ml)。将a6溶液10μl,置于1.5ml离心管中,加入490μl水混匀后,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。dtpa-zn储备液室温放置4h稳定性样品的制备:精密移取当日新鲜的dtpa-zn储备液(a1)50μl至1.0ml量瓶中,于室温放置4h后,用水稀释定容得a3溶液(5.0×103μg/ml);精密移取(a3)100μl至1.0ml量瓶中,用水稀释定容得a6-1溶液(500μg/ml)。取a6-1溶液10μl,置于1.5ml离心管中,加入490μl水混匀后,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。3.4.2dtpa-zn标准工作溶液稳定性样品的制备测定当日按“2.2.2质控样品工作溶液的制备”项下,新鲜制备dtpa-zn质控工作溶液(b3、b6)。取新鲜制备的b3、b6溶液10μl,置于1.5ml离心管中,加入490μl水混匀后,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。dtpa-zn标准工作溶液-20℃放置56天稳定性样品的制备:取-20℃保存的b3、b6溶液10μl,置于1.5ml离心管中,加入490μl水混匀后,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。dtpa-zn标准工作溶液室温放置4h稳定性样品的制备:精密移取当日新鲜制备的b3、b6溶液10μl,置于1.5ml离心管中,于室温放置4h后,加入490μl水混匀后,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。3.4.3内标储备液及内标工作溶液稳定性样品的制备测定当日按“2.2.3内标工作溶液的制备”项下,精密移取新鲜制备的内标储备液(is1)50μl至1ml量瓶中,用水稀释定容至刻度得is2溶液(500μg/ml)。取新鲜制备的is2溶液20μl,置于1.5ml离心管中,加入480μl水混匀后,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。内标储备液-20℃放置57天稳定性样品的制备:精密移取于-20℃保存的内标储备液(is1,-20℃放置57天)50μl至1ml量瓶中,用水稀释定容至刻度得is2溶液(500μg/ml)。取is2溶液20μl,置于1.5ml离心管中,加入480μl水混匀后,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。内标储备液室温放置4h稳定性样品的制备:精密移取当日新鲜制备的(is1)50μl至1ml量瓶中,于室温放置4h后,用水稀释定容至刻度得is2-1溶液(500μg/ml)。取is2-1溶液20μl,置于1.5ml离心管中,加入480μl水混匀后,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。内标工作溶液-20℃放置57天稳定性样品的制备:取-20℃保存的is2溶液(-20℃放置57天)20μl,加入480μl水混匀后,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。内标工作溶液室温放置4h稳定性样品的制备:取新鲜制备的is2溶液20μl,置于1.5ml离心管中,于室温放置4h后,加入480μl水混匀后,吸取10μl与190μl水充分混匀,取10μl进行lc-ms/ms分析。3.5数据处理与分析应用winnolin(phoenix6.3,美国)药代动力学软件对所测数据进行分析,获得与药物暴露相关的动力学参数cmax、tmax、auc0-t和mrt0-t。4试验结果4.1lc-ms/ms定量方法学验证4.1.1方法选择性待测物的二级全扫描质谱图见图1。取6种不同来源的空白人尿液50μl,置于1.5ml离心管中,按“3.3.1空白尿液样品的制备”项下操作,进行lc-ms/ms分析,获得空白尿液样品的色谱图,如附图2a;将一定浓度的标准溶液加入到空白尿液中,取尿液样品50μl,按“3.3.3标准曲线的制备”项下操作,得色谱图,如附图2b,其中dtpa-zn的保留时间约为4.67min,内标edta-zn的保留时间约为5.02min;取给药后采集的尿液样品50μl,按“3.3.10未知样品的制备”项下操作,如附图2c。结果表明,空白尿液中内源性物质不干扰待测物及内标的测定。4.1.2方法的交叉干扰试验按“3.3.6交叉干扰试验样品的制备”项下操作,在不含内标的uloq样品后进行零点尿液样品分析,得附图3。结果表明,dtpa-zn与内标之间无交叉干扰。4.1.3标准曲线以待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,用加权(w=1/x2)最小二乘法进行回归运算,求得dtpa-zn的直线回归方程,标准曲线见图4。待测物在10~2000μg/ml的范围内,浓度与峰面积比之间具有良好的线性关系,(r2>0.99)。4.1.4方法的精密度与准确度按“3.3.5最低定量下限样品(lloq)的制备”和“3.3.4质控样品的制备”项下操作,制备dtpa-zn最低定量下限(lloq,浓度为10μg/ml)样品和低、中、高3个浓度(分别为20、180和1800μg/ml)的qc样品,每一浓度进行6样本分析,连续测定三天,计算lloq和qc样品的测得浓度,与制备浓度对照,求得本法的准确度与精密度,将3个分析批的结果进行方差分析获得精密度和准确度(见表3)。结果显示,方法的精密度和准确度均符合生物样品定量分析要求。表3:dtpa-zn的准确度与精密度(n=18)4.1.5提取回收率和基质效应按“3.3.4质控样品的制备”和“3.3.7提取回收率样品的制备”项下操作。配制3个浓度的人尿液qc样品,每一浓度进行6样本分析,并取6种不同来源的空白人尿液,配制提取回收率样品,质控样品的峰面积与提取回收率样品的峰面积相比得到提取回收率(见表4)。按“3.3.7提取回收率样品的制备”和“3.3.8基质效应样品的制备”项下操作。取6种不同来源的空白人尿液,配制提取回收率样品;取dtpa-zn质控样品工作溶液(b3、b4、b7)10μl和内标溶液(is2)20μl,配制基质效应样品,每一浓度进行6样本分析,获得相应的峰面积。提取回收率样品的峰面积与基质效应样品的峰面积相比得到基质效应(见表5),实验结果表明人尿液中dtpa-zn基质效应均在85%~115%之间,尿液基质对待测物的测定没有显著的影响。表4:dtpa-zn的提取回收率(n=6)标示浓度(μg/ml)回收率(mean±sd)(%)rsd(%)2091.5±4.75.218093.5±3.33.5180090.1±3.13.4表5:dtpa-zn的基质效应(n=6)4.1.6尿液样品稳定性考察考察了dtpa-zn尿液样品在各种实验条件下的稳定性。结果表明,dtpa-zn尿液样品稳定性的rsd均小于6.1%,相对偏差re在3.1~6.4%的范围内(见表6),二者的稳定性符合本试验要求,详细数据见附表5。表6:尿液中dtpa-zn的稳定性(n=4)4.1.7储备液和工作溶液稳定性考察按“2.5.1dtpa-zn储备液稳定性样品的制备”项下操作,考察了dtpa-zn储备液、工作溶液,内标储备液、工作溶液在室温放置、-20℃放置的稳定性。采用外标一点法计算储备液及工作溶液的实测浓度,将其与理论值比较计算re(%);同时计算储备液及工作溶液室温放置前后两种溶液峰面积的rsd(%)。结果表明:待测物(dtpa-zn)储备液、工作溶液室温放置4h、-20℃放置56天稳定。内标(edta-zn)储备液、工作溶液室温放置4h、-20℃放置57天稳定。结果见表7。表7:dtpa-zn、内标储备液及工作溶液稳定性(n=6)4.1.8方法的残留考察配制dtpa-zn最高定量限uloq(2000μg/ml)的尿液样品和空白尿液样品。在uloq样品后进行空白尿液样品分析。比较空白尿液样品与lloq的色谱图,空白尿液样品中待测物响应值不应超过lloq的20%。空白尿液样品中dtpa-zn及内标的信号响应强度分别为lloq的6.2%和0.3%。结果表明uloq样品对空白尿液样品无明显干扰。4.2未知尿液样品测定与质量控制试验尿液样品测定按“3.3.10未知尿液样品制备”项下操作,并以当日的标准曲线计算各时间点样品中dtpa-zn的浓度,由qc样品决定当日数据的取舍。要求每个分析批的qc样品的准确度的85%~115%范围内,可以有1/3的浓度点超限,但同一浓度至少有50%符合标准。5dtpa-zn的药代动力学12名健康受试者静脉滴注给予zn-dtpa注射液(单次静滴250mg、单次静滴500mg、单次静滴1000mg、多次静滴500mg),于不同时间点取尿液,测定尿液中dtpa-zn药物浓度,并绘制平均药物浓度-时间曲线,结果显示,同一剂量时药物浓度-时间曲线基本吻合,不同剂量时药物浓度-时间曲线变化趋势相同,相关药动学参数相同。6结论本试验采用lc-ms/ms法测定人尿液样品中dtpa-zn的浓度。尿液样品经固相萃取方法处理后,采用esi源,以mrm扫描方式进行定量分析,尿液中的内源性物质不干扰dtpa-zn的测定。本方法准确、选择性强、灵敏度高,并且符合cfda颁布的“化学药物制剂人体生物利用度和生物等效性研究技术指导原则”([h]gcl2-1)有关要求,适合zn-dtpa在人尿液中药物动力学研究。以上通过本发明较佳实施例对本发明的精神作了详细阐述。本领域技术人员理解,凡是根据本发明技术实质对以上实施例所作的任何修改、等同变化与修饰,均落在本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1