一种同时检测水产品中64种兽药残留的方法与流程
本发明涉及一种检测水产品中残留药物的方法。
背景技术:
近年来我国居民随着可支配收入的稳步增长,饮食方面更加注重营养和健康,对水产品的需求量逐年增大,促进了水产行业的快速发展。但是,水产品在生产运输、市场销售和餐饮环节,为了治疗或预防各类疾病,相关人员在使用兽药过程中缺乏相应的科学知识以及对经济利益的不断追求,存在误用、滥用禁用或限用兽药现象。出现了食品动物会产生耐药性、影响动物疫病控制、增加动物性食品中药物残留等问题。对动物和动物性食品安全构成威胁,人体长期摄入将产生蓄积,引起“三致作用”(即致癌、致突变、致畸形。因此我国、美国、日本、欧盟、国际食品法典委员会等对兽药在食品动物中的使用进行了限定,兽药残留也日益受到世界各国及地区的重视。
随着科技的不断进步,兽药残留的检测已迅速向多种类高通量发展。色谱质谱法因具有较高的灵敏度和选择性,成为检测复杂动物组织中兽药多残留的主流方法。目前主要用到的有气相色谱-质谱仪(gc-ms)、液相色谱-三重四级杆液质联用仪(lc-qtrap)、液相色谱-离子阱质谱仪(lc-iontrap/ms)、液相色谱-飞行时间质谱仪(lc-tof/ms)、液相色谱-四级杆/静电场轨道阱高分辨质谱仪(uhplc-esiq-orbitrap)等。由于兽药种类较多,类别间差异较大,多种兽药残留同时提取的前处理过程相对复杂。例如gc-ms法的前处理需要进行衍生化;lc-ms法为了保护目标物质在提取过程中不发生分解、变性等,在样品提取过程中往往通过加入缓冲溶液或者调ph值等手段来保证目标物的回收率以满足检测要求。uhplc-esiq-orbitrap在全扫描模式下提取目标化合物的精确质量数,采用自动触发采集二级质谱图,进一步提高了定性的准确性,有利于使用简便的前处理方法。目前国内外有使用该仪器建立了奶粉、猪肉料、蜂蜜等基质中兽药残留的测定方法,但在水产品兽药多残留检测方面的研究鲜有报道。
公开号为107167539a的专利申请公开了同时测定鱼肉中31种兽药残留的方法,但是该方法只能同时检测31种兽药,无法检测4-硝基咪唑等其余兽药。
技术实现要素:
为了解决上述问题,本发明提供了如下技术方案:
本发明提供了一种检测水产品中64种残留药物的方法,它包括如下步骤:
(1)取待检样品,前处理,制备得到供试液;所述前处理的步骤如下:
1)取待检样品,均质,加入溶剂,超声提取,加入除水剂;
2)除水后浓缩,加入复溶液定容,再加入溶剂除去其中的干扰物质;
3)将步骤2)中得到的溶液加入乙二胺-n-丙基硅烷净化提取得到待检溶液,冷冻脱脂,得供试液;
(2)采用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测:
其中的色谱条件为:色谱柱:accucorerp-ms柱;柱温:25-35℃;流速:0.25-0.35ml/min;流动相:a相-含0.1%甲酸的水溶液,b相-含0.1%甲酸的乙腈溶液;梯度洗脱。
其中的质谱条件为:离子源:可加热电喷雾离子源;采集方式:全扫描/数据依赖二级扫描;归一化碰撞能:20%、40%、60%;喷雾电压:3000~3500v离子传输管温度:300~400℃;加热器温度:300~450℃;鞘气n2流速:35~50arb;辅助气n2流速:5~20arb。
进一步的,检测的药物为非甾体类抗炎药、四环素类、喹噁啉及其代谢物、甲状腺拮抗剂、硝基呋喃类、苯并咪唑类、β2-受体激动剂、镇静剂、磺胺类、喹诺酮类、氨苯砜、甾体类抗炎药、大环内酯类、硝基咪唑类。
进一步的,检测的具体的药物为4-硝基咪唑、羟甲基甲硝咪唑、5-氯-1-甲基-4-硝基咪唑、2-疏基苯并咪唑、苯基硫氧嘧啶、n-乙酰氨苯砜、磺胺喹噁啉、吲哚美辛、甲基硫脲嘧啶、甲硝唑、洛硝哒唑、克仑塞罗、卡巴氧、2-喹喔啉羧酸、呋喃唑酮、氨苯砜、羟基甲硝唑、呋喃它酮、丙基硫氧嘧啶、土霉素、磺胺二甲嘧啶、磺胺甲噻二唑、磺胺氯哒嗪、维吉霉素m1、二甲硝咪唑、阿苯达唑-2-氨基砜、替硝唑、磺胺甲氧哒嗪、磺胺间甲氧嘧啶、脱氧卡巴氧、氟甲喹、托麦汀、利托君、磺胺甲基嘧啶、呋喃西林、溴代克伦特罗、磺胺甲恶唑、噁喹酸、舒林酸、保泰松、特硝唑、4-甲酰氨基安替比林、诺氟沙星、羟基异丙硝唑、克仑潘特、阿苯达唑砜、群勃龙、酮洛芬、4-甲氨基安替比林、克仑丙罗、阿苯达唑亚砜、妥布特罗、奥芬达唑、芬苯达唑砜、吡罗昔康、去氢睾酮、阿扎哌醇、4-差向土霉素、美托洛尔、2-氨基-5-苯并咪唑、奥苯达唑、异丙硝唑、苯乙醇a、美洛昔康。
进一步的,前处理步骤的具体方法如下:
1)在待测物中加入乙腈-水(80:20,v/v),超声提取,加入无水硫酸钠除水;
2)除水后浓缩近干,加入0.1%甲酸的甲醇-乙腈-水(2:2:6,v/v/v)复容,加入乙腈饱和正己烷溶液净化,涡旋,超声;
3)取步骤2)得到的溶液的下层液,加入乙二胺-n-丙基硅烷净化,冷冻后离心,过有机相滤膜,得到供试液。
进一步的,其中的色谱条件具体为:色谱柱:accucorerp-ms柱-100mm×2.1mm,2.6μm;柱温:30℃;流速:0.3ml/min;进样量:10μl;流动相:a相-含0.1%甲酸的水溶液,b相-含0.1%甲酸的乙腈溶液;梯度洗脱程序:0~15min,95%a;15~17min,5%a;17~17.1min,95%a;17.1~20min,95%a。
进一步的,其中的质谱条件具体为:离子源:可加热电喷雾离子源,采集方式:全扫描/数据依赖二级扫描;一级扫描分辨率为70000,二级扫描分辨率为17500;归一化碰撞能:20%、40%、60%;喷雾电压:3200v;离子传输管温度:325℃;加热器温度:350℃;鞘气(n2)流速:40arb;辅助气(n2)流速:10arb。动态排除:6s;顶点触发:2~6s。
进一步的,检测水产品中64中兽药的方法还包括如下步骤:
取不同浓度的残留药物标准品,采用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测;根据不同质量浓度的标准品对应质谱中的响应面积,建立标准曲线;根据待检样品相应物质在质谱中的响应面积,计算残留药物的含量。
进一步的,检测水产品中64中兽药的方法还包括如下步骤:取残留药物标准品,采用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测;根据得到的残留药物标准品的质谱特性对待测样品中相应物质进行定性。
本发明的有益效果在于:本发明建立了一种能够同时对水产品中的14类、64种兽药残留进行检测,该方法检测成本低、周期短、稳定性好、准确度高、灵敏度高,适用于日常对大批量水产品中兽药残留的快速筛查。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1为64种兽药混合标准溶液的提取离子流图;
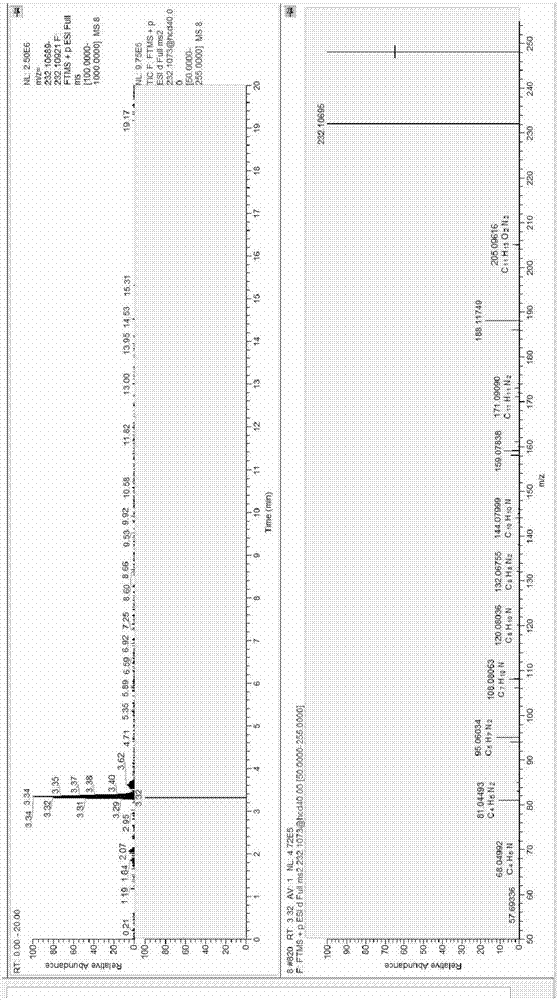
图2为冰鲜鳙鱼头的提取离子流色谱图和质谱图;
图3为冻罗非鱼片的提取离子流色谱图和质谱图;
图4为南美对虾的提取离子流色谱图和质谱图。
具体实施方式
仪器、试剂与材料
超高效液相色谱-四级杆/静电场轨道阱高分辨质谱仪(ultimate3000qexacitvuplc-hrms,配hesi离子源,tracefinder3.3efs数据处理系统,美国thermofisher公司);accucorerp-ms柱(100mm×2.1mm,2.6μm,美国thermofisher公司);cp2250天平(德国sartorius公司);涡旋混合器(德国ika公司);mmv-1000w超声振荡器(日本eyela公司);sigma2-16k台式离心机(德国sartorius-sigma公司);bhchisynocre平行定量浓缩仪(瑞士步琪公司);milli-q纯水机(美国millipore公司);0.22μm有机相滤膜(上海安谱公司)。
乙腈、正己烷、甲醇均为色谱纯(美国默克公司);无水硫酸钠(分析纯,使用前在650℃的马弗炉内灼烧4h);primarysecondaryamine(psa)(德国cnw公司)、十八烷基硅烷(c18)(德国cnw公司);氨基(nh2)吸附剂(天津博纳艾杰尔公司);64种兽药(见表1)标准品(纯度均≥90.0%,德国dr.ehrenstorfer公司。
实施例1本发明水产品中64种兽药的定性与定量检测方法
1、检测方法
(1)样品前处理方法
取待检试样,均质,准确称取均质后的试样(2.00±0.01)g置于50ml聚丙烯离心管中,加入10ml乙腈-水(80:20,v/v)溶液,涡旋混匀30s,超声提取(声波频率45khz,有效功率200w)10min,加入4g无水硫酸钠振摇10min,以4000r/min的速度离心5min,取上清液5ml于平行定量浓缩仪浓缩至近干,用1ml含0.1%甲酸的甲醇-乙腈-水(2:2:6,v/v/v)定容,加入4ml乙腈饱和正己烷以2000r/min的转速涡旋30s,超声(声波频率45khz,有效功率200w)5min。放置15min。取1.2ml下层液转移至已称有50mg乙二胺-n-丙基硅烷(psa)的2ml高速离心管涡旋30s以上,-20℃冰箱中放置30min。置于4℃离心机以14500r/min离心15min。取下层液过0.22μm的有机相滤膜,滤液作为供试液,上机。
(2)标准品的制备
标准储备溶液:分别称取适量的64种标准品,其中氟甲喹、吡罗昔康、舒林酸、托美丁、酮洛芬、美洛昔康、吲哚美辛、保泰松用乙腈配制成质量浓度为100μg/ml的标准储备溶液;噁喹酸先加1ml0.1mol/lnaoh溶液溶解,再加入甲醇定容到10ml配制成质量浓度为100μg/ml的标准储备溶液,其余标准品用甲醇配制成质量浓度均为100μg/ml的标准储备溶液,置于-18℃冰箱避光保存。
混合标准溶液:分别取上述标准储备溶液用甲醇配制成质量浓度为1μg/ml的混合标准溶液,在2-4℃冰箱保存。临用前按需要混合稀释为标准工作溶液。
利用空白基质溶液逐级稀释配制不同浓度的混合标准溶液:400ng/ml、200ng/ml、100ng/ml、50ng/ml、25ng/ml、10ng/ml、5ng/ml、2.5ng/ml、1.25ng/ml、0.625ng/ml、0.3125ng/ml、0.1562ng/ml、0.078ng/ml、0.039ng/ml。
(3)超高效液相色谱-四极杆/静电场轨道阱高分辨质谱
1)色谱条件
色谱柱:accucorerp-ms柱(100mm×2.1mm,2.6μm);柱温:30℃;流速:0.3ml/min;进样量:10μl;流动相:含0.1%甲酸的水溶液(a相),含0.1%甲酸的乙腈溶液(b相);梯度洗脱程序:0~15min,95%a;15~17min,5%a;17~17.1min,95%a;17.1~20min,95%a。
2)质谱条件
离子源:可加热电喷雾离子源(hesi),采集方式:全扫描/数据依赖二级扫描(fullms/ddms2),topn=1(前1强);一级扫描分辨率为70000,二级扫描分辨率为17500;归一化碰撞能(stepped(n)ce):20%、40%、60%;喷雾电压(sprayvoltage(+)):3200v;离子传输管温度(capillarytemp):325℃;加热器温度(heatertemp):350℃;鞘气(sheathgas)(n2)流速:40arb;辅助气(auxgas)(n2)流速:10arb。动态排除(dynamicexclusion):6s;顶点触发(apextrigger):2~6s。
2定性检测
根据得到的待测样品中相应物质的质谱特性(见表1)对待测样品中相应物质进行定性。
表164种兽药的分子式与质谱参数
3定量检测
根据不同质量浓度的标准品对应质谱中的响应面积,建立标准曲线(见下表2);根据待检样品相应物质在质谱中的响应面积,计算残留药物的含量。
实施例2本发明水产品中64种兽药的定性与定量检测方法
1、检测方法
(1)样品前处理方法
取待检试样,均质,准确称取均质后的试样(2.00±0.01)g置于50ml聚丙烯离心管中,加入10ml乙腈-水(80:20,v/v)溶液,涡旋混匀30s,超声提取(声波频率45khz,有效功率200w)10min,加入4g无水硫酸钠振摇10min,以4000r/min的速度离心5min,取上清液5ml于平行定量浓缩仪浓缩至近干,用1ml含0.1%甲酸的甲醇-乙腈-水(2:2:6,v/v/v)定容,加入4ml乙腈饱和正己烷以2000r/min的转速涡旋30s,超声(声波频率45khz,有效功率200w)5min。放置15min。取1.2ml下层液转移至已称有50mgpsa的2ml高速离心管涡旋30s以上,-20℃冰箱中放置30min。置于4℃离心机以14500r/min离心15min。取下层液过0.22μm的有机相滤膜,滤液作为供试液,上机。
(2)标准品的制备
标准储备溶液:分别称取适量的64种标准品,其中氟甲喹、吡罗昔康、舒林酸、托美丁、酮洛芬、美洛昔康、吲哚美辛、保泰松用乙腈配制成质量浓度为100μg/ml的标准储备溶液;噁喹酸先加1ml0.1mol/lnaoh溶液溶解,再加入甲醇定容到10ml配制成质量浓度为100μg/ml的标准储备溶液,其余标准品用甲醇配制成质量浓度均为100μg/ml的标准储备溶液,置于-18℃冰箱避光保存。
混合标准溶液:分别取上述标准储备溶液用甲醇配制成质量浓度为1μg/ml的混合标准溶液,在2-4℃冰箱保存。临用前按需要混合稀释为标准工作溶液。
利用空白基质溶液逐级稀释配制不同浓度的混合标准溶液:400ng/ml、200ng/ml、100ng/ml、50ng/ml、25ng/ml、10ng/ml、5ng/ml、2.5ng/ml、1.25ng/ml、0.625ng/ml、0.3125ng/ml、0.1562ng/ml、0.078ng/ml、0.039ng/ml。
(3)超高效液相色谱-四极杆/静电场轨道阱高分辨质谱
1)色谱条件
色谱柱:accucorerp-ms柱(100mm×2.1mm,2.6μm);柱温:25℃;流速:0.25ml/min;进样量:10μl;流动相:含0.1%甲酸的水溶液(a相),含0.1%甲酸的乙腈溶液(b相);梯度洗脱程序:0~15min,95%a;15~17min,5%a;17~17.1min,95%a;17.1~20min,95%a。
2)质谱条件
离子源:可加热电喷雾离子源(hesi),采集方式:全扫描/数据依赖二级扫描(fullms/ddms2),topn=1(前1强);一级扫描分辨率为70000,二级扫描分辨率为17500;归一化碰撞能(stepped(n)ce):20%、40%、60%;喷雾电压(sprayvoltage(+)):3000v;离子传输管温度(capillarytemp):300℃;加热器温度(heatertemp):300℃;鞘气(sheathgas)(n2)流速:35arb;辅助气(auxgas)(n2)流速:5arb。动态排除(dynamicexclusion):6s;顶点触发(apextrigger):2~6s。
2定性检测
根据得到的待测样品中相应物质的质谱特性对待测样品中相应物质进行定性。
3定量检测
根据不同质量浓度的标准品对应质谱中的响应面积,建立标准曲线;根据待检样品相应物质在质谱中的响应面积,计算残留药物的含量。
实施例3本发明水产品中64种兽药的定性与定量检测方法
1、检测方法
(1)样品前处理方法
取待检试样,均质,准确称取均质后的试样(2.00±0.01)g置于50ml聚丙烯离心管中,加入10ml乙腈-水(80:20,v/v)溶液,涡旋混匀30s,超声提取(声波频率45khz,有效功率200w)10min,加入4g无水硫酸钠振摇10min,以4000r/min的速度离心5min,取上清液5ml于平行定量浓缩仪浓缩至近干,用1ml含0.1%甲酸的甲醇-乙腈-水(2:2:6,v/v/v)定容,加入4ml乙腈饱和正己烷以2000r/min的转速涡旋30s,超声(声波频率45khz,有效功率200w)5min。放置15min。取1.2ml下层液转移至已称有50mgpsa的2ml高速离心管涡旋30s以上,-20℃冰箱中放置30min。置于4℃离心机以14500r/min离心15min。取下层液过0.22μm的有机相滤膜,滤液作为供试液,上机。
(2)标准品的制备
标准储备溶液:分别称取适量的64种标准品,其中氟甲喹、吡罗昔康、舒林酸、托美丁、酮洛芬、美洛昔康、吲哚美辛、保泰松用乙腈配制成质量浓度为100μg/ml的标准储备溶液;噁喹酸先加1ml0.1mol/lnaoh溶液溶解,再加入甲醇定容到10ml配制成质量浓度为100μg/ml的标准储备溶液,其余标准品用甲醇配制成质量浓度均为100μg/ml的标准储备溶液,置于-18℃冰箱避光保存。
混合标准溶液:分别取上述标准储备溶液用甲醇配制成质量浓度为1μg/ml的混合标准溶液,在2-4℃冰箱保存。临用前按需要混合稀释为标准工作溶液。
利用空白基质溶液逐级稀释配制不同浓度的混合标准溶液:400ng/ml、200ng/ml、100ng/ml、50ng/ml、25ng/ml、10ng/ml、5ng/ml、2.5ng/ml、1.25ng/ml、0.625ng/ml、0.3125ng/ml、0.1562ng/ml、0.078ng/ml、0.039ng/ml。
(3)超高效液相色谱-四极杆/静电场轨道阱高分辨质谱
1)色谱条件
色谱柱:accucorerp-ms柱(100mm×2.1mm,2.6μm);柱温:35℃;流速:0.35ml/min;进样量:10μl;流动相:含0.1%甲酸的水溶液(a相),含0.1%甲酸的乙腈溶液(b相);梯度洗脱程序:0~15min,95%a;15~17min,5%a;17~17.1min,95%a;17.1~20min,95%a。
2)质谱条件
离子源:可加热电喷雾离子源(hesi),采集方式:全扫描/数据依赖二级扫描(fullms/ddms2),topn=1(前1强);一级扫描分辨率为70000,二级扫描分辨率为17500;归一化碰撞能(stepped(n)ce):20%、40%、60%;喷雾电压(sprayvoltage(+)):3500v;离子传输管温度(capillarytemp):400℃;加热器温度(heatertemp):450℃;鞘气(sheathgas)(n2)流速:50arb;辅助气(auxgas)(n2)流速:20arb。动态排除(dynamicexclusion):6s;顶点触发(apextrigger):2~6s。
2定性检测
根据得到的待测样品中相应物质的质谱特性对待测样品中相应物质进行定性。
3定量检测
根据不同质量浓度的标准品对应质谱中的响应面积,建立标准曲线;根据待检样品相应物质在质谱中的响应面积,计算残留药物的含量。
实施例4本发明检测方法的条件筛选以及方法学验证
一、溶液配制和仪器
1标准溶液的配制
标准储备溶液:分别称取适量的上述标准品,其中氟甲喹、吡罗昔康、舒林酸、托美丁、酮洛芬、美洛昔康、吲哚美辛、保泰松用乙腈配制成质量浓度为100μg/ml的标准储备溶液;噁喹酸先加1ml0.1mol/lnaoh溶液溶解,再加入甲醇定容到10ml配制成质量浓度为100μg/ml的标准储备溶液,其余标准品用甲醇配制成质量浓度均为100μg/ml的标准储备溶液,置于-18℃冰箱避光保存。
混合标准溶液:分别取上述标准储备溶液用甲醇配制成质量浓度为1
μg/ml的混合标准溶液,在2-4℃冰箱保存。临用前按需要混合稀释为标准工作溶液。
2样品前处理方法
准确称取均质后的试样(2.00±0.01)g置于50ml聚丙烯离心管中,加入10ml乙腈-水(80:20,v/v)溶液,涡旋混匀30s,超声提取10min,加入4g无水硫酸钠振摇10min,以4000r/min的速度离心5min,取上清液5ml于平行定量浓缩仪浓缩至近干,用1ml含0.1%甲酸的甲醇-乙腈-水(2:2:6,v/v/v)定容,加入4ml乙腈饱和正己烷以2000r/min的转速涡旋30s,超声5min。放置15min。取1.2ml下层液转移至已称有50mgpsa的2ml高速离心管涡旋30s以上,-20℃冰箱中放置30min。置于4℃离心机以14500r/min离心15min。取下层液过0.22μm的有机相滤膜,滤液上机。
3空白基质混合标准溶液的配制
取阴性样品,按1.3节方法处理,浓缩至近干后,加入1.0ml混合标准溶液复溶,涡旋混匀,净化,过0.22μm有机滤膜,滤液上机。
4仪器条件
1色谱条件
色谱柱:accucorerp-ms柱(100mm×2.1mm,2.6μm);柱温:30℃;流速:0.3ml/min;进样量:10μl;流动相:含0.1%甲酸的水溶液(a相),含0.1%甲酸的乙腈溶液(b相);梯度洗脱程序:0~15min,95%a;15~17min,5%a;17~17.1min,95%a;17.1~20min,95%a。
2质谱条件
离子源:可加热电喷雾离子源(hesi),采集方式:全扫描/数据依赖二级扫描(fullms/ddms2),topn=1(前1强);一级扫描分辨率为70000,二级扫描分辨率为17500;归一化碰撞能(stepped(n)ce):20%、40%、60%;喷雾电压(sprayvoltage(+)):3200v;离子传输管温度(capillarytemp):325℃;加热器温度(heatertemp):350℃;鞘气(sheathgas)(n2)流速:40arb;辅助气(auxgas)(n2)流速:10arb。动态排除(dynamicexclusion):6s;顶点触发(apextrigger):2~6s.64种兽药的质谱参数见上表1。
二、检测方法参数的优化
1.色谱条件
实验首先对比了色谱柱waters
对流动相,有机相采用本发明0.1%甲酸的乙腈溶液时,目标物的峰型最好,采用乙腈、甲醇、含0.1%甲酸的乙腈溶液和含0.1%甲酸的甲醇溶液的效果则不佳。
采用本发明实施例1的色谱条件,具体地选用thermoaccucorerp-ms色谱柱,水相为含0.1%甲酸的水溶液,有机相为含0.1%甲酸的乙腈溶液。对64种目标化合物的提取离子流色谱图见图1,可以看出,64种目标化合物的峰性优良。
2.质谱条件的优化
先对目标物进行一级质谱全扫描,发现其母离子,强度达到设定阈值(1e6)时,自动触发二级质谱扫描,同时得到母离子的精确质量数以及二级质谱的全扫描信息。采用20%、40%、60%三种不同归一化碰撞能(stepped(n)ce)对化合物进行碎裂,得到一张碎片离子信息丰富的加合图。进一步优化其余条件,动态排除(dynamicexclusion)对比了6s、8s、10s,发现6s时峰形结果较好。顶点触发(apextrigger)为2~6s,topn=1(前1强)时可获得满意的二级质谱图。
三、样品前处理条件的优化
1提取液的选择
64种兽药涉及14类,各类物质的化学性质有一定的差异。本实验比较了乙腈-甲醇-水溶液(4:3:3,v/v/v)和乙腈-水溶液(7:3,v/v),结果显示后者比前者的提取效率高(见表2)
表2不同提取液对64种兽药回收率的影响
进一步对比不同体积比的乙腈-水溶液后发现,乙腈-水溶液(6:4,v/v)和乙腈-水溶液(8:2,v/v)相较提取效率更好且无显著差异(见图2)。考虑到提取液中水占比高将延长后续的除水和浓缩时间,最终采用乙腈-水(8:2,v/v)作为提取液。
2除水剂的选择
实验对比了常用除水剂无水硫酸钠和无水硫酸镁的除水效果。当使用无水硫酸镁时四环素类化合物的回收率降低,土霉素、拖美汀、保泰松等目标物回收率也明显降低。通过比较,实验最后采用4g无水硫酸钠作为除水剂。
3净化剂的选择
实验对比了c18、psa、nh2作为杂质吸附剂对净化效果的影响。加入nh2,硝基咪唑类的回收率明显低于使用c18或psa。使用c18时除了对于特硝唑等少数目标物的回收率优于psa外,其余大部分的回收率均明显低于psa。实验选择以psa作为吸附剂,使用量选择对比了50mg、80mg、100mg和120mg,结果显示当psa为50mg时对于大多数目标物均可获得较好的回收率。最终选择使用50mg的psa作为净化剂。
4复溶液的优化
提取液浓缩近干后需要复溶。有文献报道使用0.1%甲酸的乙腈-水(1∶4,v/v)、1%甲酸乙腈-1%甲酸水(4:6,v/v),本文对比了0.1%甲酸乙腈-水(6:4,v/v)、0.1%甲酸乙腈-水(7:3,v/v)、0.1%甲酸乙腈-水(8:2,v/v)、甲醇-水(6:4,v/v)、甲醇-水(7:3,v/v)、甲醇-水(8:2,v/v)、0.1%甲酸水-甲醇-乙腈(8:1:1,v/v/v)、0.1%甲酸水-甲醇-乙腈(6:2:2,v/v/v),实验结果显示当使用0.1%甲酸水-甲醇-乙腈(6:2:2,v/v/v)为复溶液时目标物的回收率平均水平最高,见表3。
表3不同复溶液对64种兽药回收率的影响
四、本发明检测方法的方法学验证
1线性范围和方法定量限
利用空白基质溶液逐级稀释配制不同浓度的混合标准溶液:400ng/ml、200ng/ml、100ng/ml、50ng/ml、25ng/ml、10ng/ml、5ng/ml、2.5ng/ml、1.25ng/ml、0.625ng/ml、0.3125ng/ml、0.1562ng/ml、0.078ng/ml、0.039ng/ml。在优化后的仪器条件下进行测定,以各化合物在质谱中的响应面积(у)为纵坐标,质量浓度(x,ng/ml)为横坐标进行线性拟合,得到各化合物的线性范围及其对应的决定系数(r2),各化合物的r2均不小于0.995(见表4)。
表4线性方程、相关系数(r2)、线性范围、回收率和精密度
2回收率与精密度
在空白水产品基质鲩鱼、南美对虾、北极贝中分别添加低、中、高3个水平的混合标准溶液,每个添加水平重复测定6次,目标化合物的回收率在56.2%~124.6%之间,rsd在1.3%~29.8%之间,满足实际检测的要求,结果见表2。
3基质效应的评估
基质效应(matrixeffect,me)是由基质中的共提干扰物(非目标化合物)与目标化合物竞争电离所致,单独采用10ng/ml的添加水品对基质效应进行了计算,按照公式:me=(1-样品基质中添加相同含量化合物的响应值/纯溶剂中化合物的响应值)×100%,me结果为正值表示增强,负值表示抑制,绝对值越大me越强[22]。通过实验对鱼、虾、贝进行了评估,虾和贝的基质效应干扰整体水平大于鱼类,结果见表2。
在优化条件下,以鲩鱼基质为例,添加目标兽药混合标准溶液至理论添加量10ug/kg。按实施例1方法进行前处理,比较初始流动相和空白基质溶液配置的系列梯度标准溶液的定量结果。基质匹配法更能有效地消除基质效应的干扰。
实验结果说明,本发明建立的检测方法准确度好,灵敏度高。
五、实际样品检测
1、检测方法
采用本方面实施例1的方法(相关的质谱特性与标准曲线见实施例1),对市购的24份水产品进行检测。
2、检测结果
在冻罗非鱼片、冰鲜鳙鱼头、鳌山鱼肉、黄骚根鱼肉、鲮鱼肉、南美对虾、鳗鱼肉等7份样品中检出4-甲酰氨基安替比林,其中冻罗非鱼片:5.144μg/kg,冰鲜鳙鱼头:23.626μg/kg,南美对虾:1.412μg/kg。
4-甲酰氨基安替比林是安乃近代谢物,在农业部公告第235号的附录2中,仅规定了牛/猪/马的肌肉、脂肪、肝、肾中4-氨甲基-安替比林(安乃近另一个代谢物)的最高残留限量为200μg/kg。水产品中检出有可能来自环境的污染或养殖户使用的兽药为复配制剂。
结果见图2、图3和图4。
实验结果说明,本发明方法可以有效检测水产品中的兽药。
综上所述,本研究使用超高效液相色谱-四级杆/静电场轨道阱高分辨质谱,建立了同时检测水产品中14类64种兽药残留的方法。该方法检测成本低、周期短、稳定性好、准确度高,适用于日常对大批量水产品中兽药残留的快速筛查。
- 还没有人留言评论。精彩留言会获得点赞!