数字计数方法的改进与流程
本发明涉及用于检验样品中的材料(例如一种或多种分析物类型)的存在情况的方法,并且更特别的是用于改进的单酶联免疫吸附测定法(selisa)检验以及单酶联分子分析(selma)的其他变体。本发明因此进一步涉及单分子数字计数分析的改进,例如减少假阳性检测和/或背景噪声。
发明背景
科学家在过去几十年已经开发了许多检测单分子的方法,从而使得能够对各种类型的分子(包括单个寡核苷酸、单个蛋白质和单个肽)进行高灵敏度测量。单分子测量用于数字检测或数字诊断测试,其中单个(或几个)分析物分子被限制在分隔区中,其中所述的分隔区提供用于检测单个分析物的存在的合适环境。例如,在单酶联免疫吸附测定法(selisa)的情况下,将包含夹在捕获抗体和酶联检测抗体之间的分析物分子的单个免疫复合物置于单独的微分隔区中,并最后提供荧光或生色酶底物以在所述的分隔区内产生可检测的光学信号。另一实例是数字聚合酶链式反应(dpcr),其中单个寡核苷酸分析物与pcr引物和pcr混合物共同包封在分隔区中,因此导致荧光标记的扩增子的分析物-模板化指数扩增。
尽管具有最先进的数字检测的优点,但该领域的主要挑战是抑制不期望的背景噪声。当分析由分子的复杂混合物组成的样品时,通常会产生背景噪声。例如,在通过selisa分析源自血液的样品的情况下,背景噪声主要来自两种机制:
机制1:在样品处理过程中,主要是靶分析物形成免疫复合物,然而,捕获和检测抗体都不能完美地区分存在于样品中的靶分析物和类似的非靶分子(本文也称为非靶化合物)(蛋白质、多肽等等),并且因此一小部分非靶分子也将能够形成免疫复合物。因为非靶分子的浓度通常比靶分子的浓度高几个数量级,所以即使一小部分“假”免疫复合物也能够覆盖掉(overwhelm)靶分析物免疫复合物的数量。
机制2:前述抗体不能完美地区分靶标和非靶标,使得酶联检测抗体的非特异性结合/吸附至不存在靶分析物的区域或分隔区。可以通过改善测试中的表面化学来减少该问题,使得检测抗体的非特异性结合达到更少的程度。然而,完全消除非特异性结合不可能通过实验实现,因此导致仅来源于单酶联检测抗体的“假”信号。
已经在单分子检测文献中讨论了这两种机制,例如在d.m.rissin等人发表于naturebiotechnology(2010),vol.28,pp.595-599的题为“single-moleculeenzyme-linkedimmunosorbentassaydetectsserumproteinsatsubfemtomolarconcentrations”的研究文章(doi:10.1038/nbt.1641)中。在该研究文章中,rissin及同事描述了一种selisa方法,并在分析校准样品时报告了220zeptomolar(也称为220x10-21m,约15个分子)的检测限(lod)。然而,当用血清样品替换校准样品时,lod增加三个数量级至约200阿摩尔(也称为200x10-18m或200am,约12,000个分子)。如机制1和2中所述,能够从血清中的非靶化合物干扰靶分析物与检测/捕获抗体对之间的特异性相互作用的方式来理解灵敏度的这种显著降低。
机制1还可以应用于除蛋白质和肽之外的分析物分子的其他情况。这方面的突出实例是通过聚合酶链式反应(pcr)检测单碱基对取代和/或单核苷酸多态性(snp)。这里,应用对snp具有特异性的pcr引物以特异性扩增包含snp序列的寡核苷酸分析物。然而,snp检测是非常具有挑战性的,因为通常样品可能包含高浓度的野生型非靶寡核苷酸,其在很大程度上干扰snp特异性pcr引物。通过使用高度优化的引物,常规pcr检测可以在100个野生型分子的背景中可靠地检测到一个snp寡核苷酸分子(100:1比例)。如果野生型与靶标的比例进一步增加,则将产生假阳性结果。在dpcr的情况下,可以容忍更高的野生型与靶标的比例,因为单个(或几个)寡核苷酸被包封在单独的分隔区中。因此,对于单独的分隔区,对于分别包含单个snp分析物寡核苷酸、单个野生型寡核苷酸和各自一个的分隔区,野生型与靶标的比例,即0:1、1:0或1:1是非常有利的。虽然如此,为了实现每个分隔区单个(或几个)寡核苷酸的可靠包封,大多数分隔区必须是空的,参见例如d.pekin等人发表在labonachip(2011),vol.11,pp.2156-2166的题为“quantitativeandsensitivedetectionofraremutationsusingdroplet-basedmicrofluidics”的研究文章(doi:10.1039/c1lc20128j)。dpcr的一般规则是制备是样品中野生型+靶分子的预期数量的5-10倍的分隔区,因此基本上从分析中丢弃了大部分制备的分隔区。
科学家们正在研发用于分析生物和化学系统中的变化的技术,其中这些变化通常与2种或多种状态之间的转换有关。例如witters等人在digitalbiologyandchemistry(doi:10.1039/c4lc00248b,(frontier)labonachip,2014,14,pp.3225-3232)中讨论了各种数字生物和化学技术的开发。由于能够使用定性测量获得定量信息,数字技术在稳健性(robustness)、测定法设计和简便性方面提供优点时,则这些数字技术能够相当良好地工作。但是,数字技术是相对复杂的,部分是由于在分离和操作单一分子方面的技术困难。例如一些技术使用微米尺寸的磁珠来处理飞升(femtoliter)体积的样品。参见rissin等人的single-moleculeenzyme-linkedimmunosorbentassaydetectsserumproteinsatsubfemtomolarconcentrations(doi:10.1038/nbt.1641,naturebiotechnology2010,28,pp.595–599)。其他技术使用甚至更小体积的阿升(attoliter)。由于在典型的实验室温度和压力下造成处理困难的小体积的流体动力学呈现的行为,所以这些微小的体积能够造成挑战。
例如大部分的数字检测技术依赖于包含分析物以及多种检测和捕获探针的液体的微分隔。分析物以及检测/捕获探针被携带或存在于微米尺寸的液滴中,通常为皮升-至-阿升级体积。
因此,将样品分成较小的体积的方式是数字检测工艺的重要的部分。最容易利用的设备格式取决于形成微分隔区的阵列的固体或聚合基底,其中样品能够被转移至所述的微分隔区中。这些阵列主要形成2种:(i)微孔阵列以及(ii)毛细管阵列。在微孔阵列中,通过基底中的凹陷形成分隔区,而在毛细管阵列中,分隔区将所有的途径延伸通过基底,因此形成通孔。在这2种类型的阵列中固有的主要挑战是样品和辅助反应剂加载在这些阵列上的方式。在微孔阵列中,凹陷可能不容易被液体样品充满,这是因为由于孔的微小维度,使得空气不能离开孔,这种情况的实例参见kim等人发表于labonachip,(2012)vol.12,pp.4986-4991的标题为“large-scalefemtoliterdropletarrayfordigitalcountingofsinglebiomolecules”的研究文章(doi:10.1039/c2lc40632b)。毛细管阵列不存在这种问题,这是因为每个分隔区都具有2个开口,使得如果由顶部开口加入液体样品,则空气能够通过底部开口逃逸。但是,当微孔或毛细管分隔区内保持的液体与另外的液体进行交换时,出现由于分子的缓慢扩散所导致的另外的问题。由于微孔和毛细管均与加入的液相流垂直定位,所以不能发生良好的混合,因此液体交换仅能够通过从大体积液体分子扩散进入毛细管来发生,反之亦然。因而,为了确保合适的液体交换,必须采用时间延迟(时间延迟的长度取决于微孔/毛细管的维度,以及所加入的分子物质的类型)。
为了克服这些挑战,已经开发出第三种阵列,其被称为表面张力阵列。表面张力阵列是平坦的,并且由疏水性基底中或在疏水性基底上形成图案的亲水性特征组成。当表面张力阵列与水性样品接触时(例如通过浸没在水相中并收回阵列),由于特征与周围基底之间的表面张力差,可以在亲水性特征上形成单独的液滴。由于液滴停留在平坦的表面上,当在阵列上引入液体样品时,则可以立即发生液体加载以及液体交换(或者比扩散限定的运送快至少几个数量级)。与微孔阵列不同,没有空气能够陷在液体和亲水性特征之下,并且由于阵列不依赖于基底中的凹坑/凹陷/腔,所以液滴与大体积液体之间的液体混合不受分子扩散的限制。然而,所有3种类型的微分隔形式(微孔、毛细管和表面张力阵列)都面临将大量的液体微液滴保持足够长的时间以使数字计数可以得到实施的挑战。
在实验室的典型环境温度和压力下,这些液滴在几秒内蒸发,例如参见birdi,k.s.,vu,d.t.和winter发表于thejournalofphysicalchemistry,1989,vol.93,pp.3702-3703的标题为“astudyoftheevaporationratesofsmallwaterdropsplacedonasolidsurface”的研究文章(doi:10.1021/j100346a065)。
一旦蒸发,在微液滴内处理分子的能力将丧失,数字技术不能实施。
因此,必须防止快速蒸发,并将微液滴保持足以测量目的分子的存在情况的时间。
为此,科学家和工程人员已经开发了将容纳微液滴的分隔区密封的某些技术。这些密封防止微液滴与周围环境接触,并由此防止蒸发。
通常,存在2种密封分隔区的技术:物理密封和化学密封。当分隔区在基底中被构造成微凹陷或微腔时,使用的是物理密封。将密封盖附着在分隔区的顶部以物理密封分隔区。按照这种方式,单一分隔区的内容物不能蒸发,并且相邻的分隔区不能交换它们的内容物(否则会导致交叉污染)。采用物理密封的缺点在于一旦分隔区被拆封,因为盖不能在不破坏微分隔区的完整性的情况下容易地除去,分析就终止了。此外,为了施加物理密封,分隔区必须被构造成微孔/微腔/微凹陷,由于缓慢的分子扩散,这会导致在初始制备步骤中分隔区内的液体发生交换的技术难题。
一种类型的化学密封依赖于使用油(或非极性液体)相来覆盖分隔区。按照这种方式,由于来自样品的水仅缓慢地分配至油相中,所以减少了样品的蒸发。化学密封的优点在于其基于界面张力,因此,分隔区无需被构造成腔,但是反而能够形成停留在表面上的液滴。这种特征使得能够使反应剂快速交换,其不受到分子扩散的限制,而且相反可以通过引入新反应剂的流速来测定。此外,与物理密封不同,化学密封可以通过将油相由样品中吸出而更容易地除去。然而,化学密封的一个缺点在于来自样品的分析物或其他生物分子可以分配至非极性相中,并导致(i)样品损失;和/或(ii)液滴之间的污染。具体而言,诸如蛋白质之类的生物分子往往溶解于非极性液体中,这主要是由于蛋白质中的疏水性氨基酸在暴露于疏水性界面时本身可重排的事实。分子由水分配进入非极性相的这种性质可以通过分配系数来描述,即,油-水分配系数,水-辛醇分配系数等,例如lien,e.j.和ren,s.s.在chapter186inencyclopediaofpharmaceuticaltechnology,thirdedition,2006,isbn:9780849393990中所述。此外,已经显示,水甚至(尽管缓慢)分配进入周围的油相中,例如参见huebner,a.等人发表于labonachip,2009,vol.9,pp.692-698的著作(doi:10.1039/b813709a)。更进一步的是,当大体积水相被大体积油相替代时,或反之,存在产生乳滴的风险,即,微米尺寸的油包水内含物,或反之。乳滴可以构成实验的滋扰,这是因为它们能够弄脏表面和/或破坏装置的流动性能。
标题为“methodsfordeterminingtheconcentrationofananalyteinsolution”的wo2009029073a1描述了在限制的反应容器中进行单分子数字计数的方式。标题为“enrichmentanddetectionofnucleicacidswithultrahighsensitivity”的wo2015061362a1描述了制备液体液滴的非密封表面张力阵列的方式,其中所述的液滴展现出快速的蒸发速率。标题为“patterningdevice”的wo2013110146a2描述了制备液体液滴的表面张力阵列的方式以及在化学密封下将其用于生物测定法的方式。标题为“deviceandmethodforapportionmentandmanipulationofsamplevolumes”的wo2013063230a1描述了制备化学密封的表面张力阵列以及将该阵列用于生物测定法(包括数字计数测量)的方法。标题为“apparatusandmethodforformingartificiallipidmembrane”的jp2014021025a描述了制备使用脂膜化学密封的表面张力阵列的方法。标题为“highsensitivitydeterminationoftheconcentrationofanalytemoleculesorparticlesinafluidsample”的wo2010039180a2描述了通过将样品分开入物理密封的微孔分隔区来数字计数分析物。标题为“methodandapparatusfordiscretizationandmanipulationofsamplevolumes”的wo2010019388a2描述了微孔分隔区,其可以通过施加由一种或多种不可混溶的液体构成的化学密封而用于捕获和分开液体样品。标题为“microwellarraysfordirectquantificationofanalytesonaflatsample”的wo2012022482a1描述了物理密封的微孔分隔区分析平坦基底上所包含的样品的用途。标题为“ultrasensitivedetectionofmoleculesonsinglemoleculearrays”的us20100075407a1描述了在物理密封的微孔分隔区上实施的数字计数测量。标题为“methodsandsystemsforperformingdigitalmeasurements”的wo2012100198a2描述了通过制备和分析液体液滴的阵列而实施的数字计数测量。标题为“multilayerhighdensitymicrowells”的us20130052649a1描述了用于生物分析的微孔分隔区的化学密封阵列。标题为“apparatusandmethodsforparallelprocessingofmicro-volumeliquidreactions”的wo2001061054a2描述了化学密封的毛细管阵列用于实施生物测定法的用途。标题为“amethodofchargingatestcarrierandatestcarrier”的wo2014001459a1描述了毛细管阵列用于实施生物测定法的用途。标题为“ananalyticalassemblyforpolymerasechainreaction”的wo1998047003a1描述了寡核苷酸的数字计数。标题为“systemsandmethodsformanipulatingamoleculeinananopore”的wo2011097028a1描述了操纵膜纳米孔中的单个分子的方式。标题为“nucleotideanalogs”的us2008026379a1描述了单个寡核苷酸分子的顺序测序。标题为“assayfordetectinggeneticabnormalitiesingenomicnucleicacids”的us2009142755a1描述了通过在固体支持物上的捕获来检测核酸。标题为“detectionoftargetnucleicacidsequencesbycyclicexonucleolyticreactions”的us2012190030a1描述了在不使用聚合酶链式反应的情况下检测核酸。标题为“combinatorialsinglemoleculeanalysisofchromatin”的wo2017034970a1描述了在固体支持物上顺序标记和检测寡核苷酸/染色质复合物。标题为“methodandapparatusfortheanalysisandidentificationofmolecules”的ep3048445a2描述了使用纳米孔对单个寡核苷酸进行测序的方式。
因此,本领域仍需要用于密封分隔区的改进的系统和方法,其中所述的分隔区容纳包含待分析的材料的液滴。
到目前为止,重复标记已经应用于单分子数字计数以实现多重化,即,通过使用在标记反应1中对分析物1具有特异性的标记试剂,在标记剂反应2中对分析物2具有特异性的标记试剂等,可以检测更多数量的靶分析物类型,参见例如wo2009029073a1和wo2017034970a1。
本领域还需要在涉及数字计数的分析、例如单分子检测或定量中减少噪声。减少或预防在数字计数中导致计数误差的噪声可以极大地提高现有单分子检测测定法的灵敏度和特异性。特别地,在最先进的单分子检测测定法的灵敏度和特异性方面的改进,其中测定法基于与分析物结合的标记试剂,受到以下挑战:(i)标记试剂与分析物的不完全结合,(ii)不同分析物类型的交叉标记和(iii)标记试剂与捕获位点的非特异性结合。
概述
本发明人惊奇地发现,通过(i)使用多个离散捕获位点从样品中捕获分析物,和(ii)将被捕获的分析物进行一个或多个检测循环,其中每个检测循环使得能够检测来自结合的标记试剂的信号,然后任选地除去结合的标记试剂,可以大大减少计数误差,例如数字计数分析中的假阳性检测和/或背景噪声。因此,本发明人已经发现,仅通过在每个检测循环中用相同的标记试剂标记和重新标记相同的分析物并结合记录单独的捕获位点显示的信号,可以大大减少背景噪声,特别是假阳性检测。
因为与标记试剂与被捕获的分析物的特异性结合相互作用相比,标记试剂与空捕获位点或与被捕获的非靶分子的非特异性结合相互作用发生的概率较低,所以预期非靶分子的重复标记或标记试剂与空捕获位点的重复非特异性结合在每次重复检测循环时变得越来越不可能。另一方面,预期被捕获的分析物的特异性标记基本上不受影响,因此更可能在每个检测循环中重复产生信号。因此,标记试剂的非特异性相互作用变得受到抑制,从而导致较少的计数误差并因此导致改善的检测灵敏度和特异性。
在本文公开的第一方面中,是用于数字计数分析可能包含至少一种分析物的样品的方法,其中所述的样品已经与具有多个离散捕获位点的固相接触,每个位点能够捕获所述的至少一种分析物,所述的方法包括至少两个检测循环,其中每个检测循环包括以下步骤
a)触发来自被捕获的和标记的分析物的信号,
b)记录显示来自所述的被捕获的和标记的分析物的信号的捕获位点的数量和位置,
c)并且在执行进一步的检测循环之前,使信号失活。
在本文公开的第二方面中,是用于数字计数分析可能包含至少一种分析物的样品的方法,其中所述的样品已经与具有多个离散捕获位点的固相接触,每个位点能够捕获所述的至少一种分析物,所述的方法包括至少两个检测循环,其中每个检测循环包括通过添加标记试剂来标记所述的至少一种分析物并将至少一种被捕获的和标记的分析物进行分隔以产生包含至少一种分析物的液体分隔区的步骤,然后进行步骤a)-c):
a)触发来自所述的被捕获的和标记的分析物的信号,
b)记录显示来自所述的被捕获的和标记的分析物的信号的捕获位点的数量和位置,
c)并且在执行进一步的检测循环之前,使信号失活。
在本文公开的第三方面中,是用于数字计数分析可能包含至少一种分析物的样品的方法,其中所述的样品已经与具有多个离散捕获位点的固相接触,每个位点能够捕获所述的至少一种分析物,其中通过在固相上捕获所述的至少一种分析物之前或期间在标记步骤中添加标记试剂来标记所述的至少一种分析物,所述的方法包括至少两个检测循环,其中将所述的至少一种被捕获的和标记的分析物分隔以产生包含至少一种分析物的液体分隔区,然后进行步骤a)-c):
a)触发来自所述的被捕获的和标记的分析物的信号,
b)记录显示来自所述的被捕获的和标记的分析物的信号的捕获位点的数量和位置,
c)并且在执行进一步检测循环之前,使信号失活,
其中在执行进一步的检测循环之前进行步骤c)然后进行重新标记步骤,其中通过添加标记试剂来标记所述的至少一种被捕获的分析物。
在本文公开的另一方面,是具有多个离散捕获位点的固相的用途,每个位点能够在本文所述的方法中捕获所述的至少一种分析物。
在本文公开的另一方面,是具有多个离散捕获位点的固相的用途,每个位点能够在本文所述的方法中捕获所述的至少一种分析物,用于减少在数字计数分析中的计数误差。
在本文公开的另一方面,是具有多个离散捕获位点的固相的用途,每个位点能够捕获所述的至少一种分析物,用于通过执行如本文所述的至少两个检测循环来减少在数字计数分析中的计数误差。
在本文公开的另一个方面中,是数字计数至少一种或多种不同的分析物类型的方法,该方法包括计数在气相密封下多个纳升-至-阿升液滴中所包含的分析物类型。
在本文公开的另一个方面中,是在气相密封下多个纳升-至-阿升液滴用于数字计数至少一种或多种不同的分析物类型的用途。
附图说明
通过下文进一步的描述,并参照附图,将更全面地理解本发明的上述和其他目的与优点,其中:
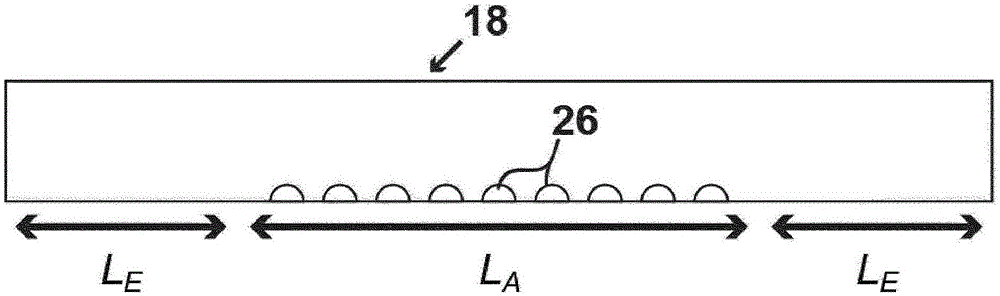
图1描绘了具有多个微液滴26的流动分隔区18的一个实例。草图未按比例绘制;
图2描绘了图1中流动分隔区18的末端的一个实例。草图未按比例绘制;
图3描绘了流动分隔区18的示例图,其具有形成气相密封的蒸气相。草图未按比例绘制;
图4描绘了将流体由流动分隔区收回以创建气相密封的过程的示例图。绘图为在操作流动系统时所获得的亮视野显微照片的摘录,参见实施例1-5。亮视野显微照片的比例尺为20μm;
图5描绘了亲水性特征14的示例图,所述的亲水性特征14包括(i)平坦的特征;(ii)在疏水性基底16中形成凹坑的特征;以及(iii)包含由疏水性基底上凸起的特征,其中所述的凹坑包含亲水区。草图未按比例绘制;
图6描绘了与固体支持体接触的液体液滴的实例。在该实例中,草图上示出以下的实例:(i)在气体气氛中,停留在疏水性基底上的液体液滴的接触角(γ);(ii)圆形的平坦亲水性特征的半径(rd);(iii)停留在圆形的平坦亲水性特征上的液体液滴的接触角(α);以及(iv)对于圆形的平坦亲水性特征,最大液滴体积的几何形状的界定。草图未按比例绘制;
图7描绘了制备平坦的亲水性特征(被疏水性基底包围)的图案的2个示例性基于光刻的过程。所示的步骤包括:
a—提供亲水性晶片基底;
b2—光敏薄膜涂层的沉积;或b1—晶片的同质表面改性;
c2—涂层的uv暴露和显影;
c1—光敏薄膜涂层的沉积,然后进行c1’—涂层的uv暴露和显影;
d2—晶片的疏水性表面改性;或d1—疏水性层的选择性蚀刻;
e—薄膜涂层的除去,从而取得-f—亲水性特征的平坦的图案。
图8示意性地提供了通用数字计数测量的实例,其中样品中的分析物的浓度是通过分析展示阳性信号的分隔区的数量而获得的;
图9提供了基于平坦的亲水性特征的selma过程的示例性草图。在步骤(a)中,来自样品的分析物在单一的步骤中结合,从而捕获位于亲水性特征上的探针。在步骤(b1)中,存在于大体积液体中的捕获探针(捕获探针部分2)与来自样品的分析物结合,由此在步骤(b2)中,导致分析物/捕获探针部分2复合物形成。步骤(b3)在b2之后,并且显示分析物/捕获探针部分2复合物与停留于固体支持体上的捕获探针(捕获探针部分1)结合。捕获探针部分1和2彼此识别,并由此在固体支持体上形成捕获探针部分1/捕获探针部分2/分析物复合物,因此将分析物固定化在亲水性特征上。在步骤(c)中,将标记试剂加入捕获探针/分析物复合物中,例如由此形成捕获探针/分析物/标记试剂复合物。在步骤(d)中,捕获探针/分析物复合物通过标记试剂的第一部分(标记试剂部分1)进行标记。在步骤(e)中,捕获探针/分析物/标记试剂部分1复合物随后被标记试剂的第二部分(标记试剂部分2)进行第二标记。在步骤(f)中,形成功能捕获探针/分析物/标记试剂复合物。在步骤(g)中,在亲水性特征的表面上形成液体液滴。液滴包含检测试剂,并且通过气相密封而免于蒸发。在步骤(h)中,通过处理标记试剂将检测试剂转化成分子报告子。草图未按比例绘制;
图10提供了示例性流动系统的草图。流动系统由包含5个功能元件的长方形板组成。每个元件都用数字标记,并且通过虚线正方形包围。元件1为液体出口,其与提供抽吸的压力源连接。元件2为流动分隔区。元件3为液体入口,其将流动分隔区与液体加载垫连接。元件4为液体加载垫,其成型为用于液体反应剂的容器。元件5为液滴区,其呈现被疏水性基底围绕的亲水性特征的图案。液滴区存在于流动分隔区的底部。草图未按比例绘制;
图11示出蒸发与流动通道/液滴/阵列的几何形状之间的理论关系的实例。(a)用于阵列的方程17的图,其中液滴半径为2.5μm,并且比例因子为n=4和
图12证明对于多种流动通道几何形状和温度而言,在气相密封下的抗蒸发微液滴和液滴稳定性的实例。亮视野显微照片显示在流动通道中形成的液滴,其中所述的流动通道展示高度(a)2000μm、(b)800μm和(c)150μm。对于a-c,阵列参数是相同的,即,液滴半径rd=2.5μm,凹陷与阵列高度的比值
图13提供了定义(a)示例性流动通道28和(b)嵌入在流动通道中的示例性微液滴阵列30的参数的示例性草图。草图未按比例绘制;
图14提供了对于包含1pmdna靶的校准样品而言,对应的一对亮视野(i)和荧光(ii)显微照片。荧光信号如实施例4中所述鉴定,并使用白色圆形进行标记。将荧光信号的位置施加于亮视野显微照片中,并以黑色的圆形显示。显然,荧光信号的位置对应于液体液滴的位置。比例尺为10μm;
图15提供了由包含以下浓度的dna靶((a)100am、(b)1fm(1飞摩尔/l或1x10-15m)和(c)10fm)的样品得到的3个代表性荧光显微照片。计数各样品的荧光液滴的数量,并对阵列上存在的液滴的总数归一化,从而提供荧光液滴的百分比分数(percentwisefraction),即,阳性分数。对于包含100amdna靶、1fmdna靶、10fmdna靶的样品以及不包含dna靶的对照样品(d)绘制阳性分数。柱状图上的值表示各样品的由5个检测实验收集的平均值。误差棒表示对于5个相同实施的试验,阳性分数的标准偏差;
图16提供了包含100am靶dna的样品的一系列荧光显微照片,如实施例5中所概括。在该系列中的第一显微照片(i)是在第一检测步骤之后获得的,该系列中的第二显微照片(ii)是在第二检测步骤之后在相同的位置获得的,该系列中的第三显微照片(iii)是在第三检测步骤之后在相同的位置获得的。
图17提供了用于数字计数样品中一种或多种分析物的示例性流动系统(10)的截面草图,其中所述的流动系统(10)包含显示亲水性特征(14)的图案的支持体(12)。该图案嵌入疏水性基底(16)中、放置疏水性基底(16)上或者被疏水性基底(16)包围,并且嵌入在流动分隔区(18)中,其展示开口(20)。每个亲水性特征都具有附着在表面上的捕获探针(22)。支持体分成2个区域(24),每个区域都呈现特定类型的捕获探针。草图未按比例绘制。
图18显示了在单分子计数分析中显示信号的捕获位点数量与所应用的检测循环数的函数之间的理论关系的实例。根据方程25-28绘制图,并应用以下参数(a)nta=10,nnm=10.000,nc=100.000,pta=0.9,pnm=0.05和fnsr=0,(b)nta=10,nnm=100.000,nc=100.000,pta=0.9,pnm=0.05和fnsr=0.05,(c)nta=10,nnm=1.000.000,nc=100.000,pta=0.9,pnm=0.05和fnsr=0和(d)nta=10,nnm=1.000.000,nc=1.000.000,pta=0.9,pnm=0.05和fnsr=0.05。在图a-d中,ct(x)、lta(x)、lnm(x)和lnsr(x)表示信号阳性捕获位点的总数、信号阳性捕获位点的数量,其中信号分别源自(i)靶分析物、(ii)非靶分子和(iii)非特异性保留的标记试剂,并且其中x表示检测循环的数量。
发明详述
定义
在本发明的内容中,术语“数字计数”、“数字计数分析”、“单分子数字计数”或“单分子数字计数分析”是指其中将样品的特定成分以有限浓度分配至分隔区中,使得分隔区的数量大于特定样品成分的数量的任何分析。按照这种方式,可以根据各分隔区是空的(值0)还是加载的(值1)将二进制/数字值分配给每个分隔区。在该内容中,加载的是指包含至少一种特定样品成分的分隔区,而空的是指不包含特定样品成分的分隔区。当基于由特定样品成分本身来源的特定信号或者由辅助检测反应剂(其与存在特定样品成分偶联)来源的特定的信号,评价加载的和空的分隔区的数量时,发生数字计数。
在本发明的内容中,术语“数字计数测量”是指上文定义的数字计数过程,但是进一步包括数字计数结果的任何数学处理或校准,从而赋予所有分隔区中存在的特定样品成分的绝对数值。这可包括(i)说明以下事实:加载的分隔区可包含相同样品成分的1、2、3等等个拷贝;或者(ii)说明以下事实:加载的分隔区可错误分类成空的,反之亦然,这是由于信号生成过程中的缺陷。数字计数测量的实例包括数字聚合酶链式反应(dpcr)、单酶联免疫吸收测定法(selisa)或者数字单酶联免疫吸附测定法(delisa)。数字计数测量过程的草图概括于图8中。
在本发明的内容中,术语“selma”作为单酶联分子分析的缩写,并且是指特定的一种数字计数测量。在selma中,数字计数测量发生在流动系统中,其中液滴的分隔区以图案形式组织,并且特定样品成分在分隔区内成为固定化的/被捕获的。按照这种方式,可以使样品成分经过多个反应步骤而不损失,其中每个反应步骤均由溶液或反应剂的浸渍以及由流动系统中收回组成。示例性selma过程的草图在图9中提供。
在本发明的内容中,“亲水性特征”是指具有第一组材料性质的结构,该结构被具有另一组材料性质的固体基底围绕或支持。应当调节结构和固体基底的材料性质,使得所述的结构比固体基底是更加可润湿的。换言之,与固体基底相比,构成所述的结构的材料展现出与水形成更小的接触角。所述的结构可以通过化学和/或物理手段界定。非限定性的一组可能的结构包括(i)封闭的平坦的区域,其由比围绕的基底更具有亲水性的材料构成;以及(ii)在围绕的基底上形成的凹坑、凸起或它们的组合,其中一个或多个侧面由比围绕的基底更具亲水性的材料组成。示例性亲水性特征的草图在图5中提供。在selma的内容中,可以例如通过提供用于分析物捕获的不同的化学功能性,以及通过提供用于信号生成和检测的液滴的图案,操作亲水性特征,从而呈现用于数字计数测量的合适的反应分隔区。
在本发明的内容中,术语“平坦的亲水性特征”是指其中疏水性基底是平坦的并且嵌入在疏水性基底中的亲水性特征是平坦的设计。平坦性的理想情况概括于图5中,但是对于实际应用而言,平坦性必须根据表面粗糙度进行界定。例如因为疏水性基底和亲水性特征可以由不同的材料形成,所以在疏水性区域和亲水性区域之间的高度可以具有微小的差异。在一个实施方案中,合适的认为亲水性特征是平坦的标准可以为,疏水性区域和亲水性区域之间的高度差(δh)(备选地,表面粗糙度)与特征特征的尺寸相比应该是可忽略的。在半径为rd的圆形亲水性特征的情况下,标准可以为rd>>δh。在一个实施方案中,展现δh值小于20nm的特征被认为是平坦的。
在本发明的内容中,术语“接触角”是指在液体/蒸气/固体界面处测量的特征角。在其中液体液滴以气相形式沉积在固体表面上的内容中,通过线上(ontheline)某点的液体测量接触角,其中液体/蒸气界面与固体界面相遇。在固体表面与液体界面的切线之间测量所述的角,如w.c.bigelow,d.l.pickett和w.a.j.zisman在“oleophobicmonolayersi:filmsadsorbedfromsolutioninnon-polarliquids”publishedinjournalofcolloidscience,vol.1,pp.513-538(1946)的著作(doi:10.1016/0095-8522(46)90059-1)中所定义。示例性接触角的草图在图6中提供。
在本发明的内容中,术语“rh”是指“液体的气体成分的相对蒸气饱和度”,其是术语“相对湿度(relativehumidity)”的泛化。相对湿度定义为水的分蒸气压(pw)与大气中水的饱和压力(psat)之间的比值,即,rh=pw/psat。饱和压力在本此定义为与液态水形成热平衡的水蒸气所赋予的分压。rh值可以泛化,从而包括除了水以外的其他液体。在这种情况下,rh仍等于pw/psat,但是此时pw被理解为给定液体的气体成分所赋予的分压,而psat被理解为与给定液体形成热平衡的气体成分所赋予的分压。分压是指这样的情况,其中气相由几种气体物质构成。rh可以因此被视为相应气相的蒸气饱和度水平的指示。对于rh=0,气相不包含液体的任何气体成分,而对于rh=1,气相抽吸了液体的气体成分的最大可能的内容物。
在本发明的内容中,术语“rhi”是指“液体的气体成分的初始相对蒸气饱和度”。当使用术语“液体的气体成分的初始相对蒸气饱和度”时,则其是指这样的情况,其中将发生改变,并因此其中仍尚未建立热平衡。例如如果将液体1(具有psat的特征饱和压力)放置于包含气相的封闭的环境中,其中液体1的气体成分的分压为p1,那么如果p1<psat,液体将蒸发。因为液体的气体成分的初始相对蒸气饱和度是在发生任何改变之前计算的,所以液体的气体成分的初始相对蒸气饱和度为rhi=p1/psat。然而,一旦液体1开始蒸发,rh值将逐渐由rhi值增加,直至(i)rh=1,由此使气相饱和;或者(ii)所有的液体均蒸发。
在本发明的内容中,术语“最大液滴体积”是指如果在最佳的条件下制备时可以支持单一亲和性特征的最大液体体积。在液体从液滴蒸发的内容中,则参照最大液滴体积来计算蒸发的液体的体积分数。在图6中提供用于平坦的圆形亲水性特征的示例性最大液滴体积的草图。
在本发明的内容中,术语“总(aggregate)最大液滴体积”是指通过将包含多个液滴的图案的最大液滴体积加在一起而获得的体积总和。在液体由所述的图案蒸发的内容中,就总最大液滴体积来计算蒸发的液体的体积分数。
在本发明的内容中,术语“样品”是指生物或化学材料的集合,其可以经过实验室处理或可以未经过实验室处理。样品可以呈现液体或固体形式,并且可以包含特定的成分,其起到用于数字计数的输入的作用。
在本文中,“可能包含至少一种分析物的样品”是指生物样品,其被怀疑包含一种或多种特定分析物类型或者被怀疑在所述的样品中包含一种或多种特定浓度的一种或多种特定分析物类型。
在本发明的内容中,术语“分析物”是指特定样品成分,其可以用于数字计数测量中。分析物是生物或分子本性的,并且将(i)与其余的样品材料分离,和/或(ii)在数字计数处理过程中分开操作。
在本文中,术语“分析物类型”是指特定类别或种类的分析物。例如,两种不同的分析物类型可以分别是寡核苷酸和蛋白质。两种不同分析物类型的另一实例可以是蛋白质和细胞,但分析物类型也可以指例如两种不同的蛋白质、两种不同的寡核苷酸或两种不同的细胞。
在本发明的内容中,术语“捕获探针”是指能够识别并结合分析物的特定区域的分子本性的化学或生物化学试剂,例如将分析物保留和/或限制在反应分隔区中。
在本发明的内容中,术语“标记试剂”是指能够识别和结合分析物的特定区域的分子本性的化学或生物化学试剂。标记试剂的结合区域不同于捕获探针的结合区域,从而在数字计数测量过程中,可以建立捕获探针/分析物/标记试剂复合物。此外,除了一种或多种分析物结合模式以外,标记试剂包括一种或多种检测模块。术语标记试剂可以进一步指一种或多种试剂,当其组合在一起时,其可以提供分析物结合模式和检测模块。
在本发明的内容中,术语“检测模块”是指能够介导可通过检测器检测的信号生成的生物化学、化学、生物或物理部分。信号在本性上可以是光学、电学或磁性的。此外,检测模块可以依赖于检测试剂,从而取得信号生成。
在本发明的内容中,术语“检测试剂”是指化合物,通常为分子本性的,当其与相容的检测模块接触时,可以改变化学或物理状态。检测试剂的状态的改变可以通过合适的检测器记录并转换成信号。此外,发生状态改变的检测试剂可以称为报告分子或分子报告子。
在本发明的内容中,术语“可检测浓度”或“最低可检测浓度”是指局限于反应分隔区内的分子报告子的最低浓度,其可以通过合适的检测器检测。为了使浓度是可检测的,由分子报告子得到的信号应该超过检测器的噪声水平。通常,更高浓度的分子报告子往往产生检测器记录的、相应的更高的信号。
在本发明的内容中,术语“离散捕获位点”是指固相上的特定区域,其能够捕获或附着于分析物。捕获位点区域可以用对分析物类型具有特异性的捕获探针进行官能化。固相可以是显示多个离散捕获位点的连续表面或基底,使得单独捕获位点的区域不相交。此外,固相也可以由一种或多种胶体珠子组成,其中珠子的表面已经用捕获探针进行官能化。在这种情况下,单个珠子将构成单个捕获位点,并且例如悬浮在液体中的珠子集合将构成多个离散捕获位点。
在本发明的内容中,术语“液体分隔区”是指液体体积(通常在纳升-至-阿升范围内),其中单独的液体分隔区与存在的其他液体分隔区是流体隔离的。
在本发明的内容中,术语“流体隔离”是指以这样的方式制备的液体分隔区,使得来自一个单独分隔区的液体内容物不能够容易地泄漏到存在的任何其他分隔区中。可以通过例如将大体积液体分配到(i)孔/腔/毛细管中,(ii)包含亲水性特征的疏水基底上较小的液体体积中,使得每个液体体积通过表面张力得到保持在位置中或(iii)乳液液滴中,使得液体分隔区得到流体隔离。
在本发明的内容中,术语“分隔”是指将大体积液体及其内容物分配成较小体积的过程,使得每个体积形成液体分隔区。
在本发明的内容中,术语“触发信号”是指诱导限制在液体分隔区中的标记试剂以产生可检测信号的过程。可以通过使所述的标记试剂的检测模块与合适的检测试剂接触来诱导可检测的信号。然后,检测模块可以将检测试剂转化为分子报告子,由于液体分隔区的流体隔离,该分子报告子在分隔区内积聚,直到在分隔区内建立所述的分子报告子的最小可检测浓度。
在本发明的内容中,术语“使信号失活”是指使标记试剂永久地丧失在其被限制的液体分隔区内触发信号的能力的过程。使标记试剂丧失在液体分隔区内触发信号的一种方式可以是从分隔区除去标记试剂。使标记试剂丧在液体分隔区内触发信号的另一种方式可以是例如通过化学、生物化学或物理手段,使标记试剂的检测模块丧失能力,使得它将不能将检测试剂转化为分子报告子。
在本发明的内容中,术语“非特异性结合”是指例如标记试剂直接附着于空捕获位点并因此不直接附着于被捕获的分析物。如果标记试剂代替被捕获的分析物而附着于被捕获的非靶分子,则也可以认为它是非特异性结合的。非特异性结合的标记试剂可产生错误或假阳性信号,因为容纳非特异性结合的标记试剂的液体分隔区没有捕获分析物,但仍能够产生可检测的信号。
在本发明的内容中,术语“计数误差”或“数字计数误差”是指例如源自非特异性结合的标记试剂的假阳性信号。容纳非特异性结合的标记试剂但不容纳被捕获的分析物的液体分隔区在数字计数分析中被认为是噪声,因为它们不代表来自分析物的真实信号。例如,(i)如果它已被物理吸附或化学吸附到捕获位点而不形成分析物/标记试剂-复合物或(ii)如果在标记试剂和捕获位点上存在的另一种非靶化合物/分子之间形成复合物,标记试剂可被认为是非特异性结合的。
在本发明的内容中,术语“假阳性检测循环”例如是指检测循环,其中进行标记或重新标记步骤而不使多个捕获位点与标记试剂接触。这允许假阳性信号(以非特异性结合的标记试剂的形式)被检测到。例如,如果在前面的检测循环中已经进行了信号失活步骤,使得已经特异性地除去了与被捕获的分析物结合的标记试剂,则非特异性结合的标记试剂将保留在捕获位点上。因为在标记或重新标记步骤中没有向多个捕获位点提供新的标记试剂,所以信号触发步骤可以仅产生来自容纳非特异性结合的标记试剂的液体分隔区的可检测信号,并且因此使得能够检测产生假阳性信号的液体分隔区。假阳性检测循环的另一实例可以允许通过应用检测循环来鉴定和定量样品中非靶化合物/分子的数量,其中使用特异于非靶化合物/分子的标记试剂进行标记或重新标记步骤。
在本发明的内容中,术语“间歇信号模式”是指液体分隔区,其已经经历了两个或更多个检测循环,并且其中液体分隔区在所有检测循环中都不产生信号。例如,如果执行了四个检测循环,并且液体分隔区仅在第二和第四检测循环中产生信号,则认为产生间歇信号模式。另一方面,如果另一个液体分隔区经历了四个检测循环,并且它在所有循环中产生信号,则不认为产生间歇信号模式,而是认为重复产生信号。
在本发明的内容中,术语“流动分隔区”是指分隔区,其可以是通道形状并且用于引导液体的流动,使得液体将与多个离散捕获位点接触。流动分隔区可具有入口(其中液体可进入流动分隔区)和出口(其中液体可离开流动分隔区)。在入口和出口之间,可以放置多个离散捕获位点。
在本发明的内容中,术语“流动系统”是指一个或多个流动分隔区的组件,其还可包括一个或多个储存器(reservoir)以容纳液体,一个或多个阀门或开关机构以将液体从储存器分配到流动分隔区中或者允许或防止液体进入流动分隔区。此外,流动系统还可包含或连接到液体驱动单元,以使得液体能够流入流动分隔区。
在本发明的内容中,术语“气相密封”是指建立气相密封的过程的结果,其中气相密封的目的是防止或减少液体分隔区的蒸发。在实施方案中,通过在流动系统中放置多个纳升-至-阿升液体分隔区来启动该过程,其中流动系统的尺寸和多个液体分隔区的空间构造已经配置成使得在流动系统的流动室内的气相已经被液体的气体组分饱和之前,单个液体分隔区的液体体积的仅有少部分可以蒸发。按照这种方式,蒸发的液体建立气相密封,这可以确保纳升-至-阿升液体分隔区在流动分隔区中保持稳定长时间而不会蒸发。
在本发明的内容中,术语“固定化”是指将移动组分从样品(例如分析物)固定到固相到如此程度以致使得一旦固定就防止其扩散回样品中的过程。
本文公开的发明提供了用于减少计数误差例如在单分子测量中的假阳性检测和/或减少/除去噪声的方法,因此允许改善的定量、改善的灵敏度和改善的特异性。
在本文公开的第一实施方案中,是用于数字计数分析可能包含至少一种分析物的样品的方法,其中所述的样品已经与具有多个离散捕获位点的固相接触,每个位点能够捕获所述的至少一种分析物,所述的方法包括至少两个检测循环,其中每个检测循环包括以下步骤:
a)触发来自被捕获的和标记的分析物的信号,
b)记录显示来自所述的被捕获的和标记的分析物的信号的捕获位点的数量和位置,
c)并且在执行进一步的检测循环之前,使信号失活。
在本文公开的实施方案中,所述的捕获位点在信号触发过程中被液体分隔区包围。
在第一实施方案中,数字计数分析可以特别适用于以一种格式实施,其中捕获位点被提供为基板中的腔、凹坑或通孔,并且其中检测循环中的单独步骤可以是通过将反应剂溶液抽吸和分配到多个捕获位点中或通过从反应剂溶液中完全浸没和收回基底来进行。
离散捕获位点可以通过固体基底的化学图案化,例如固态芯片的表面,或通过基底的拓扑图案化,例如微量滴定板中的孔来提供。然后,化学或拓扑图案的特征可以通过用捕获探针衍生表面来显示结合来自样品的分析物的能力。离散捕获位点也可以提供为胶体珠子的集合或悬浮。在那种情况下,每个珠子构成单个捕获位点,条件是珠子的表面已经用捕获探针衍生化。
在另一个实施方案中,数字计数分析还可以特别适用于在如本文所述的流动分隔区中实施,其中亲水性特征被配置为支持多个液体纳升-至-阿升液滴,并且流动分隔区还被配置为支持气相密封,减少每个纳升-至-阿升液滴的蒸发。
在本文公开的第二实施方案中,是用于数字计数分析可能包含至少一种分析物的样品的方法,其中所述的样品已经与具有多个离散捕获位点的固相接触,每个位点能够捕获所述的至少一种分析物,所述的方法包括至少两个检测循环,其中每个检测循环包括通过添加标记试剂来标记所述的至少一种分析物并将所述的至少一种被捕获的和标记的分析物分隔以产生包含至少一种分析物的液体分隔区的步骤分析物的步骤,然后进行步骤a)-c):
a)触发来自所述的被捕获的和标记的分析物的信号,
b)记录显示来自所述的被捕获的和标记的分析物的信号的捕获位点的数量和位置,
c)并且在执行进一步的检测循环之前,使信号失活。
在该第二实施方案中,数字计数分析可以特别适用于以一种格式实施,其中检测循环中的所有步骤和导致捕获的所有步骤可以发生在包含多个捕获位点的固体基底上或附近。基底可以例如是疏水的,具有亲水捕获位点的图案,使得在反应剂溶液浸没和从基底收回时可以在捕获位点上形成液体分隔区。
在本文公开的第三实施方案中,是用于数字计数分析可能包含至少一种分析物的样品的方法,其中所述的样品已经与具有多个离散捕获位点的固相接触,每个位点能够捕获所述的至少一种分析物,其中通过在所述的固相上捕获所述的至少一种分析物之前或期间在标记步骤中添加标记试剂来标记所述的至少一种分析物,所述的方法包括至少两个检测循环,其中将所述的至少一种被捕获的和标记的分析物分隔以产生含有至少一种分析物的液体分隔区,然后进行步骤a)-c):
a)触发来自所述的被捕获的和标记的分析物的信号,
b)记录显示来自所述的被捕获的和标记的分析物的信号的捕获位点的数量和位置,
c)并且在执行进一步的检测循环之前,使信号失活,
其中,在执行进一步的检测循环之前进行的步骤c)然后进行重新标记步骤,其中通过添加标记试剂来标记所述的至少一种被捕获的分析物。
在该第三实施方案中,数字计数分析可以特别适用于以一种格式实施,其中初始捕获和标记在大体积(bulk)溶液中进行,并且其中检测循环和重新标记涉及对分析物和/或标记试剂的分隔。例如,可以通过使用胶体珠子的集合作为多个捕获位点来实施初始捕获和标记,并且将胶体珠子的集合悬浮在包含样品和标记试剂的溶液中,使得珠子可以带有被捕获的和标记的分析物。接下来,珠子的集合可以被分隔,例如通过包封在乳液液滴中,或通过分散到固体基底上的腔、凹坑或通孔中。另一实例可以是将包含分析物的样品与标记试剂混合并引入到具有多个离散捕获位点的固体基底上,使得被捕获的和标记的分析物可以在单个步骤中形成。
在实施方案中,该方法包括一个步骤(捕获步骤)以使得能够通过捕获元件来捕获靶分析物,使得靶分析物在分析的前几个步骤之一中变得固定化。捕获元件不一定仅对靶标具有特异性,而且还可以显示与非靶化合物的一定程度的交叉反应性。
固定化可以在大体积溶液中发生,但也可以在液体分隔区中发生,其中仅一种或几种靶分析物被限制在液体分隔区内。在实施方案中,离散捕获位点的数量大于样品中分析物的数量,使得每个液体分隔区是空的(即没有被捕获的分析物)或加载的(即一种或多种被捕获的分析物)。对于具有未知量的分析物的样品,能够通过在逐渐稀释的样品上进行本文公开的方法来确保这种分布。每个液体分隔区的被捕获的分析物的占有率是随机的,并且可以通过泊松分布来近似。
捕获元件可以例如由抗体、抗体片段或适体构成,其能够结合许多种化合物,包括蛋白质和多肽。捕获元件也可以是单链或双链寡核苷酸或其合成变体,其可以通过序列互补性和/或链侵入来捕获其他寡核苷酸。此外,捕获元件也可以是对整类分子例如蛋白质、氨基酸、寡核苷酸等具有反应性的化学物质,使得分析物共价附着到捕获位点。
此外,在实施方案中,该方法包括另一步骤(标记步骤)以通过一种或多种标记试剂实现对靶分析物的标记,使得在被捕获的靶分析物和一种或多种标记试剂之间形成复合物。标记试剂可以与靶分析物特异性相互作用,但也可以与非靶化合物较小程度地相互作用。标记反应可以在大体积溶液中发生,但也可以在液体分隔区中发生,其中仅一种或几种靶分析物固定化在液体分隔区内。
标记试剂可以例如由抗体、抗体片段或适体构成,但也可以是单链或双链寡核苷酸或其合成变体。标记试剂可包含用于结合分析物的区域和用于提供或促进信号的另一区域。一种类型的标记试剂可以由与酶或任何其他(生物)化学催化剂连接的结合区域构成,其中酶或催化剂可以促进信号产生。
大体积进行的标记反应可以通过例如将包含多个捕获位点的固体基底浸入包含标记试剂的溶液中或通过将每个珠子构成单个捕获位点的胶体珠子的集合悬浮于标记试剂溶液中而发生。在液体分隔区内进行的标记反应可以通过形成多个液体分隔区来发生,其中单个液体分隔区占据单个捕获元件,并且其中液体分隔区的液体是标记试剂的溶液。这可以通过以下实现:(i)将标记试剂的溶液分配到微量滴定板的孔中,其中孔构成捕获位点,(ii)制备包封胶体珠子的油包水乳液液滴,其中单个珠子是单个捕获位点,并且其中珠子与标记试剂共同包封或者(iii)通过将包含多个离散亲水捕获位点的固体疏水基底浸入标记试剂的水性溶液中,然后从溶液中收回基底,使得液体液滴在亲水性捕获位点上/中形成。
更进一步地,实施方案中的方法包括另一个步骤(检测步骤)以产生容纳单个或几个被固定化的和标记的靶分析物的液体分隔区,并触发一个或多个标记试剂而产生可检测的信号。然而,由于捕获元件和标记试剂都可以显示对非靶化合物的亲和力,因此也可以触发(i)容纳被捕获的和标记的非靶化合物的复合物的分隔区和(ii)非特异性结合的标记试剂而产生可检测的信号。
更进一步地,实施方案中的方法包括又一个步骤(记录步骤),以记录显示可检测信号的液体分隔区的数量和空间位置。
更进一步地,实施方案中的方法包括又一个步骤(失活步骤),以从被捕获的和标记的靶分析物以及从被捕获的和标记的非靶化合物除去一种或多种标记试剂。另外,该方法包括使产生先前产生信号的所有标记试剂的产生信号的能力失活。
更进一步地,实施方案中的方法包括一次或多次重复一个或多个步骤。第二步骤可以应用与前一步骤中相同的标记试剂,但也可以应用显示不同特异性的另一类型的标记试剂。
在实施方案中,该方法的结果是比较记录步骤的每次重复之间的信号阳性液体分隔区的空间位置。按照这种方式,可以将靶分析物与非靶化合物和非特异性结合的标记试剂区分开,因为已经选择标记试剂以优选地标记靶分析物。因此,容纳靶分析物的液体分隔区将更容易一致地和重复地产生信号,而容纳非靶化合物和非特异性结合的标记试剂的液体分隔区将不太可能重复信号。
在实施方案中,在捕获至少一种分析物之前或期间,将样品和具有多个离散捕获位点的固相进行分隔。
在捕获位点上捕获分析物之前或期间的分隔可以例如通过以下实现:(i)将包含分析物的溶液分配到微量滴定板的孔中,其中单个孔是捕获位点,(ii)制备油包水乳液液滴,其中每个液滴包封含有分析物的溶液和胶体珠子,其中珠子是捕获位点或(iii)将含有多个离散亲水捕获位点的固体疏水基底浸入包含分析物的水性溶液,然后从溶液中收回基底,使得包含分析物的液体液滴在亲水性捕获位点上/中形成。
在实施方案中,在标记至少一种分析物之前或期间,将被捕获的分析物和标记试剂进行分隔。
在标记被捕获的分析物之前或期间的分隔可以例如通过以下实现:(i)将包含所述的标记试剂的溶液分配到微量滴定板的孔中,其中单个孔是捕获位点,并且其中一些孔包含被捕获的分析物,(ii)制备油包水乳液液滴,其中每个液滴包封胶体珠子,其中珠子是捕获位点,并且其中一些乳液液滴包含具有捕获分析物的胶体珠子,并且其中将珠子与标记试剂共同包封或(iii)将含有多个离散亲水性捕获位点的固体疏水性基底浸入标记试剂的水性溶液中,然后从溶液中收回基底,使得包含标记试剂的液滴形成在亲水性捕获位点上/中,并且其中一些捕获位点包含被捕获的分析物。
在实施方案中,将所述的被捕获的和标记的分析物分隔以产生包含至少一种分析物的液体分隔区。
所述的被捕获的和标记的分析物可以经分隔以产生液体分隔区,例如通过(i)在疏水基底上浸没和收回多个亲水捕获位点,其中在液体中一些捕获位点包含被捕获的和标记的分析物,使得液体分隔区可以形成在亲水捕获位点的表面上,(ii)产生包封被捕获的和标记的分析物的油包水乳液液滴,或(iii)将被捕获的和标记的分析物分配到基底上的孔中。
在实施方案中,通过在步骤a)之前的每个检测循环中的标记步骤中添加标记试剂来标记所述的分析物。
在实施方案中,通过在所述的固相上捕获所述的分析物之前或期间在标记步骤中添加标记试剂来标记所述的被捕获的分析物,并且在执行进一步的检测循环之前进行步骤c)然后进行重新标记步骤,其中通过添加所述的标记试剂来标记所述的被捕获的分析物。
在一些实施方案中,标记所述的分析物可以在捕获所述的分析物之前或同时实施。例如,可以将胶体珠子形式的捕获位点与包含标记试剂和分析物的溶液混合,使得(i)分析物被捕获然后被标记或(ii)分析物被标记然后被捕获。另一实例可以是将包含标记试剂和分析物的溶液注入到容纳多个离散捕获位点的固体基底中,使得标记和捕获可以同时进行。
在本文公开的实施方案中,至多99%、例如至多95%、例如至多90%、例如至多85%、例如至多80%、例如至多75%、例如至多70%、例如至多65%的液体分隔区包含被捕获的和标记的分析物。
对于定量数字计数分析,优选的是并非所有捕获位点都包含被捕获的和标记的分析物,因为这可能导致所有捕获位点的饱和,从而阻止对所有分析物的精确计数。为了实现精确计数,一小部分捕获位点应为空,即不包含被捕获的和标记的分析物。为了获得分析物占据的和空的捕获位点的最佳分布,能够以几种稀释度提供相关样品,由此能够对提供可接受的或最佳的分布的稀释样品进行计数。通过计数空捕获位点的数量并将其与被占据的捕获位点的数量进行比较,能够通过使用统计分析例如泊松统计来估计捕获位点上的分析物的总数。
在本文公开的实施方案中,所述的样品包含或可能包含靶分析物和非靶化合物,其中所述的靶分析物被所述的捕获位点捕获的捕获效率为c1,其中所述的非靶化合物被所述的捕获位点捕获的捕获效率为c2并且c1≥c2,其中所述的靶分析物由第一标记试剂标记的标记效率为l1,其中所述的非靶化合物由第一标记试剂标记的标记效率为l2并且l1≥l2,其中调节检测循环的次数nc使得比率
在本文公开的实施方案中,该方法包括假阳性检测循环,其中在所述的标记步骤中应用第二标记试剂代替所述的第一标记试剂,其中所述的非靶标化合物由所述的第二标记试剂标记的标记效率l1,其中所述的靶分析物由所述的第二标记试剂标记的标记效率为l2并且l1≥l2。在本文公开的实施方案中,在所述的样品中存在的非靶化合物的数量是从在假阳性检测循环中显示信号的捕获位点的数量来估计的。在本文公开的另一个实施方案中,在所述的样品中存在的靶分析物的数量是从在假阳性检测循环之前在所有检测循环中重复显示信号的捕获位点的数量和从在所述的样品中存在的非靶化合物的估计数量来估计的。
在本文公开的实施方案中,该方法包括假阳性检测循环,其中该方法不包括任何标记步骤。
假阳性检测循环可以允许从分析中鉴定和丢弃源自非特异性结合的标记试剂的假阳性信号。例如,在实施方案中,可以通过在假阳性检测循环之前从所述的被捕获的分析物中的特异性除去来使特异性结合的标记试剂失活。在假阳性检测循环期间,不会将新的标记试剂引入所述的被捕获的分析物中,因此仅可以触发在所述的失活步骤之后留下的非特异性结合的标记试剂以产生信号。
在本文公开的实施方案中,标记试剂包括检测模块,并且其中所述的触发信号的步骤是通过将检测试剂递送至检测模块。
在实施方案中,检测模块可以包括能够将检测试剂连续转化为分子报告子的酶或(生物)化学催化剂。分子报告子可以产生光学信号、电信号、磁信号或可以使用成像检测器检测的任何其他信号。在通过液体分隔区内的检测模块连续产生分子报告子的情况下,分子报告子的浓度可迅速达到分隔区内的可检测浓度。
在本文公开的实施方案中,检测循环包括在触发来自所述的至少一种被捕获的和标记的分析物的信号之前随后除去未标记所述的分析物的标记试剂的步骤。
可以将标记试剂以高浓度添加到被捕获的分析物中到如此程度以致使得能够实现快速结合动力学。因此,可以在标记或重新标记步骤之后通过冲洗除去过量的标记试剂。
在本文公开的实施方案中,从所述的被捕获的分析物或所述的被捕获的和标记的分析物除去未结合的样品组分。
样品可以由化学或生物材料的复杂混合物组成,但其中只有分析物是数字计数分析所关心的。因此,可以从所述的被捕获的分析物或所述的被捕获的和标记的分析物除去未结合的样品组分,例如通过洗涤或漂洗程序。
在本文公开的实施方案中,使信号失活的步骤选自
a)从所述的捕获的分析物脱离所述的标记试剂,
b)使所述的标记试剂促进信号的能力失活,或者
c)a)和b)的组合,
并且其中使信号失活的步骤任选地然后进行漂洗步骤。
可以通过破坏所述的标记试剂与所述的被捕获的分析物的结合能力来实现从所述的被捕获的分析物脱离(detachment)所述的标记试剂。脱离可以通过例如升高温度,改变容纳所述的被捕获的和标记的分析物的液体的化学组成或通过从所述的被捕获的分析物中生化或化学切除所述的标记试剂来进行。为使脱离过程可行,不应破坏所述的被捕获的分析物与所述的捕获位点的结合。有助于脱离的有用的化学试剂是各种离液物质(即其存在提供了熵的增加的物质)。有用的离液剂例如选自正丁醇、乙醇、氯化胍、高氯酸锂、乙酸锂、氯化镁、苯酚、2-丙醇、十二烷基硫酸钠、硫脲和尿素。
可以通过破坏所述的标记试剂的检测模块来实现对所述的标记试剂介导信号的能力的失活。例如,如果所述的检测模块由酶构成,则应该破坏酶将检测试剂转化为分子报告子的能力。这通常需要了解所述的酶的分子机制,但存在本领域技术人员已知的几种方法。例如,碱性磷酸酶可以通过用乙二胺四乙酸(edta)处理而失活,或者辣根过氧化物酶可以通过用苯酚溶液处理而失活。
尽管标记试剂的脱离可用于选择性除去特异性结合的标记试剂,但对所述的标记试剂的信号介导能力的失活可用于从非特异性结合的标记试剂除去信号。非特异性结合的标记试剂可以例如附着于捕获位点的表面(而不是附着于所述的被捕获的分析物),因此可能使所述的标记试剂对特定的脱离程序具有抗性。因此,通过使非特异性结合的标记试剂的信号介导能力失活,所述的标记试剂将不会在随后的检测循环中产生假阳性信号。
在本文公开的实施方案中,该方法包括通过固定化在所述的固相上从样品中捕获所述的至少一种分析物。
在本文公开的实施方案中,该方法包括通过使用对所述的分析物具有特异性的一种或多种捕获探针并且其中所述的捕获探针附着于所述的固相,从所述的样品中捕获所述的至少一种分析物。
在本文公开的实施方案中,使用第一数量和第二数量的检测循环,并且其中所述的第一数量的检测循环使用与所述的第二数量的检测循环不同的标记试剂。
可以在不同的检测循环中使用不同类型的标记试剂例如以标记不同类型的被捕获的分析物或以用不同的标记试剂标记相同类型的被捕获的分析物。第一个过程可用于检测大量的不同的分析物类型,而前一个过程可用于(i)确认特定分析物的特性或(ii)定量捕获位点上的非靶化合物的存在。
在本文公开的实施方案中,用于一种或多种不同分析物类型的一种或多种不同捕获探针附着于所述的固相。
可以将多个捕获位点分入捕获位点的区域或集合,其中每个区域或集合通过与其附着的捕获探针的类型而彼此不同。按照这种方式,可以捕获和组织大量的不同分析物类型,从而数字计数分析可以使得能够在相同测量中定量几种不同的分析物类型。
在本文公开的实施方案中,一种或多种不同的标记试剂用于标记一种或多种不同的分析物类型。
在实施方案中,其中多个捕获位点显示具有不同捕获探针的若干区域,这样已经在几个区域上捕获了几种分析物类型,在标记或重新标记步骤期间用不同类型的标记试剂的集合补充多个捕获位点可能是有用的。这可以使得能够同时标记存在于多个捕获位点上的所有不同分析物类型并因此提高数字计数分析的多路复用能力。
在本文公开的实施方案中,检测循环的数量是至少3个循环,至少4个循环,至少5个循环,至少6个循环,至少7个循环,至少8个循环,至少9个循环,或至少10个循环。
在本文公开的实施方案中,检测循环的数量为3-20个循环,3-15个循环,3-10个循环,3-9个循环,3-8个循环,3-7个循环,3-6个循环或3-5个循环。
在本文公开的实施方案中,通过从所述的被捕获的分析物脱离使所述的标记试剂失活并通过冲洗除去。
在本文公开的实施方案中,使信号失活的步骤在多个液体分隔区中进行。
在本文公开的实施方案中,通过从在本文公开的一个实施方案中被捕获的分析物脱离而使所述的标记试剂失活并且其中所述的脱离是通过酶促切割。
在本文公开的实施方案中,通过从所述的被捕获的分析物脱离来使所述的标记试剂失活并且其中所述的脱离是通过调节ph、调节离子强度、添加变性盐或添加洗涤剂的化学裂解或解吸。
在本文公开的实施方案中,通过从所述的被捕获的分析物脱离使所述的标记试剂失活并且其中所述的脱离是通过加热。
在本文公开的实施方案中,通过改变其化学或物理状态使所述的标记试剂失活。
在本文公开的实施方案中,所述的标记试剂包括酶并且其中所述的酶的状态通过活性位点的化学或生物化学修饰而改变。
在本文公开的实施方案中,标记试剂包括酶并且其中所述的酶的状态通过酶的三级结构的化学或物理破坏而改变。
在本文公开的实施方案中,通过在所述的多个离散捕获位点上引入和收回亲水性液体,将所述的被捕获的和标记的分析物分隔以产生容纳所述的被捕获的和标记的分析物的液体分隔区,其中每个离散捕获位点被赋予亲水性并且其中将所述的多个离散捕获位点放置在疏水性基底上,使得在收回亲水性液体时,形成多个液体液滴并且每个液滴占据一个离散的捕获位点。
在本文公开的实施方案中,通过在所述的多个离散捕获位点上引入第一亲水液体,然后用第二液体替换所述的第一亲水液体,将所述的被捕获的和标记的分析物分隔以产生容纳分析物的液体分隔区,其中所述的两种液体是不混溶的并且其中所述的第二液体比所述的第一液体更轻,并且其中每个离散捕获位点被赋予亲水性,并且其中将所述的多个离散捕获位点放置在疏水基底上,使得用所述的第二液体替换所述的第一亲水液体时,形成包含第一亲水液体的多个液体液滴并且每个液滴占据一个离散捕获位点。
在本文公开的实施方案中,通过将第一液体引入所述的多个离散捕获位点,将被捕获的和标记的分析物分隔以产生容纳分析物的液体分隔区,其中每个离散捕获位点是孔形状或毛细管形状,并且其中用第二液体替换所述的第一亲水液体,其中所述的两种液体是不混溶的并且所述的第二液体比所述的第一液体更轻,使得在替换所述的第一液体时,形成包含所述的第一液体的多个液体液滴并且每个液滴占据一个离散的液体。
在本文公开的实施方案中,通过将液体引入所述的多个离散捕获位点,将所述的被捕获的和标记的分析物分隔以产生容纳分析物的液体分隔区,其中每个离散捕获位点是孔形状或毛细管形状,并且其中将所述的液体分配到所述的离散捕获位点,使得每个液体分隔区占据一个离散捕获位点。
在本文公开的实施方案中,通过将液体引入所述的多个离散捕获位点,将所述的被捕获的和标记的分析物分隔以产生容纳分析物的液体分隔区,其中每个离散捕获位点是孔形状,并且其中通过在多个捕获位点上施加盖子来替换液体,使得形成多个液滴并且每个液滴占据由盖子限定的一个孔形状的捕获位点。
在本文公开的实施方案中,通过将包含所述的多个离散捕获位点和所述的被捕获的和标记的分析物的第一液体引入第二液体,将所述的被捕获的和标记的分析物分隔以产生容纳所述的被捕获的和标记的分析物的液体分隔区,其中所述的第二液体与所述的第一液体是不混溶的,使得形成由所述的第一液体组成并被所述的第二液体包围的多个乳液液滴,并且其中每个乳液液滴包含至少一个离散捕获位点和至少一个被捕获的和标记的分析物。
在本文公开的实施方案中,将在每个检测循环中显示信号的液体分隔区的位置与在其他检测循环中显示信号的液体分隔区的位置进行比较,使得计数液体分隔区显示信号的连续检测循环的数量,并且其中液体分隔区被分类为至少两个类别,第一类别的液体分隔区显示比第二类别更大的计数。
显示信号的液体分隔区数量与分隔区内被捕获的化合物的特性有关。例如,考虑其中已经捕获分析物的捕获位点和其中已经捕获非靶化合物的另一个捕获位点。所述的分析物可以是寡核苷酸,其序列包含单个碱基对变化,例如单核苷酸多态性,并且所述的非靶化合物可以是具有与分析物相同序列的寡核苷酸,但没有单核苷酸多态性,即具有野生型序列。在该实施方案中,当两个捕获位点都接收对所述的分析物具有特异性的标记试剂时,则优先标记所述的分析物。然而,所述的非靶化合物也可能被标记,但效率较低。按照这种方式,容纳所述的靶分析物的液体分隔区可以在所有或大多数检测循环中显示信号,并且容纳所述的非靶化合物的液体分隔区可以在很少或没有检测循环中显示信号。通过比较其中每个液体分隔区显示信号的检测循环的数量,容纳所述的分析物的分隔区可以与容纳所述的非靶化合物的分隔区区分开。
在本文公开的实施方案中,应用在连续检测循环中重复显示信号的液体分隔区的数量来计算在所述的样品中的靶分析物的浓度。
在本文公开的实施方案中,所述的离散捕获位点的数量为至少1,000、优选地至少10,000、优选地至少100,000、优选地至少1,000,000、优选地至少10,000,000。
在本文公开的实施方案中,所述的离散捕获位点是圆形或球形的并且其中所述的单独离散位点的直径小于1mm、优选地小于100μm、优选地小于10μm、优选地小于1μm。
圆形捕获位点可以通过固体基底的化学或拓扑学的图案化而形成,而球形捕获位点可以由胶体珠子的集合构成。
在本文公开的实施方案中,所述的离散捕获位点是圆形或球形的并且其中所述的离散位点的直径为0.5-5μm、0.5-10μm、0.5-50μm、0.5-100μm、10-1000μm、50-1000μm、100-1000μm。
在本文公开的实施方案中,所述的离散捕获位点是二次的并且其中所述的单独离散位点的长度小于1mm、优选地小于100μm、优选地小于10μm、优选地小于1μm。
在本文公开的实施方案中,所述的离散捕获位点是二次的并且其中所述的离散位点的长度为0.5-5μm、0.5-10μm、0.5-50μm、0.5-100μm、10-1000μm、50-1000μm、100-1000μm。
在本文公开的实施方案中,所述的固相是
a)固体基底,
b)胶体珠子,或
c)胶体珠子的集合。
在本文公开的实施方案中,所述的液体分隔区在气相密封下是多个液体纳升-至-阿升液滴的形式。
在本文公开的实施方案中,所述的液体分隔区占据孔形状捕获位点、腔形捕获位点或毛细管形捕获位点。
在本文公开的实施方案中,所述的液体分隔区是多个油包水乳液液滴的形式。
在本文公开的实施方案中,所述的液体分隔区是在水不混溶的液相下多个水性纳升-至-阿升液滴的形式。
在本文公开的实施方案中,所述的数字计数在流动系统中执行,用于数字计数在样品中的一种或多种分析物类型,所述的流动系统包括在疏水基底内或疏水基底上具有亲水性特征的图案的支持物,所述的疏水基底嵌入在包括至少一个开口的流动分隔区中,所述的亲水性特征被构造成用于支持多个液体纳升-至-阿升液滴,每个液滴具有最大液滴体积,并且所述的流动分隔区被构造成支持减少每个纳升-至-阿升液滴的蒸发的气相密封。
在本文公开的实施方案中,所述的气相密封在所述的流动系统内建立能够减少微液滴的蒸发的蒸气压力。
在本文公开的实施方案中,所述的气相密封减少每个纳升-至-阿升液滴的蒸发至小于最大液滴体积的50%。
在实施方案中,本文公开的方法包括以下步骤:(i)将在所述的疏水性基底中或在所述的疏水性基底上的亲水性特征的图案与包含所述的一种或多种分析物类型的样品接触。
在实施方案中,本文公开的方法包括以下步骤(ii)在所述的亲水性特征上捕获所述的一种或多种分析物类型。
在实施方案中,本文公开的方法包括以下步骤(iii)使用对待检测的分析物类型具有特异性的标记试剂标记所述的至少一种被捕获的分析物类型。
在本文公开的实施方案中,将所述的被捕获的和标记的分析物分隔以产生容纳至少一种分析物的液体分隔区,其通过以下步骤(iv)使检测试剂流过所述的图案并从所述的图案中收回以产生纳升-至-阿升液滴形式的单个液滴。
在本文公开的实施方案中,所述的方法包括步骤(v)计数容纳所述的标记和检测试剂的液滴的数量。
在本文公开的实施方案中,所述的方法包括一次或多次重复步骤(iii)、(iv)和(v)。
在本文公开的实施方案中,所述的方法包括通过使用对待检测的第二分析物类型具有特异性的第二标记试剂代替所述的第一标记试剂来重复步骤(iii)、(iv)和(v)。
在本文公开的实施方案中,所述的方法包括使在之前的步骤中存在的所述的标记试剂失活的步骤,然后重复步骤(iii)、(iv)和(v)。
在本文公开的实施方案中,通过从所述的被捕获的分析物上脱离使标记试剂失活并通过冲洗流动系统除去。
在本文公开的实施方案中,所述的标记试剂包括酶和特异性分析物识别部分,并且所述的分析物识别部分选自以下分子:寡核苷酸、蛋白质、肽、适体、抗体、其复合物或其合成变体。
在本文公开的实施方案中,所述的离散捕获位点是亲水性特征。
在本文公开的实施方案中,将用于一种或多种不同分析物类型的一种或多种捕获探针附着于所述的亲水性特征。
在本文公开的实施方案中,所述的方法包括附着于亲水性特征的多于一种类型的捕获探针,并且其中不同类型的捕获探针排列在区域中。
在本文公开的实施方案中,所述的捕获探针选自以下探针:寡核苷酸、适体、蛋白质、抗体、肽或其合成变体。
在本文公开的实施方案中,通过完全浸没使包含液体中的所述的一种或多种分析物类型的样品与包含所述的亲水性特征的基底接触。
在本文公开的实施方案中,通过完全浸没使包含用于分析物的标记试剂的溶液与所述的被捕获的分析物接触来进行标记。
在本文公开的实施方案中,所述的分析物是单链或双链寡核苷酸,其中所述的寡核苷酸的序列是基因组序列或具有一个或多个碱基对变化的转录的基因组序列,所述的碱基对变化是例如单核苷酸多态性、插入或缺失。
在本文公开的实施方案中,所述的分析物选自以下分析物:单链寡核苷酸、双链寡核苷酸复合物、蛋白质、蛋白质/寡核苷酸复合物、蛋白质/脂质复合物、肽、外来体、病毒颗粒、病毒样颗粒、纳米颗粒、细胞碎片或细胞。
在本文公开的实施方案中,所述的样品衍生自全血、血浆或血清。
在本文公开的实施方案中,所述的样品选自以下样品:血液、血浆、血清、尿、唾液、脑脊髓液、泪液或组织。
在本文公开的实施方案中,所述的样品选自以下样品的实验室处理的样品:血液、血浆、血清、尿、唾液、脑脊髓液、泪液或组织。
在本文公开的实施方案中,所述的数字计数分析涉及单分子检测和定量。
在本文公开的实施方案中,所述的被捕获的分析物与随后用于捕获的捕获探针共价偶联。
所述的被捕获的分析物和所述的固相之间的共价键可以确保所述的被捕获的分析物在使信号失活的步骤期间不从所述的固相脱离。在实施方案中,所述的失活步骤用于从所述的被捕获的分析物除去标记试剂,但是应该以将所述的被捕获的分析物保留在所述的固相上的方式实施。共价键足够强以在大多数条件下将所述的被捕获的分析物保留在所述的固相上,并因此可以在用于脱离所述的标记试剂的条件方面提供更大的灵活性。
在本文公开的实施方案中,所述的捕获探针是寡核苷酸或合成的寡核苷酸,所述的分析物是寡核苷酸或包含寡核苷酸的分子复合物,其中所述的分析物通过与所述的捕获探针序列互补的序列与所述的捕获探针结合并且其中所述的共价交联是通过是使用链间交联试剂实施的,所述的链间交联试剂例如铂络合物、丝裂霉素c、氮芥、补骨脂素或醛。
在本文公开的实施方案中,所述的捕获探针是蛋白质、适体、肽或其合成变体,所述的分析物是蛋白质、肽或含有蛋白质或肽的复合物,所述的分析物通过对所述的分析物特定区域的结构识别而与所述的捕获探针结合,并且其中所述的共价交联是通过使用化学固定试剂实施的,所述的化学固定试剂例如甲醛、戊二醛、四氧化锇、甲基乙二醛或乙酸铀酰。
在本文公开的实施方案中,所述的捕获探针是合成的寡核苷酸,其中所述的合成修饰并入对所述的分析物具有反应性的化学基团,使得可以在分析物和随后进行的捕获后捕获探针之间建立共价连接。在本文公开的实施方案中,通过使所述的分析物/捕获探针-复合物与化学试剂接触来触发分析物和捕获探针之间的共价连接。在本文公开的实施方案中,通过使分析物/捕获探针-复合物与电磁辐射接触来触发分析物和捕获探针之间的共价连接。
在本文公开的实施方案中,所述的分析是单分子数字计数分析。在本文公开的另一个实施方案中,数字计数测量包括单酶连锁分子分析(selma)、数字聚合酶链式反应(dpcr)、单酶联免疫吸附测定法(selisa)或数字单酶联免疫吸附测定法(delisa)。
在本文公开的实施方案中,所述的至少一种分析物是寡核苷酸,其中所述的寡核苷酸的序列是基因组序列或具有一个或多个碱基对变化的转录的基因组序列,所述的碱基对变化是例如单核苷酸多态性、插入或缺失,并且其中所述的样品可能包含多于一种的非靶寡核苷酸,所述的非靶寡核苷酸具有与靶标相同的基因组序列或转录的基因组序列,但没有所述的一个或多个碱基对变化。
在本文公开的实施方案中,所述的样品包含第一和第二分析物类型,其中所述的第一分析物类型具有第一序列和在所述的样品中的第一浓度,其中所述的第二分析物类型具有第二序列和在所述的样品中的第二浓度,其中所述的第一和第二序列是不同的,其中所述的第一和第二序列是基因组序列或转录的基因组序列,并且如本文所述,测量所述的第一和第二浓度并将其相互比较以鉴定拷贝数变异。
在本文公开的实施方案中,通过大气提供气相,并且捕获探针选自单链dna寡聚体、单链锁核酸寡聚体或单链肽核酸寡聚体;不同类型的捕获探针排列在区域中;分析物为由经处理的血液样品提取的单链dna;标记试剂包括检测模块和识别部分;检测模块是酶并且识别部分选自单链dna寡聚体、单链锁核酸寡聚体或单链肽核酸寡聚体。
数字计数测量可以允许单一的分析物分子被直接检测,并由此计数,从而测定它们在样品中的浓度。数字计数测量可以用于数字聚合酶链式反应(dpcr)、数字酶联免疫吸附测定法(delisa)或它们的变体中。对于dpcr,在反应分隔区中分离单一的核苷酸分析物,并使其经历聚合酶辅助核苷酸扩增以及扩增子的荧光标记。对于delisa,在微胶体颗粒的表面上捕获单一蛋白质/肽分析物,使用酶缀合的抗体进行标记,在微观反应分隔区中分离,并提供检测试剂。当检测试剂被酶处理时,产生光学信号(例如荧光、化学发光、吸光),这是由于反应分隔区的微观体积快速达到可检测浓度。数字计数测量的原理概括于图8中。
在本文公开的实施方案中,为了使用本发明所述的流动系统实施给定分析物的数字计数测量,至少需要以下3个一般的步骤:(1)分析物捕获;(2)分析物标记;以及(3)分析物计数,例如参见图9中的草图。在步骤1中,来自样品的分析物被特异性地捕获在亲水性特征上。在步骤2中,使用合适的试剂,例如酶缀合物,特异性地标记捕获的分析物。在步骤3中,形成微液滴的阵列,使得液体包含检测试剂。在其中标记试剂为酶的情况下,检测试剂应该为用于酶的发荧光的/显色的/化学发光的底物。在处理底物的时候,在液滴中产生可检测的光学信号,其中所述的液滴最初容纳有标记试剂和检测反应剂。接着,可以通过阵列的光学成像来计数产生信号的液滴。
在一个实施方案中,流动系统包含用于一种或多种不同的分析物类型的一种或多种捕获探针,所述的捕获探针附着在亲水性特征上。在其他的实施方案中,不同类型的捕获探针排列在区域中。
本发明超过dpcr和微胶体辅助的delisa的优点在于分析物可以被捕获,并且特异性地组织在亲水性特征上。当要(i)在单一测量中测量多种不同的分析物类型;以及(ii)如果需要重复测量时,上述情况是理想的。
在第一种情况下,不同的捕获探针可以被置于流动分隔区中的不同区域,使得对一种分析物类型具有特异性的捕获探针位于第一区域中,对另一种分析物类型具有特异性的另一种捕获探针位于第二区域中,等等。这是dna和蛋白质微阵列研究领域内公知的策略,其中可以在单一测量中检测几百种靶分析物,例如参见weinrich,d.等人发表于angewandtechemieinternationaledition(2009),vol.48,pp.7744-7751的标题为“applicationsofproteinbiochipsinbiomedicalandbiotechnologicalresearch”的综述(doi:10.1002/anie.200901480)。
在第二种情况下,可以通过除去标记和检测试剂,并将它们再次引入流动系统中而重复数字计数。因为被捕获的分析物保持固定化在亲水性特征上,所以可以重复数字计数测量,从而改进例如信噪比,参见实施例5。这对于dpcr或delisa都是不可能的,因为标记和检测试剂不能在未除去分析物的情况下被除去。
在一个实施方案中,用于一种或多种不同的分析物类型的一种或多种捕获探针通过连接体部分附着在亲水性特征上。在大多数情况下,连接体分子起到连接亲水性特征的硬质无机表面与软质有机捕获探针的作用。因此,连接体分子可以包含双重化学官能性,从而连接捕获探针与表面。连接体分子可以选择为聚(乙二醇)聚合物,其是挠性的、惰性的并且是亲水性的。它们还可以选择为直链烷烃链。聚(乙二醇)连接体可以制备成不同的尺寸/长度,因此在表面和捕获探针之间提供更大的分离,而烷烃链通常更短。其他连接体分子包括但不限于多肽或寡核苷酸。连接体分子上存在的化学官能性可以选自反应性化学官能团的多种选择,例如醛、炔、胺、叠氮化物、生物素、boc/fmoc-保护的胺、羧酸、环氧化物、酰肼、羟基、马来酰亚胺、n-羟基琥珀酰亚胺、硫醇、乙烯砜和它们的变体。
在一个实施方案中,超过一种类型的捕获探针附着在亲水性特征上,而不同类型的捕获探针排列在区域中。在一个实施方案中,捕获探针选自以下探针:寡核苷酸、蛋白质、肽或它们的合成变体。
在其中捕获探针为寡核苷酸的情况下,该探针能够捕获其他的寡核苷酸,其展现出对于捕获探针的互补序列。合成寡核苷酸变体例如锁核酸(lna)或肽核酸(pna)(其展现出链入侵性质)还可以用于捕获单链或双链dna。适体也可以用作捕获探针,从而能够捕获蛋白质或肽。此外,抗体或抗体片段可以用作捕获探针,从而介导蛋白质、肽或小分子的特异性捕获。
在本文公开的实施方案中,所述的方法进一步包括以下步骤:(i)将疏水性基底中或疏水性基底上的亲水性特征的图案与包含一种或多种分析物类型的样品接触。
在本文公开的实施方案中,所述的方法进一步包括以下步骤:(ii)在亲水性特征上捕获至少一种分析物类型。
在亲水性特征上可以捕获大量的分析物类型,其中所述的亲水性特征已经发生(生物)化学官能化,如之前更详细地描述的那样。例如为了特异性地捕获基于寡核苷酸的分析物,例如rna、mrna、病毒rna、dna、病毒dna、细菌dna、dna/rna复合物或蛋白质/dna/rna,必须施加展示对于分析物的互补寡核苷酸序列的基于寡核苷酸的捕获探针。为了特异性地捕获基于蛋白质或肽的分析物或其复合物,必须施加基于抗体或适体的捕获探针,其特异性地识别分析物的三级结构,即,抗原/抗体结合。可以使用特异性靶向分析物所展示的抗原的抗体以相同方式捕获包含完整生物实体或大分子组件(例如细胞、细菌、病毒、病毒样颗粒、纳米颗粒或细胞碎片)的分析物。备选地,上文提及的分析物类型可以不借助于捕获探针而被捕获,但是必须使微液滴的尺寸(即,vd值)与分析物的尺寸匹配,使得仅一种分析物能够保留在液滴中。
此外,可以使用介导捕获的辅助探针补充捕获探针,使得辅助探针首先特异性地结合分析物,然后特异性地结合表面上的捕获探针,由此起到系链(tether)的作用,例如参见图9中的草图。
此外,所有上文提及的分析物类型可以通过使用异双功能化学交联试剂而非特异性地被捕获在亲水性特征上,使得交联试剂的一个末端与分析物结合,并且另一个末端与表面结合。
在本文公开的实施方案中,所述的方法进一步包括以下步骤:(iii)使用对待检测的分析物类型具有特异性的标记试剂,标记至少一种被捕获的分析物类型。
可以以相同方式选择标记试剂作为捕获探针,从而介导分析物的特异性标记。例如如果分析物为寡核苷酸,则捕获探针和标记试剂都可以为寡核苷酸或其合成的变体。在这种情况下,捕获探针可以识别分析物上的一个特定的序列,并且标记试剂可以识别另一个特定的序列。标记试剂可以包含用于特异性识别分析物的一个模块,以及用于随后检测分析物的另一个模块。至少3种类型的标记试剂达到这些标准:酶缀合的寡核苷酸、酶缀合的蛋白质/肽或酶缀合的适体。分析物识别模块分别通过寡核苷酸、蛋白质/肽或适体提供,而检测模块通过酶提供。
在本文公开的实施方案中,所述的方法进一步包括以下步骤:(iv)检测试剂流动穿过(across)所述的图案以及从所述的图案收回,从而产生纳升-至-阿升液滴的形式的单个液滴。
在形成包含检测反应剂的水性微液滴的情况下,可以在呈现标记试剂和检测试剂的液滴的子集中引发信号生成。在其中标记试剂包含酶的情况下,合适的检测反应剂为任何相容的酶底物,其能够响应于酶处理而生成光学信号。例如在其中所述的酶属于过氧化物酶类的情况下,合适的检测试剂包括abts(2,2'-连氮基双[3-乙基苯并噻唑啉-6-磺酸]-二铵盐)、opd(邻苯二胺二盐酸盐)、tmb(3,3',5,5'-四甲基联苯胺),以及以下商品名的产品quantablu、quantared、amplexultrared或supersignalelisapico/femto。在其中所述的酶属于磷酸酶类的情况下,合适的检测试剂包括pnpp(对硝基苯基磷酸盐)、4-mup(4-甲基伞形基磷酸酯)、bcip/nbt(5-溴-4-氯-3-吲哚基磷酸盐/硝基蓝四唑),以及以下商品名的产品cspd、cpdstar或dynalight。在所述的酶属于半乳糖苷酶类的情况下,合适的检测试剂包括fdg(荧光素di-β-d-吡喃半乳糖苷)、ddao半乳糖苷(9h-(1,3-二氯-9,9-二甲基吖啶-2-酮-7-基)β-d-吡喃半乳糖苷)、mug(4-甲基伞形酮基β-d-吡喃半乳糖苷)、onpg(邻硝基苯基-β-d-吡喃半乳糖苷)、试卤灵β-d-吡喃半乳糖苷、x-gal(5-溴-4-氯-3-吲哚基β-d-吡喃半乳糖苷),以及以下商品名的产品galacton-star或bluo-gal。此外,可以使用任何elisa相容的酶/底物对。
在本文公开的实施方案中,所述的方法进一步包括以下步骤:(v)计数容纳标记试剂和检测反应剂的液滴的数量。
借助于成像装置(例如光学显微镜)最方便地执行展现光学信号的液滴的计数。使用显微镜,可以将单个液滴成像,并由显微照片的相对强度单位来评价它们的信号水平。在其中信号的本性是化学发光或荧光的情况下,可以使用荧光滤波器组记录所得的显微照片。此外,如实施例4所示,可以使用在相同位置获得的亮视野显微照片来补充荧光显微照片,从而验证液滴的位置和外观,并将其与荧光信号的位置相关联。
在其中信号的本性是比色的情况下,可以通过亮视野显微镜成像来记录所得的显微照片,从而评价单个液滴的吸光率、反射率或透光率。
在其中液滴阵列覆盖大面积使得单一显微照片的视野不能包含液滴的情况下,可以在多个位置记录多个显微照片,从而重新构建展示完整阵列的更大的显微照片。为了指导成像的重新构建(例如显微照片拼接),可以将容易识别的微图案并入在阵列上。
在本文公开的实施方案中,所述的方法进一步包括一次或多次重复步骤(iii)、(iv)和(v)。
在本文公开的实施方案中,所述的方法进一步包括通过使用对待检测的第二分析物类型具有特异性的第二标记试剂,而不使用第一标记试剂,重复步骤(iii)、(iv)和(v)。
在本文公开的实施方案中,所述的方法进一步包括使之前的步骤中存在的标记试剂失活的步骤,然后重复步骤(iii)、(iv)和(v)。
重复标记、加入检测反应剂和计数信号阳性液滴的步骤的能力是selma测量的独特征质,其具有至少2个优点:
第一,通过从之前的测量除去标记和检测试剂以及随后再次引入标记和检测试剂可以增加信噪比。这是由于以下事实:标记试剂可以非特异性地结合不存在任何分析物的亲水性特征的表面。非特异性地结合的标记试剂由此可以在计数测量中包含背景噪声,由此导致潜在的低的信号比。然而,由于非特异性的结合是在阵列上的随机位置发生的,而与分析物的特异性结合仅在存在分析物的阵列特征上发生,则可以通过重复测量来区分2种结合模式。在重复测量中,仅展现非特异性结合的液滴不能在每次重复测量时提供阳性信号,而展现特异性结合的液滴每次都可以提供阳性信号。按照这种方式,背景噪声可以显著地降低,由此得到更高的测量灵敏度。
第二,通过从之前的测量除去对分析物类型具有特异性的标记和检测试剂并且随后引入对另一种分析物类型具有特异性的标记和检测试剂,可以提供更高的复用能力。在这种情况下,每次重复测量时,都计数新的一组分析物类型。例如如果使用对10种不同分析物类型具有特异性的捕获探针将所述的阵列官能化,则通过重复测量10次(每次都引入新的标记和检测试剂),则所有的10种分析物都可以定量。
在本文公开的实施方案中,通过与表面结合的分析物脱离而使标记试剂失活并且通过冲洗流动系统而除去。
如本领域那些技术人员已知的那样,存在使分子探针失活的多种方法。在selma测量的情况下,最方便的方法依赖于从分析物释放标记试剂,同时保持分析物与捕获探针结合。一旦标记试剂脱离,可以通过使用漂洗溶液冲洗流动通道而除去标记试剂。由于检测试剂不倾向于与阵列表面结合,所以检测试剂更容易除去,因此无需脱离步骤。
在本文公开的实施方案中,标记试剂通过酶切割而脱离。
在其中捕获探针、分析物和标记试剂为寡核苷酸的情况下,可以通过核酸外切酶处理来特异性除去标记试剂。核酸外切酶是降解双链dna的酶,所述的双链dna例如分析物与标记试剂之间的互补序列。通过使捕获探对于核酸外切酶处理迟钝(例如通过选择肽核酸、锁核酸或化学改性的单链dna作为捕获探针),仅分析物和标记试剂之间的结合被破坏。
在一个实施方案中,标记试剂是通过化学断裂或解吸附而脱离的,例如通过加入或调节ph、离子强度、变性盐或洗涤剂。
在一个实施方案中,标记试剂是通过增加流动系统的温度而脱离的。
在一个实施方案中,标记试剂是通过改变其化学或物理状态而失活的。
在其中分析物和标记试剂均为寡核苷酸并且均通过碱基配对序列互补而彼此结合的实施方案中,可以通过改变溶液的ph和离子强度而特异性地除去标记试剂。例如当ph升高时,由于核碱基的去质子化作用,dna的双链结构被破坏。此外,还可以通过降低溶液的离子强度,由此增加dna主链上带电荷的磷酸盐基团之间的静电排斥而取得双螺旋dna的分离。进一步地,通过将温度升至双螺旋dna的熔融转变温度以上,可以使得标记试剂与分析物分离。
在其中分析物和标记试剂为基于蛋白质或肽的实施方案中,可以通过使用洗涤剂、变性盐或通过升高温度来使破坏/变性三级结构,而使标记试剂脱离。
在一个实施方案中,标记试剂包括酶,并且可以通过活性位点的化学或生物化学修饰来改变酶的状态,使得标记试剂失活。
可以通过破坏活性位点使酶失活,使得进一步的酶处理不可能。例如在其中所述的酶属于过氧化物酶类的情况下,当暴露于苯酚溶液时,活性位点被不可逆的破坏,例如参见mao,l.,luo,s.,huang,q.和lu,j.发表于scientificreports,vol.3,articlenumber3126(2013)的"horseradishperoxidaseinactivation:hemedestructionandinfluenceofpolyethyleneglycol"著作(doi:10.1038/srep03126)。此外,在所述的酶属于磷酸酶类的情况下,活性位点需要锌和镁离子复合物来发挥功能。因此,通过使用螯合试剂例如edta(乙二胺四乙酸)除去这些离子,可以导致酶不可逆的灭活,即,酶活性的终止,例如参见ackermann,b.p.和ahlers,j.发表于biochemicaljournal,vol.153,pp.151-157(1976)的“kineticsofalkalinephosphatasefrompigkidney.influenceofcomplexingagentsonstabilityandactivity”的著作(doi:10.1042/bj1530151)。
在一个实施方案中,标记试剂包括酶,并且其中酶的状态是通过化学或物理破坏酶的三级结构而改变的。
例如可以通过升高溶液的温度、通过升高或降低ph、通过升高或降低溶液的离子强度、通过加入洗涤剂或通过使用化学交联试剂以共价修饰酶而改变酶的结构。
在一个实施方案中,标记试剂包括酶和特异性分析物识别部分,并且分析物识别部分选自以下分子:寡核苷酸、蛋白质、肽、适体、抗体、它们的复合物或它们的合成变体。
在一个实施方案中,通过完全浸渍将在液体中包含一种或多种分析物类型的样品与包含亲水性特征的基底接触。
在一个实施方案中,所述的方法进一步包括除去液体和洗涤基底。
在一个实施方案中,标记是通过完全浸渍使包含用于分析物的标记试剂的溶液与被捕获的分析物接触而实施的。
在一个实施方案中,所述的方法进一步包括除去包含残余的标记试剂的溶液,和洗涤基底。
在本文公开的实施方案中,容纳亲水性特征的图案的基底位于流动分隔区内部,由此能够通过压力驱使的驱动使液体塞从入口到出口进行液体接触。包含不同反应剂(标记试剂、检测试剂、失活试剂、漂洗溶液)的不同溶液可以被加载至液体加载垫中,并驱动至流动分隔区中。液体接触模式可以分类为:(i)流动-通过(flow-through)接触;或者(ii)灌输-停止-收回接触。在流动-通过接触模式中,液体塞被驱动穿过流动分隔区中,直至液体塞的整个体积通过。在灌输-停止-收回接触模式中,液体塞被驱动,直至其充满流动分隔区的整个体积,然后停止。在某段等待时间后,液体塞被驱动出流动通道,并进入液体出口。
流动-通过接触模式通常适用于其中反应剂过量的反应步骤。该步骤的持续时间可以通过流速(体积/时间)和液滴塞的体积来确定,并且可以调节,从而取得所需的处理时间。诸如漂洗步骤、标记步骤、失活步骤和检测步骤之类的步骤通常以流动-通过的接触模式进行实施。
灌输-停止-收回接触可以适用于需要更长孵育时间的步骤中,并且其中反应剂以低浓度存在。例如捕获步骤,其中包含低浓度分析物的样品将与亲水性特征表面上的捕获探针结合。对于捕获步骤,有利的是延长该步骤的持续时间,从而确保所有的分析物均从样品中完全捕获,即,足够的孵育时间以允许分析物从流动分隔区的顶部扩散至底部,以及足够的时间以在表面上能够成功捕获的。灌输-停止-收回接触等同于亲水性图案在溶液中的完全浸渍。
在一个实施方案中,分析物选自以下分析物:单链寡核苷酸、双链寡核苷酸复合物、蛋白质、蛋白质/寡核苷酸复合物、蛋白质/脂质复合物、肽、外泌体、病毒颗粒、病毒样颗粒、纳米颗粒、细胞碎片或细胞。
在一个实施方案中,样品选自以下样品:血液、血浆、血清、尿、唾液、脑脊液、泪液或组织。
在一个实施方案中,样品选自以下样品的实验室处理的样品:血液、血浆、血清、尿、唾液、脑脊液、泪液或组织,例如血液。
根据样品的类型,可以存在不同种类的分析物类型,并且可以需要不同的实验室方案以制备用于测量的分析物。例如如果样品为血液样品,必须使用抗凝剂(例如乙二胺四乙酸(edta)、柠檬酸盐或草酸盐)处理血液,以防止凝固。血液样品的实验室处理的另一实例是离心或者过滤血液,以便除去样品中的细胞。血液样品的实验室处理的另一实例是稀释血液或加入活性成分,从而有助于目的生物标志物的特异性提取。例如可以使用固相可逆固定化方法从液体样品纯化dna分析物,其中将血液与拥挤试剂(crowdingagent)和羧酸涂敷的顺磁性微颗粒混合。这些反应条件可以有利于dna选择性吸收在微颗粒的表面上,然后可以通过施加磁场进行提取。对于其他应用而言,有利的是使稀释的或以其他方式处理的样品经过(i)电泳步骤或(ii)透析步骤,从而基于分子的电荷、尺寸和分子量由样品中选择这些分子。
在一个实施方案中,一种或多种被捕获的分析物与随后用于捕获的捕获探针形成共价交联或偶联。
有利的是在分析物和捕获探针之间建立共价连接,因为其提供了将分析物基本上不可逆的固定化在表面上。按照这种方式,可以更容易地取得标记试剂的脱离,这是因为分析物与标记试剂之间的连接是非共价的,因此较弱。例如如果捕获探针和分析物均为寡核苷酸,并且通过互补碱基配对结合在一起,此外通过一个或多个共价连接结合在一起,而且如果标记试剂也是寡核苷酸,但是仅通过互补碱基配对与分析物结合,则可以通过使复合物经过碱性ph而容易地使标记试剂从分析物上解离。碱性ph不可能如同分析物/标记试剂之间较弱的碱基配对连接的程度那样,影响捕获探针/分析物之间强的共价连接。
作为另一实例,考虑捕获探针为抗体,而分析物为蛋白质或肽,并且在这二者时间建立共价连接。如果标记试剂是基于抗体的,并且通过抗体/抗原相互作用与分析物结合,则可以通过加入洗涤剂或加入变性剂容易地除去,同时仍保持捕获探针与分析物之间的共价连接。
在一个实施方案中,捕获探针为寡核苷酸或合成的寡核苷酸,分析物为通过与捕获探针序列的碱基配对而与捕获探针结合的寡核苷酸并且并且通过使用链间交联试剂(例如铂络合物、丝裂霉素c、氮芥、补骨脂素或醛)进行共价交联。如同上述那些的链间交联试剂能够在双螺旋dna、双螺旋dna/rna、或者包含核碱基的它们的合成变体中,在相对的链上的核碱基之间形成共价键。与非共价链间碱基配对连接相比,链间共价连接提供增强的稳定性,由此提供分析物与捕获探针(并由此与亲水性特征之间)的实际不可逆的固定化。
在一个实施方案中,捕获探针为蛋白质、肽或它们的合成变体,分析物为蛋白质、肽或者包含蛋白质或肽的复合物,分析物通过分析物特定区域的结构识别与捕获探针结合,并且通过使用化学固定试剂(例如甲醛、戊二醛、四氧化锇或乙酸铀酰)实施共价交联。如同上述那些的化学固定剂能够交联氨基酸,由此在分析物和捕获探针之间的接触区域提供共价连接。这可以导致分析物与捕获探针(并由此与亲水性特征之间)的实际不可逆的固定化。
在本发明所述的方法和流动系统的实施方案中,通过大气提供气相,和/或捕获探针选自单链dna寡聚体、单链锁核酸寡聚体或单链肽核酸寡聚体,和/或不同类型的捕获探针排列在区域中,和/或分析物为由经处理的血液样品提取的单链dna,和/或标记试剂包含检测模块和识别部分,和/或检测模块为酶,和/或识别部分选自单链dna寡聚体、单链锁核酸寡聚体或单链肽核酸寡聚体。
在本发明所述的方法和流动系统的另一个实施方案中,通过大气提供气相,捕获探针选自单链dna寡聚体、单链锁核酸寡聚体或单链肽核酸寡聚体,不同类型的捕获探针排列在区域中,分析物为由经处理的血液样品提取的单链dna,标记试剂包含检测模块和识别部分,检测模块为酶,以及识别部分选自单链dna寡聚体、单链锁核酸寡聚体或单链肽核酸寡聚体。
在下文中,描述应用的一些非限定性实例:
在本文公开的实施方案中,具有多个离散捕获位点的固相的用途,每个位点能够在本文所述的方法中捕获所述的至少一种分析物。
在本文公开的实施方案中,具有多个离散捕获位点的固相的用途,每个位点能够在本文所述的方法中捕获所述的至少一种分析物,用于减少数字计数分析中的计数误差。
在本文公开的实施方案中,具有多个离散捕获位点的固相的用途,每个位点能够捕获所述的至少一种分析物,用于通过执行如本文所述的至少两个检测循环来减少数字计数分析中的计数误差。
单酶联免疫吸附测定法(selisa),其中蛋白质或肽分析物被表面结合的抗体探针捕获,然后进行标记并通过单酶缀合的检测探针检测。
单寡核苷酸杂交测定法,其中寡核苷酸分析物被表面结合的互补性寡核苷酸探针捕获,然后进行标记并通过单酶缀合的检测探针检测。
另一类应用处理了单一生物实体(例如细胞、细胞碎片/细胞器、细菌、病毒壳体等)的操作和定量。在这些情况下,所述的测定法可以使用表面结合的捕获探针将任何上文提及的生物实体固定化,然后施加特定的检测探针,从而定量它们的数量和种类。备选地,在生物实体被捕获后,它们可以被破裂,它们的蛋白质、肽、脂质或寡核苷酸的内容物可以被另一组表面结合的捕获探针捕获,然后进行标记并通过单酶缀合的检测探针检测。
此外,本发明适用于实施数字聚合酶链式反应(dpcr)或它们的变体。在本发明的一个实施方案中,dpcr测定法通过在单一的液滴中包含靶序列以及扩增反应剂和检测探针,检测特定的寡核苷酸序列。当pcr发生时,靶序列被扩增,由此可以通过检测探针可检测。在本发明的另一个实施方案中,靶寡核苷酸首先被表面结合的探针特异性地捕获,然后,扩增反应剂和检测探针被供入单个液滴中,从而可以进行pcr和检测反应。
在一个实施方案中,本发明所述的系统和方法提供了用于微液滴的改进的密封,并由此,提供了气相密封。在实施方案中,本发明所述的系统和方法包括通道型流动分隔区,其具有用于支持多个微液滴的表面。在实施方案中,如本文所公开,通道型流动分隔区还具有在支持液滴的表面上延伸的表面,并且包含壁,使得通道型流动分隔区具有2个开口,每个开口分别在流动分隔区的一侧上。在一个实施方案中,通道是具有正方形截面的长方形,使得每个开口都是正方形。在其他实施方案中,流动分隔区是圆柱形,并且每个开口是圆形。在这两种实施方案中,例如在阵列中,微液滴彼此间隔开,并且位于流动分隔区内的中心。在实施方案中,中心定位的液滴与每个开口间隔一定长度(le)。在一个实施方案中,部分基于微液滴中所包含的流体的总体积、与流动分隔区接触的周围环境的温度和压力以及长度le来选择流动分隔区的高度(h)。在一个实施方案中,选择高度h,以创建流动分隔区内的蒸气压力,该蒸气压力降低微液滴蒸发的速率。不被理论所限定,但是当微液滴蒸发时,由蒸发形成的蒸气创建了气相密封,与通常暴露于周围环境,微液滴所经历的速率相比,所述的气相密封降低蒸气发生时的速率。在一个实践中,应该理解的是对于水性溶液,水的某些级分将蒸发进入气相中。但是,蒸发的程度可以通过选择(i)合适的流动通道的深度和几何形状;(ii)合适的滴液体积;以及(iii)合适的微液滴阵列几何形状来预测和合理地控制。通过正确地选择参数,由于流动通道中的蒸气压力以及由此增加的湿度,微液滴将不会蒸发。这提供了气相密封,其类似于化学密封,而且替代了使用液相覆盖流动分隔区,微液滴保持在气相中,例如空气。与液相相比,气相的优点在于许多大生物分子(蛋白质、dna、脂质等)不分配进入空气中,这是因为它们的沸点显著高于水。与化学密封不同,气相密封允许反应剂容易地被引入在阵列上,而不必除去油相。
对于其中流动分隔区储存停留在平坦的基底上的微液滴(通过表面张力原位保持并整合至流动通道中)的实施方案,可以通过将阵列与液体接触,然后收回液体,来建立气相密封。在液体收回时,阵列将保持微液滴,并且流动通道将充满例如空气,由此建立气相密封。因此,本发明所述的系统和方法除此之外提供了嵌入流动通道中的基于表面张力的微液滴阵列,其中流动通道的几何形状与阵列的几何形状匹配,例如将蒸发降低至某一分数以下,例如低于5%。
在本文中,被构造用于支持多个纳升-至-阿升液滴的亲水性特征的特征具体可以指亲水性特征形成具有第一亲水性性质的材料的图案,所述材料被具有第二亲水性性质的材料包围,所述的第一性质比第二性质具有更高的亲水性,这是指对于具有第一亲水性性质的材料上的液滴而言,接触角更低。在一个实例中,认为具有第二亲水性性质的材料是疏水性的,由此所述的液滴基本上专门地定位在具有第一亲水性性质的材料上。
被构造用于支持减少蒸发的气相密封的流动分隔区的特征是指流动分隔区的体积相对于液滴的体积。本发明认为具有体积vc的流动分隔区是在被构造用于支持减少蒸发的气相密封的分隔区的界定范围内,vc临界值通过下式设定:
减少蒸发的气相的实例可以为基本处于饱和温度和压力的蒸气,使得其不能增加相对湿度,即,接近100pct.湿度,或者至少90-100pct.范围内,例如95-100pct.湿度的范围内。术语“开口”是指样品进入疏水性基底上的亲水性特征的入口。开口可以通过由外部进入分隔区的相同或不同尺寸的一个或多个入口形成。
流动分隔区是其中样品可以流动并且将亲水性特征安置在疏水性基底上的分隔区。流动分隔区可以通过一个或多个不同的室形成。如果其通过多于一个的室界定,则所述的室处于流体连接下。
捕获探针是能够捕获特定构成成分的特征。捕获探针可以基于例如pna或dna,例如单链pna寡聚体。
在一个实施方案中,用于亲水性特征的支持体位于流动分隔区内的中心。在一个实例中,用于亲水性特征的支持体在流动分隔区内被疏水性材料包围,其中所述的疏水性材料形成用于亲水性特征的支持体的边界。
本发明的具体实施方案
使用流动分隔区进行数字计数的流动系统
本文公开了用于数字计数样品中一种或多种不同的分析物类型的流动系统,例如在本文所述的方法和用途中,其包括:在疏水性基底中或疏水性基底上具有亲水性特征的图案的支持体,所述的疏水性基底嵌入在包含至少一个开口的流动分隔区中,所述的亲水性特征被构造用于支持多个液体纳升-至-阿升液滴。在实施方案中,流动分隔区被构造用于支持减少各个纳升-至-阿升液滴的蒸发的气相密封。在实施方案中,气相密封将各个纳升-至-阿升液滴的蒸发减少至最大液滴体积的小于50%。
在本文公开的实施方案中,流动系统包括在疏水性基底中或在疏水性基底上提供亲水性特征的图案的液滴区,从而能够形成抗蒸发的气相密封的纳升-至-阿升液滴。
在本文公开的实施方案中,流动系统包括重叠液滴区的一个或多个流动分隔区,例如流动通道,从而使液体能够与亲水性/疏水性图案接触。
在本文公开的实施方案中,流动系统包括用于使用液体和反应剂供入流动分隔区和液滴区的液体加载垫。
在本文公开的实施方案中,流动系统包括连接流动分隔区和液体加载垫的液体入口。
在本文公开的实施方案中,流动系统包括连接流动分隔区与提供抽吸的压力源的液体出口,并由此介导液体驱动通过流动分隔区。
在本文公开的另一个实施方案中,流动系统包括至少5种不同的元件,从而发挥单分子数字计数装置的功能,还参见图10。
这些元件如下:
·提供亲水性特征的图案的液滴区,其中所述的亲水性特征被疏水性基底包围,从而能够形成抗蒸发的气相密封的纳升-至-阿升液滴;
·重叠液滴区的一个或多个流动分隔区,从而能够使液体与亲水性/疏水性图案接触;
·使用液体和反应剂供入流动分隔区的液体加载垫;
·连接流动分隔区和液体加载垫的液体入口;
·连接流动分隔区和提供抽吸压力源的液体出口,并由此介导液体驱动通过流动分隔区。
上述提及的5种特征定义了示例性流动系统,其中通过由入口至出口的压力下降的手段将液体驱动穿过流动分隔区。不采用提供抽吸,可以将加载垫中的液体反应剂推动通过流动通道。这需要加载垫的一侧与压力源连接,而另一侧与液体入口连接。在这种情况下,液体出口不需要与压力源连接。驱动液体流动的备选手段是通过重力,在这种情况下,不需要压力源;或者通过双向电泳驱动,这需要电极嵌入在流动通道中。在本文公开的一个实施方案中,液体驱动是抽吸驱使的。
如本领域那些技术人员已知的那样,相似的功能流动系统可以通过多种不同的方法制造。这些方法包括但不限于:
1.使用计算机数控(cnc)铣削,注射成型,热模压印或3d打印,从而在固体基底上制造流动分隔区。
2.采用与cnc铣削、注射成型、热模压印或3d打印相容的任何固体基底。
3.由一种或多种成分生产流动系统,随后将成分粘合(bonding)在一起,从而取得所需的几何形状或功能性。粘合技术包括压敏粘附膜、液体粘合剂的喷涂、热粘合、超声波焊接或激光焊接。不采用粘合技术,可以将单一的成分以机械、电机或磁性方式夹住,从而生产最终的组件。对于用于微流体应用的粘合和制造工艺的综述,参见temiz,y.,lovchik,r.,kaigala,g.v.和delamarche,e.发表于microelectronicsengineering,vol.132,pp.156-175(2015)的“lab-on-a-chipdevices:howtocloseandplugthelab”的综述(doi:10.1016/j.mee.2014.10.013)。
如本文所公开,基底上的亲水性特征被构造用于支持多个液体纳升-至-阿升液滴,每个液滴都具有最大的液滴体积。亲水性表面可以是能够保持具有最大液滴体积的液滴的任何种类。即,只要最大体积的液滴保持在亲水性特征上,亲水性特征则可以被构造用于支持这种液滴。
在本文公开的实施方案中,液滴区由亲水性特征的图案组成,其中所述的亲水性特征被疏水性介质所包围。在这种实施方案中,亲水性特征的几何形状、液体的物理/化学性质以及疏水性基底决定了最大液滴体积,其中单一的特征能够保持,使得液体不会接触周围的疏水性介质。凭实验确定最大液滴体积的一种方式是将增加量的液体沉积在初始干燥的亲水性特征上。液体沉积可以借助于自动化微分配器实施,或者在微米尺寸的特征上,可以借助于压力驱动的微操作器实施,但是应该在加湿的室中进行,这样不能发生蒸发。此外,借助于显微镜,可以测量沉积的液滴的印迹。因此,一旦测量的印迹超越亲水性特征所界定的周边,则可以达到并超过最大液滴体积。
除了实验方法,还可以由简单的理论模型评估最大液滴体积。在这种情况下,假设如下:亲水性特征为半径rd的圆形,并且当液体与疏水性介质接触时,液体展现出接触角γ,而且液滴停留在平坦的表面上,参见图5-6。进一步假设:液滴足够小,使得重力不显著地影响液滴的形状。当液体沉积在亲水性特征上时,液体将扩散至周边,并且液体将由此形成接触角α。接触角α定义为这样的角:液滴表面的切线与在周边处平坦的亲水性表面形成的角。随着液滴的体积增加,α也增加,但是仅增加到某一点。如果α超过γ,对于液滴扩散至疏水性介质上并由此超越亲水性周长在能量上则是更有利的。结果,在最大液滴体积,α等于γ,并且体积(vd)可以通过冠状球形(cappedsphere)的几何形状描述而获得:
对于足够接近90°的γ值而言,方程1可以通过假设液滴为半球冠而进一步简化,由此展现vd值为
在另一种情况下,其中亲水性特征被成型为半径rd且深度d的圆形腔,则通过将腔体积
在一个实施方案中,亲水性特征被构造用于支持纳升-至-阿升液滴,并且液体展现出在疏水性基底上的接触角为至少90°且至多150°。在一个实施方案中,亲水性特征被构造用于支持半径(rd)为至少0.1μm且至多100μm的纳升-至-阿升液滴。
尽管能够采用多种方法制造被疏水性介质包围的亲水性特征的阵列,但是最容易应用的一种方法会涉及光刻术。光刻术能够准确地生产微米尺寸的化学和/或物理结构,并且依赖于平的晶片基底(具有光敏薄膜)的涂层。在随后的步骤中,通过提供预期图案的光掩模暴露于高强度的紫外光而选择性地除去所述的薄膜。示例性制造过程的草图在图7中提供。但是,由于uv光刻术的光学分辨率,准确地生产低于0.1μm的特征在技术上仍是挑战。在其中图案化的亲水性特征为平坦的圆形并且展现rd值为0.1μm的情况下,根据方程1,对于γ值为90°而言,相应的最大液滴体积为vd=2.9阿升,并且对于γ值为150°而言,相应的最大液滴体积为vd=33.1阿升。
展现出rd值降低至0.1μm的亲水性特征可以形成高密度的阵列,在单分子数字计数的内容中,其可以转化成(i)扩大的动力学范围;以及(ii)更快速的检测时间。
扩大的动力学范围是由于以下事实:对于数字计数而言,测量中存在的液滴分隔区的数量决定了信号的线性。直到所有的液滴分隔区均产生信号,则认为该信号是线性的,即,阵列已经饱和。例如覆盖10mmx10mm的规则长方形阵列(rd值为0.1μm并且特征间间距为0.4μm)应该容纳6.25亿个液滴,由此展现出跨越大约8个数量级的线性动力学范围。
更快速的检测时间依赖于以下事实:对于数字计数而言,分子报告子通常由酶或酶偶联系统产生。在这种实施方案中,单一的酶通过将非荧光的/化学发光的/比色分子重复转化成发荧光的/发光的/吸光的物质(分子报告子)而产生信号。报告子分子的最低可检测浓度取决于液滴体积;假设恒定的酶周转率,体积越小,达到所述的浓度越快。
在另一方面中,在纳升范围内展现出更大体积的液滴(例如对于γ值为90°而言,rd值为100μm的圆形平坦的亲水性特征具有最大体积2.1纳升,而对于γ值为150°而言,rd值为100μm的圆形平坦的亲水性特征具有最大体积33.1纳升)在以下情况下是有利的:(i)其中不需要大的动力学范围,例如预计分析物浓度太低以至于不能使阵列饱和;或者(ii)其中亚纳升(sub-nanoliter)液滴不能被成像传感器分辨。
备选地,纳升体积的液滴可以用于使更大的生物实体(例如细胞、细胞碎片、病毒颗粒、囊泡、细胞器等)形成阵列并组织,然后测量。
在一个实施方案中,亲水性基底为玻璃、亲水性聚合物或金属氧化物化合物。
亲水性基底的主要要求在于液体应该在其上形成接触角,该接触角小于在疏水性基底上形成的接触角。此外,基底优选地应该顺应微制造方法,例如光刻术、软刻术或微压印。二氧化硅及其纯的和掺杂的变体是此目的的合适的选择,不仅因为其是作为光刻术的良好表征的基底,而且还因为大量化学和生物化学表面官能化方案都是可利用的。例如有广泛的市售可得的硅烷化合物(例如参见gelestinc.发表的“silanecouplingagents,version3.0”),其可以用于二氧化硅表面的直接的衍生化。尽管硅烷化对于在表面上呈现硅烷醇基团的材料(例如二氧化硅)是最高效的,但是许多其他的材料可以顺应这种工艺。这些材料包括但不限于铝、硅酸铝、硅、铜、锡、滑石、无机氧化物(例如氧化亚铁、二氧化钛、氧化铬)、钢、铁、镍和锌。
在基底的硅烷衍生化时,新的化学功能性被引入至材料中,因此,液体在官能化后的基底上展现出改变的接触角。鉴于此,最初亲水性的基底(例如玻璃)可以通过使用疏水性硅烷部分(例如氟碳硅烷)的官能化而成为疏水性的。备选地,最初轻微亲水性的基底可以通过使用高度亲水性硅烷部分(例如聚(乙二醇)硅烷)的官能化而成为甚至更高的亲水性的。这是本领域技术人员公知的,因此本文件中所指的液体/固体接触角仅涉及任何初始基底材料的任何表面改性后的液体/固体接触角。
无机基底的硅烷衍生化仅构成了将新的化学功能引入基底中的多种过程中的一种。另一种方法包括使单硫醇盐化合物吸附在金基底上,从而产生自组装的单层。而另一种方法(其顺应于软的有机基底,例如塑料)为等离子体聚合,其中所需的化学聚合物薄层沉积在由相应的单体的等离子体得到的塑料表面上。
亲水性特征的构造可涉及以下的至少一种:
·构成亲水性特征的材料的亲水性;
·构成疏水性基底的材料的疏水性;
·所述的特征的面积;以及
·所述的特征的厚度。
在一个实施方案中,最大液滴体积为通过方程1计算的vd。因此,可以提供亲水性特征,使得该体积的液滴能够保持在各个亲水性特征处。
关于如何使最大液滴体积达到单个亲水性特征的特定构造的实例,可以实施以下步骤:
1.首先,为手头上的应用选择合适的液滴体积,参见上文提及的关于液滴体积的讨论。
2.接着,针对本发明应用中施加的液体,获得固体/液体接触角γ。
3.然后,决定亲水性特征的所需几何形状,即,圆形、正方形、六角形等。所述的形状可能取决于生产图案所采用的制造过程。
4.计算由步骤3得到的特定形状的周长与相应的最大液滴体积之间的关系。在圆形的情况下,所述的关系在方程1中提供。对于其他的几何形状,所述的关系必须以与在方程1的推导中所述相似的方式推导得到。
5.获得与由步骤4中的关系得到的所选液滴的体积相对应的周长。在圆形的情况下,足以求解方程1得到rd。
在另一个实施方案中,必须确定流动分隔区(其中保留有亲水性特征的图案)的构造,以提供功能气相密封,从而减少从微米尺寸的液滴的蒸发。例如如果阿升水性液滴在环境条件下沉积在基底上,由于高的表面/体积比,液滴将在几秒内蒸发。因此,对于其中必须测量液滴内容物的应用而言,液滴必须在延长的时间内是稳定的,因此应当极大地减少或完全消除蒸发。
在本文公开的另一个实施方案中,提供了容纳亲水性特征的图案的流动分隔区,所述的亲水性特征被构造用于支持上文所述的特定最大体积的液滴,其中所述的流动分隔区展现出体积vc,并且携带液滴的亲水性图案的最大可得总体积记录为vda。如果所述的图案容纳大量的液滴(nd)(每个液滴都展现出相同的最大液滴体积(vd)),则vda=vd·nd。如果所述的图案容纳变化尺寸的液滴,则相应的vda值为:
其中vd,i为在所述的图案上第i个液滴的最大体积。因此,液体的相应的摩尔量(nda)则为:
其中mw为液体的摩尔重量,并且ρl为液体的密度。如果所有的液滴都完全蒸发,并且假设蒸发的蒸气作为理想的气体,则所得的蒸气将在流动分隔区内产生相应的蒸气压力(pvap)为:
其中r为摩尔气体常数,t为温度。然而,完全的液滴蒸发仅对于vc>>vda是可能的,这是因为在这种情况下,完全液滴蒸发所产生的蒸气量不会显著改变流动分隔区的初始蒸气压力。但是对于接近vda体积的流动分隔区体积而言,液滴蒸气会增加流动分隔区内的压力,直至饱和蒸气压力(psat)建立起来。一旦达到psat,则进一步的蒸发是不可能的。psat值(即,在热动力平衡,由液体的气体成分产生的蒸气压力)通过以下克劳修斯-克拉佩龙方程给出:
其中δhvap为所述的液体的蒸发焓,p0为在相应的参照温度t0的所述液体的参照蒸气压力。
因此,能够蒸发的液体的最大允许摩尔量(nvap)能够由以下的理想气体方程获得:
对于nvap≥nda而言,发生完全的液滴蒸发。用于最大流动分隔区体积(vmax)(即,其中液滴不完全蒸发的最大可能的流动分隔区体积)的表示方式现在可以以下获得:
因此,能够容纳功能的且长期稳定的液滴图案的任何流动分隔区都应该被构造成使得vc<vmax。
方程7中的表示方式是指平衡状态。达到平衡的途径有多种,而且可以描述为:(i)亲水性特征的图案与液体接触,从而产生液滴的图案,每个液滴最初都展现出最大可能体积;(ii)液体将从液滴蒸发,直至在流动分隔区内建立饱和压力;以及(iii)现在由于蒸发而具有减小的体积的液滴保持稳定。
重要的是,所述的图案必须与液体以合适的方式接触,从而产生功能气相密封。例如通过驱动液体塞(liquidplug)穿过所述的图案,由此使液体微液滴沉积在亲水性特征上。一旦液体塞已经与阵列上所有的特征接触,液体入口和出口必须被堵塞,从而提供封闭的环境。这可以通过多种方式取得,例如(i)通过在液滴入口和出口处安装阀;或者(ii)通过使液体流动同步,使得第一液体塞之后跟随第二塞,第一液体塞被驱动至液体出口,然后停止,第二液体塞被驱动进入液体入口,由此使用液体封闭入口和出口。按照这种方式,由液滴得到的蒸发的液体将在流动分隔区内建立饱和压力,并因此成为抗蒸发的。这将在实施例1和2中举例说明。
此外,在方程7和以下的讨论中,假设在其中制备流动系统的气相在将亲水性特征的图案与液体接触之前不包含任何蒸发的液体(即,液体的气体成分)。但是,并非总是这种情况。例如在其中液体为水并且气相为大气的情况下,空气最初可包含特定分数的水蒸气。对于大气而言,相对湿度(rh)提供相对于饱和压力的水蒸气压力,即rh=pw/psat,其中pw为大气中水蒸气的分压。如果大气的初始相对水蒸气饱和度(rhi)等于0,则空气将不具有水蒸气内容物,因此可以应用方程7。另一方面,如果rhi>0,方程7需要修改,因为更少的液滴需要蒸发以建立饱和压力,因此参见方程6:
这将转换为以下解答方式,求得vmax:
在本发明的内容中,尽可能一般地理解rhi,即,因此不仅涉及水,而且涉及任何其他的液体(参见上文定义的部分)。在这种情况下,rhi的更通常的定义为rhi=pl/psat,其中pl为施加液体的气体成分的初始蒸气压力。pl值是指其中使用流动系统然后形成液滴阵列的气相。一旦在流动分隔区内达到饱和压力,则将建立气相密封。因此,在流动分隔区内的局部,rh值将由初始值升至1,表明完全饱和以及功能气相密封。
在一个实施方案中,本文公开的流动分隔区具有体积(vc),其中体积(vc)大于所有的液体纳升-至-阿升液滴的总最大液滴体积(vda),并且小于vmax,如方程9中计算。
在本文公开的实施方案中,为了获得用于数字计数分析物的流动系统的最佳构造(在疏水性基底中或在疏水性基底上包含亲水性特征的图案),必须考虑:(i)单个亲水性特征的构造;(ii)所述的特征的图案的构造;以及(iii)其中存在图案的分隔区的构造。综上,这3种构造提供了通过气相密封能够保持液滴的抗蒸发图案的流动系统。上文已经概述了单个亲水性特征的构造。用于测定流动系统的构造的示例性接下来的步骤如下:
1)确定应用所需的液滴的总数。如上文所讨论的那样,液滴的总数决定了测量的动力学范围,因此应该与分析物的预期浓度范围匹配。
2)所述的图案的vda值现在可以由方程2计算,因此提供流动分隔区体积即vc值的下限。
3)测定所施加的液体的公称摩尔重量(mw)和体积密度(ρl),以及进行测量时的温度(t)和rhi值。对于参照温度、压力和蒸发焓使用一组合适的值,从而使用方程9计算流动分隔区体积的vmax值。例如对于水而言,在t0=373k,p0=1.0atm,其展示出δhvap值为40.7kj/mol。
4)确定亲水性特征的图案的特定排列,例如正方形晶格阵列、六角形晶格阵列、长方形晶格阵列、菱形晶格阵列等。优选的阵列几何形状通常通过制造方法测定。确定阵列的长度和宽度以容纳液滴的总数。
5)确定流动分隔区的几何形状,例如长方形通道、圆形通道、半圆形通道等。优选的阵列的几何形状通常通过制造方法测定。
6)使流动分隔区的几何形状成比例,使得总体积小于vmax。其实例在实施例2中提供。简言之,在长方形通道的情况下,总体积以通道的宽度x长度x高度给出。通道的宽度和长度应该例如与阵列的宽度和长度匹配,因此剩下高度是可变的。因此可以选择高度以提供小于vmax的总体积。
在本文公开的另一个实施方案中,提供了流动系统,其中亲水性特征为具有半径(rd)的圆形,并且其中单一亲水性圆形能够支持的最大液滴体积(vd)在方程1中提供。
在实施方案中,各个纳升-至-阿升液滴的蒸发为各个纳升-至-阿升液滴的最大液滴体积的小于50%、小于40%、小于30%、小于20%、小于10%、小于5%、小于1%。
对于流动系统的给定构造,即,指定的一组vc值和vda值,可以计算相应的蒸发的分数θvap。蒸发的分数定义为蒸发形成气相的液滴体积分数,即,θvap=nvap/nda。将方程3和方程8带入该表示中得到:
如果假设θvap值大于1,则整个液滴阵列由于例如太大的流动分隔区体积、阵列上太少的液滴、太高的温度、太小的亲水性特征等而蒸发。另一方面,如果θvap小于1,则认为气相密封因为完整的液滴(尽管展现出减小的体积)可以保持在亲水性特征上而发挥功能。
原则上,可以使用本领域技术人员已知的、能够密封液滴以抵抗蒸发的任何气体。气相密封的实例为大气、氮气、氩气或氦气或它们的混合物。在一个实施方案中,通过大气、氮气、氩气或氦气提供气相密封。在另一个实施方案中,通过大气提供气相密封。
在一个实施方案中,具有亲水性特征基底的图案的疏水性支持体是平坦的。在另一个实施方案中,亲水性特征的图案包括其中亲水性特征以阵列形式排列的至少一个区域。
在实施方案中,亲水性特征以二次平面阵列组织,所述的特征被成型为具有半径(rd)的圆形,所述的阵列在相邻的特征之间具有行距(δ),其中δ为至少3rd,所述的阵列沿流动方向延伸长度(lax),所述的阵列在垂直于流动方向上延伸长度(lay),所述的通道沿流动方向具有长度(lcx),其中lcx大于或等于lax,所述的通道在垂直于流动方向上具有长度(lcy),其中lcy大于或等于lay,所述的通道具有高度(h),其为至少2rd且至多hmax,其中hmax由以下方程计算得到:
其中根据方程1,θmax为液滴的最大允许蒸发体积分数,并且vd(rd,γ)为最大液滴体积。为了得到方程11,必须考虑方程10,其将蒸发的分数(θvap)表示为流动分隔区体积(vc)和液滴阵列的最大总体积(vda)的函数。对于展现出上文提及的几何形状的流动分隔区,流动分隔区体积为vc=hlcxlcy,而最大总液滴阵列的体积为vda=vd(rd,γ)laxlayδ-2。用于建立流动分隔区的功能构造以提供气相密封的一种方法是将液滴的最大允许蒸发体积分数设定为合适的值,例如θmax=0.05。接着,通过使流动分隔区高度作为唯一的可变参数,可以通过将vc=vmax=hmaxlcxlcy、vda和θmax带入方程10,以求得hmax,由此得到方程11中的结果,从而获得最大允许高度(hmax)。
在一个实施方案中,亲水性特征的图案包括至少2个区域,而一个区域的阵列不同于另一个区域的阵列。
在其中亲水性特征被构造用于支持不同尺寸的液滴的情况下,应该使用与图案上最小液滴体积相对应的vd值实施方程11中的hmax的计算。按照这种方式,阵列上最小和最大液滴可以保持稳定而不会蒸发超过θmax值的设定。
在一个实施方案中,用于亲水性特征的支持体位于流动分隔区的中心。
尽管在包含亲水性特征的阵列的流动分隔区中的中心位置通常是优选的,但是阵列的确切位置不影响之前计算的结果。这是由于该计算基于以下假设:在流动分隔区内建立热动力平衡,即,其中由亲水性特征支持的液体液滴得到的蒸发速率等于流动分隔区中蒸气冷凝成液滴的速率的平衡。然而,因为分隔区内蒸气的传输动力学,与分散定位的阵列相比,中心定位的阵列可以更快地达到平衡。
在一个实施方案中,亲水性特征的数量为至少1,000、至少10,000、至少100,000、至少1,000,000、至少10,000,000。
在一个实施方案中,疏水性层为与基底共价接枝的分子单层。在一个实施方案中,疏水性层为化学吸收在金属基底上的分子单层。
在一个实施方案中,流动分隔区是通道成型的,并且在流动分隔区的相对末端的2个开口之间形成流动方向。在一个实施方案中,流动分隔区和开口在垂直于流动方向的截面中具有长方形形状。在一个实施方案中,在垂直于流动方向的截面中流动分隔区具有长方形形状并且开口具有圆形。
在本文公开的一个方面中,提供了制备流动系统的方法。
为了提供对本发明的全面的理解,现在将描述某些示意性的实施方案,包括支持微液滴的阵列从而可以进行酶的selisa分析的系统。然而,本领域技术人员应该理解的是本文所述的系统和方法可以适用于以及经修改而用于其他合适的应用中,并且这种其他的加入和修改不脱离本发明的范围。
图1描绘了用于支持多个微液滴并具有降低的蒸发速率的系统的一个实施方案。具体而言,图1示出系统18,其中长方形流动分隔区容纳多个微液滴。所述的微液滴被置于流动分隔区的底表面上。流动分隔区的各个末端对周围环境开放。
图2为流动分隔区的末端的剖视图。图2示出对于这种实施方案,在高度h的形状中,末端为正方形(通过垂直的箭头描绘)。返回至图1,显示微液滴阵列的各个末端与流动分隔区的末端间隔距离le(通过双箭头显示)。
图1的流动分隔区为支持微液滴阵列的流动通道。可以使用任何已知的技术将微液滴插入流动通道中。所绘制的流动通道的维度通常可以通过图1理解,并且表征为通道的高度h,la为被液滴阵列覆盖的流动通道的长度,le为将微阵列与入口和出口分开的通道的长度(并且不支持微液滴阵列的任何部分)。考虑到流动通道的长度、高度和形状,可以计算流动通道的体积。一种此类计算的细节在实施例2中列出。
各个液滴基本上都是半球形的,并且可以模制成这样。半球形的液滴具有半径。滴基本上以标准的行距间隔开。虚线可以是线性阵列、正方形阵列或任何其他合适的排列。当然可以评估微液滴的阵列中所包含的液体的全部总体积(作为半径和液滴数量的函数)。一种此类计算的细节在实施例2中列出。
一旦已知流动通道的几何形状,便可以计算可利用的体积。体积和平衡水蒸气压力(pw)决定将蒸发的水量,如克劳修斯-克拉佩龙方程所述。一种此类计算的细节在实施例2中列出。因为蒸气压力是通过从液滴蒸发的水产生的,由此使流动通道中的空气潮湿并饱和。结果,如果仅总液滴体积的一小部分便足以建立平衡蒸气压力,则剩余的水体积将作为液滴保存在表面上。按照这种方式,潮湿的空气提供了气相密封,如图3所示(通过包围微液滴的虚线显示)。
针对溶液的某一体积,通过选择例如特定的高度h,蒸发的水量可以保持在大约5%,如图11b所示。
建立气相密封的过程示于图4的显微照片中。在此,水塞从流动通道的一个末端驱动到另一个末端,留下良好界定的微米尺寸的水性液滴。在显微照片的左侧可以看见后退的水边(water-front),并且可以在水边的右侧看见液滴的阵列。黑色箭头表明其中液体被驱动的方向。
应用
本文所述的发明具有许多可能的应用,这是本领域那些技术人员已知的,例如参见witters等人的digitalbiologyandchemistry(doi:10.1039/c4lc00248b,(frontier)labonachip,2014,14,pp.3225-3232)。这些包括一类测定法,我们称其为单酶联分子分析(selma)。基于selma的测定法依赖于单一肽、蛋白质和/或寡核苷酸分子的操作和检测。
在一个方面中,本文公开的流动系统可以用于数字计数至少一种或多种不同的分析物类型的方法中。
基于selma的测量为数字计数测定法,其中分析物固定化在气相密封的液滴内部,并且其中分析物在一个或多个步骤中依次使用酶缀合的试剂进行标记。由于液滴的纳升-至-阿升级体积,单一的酶通过检测试剂的连续酶转化能够在几秒至几分钟内产生可检测的光学信号。在图9中提供关于示例性基于selma的测量的草图,并且在实施例4中描述selma的实验证明。
在本文公开的一个方面中,提供了用于数字计数至少一种或多种不同的分析物类型的方法,该方法包括在气相密封下,计数在多个液体纳升-至-阿升液滴中所包含的分析物类型。
在本文公开的实施方案中,气相密封在流动分隔区内建立能够减少微液滴的蒸发的蒸气压力。
在本文公开的实施方案中,在流动系统中实施数字计数,所述的流动系统包括:在疏水性基底中或疏水性基底上具有亲水性特征的图案的支持体,所述的疏水性基底嵌入在包含至少一个开口的流动分隔区中,所述的亲水性特征被构造用于支持多个纳升-至-阿升液滴。
在本文公开的实施方案中,亲水性特征为具有半径(rd)的圆形,并且其中单一亲水性圆形能够支持的最大液滴体积(vd)如下:
其中γ为在疏水性基底上的液体接触角。
在本文公开的实施方案中,气相密封将各个纳升-至-阿升液滴的蒸发减少至最大液滴体积的小于50%。
在本文公开的实施方案中,本发明所述的流动系统用于本文公开的方法中。
本领域技术人员至多使用常规的试验,便知道或者能够弄清楚本文所述的实施方案和实践的多种等价物。
因此,应该理解的是本发明不限于本文公开的实施方案,而且通过所附权利要求可以理解本发明,其中所述的权利要求可以解释为在法律规定下是广泛允许的。
特别地,本发明涉及以下编号项:
编号项1.用于数字计数分析可能包含至少一种分析物的样品的方法,其中所述的样品已经与具有多个离散捕获位点的固相接触,每个位点能够捕获所述的至少一种分析物,该方法包括至少两个检测循环,其中每个检测循环包括以下步骤:
a)触发来自被捕获的和标记的分析物的信号,
b)记录显示来自所述的被捕获的和标记的分析物的信号的捕获位点的数量和位置,
c)并且在执行进一步的检测循环之前,使信号失活。
编号项2.根据编号项1的方法,其中所述的样品和所述的具有多个离散捕获位点的固相在捕获所述的至少一种分析物之前或期间被分隔。
编号项3.根据编号项1的方法,其中被捕获的分析物和标记试剂在标记所述的至少一种分析物之前或期间被分隔。
编号项4.根据编号项1-3中任一项所述的方法,其中通过在步骤a)之前的每个检测循环中的标记步骤中添加标记试剂来标记所述的分析物。
编号项5.根据编号项1-4中任一项所述的方法,其中通过在所述的固相上捕获所述的分析物之前或期间在标记步骤中添加标记试剂来标记所述的被捕获的分析物,并且其中在执行进一步的检测循环之前进行步骤c)然后进行重新标记步骤,其中通过添加标记试剂来标记所述的被捕获的分析物。
编号项6.根据编号项1-5中任一项所述的方法,其中将所述的被捕获的和标记的分析物分隔以产生包含至少一种分析物的液体分隔区。
编号项7.用于数字计数分析可能包含至少一种分析物的样品的方法,其中所述的样品已经与具有多个离散捕获位点的固相接触,每个位点能够捕获所述的至少一种分析物,所述的方法包括至少两个检测循环,其中每个检测循环包括通过添加标记试剂来标记所述的至少一种分析物并将所述的至少一种被捕获的和标记的分析物分隔以产生含有至少一种分析物的液体分隔区的步骤,然后是步骤a)-c):
a)触发来自所述的被捕获的和标记的分析物的信号,
b)记录显示来自所述的被捕获的和标记的分析物的信号的捕获位点的数量和位置,
c)并且在执行进一步的检测循环之前,使信号失活。
编号项8.用于数字计数分析可能包含至少一种分析物的样品的方法,其中所述的样品已经与具有多个离散捕获位点的固相接触,每个位点能够捕获所述的至少一种分析物,其中通过在所述的固相上捕获所述的至少一种分析物之前或期间在标记步骤中添加标记试剂来标记所述的至少一种分析物,所述的方法包括至少两个检测循环,其中将所述的至少一种被捕获的和标记的分析物分隔以产生包含至少一种分析物的液体分隔区,然后是步骤a)-c):
a)触发来自所述的被捕获的和标记的分析物的信号,
b)记录显示来自所述的被捕获的和标记的分析物的信号的捕获位点的数量和位置,
c)并且在执行进一步的检测循环之前,使信号失活,
在执行进一步的检测循环之前进行步骤c)然后进行重新标记步骤,其中通过添加标记试剂来标记所述的至少一种被捕获的分析物。
编号项9.根据前述编号项中任一项所述的方法,其中所述的分析是单分子数字计数分析。
编号项10.根据前述编号项中任一项所述的方法,用于在样品的单分子数字计数分析中减少假阳性检测和/或背景噪声。
编号项11.根据前述编号项中任一项所述的方法,其中所述的样品包含或可能包含靶分析物和非靶化合物,其中所述的靶分析物被所述的捕获位点捕获的捕获效率为c1,其中所述的非靶化合物被所述的捕获位点捕获的捕获效率为c2并且c1≥c2,其中所述的靶分析物由第一标记试剂标记的标记效率为l1,其中所述的非靶化合物由第一标记试剂标记的标记效率为l2并且l1≥l2,其中调整检测循环数nc使得比率
编号项12.根据编号项11的方法,其包括假阳性检测循环,其中在所述的标记步骤中应用第二标记试剂代替所述的第一标记试剂,其中所述的非靶化合物由所述的第二标记试剂标记的标记效率为l1,其中所述的靶分析物由所述的第二标记试剂标记的标记效率为l2并且l1≥l2。
编号项13.根据编号项12的方法,其中在所述的样品中存在的非靶化合物的数量是从在所述的假阳性检测循环中显示信号的捕获位点的数量估计的。
编号项14.根据编号项13的方法,其中在所述的样品中存在的靶分析物的数量是从在所述的假阳性检测循环之前的所有检测循环中重复显示信号的捕获位点的数量和从在所述的样品中存在的非靶化合物的估计数量估计的。
编号项15.根据前述编号项中任一项所述的方法,其中至多99%,例如至多95%,例如至多90%,例如至多85%,例如至多80%,例如至多75%,例如至多70%,例如至多65%的液体分隔区包含被捕获的和标记的分析物。
编号项16.根据前述编号项中任一项所述的方法,其包括假阳性检测循环,其中该方法不包括任何标记步骤。
编号项17.根据前述编号项中任一项所述的方法,其中所述的标记试剂包括检测模块,并且其中所述的触发信号的步骤是通过将检测试剂递送到所述的检测模块。
编号项18.根据前述编号项中任一项所述的方法,其中所述的检测循环包括在触发来自所述的至少一种被捕获的和标记的分析物的信号之前随后除去未标记所述的分析物的标记试剂的步骤。
编号项19.根据前述编号项中任一项所述的方法,其中从所述的被捕获的分析物或所述的被捕获的和标记的分析物除去未结合的样品组分。
编号项20.根据前述编号项中任一项所述的方法,其中所述的使信号失活的步骤选自
a)从所述的被捕获的分析物脱离所述的标记试剂,
b)使所述的标记试剂促进信号的能力失活,或者
c)a)和b)的组合,
并且其中使信号失活的步骤任选地然后进行漂洗步骤。
编号项21.根据前述编号项中任一项所述的方法,其中从所述的样品中捕获所述的至少一种分析物是通过固定化在所述的固相上。
编号项22.根据前述编号项中任一项所述的方法,其中从所述的样品中捕获所述的至少一种分析物是通过使用一种或多种对所述的分析物具有特异性的捕获探针并且其中所述的捕获探针附着于所述的固相。
编号项23.根据前述编号项中任一项所述的方法,其中使用第一数量和第二数量的检测循环,并且其中所述的第一数量的检测循环使用与所述的第二数量的检测循环不同的标记剂。
编号项24.根据前述编号项中任一项所述的方法,其中用于一种或多种不同分析物类型的一种或多种不同捕获探针附着于所述的固相。
编号项25.根据前述编号项中任一项所述的方法,其中一种或多种不同的标记试剂用于标记一种或多种不同的分析物类型。
编号项26.根据前述编号项中任一项所述的方法,其中所述的检测循环的数量为至少3个循环,至少4个循环,至少5个循环,至少6个循环,至少7个循环,至少8个循环,至少9个循环或至少10个循环。
编号项27.根据前述编号项中任一项所述的方法,其中所述的检测循环的数量为3-20个循环,3-15个循环,3-10个循环,3-9个循环,3-8个循环,3-7个循环,3-6个循环或3-5个循环。
编号项28.根据前述编号项中任一项所述的方法,其中通过从所述的被捕获的分析物脱离而使所述的标记试剂失活并通过冲洗除去。
编号项29.根据前述编号项中任一项所述的方法,其中所述的使信号失活的步骤在所述的多个液体分隔区中进行。
编号项30.根据前述编号项中任一项所述的方法,其中通过从所述的被捕获的分析物脱离来使所述的标记试剂失活并且其中所述的脱离是通过酶促切割。
编号项31.根据前述编号项中任一项所述的方法,其中通过从所述的被捕获的分析物脱离来使所述的标记试剂失活并且其中所述的脱离是通过调节ph、调节离子强度、添加变性盐或添加洗涤剂的化学裂解或解吸。
编号项32.根据前述编号项中任一项所述的方法,其中通过从所述的被捕获的分析物脱离来使所述的标记试剂失活并且其中所述的脱离是通过加热。
编号项33.根据前述编号项中任一项所述的方法,其中通过改变其化学或物理状态使所述的标记试剂失活。
编号项34.根据前述编号项中任一项所述的方法,其中所述的标记试剂包括酶并且其中通过对活性位点的化学或生物化学修饰来改变所述的酶的状态。
编号项35.根据前述编号项中任一项所述的方法,其中所述的标记试剂包括酶并且其中通过对所述的酶的三级结构的化学或物理破坏来改变所述的酶的状态。
编号项36.根据前述编号项中任一项所述的方法,其中通过在所述的多个离散捕获位点上引入和收回亲水性液体,将所述的被捕获的和标记的分析物分隔以产生容纳所述的被捕获的和标记的分析物的液体分隔区,其中每个离散捕获位点被赋予亲水性并且其中所述的多个离散捕获位点放置在疏水性基底上,使得在收回亲水性液体时形成多个液体液滴并且每个液滴占据一个离散捕获位点。
编号项37.根据前述编号项中任一项所述的方法,其中通过在所述的多个离散捕获位点上引入第一亲水液体,然后用第二液体替换所述的第一亲水液体,将所述的被捕获的和标记的分析物分隔以产生容纳分析物的液体分隔区,其中所述的两种液体是不混溶的并且其中所述的第二种液体比所述的第一种液体更轻,并且其中每个离散捕获位点被赋予亲水性,并且所述的多个离散的捕获位点被放置在疏水性基底上,使得在用所述的第二液体替换所诉的第一亲水液体时,形成包含所述的第一亲水性液体的多个液体液滴并且每个液滴占据一个离散捕获位点。
编号项38.根据前述编号项中任一项所述的方法,其中通过将第一液体引入所述的多个离散捕获位点,将所述的被捕获的和标记的分析物分隔以产生容纳分析物的液体分隔区,其中每个离散捕获位点是孔形状或毛细管形状,并且其中所述的第一液体被所述的第二液体替换,其中所述的两种液体是不混溶的并且所述的第二液体比所述的第一液体更轻,使得在替换所述的第一液体时,形成包括所述的第一液体的多个液体液滴并且每个液滴占据一个离散的捕获位点。
编号项39.根据前述编号项中任一项所述的方法,其中通过将液体引入所述的多个离散捕获位点,将所述的被捕获的和标记的分析物分隔以产生容纳分析物的液体分隔区,其中每个离散捕获位点是孔形状或毛细管形状,并且其中所述的液体被分配到所述的离散捕获位点,使得每个液体分隔区占据一个离散捕获位点。
编号项40.根据前述编号项中任一项所述的方法,其中通过将液体引入所述的多个离散捕获位点,将所述的被捕获的和标记的分析物分隔以产生容纳分析物的液体分隔区,其中每个离散捕获位点是孔形状,并且其中通过在所述的多个捕获位点上施加盖子来替换所述的液体,使得形成多个液体液滴并且每个液滴占据由所述的盖子限定的一个孔形状的捕获位点。
编号项41.根据前述编号项中任一项所述的方法,其中通过引入包含所述的多个离散捕获位点和所述的被捕获的和标记的分析物的第一液体到第二液体,将所述的被捕获的和标记的分析物分隔以产生容纳所述的被捕获的和标记的分析物的液体分隔区,其中所述的第二液体与所述的第一液体不混溶,使得形成由所述的第一液体组成并被所述的第二液体包围的多个乳液液滴,并且其中每个乳液液滴包含至少一个离散液体捕获位点和至少一个被捕获的和标记的分析物。
编号项42.根据前述编号项中任一项所述的方法,其中将在每个检测循环中显示信号的液体分隔区的位置与在其他检测循环中显示信号的液体分隔区的位置进行比较,使得计数液体分隔区显示信号的连续检测循环的数量,并且其中液体分隔区被分类为至少两个类别,所述的第一类别的液体分隔区显示出比所述的第二类别更多的计数。
编号项43.根据编号项42的方法,其中应用在连续检测循环中重复显示信号的液体分隔区的数量以计算在所述的样品中靶分析物的浓度。
编号项44.根据前述编号项中任一项所述的方法,其中所述的离散捕获位点的数量为至少1,000、优选地至少10,000、优选地至少100,000、优选地至少1,000,000、优选地至少10,000,000。
编号项45.根据前述编号项中任一项所述的方法,其中所述的离散捕获位点是圆形或球形并且其中所述单独离散位点的直径小于1mm、优选地小于100μm、优选地小于10μm、优选地小于1μm。
编号项46.根据前述编号项中任一项所述的方法,其中所述的离散捕获位点是圆形或球形并且其中所述的离散位点的直径为0.5-5μm、0.5-10μm、0.5-50μm、0.5-100μm、10-1000μm、50-1000μm、100-1000μm。
编号项47.根据前述编号项中任一项所述的方法,其中所述的离散捕获位点是二次的并且其中所述的单独离散位点的长度小于1mm、优选地小于100μm、优选地小于10μm、优选地小于1μm。
编号项48.根据前述编号项中任一项所述的方法,其中所述的离散捕获位点是二次的并且其中所述的离散位点的长度为0.5-5μm、0.5-10μm、0.5-50μm、0.5-100μm、10-1000μm、50-1000μm、100-1000μm。
编号项49.根据前述编号项中任一项所述的方法,其中所述的固相为
a)固体基底,
b)胶体珠子,或
c)胶体珠子的集合。
编号项50.根据前述编号项中任一项所述的方法,其中所述的液体分隔区在气相密封下是多个液体纳升-至-阿升液滴的形式。
编号项51.根据前述编号项中任一项所述的方法,其中所述的液体分隔区占据孔形捕获位点、腔形捕获位点或毛细管形捕获位点。
编号项52.根据前述编号项中任一项所述的方法,其中所述的液体分隔区是多个油包水乳液液滴的形式。
编号项53.根据前述编号项中任一项所述的方法,其中所述的液体分隔区在水不混溶的液相下是多个液体纳升-至-阿升液滴的形式。
编号项54.根据前述编号项中任一项所述的方法,其中所述的数字计数在用于数字计数样品中的一种或多种分析物类型的流动系统(10)中执行,所述的流动系统包含:在疏水性基底(16)中或在疏水性基底(16)上具有亲水性特征(14)的图案的支持体(12),所述的疏水性基底(16)嵌入在包含至少一个开口(20)的流动分隔区(18)中,所述的亲水性特征(14)被构造用于支持多个液体纳升-至-阿升液滴,其中每个所述的液滴都具有最大液滴体积,并且所述的流动分隔区(18)被构造用于支持减少各个纳升-至-阿升液滴的蒸发的气相密封。
编号项55.根据编号项54所述的方法,其中所述的气相密封在所述的流动系统内建立能够减少所述的微液滴的蒸发的蒸气压力。
编号项56.根据编号项54-55中任一项所述的方法,其中所述的气相密封减少每个纳升-至-阿升液滴的蒸发至小于最大液滴体积的50%。
编号项57.根据编号项54-56中任一项所述的方法,其包括以下步骤:(i)将在所述的疏水性基底(16)中或在所述的疏水性基底(16)上的亲水性特征(14)的图案与包含所述的一种或多种分析物类型的样品接触。
编号项58.根据编号项54-57中任一项所述的方法,其包括以下步骤:(ii)在所述的亲水性特征(14)上捕获所述的一种或多种分析物类型。
编号项59.根据编号项54-58中任一项所述的方法,其包括以下步骤:(iii)使用对待检测的分析物类型具有特异性的标记试剂标记所述的至少一种被捕获的分析物类型。
编号项60.根据编号项54-59中任一项所述的方法,其中将所述的被捕获的和标记的分析物分隔以产生容纳至少一种分析物的液体分隔区,通过以下步骤:(iv)使检测试剂流动穿过所述的图案并从所述的图案收回,从而产生纳升-至-阿升液滴形式的单独液滴。
编号项61.根据编号项54-60中任一项所述的方法,其包括以下步骤:(v)计数容纳所述的标记和检测试剂的液滴的数量。
编号项62.根据编号项54-61中任一项所述的方法,其包括一次或多次重复步骤(iii)、(iv)和(v)。
编号项63.根据编号项54-62中任一项所述的方法,其包括通过使用对待检测的第二分析物类型具有特异性的第二标记试剂代替所述的第一标记试剂来重复步骤(iii)、(iv)和(v)。
编号项64.根据编号项54-63中任一项所述的方法,其包括使在之前的步骤中存在的所述的标记试剂失活的步骤,然后重复步骤(iii)、(iv)和(v)。
编号项65.根据编号项54-64中任一项所述的方法,其中通过从所述的被捕获的分析物脱离使所述的标记试剂失活并通过冲洗所述的流动系统除去。
编号项66.根据前述编号项中任一项所述的方法,其中所述的标记试剂包括酶和特异性分析物识别部分,并且所述的分析物识别部分选自以下分子:寡核苷酸、蛋白质、肽、适体、抗体、其复合物或其合成变体。
编号项67.根据前述编号项中任一项所述的方法,其中所述的离散捕获位点是亲水性特征。
编号项68.根据前述编号项中任一项所述的方法,其中用于一种或多种不同分析物类型的一种或多种捕获探针(22)附着于所述亲水性特征(14)。
编号项69.根据前述编号项中任一项所述的方法,包括附着于所述的亲水性特征(14)的多于一种类型的捕获探针(22),并且其中所述的不同类型的捕获探针(22)排列在区域(24)中。
编号项70.根据前述编号项中任一项所述的方法,其中所述的捕获探针(22)选自以下探针:寡核苷酸、适体、蛋白质、抗体、肽或它们的合成变体。
编号项71.根据前述编号项中任一项所述的方法,其中通过完全浸没使包含液体中的所述的一种或多种分析物类型的样品与包含所述的亲水性特征(14)的基底接触。
编号项72.根据前述编号项中任一项所述的方法,其中通过使包含用于所述的分析物的标记试剂的溶液通过完全浸没与所述的被捕获的分析物接触来执行标记。
编号项73.根据前述编号项中任一项所述的方法,其中所述的分析物选自以下分析物:单链寡核苷酸、双链寡核苷酸复合物、蛋白质、蛋白质/寡核苷酸复合物、蛋白质/脂质复合物、肽、外泌体、病毒颗粒、病毒样颗粒、纳米颗粒、细胞碎片或细胞。
编号项74.根据前述编号项中任一项所述的方法,其中所述的样品选自以下样品:血液、血浆、血清、尿、唾液、脑脊液、泪液或组织。
编号项75.根据前述编号项中任一项所述的方法,其中所述的样品选自以下样品的实验室处理的样品:血液、血浆、血清、尿、唾液、脑脊液、泪液或组织。
编号项76.根据前述编号项中任一项所述的方法,其中所述的数字计数分析涉及单分子检测和定量。
编号项77.根据前述编号项中任一项所述的方法,其中所述的被捕获的分析物与随后用于捕获的所述的捕获探针(22)共价偶联。
编号项78.根据前述编号项中任一项所述的方法,其中所述的捕获探针是寡核苷酸或合成的寡核苷酸,所述的分析物是寡核苷酸或包含寡核苷酸的分子复合物,其中所述的分析物通过与所述的捕获探针序列互补的序列与所述的捕获探针结合并且其中所述的共价交联是通过使用链间交联试剂实施的,所述的链间交联试剂例如铂络合物、丝裂霉素c、氮芥、补骨脂素或醛。
编号项79.根据前述编号项中任一项所述的方法,其中所述的捕获探针是蛋白质、适体、肽或其合成变体,所述的分析物是蛋白质、肽或包含蛋白质或肽的复合物,所述的分析物通过对所述的分析物的特定区域的结构识别与所述的捕获探针结合并且其中所述的共价交联是通过使用化学固定剂实施的,所述化学固定剂例如甲醛、戊二醛、四氧化锇、甲基乙二醛或乙酸铀酰。
编号项80.根据前述编号项中任一项所述的方法,其中所述的捕获探针是合成的寡核苷酸,其中所述的合成修饰并入对所述的分析物具有反应性的化学基团,使得能够在分析物和随后进行捕获的捕获探针之间建立共价连接。
编号项81.根据编号项80所述的方法,其中通过使所述的分析物/捕获探针-复合物与化学试剂接触来触发分析物和捕获探针之间的共价连接。
编号项82.根据编号项80所述的方法,其中通过使所述的分析物/捕获探针-复合物与电磁辐射接触来触发分析物和捕获探针之间的共价连接。
编号项83.根据前述编号项中任一项所述的方法,其中所述的数字计数测量包括单酶联分子分析(selma)、数字聚合酶链式反应(dpcr)、单酶联免疫吸附测定法(selisa)或者数字单酶联免疫吸附测定法(delisa)。
编号项84.根据前述编号项中任一项所述的方法,其中所述的至少一种分析物是寡核苷酸,其中所述的寡核苷酸的序列是基因组序列或具有一个或多个碱基对变化的转录的基因组序列,所述的碱基对变化是例如单核苷酸多态性、插入或缺失,并且其中所述的样品可能包含多于一种的非靶寡核苷酸,所述的非靶寡核苷酸具有与所述的靶标相同的基因组序列或转录的基因组序列,但没有所述的一个或多个碱基对变化。
编号项85.根据前述编号项中任一项所述的方法,其中所述的样品包含第一和第二分析物类型,其中所述的第一分析物类型具有第一序列和在所述样品中的第一浓度,其中所述的第二分析物类型具有第二序列和在所述样品中的第二浓度,其中所述的第一和第二序列是不同的,其中所述的第一和第二序列是基因组序列或转录的基因组序列,并且其中根据前述编号项中任一项,测量所述的第一和第二浓度并且将其相互比较以识别拷贝数变化。
编号项86.根据前述编号项中任一项所述的方法,其中所述的气相由大气提供,并且其中所述的捕获探针选自单链dna寡聚体、单链锁核酸寡聚体或者单链肽核酸寡聚体,其中不同类型的捕获探针排列在区域中,其中所述的分析物是从加工的血液样品中提取的单链dna,其中所述的标记试剂包含检测模块和识别部分,其中所述的检测模块是酶并且所述的识别部分选自单链dna寡聚体、单链锁核酸寡聚体或单链肽核酸寡聚体。
编号项87.具有多个离散捕获位点的固相的用途,每个位点能够在根据前述编号项中任一项所述的方法中捕获所述的至少一种分析物。
编号项88.具有多个离散捕获位点的固相的用途,每个位点能够在根据前述编号项中任一项所述的方法中捕获所述的至少一种分析物,用于减少数字计数分析中的计数误差,例如减少假阳性检测和/或减少背景噪音
编号项89.具有多个离散捕获位点的固相的用途,每个位点能够捕获所述的至少一种分析物,用于通过执行编号项1-86中任一项所定义的至少两个检测循环来减少计数误差,例如在数字计数分析中减少假阳性检测和/或减少背景噪声。
本发明的其他的具体的实施方案
用于将体积为皮升或更小的微液滴适当地保持在基底上和液相中的方法,其包括将微液滴置于具有至少一个开口的通道内,将所述的通道的体积设定为在该通道内建立能够减少微液滴的蒸发的蒸气压力的值。
本发明进一步涉及以下实施方案:
实施方案1.用于数字计数样品中一种或多种分析物类型的流动系统,包含:在疏水性基底中或在疏水性基底上具有亲水性特征的图案的支持体,所述的疏水性基底嵌入在包含至少一个开口的流动分隔区中,所述的亲水性特征被构造用于支持多个液体纳升-至-阿升液滴,其中每个所述的液滴都具有最大液滴体积,以及所述的流动分隔区被构造用于支持减少各个纳升-至-阿升液滴的蒸发的气相密封。
实施方案2.根据实施方案1所述的流动系统,其中所述的流动分隔区具有体积(vc),其中所述的体积(vc)大于所有的液体纳升-至-阿升液滴的总最大液滴体积(vda),并且小于通过以下方程计算的vmax:
其中ρl为所述的液体的体积密度,r为摩尔气体常数,t为温度,rhi为所述的液体的气体成分的初始相对蒸气饱和度,p0为在相应的参照温度t0的所述液体的参照蒸气压力,mw为所述的液体的摩尔重量,并且δhvap为所述的液体的蒸发焓。
实施方案3.根据实施方案1-2中任一项所述的流动系统,其中所述的亲水性特征为具有半径(rd)的圆形,并且其中所述的单一亲水性圆形能够支持的最大液滴体积(vd)如下:
其中γ为在所述的疏水性基底上的液体接触角。
实施方案4.根据上述实施方案中任一项所述的流体系统,其中所述的各个纳升-至-阿升液滴的蒸发为所述的各个纳升-至-阿升液滴的最大液滴体积的小于50%、小于40%、优选地小于30%、优选地小于20%、优选地小于10%、优选地小于5%、优选地小于1%。
实施方案5.根据上述实施方案中任一项所述的流体系统,其中所述的气相密封是通过大气、氮气、氩气和/或氦气构成的。
实施方案6.根据上述实施方案中任一项所述的流体系统,其中所述的气相密封是通过大气构成的。
实施方案7.用于数字计数样品中一种或多种不同的分析物类型的流动系统,包含:在疏水性基底中或在疏水性基底上具有亲水性特征的图案的支持体,所述的疏水性基底嵌入在包含至少一个开口的流动分隔区中,所述的亲水性特征被构造用于支持多个液体纳升-至-阿升液滴。
实施方案8.根据上述实施方案中任一项所述的流体系统,其包含重叠在所述的液滴区的一个或多个流动分隔区,从而能够使液滴与所述的亲水性/疏水性图案接触。
实施方案9.根据上述实施方案中任一项所述的流体系统,其包含一个或多个液体加载垫,用于使用液体和反应剂供入所述的流动系统。
实施方案10.根据上述实施方案中任一项所述的流体系统,其包含连接所述的流动分隔区和所述的液体加载垫的液体入口。
实施方案11.根据上述实施方案中任一项所述的流体系统,其中液体是通过由所述的入口至所述的出口的压力下降的手段而驱动穿过所述的流动通道。
实施方案12.根据上述实施方案中任一项所述的流体系统,其包含连接所述的流动通道和压力源从而提供抽吸的液体出口,并因此介导液体驱动通过所述的流动通道。
实施方案13.根据上述实施方案中任一项所述的流体系统,其中所述的气相密封是通过大气、氮气、氩气和/或氦气构成的。
实施方案14.根据上述实施方案中任一项所述的流体系统,其中所述的气相是通过大气构成的。
实施方案15.根据上述实施方案中任一项所述的流体系统,其包含用于一种或多种不同的分析物类型的至少一种捕获探针,所述的捕获探针附着在所述的亲水性特征上。
实施方案16.根据上述实施方案中任一项所述的流体系统,其中所述的不同类型的捕获探针排列在区域中。
实施方案17.根据上述实施方案中任一项所述的流体系统,其中所述的支持体是平坦的。
实施方案18.根据上述实施方案中任一项所述的流体系统,其中所述的亲水性特征是平坦的。
实施方案19.根据上述实施方案中任一项所述的流体系统,其中所述的亲水性特征的图案包含其中所述的亲水性特征以阵列排列的至少一个区域。
实施方案20.根据上述实施方案中任一项所述的流体系统,其中所述的亲水性特征以二次平面阵列组织,所述的特征被成型为具有半径(rd)的圆形,所述的阵列在相邻的特征之间具有行距(δ),其中δ为至少3rd,所述的阵列沿流动方向延伸长度(lax),所述的阵列在垂直于流动方向上延伸长度(lay),所述的通道沿流动方向具有长度(lcx),其中lcx大于或等于lax,所述的通道在垂直于流动方向上具有长度(lcy),其中lcy大于或等于lay,所述的通道具有高度(h),其为至少2rd且至多hmax,其中hmax由以下方程计算得到:
其中γ为与所述的疏水性材料的液体接触角,θmax为所述的液滴的最大允许蒸发体积分数,ρl为所述的液体的体积密度,r为摩尔气体常数,t为温度,rhi为所述的液体的气体成分的初始相对蒸气饱和度,p0为在相应的参照温度t0的所述液体的参照蒸气压力,mw为所述的液体的摩尔重量,并且δhvap为所述的液体的蒸发焓。
实施方案21.根据上述实施方案中任一项所述的流体系统,其中所述的亲水性特征的图案包含至少2个区域,并且其中所述的一个区域的阵列与另一个区域的阵列不同。
实施方案22.根据上述实施方案中任一项所述的流体系统,其中支持所述的亲水性特征的区域位于所述的流动分隔区内的中心。
实施方案23.根据上述实施方案中任一项所述的流体系统,其中亲水性特征的数量为至少1,000、优选为至少10,000、优选为至少100,000、优选为至少1,000,000、优选为至少10,000,000。
实施方案24.根据上述实施方案中任一项所述的流体系统,其中所述的流动分隔区是通道成型的,并且在所述的分隔区的相对末端的2个开口之间形成流动方向。
实施方案25.根据实施方案13所述的流动系统,其中所述的流动分隔区和所述的开口在与流动方向垂直的截面中具有长方形形状。
实施方案26.根据实施方案13所述的流动系统,其中所述的流动分隔区具有长方形形状,并且所述的开口在与流动方向垂直的截面中具有圆形形状。
实施方案27.根据上述实施方案中任一项所述的流体系统,其中所述的亲水性特征被构造用于支持所述的纳升-至-阿升液滴,并且其中所述的液滴在所述的疏水性基底上展现出接触角为至少90°且最大150°。
实施方案28.根据上述实施方案中任一项所述的流体系统,其中所述的亲水性特征被构造用于支持半径为至少0.1μm且最大100μm的纳升-至-阿升液滴。
实施方案29.根据上述实施方案中任一项所述的流体系统,其中所述的亲水性基底是玻璃、亲水性聚合物或金属氧化物化合物。
实施方案30.根据上述实施方案中任一项所述的流体系统,其中所述的疏水性层为与所述的基底共价接枝的分子单层。
实施方案31.根据上述实施方案中任一项所述的流体系统,其中所述的疏水性层是化学吸收在金属基底上的分子单层。
实施方案32.根据上述实施方案中任一项所述的流体系统,其中所述的一种或多种被捕获的分析物与随后用于捕获的所述的捕获探针形成共价交联或偶联。
实施方案33.根据上述实施方案中任一项所述的流体系统,其中所述的捕获探针为寡核苷酸或合成的寡核苷酸,所述的分析物为寡核苷酸或包含寡核苷酸的分子复合物,其中所述的分析物为通过与所述的捕获探针序列互补的序列而与所述的捕获探针结合,并且其中所述的共价交联是通过使用链间交联试剂实施的,所述的链间交联试剂例如铂络合物、丝裂霉素c、氮芥、补骨脂素或醛。
实施方案34.根据上述实施方案中任一项所述的流体系统,其中捕获探针为蛋白质、肽或它们的合成变体,所述的分析物为蛋白质、肽或者包含蛋白质或肽的复合物,所述的分析物为通过对所述的分析物特定区域的结构识别而与所述的捕获探针结合,并且其中所述的共价交联是通过使用化学固定试剂实施的,所述的化学固定试剂例如甲醛、戊二醛、四氧化锇或乙酸铀酰。
实施方案35.根据上述实施方案中任一项所述的流体系统,其中所述的数字计数为数字计数测量。
实施方案36.根据上述实施方案中任一项所述的流体系统,其中所述的数字计数测量为单酶联分子分析(selma)、数字聚合酶链式反应(dpcr)、单酶联免疫吸附测定法(selisa)或者数字单酶联免疫吸附测定法(delisa)。
实施方案37.制备上述实施方案中任一项所定义的流动系统的方法。
实施方案38.使用上述实施方案中任一项所定义的流动系统用于数字计数至少一种或多种不同的分析物类型的方法。
实施方案39.用于数字计数至少一种或多种不同的分析物类型的方法,所述的方法包括在气相密封下计数在多个液体纳升-至-阿升液滴中所包含的所述的分析物类型。
实施方案40.根据实施方案39所述的方法,其中所述的气相密封在所述的流动系统内建立能够减少所述的微液滴的蒸发的蒸气压力。
实施方案41.根据实施方案39-40中任一项所述的方法,其中所述的数字计数是在流动系统中实施的,其中所述的流动系统包含:在疏水性基底中或在疏水性基底上具有亲水性特征的图案的支持体,所述的疏水性基底嵌入在包含至少一个开口的流动分隔区中,所述的亲水性特征被构造用于支持多个液体纳升-至-阿升液滴。
实施方案42.根据实施方案39-41中任一项所述的方法,其中所述的亲水性特征为具有半径(rd)的圆形,并且其中所述的单一亲水性圆形能够支持的最大液滴体积(vd)如下:
其中γ为在所述的疏水性基底上的液体接触角。
实施方案43.根据实施方案39-42中任一项所述的方法,其中所述的液相密封将各个纳升-至-阿升液滴的蒸发减少至所述的最大液滴体积的小于50%。
实施方案44.根据实施方案39-43中任一项所述的方法,其中所述的流动系统如实施方案1-36中任一项定义。
实施方案45.根据实施方案39-44中任一项所述的方法,其进一步包括以下步骤:(i)将疏水性基底中或疏水性基底上的亲水性特征的图案与包含一种或多种所述的分析物类型的样品接触。
实施方案46.根据实施方案39-45中任一项所述的方法,其包括以下步骤:(ii)在所述的亲水性特征上捕获至少一种分析物类型。
实施方案47.根据实施方案39-46中任一项所述的方法,其包括以下步骤:(iii)使用对待检测的分析物类型具有特异性的标记试剂标记至少一种所述的被捕获的分析物类型。
实施方案48.根据实施方案39-47中任一项所述的方法,其包括以下步骤:(iv)使检测试剂流动穿过所述的图案以及从所述的图案收回,从而产生纳升-至-阿升液滴的形式的单个液滴。
实施方案49.根据实施方案39-48中任一项所述的方法,其包括以下步骤:(v)计数容纳所述的标记和检测试剂的液滴的数量。
实施方案50.根据实施方案39-49中任一项所述的方法,其包括一次或多次重复步骤(iii)、(iv)和(v)。
实施方案51.根据实施方案39-50中任一项所述的方法,其包括通过使用对待检测的第二分析物类型具有特异性的第二标记试剂代替所述的第一标记试剂来重复步骤(iii)、(iv)和(v)。
实施方案52.根据实施方案39-51中任一项所述的方法,其包括使在所述的上述步骤中存在的标记试剂失活的步骤,然后重复步骤(iii)、(iv)和(v)。
实施方案53.根据实施方案39-52中任一项所述的方法,其中所述的标记试剂是通过从所述的表面结合的分析物脱离而失活的,并通过冲洗所述的流动系统而除去。
实施方案54.根据实施方案39-53中任一项所述的方法,其中所述的标记试剂是通过酶切割而脱离的。
实施方案55.根据实施方案39-54中任一项所述的方法,其中所述的标记试剂是通过调节ph、调节所述的离子强度、加入变性盐或加入洗涤剂的化学断裂或解吸附而脱离的。
实施方案56.根据实施方案39-55中任一项所述的方法,其中所述的标记试剂是通过升高所述的流动系统的温度而脱离的。
实施方案57.根据实施方案39-56中任一项所述的方法,其中所述的标记试剂是通过改变其化学或物理状态而失活的。
实施方案58.根据实施方案39-57中任一项所述的方法,其中所述的标记试剂包括酶,并且其中所述的酶的状态是通过活性位点的化学或生物化学修饰而改变的。
实施方案59.根据实施方案39-58中任一项所述的方法,其中所述的标记试剂包括酶,并且其中所述的酶的状态是通过化学或物理破坏所述的酶的三级结构而改变的。
实施方案60.根据实施方案39-59中任一项所述的方法,其中所述的标记试剂包括酶和特异性分析物识别部分,并且所述的分析物识别部分选自以下分子:寡核苷酸、蛋白质、肽、适体、抗体、它们的复合物或它们的合成变体。
实施方案61.根据实施方案39-60中任一项所述的方法,其中用于一种或多种不同的分析物类型的一种或多种捕获探针附着在所述的亲水性特征上。
实施方案62.根据实施方案39-61中任一项所述的方法,其中用于一种或多种不同的分析物类型的一种或多种捕获探针通过连接体部分附着在所述的亲水性特征上,所述的连接体部分选自以下分子:聚(乙二醇)、直链或支链的烷烃、肽、寡核苷酸或它们的合成变体。
实施方案63.根据实施方案39-62中任一项所述的方法,其包括多于一种类型的附着在所述的亲水性特征上的捕获探针,并且其中不同类型的所述的捕获探针排列在区域中。
实施方案64.根据实施方案39-63中任一项所述的方法,其中所述的捕获探针选自以下探针:寡核苷酸、蛋白质、肽或它们的合成变体。
实施方案65.根据实施方案39-64中任一项所述的方法,其中包含在液体中所述的一种或多种分析物类型的所述的样品通过完全浸渍与包含所述的亲水性特征的所述的基底接触。
实施方案66.根据实施方案39-65中任一项所述的方法,其包括除去所述的液体,以及洗涤所述的基底。
实施方案67.根据实施方案39-66中任一项所述的方法,其中所述的标记是通过使包含用于所述的分析物的标记试剂的溶液通过完全浸渍与所述的被捕获的分析物接触而实施的。
实施方案68.根据实施方案39-67中任一项所述的方法,其包括除去包含残余探针的溶液,以及洗涤所述的基底。
实施方案69.根据实施方案39-68中任一项所述的方法,其中所述的液体是通过由所述的入口至所述的出口形成的压力下降的手段而驱动穿过所述的流动通道。
实施方案70.根据实施方案39-69中任一项所述的方法,其中所述的分析物选自以下分析物:单链寡核苷酸、双链寡核苷酸复合物、蛋白质、蛋白质/寡核苷酸复合物、蛋白质/脂质复合物、肽、外泌体、病毒颗粒、病毒样颗粒、纳米颗粒、细胞碎片或细胞。
实施方案71.根据实施方案39-70中任一项所述的方法,其中所述的样品选自以下样品:血液、血浆、血清、尿、唾液、脑脊液、泪液或组织。
实施方案72.根据实施方案39-71中任一项所述的方法,其中所述的样品选自以下样品的实验室处理的样品:血液、血浆、血清、尿、唾液、脑脊液、泪液或组织,例如处理的血液样品。
实施方案73.根据实施方案39-72中任一项所述的方法,其中所述的一种或多种被捕获的分析物与随后用于捕获的所述的捕获探针形成共价交联或偶联。
实施方案74.根据实施方案39-73中任一项所述的方法,其中所述的捕获探针为寡核苷酸或合成的寡核苷酸,所述的分析物为通过与所述的捕获探针序列互补的序列而与所述的捕获探针结合的寡核苷酸,并且其中所述的共价交联是通过使用链间交联试剂而实施的,所述的链间交联试剂例如铂络合物、丝裂霉素c、氮芥、补骨脂素或醛。
实施方案75.根据实施方案39-74中任一项所述的方法,其中所述的捕获探针为蛋白质、肽或它们的合成变体,所述的分析物为蛋白质、肽或包含蛋白质或肽的复合物,所述的分析物为通过对所述的分析物特定区域的结构识别而与所述的捕获探针结合,并且其中所述的共价交联是通过使用化学固定试剂实施的,所述的化学固定试剂例如甲醛、戊二醛、四氧化锇或乙酸铀酰。
实施方案76.根据实施方案39-75中任一项所述的方法,其中所述的数字计数为数字计数测量。
实施方案77.根据实施方案39-76中任一项所述的方法,其中所述的数字计数测量为单酶联分子分析(selma)、数字聚合酶链式反应(dpcr)、单酶联免疫吸附测定法(selisa)或者数字单酶联免疫吸附测定法(delisa)。
实施方案78.根据实施方案1-38中任一项所述的流动系统,其中所述的气相是由大气提供的,和/或其中所述的捕获探针选自:单链dna寡聚体、单链锁核酸寡聚体或单链肽核酸寡聚体,和/或其中所述的不同类型的捕获探针排列在区域中,和/或其中所述的分析物为从处理的血液样品提取的单链或双链dna,和/或其中所述的标记试剂包括检测模块和识别部分,和/或其中所述的检测模块为酶,和/或所述的识别部分选自单链dna寡聚体、单链锁核酸寡聚体或单链肽核酸寡聚体。
实施方案79.根据实施方案39-77中任一项所述的方法,其中所述的气相是由大气提供的,和/或其中所述的捕获探针选自:单链dna寡聚体、单链锁核酸寡聚体或单链肽核酸寡聚体,和/或其中所述的不同类型的捕获探针排列在区域中,和/或其中所述的分析物为从处理的血液样品提取的单链或双链dna,和/或其中所述的标记试剂包括检测模块和识别部分,和/或其中所述的检测模块为酶,和/或所述的识别部分选自单链dna寡聚体、单链锁核酸寡聚体或单链肽核酸寡聚体。
实施方案80.多个液体纳升-至-阿升液滴在气相密封下用于数字计数至少一种或多种不同的分析物类型的用途。
实施方案81.根据实施方案80所述的用途,其是通过根据实施方案39-77和79中任一项所述的方法实施的。
实施方案82.根据实施方案80-81中任一项所述的用途,其是在根据实施方案1-38和78中任一项所述的流动系统中实施的。
在下文中,描述应用的一些非限定性应用的实施例。
实施例1
飞升水性微液滴阵列的形成和保持
为了形成稳定的微液滴,将嵌入在平坦的疏水性区域上的亲水性圆形特征的规则二次阵列与磷酸盐缓冲的水性溶液接触。将10μl溶液塞驱动穿过阵列的表面,由此将微液滴留在亲水性特征上,如图4中的显微照片所示。
流动系统是通过长方形通道的各个末端的2个开口界定的,从而指导液体。通道的宽度为3mm,长度为16mm,而高度为150μm。阵列被放置于通道内的中心,并且宽度为2.9mm,长度为14mm,并且由总计406,000个亲水性特征组成。亲水性圆形的直径为5μm,圆间间距(inter-circlespacing)为10μm。疏水性表面上水性溶液的接触角为大约110°,并且在21℃的环境温度实施实验。允许蒸发至多3%的液滴体积,根据方程11,其表明对于干燥的空气(rhi=0)而言,通道的最大高度为大约680μm。由于流动分隔区的高度仅为150μm并因此小于最大高度,所以气相密封是功能性的,并且能够保持微液滴完整。
通过将10-μl体积放置于与通道入口连接的加载垫中,使阵列与大体积水相溶液接触。接着,在通道的出口处,施加负压,由此使10-μl液滴塞以5μl/min流速驱动穿过通道。一旦大体积液体的后退边缘(recedingedge)达到通道出口,则停止施压,并将新的液体塞放置在加载垫上。由于功能性气相密封,在亲水性特征的顶部上面形成的液滴在超过1个小时的时间内保持稳定,而不会发生任何显著的蒸发,例如参见图12c。
实施例2
如何通过优化流动通道、液滴和阵列的几何形状使得水性微液滴的阵列抗蒸发
考虑其中化学图案化的固体基底已经被嵌入的流动通道。化学图案由组织在阵列中的圆形亲水性区域组成。亲水性阵列被连续的疏水性区域包围。按照这种方式,一旦水性溶液被灌输并随后由流动通道收回,则在亲水性特征的顶部上面形成微液滴的阵列,如实施例1所示。
流动通道的维度在图13上定义,并且通过以下方面表征:h,其为通道的高度;la,其为被阵列覆盖的流动通道的长度;le,其为通向入口/出口,但是不容纳阵列的通道的过多部分的长度。定义阵列的参数为微液滴半径rd(其定义为固体基底上亲水性特征的半径),和δ(其为相邻的液滴之间的中心-与-中心的距离)。在下文中,我们假设阵列以四角形图案组织,但是可以使用相同的原理驱动用于其他阵列图案的溶液,以下文所示。
首先,我们将计算在流动通道中存在的水的总摩尔量。这是通过计算液滴的体积(vd),并将其乘以存在的液滴的总数量而得到的。我们将假设可以通过展现球形一半体积的半球形来表示液滴。因为阵列和流动通道沿着y方向是一致的,所以我们仅需要考虑由一条线的液滴组成的一维阵列(如草图所示)以及液滴间间距的宽度为δ的准一维流动通道。沿着一维阵列的液滴的总数量(nd)则为:
nd=la/δ方程12
所有液滴的总摩尔量(ntot)现在能够评价如下:
在此,mw为所有液滴的总质量,mw为水的摩尔重量(18.016g/mol),ρw为水的密度(1000g/l)。为了计算在给定温度下有多少水发生蒸发,我们必须使用克劳修斯-克拉佩龙方程计算水的平衡蒸气压力(pw):
在此,p0为在参照温度t0的参照平衡蒸气压力,t为反应温度,r为气体常数(8.31j·mol-1·k-1),并且δhvap(40.65kj·mol-1)为在水蒸发时的焓变。在293k温度,p0和t0的合适的值分别为2.34kpa。对于体积为vf的封闭的流动通道而言,水的蒸气压力表明多少水可以作为水蒸气转变成空气。根据理想气体定律,在平衡下水蒸气的摩尔量(nevap)符合:
蒸发的水的分数(θw)现在能够评价为蒸发的水与水的总摩尔量的比值。
我们现在将引入:(i)无量纲比例因子(dimensionlessscalingfactor)n=δ/rd,其为表征阵列的几何形状的参数(即,n值越大,导致越发的几乎不密集的阵列);以及(ii)无量纲比例因子
方程17可以重排,使得如果选择所需的最大蒸发的分数(θmax),则能够评价相应的最大高度(hmax):
在图11中,针对多个流动通道/液滴/阵列的几何形状和温度,描绘方程17和方程18。进一步地在图12中,已经示出液滴稳定性作为温度和流动通道几何形状的函数的实验证明。对于液滴保留而优化的流动通道而言(图12c),液滴阵列在一定的温度范围内(25-45℃,如在此所证明)并且在至少1.5小时的延长的时间内保持稳定。原则上,一旦建立热动力学平衡,液滴阵列则是无限稳定的。但是,在实际中,流动通道/阵列不能完美地密封而杜绝外部环境,因此液滴会缓慢蒸发。
实施例3
流动系统的制造
流动系统的制造在2个主要的步骤中进行;一个步骤使用uv光刻术和微制造处理来生产图案化的亲水性特征,而第二步骤将亲水性图案整合至流动分隔区中,从而展现正确的几何形状。下文将更详细地描述2个步骤。
图案化的亲水性基底的微制造
在本发明的这种实施方案中,亲水性特征由石英(sio2)构成,疏水性区域由全氟十二烷基三氯硅烷(fdts)构成。在制造过程的第一个步骤中,使用mvd100molecularvapordeposition系统(appliedmicrostructuresinc.)通过分子气相沉积将fdts的分子单层沉积在石英晶片上。fdts与石英表面上的硅烷醇基团共价附着,并由此在晶片表面上产生疏水性单层。
接着,通过旋涂,然后在90℃对晶片进行软烘使过量的溶剂蒸发,将az5214e光刻胶(microchemicalsgmbh)的层沉积在经fdts处理的晶片的顶部上面。使用ma6型
在最终的处理步骤中,选择性地除去fdts单层,从而暴露下方的亲水性石英表面。这是通过使用300型plasmaprocessor(tepla)使晶片经历短时间的氧气-等离子体,由此除去fdts单层但是留下更厚的光刻胶膜而实现的。为了除去光刻胶膜,将晶片在丙酮中超声波处理10min,由此将所述的膜溶解并由此提供被疏水性fdts分子单层包围的亲水性石英特征的图案。
微制造的阵列在流动通道中的整合
在整合之前,将微结构化的晶片切割成长方形小块(25mmx12mm),以适合流动分隔区。在这种情况下,在所述的阵列需要进一步的表面官能化的情况下,实施官能化方案,然后进行分隔区整合,如以下实施例4-5所述。
通过cnc铣削聚(甲基丙烯酸甲酯)(pmma)片,制备流动通道和液体加载垫。流动通道的宽度为1mm,长度为8mm,高度为100μm,并且壁厚为200μm。流动通道在与蠕动泵连接的出口达到终点,其中所述的蠕动泵提供液体驱动所需的抽吸。液体加载垫展现出体积为大约100μl,并且通过入口与流动通道连接。流动通道、加载垫、入口和出口是由单一的8mm厚pmma厚板雕刻的,其在下文中称为pmma流动结构。
为了将容纳亲水性特征的微制造的阵列的长方形晶片(芯片)附着在pmma流动结构上,使用co2激光仪切割一块公称厚度为142μm的双侧压敏粘附膜(arcare90106,adhesivesresearch,inc.)。激光切割的粘附膜的几何形状与pmma流动结构的几何形状匹配,但是稍微更小一点,使得流动通道被粘附剂包围,但是不接触。接着,使粘附剂附着在pmma流动结构的底部侧,然后在粘附剂的顶部上面放置阵列芯片。然后,将组件(pmma流动结构、粘附剂和阵列芯片)夹在2个平的5mm厚的pmma片之间,并放置在粘结压力机中。将夹层在40℃、6kn压力夹紧60秒。按照这种方式,粘合剂被压制成由流动通道的高度界定的100μm的厚度。所得的粘结的组件界定了功能流动系统。
实施例4
单一dna分子的数字计数
在本实施例中,显示如何通过使用具有整合的液滴阵列芯片的流动系统可以检测和数字计数单一的生物分子(在这种情况下为单链dna)。根据实施例1-3所述的过程,生产和操作流动系统组件,但是在液滴阵列芯片整合至pmma流动结构之前,使芯片经历进一步的表面官能化,从而可以使单链靶dna被特异性的捕获。微制造的芯片由93,750个圆形亲水性特征组成,其直径为4μm,并且以正方形阵列排列,特征之间的间距为8μm。
表面官能化方案
通过在丙酮中进行10min超声波处理,然后在异丙醇中进行10min超声波处理,再在乙醇中进行10min超声波处理,完全清洁液滴阵列的芯片。将该芯片在氮气流下干燥,并浸渍在1%(v/v)环氧硅烷(dynasylanglyeo,evonikindustries)溶液在95%(v/v)乙醇中形成的溶液中。将芯片在环氧硅烷溶液中孵育30min,随后使用95%乙醇洗涤3次,在氮气流下干燥,并在110℃固化30min。
接着,使硅烷化芯片上的环氧基基团与聚(乙二醇)部分上存在的胺基团反应。聚(乙二醇)由甲氧基-聚(乙二醇)2000-胺(oh-peg2000-nh2)(jenkemtechnology)和羧酸-聚(乙二醇)2000-胺(cooh-peg2000-nh2)(jenkemtechnology)的混合物组成。该混合物具有10:1摩尔比的oh-peg2000-nh2与cooh-peg2000-nh2,并且在10mm磷酸盐缓冲的生理盐水(pbs),138mmnacl,2.7mmkcl,1.5m硫酸铵,ph7.4中具有100g/l的公称总浓度。将芯片在40℃与混合物孵育20小时。随后,使用milli-q水(milliporecorp.)将芯片洗涤3次,并在氮气流下干燥。
在最后的表面改性步骤中,使用对dna靶具有特异性的捕获探针将芯片官能化。捕获探针为在n末端具有赖氨酸基团的14-mer肽核酸(pna),其用于附着在接枝cooh-peg2000-nh2的表面上的羧酸基团上。pna探针的序列从n末端至c末端为k-o-acatagttgacacg-oo(seqidno:1:acatagttgacacg)(panagene),其中k表示赖氨酸基团,o表示乙二醇连接体,而字母g、c、a和t表示dna核碱基的pna类似物。
首先,通过将芯片浸渍在摩尔比为1:1并且各种化合物在100mm2-(n-吗啉代)乙磺酸(mes)缓冲剂中的公称浓度为25g/l的n-羟基琥珀酰亚胺和n-(3-二甲基氨基丙基)-n′-乙基碳二亚胺盐酸盐的混合物中,制备芯片的表面用于与pna探针反应。将芯片在所述的混合物中在4℃孵育30min,然后在100mmmes缓冲剂中进行简单的冲洗。然后,将芯片浸渍在pna探针在100mmmes缓冲剂中形成的100nm溶液中,并在环境温度孵育30min。随后,使用100mmmes缓冲剂简单冲洗芯片,然后在50mm三(羟甲基)氨基甲烷中浸渍10min。使用milli-q水冲洗芯片3次,在氮气流下干燥,并储存在真空干燥器中,直至它们与pmma流动结构结合,如实施例3中概述。
检测方案
用于检测的靶为50-bpdna寡聚体(5'-tctgtcgtaggcacagagcggtcttacggccagtcgcgtgtcaactatgt-3'(seqidno:2))。dna寡聚体的最后14个碱基对与pna捕获探针互补,而dna寡聚体的最初12个碱基对与基于dna的标记试剂互补。标记试剂由一个或多个与辣根过氧化物酶缀合的12-bpdna寡聚体构成。标记dna寡聚体的序列为5'-gcctacgacaga-3'-teg-生物素(与teg-生物素缀合的seqidno:3),其中teg表示四(乙二醇)连接体。
通过将中性抗生物素蛋白(neutravidin)-辣根过氧化物酶(nav-hrp)缀合物(invitrogen,a2664)与标记寡聚体以nav-hrp与寡聚体的摩尔比为1:3进行混合,制备标记试剂。nav-hrp的最终浓度为100nm,并且在5x柠檬酸钠(ssc)缓冲剂,1.0g/l牛血清白蛋白(bsa),0.5%(v/v)tritonx-100,ph7.0中制备混合物。将混合物在4℃孵育24小时,由此能够使生物素化的dna寡聚体附着在nav-hrp上的中性抗生物素蛋白部分上。所得的缀合物展现出每个nav-hrp具有平均3个结合的dna寡聚体,并且在下文中简写为nav-hrp-lo3。
以下缓冲剂用于检测实验:
钝化缓冲剂:5xssc缓冲剂,0.5%(v/v)tritonx-100,10g/lbsa,ph7.0。
标记缓冲剂:5xssc缓冲剂,0.5%(v/v)tritonx-100,10g/lbsa,ph7.0。
清洁缓冲剂1:10mmpbs,138mmnacl,2.7mmkcl,0.1%(v/v)tritonx-100,50g/l20kda分子量的聚(乙二醇)(peg20000),ph7.4。
清洁缓冲剂2:10mmpbs,138mmnacl,2.7mmkcl,50g/lpeg20000,ph7.4。
检测缓冲剂:10mmpbs,138mmnacl,2.7mmkcl,10g/lpeg20000,1.0mmh2o2,ph7.4。
在5xssc缓冲剂,0.5%tritonx-100,ph7.0中制备公称dna靶浓度变化(10fm,1fm和100am)的溶液以及不包含dna靶的对照,然后立即进行检测实验。为了实施检测实验,按照以下方式操作流动系统:
步骤1:将25μldna靶溶液以流速0.2μl/min驱动通过流动通道。
步骤2:使用10μl钝化缓冲剂灌输流动通道。
步骤3:孵育10min,并将溶液驱动流出流动通道。
步骤4:使用在标记缓冲剂中10μl的50pmnav-hrp-lo3灌输流动通道。
步骤5:孵育10min,并将溶液驱动流出流动通道。
步骤6:以流速10μl/min驱动100μl清洁缓冲剂1。
步骤7:以流速10μl/min驱动100μl清洁缓冲剂2。
步骤8:以流速5μl/min驱动检测缓冲剂中3μl的200μmampliflured(sigmaaldrich,90101-5mg-f)溶液。
简言之,上述方案能够使dna靶在步骤1中与表面附着的pna捕获探针结合。接着,在步骤4-5中,使用nav-hrp-lo3标记被捕获的dna靶。在步骤6-7中除去过量的标记试剂后,在步骤8中建立包含检测试剂ampliflured的微液滴。ampliflured为辣根过氧化物酶的荧光底物,当酶处理时其转化成发荧光的化合物试卤灵(激发波长570nm,发射波长585nm)。结果,容纳标记试剂的液滴产生荧光信号,其使用荧光显微镜可以容易地检测。
在步骤8之后,使用与合适的荧光滤波器组结合的555-nmled激发光源,在荧光显微镜(zeissaxiovert.a1)下检查流动系统,从而检测由试卤灵发出的信号。使用1.4mpccd照相机(axiocammr3)记录相应的亮视野和荧光显微照片,如图14中所示。
使用图像分析软件imagej定量荧光显微照片,以计数发荧光的液滴的数量。简言之,通过将低于某一强度阈值的像素值格式化成0并将高于某一强度阈值的像素值格式化成1,将灰度级显微照片转化成二进制格式。接着,计数值为“1”的相连的像素群集。由低于4个像素组成的群集作为噪声弃去。记录整个阵列的群集的总数量用于随后的数据分析。相同的强度阈值适用于所有检测实验的所有荧光显微照片。
图15中示出总计20个检测实验的结果。图中示出在阵列上存在的液滴的百分比分数,其中所述的阵列展现出对不同浓度的dna靶的可检测荧光信号。在对照样品中,其中不存在dna靶的情况下,仍有一些液滴是可检测的。这可能是由于阵列上存在非特异性结合(例如物理吸收或化学吸收)的标记试剂。非特异性结合(nsb)是普通的现象,其在高敏感应用(例如单一分子计数)中是更明显的。在此所示的试验中,容纳nsb标记试剂的液滴的分数为0.280+/-0.097%(从5个试验得到的平均值+/-标准偏差)。另一方面,发现包含靶dna的样品展现出更高分数的可检测微液滴,因此证明微量分子靶的特异性检测和定量。然而,当靶dna的浓度升高时,发荧光的液滴的数量并非以正比例方式增加。这可能是由于通过以下方式的靶的浓度依赖性损失:例如非特异性吸收在流动系统的其他表面上,或者表面结合的dna靶的不完全标记。
实施例5
单一dna分子的重复检测
在本实施例中,显示被捕获的dna靶如何可以通过标记试剂的失活而被重复检测。根据实施例1-3生产和操作在本实施例中使用的流动系统,并根据实施例4中提供的表面官能化方案来官能化所述的流动系统。
以下文所示,使用被捕获的靶的重复检测的优点在于每次重复检测,都可以改进信噪比,还可以改进检测极限。此外,在区分容纳一个或多个单核苷酸多态性(snp)的dna靶与不具有snp但其他方面一致的野生型dna链中,上述操作能够得到增加的特异性,例如实施例6。
在本实施例中,我们使用如实施例4中所述的相同的检测方案,但是3次重复标记和检测步骤。由于捕获探针基于pna而标记试剂基于dna,所以可以使用消化标记试剂的t7核酸外切酶选择性地除去标记试剂,同时保持捕获探针/靶复合物完整。此外,为了除去来自nsb标记试剂的信号,使用苯酚溶液使探针的酶部分失活,其中所述的苯酚选择性地改变过氧化物酶的活性位点的结构,由此防止其在随后的检测测定法中产生信号。
钝化缓冲剂、标记缓冲剂、清洁缓冲剂1、清洁缓冲剂2和检测缓冲剂与实施例4中使用的相同。此外,使用以下2种反应剂:
消化缓冲剂:在50mm乙酸钾,20mmtris-醋酸,10mm乙酸镁,1mmdtt,ph7.9中的1500单位/mlt7核酸外切酶(newenglandbiolabs,m0263l)。
失活缓冲剂:10mmpbs,138mmnacl,2.7mmkcl,ph7.4中的5.0mm苯酚,1.0mmh2o2。
按照以下方式实施试验,从而能够进行相同被捕获的dna靶的3个不同的检测步骤。
步骤1:将25μldna靶溶液以流速0.2μl/min驱动通过流动通道。
步骤2:使用10μl钝化缓冲剂灌输流动通道。
步骤3:孵育10min,并将溶液驱动流出流动通道。
步骤4:使用在标记缓冲剂中10μl的50pmnav-hrp-lo3灌输流动通道。
步骤5:孵育10min,并将溶液驱动流出流动通道。
步骤6:将100μl清洁缓冲剂1以流速10μl/min驱动通过流动通道。
步骤7:将100μl清洁缓冲剂2以流速10μl/min驱动通过流动通道。
步骤8:以流速5μl/min驱动检测缓冲剂中3μl的200μmampliflured(sigmaaldrich,90101-5mg-f)溶液。
步骤9:记录液滴阵列的荧光和亮视野显微照片。
步骤10:使用10μl消化缓冲剂灌输流动通道。
步骤11:孵育10min,并将溶液驱动流出流动通道。
步骤12:以流速5μl/min使20μl失活缓冲剂驱动通过流动通道。
步骤13:以流速10μl/min使50μl清洁缓冲剂1驱动通过流动通道。
步骤14:重复步骤4-13。
步骤15:重复步骤4-9。
对于各种样品,记录一系列三张连续的荧光显微照片,并使用实施例4中概括的相同的设置和过程进行分析。在所述的系列中的第一显微照片对应于第一检测步骤,该系列中的下一张显微照片对应于第二检测步骤,以此类推。通过在流动系统表面上使用特定的标记(其在亮视野显微照片上是可见的),针对检测步骤之间xy位置的变化校正荧光显微照片的坐标。按照这种方式,可以比较不同检测步骤中单个液滴的xy位置。接着,对于检测系列中的各个显微照片,记录展示出荧光信号的液滴的xy像素位置,并与该系列中其余的2名成员比较。在检测步骤之间差异不超过4个像素的液滴位置被认为是“持续性”液滴,即,当加入标记和检测试剂时,重复产生信号的液滴。
3个检测步骤的结果示于图16中,其中针对包含100amdna靶的样品显示一系列荧光显微照片。在显微照片上,使用圆形标记持续性液滴。对于对照样品,其中未加入dna靶,在所有的3个检测步骤中均没有识别到持续性液滴。
下表显示在100amdna靶样品与对照样品之间的定量比较。表格概括了由5个相同制备的样品(包含100am靶dna)和5个相同制备的对照样品(不包含靶dna)得到的平均结果。所述表格提供了对于对照样品(第一行)和100am靶dna样品(第二行)的持续性液滴的平均阳性分数(avg.),如实施例5中定义。标准偏差(st.dev.)对应于5个样品的标准偏差。第三行提供了由各个随后的检测步骤得到的信噪(s/n)比。s/n比以实验测量值形式提供(括号中补充理论值)。第二行的平均值除以第一行的平均值,得到实验值。以下计算理论值,将100am样品的平均值除以:(i)第一检测步骤的0.28%;(ii)第二检测步骤的7.84·10-4%(0.28%·0.28%);以及(iii)第三检测步骤的2.2·10-6%(0.28%·0.28%·0.28%)。
对于检测步骤的各次重复而言,对照样品的持续性液滴的百分比分数降低,随后导致s/n比增加。该结果的原因在于在对照样品中,仅nsb标记试剂提供荧光信号。它们以随机方式与阵列结合,并且因为它们的信号在随后的检测步骤之间失活,所以相同的液滴不可能在随后的检测步骤中产生信号。例如假设nsb标记试剂的随机结合图案,如果在各个检测步骤中,容纳nsb标记试剂的液滴的分数为0.28%(例如图15d),则仅有2.2·10-6%(0.28%·0.28%·0.28%)的机会在所有的3个检测步骤中均观察到持续性液滴。对于容纳100,000个液滴的阵列而言,2.2·10-6%的假阳性检测率相当于仅0.002的假阳性检测。因此,非常不太可能观察到对照样品的任何持续性液滴。
因此,对于这些特定的试验背景而言,从nsb标记试剂衍生的所有噪声均可以被排除在外,由此持续至少3个连续的检测步骤的任何液滴均(以极高的可能性)代表了功能组装的捕获探针/dna靶/标记探针复合物。
实施例6
在非靶dna(在序列中与靶具有单一碱基对的差异)的1:10,000(靶:非靶)背景下用于检测单一dna分子的流动系统设置的描述
在本实施例中,能够实施数字检测100μl样品溶液中存在的dna分析物的流动系统是通过下文描述的步骤获得的。预计分析物(靶dna)以大约10am的浓度存在于样品中,并且包含以下序列段:
捕获探针为单链pna寡聚体,其选择为与靶和野生型dna的5’末端互补,这可以通过使用包含以下序列的捕获探针而实现:5'-gtgcctacgacaga-3'(seqidno:6),其中5’和3’分别对应于探针的n末端和c末端。根据idtoligoanalyzer软件(https://eu.idtdna.com/calc/analyzer),预计捕获探针的解链温度为至少46.8℃,因此,100%的靶和野生型dna在环境温度(即,23℃)是结合的。因此,阵列必须被设计成容纳至少6000000个dna分子结合,这相当于包含100fmdna的100μl样品的100%结合。
为了实施数字计数测量,使用标记试剂标记被捕获的靶dna,其中所述的标记试剂由包含以下序列的单链dna寡聚体组成:5-atagttgacac-3'(seqidno:7),该寡聚体与诸如辣根过氧化物酶、碱性磷酸酶或β-半乳糖苷酶之类的酶缀合,所有这些均具有市售可得的荧光底物。标记试剂与dna靶的序列在3’末端完全匹配。在优化的结合条件下,82.6%的靶dna在23℃的温度与标记试剂结合(idtoligoanalyzer)。但是,在相同的条件下,1%的野生型dna也与标记试剂结合,这是由于靶与野生型之间高度的序列相似性。结果,为了实施数字计数测量,阵列必须存在至少120,000个亲水性特征。选择120,000个特征的量,使得在实施第一标记和第一检测步骤时,阵列的大约一半的液滴会产生荧光信号,即,6000000个野生型dna的1%+600个靶dna的82.6%。
为了容纳120,000个亲水性特征,该特征必须成型为直径为5μm的圆形,并且被放置在规则的二次阵列(最邻近的间隔为10μm)中。根据方程1,单个的亲水性特征由此可以支持最大体积为vd=52飞升的水性液滴。为了计算最大液滴体积,使用110o的γ值(其对应于在全氟十二烷基三氯硅烷(fdts)支持体上水的接触角)。因此,液滴阵列的总体积为vda=6.2纳升(120,000乘以52飞升)。最大流动分隔区体积则得自方程9,vmax=326μl。
为了计算最大流动分隔区体积,使用以下值;ρl=1000kg/m3为水的体积密度,r=8.31j/(mol·k)为摩尔气体常数,t=296k(23℃)为温度,rhi=0作为干燥大气的初始相对水蒸气饱和度,p0=1226pa为在温度t0=283k(10℃)水蒸气的蒸气压力,mw=18.016·10-3kg/mol为水的摩尔重量,并且δhvap=40.65·103j/mol为水的蒸发焓。所述的值可以得自lange’shandbookofphysicalchemistry(isbn-13:9780070163843)和atkin’sphysicalchemistry,volume1:thermodynamicsandkinetics(isbn-13:9780716785675)。
然而,为了使液滴(i)在成像检测步骤过程中保持稳定以及(ii)提供用于酶反应的最佳条件,仅允许一小部分的液滴体积蒸发。因此,液滴的最大允许蒸发体积分数设定为5%,即,θmax=0.05,因此得到流动分隔区体积vc=16.3μl,即,vc=θmax·vmax。
流动分隔区的最终几何形状的设计是通过选择分隔区的长方形通道形状而获得的,其中所述的分隔区长方形通道形状展现出10:1的纵横比,长度lcx=15mm,宽度lcy=1.5mm。因此,需要通道的高度为低于hmax=724μm(hmax=vc/(lcy·lcx)),以确保不超过5%的最大液滴体积蒸发。可以将10:1纵横比用于亲水性特征的阵列,使得该阵列呈现1,091x110圆形特征,对应于lax=10.9mm和lay=1.1mm。
对于上文概述的流动系统设置而言,可以通过3次重复标记和检测步骤,在背景超过靶10,000倍下可信赖地检测dna靶,如实施例5中所述。按照这种方式,预计平均60,496个dna分子(6000000个野生型dna的1%+靶dna的82.6%)在第一检测步骤中可以提供信号,对应于野生型dna的60000假阳性检测和靶dna的496个正确的检测。
在第二检测步骤中,预计平均1,010个dna分子(60,000个野生型dna的1%+496个靶dna的82.6%)可以提供持续性信号,对应于野生型dna的600个假阳性检测和靶dna的410个正确的检测。在第三检测步骤中,预计平均344个dna分子(600个野生型dna的1%+410个靶dna的82.6%)可以提供持续性信号,对应于野生型dna的6个假阳性检测和靶dna的338个正确的检测。
对于第三检测步骤而言,预计正确检测的数量超过假阳性检测的数量是56倍,因此提供优异的定量精确度。而且,通过第四次重复标记和检测步骤,预计会完全消除假阳性检测。
实施例7
信号阳性捕获位点的数量与应用的检测循环的数量之间的分析关系
考虑本发明的设计用于检测和定量靶寡核苷酸的实施方案,所述靶寡核苷酸具有以与参照(野生型)寡核苷酸序列相比显示单碱基对取代形式的遗传改变的序列。在这种情况下,所述的靶分析物将是单碱基对取代的寡核苷酸,并且因此所述的参照(野生型)寡核苷酸构成高度相似的非靶分子,这可能对常规单分子计数方法的假阳性检测率有很大贡献。在当前实施方案中,捕获位点可以用与对于靶分析物和非靶分子共有的序列互补的寡核苷酸捕获探针进行官能化。另一方面,标记试剂可以由具有与显示单碱基对取代的靶分析物的部分互补的序列的寡核苷酸构成。因此,将预期对靶分析物的标记效率将高于对非靶分子的标记效率,但不一定高得多。
考虑到在本实施例中,在捕获位点上捕获的靶分析物和非靶分子的数量分别是nta和nnm,并且可用的捕获位点的总数是nc。在本实施例中,假设根据泊松分布,靶分析物和非靶分析物都分布在捕获位点中。因此,容纳至少一种靶分析物的分隔区的数量(cta)和容纳至少一种非靶分子的分隔区的数量(cnm)是
cta=nc(1-exp(-nta/nc))方程19
cnn=nc(1-exp(-nnm/nc))方程20
进一步考虑标记试剂对靶分析物的标记效率是pta,并且标记试剂对非靶分子的标记效率是pnm。在本实施例中,标记效率分别表示与标记试剂杂交的靶分析物和非靶分子的分数。标记效率可以通过例如解链曲线分析直接测量,或者基于靶分析物、非靶分子和标记试剂的寡核苷酸序列进行估计。
用至少一种标记试剂成功标记容纳n个单独靶分析物的捕获位点的概率(pta(n))是
pta(n)=1-(1-pta)n方程21
并且同样,用至少一种标记试剂成功标记容纳n个单独非靶分子的捕获位点的概率(pnm(n))是
pnm(n)=1-(1-pnm)n方程22
此外,恰好包含n个靶分析物的捕获位点的分布(fta(n))由泊松分布给出
因此,恰好显示n个靶分析物的捕获位点的数量(cta(n))是cta(n)=nc·fta(n)。同样地,恰好包含n个非靶分子的捕获位点的分布(fnm(n))由方程24给出并且恰好显示n个非靶分子的捕获位点的数量(cnm(n))是cnm(n)=nc·fnm(n)。
对于包括在标记步骤中重新应用相同类型的标记试剂的许多重复检测循环的分析,通过对具有至少一种标记试剂的捕获位点的所有可能配置求和而得到每个检测步骤连续标记的包含靶分析物的捕获位点的平均数量(lta(x)),其中x代表检测循环的数量
同样,每个检测循环连续标记的包含非靶分子的捕获位点的平均数量(lnm(x)),其中x代表重复的数量,给出为
除了靶分析物和非靶分子的序列依赖性标记之外,标记试剂也可以通过例如疏水或静电相互作用而非特异性地保留在捕获位点上。在本实施例中,我们假设非特异性保留的标记试剂的数量(lnsr(x))可以计算为
在此,x是重复的数量并且fnsr是容纳至少一个非特异性地保留的标记试剂的分隔区的分数。通过在不存在靶分析物和非靶分子的情况下执行检测循环并且计数显示信号的捕获位点的数量,可以通过实验获得fnsr的值。因此,通过将来自靶分析物的序列依赖性标记、靶分子的序列依赖性标记和序列非依赖性非特异性保留的标记试剂的贡献合计,可以得到在分隔后显示可检测信号的捕获位点的预期数量作为检测循环数(ct(x))的函数:
ct(x)=lta(x)+lnm(x)+lnsr(x)方程28
在图18中,针对四种不同配置绘制了来自lta、lnm和lnsr的贡献。在图18中,针对(a)nta=10,nnm=10.000,nc=100.000,pta=0.9,pnm=0.05和fnsr=0,(b)nta=10,nnm=100.000,nc=100.000,pta=0.9,pnm=0.05和fnsr=0.05,(c)nta=10,nnm=1.000.000,nc=100.000,pta=0.9,pnm=0.05和fnsr=0以及(d)nta=10,nnm=1.000.000,nc=1.000.000,pta=0.9,pnm=0.05,fnsr=0.05计算ct、lta、lnm和lnsr的值。
在图18a-d中,靶分析物在数量上远远超过非靶分子和非特异性保留的标记试剂,否则会损害常规单一检测循环实验的准确性。在前3-4个检测循环内,快速消除了显示非特异性保留的标记试剂的5%群体(fnsr=0.05)捕获位点的存在。此外,源自非靶分子的假阳性信号在前3-6个检测循环内迅速降低几个数量级,而使来自靶分析物的特定信号基本不变。
实施例8
评估单分子数字计数分析的检测限(lod)、定量限(loq)和动态范围(dr)作为所应用的检测循环数的函数。
表1和表2列出了对于显示一个(c1)、两个(c2)、时间(c3)和四个(c4)检测循环的分析的假阳性捕获位点平均数(nfp)、信号阳性捕获位点数量的标准偏差(δnfp)、检测限(lod)、定量限(loq)和动态范围(dr)的模拟值。
在本实施例中,通过指定捕获位点的数量(nc)、靶分析物的数量(nta)、非靶分子的数量(nnm)、标记试剂对靶分析物的标记效率(pta)、标记试剂对非靶分子的标记效率(pnm)和非特异性保留的标记试剂的分数(fnsr)的值进行模拟,获得nfp值,参见实施例7。
为了初始化模拟,每个捕获位点都分配了一个唯一索引。为了模拟捕获步骤,模拟算法在可用数量的捕获位点中随机分布靶分析物和非靶分子。分配给单独靶分析物或非靶分子的捕获位点在模拟的剩余部分中不改变。接着,通过-对每个捕获位点-模拟标记步骤,来根据方程21-22计算pta(n)和pnm(n),其中n代表捕获位点上分别存在的靶分析物和非靶分子的总数,并且接着在0和1之间得出两个随机值。如果第一个随机值小于pta(n),则认为捕获位点包含靶分析物/标记试剂复合物。如果第二随机值小于pnm(n),则认为捕获位点包含非靶分子/标记试剂复合物。在这两种情况下,捕获位点都已注册为已标记,否则不会。
为了解释非特异性保留的标记试剂,随机选择fnsr·nc捕获位点并注册为已标记。在每个标记步骤结束时编译并保存所有捕获位点的唯一索引及其标记或未标记的状态的列表。为了模拟随后的检测循环,进行了新的模拟标记过程,并编译了所有捕获位点的唯一索引和标记状态的新列表。
在已经模拟了所有检测循环后,将每个检测循环的标记列表相互比较,以鉴定在所有检测循环中被持久标记的捕获位点。单次模拟的结果是被持久标记的捕获位点的数量(npl)。为了获得nfp值,进行应用相同初始化参数的1000次模拟,并将nfp计算为所有记录的npl值的平均值。同样,为了获得δnfp值,计算所有记录的npl值的标准偏差。为了获得lod-值、loq-值和dr-值,在nta=0的情况下进行模拟,使得仅产生假阳性事件,并且因此模拟将提供测量的固有计数误差的估计。lod-值、loq-值和dr-值分别计算为nfp+3δnfp、nfp+10δnfp和nc/loq。
对于表1和表2中所示的模拟结果,应用以下值:nc=105、nta=0、pnm=0.05、fnsr=0和nnm=103-105。从表中能够看出,每次重复检测循环时,测试的lod-值、loq-值和dr-值变得越来越好(值减小),这是由于更少的假阳性检测(nfp)。然而,样品中非靶分子的数量不利地影响lod-值、loq-值和dr-值,这是由于相对于可用捕获位点的总数,假阳性捕获位点的比例更高。
表1:对于含有1,000个(左)和10,000个(右)非靶分子的样品的selma测试的理论分析性能。
表2:对于含有100,000个(左)和1,000,000个(右)非靶分子的样品的selma测试的理论分析性能。
序列表
seqidno:1:acatagttgacacg
seqidno:2:5'-tctgtcgtaggcacagagcggtcttacggccagtcgcgtgtcaactatgt-3'
seqidno.3:5'-gcctacgacaga-3'
seqidno:4:5'-tctgtcgtaggcacagagcggtcttacggccagtcgcgtgtcaactat-3'
seqidno:5:5'-tctgtcgtaggcacagagcggtcttacggccagtcgcgtgtccactat-3'
seqidno:6:5'-gtgcctacgacaga-3'
seqidno:7:5'-atagttgacac-3'
序列表
<110>selmadiagnosticsaps
<120>数字计数方法的改进
<130>21221pct00
<160>7
<170>patentinversion3.5
<210>1
<211>14
<212>dna
<213>人工序列
<220>
<223>dna序列的pna类似物
<400>1
acatagttgacacg14
<210>2
<211>50
<212>dna
<213>人工序列
<220>
<223>模式寡核苷酸
<400>2
tctgtcgtaggcacagagcggtcttacggccagtcgcgtgtcaactatgt50
<210>3
<211>12
<212>dna
<213>人工序列
<220>
<223>生物素标记的dna寡核苷酸
<400>3
gcctacgacaga12
<210>4
<211>48
<212>dna
<213>人工序列
<220>
<223>模式靶dna
<400>4
tctgtcgtaggcacagagcggtcttacggccagtcgcgtgtcaactat48
<210>5
<211>48
<212>dna
<213>人工序列
<220>
<223>模式非靶dna
<400>5
tctgtcgtaggcacagagcggtcttacggccagtcgcgtgtccactat48
<210>6
<211>14
<212>dna
<213>人工序列
<220>
<223>pna修饰的捕获探针
<400>6
gtgcctacgacaga14
<210>7
<211>11
<212>dna
<213>人工序列
<220>
<223>单链dna标记
<400>7
atagttgacac11
- 还没有人留言评论。精彩留言会获得点赞!