一种外膜蛋白酶T酶解组蛋白并进行质谱分析的方法与流程
本发明属于蛋白质分析技术领域,具体涉及一种利用外膜蛋白酶t酶解组蛋白并进行质谱分析的方法。
背景技术:
现有技术公开了组蛋白上存在大量的翻译后修饰,例如甲基化,乙酰化。这些翻译后修饰在多种dna依赖的生物过程中发挥重要功能,主要通过改变染色质高级结构或者招募特异结合的蛋白的方式参与转录激活,转录抑制,染色质的解聚等众多生物学过程。据研究报道,已发现组蛋白上存在20多种翻译后修饰,位于130个不同的位点和变体上,利用质谱技术高效快速灵敏的鉴定和定量这些后修饰是实现其进一步研究的首要前提。然而,基于质谱技术的组蛋白翻译后修饰研究面临着一些困难。首先,组蛋白的氨基酸序列中存在大量精氨酸和赖氨酸,例如核心组蛋白h3的序列中百分之二十三属于碱性氨基酸,因此传统胰蛋白酶消化产生的肽段片段非常小,亲水性很强,在反向色谱柱无法保留以至于质谱检测不到;第二,组蛋白赖氨酸和精氨酸上丰富的翻译后修饰会大大降低甚至完全阻碍胰酶的酶切效率;第三,尽管目前已有基于醋酸酐、丙酸酐等化学试剂可在组蛋白酶切前衍生化保护,但是这种方法存在以下缺点:丙酰化修饰也是一种内源的修饰,衍生修饰无法和天然的丙酰化修饰进行区分;其次,组蛋白丙酰化衍生时会发生一些侧链的副反应,包括甲基酯化,酰胺化,过度丙酰化和丙酰化反应不完全;最后,组蛋白进行的这两步衍生化操作繁琐,耗时耗力,对于一些生物分子实验室的可操作性差。因此,本申请的发明人拟提供一种底物序列特异识别的蛋白酶(外膜蛋白酶t)酶切组蛋白以产生适合质谱鉴定长度肽段的新方法,该方法将有利于快速实现组蛋白酶切肽段及翻译后修饰的质谱鉴定,从而进一步促进表观遗传领域中组蛋白翻译后修饰的研究。
技术实现要素:
本发明的目的在于补充现有组蛋白质谱分析技术存在的缺陷,提供一种操作方便、无需化学衍生化、快速高效,实现组蛋白翻译后修饰的质谱鉴定新方法。
本发明提供了一种组蛋白一步酶解并质谱分析的新方法,尤其是利用外膜蛋白酶t来酶切组蛋白以产生适合质谱分析的肽段。本发明利用外膜蛋白酶t的特异底物识别序列(仅识别两个连续的碱性氨基酸,即-kk-,-rr-,-kr-,-rk-),这种酶切识别序列可产生适合质谱分析的肽段长度,并且对发生修饰的赖氨酸和精氨酸也具有较好的酶切效率,可以实现组蛋白一步酶切并进行翻译后修饰的质谱分析。
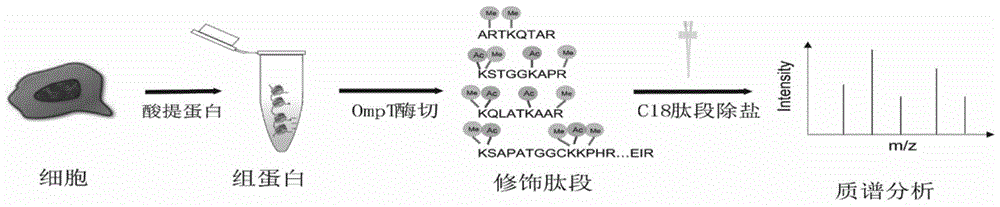
本发明提供的外膜蛋白酶t酶解组蛋白并进行质谱分析的方法,利用底物特异性识别的外膜蛋白酶t直接与组蛋白进行一步酶切,产生适合于质谱分析长度的肽段,经过除盐以后进入液相色谱-质谱分析,对发生修饰的肽段进行定性和定量分析;具体步骤为:
(1)核心组蛋白提取:基于组蛋白的碱性特性,提取细胞核后用盐酸裂解提取核心组蛋白;
(2)蛋白纯化:经步骤(1)酸提后的组蛋白样品进行超滤置换溶液,用水置换后换成酶解缓冲液,去除盐酸和其他杂质;使组蛋白处于酶解液环境;
(3)蛋白酶解:向经步骤(2)处理后的蛋白中加入外膜蛋白酶t,外膜蛋白酶t和组蛋白的质量比1:(20-50),充分混合,25-37摄氏度酶切12-16小时,使蛋白质完全酶解成氨基酸长度在6-20之间的肽段;
(4)质谱分析:对上一步得到的酶解产物进行高速离心,通过除盐柱富集上清中的肽段,冻干,然后进行质谱检测。
步骤(1)中,所述提取核心组蛋白的操作如下:对蛋白样品,首先用缓冲液提取细胞核;采用盐酸裂解液提取细胞核:在细胞核沉淀中加入终浓度为0.1m-0.4m的盐酸,在4-10摄氏度下过夜慢摇孵育,使细胞中的核心组蛋白充分溶解在盐酸溶液里。
步骤(2)中,所述蛋白纯化的操作过程为:将过夜提取后的粗蛋白1000g-12000g高速离心后,将上清转入3kda的超滤管,用双蒸水洗涤2-3次,去除盐酸及其他杂质,最后用酶解缓冲液置换。
步骤(3)中,所述蛋白酶解的操作流程为:先用bca对核组蛋白进行蛋白定量,补充酶解缓冲液至蛋白浓度为0.5μg/μl-2μg/μl;然后加入外膜蛋白酶t,进行酶解。
步骤(4)的操作流程为:对上一步得到的酶解产物进行6000g-12000g离心,取上清,然后除盐、冻干;再重溶于0.05-0.2%fa中;最后进行lc-ms/ms分析。
本发明的一个实施例中,所述步骤(1)中的细胞样品需用pbs清洗2-3次,加入500μl-1ml的裂解液(150mmnacl,20mmtris-hclph7-8,0.1%triton-100以及蛋白酶抑制剂)后进行裂解破碎,孵育时间是30分钟到1小时,温度为4摄氏度;组织样品用pbs清洗干净后剪成尽量小的碎片,加入500μl-1ml的裂解液进行匀浆,匀浆时间为15分钟到30分钟;向高速离心后得到的细胞核沉淀中加入终浓度为0.4m的hcl,轻轻震荡,在静音混匀器上过夜孵育,抽提温度是4摄氏度,抽提时间是12-14小时。
本发明的一个实施例中,所述步骤(2)中每次超滤所需的双蒸纯水的体积为200-400μl,透析至管内剩余体积小于50μl,重复2-3次,离心使用的转速为10000g-12000g,温度为4摄氏度;最终组蛋白处于20-50μl酶解缓冲液中50mmtris-hcl,5mmedta(ph6-7)。
本发明的一个实施例中,所述的步骤(3)中组蛋白样品浓度为0.5μg/μl-2μg/μl,溶于50mmtris-hcl,5mmedta(ph=6-7)的酶解缓冲液中;外膜蛋白酶t的浓度是20ng/μl-100ng/μl,蛋白酶和组蛋白质量比保持在1:20-1:50,酶解反应的时间是12-16小时,酶解温度是25-37摄氏度。
本发明的一个实施例中,所述的步骤(4)中用10%tfa中止酶解反应,使得tfa的最终浓度为0.1%-0.5%;取上清后0.1%tfa溶液平衡除盐柱2-3次,上样3-5次,然后依次用0.1%tfa洗杂一次,80%acn/0.1%tfa洗脱一到两次。
本发明方法中,由于外膜蛋白酶t能特异地识别连续的碱性氨基酸,从而能直接酶解组蛋白,无需衍生化反应就可产生适合质谱分析长度的肽段,能够显著加快组蛋白质谱前处理的流程,具有操作简便、快速的特点。
附图说明
图1为本方法一步酶切组蛋白并质谱分析的流程图。
图2为0.5μg/μl的一系列标准修饰肽段与外膜蛋白酶t孵育12小时后的maldi-tof-ms谱图,maldi-tof-ms谱图纵坐标为质谱峰的相对强度(%),横坐标为质荷比(m/z)。
图3为四种标准组蛋白混合物和外膜蛋白酶t在不同条件下的酶切效率变化图,纵坐标为外膜蛋白酶t的酶解效率指数(谱图数最多的作为100%),横坐标为设置的不同条件;误差线代表三次技术重复。
图4为293t细胞酸提核心组蛋白后经外膜蛋白酶t酶解后进行质谱分析的结果,经搜库软件搜索并定量后,横坐标为修饰位点的情况,纵坐标为修饰的相对含量,从图中可以看出本方法可对核心组蛋白h3和h4上常见的精氨酸修饰和赖氨酸甲基化、乙酰化修饰进行定性和定量。
具体实施方式
下面的实例是对本发明提出的一种基于外膜蛋白酶t酶解组蛋白并质谱分析方法的进一步说明。
实施例1,外膜蛋白酶t对于赖氨酸和精氨酸修饰肽段酶切效率的实验
将5μg/μl的一系列标准肽段(共八条,序列为artkqtarkstggk,其中k上的修饰包括:不含修饰,一甲基化,二甲基化,三甲基化,乙酰化,r上的修饰包括:一甲基化,对称二甲基化,非对称二甲基化)用50mmtris-hcl,5mmedta(ph6-7)的酶解缓冲液按1:10稀释为0.5μg/μl。取30ul该肽段溶液,加入1-3μl0.1μg/μl的外膜蛋白酶t(肽段与酶的比例在1:50-1:100),在25摄氏度下震荡反应12小时,加热煮沸3-5分钟中止酶解反应。反应后溶液高速离心后取上清液0.8μl点样于maldi靶板上,待干燥后再点样等体积的α-氰基-4-羟基肉桂酸基质溶液,干燥结晶后进行maldi-tof-ms分析,结果如图2所示。其中,a是赖氨酸上的不同修饰,b是精氨酸上的不同修饰,每条肽段的反应溶液以及所加的外膜蛋白酶t的量均保持一致;*为未被酶切的标准肽段的单电荷峰,#为酶切后产生的肽段前半段,从图a和图b可以看出,经过外膜蛋白酶t消化后,赖氨酸上发生的甲基化和乙酰化对酶切无影响,精氨酸上的一甲基化对酶切无影响。对称二甲基化和非对称二甲基化对酶切均有抑制,且对称二甲基化的抑制作用更强。
实施例2,外膜蛋白酶t在不同条件下酶解标准组蛋白效率的实验
配制ph值为3,4,5,6,7,8的50mm酶解缓冲液(3-6为柠檬酸-磷酸氢二钠缓冲体系,7-8为tris-hcl),以大肠杆菌纯化的四种组蛋白混合物作为标准蛋白,四种组蛋白加入的比例基本相同。用不同ph值的酶解缓冲液稀释组蛋白至0.1μg/μl,加热煮沸3分钟以破环蛋白结构,冷却后加入1/100的外膜蛋白酶t,在25摄氏度酶解仪孵育过夜反应。反应结束后高速离心,取上清液进行c18柱除盐操作,将酶解后的肽段重溶于0.1%fa后进行ltq-orbitrapxl质谱分析,以计谱图数法作为半定量的依据。温度条件设置为:15℃,25℃,37℃,55℃,65℃,80℃。酶比例条件设置为1:10,1:25,1:75,1:100,1:200,1:400,1;600。有机试剂设置为在酶解缓冲液中加入以下溶液:10%,20%,40%,60%acn以及2m尿素。检测到的外膜蛋白酶解效率指数与各条件的关系如图3所示。从图中可以看出,在温度为37℃,ph为7,酶与蛋白比例为1:25的情况下酶切效率可达到最佳,同时有机溶剂如乙腈对酶切效率影响很小。
实施例3,基于外膜蛋白酶t一步酶解组蛋白并质谱分析效果的实验
取一盘10cm皿收集的293t细胞,用500μl-1mlpbs清洗2-3次后,加入500μl裂解液(150mmnacl,20mmtris-hclph7-8,0.1%triton-100以及蛋白酶抑制剂)充分混合使细胞破碎,10000g离心收集沉淀;再加入800μl0.4mhcl过夜四度孵育。第二天12000g高速离心取上清后转移至3kda的超滤管中,用400μlddh2o洗涤两遍后换成50μl50mmtris-hclph6-7,5mmedta酶解缓冲液;bca定量试剂盒定量后将所得的组蛋白用酶解缓冲液稀释为1μg/μl,按照1:25的比例加入外膜蛋白酶t,37摄氏度反应14小时。之后加入终浓度为0.1%tfa中止酶解反应,高速离心后将上清液(含有酶解好的组蛋白肽段)除盐后进行obitrapfusion质谱分析,经搜库后鉴定到组蛋白修饰如图4。从图中可以看出本方法可对核心组蛋白h3和h4上常见的精氨酸修饰和赖氨酸修饰进行定性和定量。
- 还没有人留言评论。精彩留言会获得点赞!
- 针对磷酸化TAU蛋白的骆驼科单结构域抗体以及生产其缀合物的方法与流程
- 一种用于预防或治疗阿尔茨海默症的组合物的制作方法与工艺
- 骨形成蛋白‑9作为制备治疗和/或预防与胆碱能系统退变相关疾病的药物组合物的用途的制作方法与工艺
- 一种用于增强记忆力的血浆提取物及其制备方法和应用与流程
- 用于治疗神经退化性疾病的新化合物的制作方法与工艺
- 一种高灵敏度可回收纳米生物传感器及其制备方法与应用与流程
- 从血浆中分离用于治疗阿尔兹海默症的混合物的方法及混合物和应用与流程
- 2‑吲哚酮衍生物及其开环衍生物及合成方法与用途与流程
- 神秘果叶提取物在治疗阿尔兹海默病的药物制备中的应用的制造方法与工艺
- 一种Tau蛋白抑制剂及在制备治疗阿尔兹海默症的药物中的应用的制造方法与工艺