获取有关糖尿病信息的方法及其利用与流程
本发明涉及获取有关糖尿病信息的方法。本发明涉及判定糖尿病发病风险的方法。本发明涉及用于获取有关糖尿病信息的试剂盒。本发明涉及用于判定糖尿病发病风险的装置和计算机程序。
背景技术:
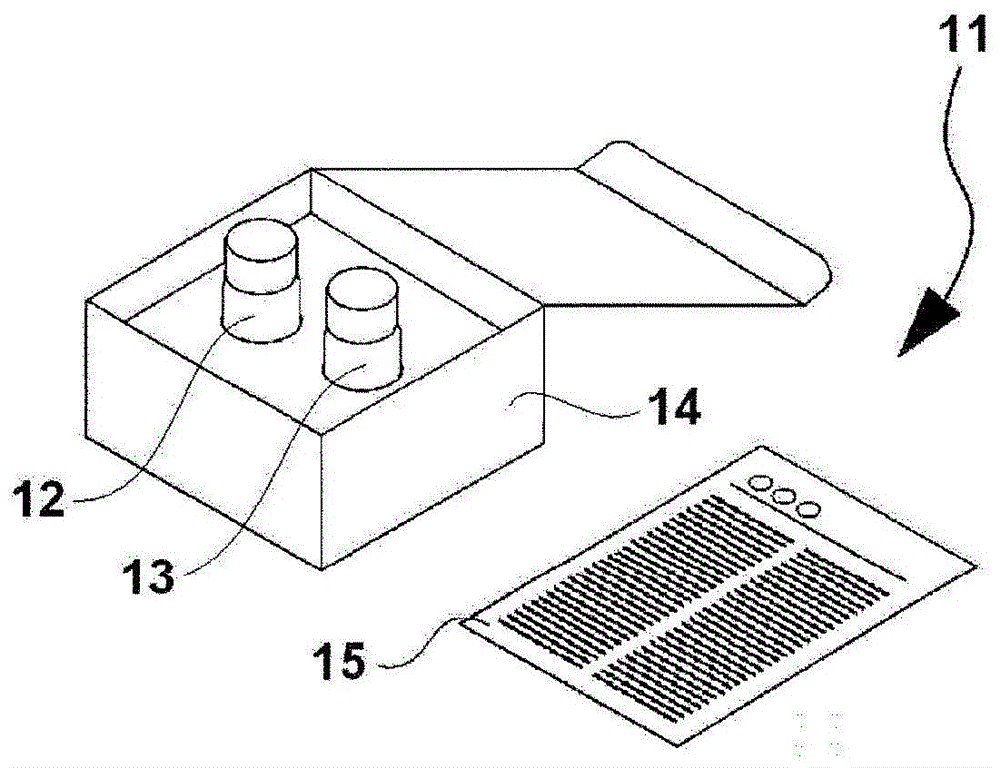
:糖尿病是以慢性高血糖和糖尿为症状的代谢性疾病。糖尿病、特别是2型糖尿病的发病是由于遗传因素、以及暴饮暴食、肥胖、和缺乏运动等环境因素,导致胰岛素的分泌和感受性下降而引起的。截止到2017年为止,全世界糖尿病患者的人数估计超过4亿人,估计未来也会增加。另外,已知糖尿病会引起心血管疾病、神经障碍、肾病、视网膜病变等各种并发症,患者的生活质量下降和医疗费的增加成为问题。另一方面,已知糖尿病发病风险可以通过进行饮食疗法和运动疗法改善生活习惯来降低。从公共卫生和医疗经济的观点考虑,重要的是,找出糖尿病发病风险高的人群,积极进行干预以改善生活习惯。在糖尿病的诊断中使用空腹时血糖、糖负荷试验和血红蛋白a1c(hba1c)的测定值。当这些值比诊断为糖尿病的值低但比正常值高时,诊断为临界型。已知临界型比健康者的糖尿病发病风险高。另外,在非专利文献1中,研究了由高密度脂蛋白(hdl)引起的从巨噬细胞的胆固醇排出与2型糖尿病发病的相关性。在非专利文献1中记载了将胆固醇排泄率除以apoai蛋白质的量而得到的值(胆固醇排泄/apoai比)与2型糖尿病的发病相关。另一方面,非专利文献1中表明,非糖尿病受试者组与糖尿病受试者组之间的胆固醇排泄率本身没有显著差异。现有技术文献非专利文献非专利文献1:blanco-rojo,r.等人,hdlcholesteroleffluxnormalizedtoapoa-iisassociatedwithfuturedevelopmentoftype2diabetes:fromthecordioprevtrial.sci.rep.,2017,7(1):12499技术实现要素:发明要解决的课题本发明的目的是提供可预测糖尿病发病风险的新的手段。解决课题的手段本发明人等发现,每单位体积受试者的生物样品的甾醇摄取能力的测定值成为糖尿病发病风险的指标,从而完成了本发明。为此,本发明提供获取受试者的有关糖尿病信息的方法,其包括测定受试者的生物样品中的脂蛋白的甾醇摄取能力,每单位体积生物样品的甾醇摄取能力的测定值成为糖尿病发病风险的指标。本发明提供判定受试者的糖尿病发病风险的方法,其包括:测定受试者的生物样品中的脂蛋白的甾醇摄取能力的工序、以及以下的(1)和/或(2)的工序:(1)当每单位体积生物样品的甾醇摄取能力的测定值为规定的阀值以下时,判定为糖尿病发病风险高的工序,(2)当每单位体积生物样品的甾醇摄取能力的测定值高于规定的阀值时,判定为糖尿病发病风险低的工序。本发明提供用于获取有关糖尿病信息的试剂盒,其包括标记甾醇、与脂蛋白结合的捕捉体。本发明提供标记甾醇和捕捉体在制备用于获取有关糖尿病信息的试剂盒中的用途。上述捕捉体与脂蛋白结合,上述试剂盒用于上述方法。本发明提供糖尿病发病风险的判定装置:其具备包括处理器和在处理器控制下的存储器的计算机,在存储器中记录有用于使计算机执行如下步骤的计算机程序:获取受试者的生物样品中的脂蛋白的甾醇摄取能力的测定值的步骤,基于每单位体积所述生物样品的甾醇摄取能力的测定值,判定糖尿病发病风险的步骤,以及输出判定结果的步骤。本发明提供用于判定糖尿病发病风险的计算机程序,其为通过计算机记录在可读取介质中的计算机程序,其使得计算机执行如下步骤:获取受试者的生物样品中的脂蛋白的甾醇摄取能力的测定值的步骤,基于每单位体积生物样品的甾醇摄取能力的测定值,判定糖尿病发病风险的步骤,以及输出判定结果的步骤。发明效果本发明可获取每单位体积受试者的生物样品的甾醇摄取能力的测定值作为新的糖尿病发病风险的指标。附图说明[图1]是显示用于获取有关糖尿病信息的试剂盒的外观的一例的图。[图2]是显示用于获取有关糖尿病信息的试剂盒的外观的一例的图。[图3]是显示糖尿病发病风险的判定装置的一例的概略图。[图4]是显示糖尿病发病风险的判定装置的硬件构成的框图。[图5]是使用糖尿病发病风险的判定装置的判定的流程图。[图6]是使用糖尿病发病风险的判定装置的判定的流程图。具体实施方式[1.用于获取有关糖尿病信息的方法]在本实施方式的用于获取有关糖尿病信息的方法(以下,也简称为“方法”)中,测定受试者的生物样品中的脂蛋白的甾醇摄取能力。(受试者)受试者只要没有被诊断为糖尿病,就没有特殊限定。作为受试者,例如可举出健康者、没有心血管疾病病史者、具有暴饮暴食、肥胖、缺乏运动等糖尿病发病的环境因素的人等。作为没有心血管疾病病史的人,例如可举出没有经历过心肌梗塞、脑梗塞和冠状动脉成形术的任一种的人。(生物样品)生物样品只要是含有受试者的脂蛋白的样品,就没有特殊限定。作为这样的生物样品,例如可举出血液样品。作为血液样品,例如可举出血液(全血)、血浆、血清等,特别优选为血清。将生物样品通过超离心分离法、聚乙二醇(peg)沉淀法等已知的方法分离或分级,可以获得规定的含有脂蛋白的级分。在本实施方式中,可以将从生物样品制备的规定的含有脂蛋白的级分(以下,也称为“脂蛋白级分”)用于测定后述的甾醇摄取能力。本说明书中的用语“生物样品”不仅包括从受试者中采集的生物样品,也包括从该生物样品制备的脂蛋白级分。作为脂蛋白级分,特别优选为hdl级分。脂蛋白可以是hdl、低密度脂蛋白(ldl)、中间密度脂蛋白(idl)、极低密度脂蛋白(vldl)、和乳糜微粒(cm)的任一种。hdl是具有1.063g/ml以上的密度的脂蛋白。ldl是具有1.019g/ml以上且小于1.063g/ml的密度的脂蛋白。idl是具有1.006g/ml以上且小于1.019g/ml的密度的脂蛋白。vldl是具有0.95g/ml以上且小于1.006g/ml的密度的脂蛋白。cm是具有小于0.95g/ml的密度的脂蛋白。在本实施方式中,优选测定hdl的甾醇摄取能力。已知脂蛋白将胆固醇进行酯化而摄取。作为标记甾醇,在使用后述的标记胆固醇的情况下,可以在生物样品中添加脂蛋白对胆固醇的酯化反应所需的脂肪酸或含有其的组合物(例如脂质体)。在本实施方式中,可以将生物样品稀释后使用。例如,为了调整脂蛋白的浓度,可以将生物样品用水性介质稀释而得到的液体用于后述的测定。作为这样的水性介质,例如可举出水、生理盐水、磷酸缓冲生理盐水(pbs)、tris-hcl等缓冲液。在本实施方式中,可以将生物样品在后述的不具有环状结构的表面活性剂的存在下稀释。例如,可以用将不具有环状结构的表面活性剂溶解于上述水性介质而得到的溶液来稀释生物样品。通过如此稀释的生物样品与标记甾醇混合,使脂蛋白与标记甾醇在不具有环状结构的表面活性剂的存在下接触。作为脂蛋白的构成成分的载脂蛋白的浓度成为生物样品中的脂蛋白的浓度的指标。在本实施方式中,通过基于得到的载脂蛋白的浓度来稀释生物样品,可以调节生物样品中的脂蛋白浓度。载脂蛋白的浓度可以通过已知的免疫学测定法(例如,免疫比浊法)测定。作为载脂蛋白的浓度,特别优选apoai的浓度。载脂蛋白的测定优选采集生物样品的一部分用作测定样品,通过与甾醇摄取能力的测定不同的方式来进行。在本实施方式中,可以将生物样品在环状低聚糖的存在下稀释。例如可以用将环状低聚糖溶解于上述水性介质而得到的溶液来稀释生物样品。作为环状低聚糖,例如可举出环糊精、羟丙基环糊精等。环状低聚糖包合来自生物样品的胆固醇,起封闭剂的作用。在本实施方式中,可以将生物样品在与和测定对象的脂蛋白不同的脂蛋白相结合的成分的存在下稀释。例如可以用将该成分溶解于上述水性介质而得到的溶液来稀释生物样品。作为与和测定对象的脂蛋白不同的脂蛋白相结合的成分,例如可举出杯芳烃等。杯芳烃与ldl、vldl和cm结合,但不与hdl结合。在测定hdl的摄取能力时,通过在样品中添加杯芳烃,可以掩蔽来自样品的ldl、vldl和cm。在本实施方式中,可以将生物样品在用于防止标记甾醇的非特异性吸附的封闭剂的存在下稀释。例如,可以用将该封闭剂溶解于上述水性介质而得到的溶液来稀释生物样品。通过添加封闭剂,例如可以抑制后述的固相和捕捉体对标记甾醇的非特异性吸附。封闭剂只要是能够抑制标记甾醇吸附于标记胆固醇以外的物质的成分即可。作为优选的封闭剂,例如可举出2-甲基丙烯酰氧基乙基磷酰胆碱系聚合物。该聚合物既可以是2-甲基丙烯酰氧基乙基磷酰胆碱的均聚物,也可以是其与其他单体的共聚物。作为其他单体,优选具有碳数1~20的烷基作为疏水性基团的丙烯酸酯或甲基丙烯酸酯。2-甲基丙烯酰氧基乙基磷酰胆碱系聚合物是市售的。例如可举出日油株式会社的lipidure(商标)系列,其中,特别优选lipidure-bl203。(无细胞体系的测定方法)在本实施方式中,优选通过无细胞体系测定生物样品中的脂蛋白的甾醇摄取能力。无细胞体系是指为了用于测定脂蛋白的甾醇摄取能力而不添加细胞。通过无细胞体系测定脂蛋白的甾醇摄取能力的方法本身是本
技术领域:
公知的,例如记载于us2017/0315112a1(将us2017/0315112a1通过参考引入本说明书)。具体地,通过使生物样品中的脂蛋白与标记甾醇接触,制备摄取该标记甾醇的脂蛋白,基于被脂蛋白摄取的标记甾醇的标记,测定标记甾醇的摄取能力。在该测定方法中,由于标记甾醇被直接摄入样品中的脂蛋白,因此,可以不像以往的胆固醇排出功能的测定方法那样使用巨噬细胞等滞留胆固醇的细胞。在本实施方式中,即使在生物样品中含有来自受试者的细胞的情况下,认为该细胞本身几乎不影响脂蛋白对标记甾醇的摄取,测定方法被视为无细胞体系。(标记甾醇)标记甾醇是具有标记物的甾醇。以下,将标记甾醇所具有的标记物也称为“第1标记”。用于标记甾醇的甾醇只要能被摄入脂蛋白,就没有特殊限定。作为这样的甾醇,例如可举出胆固醇及其衍生物。作为胆固醇衍生物,例如可举出胆汁酸的前体、甾体的前体等。具体地,优选3β-羟基-δ5-胆酸、24-氨基-5-胆甾-3β-醇等。在本实施方式中,标记甾醇优选为具有标记物的胆固醇(以下,也称为“标记胆固醇”)。标记胆固醇中的胆固醇部分可以具有天然存在的胆固醇结构,或者可以具有从与天然存在的胆固醇的c17位键合的烷基链上除去了1个以上亚甲基和/或甲基的胆固醇(也称为降胆固醇)结构。由于脂蛋白将胆固醇进行酯化而摄取,因此优选使用通过脂蛋白进行了酯化的标记胆固醇。在本实施方式中,标记胆固醇在与生物样品混合时,通过该样品中含有的生物体来源的卵磷脂-胆固醇脂酰转移酶(lcat)被酯化。确认采用脂蛋白将标记胆固醇进行酯化的方法本身是本技术中公知的,本领域技术人员可以通过常规方法进行。第1标记只要是可以检测被脂蛋白摄取的标记甾醇的标记物,就没有特殊限定。第1标记例如可以是其本身成为检测对象的标记,也可以是产生可检测的信号的物质(以下,也称为“信号产生物质”)。作为第1标记的标记只要不阻碍脂蛋白对甾醇的摄取,而且可与该标记特异性结合的物质是存在的或可获得的,就没有特殊限定。以下,带有标记作为第1标记的甾醇也称为“附加标记的甾醇”。同样地,带有标记作为第1标记的胆固醇也称为“附加标记的胆固醇”。附加标记的胆固醇本身是本
技术领域:
公知的,例如记载于us2017/0315112a1。作为附加标记的胆固醇,例如可举出下述式(i)表示的附加标记的胆固醇。[化1](式中,r1为可具有甲基的碳数1~6的亚烷基,x和y相同或不同,表示-r2-nh-、-nh-r2-、-r2-(c=o)-nh-、-(c=o)-nh-r2-、-r2-nh-(c=o)-、-nh-(c=o)-r2-、-r2-(c=o)-、-(c=o)-r2-、-r2-(c=o)-o-、-(c=o)-o-r2-、-r2-o-(c=o)-、-o-(c=o)-r2-、-r2-(c=s)-nh-、-(c=s)-nh-r2-、-r2-nh-(c=s)-、-nh-(c=s)-r2-、-r2-o-、-o-r2-、-r2-s-、或-s-r2-,其中,r2各自独立地为键、可具有取代基的碳数1~10的亚烷基、可具有取代基的碳数6~12的亚芳基或亚杂芳基、或者可具有取代基的碳数3~8的亚环烷基或亚杂环烷基,l表示-(ch2)d-[r3-(ch2)e]f-、或-[(ch2)e-r3]f-(ch2)d-,其中,r3为氧原子、硫原子、-nh-、-nh-(c=o)-或-(c=o)-nh-,tag为标记,a和c相同或不同,为0~6的整数,b为0或1,d和e相同或不同,为0~12的整数,f为0~24的整数。)式(i)中,当a、b和c均为0时,该式表示的附加标记的胆固醇不具有连接基,标记和胆固醇部分直接键合。在式(i)中,当a、b和c的任一个不为0时,该式表示的附加标记的胆固醇在标记和胆固醇部分之间具有连接基(-[x]a-[l]b-[y]c-)。认为通过连接基,在脂蛋白的外表面露出的标记与捕捉体更容易键合。以下,说明式(i)的各取代基。r1可以以碳数1~6的亚烷基为主链,在任意位置具有甲基。r1相当于与天然存在的胆固醇的c17位键合的烷基链。在本实施方式中,当r1的碳数为1~5时,优选在天然存在的胆固醇的c20的位置具有甲基。当r1的碳数为6时,优选为与天然存在的胆固醇的c20位~c27位的烷基链相同的结构。[x]a相当于r1与l、[y]c或标记的连接部分。[y]c相当于r1、[x]a或l与标记的连接部分。x和y根据胆固醇部分与连接基相结合的反应以及连接基与标记相结合的反应的种类来确定。关于r2,键是指直接键,其间没有任何其他原子。当r2为碳数1~10的亚烷基时,作为这样的亚烷基,例如可举出亚甲基、亚乙基、亚丙基、亚异丙基、亚丁基、亚异丁基、亚戊基、亚新戊基、亚己基、亚庚基、亚辛基、2-乙基亚己基、亚壬基和亚癸基等基团。其中,优选碳数1~4的亚烷基。当r2为具有取代基的亚烷基时,上述碳数不包括取代基的碳数。当r2为亚芳基或亚杂芳基时,这样的基团可以为可含有选自n、s、o和p中的1个以上杂原子的碳数6~12的芳环。例如可举出亚苯基、亚萘基、亚联苯基、亚呋喃基、亚吡咯基、亚噻吩基、亚三唑基、亚二唑基、亚吡啶基、亚嘧啶基等基团。当r2为具有取代基的亚芳基或杂亚芳基时,上述碳数中不包括取代基的碳数。当r2为亚环烷基或杂亚环烷基时,这样的基团可以为可含有选自n、s、o和p中的1个以上杂原子的碳数3~8的非芳香环。例如可举出亚环丙基、亚环丁基、亚环戊基、亚环己基、亚环庚基、亚环辛基、亚吡咯烷基、亚哌啶基、亚吗啉基等基团。当r2为具有取代基的亚环烷基或亚杂环烷基时,上述碳数不包括取代基的碳数。作为r2中的取代基,例如可举出羟基、氰基、烷氧基、=o、=s、-no2、-sh、卤素、卤代烷基、杂烷基、羧基烷基、胺、酰胺、和硫醚等基团。r2可具有多个取代基。其中,卤素表示氟、氯、溴或碘。烷氧基表示-o-烷基,该烷基为碳数1~5,优选碳数1或2的直链或支链状饱和脂族烃基。优选地,a和c均为1,x和y相同或不同,为-(c=o)-nh-、或-nh-(c=o)-。l相当于间隔基,具有向连接基赋予规定长度的聚合物结构。该聚合物结构部分优选具有不阻碍脂蛋白对胆固醇的摄取、而且连接基部分不易被脂蛋白摄取的性质。作为这样的聚合物,可举出聚乙二醇(peg)等亲水性聚合物。在优选的实施方式中,l是由-(ch2)d-[o-(ch2)e]f-、或-[(ch2)e-o]f-(ch2)d-表示的结构。其中,d和e相同或不同,为0~12的整数,优选为2~6的整数,更优选均为2。f为0~24的整数,优选为2~11的整数,更优选为4~11的整数。标记可以为天然来源的物质和合成物质的任一种,例如可举出化合物、肽、蛋白质、核酸和它们的组合等。化合物可以是本
技术领域:
公知的标记化合物,只要可与其特异性结合的物质是存在的或可获得的,例如可举出色素化合物等。在该
技术领域:
中,已知胆固醇通过被酯化而脂溶性增加,促进脂蛋白对其的摄取。胆固醇上加成的标记可以是脂溶性或疏水性的物质。作为标记和可与该标记特异性结合的物质的组合,例如可举出:抗原和识别该抗原的抗体、半抗原和抗半抗原抗体、肽或蛋白质和识别它们的适体、配体及其受体、寡核苷酸和具有其互补链的寡核苷酸、生物素和抗生物素蛋白(或链霉抗生物素蛋白)、组氨酸标记(包含6~10个残基的组氨酸的肽)和镍、谷胱甘肽-s-转移酶(gst)和谷胱甘肽等。作为标记的抗原可以是本
技术领域:
中公知的肽标记和蛋白质标记,例如可举出flag(注册商标)、血凝素(ha)、myc蛋白质、绿色荧光蛋白质(gfp)等。作为标记的半抗原例如可举出2,4-二硝基苯酚等。对于附加标记的甾醇而言,例如可举出加成有下述式(ii)表示的结构或下述式(iii)表示的结构作为标记的甾醇。[化2][化3]式(ii)表示的结构为硼二吡咯亚甲基(bodipy(注册商标))骨架,式(iii)表示的结构表示生物素的一部分。优选加成有式(ii)或(iii)表示的结构作为标记的甾醇,因为对这样的标记的捕捉体一般是可获得的。另外,也优选加成有2,4-二硝基苯基(dnp)基团作为标记的甾醇,因为抗dnp抗体是市售的。作为不具有连接基的附加标记的胆固醇,例如可举出下述式(iv)表示的荧光标记胆固醇(23-(二吡咯亚甲基二氟化硼)-24-降胆固醇,casno:878557-19-8)。[化4]该荧光标记胆固醇由avantipolarlipids公司以topfluorcholesterol的商品名销售。式(iv)表示的荧光标记胆固醇的标记(具有bodipy骨架结构的荧光部分)与胆固醇的c23位直接键合。作为与上述具有bodipy骨架结构的荧光部分特异性结合的捕捉体,市售有抗bodipy抗体(bodipyflrabbitigg级分,a-5770,lifetechnologies公司)。作为标记通过连接基而结合的附加标记的胆固醇,可举出下述式(v)表示的带生物素的胆固醇。[化5](式中,n为0~24的整数,优选为2~11的整数,更优选为4~11的整数。)在该附加标记的胆固醇中,标记(式(iii)表示的生物素部分)通过连接基(聚乙二醇)与胆固醇部分结合。作为与生物素部分特异性结合的捕捉体,优选为抗生物素蛋白或链霉抗生物素蛋白。另外,也市售有与辣根过氧化物酶(hrp)、碱性磷酸酶(alp)等标记物结合的抗生物素蛋白或链霉抗生物素蛋白。另外,作为标记通过连接基结合的附加标记的胆固醇,可举出下述式(vi)表示的带dnp的胆固醇。[化6]在该附加标记的胆固醇中,dnp通过连接基(-(c=o)-nh-ch2-ch2-nh-)与胆固醇部分结合。作为与dnp特异性结合的捕捉体,优选为抗dnp抗体。另外,也市售有与hrp、alp等标记物结合的抗dnp抗体。甾醇部分与标记的结合方式没有特殊限定,可以将甾醇部分与标记结合,也可以通过连接基将甾醇部分与标记结合。结合手段没有特殊限定,例如,采用官能团的交联是简便而优选的。官能团没有特殊限定,但优选氨基、羧基和巯基,因为可以使用市售的交联剂。对于胆固醇而言,由于与c17位键合的烷基链上没有官能团,因而在标记的加成中,优选使用在该烷基链上没有官能团的胆固醇衍生物。作为这样的胆固醇衍生物,例如可举出胆汁酸的前体、甾体的前体等。具体地,优选3β-羟基-δ5-胆酸、24-氨基-5-胆甾-3β-醇等。标记的官能团根据标记的种类而不同。例如,在将肽或蛋白质用作标记的情况下,可以利用氨基、羧基和巯基(sh基)。在将生物素用作标记的情况下,可以利用侧链的羧基。连接基优选为在两端具有官能团的聚合物化合物。予以说明,在加成生物素作为标记的情况下,可以使用市售的生物素标记试剂。该试剂含有末端具有氨基等官能团的结合有各种长度的间隔臂(peg等)的生物素。作为用作第1标记的信号发生物质,例如可举出荧光物质、显色物质、发光物质、放射性同位素等。其中,特别优选荧光物质。荧光物质优选含有具有有极性结构的荧光团。在本
技术领域:
中,含有具有有极性结构的荧光团的荧光物质本身是已知的。用信号发生物质标记的甾醇可以通过将该物质用已知方法加成到甾醇中来制造。予以说明,在甾醇中,信号发生物质的加成位置没有特殊限定,根据所使用的信号发生物质的种类来适当地确定。甾醇与信号发生物质的结合方式没有特殊限定,优选两者通过共价键直接键合。作为含有荧光物质的甾醇,例如可举出含有具有上述式(ii)表示的bodipy骨架结构的荧光团的荧光标记甾醇等。在本实施方式中,可以使用市售的荧光标记甾醇。例如,作为含有具有bodipy骨架结构的荧光团的甾醇,可举出上述式(iv)表示的荧光标记胆固醇。式(iv)表示的荧光标记胆固醇通过470~490nm的激发波长,产生525~550nm的波长的荧光信号。(摄取有标记甾醇的脂蛋白的制备)在本实施方式中,生物样品中的脂蛋白与标记甾醇的接触例如可通过混合生物样品和含有标记甾醇的溶液来进行。在将它们混合后,脂蛋白开始摄取标记甾醇,得到摄取有标记甾醇的脂蛋白。混合的温度和时间的条件没有特殊限定。例如,可以将生物样品和标记甾醇的混合液在20~48℃,优选25~42℃下温育1分钟~24小时、优选10分钟~2小时。在温育期间,混合液既可以静置,也可以搅拌或振荡。标记甾醇的添加量没有特殊限定,但为了不耗尽标记甾醇,可稍微过量地添加。例如,可添加标记甾醇至其终浓度为0.1μm以上30μm以下,优选为1μm以上10μm以下。(不具有环状结构的表面活性剂)在本实施方式中,可以在不具有环状结构的表面活性剂的存在下制备摄取有标记甾醇的脂蛋白。不具有环状结构的表面活性剂是指作为非环式化合物的表面活性剂。此时,样品中的脂蛋白与标记甾醇的接触例如可以通过将生物样品、含有标记甾醇的溶液、和含有不具有环状结构的表面活性剂的溶液混合来进行。混合的顺序没有特殊限定。或者,可以预先制备含有不具有环状结构的表面活性剂和标记甾醇的溶液(以下,也称为“反应缓冲液”),将该反应缓冲液与生物样品混合。通过在不具有环状结构的表面活性剂的存在下进行上述混合,促进脂蛋白的摄取反应。另外,不具有环状结构的表面活性剂也具有封闭剂的作用。因此,不必使用牛血清白蛋白(bsa)等在免疫学测定中一般用作封闭剂的动物来源的蛋白质。动物来源的蛋白质有时批次之间的品质不稳定。另外,动物来源的蛋白质与表面活性剂相比,存在与生物样品中的成分、添加到测定体系中的抗体、标记甾醇等非特异性结合的倾向。由于不具有环状结构的表面活性剂为合成品,因此品质基本上稳定,对测定的影响比动物来源的蛋白质轻微。不具有环状结构的表面活性剂可适宜选自非离子性表面活性剂、阳离子性表面活性剂、阴离子性表面活性剂和两性表面活性剂,优选为非离子性表面活性剂。不具有环状结构的非离子性表面活性剂没有特殊限定,例如可举出:聚亚烷基二醇环氧乙烷加成物、聚氧乙烯烷基醚、聚氧乙烯聚氧丙烯烷基醚、聚氧亚烷基二烷基醚、聚氧亚烷基烯基醚、聚氧乙烯支链烷基醚、聚氧乙烯聚氧丙烯烷基醚、聚氧亚烷基醚、聚乙二醇脂肪酸酯、甘油脂肪酸酯、聚甘油脂肪酸酯、丙二醇脂肪酸酯、聚丙二醇脂肪酸酯、聚氧乙烯椰油脂肪酸甘油酯、聚氧乙烯硬化蓖麻油、聚氧乙烯蓖麻油、聚氧乙烯三异硬脂酸、聚氧乙烯山梨糖醇脂肪酸酯、聚氧乙烯烷基胺、聚氧乙烯聚氧丙烯烷基胺、聚氧乙烯烷基丙二胺、脂肪酸二乙醇酰胺、聚氧乙烯脂肪酸单乙醇酰胺等。不具有环状结构的非离子性表面活性剂可以单独使用或组合使用2种以上。在上述非离子性表面活性剂中,优选聚氧乙烯烷基醚和聚亚烷基二醇环氧乙烷加成物。作为聚氧乙烯烷基醚,例如可举出聚氧乙烯月桂基醚、聚氧乙烯鲸蜡基醚、聚氧乙烯硬脂基醚、聚氧乙烯山嵛基醚等。在本实施方式中,特别优选聚氧乙烯月桂基醚。聚氧乙烯月桂基醚是市售的,例如可举出日油株式会社的nonionk-230和nonionk-220、花王株式会社的emulgen123p和emulgen130k等。在本实施方式中,作为聚亚烷基二醇环氧乙烷加成物,优选为嵌段共聚物,更优选为环氧乙烷和环氧丙烷的三嵌段共聚物。作为这样的嵌段共聚物的非离子型表面活性剂,特别优选下述式(vii)表示的化合物。[化7](式中,x、y和z相同或不同,为1以上的整数,聚环氧丙烷部分的分子量为2750以下。)式(vii)表示的化合物也被称为聚丙二醇环氧乙烷加成物、聚氧乙烯聚氧丙二醇、聚氧乙烯聚氧丙烯嵌段聚合物、或泊洛沙姆(商标)型非离子表面活性剂。式(vii)中,聚环氧丙烷部分(以下,也称为“ppo”)的分子量是指由-(o-ch(ch3)-ch2)y-表示的部分的分子量,是由分子结构式计算出的分子量。在本实施方式中,ppo的分子量优选为900以上2750以下,更优选为950以上2750以下,特别优选为950以上2250以下。泊洛沙姆型非离子表面活性剂中的ppo的疏水性比较高,因此,ppo的分子量越大,表面活性剂的疏水性也越大。因此,ppo的分子量大于2750的泊洛沙姆型非离子表面活性剂有可能与脂蛋白相作用,阻碍胆固醇的摄取。式(vii)表示的化合物的平均分子量优选为1000~13000。式(vii)中,x与z的和优选为2~240。另外,式(vii)中,y优选为15~47,更优选为16~47,特别优选为16~39。本说明书中,“平均分子量”是通过凝胶渗透色谱法(gpc)测定的重均分子量。泊洛沙姆型非离子表面活性剂是市售的,例如可举出basf公司的泊洛沙姆系列、日油株式会社的pronon系列、旭电化工业株式会社的adekapluronic系列等。泊洛沙姆系列通过以ppo的分子量为纵轴、以环氧乙烷(eo)含量(%)为横轴的泊洛沙姆网格(例如,参照pitto-barrya.和barryn.p.e.,poly.chem.,2014,vol.5,p.3291-3297)来分类。泊洛沙姆网格不仅由学术文献提供,而且由各种制造业者提供。在本实施方式中,可以基于泊洛沙姆网格来选择式(vii)表示的化合物。作为式(vii)表示的泊洛沙姆型非离子表面活性剂,例如可举出泊洛沙姆l31(ppo的分子量:950,eo含有率:10%)、泊洛沙姆l35(ppo的分子量:950,eo含有率:50%)、泊洛沙姆f38(ppo的分子量:950,eo含有率:80%)、泊洛沙姆l42(ppo的分子量:1200,eo含有率:20%)、泊洛沙姆l43(ppo的分子量:1200,eo含有率:30%)、泊洛沙姆l44(ppo的分子量:1200,eo含有率:40%)、泊洛沙姆l61(ppo的分子量:1750,eo含有率:10%)、泊洛沙姆l62(ppo的分子量:1750,eo含有率:20%)、泊洛沙姆l63(ppo的分子量:1750,eo含有率:30%)、泊洛沙姆l64(ppo的分子量:1750,eo含有率:40%)、泊洛沙姆p65(ppo的分子量:1750,eo含有率:50%)、泊洛沙姆f68(ppo的分子量:1750,eo含有率:80%)、泊洛沙姆l72(ppo的分子量:2050,eo含有率:20%)、泊洛沙姆p75(ppo的分子量:2050,eo含有率:50%)、泊洛沙姆f77(ppo的分子量:2050,eo含有率:70%)、泊洛沙姆l81(ppo的分子量:2250,eo含有率:10%)、泊洛沙姆p84(ppo的分子量:2250,eo含有率:40%)、泊洛沙姆p85(ppo的分子量:2250,eo含有率:50%)、泊洛沙姆f87(ppo的分子量:2250,eo含有率:70%)、泊洛沙姆f88(ppo的分子量:2250,eo含有率:80%)、泊洛沙姆l92(ppo的分子量:2750,eo含有率:20%)、泊洛沙姆p94(ppo的分子量:2750,eo含有率:40%)、泊洛沙姆f98(ppo的分子量:2750,eo含有率:80%)等。或者,环氧乙烷和环氧丙烷的三嵌段共聚物可以是下述式(viii)表示的化合物。该化合物也被称为反向泊洛沙姆型非离子表面活性剂。[化8](式中,p、q和r相同或不同,为1以上的整数,聚环氧丙烷部分的分子量为2750以下。)式(viii)中,聚环氧丙烷部分的分子量是指由-(o-ch(ch3)-ch2)p-和-(o-ch(ch3)-ch2)r-表示的部分的分子量的合计,是由分子结构式计算出的分子量。在本实施方式中,ppo的分子量优选为900以上2750以下,更优选为950以上2250以下。式(viii)表示的泊洛沙姆型非离子表面活性剂是市售的,例如可举出basf公司的泊洛沙姆10r5(ppo的分子量:950,eo含有率:50%)等。式(viii)表示的化合物的平均分子量优选为1000~13000。式(viii)中,q优选为2~240。另外,式(viii)中,p与r的和优选为15~47,更优选为16~47,特别优选为16~39。本说明书中,“平均分子量”是通过gpc测定的重均分子量。(脂蛋白和第1捕捉体的复合物的形成)本实施方式的方法优选包括如下工序:使摄取有标记甾醇的脂蛋白和与该脂蛋白结合的第1捕捉体接触,形成含有摄取有标记甾醇的脂蛋白和第1捕捉体的复合物。通过脂蛋白和第1捕捉体的接触,第1捕捉体与脂蛋白结合,形成脂蛋白和第1捕捉体的复合物。第1捕捉体只要是可与脂蛋白表面的一部分特异性结合的物质,就没有特殊限定。作为第1捕捉体,优选为与脂蛋白特异性结合的抗体,更优选为可与作为脂蛋白的构成成分的载脂蛋白特异性结合的抗体。作为这样的抗体,例如可举出抗apoai抗体、抗apoaii抗体等。其中,特别优选抗apoai抗体。可以使用市售的抗脂蛋白抗体和抗apoai抗体。抗脂蛋白抗体和抗apoai抗体可以为单克隆抗体,也可以为多克隆抗体。抗体的来源没有特殊限定,可以是小鼠、大鼠、仓鼠、兔子、山羊、马、骆驼等任意的哺乳动物来源的抗体。另外,抗体的同种型可以为igg、igm、ige、iga等任一种,优选为igg。在本实施方式中,作为第1捕捉体,可以使用抗体的片段及其衍生物,例如可举出fab片段、f(ab')2片段等。脂蛋白和第1捕捉体的接触可以在脂蛋白和标记甾醇的接触之前、与脂蛋白和标记甾醇的接触基本上同时、或者在脂蛋白和标记甾醇的接触之后进行。脂蛋白和第1捕捉体的接触例如可以通过将生物样品、含有标记甾醇的溶液、和含有第1捕捉体的溶液混合来进行。混合可以在不具有环状结构的表面活性剂的存在下进行。生物样品、标记甾醇、第1捕捉体这三者的混合顺序没有特殊限定。它们可以基本上同时混合,也可以逐次混合。第1捕捉体的添加量没有特殊限定,本领域技术人员可根据第1捕捉体的种类等来适当地设定。在优选的实施方式中,在脂蛋白和标记甾醇的接触之后,进行该脂蛋白和第1捕捉体的接触。由此,形成摄取有标记甾醇的脂蛋白和第1捕捉体的复合物。例如,首先,将含有脂蛋白的样品和含有标记甾醇的溶液混合,制备摄取有标记甾醇的脂蛋白。向其中添加含有第1捕捉体的溶液进行混合。此时,脂蛋白摄取标记甾醇后,形成该脂蛋白和第1捕捉体的复合物。在使用抗apoai抗体作为第1捕捉体时,在抗apoai抗体与摄取有标记甾醇的脂蛋白接触之前,可以用氧化剂处理该脂蛋白。通过氧化剂的作用,抗apoai抗体与脂蛋白的反应性得以改善。作为这样的氧化剂,例如可举出过氧化氢、过氧化亚硝酸盐、二氧化氯、次氯酸等。脂蛋白和第1捕捉体的接触的温度和时间的条件没有特殊限定。例如,可以将上述混合液在20~48℃,优选25~42℃下温育1分钟~24小时、优选10分钟~2小时。在温育期间,混合液既可以静置,也可以搅拌或振荡。在本实施方式中,脂蛋白和第1捕捉体的复合物可以形成在固相上。例如,可以将生物样品、标记甾醇溶液、含有第1捕捉体的溶液、和固相混合。另外,可以在将含有脂蛋白的样品、标记甾醇溶液、和含有第1捕捉体的溶液混合后,将得到的混合液与固相混合。或者,可以将第1捕捉体预先固定化在固相上来使用。例如,通过在含有脂蛋白的样品和标记甾醇溶液的混合液中添加将抗脂蛋白抗体固定化的固相,在固相上形成复合物。混合可以在不具有环状结构的表面活性剂的存在下进行。使用固相时的温度和时间的条件没有特殊限定。例如,可以是与上述脂蛋白和第1捕捉体的接触相同的条件。作为固相,优选可捕捉复合物中的第1捕捉体的固相。固相的种类没有特殊限定,例如可举出物理吸附抗体的材质的固相、与抗体特异性结合的分子被固定化的固相等。作为与抗体特异性结合的分子,可举出蛋白质a或g、特异性识别抗体的抗体(即,二次抗体)等。另外,可以使用存在于抗体和固相之间的物质的组合来将两者结合。作为这样的物质的组合,可举出生物素和抗生物素蛋白(或链霉抗生物素蛋白)、半抗原和抗半抗原抗体等的组合。例如,在预先用生物素修饰第1捕捉体的情况下,通过将抗生物素蛋白或链霉抗生物素蛋白固定化的固相,可以捕捉第1捕捉体。固相的材料可以选自有机高分子化合物、无机化合物、生物体高分子等。作为有机高分子化合物,例如可举出胶乳、聚苯乙烯、聚丙烯、苯乙烯-甲基丙烯酸共聚物、苯乙烯-(甲基)丙烯酸缩水甘油基酯共聚物、苯乙烯-苯乙烯磺酸盐共聚物、甲基丙烯酸聚合物、丙烯酸聚合物、丙烯腈丁二烯苯乙烯共聚物、氯乙烯-丙烯酸酯共聚物、聚乙酸乙烯酯丙烯酸酯等。作为无机化合物,磁性体(氧化铁、氧化铬、钴和铁氧体等)、二氧化硅、氧化铝、玻璃等。作为生物体高分子,可举出不溶性琼脂糖、不溶性葡聚糖、明胶、纤维素等。可以组合使用其中的2种以上。固相的形状没有特殊限定,例如可举出粒子、微孔板、微管、试管等。其中,优选微孔板和粒子,特别优选96孔微孔板和磁性粒子。(洗涤工序)在本实施方式中,在脂蛋白和标记甾醇的接触与后述的甾醇摄取能力的测定之间,可以进行除去未反应的游离成分的洗涤工序。该洗涤工序包括b/f分离和复合物的洗涤。未反应的游离成分是指不构成含有摄取有标记甾醇的脂蛋白的复合物的成分。例如可举出未被脂蛋白摄取的游离的标记甾醇、未与脂蛋白结合的游离的第1捕捉体等。b/f分离手段没有特殊限定,例如通过超离心分离法等仅回收复合物,由此可以分离复合物和未反应的游离成分。在固相上形成复合物时,如果固相为粒子,则通过离心分离或磁分离而回收粒子,除去上清液,可以分离复合物和未反应的游离成分。如果固相为微孔板或微管等容器,则通过除去含有未反应的游离成分的液体,可以分离复合物和未反应的游离成分。在除去未反应的游离成分后,可以将回收的复合物用适当的水性介质洗涤。作为这样的水性介质,例如可举出水、生理盐水、pbs和tris-hcl等缓冲液等。在本实施方式中,优选在不具有环状结构的表面活性剂的存在下进行上述洗涤工序。例如,可以将不具有环状结构的表面活性剂溶解于上述水性介质来制备洗涤液,并用该洗涤液洗涤回收的复合物。在使用固相的情况下,可以将捕捉有复合物的固相用洗涤液洗涤。具体地,在回收的复合物或捕捉有复合物的固相中添加洗涤液,再次进行b/f分离。(甾醇摄取能力的测定)在本实施方式的方法中,制备摄取有标记甾醇的脂蛋白后,测定脂蛋白对标记甾醇的摄取能力。甾醇摄取能力的测定通过检测来自被脂蛋白摄取的标记甾醇的信号来进行。由于该信号反映被脂蛋白摄取的标记甾醇的量,因此,该信号的检测结果成为脂蛋白的甾醇摄取能力的指标。在本说明书中,“检测信号”是指包括定性检测信号的有无、定量信号的强度、以及将信号的强度半定量地检测为如“无信号发生”、“弱”、“强”等这样的多个等级。在本实施方式中,优选通过定量信号强度来获得测定值。来自被脂蛋白摄取的标记甾醇的信号可以是由标记甾醇直接产生的信号。这样的信号例如可以在使用具有信号发生物质作为第1标记的标记甾醇的情况下检测。即,通过检测从被脂蛋白摄取的标记甾醇中的第1标记产生的信号,可以测定摄取能力。例如,在使用荧光标记甾醇的情况下,测定荧光强度即可。测定荧光强度的方法本身在本
技术领域:
中是公知的。例如,可以使用荧光分光光度计和荧光酶标仪等公知的测定装置,测定从复合物产生的荧光强度。激发波长和荧光波长可以根据所使用的荧光标记胆固醇的种类而适当地确定。例如,在使用上述式(iv)的荧光标记胆固醇的情况下,可以从激发波长为470~490nm、荧光波长为525~550nm的范围确定。(标记甾醇和第2捕捉体的复合物的形成)来自被脂蛋白摄取的标记甾醇的信号可以是在检测被脂蛋白摄取的标记甾醇时产生的信号。为了检测被脂蛋白摄取的标记甾醇,在本实施方式中,可以使标记甾醇和与该标记甾醇结合的第2捕捉体接触,形成复合物。此时,标记甾醇优选为附加标记的甾醇,更优选为附加标记的胆固醇。另外,第2捕捉体优选为与标记特异性结合的物质。被脂蛋白摄取的附加标记的胆固醇的检测原理如下所述。通常,当胆固醇被脂蛋白摄取后,其从该脂蛋白粒子的表层移动到中心部。在附加标记的胆固醇中,认为被脂蛋白摄取的是胆固醇部分,标记露出在脂蛋白的外表面。其中,“脂蛋白的外表面”是指脂蛋白粒子的外侧的面。“在外表面露出”是指在脂蛋白的外表面上存在和从脂蛋白的外表面突出这两者。在本实施方式中,使在该外表面露出的标记和与该标记特异性结合的第2捕捉体接触,形成复合物。接着,通过检测该复合物中的第2捕捉体,检测被脂蛋白摄取的胆固醇。与标记特异性结合的物质可以根据标记的种类而适当地确定。例如,参照上述标记和可与该标记特异性结合的物质的组合,可选自抗体、配体受体、寡核苷酸、生物素、抗生物素蛋白(或链霉抗生物素蛋白)、组氨酸标记或镍、gst或谷胱甘肽等。其中,优选与标记特异性结合的抗体。这样的抗体既可以是市售的抗体,也可以是通过在该技术中公知的方法制作的抗体。抗体既可以是单克隆抗体,也可以是多克隆抗体。抗体的来源和同种型没有特殊限定,与关于抗hdl抗体所述的相同。另外,可以使用抗体的片段及其衍生物,例如可举出fab片段、f(ab')2片段等。在本实施方式中,优选在形成摄取有标记甾醇的脂蛋白和第1捕捉体的复合物之后,进行该标记甾醇与第2捕捉体的接触。特别优选在固相上形成摄取有标记甾醇的脂蛋白和第1捕捉体的复合物之后,进行该标记甾醇和第2捕捉体的接触。由此形成第1捕捉体、摄取有标记甾醇的脂蛋白和第2捕捉体的复合物。在该复合物中,摄取有标记甾醇的脂蛋白处于被第1捕捉体和第2捕捉体夹持的状态。在本实施方式中,也将第1捕捉体、摄取有标记甾醇的脂蛋白和第2捕捉体的复合物称为“三明治复合物”。标记甾醇和第2捕捉体的接触的温度和时间的条件没有特殊限定。例如,可以将含有脂蛋白和第1捕捉体的复合物的溶液与含有第2捕捉体的溶液的混合物在4~60℃、优选25~42℃下温育1秒~24小时、优选10分钟~2小时。在温育期间,混合物既可以静置,也可以搅拌或振荡。(第2标记)第2捕捉体优选用第2标记来标记。在第2捕捉体用第2标记来标记的情况下,通过检测来自标记甾醇和第2捕捉体的复合物中的第2标记的信号,可以测定甾醇摄取能力。第2标记可以是信号发生物质,可以使用催化其他物质的反应而产生可检测信号的物质。作为信号发生物质,例如可举出荧光物质、放射性同位素等。作为催化其他物质的反应而产生可检测信号的物质,例如可举出酶。作为酶,可举出碱性磷酸酶、过氧化物酶、β-半乳糖苷酶、葡萄糖氧化酶、酪氨酸酶、酸性磷酸酶、荧光素酶等。作为荧光物质,可举出异硫氰酸荧光素(fitc)、罗丹明、alexafluor(注册商标)、菁系色素等荧光色素、gfp等荧光蛋白质等。作为放射性同位素,可举出125i、14c、32p等。其中,优选酶,特别优选为碱性磷酸酶和过氧化物酶。在本实施方式中,第2标记对第2捕捉体的标记可以通过使第2标记直接或间接与第2捕捉体结合来进行。例如,使用市售的标记试剂盒等,可以使第2标记直接与第2捕捉体结合。另外,通过使用将可与第2捕捉体特异性结合的抗体用第2标记来标记而得到的二次抗体,可以使第2标记与第2捕捉体间接结合。在本实施方式中,可以使用第2标记所结合的第2捕捉体,也可以使用具有第2捕捉体和第2标记的二次抗体。在本实施方式中,在进行信号检测之前,可以进行除去未反应的游离成分的洗涤工序。作为未反应的游离成分,例如可举出未与标记结合的游离的第2捕捉体、未与第2捕捉体结合的游离的第2标记等。关于洗涤的具体的方法和洗涤液,与上述洗涤工序相同。(来自第2标记的信号的检测)检测来自第2标记的信号的方法本身是本
技术领域:
公知的。在本实施方式中,可以根据来自第2标记的信号的种类来选择适当的测定方法。例如,当第2标记为酶时,可以通过使用公知的装置测定由酶与该酶的底物反应而产生的光、色等信号来进行。作为这样的测定装置,可举出分光光度计、光度计等。酶的底物可以根据该酶的种类从公知的底物中适当地选择。例如,在使用过氧化物酶作为酶的情况下,作为底物,可举出鲁米诺及其衍生物等化学发光底物、2,2'-连氮基双(3-乙基苯并噻唑啉-6-磺酸铵)(abts)、1,2-苯二胺(opd)、3,3',5,5'-四甲基联苯胺(tmb)等显色底物。另外,当使用碱性磷酸酶作为酶时,作为底物,可举出cdp-star(注册商标)(4-氯-3-(甲氧基螺[1,2-二氧杂环丁烷-3,2'-(5'-氯)三环[3.3.1.13,7]癸烷]-4-基)苯基磷酸二钠)、cspd(注册商标)(3-(4-甲氧基螺[1,2-二氧杂环丁烷-3,2-(5'-氯)三环[3.3.1.13,7]癸烷]-4-基)苯基磷酸二钠)等化学发光底物、5-溴-4-氯-3-吲哚磷酸(bcip)、5-溴-6-氯-吲哚磷酸二钠、对硝基苯磷酸等显色底物。当第2标记为放射性同位素时,可以使用闪烁计数器等公知的装置来测定作为信号的放射线。另外,当第2标记为荧光物质时,可以使用荧光酶标仪等公知的装置来测定作为信号的荧光。予以说明,激发波长和荧光波长可以根据所使用的荧光物质的种类而适当地确定。(在固相上固定化的脂蛋白的量的测定)在本实施方式中,可以根据需要测定在固相上固定化的脂蛋白的量(以下,也称为“脂蛋白的捕捉量”)。该测定可以采用与甾醇摄取能力的测定不同的方法进行,也可以使用测定甾醇摄取能力后的固相来进行。在采用与甾醇摄取能力的测定不同的方法进行的情况下,准备多个将摄取有标记甾醇的脂蛋白固定化的固相。这样,将至少1个固相用于脂蛋白的捕捉量的测定,将其余的固相用于甾醇摄取能力的测定。脂蛋白的捕捉量的测定本身可基于公知的elisa法的原理测定。例如,可以使在固相上固定化的脂蛋白和与该脂蛋白结合的第3捕捉体接触而形成复合物,通过检测该复合物而测定脂蛋白的捕捉量。第3捕捉体只要是可与脂蛋白表面的一部分特异性结合的物质,就没有特殊限定。第3捕捉体的详情与关于第1捕捉体所述的相同。第3捕捉体可以与第1捕捉体相同或不同。优选的第3捕捉体为抗apoai抗体。当第1捕捉体和第3捕捉体为与同一抗原(例如apoai)结合的抗体时,优选彼此的表位不同。第3捕捉体优选用第3标记来标记。当第3捕捉体用第3标记来标记时,通过检测来自在固相上固定化的脂蛋白和第3捕捉体的复合物中的第3标记的信号,可以测定脂蛋白的捕捉量。第3标记的详情与关于第2标记所述的相同。第3标记可以与第2标记相同或不同。在本实施方式中,通过检测来自第3标记的信号,可以测定脂蛋白的捕捉量。关于检测来自第3标记的信号的方法,与关于第2标记所述的相同。(每单位体积生物样品的甾醇摄取能力的测定值)在本实施方式中,可以获得脂蛋白的甾醇摄取能力的测定结果作为与受试者的糖尿病相关的信息。具体地,每单位体积受试者的生物样品的甾醇摄取能力的测定值成为糖尿病发病风险的指标。每单位体积生物样品的甾醇摄取能力的测定值可按照如下方式获得。例如,在不稀释规定量的生物样品(或者规定量的从生物样品制备的脂蛋白级分)而测定甾醇摄取能力的情况下,可以取得获取的测定值本身作为每单位体积生物样品的甾醇摄取能力的测定值。或者,可以取得将获取的测定值除以用于测定的生物样品的体积(规定量的值)而得到的值作为每单位体积生物样品的甾醇摄取能力的测定值。在基于生物样品中的载脂蛋白的浓度来稀释该生物样品而用于测定的情况下,期望将获得的甾醇摄取能力的测定值换算成每单位体积生物样品的甾醇摄取能力的测定值。这是因为生物样品中的脂蛋白的浓度通过稀释来调整。例如,在基于生物样品中的载脂蛋白的浓度来稀释该生物样品而用于测定的情况下,通过下述式(1),可以将获得的甾醇摄取能力的测定值换算成每单位体积生物样品的甾醇摄取能力的测定值。(每单位体积生物样品的甾醇摄取能力的测定值)=[(甾醇摄取能力的测定值)/(脂蛋白的捕捉量的测定值)]×(生物样品中的载脂蛋白的浓度的测定值)……(1)在上述式(1)中,通过将甾醇摄取能力的测定值除以脂蛋白的捕捉量的测定值,得到每个脂蛋白的甾醇摄取能力的测定值。如上所述,生物样品中的载脂蛋白的浓度成为生物样品中的脂蛋白的浓度的指标。因此,通过将每个脂蛋白的甾醇摄取能力的测定值乘以生物样品中的载脂蛋白的浓度的测定值,可以得到每单位体积生物样品的甾醇摄取能力的测定值。每单位体积生物样品的甾醇摄取能力的测定值可用于判定受试者的糖尿病发病风险。医生等医务人员既可以使用该测定值来判定糖尿病发病风险,也可以将该测定值与其他信息组合来判定糖尿病发病风险。其中,“其他信息”是指包括血糖值、hba1c测定值、其他医学发现。[2.判定受试者的糖尿病发病风险的方法]在本实施方式中,可以将通过上述方法得到的脂蛋白的甾醇摄取能力的结果用于判定受试者的糖尿病发病风险。在本实施方式的判定受试者的糖尿病发病风险的方法(以下,也称为“判定方法”)中,首先,测定从受试者采集的生物样品中的脂蛋白的甾醇摄取能力。该测定的详情与关于本实施方式的用于获取有关糖尿病信息的方法所述的相同。在本实施方式的判定方法中,基于每单位体积生物样品的甾醇摄取能力的测定值与规定阀值的比较结果,判定受试者的糖尿病发病风险。具体地,进行以下的(1)和/或(2)的判定:(1)当每单位体积生物样品的甾醇摄取能力的测定值为规定的阀值以下时,判定为糖尿病发病风险高;(2)当每单位体积生物样品的甾醇摄取能力的测定值高于规定的阀值时,判定为糖尿病发病风险低。在上述判定中,当每单位体积生物样品的甾醇摄取能力的测定值与规定的阀值相同时,既可以判定为糖尿病发病风险高,也可以判定为糖尿病发病风险低。即,也可以进行以下的(1)和/或(2)的判定:(1)当每单位体积生物样品的甾醇摄取能力的测定值比规定的阀值低时,判定为糖尿病发病风险高;(2)当每单位体积生物样品的甾醇摄取能力的测定值为规定的阀值以上时,判定为糖尿病发病风险低。对于判定为糖尿病发病风险高的受试者来说,如果不改善目前的健康状况和生活习惯,例如可以预测在7年以内发生糖尿病的可能性高。另一方面,对于判定为糖尿病发病风险低的受试者来说,如果维持目前的健康状况和生活习惯,可以预测可避免糖尿病发病的可能性高。这样,本实施方式的判定方法可以向医生等医务人员提供有助于糖尿病发病风险的判定的信息。对通过本实施方式的判定方法判定为糖尿病发病风险高的受试者来说,通过进行积极介入以改善饮食疗法、运动疗法等的生活习惯,由此可以预防糖尿病。规定的阀值可以为多个。例如,在使用第1阀值和第2阀值作为2个规定阀值的情况下,可分类为高风险组、中风险组和低风险组。例如可以按如下所述判定糖尿病发病风险。在以下的例中,第1阀值为低于第2阀值的值:(1)当每单位体积生物样品的甾醇摄取能力的测定值为第1阀值以下时,判定为糖尿病发病风险高;(2)当每单位体积生物样品的甾醇摄取能力的测定值比第1阀值高且比第2阀值低时,判定为需要经时观察(随访);(3)当每单位体积生物样品的甾醇摄取能力的测定值为第2阀值以上时,判定为糖尿病发病风险低。当判定为需要经时观察时,判定糖尿病发病风险的高低是不合适的,但不能说糖尿病的发病风险低。即,受试者被分类为糖尿病发病的中风险组。因此,可以劝告受试者需要注意健康状况和生活习惯。在上述判定中,当每单位体积生物样品的甾醇摄取能力的测定值与第1阀值相同时,判定为糖尿病发病风险高,但也可以判定为需要经时观察。另外,在上述判定中,当每单位体积生物样品的甾醇摄取能力的测定值与第2阀值相同时,判定为糖尿病发病风险低,但也可以判定为需要经时观察。规定的阀值没有特殊限定,可适当地设定。例如,通过累积非糖尿病受试者的脂蛋白的甾醇摄取能力的数据,可以凭经验来设定规定的阀值。或者,可以按如下方式设定规定的阀值。首先,从非糖尿病的多名受试者中采集生物样品,测定脂蛋白的甾醇摄取能力,得到每单位体积生物样品的甾醇摄取能力的测定值的数据。从生物样品的采集起经过规定的时间后,确认这些受试者是否发生糖尿病。将上述数据分类为患有糖尿病的受试者组的数据和未患糖尿病的受试者组的数据。接着,求出可最精度良好地区分患有糖尿病的受试者组和未患糖尿病的受试者组的值,将该值设定为规定的阀值。在阀值的设定中,优选考虑灵敏度、特异性、阳性预测率、阴性预测率等。[3.用于获取有关糖尿病信息的试剂盒]本发明的范围也包括用于本实施方式的方法和判定方法的试剂盒。即,本发明提供用于获取有关糖尿病信息的试剂盒(以下,也称为“试剂盒”),其含有标记甾醇、和与脂蛋白结合的捕捉体。标记甾醇和与脂蛋白结合的捕捉体的详情与关于用于本实施方式的方法的标记甾醇和第1捕捉体所述的相同。标记甾醇为附加标记的甾醇时,本实施方式的试剂盒还可以包含与标记结合的捕捉体。另外,本实施方式的试剂盒还可以包含用于标记该捕捉体的标记物。在本实施方式中,标记物可以预先与捕捉体结合(将得到的捕捉体也称为“标记捕捉体”)。因此,本实施方式的试剂盒还可以包含与标记结合的标记捕捉体。当标记物为酶时,本实施方式的试剂盒还可以包含该酶的底物。与标记结合的捕捉体、标记物和底物的详情与关于上述第2捕捉体、第2标记和来自该标记的信号的检测所述的相同。本实施方式的试剂盒还可以包含用于测定脂蛋白的捕捉量的捕捉体。这样的捕捉体只要是可与脂蛋白的表面的一部分特异性结合的物质,就没有特殊限定。该捕捉体的详情与关于上述第3捕捉体所述的相同。用于测定脂蛋白的捕捉量的捕捉体可以与上述的与脂蛋白结合的捕捉体相同或不同。当这些捕捉体为与同一抗原(例如apoai)结合的抗体时,优选彼此的表位不同。本实施方式的试剂盒还可以包含用于标记用于测定脂蛋白的捕捉量的捕捉体的标记物。或者,本实施方式的试剂盒还可以包含用于测定脂蛋白的捕捉量的标记捕捉体。当标记物为酶时,本实施方式的试剂盒还可以包含该酶的底物。标记物和底物的详情与关于上述第3标记和来自该标记的信号的检测所述的相同。标记甾醇、各种的捕捉体、标记物和底物优选分别保存在不同的容器中或者被分开包装。标记甾醇、各种的捕捉体、标记物和底物的形态没有特殊限定,可以为固体(例如,粉末、结晶、冻干品等),也可以为液体(例如,溶液、悬浮液、乳浊液等)。在本实施方式中,可以将装纳第1试剂的容器和装纳第2试剂的容器捆包在箱中,提供给用户。在箱中还可以装有说明书。说明书中可以记载试剂盒的构成、使用方法、通过该试剂盒测定的值与糖尿病发病风险的关系等。这样的试剂盒的例子示于图中。参照图1,10表示试剂盒,11表示装纳标记甾醇的第1容器,12表示装纳与脂蛋白结合的捕捉体的第2容器,13表示捆包箱,14表示附带文件(说明书)。本实施方式的试剂盒还可以包含用于固定化与脂蛋白结合的捕捉体的固相。参照图2,20表示试剂盒,21表示装纳标记甾醇的第1容器,22表示装纳与脂蛋白结合的捕捉体的第2容器,23表示捆包箱,24表示说明书,25表示固相。图中,26表示作为固相的96孔微孔板,但本发明不限定于该例。[4.判定装置和计算机程序]本发明的范围还包括用于实施本实施方式的糖尿病发病风险的判定方法的装置和计算机程序。参照附图说明本实施方式的糖尿病发病风险的判定装置的一例。但是,本实施方式不限定于该例所示的方式。图3所表示的判定装置10包括测定装置20、和与该测定装置20连接的计算机系统30。测定装置只要能够基于被脂蛋白摄取的标记甾醇来检测信号,就没有特殊限定。测定装置可以根据标记甾醇的标记的种类来适当地选择。在上述例中,测定装置20是检测基于微孔板上的被脂蛋白摄取的标记甾醇的信号的酶标仪。该信号为荧光信号等光学信息。此时,将含有摄取有标记甾醇的脂蛋白的复合物固定化的微孔板安装在测定装置20中时,测定装置20获得基于标记甾醇的光学信息,并将得到的光学信息输送到计算机系统30。根据需要,可以通过测定装置测定脂蛋白的捕捉量。此时,将脂蛋白和与该脂蛋白结合的标记捕捉体的复合物固定化的微孔板安装在测定装置20中时,测定装置20获得基于标记捕捉体的光学信息,并将得到的光学信息输送到计算机系统30。用于测定脂蛋白的捕捉量的微孔板和用于测定脂蛋白的甾醇摄取能力的微孔板可以相同或不同。标记捕捉体与上述用第3标记来标记的第3捕捉体相同。计算机系统30包括计算机主体300、输入部301、以及显示检体信息和判定结果等的显示部302。计算机系统30接受来自测定装置20的光学信息。接着,计算机系统30的处理器基于光学信息,执行判定糖尿病发病风险的程序。予以说明,计算机系统30可以是如图3所示那样与测定装置20分开的设备,也可以是内置有测定装置20的设备。在后者的情况下,计算机系统30本身可以成为判定装置10。参照图4,计算机主体300具备:cpu(中央处理单元)310、rom(只读存储器)311、ram(随机存取存储器)312、硬盘313、输入/输出接口314、读取装置315、通信接口316、和图像输出接口317。cpu310、rom311、ram312、硬盘313、输入/输出接口314、读取装置315、通信接口316和图像输出接口317通过总线318连接,以便可以数据通信。另外,测定装置20通过通信接口316与计算机系统30可通信地连接。cpu310可执行rom311或硬盘313中存储的程序和ram312中下载的程序。cpu310基于从测定装置20获得的光学信息,获取每单位体积生物样品的甾醇摄取能力的测定值。每单位体积生物样品的甾醇摄取能力的测定值及其计算的详情与关于本实施方式的方法所述的相同。在使用稀释了的生物样品(或脂蛋白级分)的情况下,根据存储在rom311或硬盘313中的式(1),计算每单位体积生物样品的甾醇摄取能力的测定值。接着,cpu310基于获得的测定值以及存储在rom311或硬盘313中的规定的阀值,判定糖尿病发病风险。cpu310输出判定结果并显示在显示部302中。rom311由掩膜rom、prom、eprom、eeprom等构成。rom311中记录有由cpu310执行的计算机程序和用于执行该计算机程序的数据。ram312由sram、dram等构成。ram312用于读取记录在rom311和硬盘313中的程序。另外,在执行这些程序时,ram312被用作cpu310的作业区域。硬盘313中安装有使cpu310执行的操作系统、应用程序(糖尿病发病风险的判定用程序)等计算机程序、以及用于执行该计算机程序的数据。读取装置315由软磁盘驱动器、cd-rom驱动器、dvd-rom驱动器等构成。读取装置315可读取记录在便携式记录介质40中的程序或数据。输入/输出接口314例如由usb、ieee1394、rs-232c等串行接口、scsi、ide、ieee1284等并行接口、和包括d/a转换器、a/d转换器等的模拟接口构成。输入/输出接口314上连接有键盘、鼠标等输入部301。操作者通过该输入部301,可以向计算机主体300输入各种指令。通信接口316例如为ethernet(注册商标)接口等。计算机主体300通过通信接口316也可以向打印机等输送打印数据。图像输出接口317与由lcd、crt等构成的显示部302连接。由此,显示部302可以输出与由cpu310供给的图像数据对应的视频信号。显示部302根据输入的视频信号来显示图像(画面)。参照图5,说明通过判定装置10执行的糖尿病发病风险的判定的处理顺序。其中,以基于从微孔板上的被脂蛋白摄取的荧光标记甾醇产生的荧光信号,进行糖尿病发病风险的判定的情况为例进行说明。但是,本实施方式并不限定于该例。在步骤s101中,cpu310从测定装置20取得光学信息(荧光信号)并记录在硬盘313中。在步骤s102中,cpu310从获取的光学信息,计算每单位体积生物样品的甾醇摄取能力的测定值,并记录在硬盘313中。在步骤s103中,cpu310将计算出的测定值与记录在硬盘313中的规定阀值进行比较。当测定值为规定的阀值以下时,处理前进到步骤s104,将显示受试者的糖尿病发病风险高的判定结果记录在硬盘313中。当测定值比规定的阀值高时,处理前进到步骤s105,将显示受试者的糖尿病发病风险低的判定结果记录在硬盘313中。在步骤s106中,cpu310输出判定结果、显示显示部302中、用打印机打印。由此,可以向医生等提供有助于糖尿病发病风险的判定的信息。参照图6,说明使用2个规定阀值的糖尿病发病风险的判定的处理顺序。其中,以基于从微孔板上的被脂蛋白摄取的荧光标记甾醇产生的荧光信号,进行糖尿病发病风险的判定的情况为例进行说明。但是,本实施方式并不限定于该例。步骤s201、s202和s208分别与上述步骤s101、s102和s106所述的相同。在步骤s203中,cpu310将计算出的测定值与记录在硬盘313中的第1阀值进行比较。当测定值为第1阀值以下时,处理前进到步骤s204,将显示受试者的糖尿病发病风险高的判定结果记录在硬盘313中。当测定值比第1阀值高时,处理前进到步骤s205。在步骤s205中,cpu310将计算出的测定值与记录在硬盘313中的第2阀值进行比较。当测定值为第2阀值以上时,处理前进到步骤s206,将显示受试者的糖尿病发病风险低的判定结果记录在硬盘313中。当测定值比第2阀值低时,处理前进到步骤s207,将显示需要对受试者进行经时观察(随访)的判定结果记录在硬盘313中。以下,通过实施例详细说明本发明,但本发明并不限定于这些实施例。实施例实施例1使用久山町研究(以日本福冈县糟屋郡久山町的居民为对象进行的流行病学研究)的血液样品,研究hdl的胆固醇摄取能力与糖尿病发病之间的相关性。(1)对象集团将对象集团的信息示于表1。排除对象是那些在截止登记时患有糖尿病的人、没有接受过糖负荷试验的人、或有心血管疾病病史的人。没有接受过糖负荷试验的人由于不清楚他们是否患有糖尿病,因而是排除对象。有心血管疾病病史的人是指截止登记时经历过心肌梗塞、脑梗塞或冠状动脉血管成形术的人。[表1]登记年2002年年龄40~79岁受试者2091例排除对象糖尿病已发病者,未实施糖负荷试验者,有心血管疾病病史者观察期间7年(2)hdl的胆固醇摄取能力的测定(2.1)生物样品作为生物样品,使用被冷冻保存的各受试者的血清。在解冻的血清(0.1ml)中混合等量的22%聚乙二醇4000(ナカライテスク株式会社),得到悬浮液。将得到的悬浮液在室温下静置20分钟后,在室温下以3000rpm离心分离15分钟。使用得到的上清液作为hdl级分。(2.2)固相上的hdl和抗apoai抗体的复合物的形成(i)测定用板的准备(抗apoai抗体在固相上的固定化)在作为固相的96孔微孔板(荧光测定用黑色板h,住友ベークライト株式会社制)的每个孔中添加200μl的50mmtris-hcl(ph7.5)进行洗涤。合计进行2次该洗涤操作。向每个孔中添加100μl用50mmtris-hcl(ph7.5)稀释至10μg/ml浓度的抗apoai抗体(克隆1c5,cat.no.mono5030,sanbio公司)的溶液,在4℃静置一夜以上。除去抗体溶液,向每个孔中添加200μlpbs进行洗涤。合计进行3次该洗涤操作。向每个孔中添加200μl的2%bsa/pbs,在25℃以600rpm振荡2小时。(ii)测定用样品的制备(hdl和标记胆固醇的接触)从上述受试者的血清中取一部分,使用apoai测定用试剂盒(n-测试tiaapoai-h,ニットーボーメディカル株式会社),测定apoai浓度。浓度测定的具体操作根据该试剂盒所附的手册进行。由于hdl级分由用peg稀释2倍的血清来制备,因此hdl级分的apoai浓度设定为通过测定得到的血清的apoai浓度的1/2。稀释各hdl级分,使hdl级分中的apoai浓度为1.25~2μg/ml,制备含有hdl级分的稀释液。hdl级分的稀释采用含有2%bsa和2mm脂质体(日本精化株式会社制)的pbs(以下,也称为“缓冲液”)。作为不含hdl级分的对照检体(apoai浓度为0μg/ml),使用上述缓冲液。上述缓冲液中含有的脂质体的组成为:2mm二肉豆蔻酰磷脂酰甘油(dmpg)、2mm胆固醇和4mm氢化大豆磷脂酰胆碱(hspc)。pbs通过将磷酸盐缓冲盐水片剂(sigma-aldrich公司)溶解在水中来制备。向上述缓冲液中添加带有0.5mmbodipy的胆固醇(topfluorcholesterol,avantipolarlipids公司)至终浓度为5μm,进一步添加上述的含有hdl级分的稀释液,其量为总量的1/50。将得到的混合物在37℃下以800rpm振荡2小时。向得到的混合液中添加氧化剂(8.8m过氧化氢、1.76mm亚硝酸钠和0.86mm二乙三胺五乙酸(dtpa))。在添加有氧化剂的溶液中的各成分的终浓度为:过氧化氢1m,亚硝酸钠200μm,dtpa100μm。将这些溶液在37℃下以800rpm振荡1小时,得到含有摄入有带bodipy的胆固醇的hdl的测定用样品。(iii)摄取有胆固醇的hdl和抗apoai抗体的复合物的形成从将抗apoai抗体固定化的板中除去bsa溶液,向每个孔中添加各100μl测定用样品。接着,将板在25℃以600rpm振荡1小时,在板上形成hdl和抗apoai抗体的复合物。(2.3)hdl的胆固醇摄取能力的测定按如下所述测定来自被hdl摄取的带有bodipy的胆固醇的荧光强度。向捕捉有由hdl和抗apoai抗体形成的复合物的板的每个孔中添加100μl的10mm环糊精/pbs,将该板在25℃以600rpm振荡1小时。接着,采用荧光酶标仪(infinite(注册商标)200pro,tecan公司制)测定(激发光485nm/荧光535nm)荧光强度。(2.4)被捕捉的hdl的量的测定基于板上的复合物中的hdl所含的apoai的浓度,测定被捕捉的hdl的量。具体地如下所述。从上述(2.3)的测定后的板中除去环糊精溶液,将各孔用pbs洗涤3次。将apoai测定用试剂盒(n-测试tiaapoai-h,ニットーボーメディカル株式会社)的山羊抗apoai血清用封闭缓冲液(startingblock,thermoscientific公司)稀释1000倍,向每个孔中添加100μl得到的稀释液。将板在25℃以600rpm振荡1小时后,除去稀释液,将各孔用pbs洗涤3次。将hrp标记的兔抗山羊igg多克隆抗体(p0449,dako公司)用封闭缓冲液(startingblock,thermoscientific公司)稀释1000倍,向每个孔中添加100μl得到的稀释液。将板在25℃以600rpm振荡1小时后,除去稀释液,将各孔用pbs洗涤5次。向每个孔中添加100μl化学发光底物溶液(supersignalelisapico,37069,thermoscientific公司)。将板在25℃以600rpm振荡2分钟后,采用酶标仪(infinite(注册商标)f200pro,tecan公司制)测定发光量。(3)解析如上所述,在实施例1中,将规定量的从血清制备的hdl级分稀释至apoai的浓度为一定,用于胆固醇摄取能力的测定。因此,通过下述式(2),将上述(2.3)中得到的测定值换算为每单位体积血清的标记胆固醇摄取能力的测定值。式中,“标记胆固醇摄取能力的测定值”是上述(2.3)得到的测定值,“hdl的捕捉量”是上述(2.4)得到的测定值,“血清的apoai浓度”是上述(2.2)(ii)得到的测定值。(每单位体积血清的标记胆固醇摄取能力的测定值)=[(标记胆固醇摄取能力的测定值)/(hdl的捕捉量)]×(血清的apoai浓度)…(2)(4)结果在受试者2091例中,在观察期间,糖尿病的发病者为219例。风险比使用cox比例风险模型计算,调节潜在的混杂因子(年龄、性别、糖尿病家族史、收缩期血压、降压药、总胆固醇值、中性脂肪值、脂质改善药、肥胖·超重、吸烟、饮酒、和运动)。基于每单位体积血清的胆固醇摄取能力的值,将受试者分为4组。将各组的胆固醇摄取能力和风险比示于表2。[表2]风险比随着hdl的胆固醇摄取能力的上升,显著下降。与q1(第1四分位数)组相比,q4(第4四分位数)组的风险比为0.57倍。即,当每单位体积生物样品的胆固醇摄取能力的测定值比规定值高时,表示糖尿病发病风险低。另外,当每单位体积生物样品的胆固醇摄取能力的测定值比规定值低时,表示糖尿病发病风险高。因此显示出,在没有心血管疾病病史且非糖尿病的受试者中,通过评价apoai,评价每单位体积生物样品的胆固醇摄取能力,可以判定糖尿病发病风险。实施例2将在实施例1中作为排除对象的有心血管疾病病史者(66例)加入到受试者中,除此以外,与实施例1同样操作,研究hdl的胆固醇摄取能力与糖尿病发病风险之间的相关性。结果示于表3。[表3]风险比随着hdl的胆固醇摄取能力的上升,显著下降。与q1(第1四分位数)组相比,q4(第4四分位数)组的风险比为0.60倍。即,当每单位体积生物样品的胆固醇摄取能力的测定值比规定值高时,表示糖尿病发病风险低。另外,当每单位体积生物样品的胆固醇摄取能力的测定值比规定值低时,表示糖尿病发病风险高。因此显示出,在非糖尿病的受试者中,通过评价apoai,评价每单位体积生物样品的胆固醇摄取能力,可以判定糖尿病发病风险。附图标记说明11、21:试剂盒12、22:第1容器13、23:第2容器14、24:箱15、25:说明书26:固相(96孔微孔板)10:判定装置20:测定装置30:计算机系统当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1