快速天然单个细胞质谱分析法的制作方法
相关申请的交叉引用
本申请要求2018年12月18日提交的标题为“rapidnativesinglecellmassspectrometry”的美国临时专利申请62/781,048的优先权,其全部的公开内容通过引用并入本文。
关于联邦资助的声明
研究与开发
本发明是在美国能源部授予的合同号de-ac05-00or22725的政府支持下完成的。政府对本发明享有一定的权利。
发明领域
本发明一般涉及质谱分析法,更具体地涉及单个细胞质谱分析法。
发明背景
细胞间差异存在于任何细胞群中,直到最近,对细胞机制的理解依赖于对大量细胞群的测量。现在普遍认为总体均值可能不代表单个细胞功能,因此需要在基因组学、表观基因组学、转录组学、蛋白质组学和代谢组学中进行单个细胞分辨。单个细胞dna和rna测序的最新发展使我们具有以单个细胞分辨监测细胞谱系和细胞异质性的非凡能力。然而,即使是具有相同基因型的同基因细胞,也会表现出随机的细胞异质性。代谢物和其他组分浓度的非遗传细胞差异影响响应均匀致死药物暴露的细胞死亡易感性、动力学甚至死亡模式。在癌症治疗中,连续多轮细胞毒性化疗通常会杀死肿瘤中恒定比例而不是绝对数量的细胞,这表明存在预先存在抑制治疗的细胞异质性或细胞亚群对治疗的选择性反应。无论如何,非遗传细胞异质性对治疗和疗法的整体疗效有明显的影响。
以单个细胞分辨检测代谢物是一项重大的分析挑战。在一个细胞内,有数千种独特的化学物质以能迅速变化的低浓度存在。与单个细胞基因组学和转录组学不同,代谢物没有可用的扩增策略,因此需要高灵敏度。同样重要的是高单个细胞采样通量(throughput),这是获得足够的单个细胞数据以统计区分细胞群或亚群之间的差异所必需的。流式细胞术是最常用的单个细胞测量技术之一,它使用基于荧光的分子探针(probe)以高达数千个细胞/秒级别的极高通量分析特定代谢物,但由于光谱特征(spectroscopicsignature)重叠,流式细胞术只能同时测量大约十二个分子。使用基于重金属同位素的分子探针的组合,质谱流式细胞术可以靶向至多48种不同的分子组分,但这仍然仅代表单个细胞中存在的一小部分代谢物。不幸的是,通过流式细胞术和质谱流式细胞术进行非靶向分子分析是不可行的,因为研究人员必须先了解并选择要研究的分子。
由于其高灵敏度、化学特异性和速度,质谱分析法(ms)是用于非靶向单个细胞分析的最适合的技术之一。已经开发了几种基于真空和探头的ms技术,以实现对单个细胞的全面、非靶向化学分析。基于真空的技术包括二次离子ms(sims)、基质辅助激光/解吸电离(maldi)和激光/解吸电离(ldi)技术,这些技术虽然极其敏感,但需要在细胞自然状态之外对细胞进行重大修改,如固定和脱水,以方便在真空下进行分析。几种方法,包括活体单个细胞ms、单探头ms和其他方法,使用手动引导的探头(如移液管、光纤和毛细管)来原位测量细胞化学,有时通过环境ms在体内测量。然而,低采样通量限制了大多数这些方法的价值,因为每个细胞的测量可能需要一个小时或更长时间,并且需要重要的用户技能。一类环境ms技术使用激光脉冲来解剖单个细胞。这些技术对于组织中的细胞取样特别有用。然而,这些技术中很少能够从细胞悬液中测量细胞,并且通常具有低的采样通量和灵敏度。
随着进一步的发展,基于ms的技术可以形成快速、定量和非靶向单个细胞化学分析所需的技术基础。然而,单个细胞化学的常规定量测量仍然具有挑战性。此外,当前的ms平台需要大量的样本制备程序或以其他方式干扰细胞的天然状态,以促进分析,这可能会对细胞化学产生不可预见的影响。单个细胞的化学分析是一项重大的分析挑战。分子浓度低,需要高采样通量才能获得足够的单个细胞数据,以统计区分细胞群或亚群之间的差异。使用下一代测序技术进行单个细胞dna和rna测序需要2-3天,每次实验需要数千美元,但最近的进展开始使这些技术更快。在过去的几十年中,流式细胞术被大量用于高通量单个细胞分析。不幸的是,通过流式细胞术获得的分子信息受到使用基于荧光的分子探针的限制,由于重叠的光谱特征,分子探针在实验中只能同时针对一个或几个分子特征。质谱流式细胞术(流式细胞术和电感耦合等离子体质谱(icp-ms)的组合)通过使用基于重金属同位素的分子探针,可以在单个细胞中同时测量至多40种不同的组分。基于荧光的流式细胞术和质谱流式细胞术技术是测量单个细胞化学的最高通量技术之一,能够分别测量数千和数百个细胞/秒。然而,非靶向分子分析是不可行的,即研究人员必须先验地知道并选择要研究的分子。由于细胞化学很复杂,反应通常会以意想不到的方式进行,因此,非靶向化学分析可以提供重要的见解。添加分子探针也必然会影响细胞的化学组成,这可能对细胞化学产生未知的影响。
质谱分析法(ms)的高灵敏度、化学特异性和速度使其成为最适合用于单个细胞分析的技术之一。已经开发了几种基于ms的技术,以实现对单个细胞进行更全面和非靶向的化学分析,包括上述的质谱流式细胞术技术。基于纳米操作的技术是最敏感的技术之一,可以原位测量细胞化学。在这些方法中,细胞内容物是通过纳米移液管手动提取并由ms直接分析的;然而,低采样通量限制了这些方法的价值,因为每个细胞的测量大部分需要一个小时或更长时间,并且需要重要的用户技能。使用激光烧蚀(la)-ms系统,可以更快速地进行代谢分析,但在这些技术中,大多数只测量了70×400μm的大单个细胞的主要化学组分,这些单个细胞不代表大多数哺乳动物细胞的大小。液体涡流捕获(lvc)-ms可以以约15秒/细胞的通量测量细胞,但该技术需要将细胞干燥到显微镜载玻片上,这一工艺可能会以未知方式扭曲细胞的化学性质。另一种la-ms技术,基质辅助激光解吸/电离-ms(maldi-ms),与微流体芯片相结合,在表面上轻轻捕获单个细胞,具有高通量(1-5个细胞/秒)和单个细胞分析的灵敏度,然而,≤500质量/电荷(m/z)范围内的强烈基质信号可能会干扰感兴趣的小代谢物和药理学化合物。此外,基质和其他样本制备工艺的应用非常耗时、成本高,并且可能会使细胞化学自天然状态发生改变。
当前可用的质谱分析技术尚不能常规且快速地在细胞水平上获取多种化合物类型(从小型药物和代谢物到大型生物聚合物如蛋白质)的定量分子信息。此外,许多ms平台需要大量的样本制备程序或以其他方式干扰细胞的天然状态以促进分析,这可能会对细胞化学产生不可预见的影响。
技术实现要素:
一种通过质谱分析法分析来自含有多个细胞的样本的单个细胞的方法,包括提供多个细胞和液体介质以及将所述细胞和液体介质置于单个细胞分离喷出系统中的步骤。从所述单个细胞分离喷出系统释放含有单个细胞的液体介质。在含有流动的捕获探头溶剂的捕获探头中捕获液体介质和单个细胞被。用捕获探头中的裂解诱导器裂解所述细胞以将单个细胞组分分散到所述介质中。将裂解的单个细胞组分输送到质谱仪,其中进入该质谱仪的所述裂解的单个细胞组分与进入该质谱仪的来自样本的另一个单个细胞的任何分散组分在空间和时间上分开。然后可以对所述裂解的单个细胞组分进行质谱分析。
可以通过提供比细胞内部压力低的分压以引起细胞裂解的捕获探头溶剂来诱导裂解。捕获探头溶剂可以包括选自由甲醇、乙醇、异丙醇、己烷、氯仿、二氯甲烷、乙腈和水组成的组中的至少一种。
可以通过化学裂解剂诱导裂解。化学裂解剂可包括选自由十二烷基硫酸钠(sds)、triton-x、np-40裂解缓冲液、ripa裂解缓冲液、吐温裂解缓冲液、chaps裂解缓冲液和全氟辛酸组成的组中的至少一种。
可以由流动的捕获探头溶剂形成的液体涡流来诱导裂解。液体涡流流量可为50~300μl/分钟,洗脱时间为0.5~20秒。液体涡流可以由同轴探头形成。
可以通过在捕获探头溶剂中细胞两端施加的电压来诱导裂解。可通过对捕获探头溶剂中的细胞施加在细胞两端为0.2~1.5伏特的电压持续1~10000微秒来诱导裂解。
裂解可以由发射到捕获探头溶剂中的细胞处(emittedatthecell)的声波诱导。裂解可以由发射到捕获探头中的细胞处的频率15~20khz的声波持续0.1~10秒来诱导。
单个细胞分离喷出系统的释放速率可以为0.1~100个细胞/秒。单个细胞分离和弹出系统的释放速率可按需滴落。液体介质可包括细胞培养基。
用于通过质谱分析法分析单个细胞的系统可以包括单个细胞分离喷出系统,该系统包括用于样本的储存容器,该样本包括液体介质中的多个细胞。捕获探头可包括至少一个用于供捕获探头溶剂流动的溶剂供应导管、用于接收由单个细胞分离喷出系统释放的单个细胞并将裂解的细胞组分和捕获探头溶剂引导至质谱仪的捕获探头排液导管,以及裂解诱导器。该系统还可包括具有连接到所述捕获探头排液导管的入口的质谱仪。
裂解诱导器可以包括捕获探头溶剂。所述捕获探头溶剂提供比所述细胞的内部压力低的分压以引起所述细胞的破裂。裂解诱导器可以包括由流动的捕获探头溶剂流过所述捕获探头形成的液体涡流。同轴探头可以包括用于通过流动的捕获探头溶剂形成液体涡流的液体供给和排液导管。裂解诱导器可以包括布置在采样毛细管两侧的电极,用于向捕获探头中的细胞施加高电压。裂解诱导器可包括化学裂解剂注射器。裂解诱导器可以包括位于采样毛细管外部周围的声波发生器,用于将声波施加到捕获探头中的细胞。
附图说明
在附图中示出了目前优选的实施例,应当理解,本发明不限于所示的布置和手段,其中:
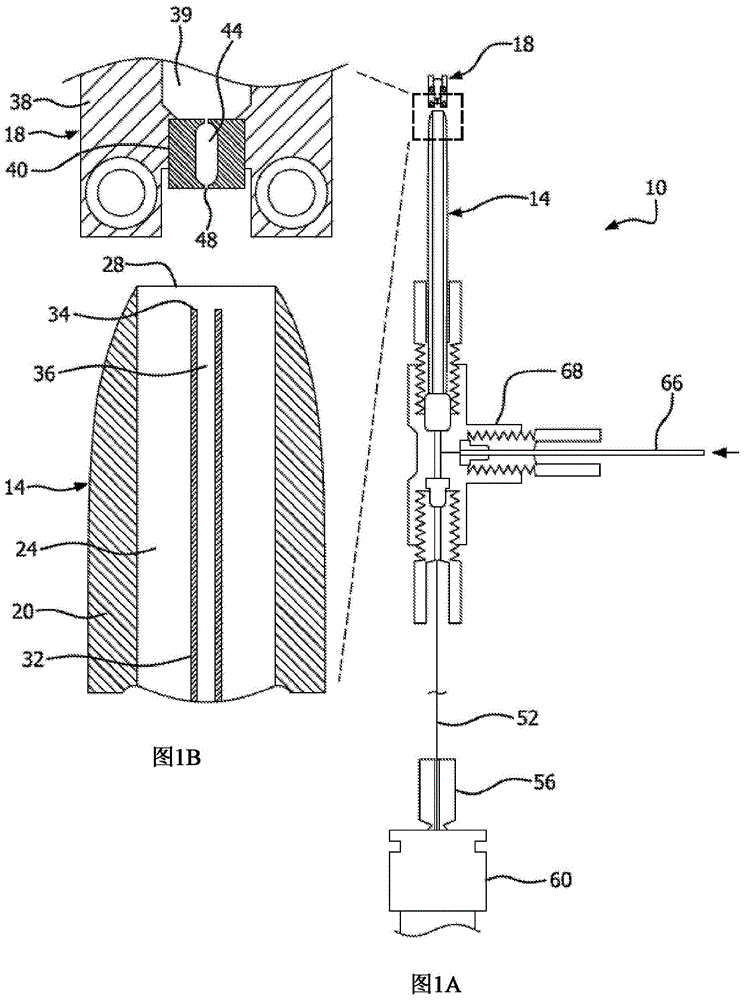
图1a是用于通过质谱分析法分析单个细胞的系统的示意性横截面;图1b是捕获探头和单个细胞分离喷出系统的放大示意横截面。
图2是具有液体涡流裂解诱导器和单个细胞分离喷出系统的捕获探头的放大示意横截面。
图3是具有施加电压裂解诱导器和单个细胞分离喷出系统的捕获探头的放大示意横截面。
图4a是具有声能裂解诱导器和单个细胞分离喷出系统的捕获探头的放大示意横截面;图4b是图4a中图4b区域的放大示意图。
图5是具有裂解剂注射器、裂解诱导器和单个细胞分离喷出系统的捕获探头的放大示意横截面。
图6是具有90/10/0.1(v/v/v)甲醇/氯仿/甲酸溶剂组合物的咖啡因液滴的咖啡因质谱信号强度对时间(分钟)的图。
图7是细小裸藻(euglenagracilis)细胞的总质谱离子电流(cps)对时间(min)的图。
图8是hela细胞的总质谱离子电流(cps)对时间(min)的图。
图9是细小裸藻细胞的总质谱离子电流(cps)对时间(min)的放大图。
图10是hela细胞的总质谱离子电流(cps)对时间(分钟)的放大图。
图11是细小裸藻细胞喷出前的图像。
图12是hela细胞喷出前的图像。
图13是单个细小裸藻细胞的强度(cps)对质荷比(m/z)的质谱图。
图14是单个hela细胞的强度(cps)对m/z的质谱图。
图15是m/z184、pc片段离子、细小裸藻和m/z236、dgts片段离子、莱茵衣藻(chlamydomonasreinhardtii)的强度对时间(分钟)的图。
图16是将细胞悬浮液喷洒在hsm介质中后,玻璃上一群没有裂解的完整细胞的图像。
图17是一组雾化液滴的图像,该液滴通过暴露于捕获探头中的液体涡流而裂解。
图18是cc503和cc125细胞类型的总离子色谱图(tic)峰面积图。
图19是对应于dgts(34:4)的m/z732.6和对应于dgts(32:0)内标的m/z712.6的相对强度对时间(秒)的提取离子色谱图(xic)图。
图20是对于dgts(34:4)从单个细胞和从提取物测量的氮限制性(-n)和正常(+n)生长的峰面积(a.u.)图。
图21是对于dgts(34:3)从单个细胞和从提取物测量的氮限制性(-n)和正常(+n)生长的峰面积(a.u.)图。
图22是对于dgts(38:4)从单个细胞和从提取物测量的氮限制性(-n)和正常(+n)生长的峰面积(a.u.)图。
具体实施方式
一种通过质谱分析法分析来自含有多个细胞的样本的单个细胞的方法包括在液体介质中提供多个细胞并将所述细胞和液体介质置于单个细胞分离喷出系统中的步骤。从单个细胞分离喷出系统中释放含有单个细胞的液体介质。然后在含有流动的捕获探头溶剂的捕获探头中捕获所述液体介质和单个细胞。在捕获探头中裂解所述细胞以将单个细胞组分分散到介质中。将裂解的单个细胞组分输送到质谱仪,其中进入该质谱仪的所述裂解的单个细胞组分与进入该质谱仪的来自样本的另一个细胞的任何裂解的单个细胞在空间和时间上分开。对裂解的单个细胞组分进行质谱分析。可以通过不同的方法和结构在捕获探头中诱导裂解。
用于通过质谱分析法分析单个细胞的系统可以包括单个细胞分离喷出系统,该系统包括用于样本的储存容器,该样本包括液体介质中的多个细胞。捕获探头包括至少一个用于供捕获探头溶剂流动的溶剂供应导管、用于接收由单个细胞分离喷出系统释放的单个细胞并将裂解的细胞组分和捕获探头溶剂引导至质谱仪的捕获探头排液导管,以及裂解诱导器。该系统还可包括具有连接到所述捕获探头排液导管的入口的质谱仪。裂解诱导器可以变化。可以将一类以上的裂解诱导器引入捕获探头中。
裂解诱导器可以包括合适的捕获探头溶剂。捕获探头溶剂提供比所述细胞的内部压力低的分压。裂解由提供低于细胞内部压力的分压的捕获探头溶剂诱导,从而导致细胞破裂和裂解。捕获探头溶剂可以是任何合适的溶剂。捕获探头溶剂可以包括选自由甲醇、乙醇、异丙醇、己烷、氯仿、二氯甲烷、乙腈和水组成的组中的至少一种。
裂解诱导器可以包括化学裂解剂。化学裂解剂可以是任何合适的裂解剂。化学裂解剂可包括选自由十二烷基硫酸钠(sds)、triton-x、np-40裂解缓冲液、ripa裂解缓冲液、吐温裂解缓冲液、chaps裂解缓冲液和全氟辛酸组成的组中的至少一种。化学裂解剂可以分散在捕获探头溶剂中。裂解诱导器可包括化学裂解剂注射器。化学裂解剂注射器的位置和构造可以变化。
裂解可以由流动的捕获探头溶剂形成的液体涡流诱导。裂解诱导器可以包括用于通过所述捕获探头从流动的捕获探头溶剂形成液体涡流的结构。裂解涡流可以由任何合适的结构产生。液体涡流可以由同轴探头形成,其中捕获探头溶剂从一个同轴溶剂供应流路流入,从公共开口端溢出,并以涡流模式进入同轴溶剂排液流路。排液流路中的其他涡流诱导结构是可能的。同轴探头可以包括用于形成由流动的捕获探头溶剂形成的液体涡流的液体供给和排液导管。如此产生的液体涡流可以具有不同的特性,但通常应提供足够的动能来裂解细胞。液体涡流可以具有50-300μl/分钟的流体流量。液体涡流可以具有50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195、200、205、210、215、220、225、230、235、240、245、250、255、260、265、270、275、280、285、290、295和300μl/分钟的流体流量,或在从这些值中选择的任何高值和低值的范围内。捕获探头溶剂的液体的洗脱时间可以为0.5~20秒。捕获探头溶剂的液体的洗脱时间可以为0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、11.5、12、12.5、13、13.5、14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19.5或20秒,或在从这些值中选择的任何高值和低值的范围内。
裂解诱导器可以包括布置在采样毛细管两侧的电极,用于向捕获探头中的细胞施加高电压。通过向携带细胞的捕获探头溶剂施加电压来诱导裂解。电极的构造可以变化,施加的电压也可以变化。细胞两端的电压可以是0.2~1.5伏。电压可以是0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4和1.5伏,或在从这些值中选择的任何高值和低值的范围内。施加电压的时间可以变化。电压可以在捕获探头溶剂中施加到细胞持续1~10000微秒。可对捕获探头溶剂中的细胞施加电压持续1、10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000或10000微秒,或在从这些值中选择的任何高值或低值的范围内。
裂解诱导器可以包括位于采样毛细管外部周围的声波发生器,用于将声波施加到捕获探头中的细胞。裂解是由发射到捕获探头中细胞处的声波引起的。声波发生器的构造可以变化。声波的频率可以变化。声波可以具有接近细胞膜共振频率的频率。声波可以具有15~20khz的频率。声波可以具有15、15.5、16、16.5、17、17.5、18、18.5、19、19.5或20khz的频率,或者在选自这些值的任何高值和低值的范围内。向细胞施加声波的时间量可能会有所不同。声能可以施加到细胞持续0.1~10秒。声能可以施加到细胞持续0.1、0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5或10秒,或在从这些值中选择的任何高值和低值的范围内。
来自单个细胞分离喷出系统的细胞的释放速率可以变化。单个细胞分离喷出系统的释放速率可以为0.1~100个细胞/秒。单个细胞分离喷出系统的释放速率可以是0.1、1、10、20、30、40、50、60、70、80、90、100个细胞/秒,或在从这些值中选择的任何高值和低值的范围内。单个细胞分离和弹出系统的释放率按需滴落。液体介质包括细胞培养基。单个细胞分离喷出系统的设计和构造可以变化。
使用喷墨打印机样机构作为单个细胞分离喷出装置的液滴喷出是以无标记和非接触方式从大块中分离单个细胞的有效手段,并且可以利用微流体分配器芯片和可以按需激活的压电致动器。一旦被激活,压电致动器会压缩分配器芯片,从而释放单个液滴。喷出液滴的大小(调整为比典型细胞略大)和使用视频显微镜使微流体分配器芯片中的细胞在被喷出之前可视化确保了每个液滴包含一个细胞。细胞在液滴喷出过程后仍然存活,这些技术通常用于填充源自单一遗传变体的新细胞培养物。本发明利用单个细胞分离喷出技术,如单个细胞打印机(scp),以分离和转移通过质谱进行分析的单个细胞。
液体涡流捕获(lvc)质谱分析法或lvc-ms是一种连续流动的液体溶剂萃取、常压ms技术。lvc-ms技术使用同轴管设计,当在优化的溶剂和雾化器气体条件下操作时,在探头的采样端保持稳定的液体涡流排放。与液体涡旋表面接触的样本被捕获,分析物分子从样本中被提取并在几秒钟内传输到质谱仪的电离源。随后,分析物使用电喷雾电离(esi)、大气压化学电离(apci)或几乎任何基于液体的电离源进行电离,并通过ms进行检测。
单个细胞分离喷出系统以及捕获探头裂解和ms技术通过将单个细胞直接喷出到诱导裂解的捕获探头中而结合在一起。包含由所述单个细胞分离喷出系统喷出的单个细胞的液滴落向捕获探头,该探头位于液滴喷出部位的正下方。液滴被捕获探头的流动溶剂捕获,其中细胞被裂解诱导器裂解。例如,当暴露于溶剂(例如甲醇、氯仿等)时,细胞壁会由于渗透压的变化而破裂。在传输到质谱仪的电离源的过程中(约6秒),细胞中的内容物可以被溶剂进一步提取。从那里,分析物分子被电离,然后使用ms以非靶向(例如,飞行时间(tof)-ms)或靶向(例如,串联ms)方式进行测量。本发明中描述的技术能够在使样本稀释最小化(minimizesampledilution)的同时有效地提取细胞内容物,从而实现测量单个细胞中的脂质和代谢物所需的灵敏度。由于捕获探头在流动的溶剂中持续运行,探头具有自清洁功能,并且可以去除从一个细胞到另一个细胞的信号残留,并且可以轻松确定来自溶剂离子或由介质引起的离子的背景信号。细胞保持其“自然”状态(即在这种情况下在生长培养基中),直到通过ms进行裂解和化学分析。此外,该技术不需要分子标记或其他样本制备方案。质谱仪和电离源的操作方式与通常用于测量聚集的细胞化学的直接灌注-esi实验完全相同。
图1a是用于通过质谱分析法分析单个细胞的系统10的横截面。系统10包括捕获探头14和单个细胞分离喷出系统18。捕获探头14可以具有不同的尺寸。在图1b中特别示出的实施例中,捕获探头14包括具有开口内部24的外部管状外壳20。捕获探头外壳20包括与开口内部24连通的开口端28。在开口内部24内是具有开口端34和开口内部36的排液导管32。排液导管32的尺寸和位置可以变化。在所示的实施例中,排液导管32与外壳20大致同轴放置。开口端34可位于开口内部24内的不同位置,但通常会偏离外壳20的开口端28。这确保流过开放内部24的流体将被吸入排液导管32的开放端34。
单个细胞分离喷出系统18可以具有不同的设计。这种设备也称为单个细胞打印机。在所示实施例中,外壳38包括用于接收液体介质中的多个细胞的容器39。隔离外壳40包括从容器39接收细胞64和液体介质的隔离室44(图2)。喷出口48的尺寸设计成使液体介质70的液滴中的单个细胞64通过。
提供连接以将溶剂输送到捕获探头14并从捕获探头14移除含有样本的溶剂并将其输送到质谱仪。排液导管32可以与质谱仪入口导管52、附件56和质谱仪端口60连通。溶剂入口导管66向捕获探头14和捕获探头外壳20的内部通道24供应溶剂。可以提供歧管配件68以为排液导管32、质谱仪入口导管52、溶剂入口导管66和捕获探头外壳20方便地提供连接和通道。其他设计也是可能的。
捕获探头14包括裂解诱导器。当单个细胞64由单个细胞分离喷出系统18接收时,裂解诱导器至少破坏单个细胞64的细胞壁或膜。通过捕获探头14的开口端28接收单个细胞64。溶剂以箭头74(图2)所示的方向朝向捕获探头14的开口端28流过捕获探头外壳20的开口内部24。可以将合适的泵施加到排液导管32以将溶剂吸入到排液导管32的开口内部36处。溶剂将沿箭头92的方向从捕获探头流向质谱仪。开口内部24中的溶剂流量可以与开口内部36中的溶剂流量平衡,使得溶剂不会溢出捕获探头外壳20的开口端28。单个细胞64进入捕获探头14的开口端28并被吸入排液导管32的开口内部36中。当单个细胞64穿过排液导管32时,单个细胞64的细胞膜被裂解诱导器裂解。
裂解诱导器操作的方式及其位置和构造可以变化。图2示出作为裂解诱导器操作的溶剂涡流80。溶剂涡流80由外壳20、排液导管32的设计和构造以及开口内部24和开口内部36中的相对流量产生。液体介质的液滴70中的单个细胞64进入排液导管32的开放末端34并接触涡流80。涡流80的动能分裂单个细胞64,至少细胞膜。产生细胞片84。涡流80的动能还可能进一步将细胞片84分裂成更小的细胞碎片88。
图3是具有施加电压裂解诱导器的捕获探头的放大横截面。施加电压许可诱导器100包括电极101和102,它们被定位成在排液导管32的开口内部36内的溶剂两端诱导电压电势。电极101和102被示出在捕获探头14内,然而,也可以将电极定位在捕获探头14中的其他地方,如外壳20内或外壳20外。施加的电压将作用于穿过排液导管32的单个细胞64以破坏细胞膜并产生细胞片106和可能的细胞碎片110。
还可以使用声能作为裂解诱导器。图4a中示出了具有声能裂解诱导器120的捕获探头的放大横截面,该声能裂解诱导器120由声能换能器122和可能的附加声能换能器124组成。声能换能器是众所周知的并且不同尺寸形状和位置是可能的。特别如图4b的展开图所示,声波128可以由换能器122产生并且声波130可以由换能器124产生。声能通过排液导管32传递并且部分地将声波传递到流过排液导管32的溶剂。当单个细胞64穿过排液导管32和声波能量时,声波能量导致单个细胞64被裂解成细胞片132和可能的细胞碎片136。
裂解诱导器还可包含裂解剂。裂解剂是与细胞壁或细胞膜组分反应以破坏细胞膜并释放细胞组分的化学组合物。裂解剂还可以起到将细胞组分降解成较小的细胞片和碎片的作用。为此可以选择裂解剂。图5是具有裂解剂注射器的捕获探头14的放大横截面。裂解剂注射器的精确构造和位置可以变化,并且不同的实施例在图5中示出。裂解剂注射器150可以从源154接收裂解剂并在开口158处将裂解剂释放到排液导管32中。裂解剂将接触排液导管32内的单个细胞64以将细胞64裂解成细胞片204和可能的细胞碎片210。其他裂解剂注射器是可能的。溶解剂注射器164可以从源168接收溶解剂并且在开口172处将溶解剂释放到外壳20的开口内部24中。也可以在溶剂到达捕获探头14之前将溶解剂注入溶剂中。图5示出了其中溶剂供应线180接收溶剂流184的另一替代实施例。溶解剂注射器190接收溶解剂流194并将溶解剂注射到溶剂流184中。然后将溶剂和溶解剂的组合在开口200注入外壳20的开口内部24,使得裂解剂会接触细胞64。
使用单个细胞分离喷出系统对本发明进行了测试,该系统结合了小液滴压电喷出,然后将液滴捕获到液体涡流捕获探头中,细胞裂解,并传输到质谱仪。一旦暴露于适当的溶剂中,细胞就会被裂解、提取并通过ms进行分析。该方法通过测量微藻、莱茵衣藻(chre)和细小裸藻(eugr)以及hela细胞在其天然生长培养基中的脂质组成进行验证。在同一溶液中混合在一起的chre和eugr微藻能够根据测量的脂质谱逐个细胞区分。在单个细胞中观察到许多二酰基甘油基三甲基高丝氨酸(dgts)、磷脂酰胆碱(pc)、单半乳糖二酰基甘油(mgdg)和二半乳糖二酰基甘油(dgdg)脂质。连续的溶剂流动可确保快速分析细胞,并且不会观察到细胞之间的信号残留。根据在每个细胞中测量的二酰基甘油三甲基高丝氨酸(dgts)和磷脂酰胆碱(pc)脂质水平之间的差异,将在同一溶液中混合在一起的chre和eugr微藻实时逐个细胞区分。通过将脂质质谱信号归一化为分析过程中添加到lvc探头溶剂中的dgts(32:0)内标,chre中存在的几种dgts脂质用单个细胞分辨率进行量化。通过与大量脂质提取物进行比较来验证定量峰面积。在氮限制和正常生长条件下5天后,比较了由数百个细胞组成的峰面积分布的chre,显示出明显的差异,并且能够通过单个细胞分辨解决细胞群体差异。在这些实验中总共分析>20000个细胞。
lc-ms
该系统由市售的单个细胞分离喷出装置single-cellprintertm(cytenagmbh,freiburg,germany)与改进的采样捕获探头组成。单个细胞分离喷出装置是一种台式大小的自动按需滴落细胞打印机,利用类似喷墨的分配原理与光学显微镜相结合,以确保每个液滴喷出一个细胞。使用该设备>95%的喷出液滴包含单个细胞。在实践中,沿着微流体样本盒壁的阴影会使细胞在图像识别算法不清楚,可能导致液滴中有两个细胞,因此,单个细胞分配效率<100%。本研究中使用的仪器能够以高达约30个液滴/秒的可控通量喷出液滴,并且可以分离直径在5~30μm之间的细胞。
单个细胞分离喷出系统分配器和图像识别设置需要针对所使用的每个样本盒和被研究的细胞进行调整。对于每个实验,一次性微流体样本盒装有50μl细胞溶液,并安装在分配器上。分配器的压电柱塞从墨盒中产生直径约70μm的液滴,而无需直接接触样本。视频监视器和图像识别算法检测到样本盒液滴喷出区域中的细胞。不包含单个细胞或包含两个或多个细胞的液滴使用位于喷嘴正下方的真空挡板系统去除,而那些包含单个细胞的液滴则允许通过。一旦样本盒连接到分配器,细胞图像识别目标区域就被设置为样本盒孔口周围的区域。图像算法经过调整以准确识别样本盒中的细胞。所有实验均使用5~25μm细胞直径、0.4~1.0圆度和30个灰度阈值。调整压电行程深度(8~12μm)和速度(90~110μm/毫秒)以可重复地喷出液滴,喷出后液滴的成像证明了这一点。
捕获探头由连接到5端口peek歧管(idexhealthandscience)的内径1.12mm、外径1.62mm的不锈钢外环构成。内环为直接连接到质谱仪的离子源的长20cm、内径0.178mm、外径0.794mm的peek毛细管(idexhealthandscience)。
将单个细胞分离喷出系统置于sciex
使用matlab2018b(mathworks,natick,ma,usa)分析单个细胞质谱数据。scpassistant
单个液滴包含细胞的事件是泊松点过程,使得细胞浓度和液滴喷出频率(即,流量)对于预测scp喷出单个细胞液滴的通量是必要的。使用30滴/秒的液滴喷出速度,对应于约0.32μl/分钟的流量。大约1×106个细胞/ml的细胞浓度通常会产生足够高的scp速度,以达到质谱分析的通量限制。
使用溶解在水中的2.5μm咖啡因溶液来验证捕获探头-液滴对齐并评估系统的分析指标,例如灵敏度、再现性、峰宽、峰形和采样通量。咖啡因液滴实验使用150μl/分钟的流量和90/10/0.1(v/v/v)甲醇/氯仿/甲酸溶剂组合物。对应于163amol咖啡因/液滴、间隔1秒的50个连续液滴的捕获,使用咖啡因的单反应监测(srm)esi-ms(m/z195.1[m+h]+→138.1[m-c2noh3+h]]+)、0.10秒累积时间、5500v电喷雾电压(is)、70v去簇电位(dp)、27ev碰撞能量(ce)、400℃涡轮加热器温度(tem)和gs1=90和gs2=60n2气体设置来测量。这些测试产生了可重现的峰(rsd=5.7%)约1.2秒宽(基线到基线,见图6)。连续的溶剂流确保液滴之间没有信号残留,液滴之间恢复到基线溶剂离子信号就证明了这一点。根据这些指标,这种单个细胞打印机/液体涡流捕获/质谱(scp-lvc-ms)系统的最大采样通量将是约1个细胞/秒。
为了评估系统测量单个细胞化学谱的能力,使用直径约5~15μm的cc-125野生型mt+[137c]chre微藻。chre细胞悬液在没有稀释或对细胞悬液进行其他改变的情况下被移液到单个细胞分离喷出系统样本盒中,放置在分配器上并调整液滴喷出设置。只允许含有单个细胞的液滴落入捕获探头中。在细胞液滴喷出之前和之后立即拍摄样本盒的图像并用于验证正确喷出。每个细胞的信号峰宽被测量为约1.2秒,与之前测量的咖啡因液滴相同并显示在图6中。在此持续时间内可以获得多次ms扫描。在tof质谱图中观察到数十个离散离子。基于单独的串联ms实验和swath-ms扫描,离子主要是二酰基甘油基三甲基高丝氨酸(dgts)和单半乳糖基二酰基甘油(mgdg)脂质,显示出大量的dgts头基和mgdg碎片离子。确定的特定脂质包括dgts(34:4)(m/z732.6[m+h]+)、dgts(34:3)(m/z734.6[m+h]+)、dgts(38:4)(m/z783.5[m+h]+)、mgdg(34:7)(m/z767.5[m+na]+)以及其他小分子,包括脱镁叶绿素a(m/z871.7[m+h]+)、叶绿素a(m/z893.7[m+h]+)和叶绿素b(m/z906.7[m+h]+)。
进行了单独的实验以验证额外的细胞类型,包括哺乳动物细胞,可以用scp-lvc-ms技术测量。获得了另一种微藻eugr以及hela细胞的单个细胞质谱,后者是一种常用的源自宫颈癌的人类上皮细胞系。将每种细胞类型的细胞悬液直接从它们的培养或储存介质(分别用于微藻和hela细胞的hsm和磷酸盐缓冲盐水(pbs))移液到各自的scp样本盒中,并通过lvc探头进行采样。除了稀释hela细胞悬液外,在分析前的任一实验中均未使用任何样本制备,例如过滤、离心、固定。
chre的单个细胞分析使用150μl/分钟的流量和90/10/0.1(v/v/v)甲醇/氯仿/甲酸溶剂组合物。质谱仪配置为获取tof质谱(m/z700-1000,0.05秒累积时间,is=5500v,dp=70v,tem=400℃,gs1=90和gs2=60)以及三个swath质谱图。本实验中使用的三个swath-ms采集扫描窗口是swath光谱#1=m/z700-800、swath光谱#2=m/z800-900和swath光谱#3=m/z900-1000。每个swath实验都使用m/z100-1000扫描范围,0.03秒累积时间,is=5500v,dp=35v,ce=48ev,碰撞能量扩散(ces)=15ev,tem=400℃,gs1=90和gs2=60雾化器气体设置。每0.2秒连续获取tof和三个swath扫描。
eugr和hela细胞的单个细胞分析使用150μl/分钟的流量和90/10/0.1(v/v/v)甲醇/氯仿/甲酸溶剂组合物。质谱仪配置为获取tof质谱图(m/z700-1000,0.10秒累积时间,is=5500v,dp=70v,tem=400℃,gs1=90和gs2=60)。eugr的总离子色谱图(tic)示于图7。hela的tic示于图8。图9和图10分别显示了eugr和hela实验的tic曲线的放大视图。图11和图12示出了(d)eugr和(e)hela细胞分别在喷出前的图像。eugr细胞的直径约为20μm,呈椭圆形,并且具有高度移动性,在scp-lvc-ms分析期间它们在样本盒中的移动证明了这一点。细胞的活动突出表明它们在lvc探头捕获时点前不受其自然状态的干扰。
eugr的质谱示于图13中。hela细胞的示于图14中。来自eugr细胞的tof-ms光谱(图13)包含类似于chre的离子(例如脱镁叶绿素a、叶绿素a和叶绿素b)。最主要是观察到mgdg(34:7)(m/z762.7[m+nh4]+)、磷脂酰胆碱(pc)(40:8)(m/z830.6[m+h]+)和二半乳糖二酰基甘油(dgdg)(34:4)(m/z930.6[m+h]+)脂质。单个hela细胞(直径约15μm)的图像和质谱分别如图12和图14所示。在一项实验中获得了500个单个细胞质谱图。鉴定的离子包括pc(34:1)(m/z760.7[m+h]+)、pc(34:2)(m/z780.6[m+na]+)、pc(34:1)(m/z782.6[m+na]+)和pc(34:0)(m/z784.6[m+na]+)以及许多其他未鉴定的离子。
这些数据一起突出了测量来自藻类和哺乳动物细胞类型的单个细胞化学的能力。除了稀释外,没有采取任何样本制备措施,但至多可能需要对细胞进行稀释/浓缩或过滤介质以获取大颗粒,以分别促进高采样通量和减轻scp样本盒堵塞的可能性。hsm和pbs介质通常对该m/z范围(700-1000)中的单个细胞质谱有可忽略不计的影响,可以通过对每种介质的空液滴进行采样来评估。正如在之前的工作中所看到的,相对于探头(1mm)的小尺寸液滴(70μm)最大限度地减少了高盐诱导离子抑制效应的影响。空液滴的测量几乎没有到没有产生细胞中测量的脂质信号,表明脂质信号来自在lvc探头中裂解的细胞,而不是溶液中的细胞渗出液。
该系统的独特之处在于能够相对于其他非靶向ms单个细胞方法以以非靶向方式高采样通量测量单个细胞。以约2.5秒/细胞的总采样通量采集了1000个chre细胞。来自每个细胞的分析物信号在基线到基线之间完全分离,细胞之间没有交叉污染。基于含有咖啡因的单个液滴的约1.2秒信号峰宽,系统的理论通量为约1秒/细胞。在实践中,通量较慢,因为细胞在溶液中未最佳对齐,因为并非每个液滴都包含单个细胞,因此会被scp的真空挡板移除。
为了证明在每个液滴中测量单个细胞,将chre的(1:1v/v)细胞悬浮液与eugr混合并获得单个细胞质谱。这两种细胞类型可以通过chre中强存在的dgts脂质和eugr中的pc脂质进行化学区分。通过监测分别指示dgts和pc脂质的脂质头基碎片离子m/z236和m/z184,使用串联ms靶向dgts和pc脂质类别。图15显示了分别指示在eugr和chre细胞中发现的pc和dgts脂质的碎片离子的提取离子色谱图。使用dgts和pc碎片离子信号可以清楚地分离细胞类型。在即将喷出细胞之前,使用液滴喷出区域的一系列显微图像来确认细胞识别。在此初步实验中分析的500个细胞中,dgts和pc碎片离子峰面积的比较能够以100%的准确度鉴定每种细胞类型。
eugr和chre细胞混合物的单个细胞分析如图15所示,使用100μl/分钟的流量和90/10/0.1(v/v/v)甲醇/氯仿/甲酸溶剂组合物。质谱仪配置为使用m/z700-800采集扫描窗口采集swath质谱。使用m/z100-300扫描范围,0.05秒累积时间,is=5500v,dp=35v,ce=48ev,ces=15ev,tem=400℃,gs1=90和gs2=60雾化器气体设置。使用了m/z184.15(pc头基)和m/z236.24(dgts头基)处离子的提取离子色谱图(xic)。
为了显示这样的化学分类可以在软件解决方案中实时进行,scpassistant
营养剥夺是扰乱chre的脂质和代谢物浓度的已知途径。定量要求细胞完全裂解,分子组分完全提取,由于细胞介质或细胞代谢物的基质抑制效应归一化。在单个细胞液滴喷出和接触lvc溶剂后收集lvc电喷雾材料表明细胞在系统中高效裂解。图16显示了lvc捕获和电喷雾后的细胞裂解,以及在hsm介质中直接(即无溶剂或电压)喷雾细胞后显微镜载玻片上的完整细胞集合。图17显示了使用溶剂(甲醇)进行scp-lvc后雾化液滴的集合。没有观察到完整细胞的证据,表明细胞在暴露于lvc探头溶剂和雾化后裂解。
图18显示cc503(无细胞壁)和cc125(正常)chre细胞之间的平均积分tic峰面积。cc125的信号水平并不显著低于cc503(无壁突变体),表明cc125细胞即使存在细胞壁也能被裂解。为了对离子抑制效应进行归一化,将1nmdgts(32:0)添加到lvc样本探头溶剂中并连续监测。选择dgts(32:0)脂质是因为在单个细胞质谱中未观察到该离子,并且是最接近可商购的dgts脂质类别的标准。cc125测得的峰面积并不显著低于cc503测得的峰面积,置信度大于95%,表明cc125中细胞壁的存在似乎不会对lvc-ms分析产生负面影响。在这些实验中,细胞的物理检查和平均细胞强度的总体一致性都证实提取了单个细胞的可溶性分析物中的接近100%的脂质。
图19显示了m/z732.6的xic,对应于来自单个细胞的dgts(34:4),以及m/z712.6,对应于dgts(32:0)内标。显示了dgts(34:4)(图20)、dgts(34:3)(图21)和dgts(38:4)(图22)脂质的平均定量峰面积,这些脂质衍生自经历氮限制(-n)和正常(+n)生长的细胞的大量脂质提取物(浅灰色)和单个细胞(深灰色)的数据。星号“*”表示两个均值相等(p<0.05)。显示在图19-22中的+n和-n的chre细胞的单个细胞分析使用150μl/分钟的流量和90/10/0.1(v/v/v)甲醇/氯仿/甲酸+2μl/分钟的1.4μmdgts(32:0)溶剂组合物。质谱仪配置为获取tof质谱(m/z700-1000,0.10秒累积时间,is=5500v,dp=70v,tem=400℃,gs1=90和gs2=60)。
使用bligth和dyer提取方案将平均单个细胞测量值与大量脂质提取物进行比较,这是一种测量聚集脂质组成的常用方法。改进的bligh和dyer提取方案如下。将0.5ml缺氮(-n)细胞、正常生长细胞(+n)和hsm介质(空白)移液入玻璃小瓶中。将3ml2:1(v/v)氯仿/甲醇加入到每个小瓶中。将15μl的21μmdgts(32:0)添加到每个小瓶中(内标)。然后将每个小瓶涡旋30秒。然后将1ml氯仿添加到每个小瓶中并涡旋30秒。向每个小瓶中加入1ml水,然后涡旋30秒。每个小瓶以2260rpm(eppendorf5430离心机,hamburg,germany)离心5分钟。将脂质提取物移液到其他玻璃小瓶中。通过添加1ml氯仿、涡旋30秒、离心和去除脂质提取物来进行另外两次提取。使用n2气干燥收集的脂质提取物,然后重新悬浮在0.5ml90/10/0.1(v/v/v)甲醇/氯仿/甲酸中。通过esi-ms测量与150μl/分钟的90/10/0.1(v/v/v)甲醇/氯仿/甲酸混合的2μl/分钟的提取物。质谱仪配置为获取tof质谱(m/z700-1000,0.10秒累积时间,is=5500v,dp=70v,tem=400℃,gs1=90和gs2=60)。
可以使用lvc流量计算细胞在lvc探头溶剂中的稀释度,通常为150μl/分钟,单个细胞信号峰宽约1.2秒,这表明每个细胞包含在3μl的溶剂中。鉴于信号谱曲线的高斯状峰形,大多数分析物(约1sigma/68%)位于0.4秒或约1μl溶剂内。
从分别在+n和-n生长条件获取的556和704个单个细胞,计算生长5天后的dgts(34:4)、dgts(34:3)和dgts(38:4)脂质的定量峰面积/细胞(图20-22)。除了+n,dgts(38:4)实验外,脂质提取物和平均单个细胞数据可以被认为是等同的。对于等同性测试,使用提取物测量值95%置信度的标准误差来定义被视为等同的单个细胞测量值的置信水平限制。通过使用每个有疑义的分子的外部校准曲线可以实现绝对定量,但在目前的情况下,这些特定脂质的标准品不可用。
+n和-n生长之间存在显著的质谱差异。细胞悬浮液的颜色明显不同,+n生长明显更绿。这与在+n细胞中观察到的更大的脱镁叶绿素a、叶绿素a和叶绿素b峰面积一致。不同营养条件下的细胞生长差异很大,-n生长细胞数浓度在实验的5天内保持相对停滞。使用单个细胞打印机的图像识别算法测量的细胞大小分布在两种生长条件下相似。细胞大小分布数据受图像识别算法设置的影响,在这种情况下,设置为允许获取直径在5~25μm之间的细胞。在chre的+n和-n实验中观察到,来自dgts(34:4)、dgts(34:3)、dgts(38:4)、mgdg(34:7)、脱镁叶绿素a和叶绿素a离子的单个细胞峰面积直方图,这些离子峰面积在正常生长条件下显著更大。尽管分子之间相似,但dgts(34:4)和dgts(34:3)脂质具有非常不同的分布。这在细胞提取数据中也很明显。
这些数据表明,本发明能够对天然介质中的单个细胞进行非靶向、高通量和定量质谱分析。本发明展示了以高通量(约2.5秒/细胞)对微藻和hela细胞的单个细胞质谱进行非靶向和靶向采集。基于质谱中观察到的化学差异,可以使用软件实现单个细胞的实时化学分类。除了tof-ms光谱之外,获得swath光谱的能力可有助于通过化学方法区分更复杂的细胞系统。该系统用于定量脂质,并通过将内标掺入lvc系统的溶剂流中来显示它们在+n和-n条件下的单个细胞生长中的分布。
实验显示直接从细胞培养物中测量的单个细胞化学,而没有极少(如果有的话)可能负面干扰细胞的样本制备程序。无需耗时且昂贵的样本预处理方案,显著提高了单个细胞实验的简便性和整体速度,并实现了对原始样本(例如水样)进行原位化学谱分析的潜力。几乎任何细胞悬液都适合本发明的分析,包括哺乳动物细胞。靶向哺乳动物细胞分析鉴定也是可能的。目前,介质应该具有与水相似的粘度才能可靠地喷出。此外,同一个液滴中包含多个细胞的可能性很小(<5%),但这些都是罕见的事件,其中大部分可以通过对scp生成的图像进行额外的后期分析来识别。喷出比此处使用的细胞(例如细菌)更小的细胞是可能的,但将取决于lvc-ms对感兴趣分子的敏感性。本发明有可能阐明基本的细胞过程,否则这些过程会因从其天然环境中去除细胞而变得模糊不清。较短的样本到答案时间,以及一次性分配盒与自清洁lvc探头的组合使本发明有可能在未来的临床应用中可行,并可能提供有关细胞代谢物和脂质的非遗传异质性如何影响治疗功效的见解,可能导致改进的治疗策略。
本发明允许进行许多独特的实验。去除可能对细胞产生负面影响的大量样本制备程序,使这种单个细胞表征能力更容易获得。可以以非靶向和靶向两种方式从单个细胞中获取多个质谱。本文所示的所有实验直接从细胞培养物中测量单个细胞化学。液滴喷出前后细胞的视频图像用于计算细胞直径,并验证系统主要喷出和获取单个细胞。通过将内标掺入系统的溶剂流中,证明了系统在单个细胞水平上定量脂质峰面积的能力。通过将单个细胞测量值的平均值与从大量脂质提取物测量的值进行比较来验证定量值。虽然目标脂质在大量脂质提取物之间的值差异小于15%,但也可以对其他脂质进行定量,包括内标类之外的脂质,但这需要根据具体情况进行评估。
与流式细胞术和质谱细胞仪仪器相比,本发明提供了来自未受干扰和未修饰细胞的细胞代谢物的非靶向化学谱分析。虽然流式细胞术通常限于一个或几个分子标签,而质谱流式细胞术通常限于几十个,但本发明可能包含数百个分子标签。此外,它不限于使用荧光团或金属同位素,但也可以在灵敏度允许的情况下使用。虽然与传统的流式细胞术技术相比,通量要慢得多,但这里提供的数据代表了与当前技术水平相比的实质性增长。缺乏耗时且昂贵的样本预处理方案,显著降低了每个实验的通量并提高了可访问性。可以以高达1个细胞/秒的理论速率,实际上约1个细胞/2.5秒获取单个细胞数据。
几乎任何细胞悬液都适合通过这种技术进行分析,包括哺乳动物细胞。虽然重点是建立scp-lvc-ms系统的概念证明,但从人类样本中进行靶向哺乳动物细胞研究是可行的。该技术的一个限制是液滴喷出机制。目前,介质必须具有与水相似的粘度才能可靠地喷出。此外,由于样本盒上的暗边,有小机率在同一个液滴中含有多个细胞。最小的细胞尺寸取决于样本盒的孔口、样本盒中单个细胞的可视化能力以及质谱仪对目标分子的灵敏度。
如附图所示并在此详细描述的本发明公开了用于说明本发明的结构和操作方法的优选实施例的特定构造和配置的元件的布置。然而,应当理解,根据本发明的精神,可以采用与所说明和描述的具有不同构造和配置的元件及其其他布置和操作方法,以及这些变化、变更和修改,本领域技术人员认为在所附权利要求中广泛定义的本发明的范围内。此外,应当理解,本文所采用的措辞和术语是为了描述的目的而不应被视为限制性的。
- 还没有人留言评论。精彩留言会获得点赞!