降低血红蛋白A1c测定中的英脱利匹特/脂血干扰的浊度归一化算法和方法与流程
相关申请的交叉引用/通过引用并入声明
不适用。
关于联邦资助的研究或开发的声明
不适用。
背景
存在于红血细胞中的血红蛋白可以通过将葡萄糖分子非酶促地添加至血红蛋白的β-链的氨基末端而被糖化。一旦血红蛋白分子被糖化,它就保持糖化,并且红细胞内糖化血红蛋白的积累反映细胞在其生命周期期间已经暴露的平均葡萄糖水平。因此,个体血液中存在的糖化血红蛋白水平与血液中的葡萄糖水平成正比,并且是个体在先前四周至三个月内的平均每日血液葡萄糖浓度的指标。因此,全血样品中糖化血红蛋白与总血红蛋白的比率在具有糖尿病的患者的诊断和监测中是相当有用的。
血液葡萄糖的精确控制可以改善许多与糖尿病相关的发病率和死亡率。因此,基于血红蛋白的物理和化学特性或基于其特异性抗体识别的表位,已经开发了许多不同的血红蛋白的测定法。临床研究已经显示,hba1c结果改进决策、患者依从性和预后(thaler等人(1999)diabetescare,22:1415-1421;和miller等人(2003)diabetescare,26:1158-1163)。
糖化血红蛋白(hba1c)通过血红蛋白a的β-链的n-末端的非酶促糖化形成。hba1c的测量被用作诊断和监测具有糖尿病的患者中的长期血液葡萄糖控制的辅助手段,并用作鉴定处于发展糖尿病的风险中的患者的辅助手段。hba1c水平反映先前时段(近似8-12周,取决于个体)内的平均葡萄糖浓度,并且比血液和尿液葡萄糖测定提供了更好的长期血糖控制指标。研究已经显示,hba1c水平的长期控制可以降低由糖尿病引起的慢性并发症的发展和进展的风险。
免疫测定法是目前在临床实验室环境中使用的最常见类型的血红蛋白测定方法。这些免疫测定法利用这样的抗体,其识别血红蛋白表位,并且在特定情况下识别糖化血红蛋白(hba1c)的表位,诸如(但不限于)其n-末端糖化氨基酸的至少一部分。例如,针对分析物hba1c的比浊抑制免疫测定法(tinia)利用抗hba1c抗体和多半抗原凝集剂(即,含有多个hba1c表位以引起与游离抗体凝集的合成分子)。然而,不完全分散的多半抗原试剂是该测定法的主要干扰,因为其基本上模拟不溶性抗体-多半抗原复合物;不完全分散的多半抗原试剂引起光散射,随后比浊测量所述光散射,并且由于吸光度和分析物浓度之间的反比关系,所述光散射因此转化为错误的低hba1c值。
光谱方法也用于血红蛋白测定;然而,生物样品内脂质的存在可以在这些方法中利用的一种或多种波长处引起干扰。因此,需要新的和改进的血红蛋白a1c测定,其利用光谱方法并且没有观察到来自英脱利匹特/脂血的显著干扰。
附图简述
图1图示说明使用掺以英脱利匹特的全血样品,在atellicach临床化学分析仪(siemenshealthineers,tarrytown,ny)上获得的%糖化血红蛋白(%a1c)相比于英脱利匹特浓度(mg/dl)的结果。
图2图示说明使用掺以英脱利匹特的全血(6.5%hba1c)获得的%偏差相比于英脱利匹特浓度(mg/dl)的结果。
图3图示说明使用掺以英脱利匹特的全血(8.0%hba1c)获得的%偏差相比于英脱利匹特浓度(mg/dl)的结果。
图4图示说明使用英脱利匹特掺加的全血(6.5%和8%hba1c)获得的a1c(µmol/l)相比于英脱利匹特浓度(mg/dl)的结果。
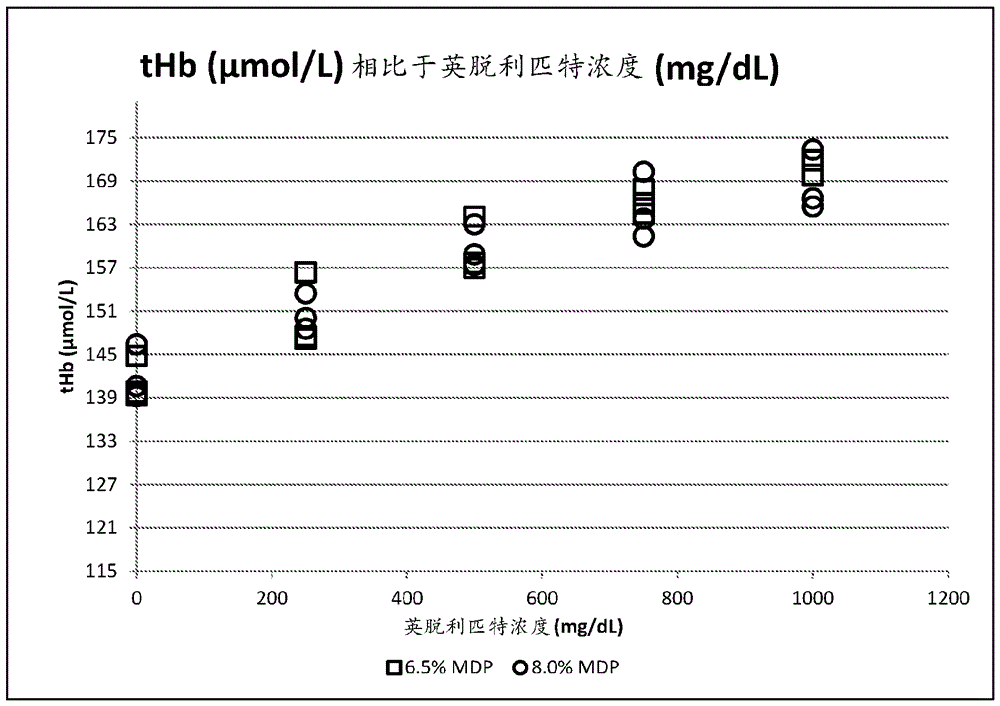
图5图示说明使用英脱利匹特掺加的全血(6.5%和8%hba1c)获得的总血红蛋白(thb;µmol/l)相比于英脱利匹特浓度(mg/dl)的结果。
图6图示说明增加的英脱利匹特对thb的影响(%)相比于英脱利匹特不存在的情况。
图7说明用于英脱利匹特掺加的样品的稀释方案。
图8图示说明具有渐增的英脱利匹特的δthb(µmol/l)相比于掺以英脱利匹特的全血(6.5%hba1c)中的805nm处的吸光度。
图9说明用于正常样品的稀释方案。
图10图示说明805nm处的吸光度相比于用盐水稀释的正常样品中的thb(μmol)。
图11说明用于atellicach-英脱利匹特干扰的稀释方案。
详细描述
在通过示例性语言和结果的方式详细解释本公开的至少一个实施方案之前,应理解,所述本公开不限于下面的描述中阐述的其对组分的构造和排列的细节的应用。本公开能够具有其他实施方案,或者能够以各种方式实践或实施。因此,本文使用的语言意欲被给予最广泛的可能范围和含义;并且实施方案意味着是示例性的—而非穷举性的。而且,应该理解,本文采用的措辞和术语是为了描述的目的,并且不应被认为是限制性的。
除非本文另有定义,否则结合本公开使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。进一步,除非上下文另有要求,否则单数术语应包括复数,并且复数术语应包括单数。通常,与本文所述的细胞和组织培养、分子生物学、以及蛋白和寡核苷酸或多核苷酸化学和杂交相关利用的术语及其技术是本领域中众所周知和常用的那些。标准技术用于重组dna、寡核苷酸合成以及组织培养和转化(例如,电穿孔、脂质转染)。酶促反应和纯化技术根据制造商的说明书或如本领域中通常完成的或如本文所述进行。前述技术和程序通常根据本领域众所周知的常规方法、并且如在本说明书通篇引用和讨论的各种一般和更具体的参考文献中所述而实施。参见例如,sambrook等人(molecularcloning:alaboratorymanual,第2版,coldspringharborlaboratorypress,coldspringharbor,n.y.(1989))和coligan等人(currentprotocolsinimmunology,wileyinterscience(1994))。与本文所述的分析化学、合成有机化学以及药用和药物化学结合利用的命名及其实验室程序和技术是本领域中众所周知和常用的那些。标准技术用于化学合成、化学分析、药物制备、配制和递送以及患者治疗。
本说明书中提及的所有专利、公开的专利申请和非专利出版物指示本公开所属领域的技术人员的技术水平。在本申请的任何部分中引用的所有专利、公开的专利申请和非专利出版物在本文中明确地通过引用以其整体并入,其程度如同每个单独的专利或出版物被具体和个别地指出通过引用并入一样。
鉴于本公开,无需过度实验即可制备和执行本文公开的所有组合物、试剂盒和/或方法。尽管已经在具体实施方案的方面描述了所述组合物、试剂盒和/或方法,但对于本领域技术人员将显而易见的是,在不脱离本公开的构思、精神和范围的情况下,可对所述组合物、试剂盒和/或方法、以及在本文描述的方法的步骤或步骤顺序中应用变化。认为对于本领域技术人员显而易见的所有此类类似的替代和修改在如所附权利要求书限定的本公开的精神、范围和构思内。
如根据本公开所利用,除非另有指示,否则以下术语应理解为具有以下含义:
与权利要求和/或说明书中的术语“包括”结合使用时,术语“一个/种(a)”或“一个/种(an)”的使用可意味着“一个/种(one)”,但它也与“一个/种或多个/种”、“至少一个/种”和“一个/种或多于一个/种”的含义一致。因此,术语“一个/种(a)”、“一个/种(an)”和“该/所述(the)”包括复数指示物,除非上下文另有明确指示。因此,例如,对“一种化合物”的提及可指一种或多种化合物、2种或更多种化合物、3种或更多种化合物、4种或更多种化合物或更大数目的化合物。术语“多个/种”是指“两个/种或更多个/种”。
术语“至少一个/种”的使用将被理解为包括一个/种以及多于一个/种的任何数量,包括但不限于2、3、4、5、10、15、20、30、40、50、100个/种等。术语“至少一个/种”可延伸多至100或1000或更多个/种,这取决于它所附接的术语;此外,100/1000的数量不视为限制性的,因为更高的限值也可产生令人满意的结果。此外,术语“x、y和z中的至少一个/种”的使用将被理解为包括单独的x,单独的y和单独的z,以及x、y和z的任何组合。序数术语(即,“第一”、“第二”、“第三”、“第四”等)的使用仅用于区分两个或更多个事项的目的,并且不意味着暗示例如一个事项相对于另一事项的任何顺序或次序或重要性、或任何添加次序。
在权利要求中使用术语“或”用于意指包括性的“和/或”,除非明确指出仅指替代方案或者除非替代方案是互相排斥的。例如,以下任一种都满足条件“a或b”:a为真(或存在)且b为假(或不存在),a为假(或不存在)且b为真(或存在),并且a和b两者均为真(或存在)。
如本文所用,对“一个实施方案(oneembodiment)”、“一个实施方案(anembodiment)”、“一些实施方案”、“一个实例(oneexample)”、“例如”或“一个实例(anexample)”的任何引用意指结合该实施方案描述的具体要素、特征、结构或特点包括在至少一个实施方案中。例如,说明书中各个地方出现的短语“在一些实施方案中”或“一个实例”不一定全部是指同一实施方案。此外,对一个或多个实施方案或实例的所有引用都应被解释为对权利要求非限定性的。
贯穿本申请,术语“约”用于指示,值包括用于测定该值的组合物/仪器/装置、方法的误差的固有变化,或研究受试者间存在的变化。例如,但不限于,当利用术语“约”时,指定值可以与列举值相差正负20%,或15%,或12%,或11%,或10%,或9%,或8%,或7%,或6%,或5%,或4%,或3%,或2%,或1%,因为此类变化适用于执行公开的方法并由本领域普通技术人员所理解。
如在本说明书和一个或多个权利要求中所用,术语“包含(comprising)”(和任何形式的包含,例如“包含(comprise)”和“包含(comprises)”)、“具有(having)”(和任何形式的具有,例如“具有(have)”和“具有(has)”)、“包括(including)”(和任何形式的包括,例如“包括(includes)”和“包括(include)”)或“含有(containing)”(和任何形式的含有,例如“含有(contains)”和“含有(contain)”)都是包括性的或开放式的,并且不排除另外的未列举的要素或方法步骤。
如本文所用的术语“或其组合”是指所述术语之前列出的事项的所有排列和组合。例如,“a、b、c或其组合”意欲包括以下中的至少一个:a、b、c、ab、ac、bc或abc,并且如果次序在特定上下文中是重要的,则也包括ba、ca、cb、cba、bca、acb、bac或cab。继续该实例,明确包括的是含有一个或多个事项或术语的重复的组合,例如bb、aaa、aab、bbc、aaabcccc、cbbaaa、cababb等等。技术人员将理解,除非从上下文可见,否则通常对任何组合中的事项或术语的数量没有限制。
如本文所用,术语“基本上(substantially)”意味着随后描述的事件或情况完全发生或者随后描述的事件或情况在大范围或程度上发生。例如,当与具体事件或环境相关时,术语“基本上”意味着随后描述的事件或情况发生在至少80%的时间、或至少85%的时间、或至少90%的时间、或至少95%的时间。术语“基本上相邻”可以意指两个事项与彼此100%相邻,或者两个事项与彼此密切接近,但与彼此不是100%相邻,或者两个事项之一的一部分与另一事项不是100%相邻,而是与另一事项密切接近。
如本文所用的术语“样品”将被理解为包括可以根据本公开利用的任何类型的生物样品。可利用的流体生物样品的实例包括但不限于:全血或其任何部分(即,血浆或血清)、尿液、唾液、痰、脑脊液(csf)、皮肤、肠液、腹膜内液、囊液(cysticfluid)、汗液、间质液、细胞外液、泪液、粘液、膀胱洗液(bladderwash)、精液、粪便、胸膜液、鼻咽液、其组合等。
如本文所用的术语“反应比色皿”包括能够执行如本文所述的至少一种诊断测定的任何装置。所述反应比色皿可以手动执行诊断测定,但在大多数情况下,所述反应比色皿将插入自动执行诊断测定的系统中。在一个非限制性实施方案中,所述反应比色皿包括用于自动诊断测定的反应比色皿,所述自动诊断测定通过例如但不限于由siemenshealthineers(tarrytown,ny)市售的atellica临床化学系统执行。然而,应理解,所述反应比色皿可以是本文描述或以其他方式考虑的能够执行根据本公开的一种或多种诊断测定的任何市售产品或比色皿。
现在转向本文公开的和/或请求保护的发明构思,本公开的某些非限制性实施方案通常涉及用于减少血红蛋白a1c测定中的干扰的方法,其中所述干扰(例如但不通过限制的方式)由英脱利匹特/脂血引起,且其中通过使用浊度归一化算法减少所述干扰。具体而言,本公开的某些非限制性实施方案涉及糖化血红蛋白测定,其中已经从其基本上除去任何浊度干扰;例如(但不通过限制的方式),在最高达约1000mg/dl的英脱利匹特浓度下,可以将任何浊度干扰基本上降低至小于+/-约5%。以这种方式,从测定中除去用英脱利匹特/脂血观察到的任何负偏差。
本公开的某些非限制性实施方案涉及测量生物样品中的%糖化血红蛋白或糖化血红蛋白:总血红蛋白比率的方法。所述方法包括以下步骤:(i)测量含有裂解的红血细胞的生物样品中在第一波长和第二波长处的吸光度,和基于在这两个波长处获得的测量值确定总血红蛋白浓度(thb),其中所述第一波长是658nm,且其中所述第二波长在约689nm至约699nm的范围内;(ii)测量含有裂解的红血细胞的生物样品中在第三波长和第四波长处的吸光度,和基于在这两个波长处获得的测量值确定糖化血红蛋白浓度(a1c),其中所述第三波长是658nm,且其中所述第四波长在约785nm至约825nm的范围内;(iii)利用步骤(ii)中在第四波长处测量的吸光度(chb)和浊度归一化算法将(i)中计算的总血红蛋白浓度归一化,以从(i)的波长测量值基本上除去任何浊度干扰,其中在最高达约1000mg/dl的英脱利匹特浓度下,将任何浊度干扰基本上降低至小于+/-约5%,且其中所述浊度归一化算法为:归一化thb=
在上述方法的某些非限制性实施方案中,所述生物样品是裂解的全血样品。
在上述方法的某些非限制性实施方案中,所述步骤在单个反应比色皿中进行。
所述第二波长可以是约689nm至约699nm的范围内的任何整数,包括约689nm、约690nm、约691nm、约692nm、约693nm、约694nm、约695nm、约696nm、约697nm、约698nm和约699nm。在一个具体(但非限制性)实施方案中,所述第二波长是694nm。
所述第四波长可以是约785nm至约825nm的范围内的任何整数,包括约785nm、约786nm、约787nm、约788nm、约789nm、约790nm、约791nm、约792nm、约793nm、约794nm、约795nm、约796nm、约797nm、约798nm、约799nm、约800nm、约801nm、约802nm、约803nm、约804nm、约805nm、约806nm、约807nm、约808nm、约809nm、约810nm、约811nm、约812nm、约813nm、约814nm、约815nm、约816nm、约817nm、约818nm、约819nm、约820nm、约821nm、约822nm、约823nm、约824nm和约825nm。在一个具体(但非限制性)实施方案中,所述第四波长是805nm。
本公开的某些非限制性实施方案涉及测量生物样品中的%糖化血红蛋白或糖化血红蛋白:总血红蛋白比率的方法。所述方法包括以下步骤:(a)裂解所述生物样品中存在的红血细胞;(b)使裂解的红血细胞与试剂反应以将血红蛋白氧化成高铁血红蛋白;(c)用蛋白酶从血红蛋白β链切割n-末端果糖基二肽片段;(d)将高铁血红蛋白转化为叠氮化物-高铁血红蛋白;(e)测量第一波长和第二波长处的吸光度,和基于在这两个波长处获得的测量值确定总血红蛋白浓度(thb),其中所述第一波长是658nm,且其中所述第二波长在约689nm至约699nm的范围内;(f)使n-末端果糖基肽片段与试剂反应以生成过氧化氢;(g)测量第三波长和第四波长处的吸光度,和基于在这两个波长处获得的测量值确定糖化血红蛋白浓度(a1c),其中所述第三波长是658nm,且其中所述第四波长在约785nm至约825nm的范围内;(h)利用步骤(g)中在第四波长处测量的吸光度(chb)和浊度归一化算法将步骤(e)中计算的总血红蛋白浓度归一化,以从步骤(e)的波长测量值基本上除去任何浊度干扰;和(i)基于(g)和(h)中计算的浓度计算%糖化血红蛋白或糖化血红蛋白:总血红蛋白比率。
在某些非限制性实施方案中,步骤(h)中使用的浊度归一化算法是:
归一化thb=
在某些非限制性实施方案中,在最高达约1000mg/dl的英脱利匹特浓度下,将任何浊度干扰基本上降低至小于+/-约5%。
在某些非限制性实施方案中,该方法的所有步骤(a)-(g)在单个反应比色皿中进行。
所述第二波长可以是约689nm至约699nm的范围内的任何整数,包括约689nm、约690nm、约691nm、约692nm、约693nm、约694nm、约695nm、约696nm、约697nm、约698nm和约699nm。在一个具体(但非限制性)实施方案中,所述第二波长是694nm。
所述第四波长可以是约785nm至约825nm的范围内的任何整数,包括约785nm、约786nm、约787nm、约788nm、约789nm、约790nm、约791nm、约792nm、约793nm、约794nm、约795nm、约796nm、约797nm、约798nm、约799nm、约800nm、约801nm、约802nm、约803nm、约804nm、约805nm、约806nm、约807nm、约808nm、约809nm、约810nm、约811nm、约812nm、约813nm、约814nm、约815nm、约816nm、约817nm、约818nm、约819nm、约820nm、约821nm、约822nm、约823nm、约824nm和约825nm。在一个具体(但非限制性)实施方案中,所述第四波长是805nm。
在某些非限制性实施方案中,所述生物样品是全血样品。
根据本公开,本领域已知的或本文以其他方式考虑的任何裂解试剂可用于裂解生物样品中存在的红血细胞。裂解试剂是本领域众所周知的并且广泛市售的,并且因此认为没有必要对其进行进一步讨论。
根据本公开,可以利用本领域已知的能够在本文公开的方法中将血红蛋白氧化成高铁血红蛋白的任何试剂。在某些非限制性实施方案中,用于在步骤(b)中将血红蛋白氧化成高铁血红蛋白的试剂是亚硝酸钠。
根据本公开,可以利用在本文公开的方法的步骤(d)中将高铁血红蛋白转化为叠氮化物-高铁血红蛋白的任何叠氮化物。在某些非限制性实施方案中,在叠氮化钠存在的情况下将高铁血红蛋白转化为叠氮化物-高铁血红蛋白。
根据本公开,可以利用能够在本文公开的方法的步骤(f)中导致与血红蛋白β链的n-末端果糖基肽片段反应后生成过氧化氢的任何试剂。在某些非限制性实施方案中,步骤(f)中使用的试剂是果糖基肽氧化酶。
本公开的某些非限制性实施方案涉及测量生物样品中的%糖化血红蛋白或糖化血红蛋白:总血红蛋白比率的方法。所述方法包括以下步骤:(a)裂解所述生物样品中存在的红血细胞;(b)使裂解的红血细胞与亚硝酸钠反应以将血红蛋白氧化成高铁血红蛋白;(c)用蛋白酶从血红蛋白β链切割n-末端果糖基二肽片段;(d)在叠氮化钠存在的情况下将高铁血红蛋白转化为叠氮化物-高铁血红蛋白;(e)测量第一波长和第二波长处的吸光度,和基于在这两个波长处获得的测量值确定总血红蛋白浓度(thb),其中所述第一波长是658nm,且其中所述第二波长在约689nm至约699nm的范围内;(f)使n-末端果糖基肽片段与试剂反应以生成过氧化氢;(g)测量第三波长和第四波长处的吸光度,和基于在这两个波长处获得的测量值确定糖化血红蛋白浓度(a1c),其中所述第三波长是658nm,且其中所述第四波长在约785nm至约825nm的范围内;(h)利用步骤(g)中在第四波长处测量的吸光度(chb)和浊度归一化算法将步骤(e)中计算的总血红蛋白浓度归一化,以从(e)的波长测量值基本上除去任何浊度干扰,其中在最高达约1000mg/dl的英脱利匹特浓度下,将任何浊度干扰基本上降低至小于+/-约5%,且其中所述浊度归一化算法为:归一化thb=
在上述方法的某些非限制性实施方案中,所述生物样品是全血样品。
在上述方法的某些非限制性实施方案中,步骤(a)-(g)在单个反应比色皿中进行。
所述第二波长可以是约689nm至约699nm的范围内的任何整数,包括约689nm、约690nm、约691nm、约692nm、约693nm、约694nm、约695nm、约696nm、约697nm、约698nm和约699nm。在一个具体(但非限制性)实施方案中,所述第二波长是694nm。
所述第四波长可以是约785nm至约825nm的范围内的任何整数,包括约785nm、约786nm、约787nm、约788nm、约789nm、约790nm、约791nm、约792nm、约793nm、约794nm、约795nm、约796nm、约797nm、约798nm、约799nm、约800nm、约801nm、约802nm、约803nm、约804nm、约805nm、约806nm、约807nm、约808nm、约809nm、约810nm、约811nm、约812nm、约813nm、约814nm、约815nm、约816nm、约817nm、约818nm、约819nm、约820nm、约821nm、约822nm、约823nm、约824nm和约825nm。在一个具体(但非限制性)实施方案中,所述第四波长是805nm。
实施例
下文提供了实施例。然而,应理解本公开,其应用不限于本文公开的具体实验、结果和实验室程序。相反,实施例仅作为各种实施方案之一提供,并且意在是示例性的,而非穷举性的。
目前使用的糖化血红蛋白测定(为advia临床化学分析仪开发;siemenshealthineers,tarrytown,ny)由两种分开的测量组成:糖化血红蛋白(alc_e)和总血红蛋白(thb_e)。两种测量值用于确定%hba1c(ngsp单位)或血红蛋白a1c_e/thb_e比率,以mmol/mol(ifcc单位)计。
抗凝全血样本在用于自动测定的系统上裂解,或者可以使用预处理溶液手动裂解以获得用于手动测定的溶血裂解物。
这种糖化血红蛋白测定是一种酶促方法,其专门测量hba1c的β-链上的n-末端果糖基二肽。在预处理步骤中,红细胞被裂解,并且血红蛋白通过与亚硝酸钠反应而被氧化为高铁血红蛋白。在反应的第一步中,使用蛋白酶从血红蛋白β链切割n-末端果糖基二肽片段。同时,在叠氮化钠存在的情况下,高铁血红蛋白被转化为稳定的叠氮化物-高铁血红蛋白,并且通过测量478/805nm处的吸光度来确定总血红蛋白浓度。在反应的第二步中,添加果糖基肽氧化酶(fpox)以与果糖基二肽反应以生成过氧化氢。在过氧化物酶存在的情况下,过氧化氢与色原反应以产生颜色,所述颜色在658/805nm处测量。
这种糖化血红蛋白测定还并入在884nm处测量的浊度归一化机制(chb_e),以有效地除去可能影响thb_e测量的任何样品浊度。
然而,其他临床化学分析仪不具有用于上述测定的浊度归一化组分的波长(884nm)处的滤光片;因此,必须开发其他归一化方法,以允许这些临床化学分析仪进行包括浊度标准化组分的糖化血红蛋白测定。如下文所述,已发现本文所述的糖化血红蛋白测定除去来自英脱利匹特/脂血的任何显著干扰。
现在转向本公开的糖化血红蛋白测定,该测定也是酶促终点测定,其中结果被测量为以下两种参数的百分比:a1c,在658/805nm处测量,和总血红蛋白(thb),在478/694nm处测量。该测定进一步包括并入第三子参数chb,以将具有英脱利匹特干扰和/或高浊度的样品中错误升高的thb值归一化。
与上文描述的为advia临床化学分析仪开发的测定相比比,在本文的糖化血红蛋白测定中,在与thb相同的读取周期期间,在805nm处测量chb,在805nm处的吸光度与英脱利匹特干扰或浊度增加无关。在本文公开的糖化血红蛋白测定中采用以下归一化方程:
归一化thb_e=
具有英脱利匹特或浊度增加的样品在两种不同的临床化学分析仪(atellicach和advia模块,siemenshealthineers,tarrytown,ny)上测试,并且发现其在两种平台上表现相似。在没有浊度归一化的情况下,这些样品表现出错误升高的thb值,以及因此错误地降低的hba1c(%)值(图1)。
当掺以英脱利匹特时,全血样品不符合|+/-5%|偏差规格。当计算至目标时|+/-5%|偏差时,通过的样品仅具有近似300mg/dl的英脱利匹特,其远低于1000mg/dl英脱利匹特目标浓度(图2和图3以及表i)。
表i:atellicach-没有归一化的英脱利匹特掺加的样品
与先前的测定平台类似,英脱利匹特干扰和样品浊度对本文的糖化血红蛋白测定的影响表现在thb部分上。因此,该平台还必需浊度归一化方程(图4、图5、图6和表ii)。
表ii:相比于零英脱利匹特,渐增的英脱利匹特对a1c(%)和thb(%)的影响
并非所有在其上进行糖化血红蛋白测定的临床化学分析仪都具有884nm处的滤光片;因此,本文所述的糖化血红蛋白测定包括重新计算thb和chb测试波长连同thb归一化常数,以允许在其他分析仪(诸如但不限于atellicach模块,siemenshealthineers,tarrytown,ny)上执行。该糖化血红蛋白测定使用的a1c测试波长保持相同,在658/805nm处。本文的测定中使用的thb测试波长为478/694nm,并且本文的测定中使用的chb测试波长为805nm。
以下方案描述了用于优化本公开的糖化血红蛋白测定的参数的过程。
在多项可行性研究中使用值为5.0、6.5、8.0和12.0%hba1c的全血医疗决策合并物(wholebloodmedicaldecisionpools)。这些样品如下制备。收集新鲜的现场抽取样品并掺以高bbi材料(血红蛋白a1chba1c,skup186-0b;bbisolutions,crumlin,uk)以获得上面提及的目标%hba1c值。在tosohg8hplc分析仪(tosohbioscience,inc.,southsanfrancisco,ca;sn13523607)上对样品进行赋值。将样品移取为0.5ml等分试样并冷冻。
使用线性回归来评估英脱利匹特对新波长处的thb浓度的影响。将2ml冰冻全血mdp(医学决策点)样品(值为6.5%hba1c)解冻并轻轻倒置近似一小时。将50μl的20,000mg/dl的英脱利匹特掺入950μl解冻的mdp,总计一(1)ml全血样品,其中最终英脱利匹特浓度为1000mg/dl。将混合物倒置近似30分钟以确保均匀。然后,使用图7中说明的稀释示意图,创建五种独特的英脱利匹特浓度渐增(0mg/dl、250mg/dl、500mg/dl、750mg/dl和1000mg/dl)的全血样品。然后在atellicach模块上以3次重复测试每个水平。然后绘制数据并经由线性回归分析找到斜率和y-截距。
如图8中所示,经由线性回归建立方程y=0.7899x–4.7676,并且其斜率用于开发新的浊度归一化方程。
使用线性回归来评估thb浓度和805nm处的吸光度的关系。从供体部位抽取总共10ml人全血,制成溶血裂解物。使edta管静置冷藏>4小时,并且细胞和血浆自然分离。从每个管移取血浆并转移至分开的容器中。然后将红细胞以2000g离心10分钟以压积细胞,并弃去上清液。压积的细胞用盐水洗涤并再次离心3次,每次洗涤之间弃去上清液。洗涤的细胞在-70℃下冷冻过夜,并且第二天解冻用于测试。遵循图9中所示的稀释示意图,产生血浆和浓缩的溶血裂解物(≥250μmol/lthb)的等距稀释液,总共六个独特的thb浓度渐增的样品。atellica稀释探针无法吸取第五和最高水平(≥250μmol/lthb),这提醒粘度样品δ标志;因此,使用水平4和5制成4.5水平。然后在atellicach分析仪上以3次重复测试每个水平。然后绘制数据并找到斜率和y-截距。
如图10中所示,经由线性回归建立方程y=0.0326x+1.2168,并且其斜率用于开发新的浊度归一化方程。
使用来自两次实验的斜率0.7899和0.0326,归一化方程用公式表示,如下所示:
归一化thb_e根据方程[1]计算:
[1]thb_enorm=thb_enot-norm–thb_e浊度
其中thb_enorm是归一化后的总血红蛋白(μmol/l);thb_enot-norm是归一化前的总血红蛋白(μmol/l);并且thb_e浊度是对thb_e的浊度贡献(μmol/l)。
thb_e浊度根据方程[2a]计算。在方程[2a]中,805nm处的吸光度(chb)用于确定由于测定读取波长(478nm)处的浊度导致的等效thb贡献。方程的第二部分(thb_enot-normx0.0326)负责884nm处的真实血红蛋白贡献,并且必须将其减去以确定对thb_e的真实浊度贡献。
0.7899和0.0326因子是凭经验推导的。0.7899是相比于805nm处的吸光度(abs805nm),浊度渐增的样品(使用英脱利匹特来掺加全血,以模拟脂血样品条件)中在478nm处测量的总血红蛋白(thb_enotnorm)的变化的线性回归的斜率。0.0326是884nm处的吸光度相比于渐增的血红蛋白浓度的斜率。
[2a]thb_e浊度=
方程[2a]简化为方程[2b]和[2c]。
[2b]thb_e浊度=
[2c]thb_e浊度=
将方程[2c]代回方程[1]得到方程[3a]:
[3a]thb_enorm=
方程[3a]然后简化为[3b]和[3c]:
[3b]thb_enorm=
[3c]thb_enorm=
最终归一化方程:
归一化thb_e=
为了评估波长,将值为6.5%hba1c的2ml冷冻全血mdp样品解冻并轻轻倒置近似一小时。将50μl的20,000mg/dl的英脱利匹特掺入950μl解冻的mdp,总计一(1)ml全血样品,其中最终英脱利匹特浓度为1000mg/dl。将混合物倒置近似30分钟以确保均匀。对照样品(不含英脱利匹特的mdp)和测试样品(英脱利匹特掺加的mdp)在分析仪上以3次重复进行测试。计算并评估以下波长组合的干扰(dobs)和%偏差:(1)a1c-658/805nm和thb-478/805nm,如表iii中所示;(2)a1c-658/694nm和thb-478/694nm,如表iv中所示;(3)a1c-658/694nm和thb-478/805nm,如表v中所示;和(4)a1c-658/805nm和thb-478/694nm,如表vi中所示。a1c的测试波长658/805nm和thb的测试波长478/694nm(表vi)显示最佳性能,且因此被确定为新的测试波长。
表iii:在658/805nm(a1c)和478/805nm(thb)处测量的英脱利匹特掺加的样品
表iv:在658/694nm(a1c)和478/694nm(thb)处测量的英脱利匹特掺加的样品
表v:在658/694nm(a1c)和478/805nm(thb)处测量的英脱利匹特掺加的样品
表vi:在658/805nm(a1c)和478/694nm(thb)处测量的英脱利匹特掺加的样品
所有以下可行性数据在分析期间均采用新的归一化方程。
将值为6.5%和8.0%hba1c的2ml冷冻全血mdp样品解冻并轻轻倒置近似一小时。将50μl的20,000mg/dl的英脱利匹特掺入950μl解冻的6.5%mdp,以在一(1)ml全血中达到1000mg/dl的英脱利匹特最终浓度。将50μl的20,000mg/dl的英脱利匹特掺入950μl解冻的8.0%mdp,以在一(1)ml全血中达到1000mg/dl的英脱利匹特最终浓度。将混合物倒置近似30分钟以确保均匀。然后使用图11中说明的稀释示意图,为两种水平的mdp创建五个独特的英脱利匹特浓度渐增(0mg/dl、250mg/dl、500mg/dl、750mg/dl和1000mg/dl)的全血样品。然后在atellicach分析仪上以三份重复测试每个水平,并且计算平均值和%偏差,如表vii和表viii中所示。
表vii:没有归一化的英脱利匹特干扰和剂量响应
表viii:进行归一化的英脱利匹特干扰和剂量响应
如可见,英脱利匹特干扰在本公开的新糖化血红蛋白测定中没有影响,并且当在目标英脱利匹特浓度(1000mg/dl)下测量时,所得的%偏差低于指定目标|+/-5%|。
因此,根据本公开,已经提供了完全满足上文所述的目的和优点的组合物及其生产和使用方法。尽管已经结合上文阐述的具体附图、实验、结果和语言描述了本公开,但显然,许多替代、修改和变化对于本领域技术人员将是显而易见的。因此,意欲涵盖落入本公开的精神和广泛范围内的所有此类替代、修改和变化。
- 还没有人留言评论。精彩留言会获得点赞!