一种提高鲸豚脂肪中多氯联苯检测精度的方法及其应用与流程
[0001]
本发明属于海洋污染检测技术领域,具体涉及一种提高鲸豚脂肪中多氯联苯检测精度的方法及其应用。
背景技术:
[0002]
多氯联苯(polychlorinated biphenyls,pcb)是一种典型的持久性有机污染物,广泛分布在水、大气、土壤、底泥、生物体等环境介质中,对人体有较强的“三致作用”,曾被作为热交换剂、润滑剂、变压器和电容器内的绝缘介质、增塑剂、石蜡扩充剂、粘合剂、有机稀释剂、除尘剂、切割油以及无碳复写纸等重要的化工产品,广泛应用于电力、塑料加工、化工和印刷等领域,给人类健康和生态环境构成巨大威胁。目前,国内外主要采用索氏提取、振荡萃取、加速溶剂萃取、超声波萃取、搅拌棒吸附萃取、分散液液微萃取、quechers等萃取技术,结合浓硫酸磺化净化、层析柱净化(佛罗里硅土、硅胶、氧化铝、活性炭等)、固相萃取、凝胶渗透色谱、冷冻脱脂、(磁性)分散固相萃取等一种或两种净化方法,再采用气相色谱电子捕获检测法、气相色谱质谱法、气相色谱串联质谱法等技术进行海产品中多氯联苯的检测。
[0003]
尽管多氯联苯已停止使用多年,但由于其持久性和疏水性等特性导致其在环境中残留并积累,并可通过生物富集和生物放大进入水生生物体。
[0004]
鲸豚类为生活在海洋中的高级哺乳动物,有着活动范围广、寿命长、脂肪含量高等特点,但由于处在海洋食物链的顶端,食物来源和生理构造方面与人类相似,随着生物富集作用,极易在体内富集较高浓度的多氯联苯,被认为是衡量海洋环境及人类健康的重要指示物种,可以用来作为研究多氯联苯的生物载体。因此,分析测定鲸豚脂肪中多氯联的含量在一定程度上可较好地反映海洋环境中多氯联苯的污染情况。
[0005]
鲸豚脂肪样本基体复杂,含有游离脂肪酸、甾醇、色素及亲脂性有机污染物等多种物质,因此,前处理及净化步骤为分析鲸豚脂肪样品中多氯联苯的关键。然而,由于多氯联苯为一种亲脂性污染物,现有方法很难将鲸豚脂肪样本基体中的其它脂溶性污染物除去,当现有的多氯联苯检测方法在鲸豚脂肪中应用时,普遍存在的效率低、干扰因素多的问题,导致检测结果精度低,灵敏度和重现性差。
技术实现要素:
[0006]
为了克服上述现有技术的不足,本发明提出了一种提高鲸豚脂肪中多氯联苯检测精度的方法,从而改善鲸豚脂肪中多氯联苯检测存在的效率低、干扰因素多的问题,使检测方法简单高效、精密度和灵敏度高、回收率及重现性好。
[0007]
为了实现上述目的,本发明所采用的技术方案是:
[0008]
本发明提供一种提高鲸豚脂肪中多氯联苯检测精度的方法,即在对鲸豚脂肪样品中的多氯联苯进行检测前,进行以下样品预处理:
[0009]
s1、对鲸豚脂肪样品进行充分碾磨;
[0010]
s2、以二氯甲烷/正己烷混合溶剂对步骤s1的鲸豚脂肪样品进行索氏抽提;
[0011]
索氏抽提法是利用溶剂回流和虹吸原理从固体物质中高效萃取化合物的一种方法。当提取器中回流下的溶剂液面超过虹吸管时,提取器中溶剂流回蒸馏瓶内,即发生虹吸。随着温度的升高,再次回流开始,每次虹吸前,固体物质都能被纯的热溶剂所萃取。利用脂肪能溶于有机溶剂的特性,在索氏抽提器中利用有机溶剂可将复杂鲸脂中的脂肪及类脂肪物质,如游离脂肪酸、甾醇、磷脂、蜡、色素以及亲脂性有机污染物等充分提取出来。
[0012]
s3、对步骤s2的抽提液进行浓缩,用正已烷定容,定容后进行二次浓缩,备用;
[0013]
s4、将步骤s3的浓缩液过gpc柱洗脱,洗脱至除尽脂肪;
[0014]
脂肪会对仪器分析产生干扰。凝胶色谱柱层析(gpc)是一种利用被分离物质分子大小不同及固定相(凝胶)具有分子筛的特点,将被分离物质各成分按分子大小分开,达到分离目的样品的前处理技术。gpc层析柱中的填料是某些惰性的多孔网状结构物质,它不具有吸附、分配和离子交换作用。让被测量的高聚物溶液通过一根内装不同孔径的色谱柱,柱中可供分子通行的路径有粒子间的间隙(较大)和粒子内的通孔(较小)。当聚合物溶液流经色谱柱(凝胶颗粒)时,较大的分子(体积大于凝胶孔隙)被排除在粒子的小孔之外,只能从粒子间的间隙通过,速率较快;而较小的分子可以进入粒子中的小孔,通过的速率要慢得多;中等体积的分子可以渗入较大的孔隙中,但受到较小孔隙的排阻,介乎上述两种情况之间。经过一定长度的色谱柱,分子根据相对分子质量被分开,相对分子质量大的在前面(即淋洗时间短),相对分子质量小的在后面(即淋洗时间长)。自试样进柱到被淋洗出来,所接受到的淋出液总体积称为该试样的淋出体积。当仪器和实验条件确定后,溶质的淋出体积与其分子量有关,分子量愈大,其淋出体积愈小。
[0015]
本发明通过聚苯乙烯凝胶色谱柱层析(gpc)可以除去鲸脂中的脂肪、蛋白质等大分子干扰物质,从而收集生物样品中的目标小分子有机污染物。
[0016]
s5、将步骤s4的洗脱液经浓缩后过酸性硅胶柱洗脱,收集得到待测目标化合物。
[0017]
样品基质中的糖类,苷类和氨基酸等强极性物质会对分析造成干扰。硅胶层析是根据物质在硅胶上的吸附力不同,通过吸附、解吸、再吸附、再解吸过程而使物质分离。一般情况下极性较大的物质易被硅胶吸附,极性较弱的物质不易被硅胶吸附。本发明通过酸性硅胶柱可以按照物质极性从小到大进行分离,从而可将鲸脂中的糖类,苷类和氨基酸等大极性物质除去,得到纯的目标极性污染物(多氯联苯)。
[0018]
优选地,步骤s2所述二氯甲烷与正己烷的体积比为(2-4):1。进一步地,所述二氯甲烷与正己烷的体积比为3:1。
[0019]
优选地,步骤s2所述索氏抽提的时间不少于48h。
[0020]
优选地,步骤s2所述的二氯甲烷/正己烷混合溶剂与鲸豚脂肪样品的料液比(ml/g)为(500-1000):1。进一步地,所述二氯甲烷/正己烷混合溶剂与鲸豚脂肪样品的料液比(ml/g)为2000:3。
[0021]
优选地,步骤s1所述鲸豚脂肪样品的取样量为0.2g-0.4g。进一步地,所述鲸豚脂肪样品的取样量为0.3g。
[0022]
优选地,步骤s3的具体操作为:先浓缩至0.5-1.5ml,用正已烷定容至8-12ml,再浓缩至1-3ml。进一步地,先浓缩至1ml,用正已烷定容至10ml,再浓缩至2ml。
[0023]
优选地,步骤s4所述的过gpc柱洗脱采用的柱子规格为50cm
×
2.5cm i.d.玻璃柱,
活塞为聚四氟乙烯材质。
[0024]
优选地,步骤s5所述的过酸性硅胶柱洗脱采用的柱子规格为400mm
×
10mm i.d.玻璃柱,活塞为聚四氟乙烯材质。
[0025]
优选地,步骤s4所述洗脱至除尽脂肪的方法为:采用150ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]淋洗柱子,待液面与凝胶顶面相平时加入上一步骤的浓缩液。用少许正己烷清洗装样品的容器,待gpc柱的液面与凝胶顶面相平时加入90ml洗脱液[dcm:hex=1:1(v/v)],待液面与凝胶顶面相平时再加入190ml混合溶剂洗脱并收集洗脱液,洗脱液旋转蒸发至约1ml,至此脂肪已基本除尽。
[0026]
优选地,步骤s5所述的过酸性硅胶柱所采用的洗脱介质为中性硅胶、酸性硅胶和无水硫酸钠,所述中性硅胶、酸性硅胶、无水硫酸钠的质量比为(7-9):(7-9):(1-3)。
[0027]
本发明还提供了一种鲸豚脂肪中多氯联苯的检测方法,即先采用上述的方法将鲸豚脂肪样品处理成待测目标化合物,在对待测目标化合物进行gc-ms/ms(气相色谱-串联质谱)分析。
[0028]
当然,以本发明方法处理得到的待测目标化合物,除了采用上述的gc-ms/ms分析方法进行多氯联苯检测外,现有的其他多氯联苯检测方法也可以用来对本发明的待测目标化合物进行检测。
[0029]
与现有技术相比,本发明的有益效果是:
[0030]
本发明提供一种提高鲸豚脂肪中多氯联苯检测精度的方法,在对鲸豚脂肪样品中的多氯联苯进行检测前,先以二氯甲烷/正己烷混合溶剂对鲸豚脂肪样品进行索氏抽提,抽提液用正已烷定容浓缩后,再相继进行过gpc柱洗脱和酸性硅胶柱洗脱,最后得到待测目标化合物,采用由上述方法得到的待测目标化合物,以现有的多氯联苯检测方法(比如gc-ms/ms分析)对鲸豚脂肪中的多氯联苯进行检测,可以有效改善鲸豚脂肪中多氯联苯检测存在的效率低、干扰因素多的问题,使检测方法简单高效、精密度和灵敏度高、回收率及重现性好。
具体实施方式
[0031]
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
[0032]
下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的试验材料,如无特殊说明,均为可通过常规的商业途径购买得到的。
[0033]
实施例1一种提高鲸豚脂肪中多氯联苯检测精度的方法
[0034]
在对鲸豚脂肪样品中的多氯联苯进行检测前,进行以下样品预处理:
[0035]
(1)取样:鲸豚(中华白海豚)脂肪样本解冻后,取0.3g左右于研钵中,加入2g无水硫酸钠充分碾磨,转移至滤纸筒中,加入5ng 13
c-pcb141标记回收率指示物(
13
c-pcb141和本实施例测定的pcbs性质相似,用来表征整个前处理过程的损失或回收率)。
[0036]
(2)抽提:在烧瓶中加入200ml二氯甲烷(dcm)/正己烷(hex)混合溶剂[dcm:hex=3:1(v/v)],索氏抽提48h。
[0037]
(3)溶剂转换:将步骤(2)得到的抽提液旋转蒸发至约1ml,转移至带刻度的玻璃离
心管中,用正已烷定容到10ml,并浓缩至2ml,待过凝胶层析色谱柱(gpc)。
[0038]
(4)过gpc柱:采用柱子规格为50cm
×
2.5cm i.d.玻璃柱,活塞为聚四氟乙烯(teflon)材质。柱子使用前用酸洗,大量自来水冲洗和蒸馏水淋洗。烘干后用丙酮、二氯甲烷和正己烷依次淋洗。准确称取40g sx-3“bio-beads”(200-400目)凝胶树脂置于500ml平底烧瓶内,用6倍于凝胶质量的dcm/hex混合溶剂[dcm:hex=1:1(v/v)]浸泡72h使其充分溶胀。然后进行湿法装柱,在柱子底部塞好棉花,用滴管小心将凝胶匀浆完全转移至色谱柱,装柱过程保持溶剂流动,利用重力使凝胶匀浆自然沉降,注意不能有气泡。柱子装好后,用300ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]淋洗,淋洗速度控制在3ml/min左右,不超过5ml/min为宜。
[0039]
采用150ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]淋洗柱子,待液面与凝胶顶面相平时加入步骤(3)得到的浓缩液。用少许正己烷清洗装样品的容器,待gpc柱的液面与凝胶顶面相平时加入90ml洗脱液[dcm:hex=1:1(v/v)],待液面与凝胶顶面相平时再加入190ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]洗脱并收集洗脱液,洗脱液旋转蒸发至约1ml,至此脂肪已基本除尽。
[0040]
(5)过酸性硅胶柱:采用柱子规格为400mm
×
10mm i.d.玻璃柱,活塞为teflon材质。柱子使用前用铬酸清洗,大量自来水冲洗和蒸馏水淋洗。烘干后用丙酮、二氯甲烷和正己烷依次淋洗。在柱子底部塞好脱脂棉,采用湿法装柱[方法同步骤(4)]。
[0041]
将步骤(4)得到的洗脱液浓缩至1ml的样品,通过酸性硅胶柱(中性硅胶、酸性硅胶、无水硫酸钠的质量比为8:8:2,从下往上依次为1cm棉花、8cm中性硅胶、8cm酸性硅胶、2cm无水硫酸钠),用35ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]洗脱,收集得到待测目标化合物(洗脱液)。
[0042]
其中,中性硅胶(80-100目)的前处理为:用二氯甲烷抽提72h,通风橱内风干后,放入烘箱中于180
±
2℃下烘12h。冷至室温后加入3%的蒸馏水(水:硅胶=3:100,w/w)去活化,放置于干燥器中平衡12h后得中性硅胶,于正己烷中密封保存;酸性硅胶的前处理为:用上述中性硅胶,加入浓硫酸(分析纯,ar)(56:44,w/w)混匀后,置干燥器内平衡过夜后加入正己烷使用;无水硫酸钠(ar)的前处理为:600℃下灼烧4h,冷却后于干燥器中保存。
[0043]
实施例2一种提高鲸豚脂肪中多氯联苯检测精度的方法
[0044]
在对鲸豚脂肪样品中的多氯联苯进行检测前,进行以下样品预处理:
[0045]
(1)取样:鲸豚(中华白海豚)脂肪样本解冻后,取0.2g左右于研钵中,加入2g无水硫酸钠充分碾磨,转移至滤纸筒中,加入5ng 13
c-pcb141标记回收率指示物。
[0046]
(2)抽提:在烧瓶中加入200ml二氯甲烷(dcm)/正己烷(hex)混合溶剂[dcm:hex=2:1(v/v)],索氏抽提50h。
[0047]
(3)溶剂转换:将步骤(2)得到的抽提液旋转蒸发至约0.5ml,转移至带刻度的玻璃离心管中,用正已烷定容到8ml,并浓缩至1ml,待过凝胶层析色谱柱(gpc)。
[0048]
(4)过gpc柱:采用柱子规格为50cm
×
2.5cm i.d.玻璃柱,活塞为聚四氟乙烯(teflon)材质。柱子使用前用酸洗,大量自来水冲洗和蒸馏水淋洗。烘干后用丙酮、二氯甲烷和正己烷依次淋洗。准确称取40g sx-3“bio-beads”(200-400目)凝胶树脂置于500ml平底烧瓶内,用6倍于凝胶质量的dcm/hex混合溶剂[dcm:hex=1:1(v/v)]浸泡72h使其充分溶胀。然后进行湿法装柱,在柱子底部塞好棉花,用滴管小心将凝胶匀浆完全转移至色谱柱,
装柱过程保持溶剂流动,利用重力使凝胶匀浆自然沉降,注意不能有气泡。柱子装好后,用300ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]淋洗,淋洗速度控制在3ml/min左右,不超过5ml/min为宜。
[0049]
采用150ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]淋洗柱子,待液面与凝胶顶面相平时加入步骤(3)得到的浓缩液。用少许正己烷清洗装样品的容器,待gpc柱的液面与凝胶顶面相平时加入90ml洗脱液[dcm:hex=1:1(v/v)],待液面与凝胶顶面相平时再加入190ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]洗脱并收集洗脱液,洗脱液旋转蒸发至约1ml,至此脂肪已基本除尽。
[0050]
(5)过酸性硅胶柱:采用柱子规格为400mm
×
10mm i.d.玻璃柱,活塞为teflon材质。柱子使用前用铬酸清洗,大量自来水冲洗和蒸馏水淋洗。烘干后用丙酮、二氯甲烷和正己烷依次淋洗。在柱子底部塞好脱脂棉,采用湿法装柱[方法同步骤(4)]。
[0051]
将步骤(4)得到的洗脱液浓缩至1ml的样品,通过酸性硅胶柱(中性硅胶、酸性硅胶、无水硫酸钠的质量比为7:7:1,从下往上依次为1cm棉花、7cm中性硅胶、7cm酸性硅胶、1cm无水硫酸钠),用35ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]洗脱,收集得到待测目标化合物(洗脱液)。
[0052]
其中,中性硅胶、酸性硅胶、无水硫酸钠的前处理同实施例1。
[0053]
实施例3一种提高鲸豚脂肪中多氯联苯检测精度的方法
[0054]
在对鲸豚脂肪样品中的多氯联苯进行检测前,进行以下样品预处理:
[0055]
(1)取样:鲸豚(中华白海豚)脂肪样本解冻后,取0.3g左右于研钵中,加入2g无水硫酸钠充分碾磨,转移至滤纸筒中,加入5ng 13
c-pcb141标记回收率指示物。
[0056]
(2)抽提:在烧瓶中加入150ml二氯甲烷(dcm)/正己烷(hex)混合溶剂[dcm:hex=4:1(v/v)],索氏抽提50h。
[0057]
(3)溶剂转换:将步骤(2)得到的抽提液旋转蒸发至约1.5ml,转移至带刻度的玻璃离心管中,用正已烷定容到12ml,并浓缩至3ml,待过凝胶层析色谱柱(gpc)。
[0058]
(4)过gpc柱:采用柱子规格为50cm
×
2.5cm i.d.玻璃柱,活塞为聚四氟乙烯(teflon)材质。柱子使用前用酸洗,大量自来水冲洗和蒸馏水淋洗。烘干后用丙酮、二氯甲烷和正己烷依次淋洗。准确称取40g sx-3“bio-beads”(200-400目)凝胶树脂置于500ml平底烧瓶内,用6倍于凝胶质量的dcm/hex混合溶剂[dcm:hex=1:1(v/v)]浸泡72h使其充分溶胀。然后进行湿法装柱,在柱子底部塞好棉花,用滴管小心将凝胶匀浆完全转移至色谱柱,装柱过程保持溶剂流动,利用重力使凝胶匀浆自然沉降,注意不能有气泡。柱子装好后,用300ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]淋洗,淋洗速度控制在3ml/min左右,不超过5ml/min为宜。
[0059]
采用150ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]淋洗柱子,待液面与凝胶顶面相平时加入步骤(3)得到的浓缩液。用少许正己烷清洗装样品的容器,待gpc柱的液面与凝胶顶面相平时加入90ml洗脱液[dcm:hex=1:1(v/v)],待液面与凝胶顶面相平时再加入190ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]洗脱并收集洗脱液,洗脱液旋转蒸发至约1ml,至此脂肪已基本除尽。
[0060]
(5)过酸性硅胶柱:采用柱子规格为400mm
×
10mm i.d.玻璃柱,活塞为teflon材质。柱子使用前用铬酸清洗,大量自来水冲洗和蒸馏水淋洗。烘干后用丙酮、二氯甲烷和正
己烷依次淋洗。在柱子底部塞好脱脂棉,采用湿法装柱[方法同步骤(4)]。
[0061]
将步骤(4)得到的洗脱液浓缩至1ml的样品,通过酸性硅胶柱(中性硅胶、酸性硅胶、无水硫酸钠的质量比为9:9:3,从下往上依次为1cm棉花、9cm中性硅胶、9cm酸性硅胶、3cm无水硫酸钠),用35ml dcm/hex混合溶剂[dcm:hex=1:1(v/v)]洗脱,收集得到待测目标化合物(洗脱液)。
[0062]
其中,中性硅胶、酸性硅胶、无水硫酸钠的前处理同实施例1。
[0063]
实施例4一种鲸豚脂肪中多氯联苯的检测方法
[0064]
(1)氮吹定容:将按实施例1方法处理得到的待测目标化合物(洗脱液)旋蒸至约剩余1ml左右,氮吹至50μl左右(将剩余污染物转至细胞瓶,将烧瓶用二氯甲烷清洗一次,正己烷清洗两次,如此反复3次,边氮吹,边加入试剂,每次均氮吹至50μl左右),然后加入上机指示物5μl 13
c-pcb138,180,和208(本实施例使用内标法,上机指示物
13
c-pcb138,180,和208用于定量目标物pcbs),使用异辛烷定容至100μl,待上机测试。
[0065]
(2)gc-ms/ms分析:氮吹并加回收率指示物、异辛烷定容后,对pcbs采用gc-ms/ms进行分析。
[0066]
(3)色谱参数和条件
[0067]
进样口温度为280℃;传输线温度为300℃,离子源温度为300℃;载气为体积含量99.999﹪的高纯氦气,流速为1ml/min;进样体积为1μl;进样方式为不分流进样;气相色谱柱升温程序为:60℃保持1min,20℃/min升温至200℃,再以10℃/min升温至300℃,保持5min,总运行时间为23min;所述气相色谱柱为db-xlb毛细管气相色谱柱(30m
×
0.25mm
×
0.25μm,j&w scientific),固定相为二苯基与二甲基聚硅氧烷的混合液,其中二苯基的质量分数为5%,二甲基聚硅氧烷的质量分数为95%。
[0068]
(4)绘制标准曲线(以保留时间定性,内标定量)
[0069]
保留时间定性时,将标准溶液按照仪器的操作方法进行操作得到标准溶液的总离子流图(tic图),并根据待测物的离子信息(nist库查询)及对应化合物的出峰顺序,确定7种多氯联苯(pcb28、pcb52、pcb101、pcb153、pcb138、pcb180和
13
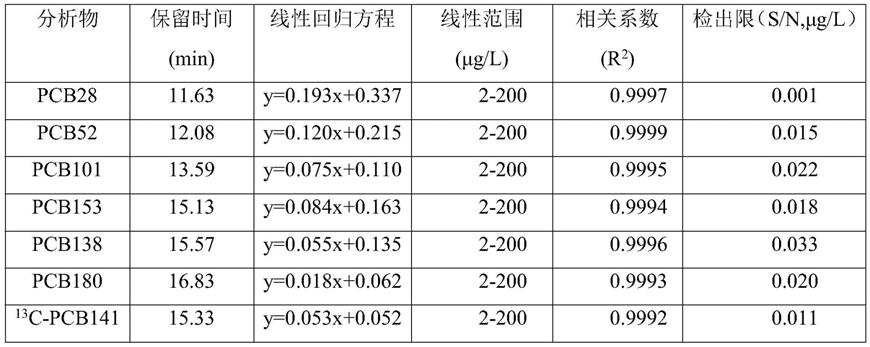
c-pcb141)的保留时间;所述7种多氯联苯的保留时间用内标法定量时,作为这7种多氯联苯色谱峰识别的依据;溶剂为异辛烷,浓度范围均为2.0-200μg/l,具体浓度为2、5、20、50、100和200μg/l。将七种不同加标浓度的标准曲线系列溶液,根据加入的多氯联苯浓度和峰面积的对应关系建立标准曲线(表1)。
[0070]
根据表1可知,采用本发明的多氯联苯检测方法,其检出限为0.001-0.033μg/l,检测灵敏度高。
[0071]
表1本发明方法的线性回归、线性范围、相关系数和检出限
[0072][0073]
(5)样品及回收率测定
[0074]
将鲸豚脂肪样本按照实施例1的方法进行处理,然后进行gc-ms/ms分析,样品分析过程中设置方法空白、空白加标和基质加标,保证数据的准确性和可靠性。同时对每个样品添加回收率指示物。在进行仪器分析时,每天进一个固定浓度的日校正标样,确保仪器运行稳定,最后统计回收率/%(表2)。
[0075]
根据表2可知,加标鲸豚脂肪样品的回收率为81.8%-103%,精密度(rsd,n=10)为3.16%-5.14%,满足分析方法对回收率和重新性要求。
[0076]
表2鲸豚样品中多氯联苯不同浓度水平的加标回收实验结果(n=10)
[0077][0078]
以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1