一种基于DNA-CuNMs的荧光检测复杂基质中Pb2+的方法
本发明涉及一种基于dna-cunms的荧光检测复杂基质中pb2+的方法,属于分析化学、材料学、纳米生物传感等领域。
背景技术:
铅离子(pb2+)造成的环境污染已经引起世界范围的关注。在长期摄入pb2+后,会对机体的血液系统、神经系统产生严重的损害,特别是会对儿童造成严重的智力损伤。目前,已经开发出许多用于测定痕量pb2+的方法,例如原子吸收光谱测定法、电感耦合等离子质谱法及共振光散射光谱法等。这些方法都需要昂贵的仪器设备,专业的技术操作人员和复杂的样品前处理等,因此特别需要一种检测灵敏度高,操作简单,检测成本低的方法。目前,荧光检测法因为简单高效的优点引起了极大的关注。其中,基于金属纳米颗粒的荧光测定法因其制备成本低和不需要复杂的仪器设备来检测重金属而受到了越来越多的关注。
chen等人利用dna作为模板制备的铜纳米材料(cunms)作为荧光探针,开发了高选择性、高灵敏度的pb2+检测方法(chen,j.;liu,j.;fang,z.;zeng,l.randomdsdna-templatedformationofcoppernanoparticlesasnovelfluorescenceprobesforlabel-freeleadionsdetection.chem.commun.2012,48,1057-1059)。其原理为,pb2+离子可以通过5d10(pb2+)-3d10(cu+)的亲金属相互作用与dna-cunms表面上的cu+反应,从而导致dna-cunms荧光淬灭。尽管结果很好,但此方法制备的dna-铜纳米材料(dna-cunms)只能在几小时内保持稳定,且没有实现在生物基质中应用。目前,制备出在复杂生物基质(如血清、细胞裂解物)中具有良好稳定性的高荧光dna-cunms仍然具有很大的挑战性。由于单链和双链dna在生物基质中容易降解,dna模板的破坏也将降低这些dna-cunms的稳定性和应用的可重复性。因此,制备高稳定性的荧光dna-cunms对于其在复杂基质中传感应用具有重要意义。
技术实现要素:
[技术问题]
单链和双链dna在生物基质中容易降解,导致现有的dna-铜纳米材料在复杂基质中的稳定性差、可重复使用性不佳。
[技术方案]
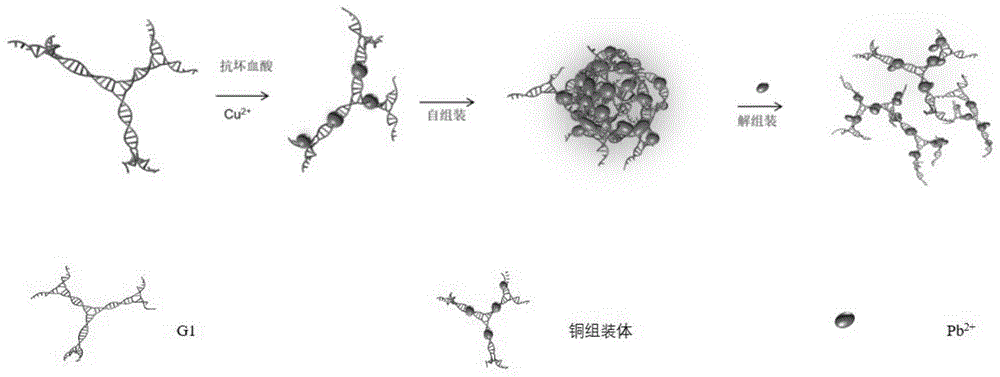
本发明提供一种基于dna-cunms的荧光检测复杂基质中pb2+的方法,所述复杂基质包括血清和细胞裂解物,检测原理为:采用树枝状dna大分子-cunms作为pb2+的荧光检测探针,pb2+离子可以通过5d10(pb2+)-3d10(cu+)的亲金属相互作用与树枝状dna大分子-cunms表面上的cu+反应,将树枝状dna大分子-cunms分解为尺寸更小的dna-cunms,破坏了树枝状dna大分子-cunms的聚集诱导荧光增强(aiee)作用。该树枝状dna大分子-cunms在血清中具有良好的稳定性,可实现血清生物基质中pb2+的定量检测。
具体地,
本发明提供了一种树枝状dna大分子-cunms,制备方法为:
(1)将三条等量的寡核苷酸链(分别命名为:y0a、y0b、y0c)在mops缓冲液(10mm,ph7.5,150mmnaac,1mmmgcl2)中混合得到混合溶液;然后,将混合溶液加热至90℃,慢慢冷却至4℃,将退火后的样品在室温下孵育30min,以获得y型dna构建块(命名为y0),y0有粘性末端;
(2)将另外三条等量的寡核苷酸链(分别命名为:y1a、y1b、y1c)通过(1)的步骤制备了另一种y型dna构建块(命名为y1),y1具有三个双臂,有或没有粘性末端;
(3)将y0和y1分别命名为y0-stex和y1-stex,其中x表示碱基数,y0-stex和y1-stex可以通过碱基互补配对,将y0-stex和y1-stex按照1比3的浓度比例杂交得到树枝状dna大分子(命名为g1);然后,将树枝状dna大分子(g1,500μl,500nm)与抗坏血酸(500μl,1.25mm)混合,立即加入cu(ac)2(200μl,500nm),将上述溶液孵育20min,完成树枝状dna大分子-cunms的制备。
本发明还提供了利用树枝状dna大分子-cunms的荧光检测pb2+的方法,包括以下步骤:
(1)pb2+标准溶液的准备:
pb2+标准溶液用mops缓冲液(10mm,ph7.5,150mmnaac,1mmmgcl2)分别稀释至2、10、20、40、60、80、100nm。用mops缓冲液(10mm,ph7.5,150mmnaac,1mmmgcl2)将制备的dna-cunms稀释至62.5nm。
(2)pb2+荧光检测标准曲线的建立:
将不同浓度的pb2+标准溶液与树枝状dna大分子-cunms溶液混合孵育20min,混合反应后再采用荧光分光光度计进行检测,建立树枝状dna大分子-cunms的荧光淬灭率信号与不同pb2+浓度之间对应关系的标准曲线(2.0-100nm);
(3)通过外标法计算得出待测样品标准溶液中pb2+的含量。
在本发明的一种实施方式中,所述缓冲溶液为mops缓冲液。所选择的mops缓冲液浓度为1-20mmmops,15-300mmnaac,0.1-2mmmgcl2,ph为7.5-8.0。
在本发明的一种实施方式中,荧光检测条件为:激发宽带为20nm,狭缝宽度为20nm,激发波长为340nm,检测590nm发射峰值处荧光值。
在本发明的一种实施方式中,所选择树枝状dna大分子-cunms溶液的浓度为30-600nm。
本发明还提供利用树枝状dna大分子-cunms的荧光检测血清中pb2+的方法,包括将血清过滤、与树枝状dna大分子-cunms混合孵育、对混合液进行荧光测试等步骤。
在本发明的一种实施方式中,可以利用血清模拟样品来测试回收率,步骤为:
(1)树枝状dna大分子-cunms溶液预处理:将制备的树枝状dna大分子-cunms用mops缓冲液(10mm,ph7.5,150mmnaac,1mmmgcl2)稀释至适当浓度,存储于4℃,在黑暗中进行接下来的实验;
(2)样品预处理:在血清中加入不同浓度的pb2+(0.1、0.4、1.6mm),添加pb2+后的血清样本稀释20倍后,0.22μm微孔滤膜过滤;
(3)血清中pb2+的回收率测定:980μl树枝状dna大分子-cunms(62.5nm)与20μl含不同浓度pb2+的血清混合孵育10min,混合反应后再采用荧光分光光度计进行检测。
[有益效果]
(1)本文发明制备了高荧光和高稳定性的树枝状dna大分子-cunms。首次以粘性末端支状dna大分子为模板制备了cunms,该cunms对pb2+检测反应灵敏(检测限为0.75nm)、快速(一步反应、10min)、在血清等复杂生物基质中有良好的稳定性。
(2)本发明所提出的检测方法实现了pb2+的高灵敏荧光检测。在2.0-100nm的浓度范围内,f0/f和pb2+的浓度呈现良好的线性关系。线性范围为2.0-100nm,检出限为0.75nm。检测限(lod)明显低于美国环境保护署(epa)饮用水中pb2+的最高推荐浓度(72nm)。
(3)本发明所合成的荧光探针树枝状dna大分子-cunms在血清复杂基质中具有高稳定性。研究发现树枝状dna大分子-cunms与血清一起保存6d后荧光强度变化不大。然而,dsdna模板化的cunms仅维持稳定4h,1d后仅保留24%的荧光强度。
(4)本发明构建的基于树枝状dna大分子-cunms的荧光检测方法对pb2+检测具有高选择性。本发明检测了树枝状dna大分子-cunms对各种重金属离子的响应。在pb2+添加浓度为0.3μm和其它常见有重金属离子的添加浓度为3μm时,pb2+对于树枝状dna大分子-cunms的荧光淬灭率在80%,其他重金属离子的荧光淬灭率均低于5%。
(5)本发明构建的基于树枝状dna大分子-cunms的荧光检测pb2+方法有望进一步应用于适配体生物传感(如将上述树枝状dna大分子-cunms的粘性末端设计为适配体序列)和细胞成像(如直接将上述树枝状dna大分子-cunms与细胞共培养,导入细胞,用于细胞内pb2+的成像)。
(6)本发明方法具有高灵敏、高选择性、高稳定性、检测快速等优势。
附图说明
图1是dna-cunms的制备以及pb2+的检测原理图。
图2是粘性末端含不同碱基数的dna-cunms的tem图;(a)g1-ste0-cunass,(b)g1-ste6-cunass,(c)g1-ste13-cunass,(d)g1-ste20-cunass,(e)g1-ste27-cunass。
图3是不同长度的粘性末端对dna-cunms的荧光光谱变化图。
图4是不同长度的粘性末端对于pb2+淬灭dna-cunms的荧光光谱变化图。
图5是添加不同浓度pb2+的dna-cunms荧光曲线和标准曲线。
图6是树枝状dna-cunms和dsdna-cunms在血清中的稳定性比较图。
图7是dna-cunms对各种重金属离子检测的选择性图。
图8是y0和y1-stex链的示意图。
具体实施方式
实施例一:树枝状dna-cunms的制备方法
参考双链dna为模板合成荧光cunms的方法,利用y形dna结构(y-dna)制备了dna树状大分子,将其作为模板分子制备荧光树枝状dna-cunms。
表1制备树枝状dna大分子-cunms的核酸模板序列
具体的,
将3条不同的寡核苷酸链(y0a,y0b,y0c)等量混合在mops缓冲液中(10mm,ph7.5,150mmnaac,1mmmgcl2)。将混合溶液加热至90℃,慢慢冷却至4℃。退火后的样品在室温下孵育30min,以获得y型dna构建块(y0)。用另外三条不同的寡核苷酸链(y1a-stex,y1b-stex,y1c-stex,x指粘性末端碱基数,分别为0、6、13、20或27)通过类似的步骤制备了另一种y型dna构建块(y1-stex)。所得y0和y1-stex链如图所8示。
y0和y1-stex可以通过碱基互补配对,以1比3的浓度比例杂交得到树枝状dna大分子(命名为g1-stex)。然后,将树枝状dna大分子g1-stex(500μl,500nm)与抗坏血酸(500μl,1.25mm)混合,立即加入cu(ac)2(200μl,500nm)。将上述溶液孵育20min,完成dna-cunms的制备,并在4℃下避光存储。其中,树枝状dna大分子(g1-stex)与抗坏血酸均用mops缓冲液(10mm,ph7.5,150mmnaac,1mmmgcl2)溶解和稀释至所需浓度。cu(ac)2用超纯水(18.2mω.cm)溶解和稀释至所需浓度。
实施例二:不同长度的粘性末端对于pb2+淬灭dna-cunms荧光的影响
应用实施例一的方法制备得到dna-cunms,这些dna-cunms具有不同长度粘性末端的树枝状dna分子(g1-stex,dna核酸单链采用表1中的序列)为模板,其粘性末端长度分别为0、6、13、20、27个碱基,其它条件相同。dna-cunms(g1-stex)用于pb2+荧光淬灭检测的原理图见图1。
1、粘性末端含不同碱基数的dna-cunms的尺寸大小
以含有不同长度粘性末端树枝状dna大分子(g1-stex)为模板,制备得到dna-cunms,其尺寸大小采用透射电镜表征,结果见图2。图2的tem图像显示,大多数尺寸较小的铜纳米簇自组装成较大的铜纳米组装体。随着g1粘性末端碱基数从0增加到6、13、20和27时,dna-cunms的平均大小分别从19nm增加到131nm、160nm、220nm和264nm。此外,在粘性末端引入g1后,cunms表现出更加致密的形态和有序的排列。
2、粘性末端含不同碱基数的dna-cunms的荧光强度
所述荧光检测条件为激发宽带为20nm,狭缝宽度为20nm,激发波长为340nm,检测590nm发射峰值处荧光值。
应用粘性末端含不同碱基数的dna为模板制备得到的dna-cunms的荧光强度结果见图3。随着g1粘性末端长度的增加,cunms的荧光强度逐渐增强。从0个碱基增加到27个碱基时,dna-cunms荧光强度增强近6倍。
3、不同长度的粘性末端对pb2+淬灭dna-cunms荧光的影响
用mops缓冲液(10mm,ph7.5,150mmnaac,1mmmgcl2)将制备的g1-ste13-cunms稀释至62.5nm。980μlcunms(62.5nm)与20μlpb2+(100nm)混合,在室温中孵育20min。
采用荧光光度计进行检测,检测条件为:激发波长为340nm,收集590nm处发射信号。
应用不同长度的粘性末端对pb2+淬灭dna-cunms荧光的影响结果见图4。g1-ste13-cunms对pb2+检测最敏感,因此选取g1-ste13-cunms作为最优。
实施例三:一种应用dna-cunms检测血清中pb2+含量的方法
应用实施例一制备得到的dna-cunms检测血清中pb2+含量,dna-cunms的制备以及pb2+的检测原理图见图1。
1、pb2+标准曲线的建立
(1)pb2+标准溶液的制备:
pb2+标准溶液用mops缓冲液(10mm,ph7.5,150mmnaac,1mmmgcl2)分别稀释至2、10、20、40、60、80、100nm。用mops缓冲液(10mm,ph7.5,150mmnaac,1mmmgcl2)将制备的dna-cunms稀释至62.5nm。980μldna-cunms与20μl不同浓度的pb2+标准溶液混合,在室温中孵育20min。拟合stern-volmer图,f0/f=1+ksv[c],估计上述检测中的淬火常数(ksv);式中,f、f0分别为带pb2+和不带pb2+的荧光,c为pb2+在nm中的浓度;kq是淬火速率常数,τ0为cunms的荧光寿命。将计算后的荧光淬灭率信号带入标准曲线,计算得出检测样品中pb2+的浓度。
(2)荧光光谱检测:
采用荧光光度计进行检测,检测条件为:激发波长为340nm,收集590nm处发射信号。
(3)线性关系、检测限的确定:
dna-cunms添加pb2+后的荧光强度计为f1,dna-cunms不添加pb2+的荧光强度计为f0,绘制标准曲线如图5。该标准曲线为f0/f=0.9905+0.01096c,r2=0.989,ksv=0.01096nm-1。线性范围为2.0-100nm,检出限为0.75nm。
2、检测血清中pb2+含量的方法
(1)样品预处理:在血清中加入不同浓度的pb2+(0.1、0.4、1.6mm)。添加pb2+后的fbs样本稀释20倍后以10000rpm离心10min,取上清液。用mops缓冲液(10mm,ph7.5,150mmnaac,1mmmgcl2)将制备的g1-ste13-cunms稀释至62.5nm。980μlcunms与20μl含不同浓度的pb2+的上清液混合,在室温中孵育20min。
(2)荧光光谱检测:采用荧光光度计进行检测,检测条件为:激发波长为340nm,收集590nm处发射信号。
3、树枝状dna-cunms和dsdna-cunms在血清中的稳定性比较
应用g1-ste13-cunms和dsdna-cunms在血清中比较稳定性。其中,dsdna-cunms以不带粘性末端的dna双链(表一中dsdna-a和dsdna-b杂交)为模板,模板序列如表2,以抗坏血酸为还原剂;500μl体系中包含500nmdsdna,1mm抗坏血酸,100μmcu2+,mops(10mm,ph7.5),naac(150mm)。将上述溶液混合后孵育20min,完成dsdna-cunms的制备(chen,j.;liu,j.;fang,z.;zeng,l.randomdsdna-templatedformationofcoppernanoparticlesasnovelfluorescenceprobesforlabel-freeleadionsdetection.chem.commun.2012,48,1057-1059)。用mops缓冲液(10mm,ph7.5,150mmnaac,1mmmgcl2)将制备的g1-ste13-cunms和dsdna-cunms稀释至500nm。700ul血清中加入100ulg1-ste13-cunms或dsdna-cunms,孵育数天,定时取样,观察荧光变化。
表2制备dsdna-cunms的核酸模板序列
应用dna-cunms检测血清中pb2+含量的稳定性见图6。g1-ste13-cunass与血清一起保存6d后荧光强度变化不大。然而,dsdna-cunms仅维持稳定4h,1d后仅保留24%的荧光强度,在血清等复杂基质中不稳定。
实施例4:方法的准确性和特异性
1、方法的准确性
向血清样品中加入标准pb2+溶液的浓度为分别为5、20和80nm,然后采用g1-ste13-cunms作为探针,每个样品检测3次。测得的pb2+平均浓度分别为4.6、19.3、72.88nm,回收率在91.1%~96.5%之间,相对标准偏差(rsd)值小于4.0%,表明该方法具有较好的准确度和精密度。
2、方法的特异性
考察了常见金属离子对检测的影响,如图7所示。首先,980μlcunms和20μl各种金属离子(al3+、fe3+,ca2+,cd2+,hg2+,cu2+,ni3+,co2+,mg2+,mn2+,zn2+,pb2+)混合。孵育20min后,分析荧光猝灭结果。所有的测量都进行了三次,并且标准偏差被绘制成一个误差棒。结果显示它们不会影响对于pb2+的检测。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种基于dna-cunms的荧光检测复杂基质中pb2+的方法
<130>baa201524a
<160>20
<170>patentinversion3.3
<210>1
<211>39
<212>dna
<213>人工序列
<400>1
gaccgatggatgacctgtctgcctaatgtgcgtcgtaag39
<210>2
<211>39
<212>dna
<213>人工序列
<400>2
gaccgatggatgacttacgacgcacaaggagatcatgag39
<210>3
<211>39
<212>dna
<213>人工序列
<400>3
gaccgatggatgactcatgatctcctttaggcagacagg39
<210>4
<211>26
<212>dna
<213>人工序列
<400>4
cctgtctgactaatgtgcgtcgtaag26
<210>5
<211>26
<212>dna
<213>人工序列
<400>5
cttacgacgcacaaggagatcatgag26
<210>6
<211>39
<212>dna
<213>人工序列
<400>6
tcatccatcggtcctcatgatctcctttagtcagacagg39
<210>7
<211>32
<212>dna
<213>人工序列
<400>7
ctctgacctgtctgactaatgtgcgtcgtaag32
<210>8
<211>32
<212>dna
<213>人工序列
<400>8
ctctgacttacgacgcacaaggagatcatgag32
<210>9
<211>39
<212>dna
<213>人工序列
<400>9
tcatccatcggtcctcatgatctcctttagtcagacagg39
<210>10
<211>39
<212>dna
<213>人工序列
<400>10
gaagccactctgacctgtctgactaatgtgcgtcgtaag39
<210>11
<211>39
<212>dna
<213>人工序列
<400>11
gaagccactctgacttacgacgcacaaggagatcatgag39
<210>12
<211>39
<212>dna
<213>人工序列
<400>12
tcatccatcggtcctcatgatctcctttagtcagacagg39
<210>13
<211>46
<212>dna
<213>人工序列
<400>13
gaagcgggaagccactctgacctgtctgactaatgtgcgtcgtaag46
<210>14
<211>46
<212>dna
<213>人工序列
<400>14
gaagcgggaagccactctgacttacgacgcacaaggagatcatgag46
<210>15
<211>39
<212>dna
<213>人工序列
<400>15
tcatccatcggtcctcatgatctcctttagtcagacagg39
<210>16
<211>53
<212>dna
<213>人工序列
<400>16
gaagcgggaagccaaaagccactctgacctgtctgactaatgtgcgtcgtaag53
<210>17
<211>53
<212>dna
<213>人工序列
<400>17
gaagcgggaagccaaaagccactctgacttacgacgcacaaggagatcatgag53
<210>18
<211>39
<212>dna
<213>人工序列
<400>18
tcatccatcggtcctcatgatctcctttagtcagacagg39
<210>19
<211>25
<212>dna
<213>人工序列
<400>19
agttgcaagaagatgacagagaagt25
<210>20
<211>25
<212>dna
<213>人工序列
<400>20
acttctctgtcatcttcttgcaact25
- 还没有人留言评论。精彩留言会获得点赞!