表征宿主细胞蛋白中酯酶对聚山梨酯降解活性的方法与流程
本申请属于生物医药
技术领域:
,具体涉及一种表征宿主细胞蛋白中酯酶对聚山梨酯降解活性的可定量的方法。
背景技术:
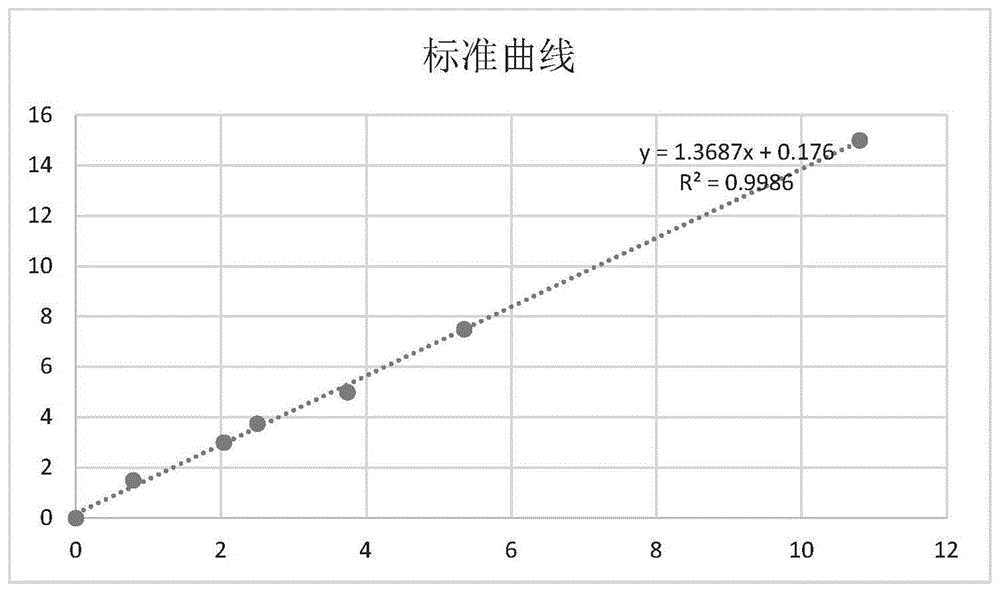
:生物医药技术是当今医药工艺发展的核心力量。以单克隆抗体类药物为典型代表的生物制品是治疗恶性肿瘤、自身免疫病以及阿尔兹海默等疾病的重要药物种类。聚山梨酯例如聚山梨酯20和80是生物制药中最常用的表面活性剂,它们可以改善蛋白质制剂药品的稳定性并在蛋白质制剂药品的长期储存和运输过程中防止蛋白质产生聚集和变性,从而阻止蛋白质制剂药品质量的下降。然而聚山梨酯在一定条件下容易发生水解,则会造成蛋白质发生聚集,引起药品质量的下降。聚山梨酯的水解机理已经被行业广泛的研究,除了酸和碱的诱导水解外,宿主细胞蛋白(hcp)与目标蛋白质共同纯化,并最终残留在蛋白质制剂药品中,是最主要的造成聚山梨酯水解的原因。由于在蛋白质制剂药品的早期开发过程中,用于检测hcp的手段匮乏,造成在蛋白质制剂开发过程中不得不忽略掉hcp对聚山梨酯降解情况影响的研究,结果在蛋白质制剂药品的长期储存和运输过程中,容易引起蛋白质的聚集和变性,在后期的调查和研究中耗费更多的资源用于解决药品质量下降的问题。基于上述的原因,亟需一种能够在蛋白质制剂药品开发的早期方便、快捷、高灵敏度检测hcp中酯酶对聚山梨酯降解活性的方法。技术实现要素:为解决上述现有技术中的问题满足现有技术中的需求,本发明提供了一种表征宿主细胞蛋白中酯酶对聚山梨酯降解活性的方法,所述方法可定量。具体地说,本发明提供了一种表征宿主细胞蛋白中酯酶对聚山梨酯降解活性的方法,其特征在于,所述方法包括:a)将包含宿主细胞蛋白的样品与乙酸萘酯反应;b)样品与乙酸萘酯的反应产物与固蓝b盐进行显色反应;和c)在550nm至600nm的波长处检测显色反应产物的吸光度;样品与乙酸萘酯反应引起所述吸光度增加表明样品中存在宿主细胞蛋白中酯酶对聚山梨酯的降解活性。其中,所述样品可以是宿主细胞培养和收获后各工段、各节点采集的中间产物,也可以是最终纯化后的终产品。本发明方法还能够确定样品中酯酶的酶活力,比活力和/或单位体积活力从而定量表征宿主细胞蛋白中酯酶对聚山梨酯的降解活性。本发明的方法能够定量分析中间产物是否存在会降解聚山梨酯的酯酶活性。本发明的方法能够用于下游纯化工艺开发中,通过定量酯酶活性随着下游工艺的优化而发生的下降,指导纯化工艺尤其是去除宿主细胞蛋白中酯酶的工艺开发。本发明的方法能够用于对终产品例如原液或成品中残留酯酶的活性进行定量,指导评估聚山梨酯因hcp降解的风险。附图说明图1:实施例之一中,萘酚含量与吸光度的标准曲线。其中,横坐标是测得的吸光度,纵坐标是萘酚含量。图2:实施例之一中,聚山梨酯80竞争性抑制酯酶对乙酸萘酯降解活性的米氏方程双倒数图。其中,横坐标为1/[s],纵坐标是1/v。具体实施方式本文中,除非特别指定,名称、量词或单位前的“一”或“1”表示存在即数量上至少为一,因此涵盖复数含义。本文中,除非特别指定,本文述及的各项技术特征,例如组分、含量、步骤、条件参数、参数值、组件、连接关系、工作关系等等,它们的组合方式不限于本文具体描述的各个实施方式和实施例,其他任意组合方式同样属于本发明的范畴。本文中,除非特别指定,以两端值表示的数值范围视同具体公开了两端值及两端值之间的所有实数及其两两组合而成的数值范围。此外,除非特别指定,当对同一技术特征或同一参数具体描述了多个可选数值范围或数值时,这些端值和数值可以任意组合,由此得出的范围只要包含在具体描述的最大连续范围之内则均属于本发明的范畴。本文中,除非特别指定,所述数值不论是否带有前行词“约”均涵盖本领域技术人员能够理解的与该数值等同的约略范围,例如该数值±10%、±5%、±3%、±2%、±1%或±0.5%的范围。本文中,除非特别指定,所有科学和技术术语的含义均符合本领域、尤其重组蛋白生产和研发领域公知或已知的含义,例如教科书、实验手册或现有技术文献中记载的含义。在本文中,除非特别说明,就溶液体系而言的百分比(%)均为质量体积比(w/v),溶液与溶液之间的比例均为体积比。“溶液”,除非特别说明,泛指多组分的液体体系。发明人发现,hcp中可降解乙酸萘酯和聚山梨酯的酯酶属于同一种酶系,故利用hcp中的酯酶对乙酸萘酯降解反应生成萘酚,利用固蓝b盐与萘酚的显色反应,检测显色反应产物的吸光度,可以观察到经过一段反应时间,吸光度增加,由此表征hcp对聚山梨酯的降解活性。使用此方法便可以在蛋白质制剂药品研究的早期来对hcp中的酯酶活性进行检测,从而在研究和开发药品的早期充分优化下游纯化工艺以去除产品中残留的酯酶,来尽可能避免蛋白质制剂药品生产后,在运输或长期储存过程中产生的质量下降的问题,此外还可以使用此方法定量检测终产品中酯酶活性,以评估因酯酶而造成的聚山梨酯下降的风险。具体地说,本发明提供了一种表征宿主细胞蛋白(hcp)中的酯酶对聚山梨酯降解活性的方法,其特征在于,所述方法包括:a)将包含宿主细胞蛋白的样品与乙酸萘酯反应;b)样品与乙酸萘酯的反应产物与固蓝b盐进行显色反应;和c)在550nm至600nm的波长处检测显色反应产物的吸光度;样品与乙酸萘酯反应引起所述吸光度增加表明样品中存在宿主细胞蛋白中酯酶对聚山梨酯的降解活性。本发明方法中,所述样品可以是重组法生产蛋白类产品工艺流程中各工段、各节点采集的样本,包括中间产物和终产品的样本。一些实施方式中,本发明方法检测中间产物中宿主细胞蛋白中酯酶对聚山梨酯降解活性。本文中,“中间产物”包括重组法生产蛋白类产品的方法中从起始材料开始,通过一个或多个不同工艺如发酵、培养、分离以及纯化、添加必要的稳定剂等各工艺过程所获得的产物(《中国药典2015版》)。举例来说,中间产物包括但不限于发酵后的收获上清液以及例如分离、纯化、浓缩、配制等下游工段获得的产物。分离和纯化的例子包括但不限澄清化(例如离心,过滤等)和层析(例如亲和层析、离子交换层析、疏水层析、多模式层析等等)。另一些实施方式中,本发明方法检测终产品中宿主细胞蛋白中酯酶对聚山梨酯降解活性。本文中,“终产品”包括原液或成品,例如重组蛋白(例如单克隆抗体)的原液或成品。其中,“原液”指收获液经提取、纯化分装于中间贮存容器中即为原液;“成品”指原液或半成品经除菌过滤后分装于无菌终容器中并经包装后即为成品(《中国药典2015版》)。一些实施方式中,步骤a)中,乙酸萘酯包含于底物溶液中与所述样品反应。所述底物溶液可包含:约0.01~0.2mol/l、约0.04~0.1mol/l或约0.04mol/l的磷酸氢二钠/磷酸二氢钠缓冲液,ph约6.0~8.0、优选ph约7.0;约0.5~3%(v/v)、约1~2%(v/v)或约1%(v/v)丙酮;和约0.00001~0.006mol/l,优选约0.0001~0.003mol/l、例如约0.0003mol/l、约0.001mol/l的乙酸萘酯。一些实施方式中,步骤a)中,样品与乙酸萘酯底物反应的温度可以是约25~30℃,孵育时间可以是约0.5~120小时。本领域技术人员知道,可以根据样品来源预估酶活的相对高低,并根据预估的相对酶活优化反应温度和孵育时间。例如,一些实施方式中,检测的样品为中间产物,例如收获上清或层析纯化产物,孵育可以是约0.5~6小时,例如约1、约2、约3、约4、约5小时;另一些实施方式中,检测的样品为终产品,例如重组蛋白质(例如单克隆抗体)原液和成品,孵育时间可以是约6~120小时、例如约6~72小时、例如约6、24、72小时。一些实施方式中,步骤b)中,作为显色剂的固蓝b盐包含在溶液中,本文中将此溶液称为“显色液”。显色液还可包含十二烷基硫酸钠。例如,显色液可以是5%(w/v)十二烷基硫酸钠溶液与1%(w/v)固蓝b盐溶液按照约10:1~1:1、例如约5:2体积比的混合物。以上所述溶液的溶剂可以是水,例如超纯水。本文中,“显色反应产物”指经历显色反应后的显色反应系。本文中,“显色反应系”指显色底物萘酚所在样品(例如制作标准曲线时的萘酚或萘酚溶液)或萘酚存在情况待测的样品(例如含hcp的样品与乙酸萘酯的反应产物)与显色剂或显色液的混合系。本文中,“显色反应产物的吸光度”在上下文中简称“吸光度”。一些实施方式中,步骤b)中,所述显色反应包括显色反应系在约4000~10000rpm、例如约8000rpm转速下离心约5~10分钟。然后取离心所得上清液检测吸光度。一些实施方式中,样品为终产品,显色反应包括约8000~10000rpm、例如约8000rpm转速下离心约5~10分钟。一些实施方式中,含hcp的样品与乙酸萘酯的反应产物与显色剂或显色液混合后立即离心,离心后立即取上清液检测吸光度。一些实施方式中,样品与底物溶液的体积比约为1:1~1:10,例如1:5。一些实施方式中,显色液与样品的体积比约为1:1。一些实施方式中,底物溶液:样品:显色液的体积比约为5:1:1。本发明的方法中,样品与乙酸萘酯反应引起吸光度增加应理解为所述反应过程中任意长度时段其后端时刻与前端时刻的吸光度进行比较可观察到吸光度随反应进行而增加。吸光度检测的时间点没有限定。举例来说,一些实施方式中,可以在样品与乙酸萘酯底物混合后立即(亦称“0时”)测定吸光度作为初始吸光度,也可在晚些时刻测定初始吸光度;后端时刻的吸光度或称“反应后吸光度”则可以是在初始吸光度测定之后任意时刻(例如反应终点)测定的吸光度;反应后吸光度相比初始吸光度增加表明样品中存在宿主细胞蛋白中酯酶对聚山梨酯的降解活性。这些时间点的确定是技术人员能够自由确定的。一些实施方式中,还包括由测得的吸光度确定样品中酯酶的酶活力、比活力和/或单位体积活力从而定量表征宿主细胞蛋白中酯酶对聚山梨酯的降解活性。举例来说,可以通过制作并使用吸光度与萘酚浓度的标准曲线来确定酶解产物即萘酚的产量,结合样品体积、蛋白含量等即可确定酶活力、比活力和单位体积活力等定量数据。本发明的方法适用于采用各种宿主细胞的、各种蛋白类生物药的重组生产工艺。例如,宿主细胞可以是哺乳动物细胞,例如中国仓鼠卵巢(cho)细胞。例如,重组蛋白可以是单克隆抗体及其功能性片段、基因工程抗体及其功能性片段、非抗体类免疫球蛋白、fc融合蛋白、以及无融合标签的任意重组蛋白,例如重组酶蛋白。本发明的方法适用于表征hcp中酯酶对各种聚山梨酸酯的降解活性,例如生物药物制剂中最常用的聚山梨酸酯20(ps20)和聚山梨酸酯80(ps80)。实施例下面将结合具体的实施例对本发明的技术方案进行更为详细地阐述。以下实施例仅为示例,对本发明技术方案不构成任何限定或限制。以下实施例中具体的材料、步骤、条件、数值或数值范围等技术参数仅是举例,并非穷举亦非限定。以下实施例中,如无特殊说明,配制使用的溶剂均为超纯水。以下实施例中,“乙酸萘酯”均指α-乙酸萘酯。以下实施例中,用cygnusf550chohcpelisa试剂盒(cygnus公司)检测hcp浓度。以下实施例中,如无特殊说明,“ppm”表示“mg/l”。实施例1:中间产物中酯酶比活力的检测标准曲线如下所述制作标准曲线:配制溶液稀释剂,其中包含0.04mol/l的磷酸氢二钠/磷酸二氢钠缓冲液,ph7.0,1%丙酮;配制萘酚标准品溶液,其中包含0.04mol/l的磷酸氢二钠/磷酸二氢钠缓冲液,ph7.0,1%丙酮,0.006mol/l萘酚;配制显色液:将5%十二烷基硫酸钠溶液与1%固蓝b盐溶液按5:2体积比混合。使用溶液稀释剂将萘酚标准品溶液按比例稀释,并与显色液按照6:1的体积比混合进行反应,检测显色反应产物的吸光度,将测得的数据以吸光度为横坐标,以萘酚含量为纵坐标,绘制成标准曲线,如表1和图1所示。标准曲线方程:y=1.3687x+0.176,r2=0.9986。表1:标准曲线数据萘酚含量(×10-3μmol)1.53.03.755.07.515600nm吸光度0.792.042.503.745.3510.80活性检测本实施例中,中间产物样品取自cho细胞经细胞培养后收获的上清液经captoblue(highsub)亲和层析后所得的中间产物溶液。样品中hcp浓度为1.0×103ppm。按照0.04mol/l的磷酸氢二钠/磷酸二氢钠缓冲液ph7.0,1%丙酮,0.0003mol/lα-乙酸萘酯准备好底物溶液。取100μl样品与500μl配制好的底物溶液混合均匀制成反应混合物(600μl),一式两份。取一份反应混合物作为显色反应底物立即进行显色反应并检测吸光度,记为“0时”值。另一份反应混合物在25℃下孵育0.5小时得反应产物溶液,然后以孵育所得反应产物溶液作为显色反应底物进行显色反应并检测吸光度。配制新鲜的显色液:5%十二烷基硫酸钠溶液500μl和1%固蓝b盐溶液200μl均匀混合。显色液在临用前即配即用。显色反应:取100μl显色液与显色反应底物混合,8000rpm离心10分钟。然后取离心所得上清液检测600nm处的吸光度,结果如下表所示:表1:检测结果0时0.5小时600nm吸光度2.355.28根据测得的吸光度由标准曲线得出反应产物溶液中作为酶解产物的萘酚含量,并根据萘酚产量,结合样品体积和hcp浓度,计算hcp中酯酶的比活力和单位体积活力。其中,酶活力单位定义为:在标准反应条件下,1分钟内催化1μmol底物转化的酶量定义为一个酶活力单位(u),即1u=1μmol/min;比活力(sa):每毫克酯酶蛋白所具有的酶活力单位数;单位体积活力:每毫升溶液所具有的酶活力单位数。经计算,本实施例中,亲和纯化所得中间产物中的hcp中酯酶的体积活力为0.67u/ml产物溶液,比活力为0.671u/mghcp酯酶蛋白。由此可见,本发明方法能够定量的描述酯酶比活力,而酯酶是hcp中降解聚山梨酯的关键酶,因此该比活力可以用来定量评估hcp中酯酶对聚山梨酯的降解活性。在工艺开发的过程中,可以通过比活力评估hcp中酯酶清除的状况,通过单位体积活力评估产品溶液对聚山梨酯降解的风险。实施例2:终产品中酯酶比活力的检测标准曲线如实施例1所述制作标准曲线。活性检测本实施例中,终产品样品取自cho生产单抗所得成品,其中hcp浓度为10.4ppm。按照0.04mol/l的磷酸氢二钠/磷酸二氢钠缓冲液ph7.0,1%丙酮,0.0003mol/lα-乙酸萘酯准备好底物溶液。取100μl成品溶液与500μl配制好的底物溶液混合均匀制成反应混合物(600μl),一式两份。取一份反应混合物作为显色反应底物立即进行显色反应并检测吸光度,记为“0时”值。另一份反应混合物在30℃下孵育120小时得反应产物溶液,然后以孵育所得反应产物溶液作为显色反应底物进行显色反应并检测吸光度。配制新鲜的显色液:5%十二烷基硫酸钠溶液500μl和1%固蓝b盐溶液200μl均匀混合。显色液在临用前即配即用。显色反应:取100μl显色液与显色反应底物混合,8000rpm离心10分钟,然后取离心所得上清液检测600nm处的吸光度,结果如下表所示:表2:检测结果0时120小时600nm吸光度0.345.97经计算,本实施例中,成品中酯酶的体积活力为0.01u/ml产品溶液,比活力为0.532u/mghcp酯酶蛋白。与实施例1的结果比较可知,成品溶液对ps80降解风险远远小于中间产品溶液。实施例3:乙酸萘酯降解活性表征聚山梨酯降解活性实验一.聚山梨酯80竞争性抑制酯酶对乙酸萘酯的降解活性竞争性实验样品制备:配制溶液稀释剂:0.04mol/l的磷酸氢二钠/磷酸二氢钠缓冲液,ph7.0,1%(v/v)丙酮;配制反应底物溶液,其中包含0.04mol/l的磷酸氢二钠/磷酸二氢钠缓冲液,ph7.0,1%(v/v)丙酮,0.003mol/l的α-乙酸萘酯;配制10%聚山梨酯80母液,其中包含10%聚山梨酯80;配制显色液:5%十二烷基硫酸钠溶液与1%固蓝b盐溶液按5:2体积比混合。分别设置聚山梨酯80组和对照组,并如表4中所示对底物溶液进行梯度稀释。如下所述检测活性:对照组:取100μl实施例1中所述的中间产物样品与500μl各稀释度的底物溶液混合均匀,在25℃下孵育0.5小时得反应产物溶液。取100μl显色液与反应产物溶液(600μl)混合,8000rpm离心10分钟。然后取离心所得上清液检测600nm处的吸光度。聚山梨酯80组与对照组的区别仅在于:取实施例1中所述的中间产物样品与10%聚山梨酯80母液配制成100μl另含0.04%聚山梨酯80的测试样品与500μl各稀释度的底物溶液混合反应。结果如下表所示:表4:竞争性抑制实验检测结果利用双倒数作图法,由稀释后浓度和吸光值求解米氏常数km。米氏方程:双倒数作图法:其中,v是酶反应速度;[s]是底物浓度;vmax是酶被底物饱和时的反应速度。结果如图2所示:聚山梨酯80组:km=0.0403,vmax=0.8868;对照组:km=0.0147,vmax=0.8300。从结果可知,聚山梨酯80的加入竞争性抑制酯酶对乙酸萘酯的降解,导致米氏常数km增加。实验二.hcp降解ps80的检测cho细胞经细胞培养后收获的上清液经captoblue(highsub)亲和层析后得到中间产物,由该中间产物取样配制成包含0.04%聚山梨酯80的反应产物溶液样品,然后放置于25℃孵育。孵育前后聚山梨酯80浓度检测如表5所示。聚山梨酯检测方法:由于在生物药品制剂中添加的浓度高于其cmc(化学成分生产和控制)值,一般以胶束的形式存在,n-苯基-1-萘胺(npn,一种荧光染料)与其结合产生荧光信号,采用荧光检测器检测,外标法定量,测定聚山梨酯80的浓度。表5:检测结果样品信息聚山梨酯80含量%(w/v)孵育前0.039孵育后0.022本实施例中实验一使用竞争性抑制方法证明了萘酯的降解和聚山梨酯的降解使用到了同样的酯酶,实验二也通过色谱法检测到了聚山梨酯的降解。这两个实验说明了两种方法,即直接检测聚山梨酯被酯酶降解的活性和酯酶对萘酯降解活性的相关性,进一步补充说明了用萘酯作为酶活表征剂可以表征酶对聚山梨酯的降解活性。由于聚山梨酯的降解速率缓慢,且降解途径多样化,受其他物化因素影响大,直接检测聚山梨酯的降解费时费力且易受到干扰。通过本方法,即以萘酯表征酯酶活性的方法,预测产品中hcp酯酶对聚山梨酯的降解,成本低,易操作,极易用于产品开发中纯化工艺的研究和产品中酯酶对聚山梨酯降解活性的风险评估。实施例4:中间产物中酯酶比活力的检测标准曲线如实施例1所述制作标准曲线。活性检测本实施例中,中间产物样品为cho细胞经细胞培养后收获的上清液经captoblue(highsub)亲和层析后所得的中间产物溶液。样品中hcp浓度为1.0×103ppm。按照0.04mol/l的磷酸氢二钠/磷酸二氢钠缓冲液ph7.0,1%(v/v)丙酮,0.0003mol/lα-乙酸萘酯准备好底物溶液。取100μl样品与500μl配制好的底物溶液混合均匀制成反应混合物(600μl),一式两份。取一份反应混合物作为显色反应底物立即进行显色反应并检测吸光度,记为“0时”值。另一份反应混合物在30℃下,孵育1小时得反应产物溶液,然后以孵育所得反应产物溶液作为显色反应底物进行显色反应并检测吸光度。配制新鲜的显色液:5%十二烷基硫酸钠溶液500μl和1%固蓝b盐溶液200μl均匀混合。显色液在临用前即配即用。显色反应:取100μl显色液与显色反应底物混合,8000rpm离心10分钟,然后取离心所得上清液检测600nm处的吸光度,结果如下表所示:表6:检测结果吸光度0时1小时600nm3.494.69经计算,本实施例中间产物中酯酶的体积活力为0.12u/ml产物溶液,比活力为0.125u/mghcp酯酶蛋白。实施例5:中间产物中酯酶比活力的检测中间产物样品、各溶液配制与实验操作与实施例4相同,区别在于底物溶液与样品溶液的孵育时间为2小时。检测结果如下:表7:检测结果吸光度0时2小时600nm3.495.67经计算,体积活力:0.12u/ml产物溶液;比活力为:0.122u/mghcp酯酶蛋白。实施例6:中间产物中酯酶比活力的检测中间产物样品、各溶液配制与实验操作与实施例4相同,区别在于底物溶液与样品溶液的孵育时间为3小时。检测结果如下:表8:检测结果吸光度0时3小时600nm3.496.13经计算,体积活力:0.10u/ml产物溶液;比活力为:0.100u/mghcp酯酶蛋白。实施例7:中间产物中酯酶比活力检测中间产物样品、各溶液配制与实验操作与实施例4相同,区别在于底物溶液与样品溶液的孵育时间为6小时。检测结果如下:表9:检测结果吸光度0时6小时600nm3.497.83经计算,体积活力:0.08u/ml产物溶液;比活力为:0.085u/mghcp酯酶蛋白。实施例8:终产品中酯酶比活力的检测标准曲线如实施例1所述制作标准曲线。活性检测本实施例中,终产品样品取自cho生产单抗所得成品。样品中hcp浓度为10.4ppm。按照0.04mol/l的磷酸氢二钠/磷酸二氢钠缓冲液ph7.0,1%(v/v)丙酮,0.0003mol/lα-乙酸萘酯准备好底物溶液。取100μl成品溶液与500μl配制好的底物溶液混合均匀制成反应混合物(600μl),一式两份。取一份反应混合物作为显色反应底物立即进行显色反应并检测吸光度,记为“0时”值。另一份反应混合物在30℃下,孵育24小时得反应产物溶液,然后以孵育所得反应产物溶液作为显色反应底物进行显色反应并检测吸光度。配制新鲜的显色液:5%十二烷基硫酸钠溶液500μl和1%固蓝b盐溶液200μl均匀混合。显色液在临用前即配即用。显色反应:取100μl显色液与显色反应底物混合,8000rpm离心10分钟,然后取离心所得上清液检测600nm处的吸光度,结果如下表所示:表10:检测结果吸光度0时24小时600nm0.782.39经计算体积活力:0.01u/ml产物溶液;比活力为:0.700u/mghcp酯酶蛋白。实施例9:终产品中酯酶比活力的检测终产品样品、各溶液配制与实验操作与实施例8相同,区别在于底物溶液与样品溶液的孵育时间为72小时。检测结果如下:表11:检测结果吸光度0时72小时600nm0.783.91经计算体积活力:0.01u/ml产物溶液;比活力为:0.480u/mghcp酯酶蛋白。基于上述实施例,结合本文整体技术信息,根据实际条件和需求可对材料、步骤、条件、数值或数值范围等参数进行增减、改换而不至于显著影响本发明效果的实现,这是本领域技术人员容易想到和容易做到的,这些增减、改换所得的实施方式同样属于本申请保护的本发明范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1