农兽药残留多目标物纳米酶探针制备及可视化快速检测系统及方法
1.本发明属于农兽药残留检测领域,涉及纳米酶探针检测技术,尤其是一种农兽药残留多目标物纳米酶探针制备及可视化快速检测系统及方法。
背景技术:
2.农产品质量安全是关乎民生的重大议题,不仅需要社会监管更需要高质量检测技术的支持,农兽药种类繁多,常规检测技术流程繁琐、成本高昂,目前的快速检测技术多针对单一目标物,对多种危害因子共存的样品检测效率低,无法实现在现场对大批量样品进行快速筛查,因而开展食用农产品中农兽药残留快速检测研发相关快检产品,显得尤为重要。
技术实现要素:
3.本发明的目的在于克服现有技术的不足之处,提供一种农兽药残留多目标物纳米酶探针制备及可视化快速检测系统及方法,合成具有过氧化物酶催化功能的pt@au纳米材料,制备纳米催化功能的信号探针及捕获探针,结合磁分离技术,实现农兽药残留的多目标物同时检测,以期为食用农产品中其他农兽药残留快速检测提供技术支撑,为食品安全保驾护航。
4.本发明解决其技术问题是采取以下技术方案实现的:
5.一种农兽药残留多目标物纳米酶探针制备及可视化快速检测方法,具体操作方法步骤如下:
6.1)制备具有过氧化物酶催化功能的pt@au纳米材料:
7.混合摩尔浓度为20mm的k2ptcl4和haucl4溶液,混合比例为6-10ml:1ml,混合后加入5-10ml,20mm的抗坏血酸,加入0.7-1ml,1mm的pluronic f127,混合液在室温下水浴超声反应3h,产物经10000r/min离心20min分离,用乙醇与水反复洗涤2-3次除去残留的pluronic f127,超纯水复溶后获得具有过氧化物酶催化功能的pt@au纳米材料,备用,该具有过氧化物酶催化功能的pt@au纳米材料浓度为12-20mm(浓度以pt量计);
8.2)制备待测目标物相应的信号探针pt@au@ab和捕获探针mpms@ag:
9.①
信号探针pt@au@ab制备方法包括:取稀释10-20倍的上述pt@au纳米材料,采用0.2m k2co3调节pt@au纳米材料ph到8.5-9.0,添加待测农兽药抗体ab,添加比例为每1ml pt@au纳米材料添加抗体的质量为10-100μg,反应1h后,再加入30μlpbs(0.01m,ph 7.4,含10%bsa),封闭pt@au多余位点,孵育反应后10000r/min离心20min除去游离的抗体或蛋白,得到免疫信号探针pt@au@ab,4℃储存备用;
10.②
捕获探针mpms@ag制备方法包括:取羧基功能化磁性聚苯乙烯微球mpms,加入待测目标物的包被抗原ag,添加比例为每5mg mpms添加的包被抗原ag的量为20-100μg(以载体蛋白ova或bsa计算),反应40-60分钟后,再加入30μlpbs(0.01m,ph 7.4,含10%bsa),封
闭mpms表面多余位点,孵育反应后在磁力架上离心处理,利用外部磁力除去游离的抗体或蛋白,1.0ml pbs(0.01m,ph7.4,10%bsa)复溶,得到待测目标物相应的捕获探针mpms@ag,4℃储存备用;
11.3)检测方法
12.1)在待测目标物的检测体系中,依次加入对应的农兽药残留标准液、对应的捕获探针mpms@ag及对应的信号探针pt@au@ab,检测体系中mpms@ag与相应的待测物竞争结合pt@au@ab,形成信号探针与待测物免疫复合物、捕获探针与信号探针免疫偶联复合物mpms@ag-pt@au@ab,检测体系孵育反应时间为15min,反应后,信号探针与捕获探针的免疫偶联复合物在外界磁力作用下,实现快速分离,经超纯水清洗2次,获得免疫偶联复合物,同时收集上清液;
13.2)分别向免疫偶联复合物中加入过氧化物复合显色液300-800μl,显色5-10min,采用可视化快速检测系统读取标准品浓度下,免疫偶联复合物所对应的“rgb”值中蓝色b值,快速检测系统记录不同浓度下对应的b值,根据b值与标准品浓度,构建线性方程检测模型,并计算相应模型的相关性系数,线性检测范围以及检测限,每种农兽药残留检测的模型通过自行比对后,选择相关性系数大于0.99,线性检测范围宽,检测限低的为最佳检测模型;
14.3)最佳检测模型确定后待测目标物样品提取液先稀释5-20倍,在检测体系中按比例加入样品提取液稀释液、捕获探针mpms@ag,混匀后再加入信号探针pt@au@ab,孵育反应后,经磁分离收集信号探针与捕获探针的复合沉淀物,经pbs清洗后,加入对应比例的复合显色液,室温催化5-10min,采用可视化快速检测系统读取检测体系b值,根据先前构建的最佳检测模型,重复测量三次,计算出样品中待测农兽药残留的浓度,
15.所述步骤(3)中每次待测目标物样品选择包括单一种类待测目标物检测或多种类待测目标物平行检测。
16.上述所述的复合显色液包括底物a和底物b,底物a包括无水乙酸钠、柠檬酸、β-糊精及过氧化氢脲,添加比例为无水乙酸钠87.86mg:柠檬酸34.60mg:β-糊精27.38mg:过氧化氢脲4.69mg,上述各组分混合后溶解于超纯水中,溶解比例为混合物154.53mg:10.95ml,底物b为tmb溶液,浓度为337.50μl 1mg/mltmb溶液。
17.上述的可视化快速检测系统包括图像采集终端(平板或智能手机的摄像头)数据收集处理模块及数据输入输出终端(触摸屏)分别用作图像捕获设备、数据分析处理和控制界面,主要的操作方法包括三个步骤:
18.⑴
图像采集终端的摄像头进行图像捕获,主要是免疫偶联复合物催化复合显色液所对应的“rgb”值中蓝色b值;
19.⑵
数据收集处理模块将图像信息转化成数据信息;
20.⑶
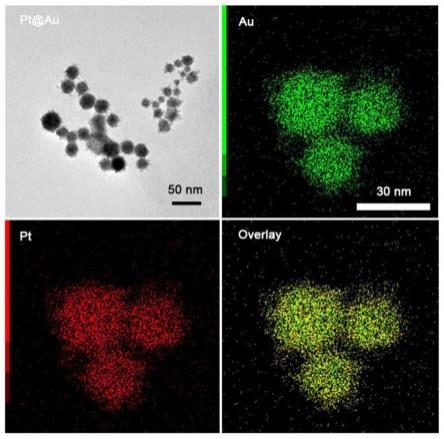
标曲构建与分析,最终将检测数据在数据输入输出终端显示。
21.具体的,首先将纳米酶催化底物显色液,按照浓度梯度依次摆放在白色背景a4纸上,然后将图像采集终端固定在离心管的斜上方(离心管和摄像头连线与水平面夹角为30
°‑
60
°
),距离为10-20cm处;
22.然后获取离心管反应溶液的rgb中的b值,记录不同浓度下的b值;
23.最后以标准品浓度为横坐标,相应的b值为纵坐标,构建相应农兽药标准曲线,并
进行验证分析。
24.本发明的优点和积极效果是:
25.1、本发明基于纳米酶的检测方法的检测限比传统的elisa要低,普通的酶(辣根过氧化物酶)为自然酶,易失活,成本高,反应条件要求相对严些,现在的纳米酶的做实验时要求的反应条件不严(ph跨度大、耐酸碱性更强),成本低。
26.2、本发明可实现可视化检测,即根据捕获到的图片颜色的变化,可以确定待检测的农兽药残留范围,利用手机或平板上的软件可定量化检测,可以确定测得具体的数值,可定量分析,便捷高效。
27.3、本发明制备一种具有过氧化物酶催化功能的pt@au纳米材料,结合多菌灵、氧乐果、氯霉素、沙丁胺醇等四种农兽药残留抗体,制备纳米酶探针,构建四种快速可视化检测方法,通过优化试验参数,结合磁分离技术,比传统酶联免疫分析方法更省时快速,且不需借助大型仪器,即可实现一个样品中四种农兽药残留的可视化快速检测。
附图说明
28.图1pt@au纳米材料tem和元素分析结果图;
29.图2为氯霉素的标准曲线;
30.图3为氧乐果的标准曲线;
31.图4为同一个样品中四种农兽药残留加标检测结果图;
32.图5为四种农兽药加标检测与elisa检测结果一致性分析。
具体实施方式
33.下面通过具体实施例对本发明作进一步详述,以下实施例只是描述性的,不是限定性的,不能以此限定本发明的保护范围。
34.实施例1
35.纳米酶pt@au材料合成鉴定及催化功能的确定
36.摩尔浓度为20mm的k2ptcl4和haucl4溶液,混合比例为9ml:1ml,混合后加入5.5ml,20mm的抗坏血酸,加入0.8ml,1mm的pluronic f127,混合液在室温下水浴超声反应3h,产物经10000r/min离心20min分离,用乙醇与水反复洗涤3次除去残留的pluronic f127,超纯水复溶后,获得pt@au纳米材料浓度为12-20mm,浓度以pt量计。制备tem样品,进行形貌和元素分布表征,表征结果如图1所示,合成的pt@au纳米酶统计分析粒径为19.0
±
5.6nm,进行au和pt元素分布分析发现,au和pt元素分布均匀,说明pt@au纳米酶具有pt催化性,又具有au可以偶联抗体蛋白的性能,因而可进行免疫信号探针制备和快速可视化检测方法的构建。
37.取离心管4只,加入复合底物显色液500μl,一次加入超纯水10μl,复溶后的纳米酶pt@au溶液10μl、20μl、50μl,记录显色液的b值,统计结果如表1所示。根据试验结果可得出结论,纳米酶具有过氧化物酶催化复合显色底物的能力,因此可用于催化显色,进行后续农兽药残留的检测实验。
38.表1pt@au纳米酶催化性能实验结果
[0039][0040]
实施例2
[0041]
多种农兽药残留的免疫信号探针及捕获探针的制备
[0042]
多种农兽药免疫信号探针pt@au@ab制备方法包括:取离心管4只,分别加入3.0ml稀释10倍的上述pt@au纳米材料,采用0.2m k2co3调节pt@au纳米材料ph到8.7,依次添加20μg氯霉素抗体、40μg多菌灵抗体、50μg氧乐果抗体、30μg沙丁胺醇抗体,反应1h后,再加入30μlpbs(0.01m,ph 7.4,含10%bsa),反应30min封闭pt@au多余位点后,孵育反应后10000r/min离心20min除去游离的抗体或蛋白,得到相应的免疫信号探针pt@au@ab,4℃储存备用。
[0043]
多种农兽药捕获探针的制备。取离心管4只,分别加入1.0ml 5mg/ml羧基功能化磁性聚苯乙烯微球mpms,采用edc和nhs活化表面的羧基基团,然后依次加入50μg氯霉素包被原、50μg多菌灵包被原、50μg氧乐果包被抗原、50μg沙丁胺醇包被原,孵育反应后,通过外部磁力富集捕获探针相应的捕获探针mpms@ag,弃去上清,pbs(0.01m,ph 7.4)清洗后,加入30μl pbs(0.01m,ph 7.4,含10%bsa),封闭mpms表位多余位点,磁分离再次pbs(0.01m,ph 7.4)清洗3次,5.0mlpbs(0.01m,ph 7.4)复溶,获得氯霉素、多菌灵、氧乐果、沙丁胺醇的捕获探针,4℃储存备用。
[0044]
pt@au纳米材料和磁性聚苯乙烯微球mpms表面成功修饰的确定分析如下:免疫信号探针和捕获探针制备过程中,取上清液,通过bca试剂盒检测上清液蛋白浓度含量,进而明确抗体偶联在pt@au纳米材料和包被原偶联在磁性微球表面的含量,具体的偶联量和偶联率如表2所示。多目标物的抗体偶联率在49.7%~61.0%之间,包被原的偶联率在64.8%~76.2%,说明成功制备免疫信号探针和捕获探针。
[0045]
表2信号探针、捕获探针的相关抗体、包被原的偶联量和偶联率分析
[0046][0047]
实施例3
[0048]
基于免疫信号探针与捕获探针的快速检测方法可行性确定。取离心管8只,依次不
同农兽药标准品、捕获探针和添加信号探针,孵育反应30min后,磁分离除去上清,沉淀物清洗3次后,依次加入复合底物显色液500.0μl,采用智能手机读取反应溶液b值,如表3所示,当不添加标准品时,磁分离获得mpms@ag-pt@au@ab免疫复合物,捕获探针结合最多的信号探针测得b值最大,当添加50μl 10μg/l相应标准品时,待测物与捕获探针竞争结合信号探针,磁分离获得少量的信号探针,体系平均检测b值相比较于没有添加标准品时的体系b值低,且差异极显著(p《0.01),验证信号探针与捕获探针成功制备,该检测方法能够进行多种农兽药残留的检测。
[0049]
表3基于免疫信号探针的快速可视化检测结果分析
[0050][0051]
实施例4
[0052]
标准曲线的构建与方法特异性评价。优化最佳的信号探针与捕获探针的比例,孵育时间,平行检测多种农兽药残留不同浓度下,检测体系的b值,根据b值与浓度的关系,构建氯霉素、多菌灵、氧乐果、沙丁胺醇的基于纳米酶免疫信号探针的快速可视化检测方法,相关的检测标准曲线如图2、3所示。按照标准曲线的构建方法,取离心管若干,先依次平行加入50μl相应的四种捕获探针,50μl 1mg/l的甲砜霉素、氟甲砜霉素、孔雀石绿、隐形孔雀石绿、结晶紫、呋喃唑酮代谢产物、呋喃妥因代谢产物、呋喃西林代谢产物、呋喃它酮代谢产物、磺胺二甲嘧啶、磺胺甲恶唑、诺氟沙星、恩诺沙星、沙丁胺醇、四环素、硫酸庆大霉素、甲硝唑,混匀再加入相应的50μl信号探针,孵育反应后,加入复合显色液,检测体系的b值,所测b值与相应标准品浓度为0体系b值差异不显著(p》0.05),与标准曲线最低检测浓度的检测体系b值差异显著(p《0.01),说明构建的多目标农兽药残留平行检测可以进行相应目标物的同时快速检测。
[0053]
实施例5
[0054]
农药残留检测以氧乐果为实验例,详细检测步骤及结果如下:
[0055]
取3.0ml 15倍制备好的pt@au纳米材料,用0.2m碳酸钾调节ph值到8.5-9.0,向其中加入50μg氧乐果抗体,4℃下孵育4h,再加入30μlpbs(0.01m,ph 7.4,含10%bsa),封闭pt@au多余位点,4℃孵育反应,10000r/min离心20min除去游离的氧乐果抗体或蛋白,用1.0ml pbs(0.01m,ph 7.4,10%bsa)复溶,获得检测氧乐果的具有纳米酶催化信号探针。
[0056]
取1.0ml 5mg/ml羧基功能化磁性聚苯乙烯微球(mpms),采用edc和nhs活化表面的羧基基团,加入50μg氧乐果包被抗原(ag),孵育反应后,通过外部磁力富集捕获探针(mpms@ag),弃去上清,pbs(0.01m,ph 7.4)清洗后,加入30μlpbs(0.01m,ph 7.4,含10%bsa),封闭mpms表位多余位点,磁分离再次pbs(0.01m,ph 7.4)清洗2-3次,5.0mlpbs(0.01m,ph 7.4)复溶,获得氧乐果捕获探针,4℃储存备用。
[0057]
在每个检测体系中,加入50μl捕获探针,50μl氧化乐果梯度标准品溶液(0,0.05,
0.1,0.5,1.0,5.0,10,50,100,200,500μg/l),混匀后再加入50μl氧乐果信号探针,孵育反应20min后,经磁分离收集上清液,信号探针与捕获探针的复合沉淀物经pbs(0.01m,ph 7.4)清洗后,各检测体系同时加入400μl复合显色液,室温催化5-10min,获得检测体系rgb值的b值,根据b值与标准品浓度的关系,氧乐果的线性检测范围为0.5-50μg/l,检测限为0.1μg/l。根据上清液催化复合显色液b值与标准品的浓度,线性检测范围为5-200μg/l,检测限为1.0μg/l。
[0058]
实施例6
[0059]
兽药残留以检测氯霉素为实验例,详细检测步骤及结果如下:
[0060]
取3.0ml15倍制备好的pt@au纳米材料,用0.2m碳酸钾调节ph值到8.5-9.0,向其中加入20μg氯霉素抗体,4℃下孵育4h,再加入30μlpbs(0.01m,ph 7.4,含10%bsa),封闭pt@au多余位点,4℃孵育反应,10000r/min离心20min除去游离的氯霉素抗体或蛋白,用1.0ml pbs(0.01m,ph 7.4,10%bsa)复溶,获得检测氯霉素的具有纳米酶催化信号探针。
[0061]
取1.0ml 5mg/ml羧基功能化磁性聚苯乙烯微球(mpms),采用edc和nhs活化表面的羧基基团,加入30μg氯霉素包被抗原(ag),孵育反应后,通过外部磁力富集捕获探针(mpms@ag),弃去上清,pbs(0.01m,ph 7.4)清洗后,加入30μlpbs(0.01m,ph 7.4,含10%bsa),封闭mpms表位多余位点,磁分离再次pbs(0.01m,ph 7.4)清洗2-3次,5.0mlpbs(0.01m,ph 7.4)复溶,获得氯霉素捕获探针,4℃储存备用。
[0062]
在每个检测体系中,加入50μl捕获探针,50μl氯霉素果梯度标准品溶液(0,0.01,0.05,0.1,0.5,1.0,5.0,10,50,100,200μg/l),混匀后再加入50μl氯霉素信号探针,孵育反应15min后,经磁分离收集上清液,信号探针与捕获探针的复合沉淀物经pbs(0.01m,ph 7.4)清洗后,各检测体系同时加入500μl复合显色液,室温催化5-10min,获得检测体系rgb值的b值,以信号探针与捕获探针的免疫复合物催化的检测体系为例,根据b值与标准品浓度的关系,氯霉素的线性检测范围为0.05-10μg/l,检测限为0.05μg/l。以上清液催化复合显色液检测体系为例,根据b值与标准品的浓度,线性检测范围为1.0-100μg/l,检测限为0.5μg/l。氯霉素的最佳的检测范围为0.05-10μg/l,检测限为0.05μg/l。
[0063]
检测实验如下:
[0064]
以氯霉素为例,具体的检测实验过程如下:
[0065]
取1.5ml离心管11个,快速加入50μl捕获探针(mpms@ag),再依次加入浓度为0,0.01,0.05,0.1,0.5,1.0,5.0,10,50,100,200μg/l的氯霉素标准品溶液50μl,混匀后再加入50μl信号探针(pt@au@ab),混匀孵育反应20min后,磁分离去除上清液,用pbs缓冲液洗涤磁分离的信号探针与捕获探针的复合物3-5次后,加入750μl显示溶液,10min后采用读取软件获得rgb的b值,以不同浓度下b值为纵坐标,样品溶液浓度为横坐标,绘制标准曲线,最终获得,检测氯霉素的检测范围为0.05-10μg/l,检测限采用三倍信噪比计算为0.05μg/l,标准曲线如图2所示。同时进行实际样品的检测(蜂蜜中氯霉素含量检测)实验结果如表4所示:
[0066]
表4蜂蜜中氯霉素含量的检测分析
[0067][0068]
检测的结果与传统的elisa方法检测的结果具有很好的一致性,且检测时间为10min,不需要大型仪器。同时进行多菌灵、氧乐果、沙丁胺醇可视化快速定量检测,检测限依次为0.01μg/l、0.01μg/l、0.05μg/l,该方法同时也可适用于其他农兽药残留的检测。
[0069]
实施例7
[0070]
根据构建方法,选取猪肉样品,进行样品中多种农兽药残留的平行快速检测实验,首先猪肉样品1不添加农兽药残留,进行本底浓度检测,猪肉样品2、3分别添加四种农兽药标准品,最终的四种农兽药的浓度为20μg/l、40μg/l水平,样品打碎后,去除蛋白和脂肪后,稀释十倍,在检测体系中按比例加入样品提取液稀释液、捕获探针mpms@ag,混匀后再加入信号探针pt@au@ab,孵育反应后,经磁分离收集信号探针与捕获探针的复合沉淀物,经pbs清洗后,加入对应比例的复合显色液,室温催化5-10min,采用可视化快速检测系统读取检测体系b值,根据先前构建的最佳检测模型,重复测量三次,计算出样品中待测农兽药残留的浓度,同时基于相同的抗体包被原构建传统elisa方法,进行快速可视化平行检测方法结果可靠性验证,具体检测结果如表5所示,该检测结果数值与elisa检测结果的数值差异不显著(p》0.05),说明所构建的快速检测方法检测结果准确,可靠,可用于实际样品中农兽药残留多目标物的同时平行检测。同时在水中添加20μg/l、40μg/l两个水平,进行实际样品中农兽药残留的检测,相关检测结果如图4、5所示。
[0071]
表5猪肉样品中不同加标的检测结果分析
[0072][0073]
注:nd为未检测出样品中目标物的浓度。
[0074]
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1