用于分析表示生物组织的三维体积的图像数据的方法与流程
本发明涉及用于分析表示生物组织的三维体积的图像数据的方法。本发明还涉及用于分析生物组织的三维体积的图像数据的计算机程序。
背景技术:
发达国家中年龄超过50岁的人中,老年性黄斑变性(AMD)、尤其是新生血管AMD(nAMD)是失明的主要原因。血管透过性的增加导致视网膜内或视网膜下的异常流体聚集,该异常流体聚集在它涉及黄斑的中心时导致视觉机能障碍。这导致迅速恶化的视敏度,色素上皮疤痕,永久丧失视力或失明。
然而,抗血管生成剂、包括雷珠单抗(Ranibizumab,商品名为Novartis,巴塞尔,瑞士)的玻璃体内注射已经显示出显著改善的nAMD的过程。为了减少玻璃体内注射的负担并优化风险/利益曲线,nAMD特征的演变(progression)能通过光学相干断层扫描(OCT)进行非侵入性监测。突出的nAMD特征包括视网膜结构厚度的增加。当在视觉上比较不同时间获取的视网膜的相同区域的两个OCT图像时,这种增加可被识别,其中时间间隔是几天到几个月。
例如,用雷珠单抗治疗的患者通常经受每月一次OCT检查。如果观察到nAMD特征的显著增长,那么治疗决策表示为:病人在当天、一个月后或两个月后(治疗期)接受雷珠单抗注射。如果nAMD特征还没有完全退去,再治疗可以被指示为一个月后。否则,该患者当天不接受注射,但通常指示维持注射(维持期)。
OCT采集以及OCT采集的随后的分析通常是由技术人员、包括眼科医生进行。这意味着,所监控的患者被要求在每次采集OCT时要访问医院的医疗实践或专门单位。这使患者承受相当大的负担。而且,OCT采集的频率(例如1个月)已经是一方面nAMD发展的密切监测和另一方面患者负担的成本及负担之间的一种折衷。
原则上,OCT采集的自动分析可缓解这些问题。近年来,许多算法已被设计来自动分析视网膜的OCT采集,例如Abràmoff MD,Garvin M.,Sonka M.,Retinal的Retinal Imaging and Image Analysis(视网膜成像和图像分析),IEEE Rev Biomed Eng.2010;3:169-208。在进行自动分析的情况下,重要的是:检测可能的成像误差以避免主要或基本是由于成像误差引起的假阴性或假阳性的结果。通常情况下,信噪比被用来提供成像质量的测量值。但是,单独该量对于评估成像数据的自动分析的结果的可靠性来说是不可靠的测量值。
技术实现要素:
本发明的目的是提供属于前述技术领域的用于分析图像数据的方法,该方法允许可靠地评估用于自动分析的成像数据的适合性。
通过权利要求1的特征详述本发明的方案。根据本发明,该方法包括以下步骤:
a)为多个子体积中的每个子体积产生至少两个误差概率值,每个值表示一种成像误差的概率,所有子体积构成三维体积;
b)基于至少两个误差的概率值,对于多个子体积中的每个子体积确定单个合并的误差概率值;
c)分析图像数据以便获得应用于多个子体积的有关生理学的结论,根据子体积的合并的误差概率,在分析中加权多个子体积中的给定子体积的图像数据。
因此,用于分析表示生物组织的三维体积的图像数据的本发明的计算机程序包括在计算机运行时适于执行上述步骤的计算机程序代码。本发明的方法允许基于至少两种成像误差产生局部误差概率值。使用这两种类型来提高误差预测的质量。根据图像数据的可靠性,具有局部值允许与不同子体积相关的图像数据的加权。如果检测到误差,通常不必重复成像步骤,但如果误差仅局部地影响图像数据,那么就能基于未受影响的图像数据获得有关生理学的结论。
特别地,被考虑用于获得有关生理学的结论的多个子体积填满待被检查的生物组织的整个三维体积。此外,相同的子体积可用于确定局部误差概率值和分析图像数据以便获得有关生理学的结论。
特别地,图像数据是光学相干断层成像(OCT)的图像数据。在OCT扫描的情况下,子体积优选对应于特定位置处的A型扫描(超声术语)。在下文中,A型扫描沿其延伸的深度轴用y来表示,而表示A型扫描的位置的垂直于y轴的两个轴分别用x和z表示。特别地,3D OCT图像数据由光谱域OCT获得。
该方法在自动分析大量的图像的情况下是特别有利的。除了其效率,其提供独立于操作员的评估,这在读片中心的应用中可能是非常有用的,或被提供为数据库主干网(backbone)的服务。
原则上,本发明的方法可应用于由诸如血管造影术、计算机断层扫描等的其他技术获得的三维图像数据。
本发明的方法特别适合人类或哺乳动物的视网膜组织的研究。特别地,它可能自动提供视网膜的OCT图像中的成像的概率的可靠评估。
本发明不限于视网膜组织的研究。使用本发明的方法可研究其他生物组织。
在本发明的优选实施例中,具有超过阈值的合并的误差概率值的多个子体积中的子体积从图像数据的分析被排除,以获得生理有关的结论。因此,该方法被简化,并且其中可能有成像误差的子体积根本不有利于有关生理学的结论。
替代性地,当分析图像数据时,可考虑基本所有子体积。在这种情况下,相应的权重是基于局部合并的误差的概率值。存在用于赋予加权的很多概率,将相比于具有更高概率的子体积更多的具有更低误差概率的子体积进行加权对获得可靠结果来说基本是唯一的条件。
取决于所采用的成像技术和被检查的生物组织,存在多个可行且合适的误差概率值的集。优选地,至少两个误差概率值包括在相关子体积中与信噪比相关的第一概率值。尽管信噪比(或噪音信号比)自己对于评估自动分析的适合性来说是不可靠的,但当与其他量结合时其仍是有价值的信息。尤其,如果例如由于成像光束未对准而存在局部的不期望的信号衰减,就像其将导致基本减弱的信号,那么信噪比将基本增大。
为了计算第一概率值,优选确定表示给定子体积的第一区域的图像数据的第一强度分布和表示给定子体积的第二区域的图像数据的第二强度分布,其中第一区域和第二区域涉及生物组织的不同的功能区域。随后,给定体积的第一概率值通过比较第一和第二强度分布获得。特别是在OCT采集的情况下,可能存在基本上不反向散射的生物组织的区域("黑区"),因此,对于这些区域接收的多数信号可归因于噪音。这些区域中的强度分布与示出OCT图像中的许多详细信息的亮的区域中的强度分布的比较允许对信噪比评估。
作为示例,在视网膜组织的OCT成像的情况下,合适的黑色区域是玻璃体液,而亮的区域位于视网膜色素上皮(RPE)和内界膜(ILM)后面。相应地,优选通过将这两个区域的强度分布与玻璃体液的强度分布比较获得两个测量值。出于安全原因,与更高的信噪比相关的测量值被用作第一概率值的基础。
通过使用应用于两个分布的柯尔莫哥洛夫-斯米尔诺夫(Kolmogorov-Smirnov)测试,可以比较强度分布。这将产生两个分布之间的差异或分离相关的量,其值在(0,1)的范围内,其中0表示分布的强度。1的补集可用作第一概率值。
用于比较两个强度分布或用于估计信噪比的其他(已知)方法可被使用。
优选地,至少两个误差概率值包括第二概率值,该第二概率值表示待被检查的生物组织的区域不被相关子体积表示的概率。这意味着:如果应被给定子体积涵盖的组织区域由于例如成像设备的不完全对准或成像过程中的对应的误差而没有被覆盖,那么其允许进行检测。这通常导致成像的三维体积中的缝隙并因此构成应避免的误差。
在OCT视网膜图像的情况下,通常要求整个视网膜深度被给定的A型扫描涵盖。如果存在未对准,可发生邻近ILM的视网膜的前部或者邻近或在RPE后面的视网膜的后部没有被涵盖。为了获得第二概率值,因此可行的是借助分段技术、例如使用基于图割算法来检测ILM和/或RPE。然后,ILM和/或RPE相对于图像边界的位置被确定。如果该位置邻近边界,那么图像误差是可能的,并且第二概率值将获得高值。为了将测量距离转化为概率值,可使用高斯核函数。
在本发明的方法的优选实施例中,表示生物组织的三维体积的图像数据的子体积通过成像设备的大量扫描而获得,所有扫描涵盖三维体积。在这种情况下,至少两个误差概率值优选包括第三概率值,该第三概率值表示在不同扫描中获得的相邻的子体积之间具有不连续性的概率。如果成像设备和被检查的生物组织失去固定对准,则可发生不连续性。可能性小的多的是:相比于在不同扫描(例如两个不同的B型扫描的空间相邻A型扫描)的相邻子体积之间在相同扫描(例如给定的B型扫描的相邻A型扫描)的相邻的子体积之间存在实质上的不连续性,因为在不同扫描情况下的时间偏移比第一情况大得多。
为了计算第三概率值,优选通过沿预定方向的相邻子体积的第一子体积的一系列体素的图像数据和沿预定方向的相邻子体积的第二子体积的一系列体素的图像数据构建距离矩阵并通过基于距离矩阵的分析计算第三概率值来比较相邻的子体积。
可通过获得对应于将距离矩阵的预定起点和预定终点相连接的路径的翘曲函数来分析距离矩阵,距离矩阵给出的距离的总和沿该路径最小。通过使用被称为例如Dijkstra算法的寻路算法可确定最短距离。
该方法受到根据例如语音识别中的时间的顺序分析而已知的“动态时间规整”方法的启发。翘曲函数对应于第一子体积的体素和第二子体积的体素之间的最佳匹配。两个被比较的子体积之间的不连续性将导致翘曲函数所表示的路径的性状改变。如果该路径与基准路径比较这将是明显的。在研究视网膜组织的情况下,沿预定方向的起点特别对应于视网膜的内界膜,终点将对应于脉络膜。
其它方法可以被使用。作为示例,可以通过图像分析,例如通过基于图割的算法确定ILM的位置。然后,沿y轴的ILM位置的比较允许检测不连续性。
优选地,至少两个误差概率值包括第四概率值,所述第四概率值表示以下概率,即表示有关子体积的图像数据是基本空的。这可能发生,因为成像设备的成像光学器件错位或其他光学、机械或电子问题。如果图像强度对于整个子体积来说处于窄的范围之内,那么图像数据被视为是基本空的。作为示例,如果对于整个子体积(例如在最低3或5%的强度值范围内)来说图像强度低于某一较低的阈值,那么第四概率值被赋予值1。否则,第四概率值被赋予值0。渐变的值也是可能的。
在本发明的方法的优选实施例中,特别是在OCT视网膜成像中,使用所有上述误差概率值,即与以下列出的相关的值:
a)信噪比;
b)被相关的子体积检查而不是表示的生物组织的区域;
c)相邻子体积之间的不连续性;和
d)表示相关子体积是基本空的图像数据。
优选地,通过将机器学习算法应用于至少两个误差概率值来确定单个合并的误差概率值。优选的算法是支持向量回归(SVR)算法。利用机器学习算法允许系统地包括在各图像数据分析领域的专家的知识。
如果应比较两个图像、即图像数据包括表示第一时间点的三维体积的第一图像和表示不同于第一时间点的第二时间点的体积的第二图像,本发明的方法特别有用,并且该方法包括以下步骤:获得沿预定方向的生物组织的层的增长概率的至少一个局部测量值。组织或其被检查的部分由第一图像的第一子体积和第二图像的第二子体积表示,第一子体积和第二子体积表示三维体积的相同区域。
可能的应用是对视网膜、尤其是黄斑区的各层的增长的自动研究。被处理过的数据有利于nAMD特征的检测,并提供对于决定nAMD的进一步治疗有用的信息。因此,该方法可用作决策支持工具,以便帮助临床医师评估玻璃体腔内注射的需要。但是,本发明不限于视网膜组织的研究。利用本发明的方法可研究其他生物组织,特别是这些组织的厚度随时间的变化受关注的情况。获得局部误差概率的本发明的方法允许排除假警报并允许使用最大量的图像,甚至那些被局部误差影响的图像。
在这些方法中,对由第一子体积和第二子体积表示的三维体积的区域产生至少两个误差概率值对,每个误差概率值对包括用于第一子体积的误差概率值和用于第二子体积的相应的误差概率值。这允许同时考虑两个图像的误差,并且能将两个图像的误差概率、表示可能的误差的实质差异与至少一个图像比较。
优选地,由每个误差概率值对获得单个局部误差概率值。该单个值是对以下概率的测量值,即两个图像的给定的子体积的比较受成像误差的影响,即其直接涉及被确定的有关生理学的量。
在该方法的优选的实施例中,其包括另外步骤:如果从合并的误差概率值获得的图像数据的全部的量低于阈值,则改变成像设备的使用者。这允许重复成像步骤,以便获得更适于自动分析的图像数据。优选地,合并的误差概率值的确定和总图像质量的评估被准实时地影响,以便使用者(有可能是病人本身或医疗保健专业人员)会收到即时反馈。阈值可是固定值,由合并的误差概率值(例如︰总和、平均值或中值)获得的量与该固定值进行比较。替代性地,机器学习算法,例如支持向量分类(SVC)模型,可用于“适用于自动分析”和“不适用于自动分析”之间的分类。
根据下面的详细说明和全部权利要求,其他有利的实施方式和特征的组合变得明显。
附图说明
用于说明实施例的附图示出︰
图1根据本发明的用于分析图像数据的方法的基本步骤的示意图;
图2由两个不同的时间点的图像数据所表示的生物组织的体积的示意图,该体积包括待用本发明的方法分析的子体积;
图3a)强度梯度的基于体素的距离;b)对应于基于体素的距离的最短距离路径;c)最短距离路径和基准路径之间的区域;和
图4A和4B用来说明用于确定信噪比的方法的OCT图像的提取;
图5A和5B在被分析的图像中提取用来说明用于确定生物组织的失去的元素(element)的方法的OCT图像;
图6A在随后的扫描中获得的图像数据所表示的生物组织的三个子体积的示意图;和
图6B用于说明随后的扫描之间的不连续效果的OCT图像的提取。
在附图中,相同的部件被给予相同的附图标记。
具体实施方式
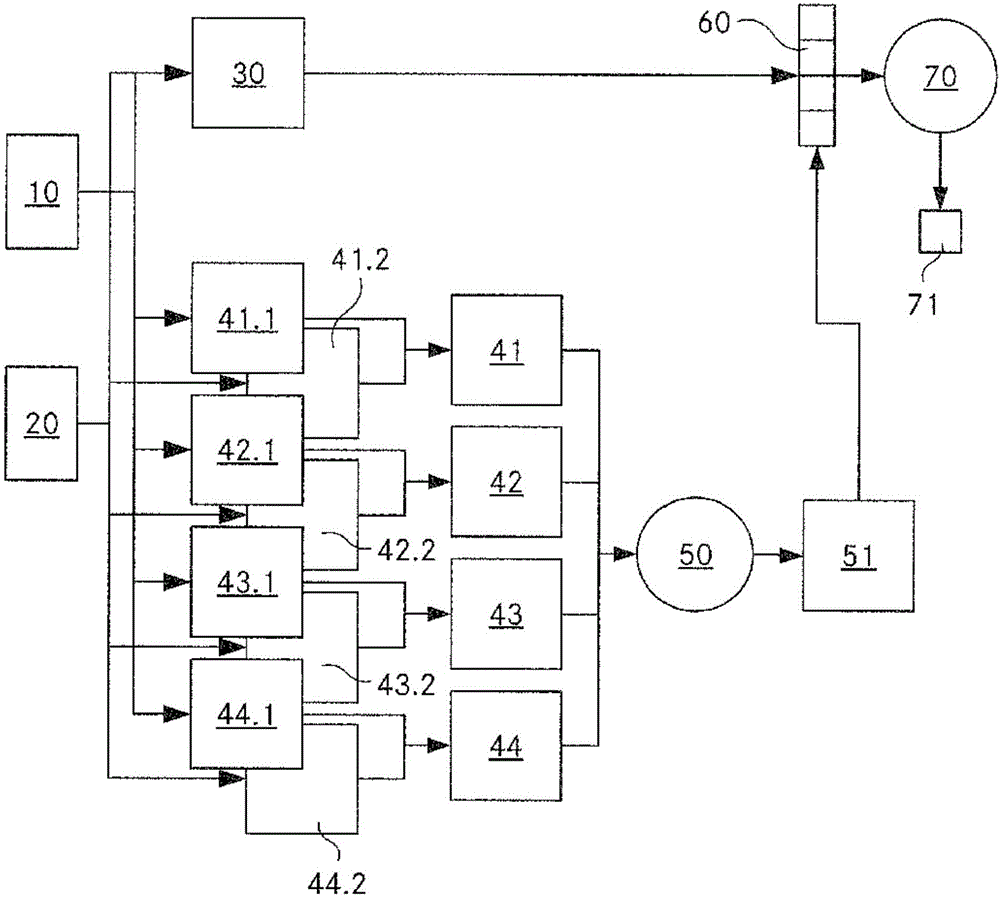
图1是根据本发明的用于分析图像数据的方法的基础步骤的示意图。所述方法用于比较在两个不同时间点获取的生物组织的两个图像10、20。这两个三维图像10、20彼此相比较,以便获得二维差异图30,该二维差异图由各子体积的图像数据的差异有关的数值网格构成。其提供第一时间点和第二时间点之间的给定子体积中的结构变化的幅度(magnitude)相关的信息。在不同子体积中的成像误差的局部概率被计算并构成误差概率图51。该图在根据差异图30计算(全局)特征向量60时被考虑。最后,利用机器学习算法,该特征向量60被映射到期望的全局量(例如全局生长概率71)。
下文中,将参考由人视网膜的黄斑区域获取的、通过光谱域OCT获得的3D OCT图像描述本发明。但是,该方法的基本步骤可应用于生物组织等的其他三维图像。
图2是在不同时间点的图像数据所表示的生物组织的体积的示意图,该生物组织的体积包括待用本发明的方法分析的子体积。首先,在不同时间点、例如在30天的时间间隔获取的表示给定组织的基本相同体积的两个图像10、20被获得。该图像由以规则网格布置的许多体素构成,网格的方向分别表示为x、y和z。两个图像10、20大体记录在冠状平面中,即x-z平面中,这可以利用如今的OCT采集设备来实现,例如,由那些以眼底SLO跟踪为特征的设备(由Heidelberg Engineering公司研发)实现。y轴是深度轴并垂直于冠状平面延伸。
在给定的示例中,将两个体积二次取样为49x49x496的体素以便在(x,z)平面中使数据各向同性。应该注意:这两个体积不必在深度方向、即沿y轴记录。因此,内界膜(ILM)使用基于图割的算法被分成两个体积,该基于图割的算法在Dufour PA,Ceklic L,Abdillahi H等人的Graph-based multi-surface segmentation of OCT data using trained hard and soft constraints(利用受过训练的硬性和软性约束的OCT数据的基于图的多面分割),IEEE Trans Med Imaging 2013;32:531-43描述。其他已知的算法可用于此目的。然后,为了随后的分析,所有的A型扫描沿y轴位移以便将ILM设置为y=0的坐标。
在将来自连续采集的两个A型扫描对齐时,由于采集之间的照明和噪声变化,体素强度的直接比较是不可靠的。作为第一预处理步骤,单位半径的中值滤波器因而被用于去噪。作为第二个预处理步骤,梯度滤波器用于增强主视网膜特征的边界(视网膜层之间的界面、nAMD特征等的边界)。
3D图像是每个A型扫描的比较A型扫描,即获得由第一图像10表示的体积中在坐标(x,z)处的A型扫描11以及获得由第二图像20表示的体积中在坐标(x,z)处的A型扫描21。两个A型扫描11、21是图像10、20所表示的体积的子体积并由具有坐标(x,y,z)的线性的系列体素构成,其中x和z是常数(并且相互比较的子体积是相同的),并且其中A型扫描11、21、即子体积的主延伸部是沿着y方向的。A型扫描11、21然后互相比较,如在下面更详细地描述的。结果是差异图30,该差异图30由与两个图像10、20的各子体积的图像数据之间的差异有关的值的网格构成。
对于两个图像10、20的子体积11、21中的每个子体积,四个不同的误差概率值被确定,它们全部由八个二维误差图41.1、41.2;42.1,42.2;43.1、43.2;44.1,44.2表示。值的确定在下面有详细地描述。但是,通常值处于(0,1)范围内,高的值表示在(x,z)处的各子体积中具有成像误差的概率高。接下来,基于从两个图像10、20获得表示相同类型的误差概率的每一对值,得到单个局部误差概率值,所有的值由二维误差图41、42、43、44表示。为此目的,为了安全起见,值对中的两个值中的较大值将被选择。
接下来,将基于支持向量模型的误差回归50应用于误差图41、42、43、44,产生二维误差概率图51。该图的元素提供有关以下概率的指示,即在给定的位置(x,z)处的确定的结构改变是误差的。
对于误差回归50来说,利用由熟练的专业眼科医生评估的OCT图像的训练数据集,支持向量模型算法已经被训练。根据训练数据集,所有成对的连续的OCT采集已经被省略,在连续的OCT采集中眼科医生观察到视网膜生长。假设专业观察者的评估都是完美的,这意味着在该减小的训练集中应该没有局部视网膜增长被测量到。然而如果通过算法已经探测到局部视网膜增长,那么推测是由于局部视网膜增长评估中的误差,可能是因为OCT体积中的质量问题。事实上,在同一位置处测量到局部质量问题的情况下,在减小的训练集中测量的局部视网膜增长被看作误差概率。所以,SVR被训练为将在位置(x,z)处提取的且在误差图41、42、43、44中储存的四个误差值用作输入和将在位置(x,z)处测量的局部视网膜增长用作期望的输出。在减小的训练集中存在象(x,z)位置那样多的训练样本。
结合图3描述差异图30的生成。
基于滤波图像,对于每一对在各自(x,z)坐标处的A型扫描来说,强度梯度的基于体素的距离被确定,即基准A-扫描11中的每个体素与目标A型扫描21中的每个体素相比较,除非它们的y坐标太远(因此排除明显不可能的分配)。由此产生的距离矩阵31在图3的a)中示出得到的距离矩阵31,其中,轴对于基准A型扫描11来说沿y坐标延伸(y1轴12)并对于目标A型扫描21来说沿y坐标延伸(y2轴22)。在矩阵角部处黑色三角形区域31a、31b是由于|y1-y2|超过一定阈值的区域的排除。在距离矩阵31中的亮线31c对应于视网膜特征的增强边界。
接下来,类似于信号处理中的动态时间规整(DTW)的序列对齐策略应用到待比较的两个A型扫描11、21。基于基于体素的距离矩阵31,利用在与基于体素的距离矩阵31相关的曲线中的已知的Dijkstra算法,发现从ILM33(左下角)到脉络膜34(右上角)在两个A型扫描11、21之间的最小失真路径32。产生的路径32在图3的b)中以与图3的a)相同的坐标示出。它是从ILM33引导到脉络膜34的路径,其中沿该路径由距离矩阵31给出的基于体素的距离值的总和最小。
如果在第一A型扫描中的一个体素与第二A型扫描中的多个体素配对,这可能意味着在那个体素中记载的组织已经在两个采集之间增长,或者流体已经出现在该体素的正下方或正上方。如在图3的b)中能看到的,这种情况在路径32的区域32a中给出。应注意,梯度滤波器的使用迫使主视网膜层在最小扭曲路径32中被对齐。
沿距离矩阵31的对角线35延伸的路径对应于相同图像(没改变)的情况。最小失真路径32超过对角线35上方则表示检测到视网膜的增长。因此,在对角线35上方和最小失真路径32下方的区域36被用作局部视网膜增长分数,见图3的c),其再次使用了与图3的a)和3的b)相同的坐标。
重复上述步骤,只要不是所有(x,z)坐标已经被分析。
其次,基于每个(x,z)的局部视网膜增长分数,差异图30(在本发明的情况下是增长图)通过重复上述步骤被建立。差异图30基本上表示作为x和z坐标函数、即根据冠状平面上的位置的局部视网膜增长分数s(x,z)的值。
下一步,连续体积的全局增长概率被计算。为此目的,考虑到误差概率图51,全局增长特征向量60从视网膜增长图(差异图30)提取。该特征向量60由以下组成:
其中,利用总和或平方和,最先两个特征使局部增长分数s(x,z)(由视网膜增长图给出)平均。最后两个特征是空间自相关特性特征,即Moran's I或Geary's C。后两个特征能将分散或随机的局部增长(这很可能是由于噪声)与nAMD特征出现或增长时通常观察的群生局部增长相区分。为了避免特征向量60受成像误差影响,只有那些增长分数s(x,z)将被考虑,该增长分数涉及其中误差概率图51中的值低于确定的阈值(即误差不大可能发生)的坐标(x,z)。
最后,利用支撑向量分类(SVC)模型70,该全局增长特征向量60被映射到全局增长概率71。SVC也对全局增长概率提供最优临界值。因此,该算法将产生二进制输出︰“增长”或者“没有增长”。如果输出是增长,保健专业人士应进行额外的检查并最终作出治疗决定。
利用由熟练的专业眼科医生评估的OCT图像的训练数据集,SVC算法已经被训练。对SVC模型已经采用标准训练策略:通过两重交叉验证,已经发现参数值(最佳软边缘参数C、最优核函数和最优核函数参数)。然后,利用最优参数集,分级机已经在整个训练集中被训练。在训练集中已有象(x,z)位置那样多的训练样本。
图4A、4B示出用来说明用于确定信噪比的方法的OCT图像的提取。应注意到:为了再现目的,OCT图像示出为反相(inverted),即(黑色)背景显示白色而前景是黑色。在下文中,我们参考非反相图像的特性。
在这种情况下,局部强度分布在邻近RPE的最亮的区域81中和邻近ILM的最亮区域82中的局部强度与表示玻璃体液的区域83中的强度分布相比较。为此目的,首先通过已知的图像分析法、诸如基于图割算法检测RPE和ILM。假设:最亮区域81、82刚好在RPE和ILM下方,并且表示玻璃体液的区域83的图像主要是噪声。
接下来,柯尔莫哥洛夫-斯米尔诺夫算法(Kolmogorov-Smirnov algorithm)应用于相互比较的两个强度分布,即在与相同的A型扫描相关的各区域中的给定数量n个测量强度I1,i、I2,i(i=1,...)根据他们值以升序排列。接下来,经验分布函数计算如下︰
这两个函数相互比较如下︰
di(x,z)=|S1,i(x,z)-S2,i(x,z)|,其中
dmax(x,z)=supidi(x,z)。
这为每个坐标(x,z)产生两个值dmax,一个用于在RPE后面的区域与玻璃体液的比较,而另一个用于在ILM后面的区域与玻璃体液的比较。相同的强度分布产生值dmax=0,即可以假定的是:dmax的较小值表示信噪比高。因此,对于每个A型扫描,dmax的较小值的补集(supplement)可被选择为误差图41.1、41.2的元素,这提供图像的相应部分受噪声影响的概率的测量值。
图4B出了以具有衰减信号的区域80为特征的B型扫描。在给定(x,z)坐标处,各误差图41.1或41.2中的概率值将具有增大的值。
图5A、5B示出在被分析的图像中用来说明用于确定生物组织的失去的元素的方法的OCT图像的提取。而且,为了再现目的,OCT图像被反相,即(黑色)背景显示白色而前景是黑色。在下文中,我们针对非反相图像的特性。
为此目的,相对于图像边界,如上所述确定的ILM位置被考虑。图5A的a)示出以下情况,即位置84a位于所允许的范围85内,而在图5A的b)和c)中,位置84b、84c分别在所允许的范围85前面和后面。通过使用高斯核函数将测量的距离转化为概率,概率的低值赋予到所允许的范围85内的位置。概率被输入误差图42.1、42.2。
图5B示出以区域86为特征的B型扫描,在区域86中邻近ILM的区域由于没对齐而丢失。在给定(x,z)坐标处,各误差图42.1或42.2中的概率值将具有增大的值。
3D OCT图像通过扫描(x,z)平面中的光束而产生。在描述的示例中,光束在其位置沿z方向递增之前沿x轴(扫描方向87)被扫描,以获得进一步的B型扫描。这意味着,沿x方向分开的相邻的A型扫描以非常短的时间间隔被分开,而沿着z方向(即属于不同的B型扫描)分开的A型扫描以明显更长的时间的时间间隔被分开。因此,相比于沿x方向分开的相邻的体积,沿z方向分开的相邻的子体积(例如在图6A中示出的在位置(x,z-1)、(x,z)和(x,z+1)处的三个子体积)之间具有不连续性的风险大得多。
如果两个相邻子体积(A型扫描)之间没有不连续性,那么强度分布类似。但是,如果视网膜和成像设备之间的相对位置在两个A型扫描之间改变,那么强度分布的不连续性上升。没有其他成像误差,相邻的A型扫描就会非常类似,但在y方向相对于彼此偏移。此偏移非常类似于由于视网膜层增长引起的偏移。这就是为什么上述的用于检测这种增长的层的方法基于根据ILM位置在y轴不对齐而预处理的图像可以基本相同的方式也用来检测信号的不连续性。这种方法得到的每一对子体积的分数,即用于在(x,z-1)和(x,z)的子体积的比较以及在(x,z)和(x,z+1)的子体积的比较。分数越高,存在不连续性的概率越大,即只要值合适地归一化,那么其可直接用作误差图43.1、43.2的元素。为考虑负z方向和正z方向的不连续性,分数的平均值被赋予到图43.1或43.2关于在给定(x,z)处的子体积的元素。
图6B示出用于说明随后的扫描之间的不连续效果的OCT图像的提取。提取示出在固定x处的yz平面,即垂直于通常的B型扫描。清晰可见的是具有不连续性的区域88。在给定(x,z)坐标处,各误差图43.1或43.2中的概率值将具有增大的值。
图44.1、44.2包含表示以下概率的值,即在给定的(x,z)处,A型扫描是基本上空的,例如由于成像设备的成像光学方面的未对齐或其他问题。如果图像强度对于在(x,z)处的整个A型扫描来说处于窄的范围之内,那么图像数据被视为是基本空的。在描述的示例中,如果对于整个子体积(有8位强度分辨率)来说图像强度低于下限阈值5,那么第四概率值被分配的值为1。否则,第四概率值被分配的值为0。
图7示出了以基本没有信号的区域89为特征的B型扫描。在给定(x,z)坐标处,各误差图44.1或44.2中的概率值将具有增大的值。
本发明并不限于上述的方法。如上所述,该方法的一些步骤可由替代算法取代。此外,该方法适用于其它组织和源于其他成像技术的图像数据。
总之,应当注意:本发明创建了用于图像数据分析的方法,该方法允许可靠地评估成像数据的适用性以便进行自动分析。
- 还没有人留言评论。精彩留言会获得点赞!