一种图像血管分割方法及装置与流程
本发明涉及医学图像领域,特别涉及血管分割。
背景技术:
血管成像技术包括计算机断层血管造影(CTA)、磁共振血管造影(MRA)等,是一类非常重要的技术,可以帮助医生诊断血管的各种疾病,如钙化、狭窄、动脉瘤等。在血管成像过程中得到的主要是三维图像,其不仅展示血管也同时包含了血管周围的其他组织(例如脂肪、肌肉、骨骼等),并不能给医生直观的感受。因此,将血管从整体三维图像中提取出来,以三维显示技术展示血管的形态,对血管疾病的诊断是非常重要的。
CTA血管提取的技术主要可以分为模型的方法和非模型的方法两大类。模型的方法如可变网格需要先提供一个标准血管模型,然后计算血管的中心线,然后根据此中心线,用单纯网格拟合实际图像中的血管结构,将血管分割出来。此方法虽然可以将血管准确分割出来,但由于网格计算非常复杂,导致分割速度很慢,阻碍了实际应用的推广。
而对于非模型的方法,如Feriman等人采用基于图割的算法实现了颈内动脉的提取。该算法是经过手动确定起始点后,计算起始点之间的迪杰斯特拉(Dijkstra)距离。以该距离为中心,标记血管感兴趣区域。最后通过图割算法,优化感兴趣区域的边界实现血管提取。该算法计算复杂,血管提取速度慢。Hackjoon等人采用基于射线造型(Ray-Casting)的动态追踪实现了穿颅血管的提取。该算法经过手动确定起始点后,通过Ray-Casting向四周放射线,获得血管的边界,再通过椭圆拟合实现血管提取。该方法鲁棒性差,不同数据的血管提取需要不同的参数,同时该方法无法提取旋转跨度很大的椎动脉。
还有一种比较特殊的血管分割技术:血管剪影方法,病人需要同一部位扫描2次(不注射造影剂扫描和注射造影剂扫描),得到非CTA图像和CTA图像。非CTA图像中,血管CT值低,CTA图像中血管CT值升高。这样2种图像配准后相减就可以将血管提取出来。该方法需要对病人扫描2次,比较耗时,同时给病人带来更多的扫描辐射量。
技术实现要素:
本发明要解决的问题是提供一种血管分割的方法和装置,解决以上问题的至少一种。
为解决上述问题,本发明提供了一种血管分割方法,包括:。
由样本图像训练得到血管中心线平均模型;配准待分割图像与所述样本图像的模板图像;将所述血管中心线平均模型映射到待分割图像;基于所述待分割图像的先验知识,调整所述血管中心线平均模型,得到待分割图像的血管中心线;基于所述待分割图像的血管中心线对待分割图像进行血管分割。
优选的,由样本图像训练得到血管中心线平均模型包括:提取样本图像的血管中心线;所述样本图像包括多套样本图像;根据各所述样本图像的血管中心线,生成血管中心线平均模型。所述提取样本图像的血管中心线包括:将样本图像的其中一套作为模板图像,其余样本图像对模板图像进行配准;提取经配准后各样本图像的血管中心线。
优选的,所述根据各样本图像的血管中心线,生成血管中心线平均模型的方法是基于动态形状模型算法进行的。
优选的,在所述由样本图像训练得到血管中心线平均模型后,还包括:基于主成分分析法,确定所述血管中心线平均模型的主要形变方向。
优选的,所述基于待分割图像的先验知识,调整所述血管中心线平均模型,得到待分割图像的血管中心线包括:对血管中心线平均模型设置约束条件;基于待分割图像的先验知识对所述约束条件赋予权值;根据所述权值,调整所述血管中心线平均模型,得到待分割图像的血管中心线。所述待分割图像的先验知识为血管半径,所述约束条件为边界距离场;所述基于先验知识对约束条件赋予权值为对血管半径的预定范围内区域赋予高权值。
优选的,在所述配准前,对待分割图像与模板图像进行初分割。所述分割方法为阈值分割。
为解决上述问题,本发明还提供了一种血管分割装置,包括:第一生成单元,用于由样本图像训练得到血管中心线平均模型;配准单元,用于配准待分割图像与样本图像;映射单元,用于将所述血管中心线平均模型映射到待分割图像;第二生成单元,用于基于先验知识,调整所述血管中心线平均模型,得到待分割图像的血管中心线;分割单元,用于基于所述待分割图像的血管中心线对待分割图像进行血管分割。
与现有技术相比,本发明可以更好的解决血管分割问题,血管分割的更加干净,不会分割到骨头造成分割失败。
附图说明
图1是本发明实施方式影像系统结构示意图;
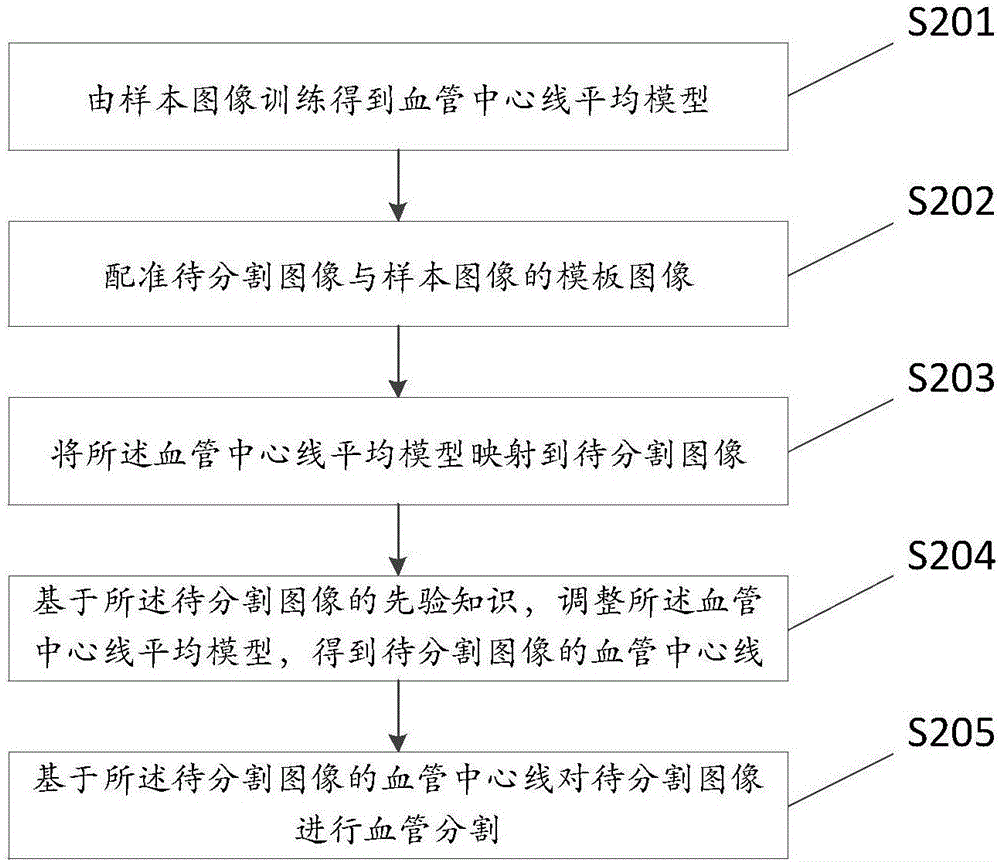
图2是本发明血管分割方法流程图;
图3是本发明血管分割装置结构图。
具体实施方式
为使本发明的上述目的、特征和优点能够更为明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在以下描述中阐述了具体细节以便于充分理解本发明。但是本发明能够以多种不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广。因此本发明不受下面公开的具体实施方式的限制。
图1所示的是一个成像系统100的示意图。在一些实施例中,成像系统100可以对既定目标进行扫描,得到扫描数据和并生成与之相关的图像。在一些实施例中,成像系统100可以对生成的图像进行进一步处理。在一些实施例中,成像系统100可以是一个设备或一个设备组。具体地,成像系统100可以是一个医学成像系统,例如,一个PET(Positron Emission Tomography)设备、一个SPECT(Single-Photon-Emission Computed Tomography)设备、一个CT(Computed Tomography)设备、一个MRI(Magnetic resonance imaging)设备等。进一步地,所述医学成像系统可以是单独使用,也可以结合使用。例如,一个PET-CT设备、一个PET-MRI设备或一个SPECT-MRI设备等。
成像系统100可以包括一个腔体110、一个床架120、一个高压发生器130、一个操作控制计算机设备140、一个图像生成器150、和一个控制显示设备160。腔体110内部可以收容用来产生和检测放射性射线的组件。在一些实施例中,腔体110可以收容一个辐射发生器180和一个探测器170。辐射发生器180可以发射放射性射线。放射性射线可以发射到置于腔体110中的物体处,并透过物体被探测器170接收。作为示例,所述辐射发生器180可以是一个X射线管。X射线管可以发射X射线,该射线透过置于腔体110内部的物体,并被探测器170接收。在一些实施例中,探测器170可以是圆形探测器、方形探测器、或弧形探测器等。所述弧形探测器的旋转角度可以是在0度到360度之间。在一些实施例中,弧形探测器的旋转角度可以是固定不变的。在一些实施例中,弧形探测器的旋转角度可以根据需要调整。例如,可以根据所需要的图像的分辨率、图像的大小、探测器的灵敏度、探测器的稳定性或其中的一种或者几种的组合,进行调整。在一些实施例中,探测器170可以是一维探测器、二维探测器、或三维探测器。
床架120可以支撑待检测的物体(例如待检测的病人)。在一些实施例中,床架120可以在检测过程中在腔体110内部移动。如图1所示,在检测过程中,床架120可以沿Z轴方向移动。根据检测的需要,病人可以仰卧、俯卧、头部在前或脚部在前。在一些实施例中,床架120可以以恒定的速度在腔体110内部移动。床架120移动的速度可以和扫描时间、扫描区域等因素相关。在一些实施例中,床架120移动的速度可以是系统默认值,也可以由用户设定。
高压发生器130可以产生高压或者强电流。在一些实施例中,所产生的高压或强电流可以传输至辐射发生器180。所产生的高压可以是80kV-140kV、75Kv-150kV或120kV-140kV。所产生的电流可以是20mA-500mA。
操作控制计算机设备140可以与腔体110、辐射发生器180、探测器170、高压发生器130、床架120、图像生成器150和/或控制显示设备160相关联。上述设备之间可以通过直接或者间接的方式相连接。在一些实施例中,操作控制计算机设备140可以控制腔体110旋转至某一位置。该位置可以是系统默认值,也可以由用户(例如医生、护士等)设定。在一些实施例中,操作控制计算机设备140可以控制高压发生器130。例如,操作控制计算机设备140可以控制高压生成器130产生的电压或电流的强度。在一些实施例中,操作控制计算机设备140可以控制显示设备160。例如,操作控制计算机设备140可以控制与显示相关的参数。所述参数可以包括显示尺寸、显示比例、显示顺序、显示数量等。作为示例,可以控制显示图像的整体或部分。作为又一示例,可以将一个图像分为几个子图(例如头部子图、颈部子图、下肢子图等),同时或依次显示几个子图。作为进一步示例,可以放大或缩小某个图像。
图像生成器150可以生成图像。在一些实施例中,图像生成器150可以进行图像预处理、图像重建、和/或血管提取等操作。图像生成器150可以和探测器170、操作控制计算机设备140、显示设备160和/或外部数据源(图中未体现)相关联。在一些实施例中,图像生成器150可以从探测器170或者外部数据源接收数据,并基于所接收的数据生成图像。所述的外部数据源可以是硬盘、软盘、随机存储器(random access memory,RAM)、动态随机存储器(dynamic random access memory,DRAM)、静态随机存储器(static random access memory,SRAM)、磁泡存储器(bubble memory)、薄膜存储器(thin film memory)、磁镀线存储器(magnetic plated wire memory)、相变存储器(phase change memory)、闪速存储器(flash memory)、云盘(a cloud disk)等中的一种或多种。在一些实施例中,图像生成器150可以将生成的图像传送至显示设备160进行显示。
显示设备160可以显示所接收的数据或图像。显示设备160可以和操作控制计算机设备140和图像生成器150相连接。在一些实施例中,显示设备160可以显示由图像生成器150所生成的图像。在一些实施例中,显示设备160可以向图像生成器150和/或操作控制计算机设备140发送指令。例如,用户可以通过显示设备160设置成像参数,该成像参数可以发送至操作控制计算机设备140。所述成像参数可以包括数据采集参数和图像重建参数等。其中,数据采集参数可以包括扫描时间、扫描目标定位信息、机架的旋转速度、电压/电流的强度等中一个或多个。图像重建参数可以包括重建视场、重建矩阵、重建算法等中的一个或多个。
需要说明的是,以上对于成像系统100的描述,仅为描述方便,并不能把本申请限制在所举实施例范围之内。可以理解,对于本领域的技术人员来说,在了解该系统的原理后,可能在不背离这一原理的情况下,对各个模块进行任意组合,或者构成子系统与其他模块连接,对实施上述方法和系统的应用领域形式和细节上的各种修正和改变。
图2是本发明血管分割方法的流程图,参见图2。
步骤S201,由样本图像训练得到血管平均模型。
具体的,作为示例,样本图像可以是很多套样本图像,每套样本图像都是三维图像数据。首先提取样本图像中的血管,然后以其中一套样本图像作为模板图像,剩余其他样本图像向模板图像进行配准。例如,可以对血管进行二值图像配准。
接着可以提取样本图像中的血管中心线,并对血管中心线进行采样,例如可以进行密集采样,获得多个血管中心线采样点。在一些实施例中,假设有M套样本图像,那么M套样本图像中的M条血管中心线可以对应M个训练样本。每一个训练样本中可以包含多个中心线采样点。
之后可以确定血管中心线平均模型。在一些实施例中,可以将采集的中心线采样点,基于动态形状模型(Active Shape Model,ASM)算法,得到血管中心线平均模型。在此处所述ASM算法是建立在点分布模型的基础上,通过训练样本图像,获取样本图像中样本点分布的统计信息。进一步地,还可以获得所述样本点可能的变化方向,从而实现在待分割图像上寻找与样本点对应的特征点位置。
在一些实施例中,每一套样本图像中的血管中心线可以对应一个中心线形状向量。多套样本图像的多条血管中心线对应的多个中心线形状向量可以组成一个训练集。在一些实施例中,可以对从样本图像中提取到的血管中心线对应的中心线形状向量进行对齐操作。此处所述对齐操作的主要目的是减少由于图像大小不同、距离远近等外界因素造成的非形状干扰,使不同样本中相对应的点之间具有可比性。
具体地,作为示例,对齐操作具体过程如下:1、对于M个训练样本,任选一个样本作为参考样本,该参考样本的中心线形状向量为参考形状向量。将训练集中所有中心线形状向量对齐到该参考样本形状向量;2、计算中心线平均形状向量。3、将所有中心线形状向量对齐到中心线平均形状向量,进一步计算新的中心线平均形状向量。4、将所有的中心线形状向量对齐到新的中心线平均形状向量。如此重复直到达到收敛,最终得到一个中心线平均模型。
进一步地,在一些实施例中,对中心线形状向量作对齐操作处理之后,可以利用主成分分析(Principal Component Analysis,PCA)方法得到形状变化的主方向和规律。基于上述所得到的平均形状向量,可以计算数据的协方差矩阵。还可以进一步计算出协方差矩阵的特征值和特征向量,并将特征值按降序排列。运用主成分分析的方法,提取协方差矩阵中的前k个特征值及对应的特征向量。进一步根据所述特征值及特征向量构造出训练样本的统计形状模型,得到一个形状参数,用来控制采样点的形状变化。
步骤S202,可以配准待分割图像与样本图像的模板图像。
步骤S203,可以将血管中心线平均模型映射到待分割图像。在一些实施例中,对于待分割图像,可以做一个初步的基于阈值的血管分割,分割出血管的大致轮廓和血管边缘,得到血管初步分割结果。对样本图像也进行一个初步的阈值分割,将模板图像的二值图像向待分割图像的相应二值图像进行配准,同时将血管中心线平均模型映射到待分割图像。
步骤S204,可以基于待分割图像的先验知识,调整血管中心线平均模型,得到待分割图像的血管中心线。
具体可以采用对血管中心线平均模型设置约束条件的方式进行,由待分割图像的先验知识对约束条件赋予权值,即可以是对符合先验知识的约束条件赋予高权值,对不符合先验知识的约束条件赋予低权值。由已经赋值的约束条件来对血管中心线平均模型进行约束调整,从而得到待分割图像的血管中心线。
约束条件可以是设定边界距离场。这里的距离场指对图像中的一个或多个像素点定义一个距离值,图像中一个或多个像素点的距离值就形成了一个距离场。在一些实施例中,可以利用血管初步分割结果得到的血管边缘,对映射得到的待分割图像的血管中心线上的每一个特征点计算出一个距离值。具体地,由于一条血管具有左右两个边缘,对于某个特征点其距离值可以有两个,分别为距离血管左边缘的距离和距离右边缘的距离,可以取其中较小的距离值作为该特征点的距离值。距离场中的距离值的大小反映了该点距离血管中心的程度。在一个设定好的距离场中,距离值大的点比距离值小的点更接近于血管的中心位置。
进一步的,对于局部的区域内比如5*5的像素区域范围内,利用主成分分析对5*5范围内的灰度特征分布生成一些特征向量,在需要对中心线上的点移动的时候,就利用这些特征向量计算每个候选点的马氏距离,将中心线上特征点移到距离最大的候选点。
之后可以根据距离场调整待分割图像的血管中心线(即调整中心线平均模型)。所述调整操作可以实现对已提取的血管中心线的修正。在一些实施例中,对之前得到的距离场,根据一个先验知识(例如,血管的半径),对距离值越接近先验信息特征点,赋予的权值越高。也可以是对距离值在血管半径一定范围内的点都赋予高权值。利用该权值,结合ASM算法中形状参数的约束,调整中心线平均模型,将映射得到的血管中心线向距离边界较远的方向不断移动,最后使其收敛到血管中心。具体的在调整中心线时,一方面中心线上的每个特征点可以在垂直于中心线切线的平面上移动到权值最大的点,另一方面对每个特征点移动到的新位置,可以利用主成分分析得到的中心线形变的约束,进行调整,得到一次迭代中心线新的位置。
步骤S205,可以根据待分割图像的血管中心线,进行待分割图像的血管分割。
在血管分割方法的基础上,如图3所示,本发明还提供了一种血管分割装置300,包括:
第一生成单元301,用于由样本图像训练得到血管中心线平均模型。
配准单元302,用于配准待分割图像与样本图像。
映射单元303,用于将所述血管中心线平均模型映射到待分割图像。
第二生成单元304,用于基于先验知识,调整所述血管中心线平均模型,得到待分割图像的血管中心线。
分割单元305,用于基于所述待分割图像的血管中心线对待分割图像进行血管分割。
血管分割装置的实施方式可参考血管分割方法的具体实施方式,这里不再一一赘述。
本发明虽然已以较佳实施例公开如上,但其并不是用来限定本发明,任何本领域技术人员在不脱离本发明的精神和范围内,都可以利用上述揭示的方法和技术内容对本发明技术方案做出可能的变动和修改,因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化及修饰,均属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!