一种基于核酸的生物逻辑门与逻辑电路的构建方法与流程
本发明涉及计算生物学的研究领域,具体为一种基于核酸的生物逻辑门与逻辑电路的构建方法。
背景技术:
计算生物学(computationalbiology)是生物学的一个分支。根据美国国家卫生研究所(nih)的定义,它是指开发和应用数据分析及理论的方法、数学建模和计算机仿真技术,用于生物学、行为学和社会群体系统的研究的一门学科。英国著名的数学家和逻辑学家,计算机逻辑的奠基者阿兰·麦席森·图灵(alanmathisonturing,1912-1957),曾指出,向日葵螺旋数目是一个fibonacci数字,而且动物皮肤的形成模式也可以被描述为一种反应扩散模型(reactiondiffusionmodel),当时图灵缺乏数据以及计算能力建立这一模型。随着科技的发展,今天我们可以获取大量的数据,计算能力也大幅度提高,因此可以从新的观点来分析生命的机制。
如果将生命体看成一架极其精密的机器,那么每个生命活动,诸如蛋白质表达、细胞间的信号传送,都可以通过计算机的模拟计算来重现。计算生物学使得传统生命研究走向定量化、精确化,而且可以在系统层面上进行观察研究,更能够深入的剖析在机器和生物机体之间是否存在根本的差异的问题。
目前英国伦敦帝国理工学院的研究人员曾利用肠道细菌和dna片段成功地构建出了可用于处理信息的“生物逻辑门”,但是由于需要细菌媒介以及外界酶参与需求等因素的影响导致其实际应用性不强。
逻辑门是计算机的基础,它是一种对输入的信息进行逻辑运算,然后输出信息的装置。通过对不同的逻辑门进行各种组合,就可以搭建出复杂的计算机电路。本专利中通过我们所特殊设计的核酸序列结构可以在不需要外界催化剂、酶与细菌等因素的参与下,高效快捷的复制出当前计算机所用电路逻辑门相似的生物逻辑门,并成功的将其串联形成逻辑电路,这一成果能够推动研发出新一代的生物计算机,并将其推广到生物信息处理应用中去。
技术实现要素:
本发明所解决的技术问题在于提供一种基于核酸的生物逻辑门与逻辑电路的构建方法,以解决上述背景技术中的缺点。
本发明所解决的技术问题采用以下技术方案来实现:一种基于核酸的生物逻辑门与逻辑电路的构建方法,包括以下步骤:
(a)利用提取试剂盒从肿瘤细胞中提取出具有标志性作用的micro-rna;micro-rna为mir-21、mir-182、mir-195。
(b)将构成逻辑门的底链核酸与表面羧基修饰的磁珠混合,使用浓度为0.2mol/l的nhs将底链核酸上修饰的氨基进行活化,使浓度为用0.8mol/l的edc使磁珠表面上修饰的羧基进行活化,edc与nhs两者共同作用,促进羧基与氨基间缩合反应的进行,通过缩合反应,利用肽键将两者链接在一起;所述的nhs(n-羟基琥珀酰亚胺)使用浓度为0.2mol/l,edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)使用浓度为0.8mol/l,其所述的nhs(n-羟基琥珀酰亚胺)使用浓度为0.2mol/l,edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)使用浓度为0.8mol/l,其所述的反应条件为edc常温活化羧基修饰磁珠30分钟后,加入底链核酸37℃摇床振荡反应12小时。
(c)利用磁力架将溶液中未链接的底链核酸与磁珠进行分离,反复清洗三次后加入信号链,利用碱基的互补作用使信号链与底链结合,形成运算模块,同时利用磁性分离技术将未结合的信号链进行分离,使用缓冲液反复清洗三次待用;所采用的底链和信号链的比例为1:2,反应条件为37℃下振荡反应1小时。
(d)加入输入链micro-rna,在反应温度为37℃下反应2小时,反应使用的缓冲液为ph=7.5、浓度为0.8mol/l的tris缓冲液;反应过程中,由于输入链与底链的碱基互补配对数要大于信号链与底链的碱基互补配对数,便可以利用链取代技术实现输入链micro-rna对信号链的取代,之后利用磁性分离技术将取代下来的信号链与运算模块分离,并使用缓冲液反复清洗三次待用;micro-rna量与与运算模块的体积比为2:1。
(e)在一定的反应条件下,将清洗好的信号链与hemin混合,在hepes缓冲体系下于95℃下恒温振荡5min后缓慢冷却至室温,随后置于37℃的摇床中振荡反应1小时,使其形成具有催化作用的g-四联体结构;之后储存于25℃环境下待用;所采用的hemin浓度为7x10-7mol/l且与hepes缓冲液体积比为1:12。
(f)将形成的g-四联体结构加入abts-h2o2体系中去,其反应环境为ph=7.5浓度为0.8mol/l的tris缓冲体系,加入比色皿中,检测样品在特定时间内,在414nm波长下的吸收情况,并对应逻辑运算中的真与假;g-四联体、h2o2、abts的用量体积为1:2:2,其中h2o2和abts的用量均为2mmol/l。
(g)将所构建的的每一个独立的逻辑门串联组合形成逻辑电路,电路组合方式为yes门与or门串联后并联and门。
以经过特殊设计的核酸序列为基础,通过链取代与磁性分离技术,实现信号的输入/运算和输出信号链的分离,之后利用游离信号链在一定实验条件下,形成具有催化作用的g-四链体结构,催化h2o2对abts的氧化反应,使之生成在414nm波长下具有特征吸收的abts+,通过对其前后紫外吸收情况的检测分析即可得出输出信号的真或假(tureorfalse)对应计算机二进制中的0或1。在此基础之上,我们进一步明确了最佳反应条件,此方法运算效率高,抗干扰性强,就有广泛的应用前景。
附图说明
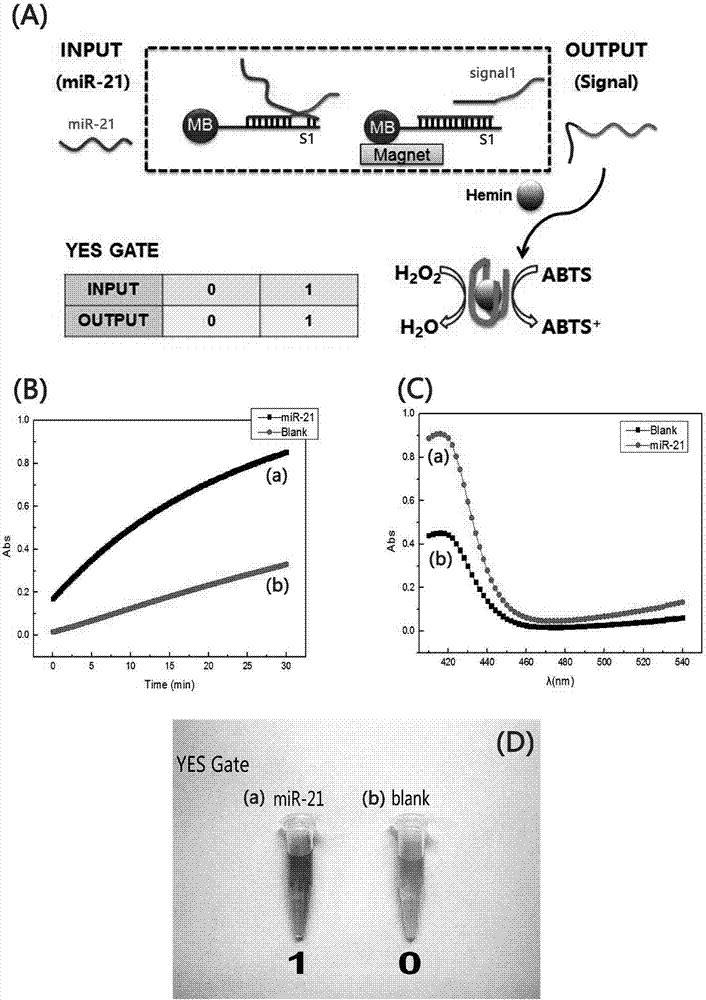
附图1为发明设计过程原理图。从细胞中提取的micro-rna作为输入信号源,经过运算模块的运算,最后以特定时间内吸光度变化的形式进行输出;
附图2为yes门的过程原理,实验数据、布尔逻辑表以及可视化的输出结果;
附图3为and门的过程原理,实验数据、布尔逻辑表以及可视化的输出结果;
附图4为or门的过程原理,实验数据、布尔逻辑表以及可视化的输出结果;
附图5为组合电路的过程原理,实验数据、布尔逻辑表以及可视化的输出结果;
附图6为碱基错配图,所构建的逻辑门对特定输入micro-rna有良好的选择性。
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体图示,进一步阐述本发明。
一种基于核酸的生物逻辑门与逻辑电路的构建方法,其主要的技术手段为两个部分:
(一)通过设计核酸链结构,利用输入链与底链的碱基互补配对数要大于信号链与底链的碱基互补配对数的方法,来实现链取代技术;
(二)使用edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)与nhs(n-羟基琥珀酰亚胺)来活化氨基修饰的核酸与表面羧基修饰的磁珠,促进羧基与氨基的缩合反应,使磁珠与底链连接在一起,利用磁珠与强磁铁间的磁力作用,实现磁性分离的目的;
逻辑门的构建整体分为提取、运算、输出三个部分,首先我们使用分离试剂盒对hela细胞中的microrna进行了提取,之后将其作为输入信号进入逻辑运算模块,输出结果利用hemin与g-四联体形成的具有催化作用的dna模拟酶结构,来催化h2o2对显色剂abts的氧化,随着氧化产物abts+的增多,溶液414nm波长下吸光度亦增强,进而实现信号的输出与microrna含量的检测。
本发明中的底链是指与表面羧基修饰的磁珠(具有磁性的微小粒子),通过羧基与氨基发生缩合反应来链接的核酸序列,输入链是指mir-21、mir-182、mir-195四种肿瘤细胞中可以作为标志物的microrna,信号链是指被输入链所竞争下来的,富含g碱基,可以形成g-四链体结构的核酸序列。
本发明所提供的方法包括以下步骤:
1)利用提取试剂盒从肿瘤细胞中提取出具有标志性作用的micro-rna。
首先使用试剂盒提供的裂解液将肿瘤细胞裂解,之后使用试剂盒提供的分离柱进行对micro-rna的富集与分离,其原理是基于micro-rna的poly(a)粘性末端与分离柱的内滤网纤维的粘附作用,之后使用洗脱液进行洗脱。
2)将构成逻辑门的底链核酸与表面羧基修饰的磁珠混合,使用浓度为0.2mol/l的nhs将底链核酸上修饰的氨基进行活化,使浓度为用0.8mol/l的edc使磁珠上修饰的羧基进行活化,edc与nhs两者共同作用,促进所以与氨基间缩合反应的进行,通过缩合反应,利用肽键将两者链接在一起;所述的方法,其所述的nhs(n-羟基琥珀酰亚胺)最佳使用浓度为0.2mol/l,edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)最佳使用浓度为0.8mol/l。
3)利用磁力架将溶液中未链接的底链核酸与磁珠进行分离,反复清洗三次后加入信号链,利用碱基的互补作用使信号链与底链结合,形成运算模块,同时利用磁性分离技术将未结合的信号链进行分离,保留由于磁力作用聚集在离心管底部的运算模块,并使用缓冲液反复清洗三次待用;
4)加入输入链micro-rna,在反应温度为37℃下反应2小时,反应使用的缓冲液为ph=7.5、浓度为0.8mol/l的tris缓冲液;反应过程中,由于输入链与底链的碱基互补配对数要大于信号链与底链的碱基互补配对数,便可以利用链取代技术实现输入链micro-rna对信号链的取代,之后利用磁性分离技术将取代下来的信号链与运算模块分离,运算模块由于底链与磁珠相连,将会和磁力架上的磁铁由于磁力作用吸附在一起,信号链则游离于溶液中,取上清液到新的离心管中,并使用缓冲液反复磁分离清洗三次待用;
5)将清洗好的信号链与hemin混合,在hepes缓冲体系下于95℃下恒温振荡5min后缓慢冷却至室温,随后置于37℃的摇床中振荡反应1小时,使其形成具有催化作用的g-四联体结构,之后储存于25℃环境下待用;
6)将形成的g-四联体结构加入abts-h2o2体系中去,其反应环境为ph=7.5浓度为0.8mol/l的tris缓冲体系,加入比色皿中,检测样品在特定时间内,在414nm波长下的吸收情况,并对应逻辑运算中的真与假;
7)将所构建的的每一个独立的逻辑门串联组合形成逻辑电路。
实施例:yes门的构建
一、使用试剂盒对肿瘤细胞中的micro-rna进行提取,并将其作为信号输入链。
二、运算模块的构建与运算。
(1)运算模块底链的建立
运算模块底链(s-mbs)由底链核酸序列(s)与磁珠(mbs)连接而成,其制备方法为将20μl(10-6m)的dna加入已用200μledc(0.8m)活化30分钟的羧基修饰磁珠中,再加入200μlnhs(0.2m),在37℃下反应12小时,之后利用磁力架进行磁性分离,去除上层未链接磁珠的含有底链核酸序列的清液,保留吸附的磁性成分,使用ph=7.5的tris缓冲液反复洗涤3次以备后续使用。
(2)运算模块信号链的加入。
取10μl洗涤后的运算模块底链,向其中加入20μl的信号链(signal),然后在37℃荡床条件下反应1小时,利用碱基的配对效应使之结合在一起,之后利用磁力架进行磁性分离,去除上层未与运算模块底链结合的信号链的清液,所保留的磁性吸附成分即是运算模块(signal-s-mbs),使用ph=7.5的tris缓冲液反复洗涤3次以备后续使用。
三、逻辑运算。
(1)加入输入链进行运算。
取10μl洗涤净的运算模块,向其中加入20μl提取的micro-rna,在37℃荡床条件下反应2小时,利用链取代技术使输入链将信号链从底链上取代下来,之后利用磁力架进行磁性分离,去除下层磁性成分,保留含有游离信号链的上清液,使用ph=7.5的tris缓冲液反复洗涤3次以备后续使用。
四、信号输出。
(1)g-四联体结构的形成。
取10μl清洗后的信号链,加入250μl的tris缓冲液,在水浴箱95℃下恒温5min后,取出冷却至室温,加入20μl7x10-7m的hemin与230μl的hepes缓冲液,在37℃荡床条件下反应1小时后储存于25℃备用。
(2)414nm吸收情况的检测
向比色皿中依次加入100μlg-四联体和200μlh2o2(2mm)与200μlabts(2mm),最后加入tris缓冲液定容至2ml,后检测30分钟内的波长吸收情况,并对比与未输入信号链空白组终值,高于其10%,即可认定为结果为真(1),反之为假(0)。
以下为本技术中所涉及的核酸序列
dnasequence(5′-3′)
yes门底链
tcaacatcagtctgataagcta-nh2
or门底链
ggctcaacatcagtctgataagctatgatagcagcacagaaaatttttt-nh2
and门底链
ggctagcttatcagactgattgaagtgtgagttctaccattgccaaaaaatttttt-nh2
yes门信号链
tagcttatcagactgatcactttgggtagggcgggttggg
or门信号链1
gccaatatttctgtgctgctatcatagcttatcagaccactttgggtagggcgggttggg
or门信号链2
tcaacatcagtctgataagctacactttgggtagggcgggttggg
and门信号链
tttggcaatggtagaactctttgggtagggcgggttggg
组合电路yes门底链
tcaacatcagtctgataagctatttttt-nh2
组合电路and门底链
agtgtgagttctaccattgccaaatttagcagcacagaaattttttt-nh2
组合电路or门底链
agaggtctgataagctatgtggcaatggtagaacttttttt-nh2
组合电路yes门信号链
tagcttatcagacttcgatg
组合电路and门信号链
gccaatatttctgtgctgctaaattcatggcaatggtagaact
组合电路or门信号链1
cactttgggtagggcgggttgggtagcttatcagac
组合电路or门信号链2
cactttgggtagggcgggttgggagttctaccattgccatgaatt
以上显示和描述了本发明的基本原理和主要特征及本发明的优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内,本发明要求保护范围由所附的权利要求书及其等效物界定。
sequencelisting
<110>青岛科技大学
<120>一种基于核酸的生物逻辑门与逻辑电路的构建方法
<130>2017
<160>14
<170>patentinversion3.5
<210>1
<211>24
<212>dna
<213>人工序列
<220>
<221>misc_feature
<222>(23)..(23)
<223>nisa,c,g,ort
<400>1
tcaacatcagtctgataagctanh24
<210>2
<211>51
<212>dna
<213>人工序列
<220>
<221>misc_feature
<222>(50)..(50)
<223>nisa,c,g,ort
<400>2
ggctcaacatcagtctgataagctatgatagcagcacagaaaattttttnh51
<210>3
<211>58
<212>dna
<213>人工序列
<220>
<221>misc_feature
<222>(57)..(57)
<223>nisa,c,g,ort
<400>3
ggctagcttatcagactgattgaagtgtgagttctaccattgccaaaaaattttttnh58
<210>4
<211>40
<212>dna
<213>人工序列
<400>4
tagcttatcagactgatcactttgggtagggcgggttggg40
<210>5
<211>60
<212>dna
<213>人工序列
<400>5
gccaatatttctgtgctgctatcatagcttatcagaccactttgggtagggcgggttggg60
<210>6
<211>45
<212>dna
<213>人工序列
<400>6
tcaacatcagtctgataagctacactttgggtagggcgggttggg45
<210>7
<211>39
<212>dna
<213>人工序列
<400>7
tttggcaatggtagaactctttgggtagggcgggttggg39
<210>8
<211>30
<212>dna
<213>人工序列
<220>
<221>misc_feature
<222>(29)..(29)
<223>nisa,c,g,ort
<400>8
tcaacatcagtctgataagctattttttnh30
<210>9
<211>49
<212>dna
<213>人工序列
<220>
<221>misc_feature
<222>(48)..(48)
<223>nisa,c,g,ort
<400>9
agtgtgagttctaccattgccaaatttagcagcacagaaatttttttnh49
<210>10
<211>43
<212>dna
<213>人工序列
<220>
<221>misc_feature
<222>(42)..(42)
<223>nisa,c,g,ort
<400>10
agaggtctgataagctatgtggcaatggtagaactttttttnh43
<210>11
<211>20
<212>dna
<213>人工序列
<400>11
tagcttatcagacttcgatg20
<210>12
<211>43
<212>dna
<213>人工序列
<400>12
gccaatatttctgtgctgctaaattcatggcaatggtagaact43
<210>13
<211>36
<212>dna
<213>人工序列
<400>13
cactttgggtagggcgggttgggtagcttatcagac36
<210>14
<211>45
<212>dna
<213>人工序列
<400>14
cactttgggtagggcgggttgggagttctaccattgccatgaatt45
- 还没有人留言评论。精彩留言会获得点赞!