医学影像分割模型训练方法、分割方法及装置与流程
本发明涉及图像处理技术领域,尤其涉及一种医学影像分割模型训练方法、分割方法及装置。
背景技术:
在计算机辅助诊疗的医学图像分析阶段,语义分割通常是一个基础任务。由于医学图像的特殊性质,其分割任务具有一定挑战性和复杂性。由于高人力成本和时间消耗,手动分割已经逐渐被自动分割所取代。
现阶段深度学习方法被广泛应用于医学图像分割,在图像分割的稳定性和准确性方面取得了极大的成就。但是,深度学习对于训练数据的要求是极高的,为了获得优秀的图片分割处理效果,往往需要大量的数据用于前期训练,但是大量的训练数据具有极大的人工标注成本,并且在医学领域这往往涉及到病患隐私,大量获取临床数据容易引起法律纠纷。因此,医学图像分割处理的模型训练过程中,往往训练数据是极其有限的,这直接导致了训练产生的模型达不到分割要求,无法完成图像分割任务。
技术实现要素:
本发明实施例提供了一种医学影像分割模型训练方法、分割方法及装置,以消除医学图像分割处理过程中由于样本较小导致的分割精度和稳定性低的问题。
本发明的技术方案如下:
一方面,本发明提供一种医学影像分割模型训练方法,包括:
获取多个批次源域训练数据,每个批次源域训练数据均包含一组支持集和一组查询集,所述支持集和所述查询集包含多个医学影像,所述医学影像中标记指定人体器官的区块作为标签;其中,每个批次源域训练数据仅包含一种人体器官的标签;
获取预设的基准模型,在一个内循环中,所述基准模型利用单个批次源域训练数据中的支持集进行k步梯度下降由第一模型参数集得到第二模型参数集,再经过查询集经一步梯度下降得到第三模型参数集;在一个外循环中,以原基准模型的第一模型参数集为起点,以第三模型参数集为更新方向,按设定步长、学习率和周期数更新得到第四模型参数集;利用各批次源域训练数据按照内循环和外循环的步骤对所述基准模型连续训练,得到源域分割模型;其中,k为自然数;
获取目标域训练数据,所述目标域训练数据包含多个医学影像,并标记目标人体器官的区块作为标签;
采用层冻结迁移的方法利用目标域训练数据对所述源域分割模型进行训练,得到目标域分割模型。
在一些实施例中,所述基准模型为u-net网络。
在一些实施例中,所述外循环中所述u-net网络的学习率设置为1e-3,步长设置为0.4,周期数为300,所述内循环中k取3。
在一些实施例中,所述u-net网络采用交叉熵函数作为损失函数。
在一些实施例中,所述u-net网络包含编码器、解码器和跳跃连接三部分,所述编码器包含四个下采样模块,每个下采样模块包含两个3×3卷积层,每个卷积层紧跟一个批量归一化层和一个修正线性单元,在下采样模块末尾为步长为2的2×2最大池化层;所述解码器包含四个上采样模块以及一个激活函数层,每个上采样模块包含一个2×2的转置卷积层,两个3×3卷积层,每个卷积层紧跟一个批量归一化层和一个修正线性单元;跳跃用于连接同一深度下采样模块的最大池化层之前的特征图与上采样模块中转置卷积层输出的特征图。
在一些实施例中,采用层冻结迁移的方法利用目标域训练数据对所述源域分割模型进行训练,得到目标域分割模型,包括:
冻结所述编码器中的前两个下采样模块,以1e-3的学习率在目标域训练数据上微调;
解冻所述编码器中的第二个下采样模块,以1e-3的初始学习率以及0.0077的衰减率再次在目标域训练数据上微调;
解冻所述编码器中的前两个下采样模块,以1e-3的学习率在目标域训练数据上微调。
在一些实施例中,对各批次源域训练数据中支持集的医学影像进行数据增强处理,包括0至180度的随机角度翻转、图像平移、横切变换和/或图像拉伸。
另一方面,本发明还提供一种医学影像分割方法,包括:
获取待分割处理的医学影像,并按照预设尺寸进行图像裁剪;
将裁剪后的待分割处理的医学影像输入至如上述的医学影像分割模型训练方法中得到的目标域分割模型,以输出分割结果。
另一方面,本发明还提供一种电子设备,包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述程序时实现如上述方法的步骤。
另一方面,本发明还提供一种计算机可读存储介质,其上存储有计算机程序,其特征在于,该程序被处理器执行时实现上述方法的步骤。
本发明的有益效果至少是:
本发明所述医学影像分割模型训练方法、分割方法及装置中,所述医学影像分割模型训练方法在源域通基于元学习的方式,在源域内循环中利用支持集和查询集连续调节模型参数,在外循环中基于查询集的模型参数作为更新方向调节原始的基础模型,通过多批次的源域训练数据连续训练得到对目标域任务变化敏感的模型参数。在将源域分割模型迁移到目标域时,能够更好地适应目标域的新任务,提高泛化效果。
本发明的附加优点、目的,以及特征将在下面的描述中将部分地加以阐述,且将对于本领域普通技术人员在研究下文后部分地变得明显,或者可以根据本发明的实践而获知。本发明的目的和其它优点可以通过在书面说明及其权利要求书以及附图中具体指出的结构实现到并获得。
本领域技术人员将会理解的是,能够用本发明实现的目的和优点不限于以上具体所述,并且根据以下详细说明将更清楚地理解本发明能够实现的上述和其他目的。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本申请的一部分,并不构成对本发明的限定。在附图中:
图1为本发明一实施例所述医学影像分割模型训练方法的逻辑示意图;
图2为本发明一实施例所述医学影像分割模型训练方法的模型训练逻辑示意图;
图3为本发明一实施例所述医学影像分割模型训练方法采用的u-net结构示意图;
图4为多源域i预训练、reptile、maml以及本申请目标域分割模型在盲肠少样本场景下损失函数的收敛图像;
图5为reptile、maml以及本申请目标域分割模型的损失和梯度传递示意图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施方式和附图,对本发明做进一步详细说明。在此,本发明的示意性实施方式及其说明用于解释本发明,但并不作为对本发明的限定。
在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明,在附图中仅仅示出了与根据本发明的方案密切相关的结构和/或处理步骤,而省略了与本发明关系不大的其他细节。
应该强调,术语“包括/包含”在本文使用时指特征、要素、步骤或组件的存在,但并不排除一个或更多个其它特征、要素、步骤或组件的存在或附加。
在此,还需要说明的是,如果没有特殊说明,术语“连接”在本文不仅可以指直接连接,也可以表示存在中间物的间接连接。
在计算机辅助诊疗的医学图像分析阶段,语义分割通常是一个基础任务。由于医学图像的特殊性质,其分割任务具有一定挑战性和复杂性,具体表现在,医学图像分割对精度和稳定性的要求高。但是在医学图像前期进行深度学习的过程中,医学图像样本的数量比较小,而传统深度学习方式需要庞大的数据量作为支撑以获得稳定性和较高的泛化性。一种可行的解决方案从其他类似任务(源域)学习模型的初始化,然后在有限的目标任务训练集(目标域)上进行微调,也即传统的迁移学习,但是在模型从源域迁移的目标域时,会出现域转移问题,由于源域和目标域之间的差异,必然会导致迁移学习适应性不强,产生次优化的问题。域适应和域泛化可以较好地解决这个问题。域适应算法重点在于利用目标域中未标记或者少量的标记数据使得在不同源域上初始化的模型都能够快速拟合。域泛化算法的目标是训练一个基于多个源域的模型,使得它能直接迁移到目标域上去。本申请在具有相似数据分布的目标域和源域上实现分割任务,为了优化分割精度,在目标域上对经多个批次源域数据学习到的模型参数进行微调,利用域适应的方法来优化域转移问题。
本申请在内循环过程中利用支持集和查询集连续调节模型参数,在外循环中基于查询集的模型参数作为更新方向调节原始的基础模型,通过多批次的源域训练数据连续训练得到源域分割模型并迁移至目标域进行微调,最终得到能够适应源域分割任务的目标域分割模型。
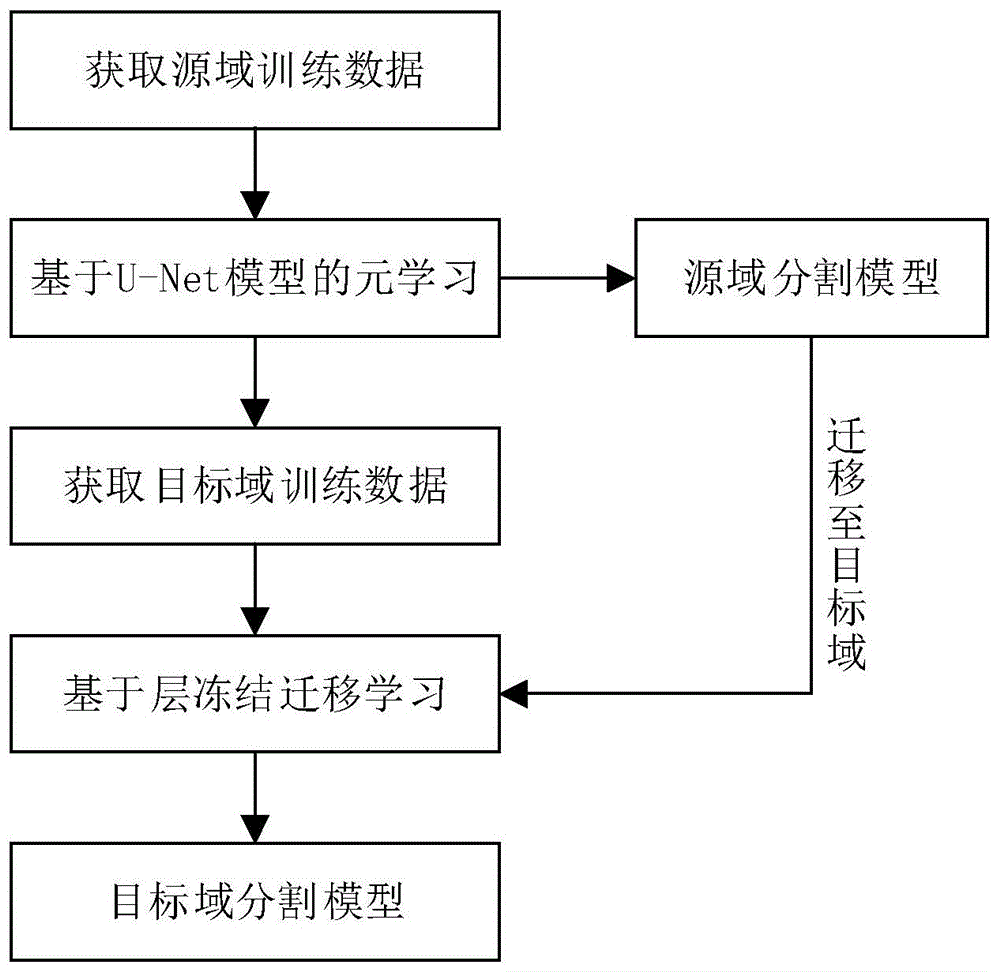
具体的,本申请提供一种医学影像分割模型训练方法,参照图1和图2,包括步骤s101~s104:
步骤s101:获取多个批次源域训练数据,每个批次源域训练数据均包含一组支持集和一组查询集,支持集和查询集包含多个医学影像,医学影像中标记指定人体器官的区块作为标签;其中,每个批次源域训练数据仅包含一种人体器官的标签。
步骤s102:获取预设的基准模型,在一个内循环中,所述基准模型利用单个批次源域训练数据中的支持集进行k步梯度下降由第一模型参数集得到第二模型参数集,再经过查询集经一步梯度下降得到第三模型参数集;在一个外循环中,以原基准模型的第一模型参数集为起点,以第三模型参数集为更新方向,按设定步长、学习率和周期数更新得到第四模型参数集;利用各批次源域训练数据按照内循环和外循环的步骤对所述基准模型连续训练,得到源域分割模型;其中,k为自然数。
步骤s103:获取目标域训练数据,目标域训练数据包含多个医学影像,并标记目标人体器官的区块作为标签。
步骤s104:采用层冻结迁移的方法利用目标域训练数据对源域分割模型进行训练,得到目标域分割模型。
在步骤s101中,可以采用medicalsegmentationdecathlon的公开数据集构建源域数据训练数据。医学影像可以统一采用核磁共振或者ct扫描影像。源域训练数据包括多个批次,每个批次标注同一种器官作为标签。对于图像分割任务而言,标签内容包括图像中指定器官所在区块,该标签是经专业医师进行标注得到的,且准确性符合临床标准。进一步的,可以对用于训练的图像分辨率进行裁剪调整,使尺寸统一并符合基准模型的输入要求,例如将图像分辨率调整为256*256。
示例性的,采用kingscollegelondon公开的心脏影像、ircad公开的肝脏影像、nijmegenmedicalcentre公开的前列腺影像和memorialsloanketteringcancercenter提供的胰腺、脾脏和盲肠影像建立6个批次的源域训练数据,每个批次的源域训练数据又分为支持集和查询集。其中,支持集与查询集中医学图像的数量可以根据实际应用场景和数据量进行配置,在一定条件下,可以按照设定比例配置支持集和查询集中医学图像的数量。
在步骤s102中,基准模型是用于图像分割的网络模型,可以选用fcn、deepmask、u-net等。初始状态下,基准模型的参数可以随机产生。本申请中,优选的基准模型为u-net网络。u-net最关键的部分在于每一次下采样都会有一个跳跃连接与对应的上采样进行级联,这种不同尺度的特征融合对上采样恢复像素大有帮助,具体来说就是高层(浅层)下采样倍数小,特征图具备更加细致的图特征,底层(深层)下采样倍数大,信息经过大量浓缩,空间损失大,但有助于目标区域(分类)判断,当高层和底层的特征进行融合时,分割效果往往会非常好。
本申请步骤s102在训练源域分割模型的过程中,引用了元学习的方式,使源域分割模型能够对各种分割任务获得更强的泛化性。具体的,在源域训练过程中,如图2所示,利用构建的n个批次的源域训练数据,逐一且连续地对基准模型进行训练。每一批次的源域训练数据都进行内循环和外循环两个部分训练。获取预设的基准模型之后,在一个内循环中,基准模型利用单个批次源域训练数据中的支持集进行k步梯度下降由模型参数θ′0得到模型参数θ′k,再经过查询集经一步梯度下降得到模型参数θ′;在一个外循环中,以原基准模型的模型参数θ′0为起点,以θ′0→θ′为更新方向,按设定步长、学习率和周期数更新得到模型参数θ;利用各批次源域训练数据按照内循环和外循环的步骤对基准模型连续训练,得到源域分割模型。在内循环中,基准模型多次梯度下降迭代地在支持集批次上训练,然后再在查询集上训练。在外循环中,以原始模型参数为起点朝着内循环中查询集训练得到参数的方向更新模型。基于n个批次的源域训练数据,连续对基准模型进行连续的迭代训练,得到源域分割模型。在图2中,先通过第1批次的源域训练数据对原始u-net网络模型进行训练,在内循环中,在支持集上进行k步梯度下降由模型参数θ′0得到模型参数θ′k,再通过查询集经过一步梯度下降得到模型参数θ′。外循环起点为模型θ′0,以θ′0→θ′为模型更新方向,β为步长,得到该次外循环的结果模型参数θ。然后采用第2批次的源域训练数据对原始u-net网络模型进行训练,在内循环中,在支持集上进行k步梯度下降由模型参数θ得到模型参数θ″k,再通过查询集经过一步梯度下降得到模型参数θ″。外循环起点为模型θ,以θ→θ″为模型更新方向,β为步长,得到该次外循环的结果模型参数θ1。以此类推,利用n个批次的数据连续训练得到最终的源域分割模型。
通过这种适应性学习的方式,最终得到的源域分割模型并不是针对某一个批次源域训练数据的最优解,而是针对所有批次源域训练数据的全局最优,对各种目标任务均有较好的适应性,在迁移过程中不会出现域转移问题,不会出现过拟合或分割效果差的问题。
本申请与现有的maml和reptile两种元学习方法,存在显著差异。其中,本申请步骤s102在内循环中支持集和查询集的训练是连续的,相比于maml中内循环以支持集进行训练并利用查询集上计算的损失对原始基准模型进行调参的过程,本申请能够将支持集和查询集训练得到的模型参数特征有效传递至原基础模型。相比于reptile并不区分支持集和查询集,本申请能够去的更稳定的训练效果,对多种任务的适应性更强。
在一些实施例中,步骤s102中,对各批次源域训练数据中支持集的医学影像进行数据增强处理,包括0至180度的随机角度翻转、图像平移、横切变换和/或图像拉伸。
神经网络的训练一般需要大量的数据才能获得比较理想的结果,在数据量有限的情况下,可以通过数据增强来增加训练样本的多样性,提高模型鲁棒性避免过拟合。同时,随机改变训练样本的特征,可以降低模型对某些属性的依赖,从而提高模型的泛化能力。各批次源域训练数据中的医学图像经过随机变换后输入基准模型,进行训练。也可以通过变换形成数量更多的训练集。
在步骤s103中,目标域训练数据是基于需要识别的目标器官所构建的训练数据,包括多个医学图像以及其中对目标器官进行标注的区块。实际应用过程中,还可以在目标域设置一定数量的医学图像作为测试集。
具体的,如图3所示,在一些实施例中,所述u-net网络包含编码器、解码器和跳跃连接三部分,所述编码器包含四个下采样模块,每个下采样模块包含两个3×3卷积层,每个卷积层紧跟一个批量归一化层和一个修正线性单元,在下采样模块末尾为步长为2的2×2最大池化层;所述解码器包含四个上采样模块以及一个激活函数层,每个上采样模块包含一个2×2的转置卷积层,两个3×3卷积层,每个卷积层紧跟一个批量归一化层和一个修正线性单元;跳跃用于连接同一深度下采样模块的最大池化层之前的特征图与上采样模块中转置卷积层输出的特征图。在一些实施例中,所述u-net网络采用交叉熵函数作为损失函数,u-net网络的学习率α设置为1e-3,步长β设置为0.4,周期数为300,内循环中k取3。
具体的,在实施过程中,采用深度学习框架keras构件基本语义分割模型u-net,实验系统环境为ubuntu,并基于一张显存为11g的nvidiageforce1080ti显卡。
在步骤s104中,采用层冻结迁移的方法利用目标域训练数据对源域分割模型进行训练。当神经网络跨层学习隐藏表示的多个阶段时,源域数据和目标域数据分布之间的差异将会被放大。源域数据起正激活作用,而目标域数据导致负激活。较大的差异可能会破坏从源域中学习到的知识和经验,也即出现遗忘性破坏问题。为了解决这个问题,在整个网络中保持相对较小的差异是非常重要的,本申请步骤s104中通过逐渐解冻浅层来实现。在浅层采用分层冻结法是因为,与场景分割相比医学图像分割更多地关注低维特征。这些低维特征与一般特征相似,一般在浅层提取。
具体的,在一些实施例中,步骤s104,即采用层冻结迁移的方法利用目标域训练数据对所述源域分割模型进行训练,得到目标域分割模型,包括步骤s1041~s1043:
步骤s1041:冻结编码器中的前两个下采样模块,以1e-3的学习率在目标域训练数据上微调。
步骤s1042:解冻编码器中的第二个下采样模块,以1e-3的初始学习率以及0.0077的衰减率再次在目标域训练数据上微调。
步骤s1043:解冻编码器中的前两个下采样模块,以1e-3的学习率在目标域训练数据上微调。
在本实施例中,基于步骤s103中所构建的u-net模型,对编码器中的浅层进行冻结并逐层解冻进行微调。u-net网络结构中,编码器在下采样过程中能够捕捉语义信息,解码器在上采样过程中能够精确定位。由于医学图像分割更多地关注低维特征,这些地位特征一般在浅层进行提取,为了降低负激活作用,本实施例中,对编码器的前两个下采样模块进行冻结,在解冻过程中由深层至浅层逐步解冻。具体的,目标域训练数据可以分为多个批次按照设定周期进行微调,例如,可以设置8个批次数据,训练300个周期。
另一方面,本发明还提供一种医学影像分割方法,包括步骤s201~s202:
步骤s201:获取待分割处理的医学影像,并按照预设尺寸进行图像裁剪。
步骤s202:将裁剪后的待分割处理的医学影像输入至上述步骤s101~s104所述的医学影像分割模型训练方法中得到的目标域分割模型,以输出分割结果。
在本实施例中,步骤s103~s104基于指定的分割任务,在目标域通过微调得到了用于分割目标器官的目标域分割模型。步骤s201中,获取待分割的医学影像之后,按照目标域分割模型的输入尺寸要求进行切割。在步骤s202中,通过步骤s104中得到的目标域分割模型中,运算后输出分割结果。
另一方面,本发明还提供一种电子设备,包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述程序时实现如上述方法的步骤。
另一方面,本发明还提供一种计算机可读存储介质,其上存储有计算机程序,其特征在于,该程序被处理器执行时实现上述方法的步骤。
下面结合具体示例对本发明进行说明:
利用medicalsegmentationdecathlon的公开数据集作为本文实验的数据集。该数据集包括十种不同人体器官的核磁共振或者ct扫描影像。所有影像均由专业医师进行标注,且准确性符合临床标准。将图像分标率调整为256*256,且将多值标注简化为二值分割任务。从中选择了六种器官的影像来做验证实验。这六种器官分别为kingscollegelondon公开的心脏影像、ircad公开的肝脏影像、nijmegenmedicalcentre公开的前列腺影像和memorialsloanketteringcancercenter提供的胰腺、脾脏和盲肠影像。
选择盲肠和肝脏作为目标域数据。为了构建基于这两个任务的少样本场景,我们将上面提到的六种影像分为两组。第一组的目标域训练集包括214张从盲肠数据中随机采样的影像,目标域测试集则由剩余的1070张盲肠数据组成。第一组的源域训练集包括三个批次数据,分别是前列腺、胰腺和脾脏总计2611张影像组成。第二组的目标域训练集包括191张从肝脏数据中随机采样的影像,目标域测试集则由剩余的18791张盲肠数据组成。第二组的源域训练集包括三个批次数据,分别是前列腺、心脏和胰腺总计2877张影像组成。
本实施例中给出一种医学影像分割模型训练方法,如下:
首先,基于深度学习框架keras构建基本语义分割模型u-net,网络结构如图3所示。u-net的网络结构由编码器、解码器和跳跃连接三部分组成。编码器包括四个下采样模块,每个下采样模块包含两个3×3卷积层(conv2d+bn+relu),每个卷积层紧跟着一个批量归一化层(batchnormalization,bn)和一个修正线性单元(rectifiedlinearunit,relu),在下采样模块末尾为步长为2的2×2最大池化层。解码器结构与编码器类似,只是最大池化层替换成了2×2的转置卷积层(transposedconvolution)。跳跃连接将同一深度的最大池化层之前的特征图和上采样模块中转置卷积层输出的特征图连接起来。由于特定深度的上采样模块利用了下采样模块在相应深度生成的特征图,所以编码器浅层冻结方法也可以保护相关解码器层的正激活。
随机初始化u-net的模型参数,在源域训练集上训练模型。按照上文步骤s102中所记载的方式,具体包括内循环和外循环。内循环基于支持集和查询集,首先在支持集上经过连续k步梯度下降由模型参数θ′0得到模型参数θ′k,再通过查询集经过一步梯度下降得到模型参数θ′。外循环起点为模型θ′0,以θ′0→θ′为模型更新方向,β为步长,得到该次外循环的结果模型参数θ。u-net模型用交叉熵函数作损失函数,源域元学习批次大小为6,采用各批次数据连续按照内循环和外循环的步骤进行训练,训练300个周期。进一步地,u-net模型的学习率α设置为1e-3,步长β设置为0.4,在外循环中学习周期数也为300,内循环中k取3。最终,基于源域训练集训练得到源域分割模型。
利用函数fθ表示u-net,当fθ基于批次τ训练时,模型参数θ经过连续i步梯度下降更新为θ′i,更新后的模型表示为
其中,α为固定的超参数,
进一步地,元优化可以被描述为如下表达式:
整个元学习的优化是基于模型参数θ的,可以基于另一个批次τ′更新θ′i来得到θ′,此优化过程可描述为如下计算式:
其中,β是元学习步长,代表朝着最终参数方向的更新比率。
进一步地,将源域分割模型按照层冻结迁移的方法转移至目标域进行微调。结合u-net网络的结构,首先冻结前两个下采样模块,此时学习率设置为1e-3。然后解冻深层的第二个下采样层,并以1e-3的初始学习率和0.0077的衰减率再次在目标域上微调。最终将所有层解冻并以1e-4的学习率在目标与上进行最后一次微调。目标域微调批次大小为8,训练300个周期,得到目标域分割模型。最后,将目标域分割模型在目标域测试集上进行测试评估。
进一步地,本实施例采用戴斯分数作为客观评价指标,戴斯分数是一种衡量两张图像重叠程度的指标,被广泛应用于医学影像分割效果的评估。对于医学影像二值分割任务,我们将感兴趣区域的比率设置为0.9,背景区域设置为0.1。本实施例中,对三种模式进行测试验证,其中,模式一旨在基于随机初始化的模型参数在目标域上直接训练模型;模式二是基于在源域上预训练得到的模型参数并在目标域上微调。模式三是在源域训练阶段应用了元学习方法,其中包括reptile、maml以及本申请的网络结构(ours)三种元学习结构。并采用戴斯分数进行对比分析,结果如表1所示。
表1
表1中,在盲肠的少样本场景中,模式一在目标域上采用标准有监督学习方法训练,得到的结果的戴斯分数为0.537。模式二在三种不同的源域上进行单源预训练,包括前列腺、胰腺和脾脏,并将由此得到的模型参数作为目标域训练的初始化参数,得到的结果的戴斯分数分别为0.591、0.590和0.591。同时,在三种任务合并成的多源域i上做了模式二的实验,得到戴斯分数为0.611的结果。而在模式三下,reptile、maml和本申请所提出的算法分别实现了0.608、0.615和0.628的戴斯分数。进一步,实验层冻结迁移策略所带来的增益。对于设计模型二和三的各种方法,该迁移方法能带来约4%的戴斯分数提升。对于肝脏的少样本场景,设计模式一能实现0.904的戴斯分数表现。单源域模式二分别能实现0.903、0.902和0.905的分数,多源域ii模式二能实现0.905的分数。reptile、maml和本申请所提出的算法分别实现了0.904、0.905和0.912的戴斯分数。在使用层冻结方法进行迁移时能实现最好的效果,达到0.926的戴斯评分。
进一步的,如图4所示,展示了盲肠少样本场景下损失函数的收敛情况。使用a1、a2、a3和a4的曲线分别展示多源域i模式二、本申请的解决方案、reptile和maml。显而易见,其他三种方法相比本申请的方法均能收敛到更小的值,但是本申请的方法却在测试数据上取得了更好的戴斯分数,这意味着本申请方法在避免少样本训练过拟合问题上能够有更好的表现。
本申请的创新点在于所提出的元学习算法,如图5(a)所示。与maml和reptile不同,maml的内循环在支持集上通过梯度下降得到模型的中间参数θs,并基于此参数在查询集上计算损失和梯度,该梯度直接作用于模型原始参数θ,虽然这个梯度所基于的模型参数由支持集得到,但是每次maml的外循环最终梯度下降方向完全由查询集的损失决定,这过分注重基于支持集经验的学习查询集的能力,这种不平衡在一定程度上削弱了支持集的作用。
如图5(b)所示,reptile则不存在支持集和查询集的划分,它的内循环通过在相同的批次上连续的梯度下降得到中间模型参数θ′,以(θ,θ′)为外循环梯度方向并以一定步长更新模型原始参数θ,这样的学习方式强调了模型在同一个批次上的学习能力并以一定的步长增强泛化能力,但是它忽略了不同批次可能带来更强的泛化能力的机会。
本实施例的算法如图5(c)所示,外循环采用和reptile相同的参数更新策略,但是在内循环中借鉴了maml的思想,采用支持集和查询集的分集策略,并且最后一次梯度下降基于查询集。这样的方法不仅考虑到分集训练学习到的“学会学习”的能力,并且更加平衡了支持集和查询集的贡献。
结合上文的结果分析,本实施例的方法相对于先进的元学习方法有明显的提升,在减轻域迁移问题并提升分割精度的同时,也能一定程度减轻过拟合问题。
综上所述,本发明所述医学影像分割模型训练方法、分割方法及装置中,所述医学影像分割模型训练方法在源域通基于元学习的方式,在源域内循环中利用支持集和查询集连续调节模型参数,在外循环中基于查询集的模型参数作为更新方向调节原始的基础模型,通过多批次的源域训练数据连续训练得到对目标域任务变化敏感的模型参数。在将源域分割模型迁移到目标域时,能够更好地适应目标域的新任务,提高泛化效果。
本领域普通技术人员应该可以明白,结合本文中所公开的实施方式描述的各示例性的组成部分、系统和方法,能够以硬件、软件或者二者的结合来实现。具体究竟以硬件还是软件方式来执行,取决于技术方案的特定应用和设计约束条件。专业技术人员可以对每个特定的应用来使用不同方法来实现所描述的功能,但是这种实现不应认为超出本发明的范围。当以硬件方式实现时,其可以例如是电子电路、专用集成电路(asic)、适当的固件、插件、功能卡等等。当以软件方式实现时,本发明的元素是被用于执行所需任务的程序或者代码段。程序或者代码段可以存储在机器可读介质中,或者通过载波中携带的数据信号在传输介质或者通信链路上传送。“机器可读介质”可以包括能够存储或传输信息的任何介质。机器可读介质的例子包括电子电路、半导体存储器设备、rom、闪存、可擦除rom(erom)、软盘、cd-rom、光盘、硬盘、光纤介质、射频(rf)链路,等等。代码段可以经由诸如因特网、内联网等的计算机网络被下载。
还需要说明的是,本发明中提及的示例性实施例,基于一系列的步骤或者装置描述一些方法或系统。但是,本发明不局限于上述步骤的顺序,也就是说,可以按照实施例中提及的顺序执行步骤,也可以不同于实施例中的顺序,或者若干步骤同时执行。
本发明中,针对一个实施方式描述和/或例示的特征,可以在一个或更多个其它实施方式中以相同方式或以类似方式使用,和/或与其他实施方式的特征相结合或代替其他实施方式的特征。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明实施例可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!