用于锂或钠离子导电的固体电解质玻璃的制作方法
本公开内容涉及钠或锂离子电化学装置的开发和改进,具体地涉及包含高离子电导率和/或高电化学稳定窗口(high electrochemical window of stability)的新型固体电解质玻璃的开发。
背景技术:
目前在国际社会中设想了四类下一代电池:锂-硫、金属-空气和金属-钠电池、多价阳离子电池和全固态电池概念(M.Tatsumisago and Hayashi,A.Sol.Stat.Ionics,2012,225,342)。这些电池设计需要高性能、安全且有成本效益的电解质,其与优化的电极材料相容。固体电解质尚未广泛应用于商业电池,这是因为它们在可接受的温度下具有不良的离子导电性,并且相对于锂-金属,稳定性不足。
Chen及同事(Z.Chen,Y.Qini,Y.Ren,W.Lu,C.Orendorff,E.P.Roth and K.Amine,Energy Environ.Sci.2011,4,4023)显示锂离子电池中较高的石墨负极表面积可以导致更大的固体电解质界面(SEI),并因此在热分解期间导致更多的发热。在~110℃发生的这种初始反应可以在电池中进一步引发其它放热反应。因此,最近对石墨阳极的工作主要集中在开发稳定的人工固体电解质界面以稳定锂化石墨并改善安全性和循环性能。
最近,在正极使用来自空气的氧气的锂电池(锂-空气电池)吸引了全世界的注意。在该开放系统中,严格需要使用具有低挥发性的电解质。对于锂-空气电池,注意力主要集中于通过锂-离子导电陶瓷电解质保护的锂-金属阳极(N.-S.Choi,Z.Chen,S.A.Freunberger,X.Ji,Y.-K.Sun,K.Amine,G.Yushin,L.F.Nazar,J.Cho and P.G.Bruce,Angew.Chem.Int.2012,51,9994)。LISICON(Li(1+x+y)AlxTi2-xSiyP(3-y)O12)(Ohara Inc.2013)已用于上述目的,其中与LISICON有关的主要问题在于与Li-金属接触减少,从而在Li/陶瓷界面上难以循环(N.-S.Choi,Z.Chen,S.A.Freunberger,X.Ji,Y.-K.Sun,K.Amine,G.Yushin,L.F.Nazar,J.Cho and P.G.Bruce,Angew.Chem.Int.2012,51,9994)。
最近通过Li10GeP2S12固体电解质获得了有希望的结果N.Kamaya,K.Homma,Y.Yamakawa,M.Hirayama,R.Kanno,M.Yonemura,T.Kamiyama,Y.Kato,S.Hama,K.Kawamoto and A.A.Mitsui,Nature Mat.2011,10,682)。在该固体电解质介质中,Li+离子在-100℃和25℃分别以0.012mScm-1和12mScm-1导电,这被认为是高导电性。Mo等人(Y.Mo,S.P.Ong and G.Ceder,Chem.Mater.2012,24,15)发现对于低电压下锂的还原或者高电压下通过分解对Li的提取,Li10GeP2S12是不稳定的。
在不同的方面,由于其高离子电导率,已研究了硫化物玻璃。在环境压力下通过使0.03Li3PO4-0.59Li2S-0.38SiS2在液氮中淬灭形成了Li3PO4-Li2S-SiS2体系的玻璃。在室温下其电导率为0.69mScm-1(S.Kondo,K.Takada and Y.Yamamura,Sol.Stat.Ionics 1992,53-56(2),1183)并且其对电化学还原的稳定性宽至10V(A.Hayashi,H.Yamashita,M.Tatsumisago and T.Minami,Sol.Stat.Ionics 2002,148,381)。
在另一个方面,对于锂离子或钠离子电化学装置,如电容器并且特别是电池,安全问题仍是主要障碍。电池制造商现在能够生产用于消费性电子产品的高质量锂离子电池,其对于所生产的每100万个电池具有小于1个报告的安全事件。然而,对于插电混合动力电动车辆和纯电动车辆中的应用来说,这种故障率仍过高,这是因为驱动车辆需要几百个锂离子电池。单个电池的故障可以产生大量的热和火焰,然后两者都可以引起相邻电池的热击穿,从而导致整个电池组的故障。因此,仍需广泛努力来解决锂电池安全问题。
通常,在室温(20℃)下本领域的电解质的液态电导率为约10mScm-1,并且在40℃提高约30-40%。液体电解质的电化学稳定窗口通常等于或小于4V,它们不能与所有电极对一起使用。
电解质的稳定性与其电化学窗口有关,而电化学窗口与电学带隙直接相关。对于Li3ClO结晶固体,计算的电子能带间隙为6.44eV,并且不会变化大于eV的小数值,其中低掺杂水平高达0.7at%。在130℃下进行循环伏安法实验以确定玻璃状样品的稳定窗口,其显示稳定范围大于8V,这使得我们的电解质能够在下一代高电压电池单元(5V)中应用。
公开了这些事实以便说明通过本公开内容解决的技术问题。
技术实现要素:
本公开内容依赖于新型玻璃类型,它是表现出玻璃化转变并且在25℃对Li离子显示出至少13mScm-1的最高离子电导率并在25℃对Na离子显示出至少17mScm-1的最高离子电导率的无序非晶相。用于锂/钠电池的这些玻璃状电解质是廉价、轻便、可循环、不易燃并无毒的。此外,它们在温度应用范围内表现出宽电化学窗口(高于8V)和热稳定性。
锂离子或钠离子电池是可充电型电池,其中锂/钠离子在放电过程中通过电解质从负极移动至正极,而在充电过程中相反。电池的电化学性受在正极和负极发生的总反应控制,并且电池的最大开路电位差由所述反应确定。
锂离子或钠离子电双层电容器(EDLC)是超级电容器,其中在充电期间锂/钠离子通过电解质向负极移动,从而在界面积累并与电极的负离子或电子形成纳米级间隔的电容器。在相反的界面,电极正离子与电解质的负离子(其由于缺少Li或Na阳离子而带负电)形成另一种EDLC。电容器的工作电位差由电解质的电化学稳定窗口确定。
锂离子或钠离子电池和电容器是用于各种装置如便携装置、电动工具、电动车辆和电网存储(电学栅极存储,electrical grid storage)的轻便、高能量密度电源;其不含有毒金属并因此被表征为无危害废弃物。
所公开的主题涉及用于Li离子或Na离子(分别为Li+和Na+)的玻璃状电解质。从具有化学计量R3-2xMxHalO的化合物合成玻璃,其中R为锂(Li)或钠(Na);M为镁(Mg)、钙(Ca)、锶(Sr)或钡(Ba);Hal为氟(F)、氯(Cl)、溴(Br)或碘(I)或者这些元素之间的混合物;O为氧。此外,0≤x≤0.01,优选0.002≤x≤0.007;优选0.003≤x≤0.005。
在达到玻璃态后,除了作为电绝缘体外,玻璃状电解质为Li+离子或Na+离子的超导体,这显示了电解质的必需功能特征。与晶体材料相比,所公开的包含Li+离子或Na+离子的玻璃状电解质中的离子电导率改善了至少两个数量级。电化学窗口还从6V变宽至大于8V。因此,如果在如上所述的化合物的式中R为锂,则它可以在锂电池或电容器的负极和正极之间应用,或者如果在相同式中R为钠,则它可以应用于钠电池或电容器。
这种玻璃已被证明是阻燃、轻量、可循环、易于合成并且成本低廉的。
所公开的主题的实施方式涉及包含式R3-2xMxHalO的固体电解质玻璃,其中
R选自由锂或钠组成的组;
M选自由镁、钙、锶或钡组成的组;
Hal选自由氟、氯、溴、碘或它们的混合物组成的组;
X是M的摩尔数并且0≤x≤0.01;
并且固体电解质玻璃具有玻璃化转变点。
在一个实施方式中,在使用CuKα射线通过X-射线衍射法的测量中,固体电解质玻璃不具有在31°≤2θ≤34°的范围内半值宽度为0.64°或以下的峰。
在一个实施方式中,在使用CuKα射线通过X-射线衍射法的测量中,Li3-2x0.005Ba0.005ClO玻璃状电解质不具有在31°≤2θ≤34°的范围内半值宽度为0.64°或以下的峰。
在一个实施方式中,本公开内容的固体电解质玻璃在25℃具有至少13mScm-1的离子电导率,其中R为离子锂;优选在25℃具有13-60mScm-1的离子电导率,更优选在25℃具有至少25mScm-1的离子电导率。
在一个实施方式中,本公开内容的固体电解质玻璃在25℃具有至少17mScm-1的离子电导率,其中R为离子钠;优选在25℃具有17-105mScm-1的离子电导率,更优选在25℃具有至少31mScm-1的离子电导率。
可以在25℃通过标准方法,即通过电化学阻抗谱(EIS)测量离子电导率。
在本公开内容的固体电解质玻璃的一个实施方式中,式中的X可以为0.002、0.005、0.007或者0.01。
在本公开内容的固体电解质玻璃的一个实施方式中,Hal可以是氯和碘的混合物。
在本公开内容的固体电解质玻璃的一个实施方式中,Hal可以是Hal=0.5Cl+0.5I。
在本公开内容的固体电解质玻璃的一个实施方式中,其中R为锂:
M为钡,Hal为氯并且x为0.005,或者;
M是钡,Hal是氯和碘的混合物,x是0.005。
在本公开内容的固体电解质玻璃的一个实施方式中,其中R为钠,M为Ba,Hal为Cl并且x为0.005。
本公开内容的另一个方面涉及式Na3-2xMxHalO的电解质组合物,具体地,固体电解质玻璃组合物,其中
M选自由镁、钙、锶或钡组成的组;
Hal选自由氟、氯、溴、碘或它们的混合物组成的组;
X是M的摩尔数并且0<x≤0.01。
本公开内容的另一个方面涉及包含本公开内容中所述的玻璃状电解质的电化学装置。
本公开内容的另一个方面涉及包含本公开内容中所述的玻璃状电解质的电池。
本公开内容的另一个方面涉及包含本公开内容中所述的玻璃状电解质的电容器。
本公开内容的另一个方面涉及包含本公开内容中所述的至少一个电容器和本公开内容中所述的至少一个电池的电化学装置。
本公开内容的另一个方面涉及用于合成包含式R3-2xMxHalO的化合物的导电玻璃电解质的方法,具体地,用于制备5g的方法,其中
R为锂;
M选自由镁、钙、锶或钡组成的组;
Hal选自由氟、氯、溴、碘或它们的混合物组成的组,具体地氯;
X是M的摩尔数并且0≤x≤0.01;
所述方法包括以下步骤:
将化学计算量的LiHal、LiOH和以下化合物之一混合:Mg(OH)2;Ca(OH)2、Sr(OH)2或Ba(OH)2;
向所述混合物中加入去离子水并且在密闭容器中混合以形成溶液;
在2-8h期间将所述溶液加热到高达250℃;
打开所述容器以蒸发加热产物中过量的水。
在一个实施方式中,用于合成以上段落中的任何化合物的方法可以包括以下步骤:
将合成的玻璃状材料引入到电化学装置的电极之间;
将玻璃状材料加热到高达170-240℃并冷却。
在一个实施方式中,用于合成以上段落中的任何化合物的方法可以包括以下步骤:
使用LiCl、LiOH和以下化合物之一的化学计量混合物:Mg(OH)2、Ca(OH)2、Sr(OH)2或Ba(OH)2;将混合物引入在具有1-2滴去离子水的特氟隆反应器中并混合以形成均匀糊剂,将所述糊剂密封在反应器中并引入砂浴中;
将混合物加热到高达250℃并保持至少4h;
打开所述反应器使过量的水蒸发;
将合成的玻璃材料引入到两个1cm宽的正方形金电极之间,并借助于用于电解质的夹子(clip)夹紧以获得等于1-3mm的规则厚度;
在-10V至10V之间的可变电势差以及100Hz至5MHz之间的可变频率作用下,将所产生的玻璃材料加热到高达230℃并在砂浴中冷却,进行2-5次。
本公开内容的另一个方面涉及用于合成包含式R3-2xMxHalO的化合物的导电玻璃电解质的方法,具体地,用于制备5g的方法,其中
R为钠;
M选自由镁、钙、锶和钡组成的组;
Hal选自由氟、氯、溴、碘或它们的混合物组成的组;
X是M的摩尔数并且0≤x≤0.01
所述方法包括以下步骤:
将化学计算量的NaHal、NaOH和以下化合物之一混合:Mg(OH)2;Ca(OH)2;Sr(OH)2或Ba(OH)2;
向所述混合物中加入去离子水,并且在密闭容器中混合以形成溶液;
在2-8h内将溶液加热到高达70-90℃;
在2-8h内将温度升高到高达190-250℃,并将所述温度维持至少2h;
打开所述容器以蒸发加热产物中过量的水。
在一个实施方式中,用于合成以上段落中的任何化合物的方法可以包括以下步骤:
将合成的玻璃材料引入到电极之间;
将玻璃加热到高达190-230℃并冷却。
在一个实施方式中,用于合成以上段落中的任何化合物的方法可以包括以下步骤:
使用NaCl、NaOH和以下化合物之一的化学计量混合物:Mg(OH)2;Ca(OH)2;Sr(OH)2或Ba(OH)2,或者
NaCl、NaF、NaOH和以下化合物之一的化学计量混合物:Mg(OH)2;Ca(OH)2;Sr(OH)2或Ba(OH)2;
将混合物引入到具有1-2滴去离子水的反应器中并混合以形成均匀糊剂,将所述糊剂密封在反应器中并引入砂浴中;
将混合物加热到高达80℃持续2h。
将温度升高至120℃持续24h;
将温度升高至245℃持续24h;
将温度保持至少4h;
打开所述反应器使过量的水蒸发;
将合成的玻璃状材料引入到两个1cm宽的正方形金电极之间,并借助于用于电解质的夹子夹紧以获得等于1-3mm的规则厚度;
将所产生的玻璃材料加热到高达230℃并在砂浴中冷却;
在-10V至10V之间的可变电势差以及100Hz至5MHz之间的可变频率作用下,将玻璃材料加热到高达140℃并在砂浴中冷却,进行2-5次。
本公开内容的另一个方面涉及用于合成包含式R3-2xMxHalO的化合物的离子导电玻璃状电解质的方法,具体地,用于制备5g的方法,其中
R为锂;
M选自由镁、钙、锶或钡组成的组;
Hal选自由氟、氯、溴、碘或它们的混合物组成的组;
X是M的摩尔数并且0≤x≤0.01
所述方法包括以下步骤:
将化学计算量的LiCl、LiOH和以下化合物之一混合:Mg(OH)2;Ca(OH)2;Sr(OH)2或Ba(OH)2;
向所述混合物中加入去离子水,具体地,5-25ml或1-2滴,并在密闭容器中混合以形成溶液,具体地,均匀的糊剂;
在2-8h期间将所述溶液加热到高达250℃;
打开所述容器以蒸发产物中过量的水;
将合成的玻璃材料引入到电极之间,具体地,将合成的玻璃材料引入到两个1cm宽的正方形金电极之间,并借助于用于电解质的夹子夹紧以获得等于1-3mm的规则厚度;
在-10V至10V之间的可变电势差以及100Hz至5MHz之间的可变频率作用下,将所得玻璃加热到高达170-240℃并冷却,尤其是进行2-5次。
本公开内容的另一个方面涉及式R3-2xMxHalO的组合物作为电解质的离子电导率和/或电解质的电化学稳定窗口的增强剂(enhancer)的用途,其中
R选自由锂或钠组成的组;
M选自由镁、钙、钡或锶组成的组;
Hal选自由氟、氯、溴、碘或它们的混合物组成的组;
X是M的摩尔数并且0≤x≤0.01。
所公开的主题涉及基于R3-2xMxHalO化学计量通过超快离子导电优化的玻璃状电解质,其中R为锂或钠离子,M是较高化合价的阳离子,如Mg2+、Ca2+、Sr2+、Ba2+;并且Hal是卤素阴离子(卤化物阴离子,halides anion),如F-、Cl-、Br-或I-,或者卤素阴离子的混合物。
玻璃-液体转变是非晶体材料中从坚硬且相对脆性状态向熔融或橡胶状状态的可逆转化。液体向固体样状态的玻璃化转变可以通过冷却或挤压发生。所述转化包括在材料结构没有任何显著变化的情况下,材料粘度约17个数量级的相对平缓增加。该显著增加的结果是在实际观察的时标(timescale)上显示出固体样机械性能的玻璃。尽管通常认为玻璃是刚性的并且完全不动,但是熟知一类或另一类的弛豫过程持续可测量直至下降至低温范围。在另一方面,低于Tg几百度时,通常在常规玻璃绝缘体中存在重要的介电损耗源。在阴离子网络中,这归因于可移动的碱性离子,并且在较小程度上归因于质子。在多数情况下,例如,在固体电解质中,这些拟自由(quasi-free)的运动方式是对特殊材料兴趣的关注,如基于自由运动的阳离子提高的固体电解质。
对玻璃化转变温度更具操作性的分类是在该温度-或在高达例如50℃的几个度数内-比热、热膨胀系数和最终介电常数突然变化。在差示扫描量热法(DSC)实验中,通过基线变化表示Tg,这表明了材料热容的变化。通常,无焓(潜热变化)与这种转变有关(它是二级转变);因此,DSC曲线中的影响是微弱的并且只有仪器灵敏时才可分辨。
这些固体电解质在Tg经历了粘性液体向固体样转化。高于Tg,观察到了非阿仑尼乌斯导电方式(non-Arrhenius conductivity regime)[Tg(Li3ClO)≈119℃、Tg(Li3-2*0.005Mg0.005ClO)≈109℃、Tg(Li3-2*0.005Ca0.005ClO)≈99℃、Tg(Li3-2*0.005Ba0.005ClO)≈75℃、Tg(Li3-2*0.005Ba0.005Cl0.5I0.5O)≈38℃]。我们所开发的固体电解质的一个变体Li3-2xBaxClO(x=0.005)在玻璃态或过冷液体状态在25℃、75℃和100℃分别具有25mScm-1、38mScm-1和240mScm-1的电导率。另一种变体Li3-2xBaxCl0.5I0.5O(x=0.005)在过冷液体状态在50℃具有121mScm-1的电导率。
反钙钛矿氢氧化物(Antiperovskite hydroxide),它们中的大多数遵循通式Li3-n(OHn)Hal或Li4(OH)3Cl,其提供了出乎意料地小于Li3-2*xMxHalO玻璃电解质的离子电导率,从而在~250℃实现了0.010Scm-1的最高的离子电导率(对于Li5(OH)3Cl2)。然而,在形成玻璃之前在我们的样品中观察到了它们,并且它们可以在玻璃形成中具有出乎意料重要的作用,这是因为在封闭表面(可以认为是外场源)附近或在存在共存相(coexisting phase)之间的界面的情况下,通过暴露于外力场破坏了均匀流体的平移对称特征(translational symmetry characteristic)。
附图说明
为了更好地理解该方案,提供了附图,这些附图代表了本发明的优选实施方式,然而,这些附图不旨在限制本发明的范围。
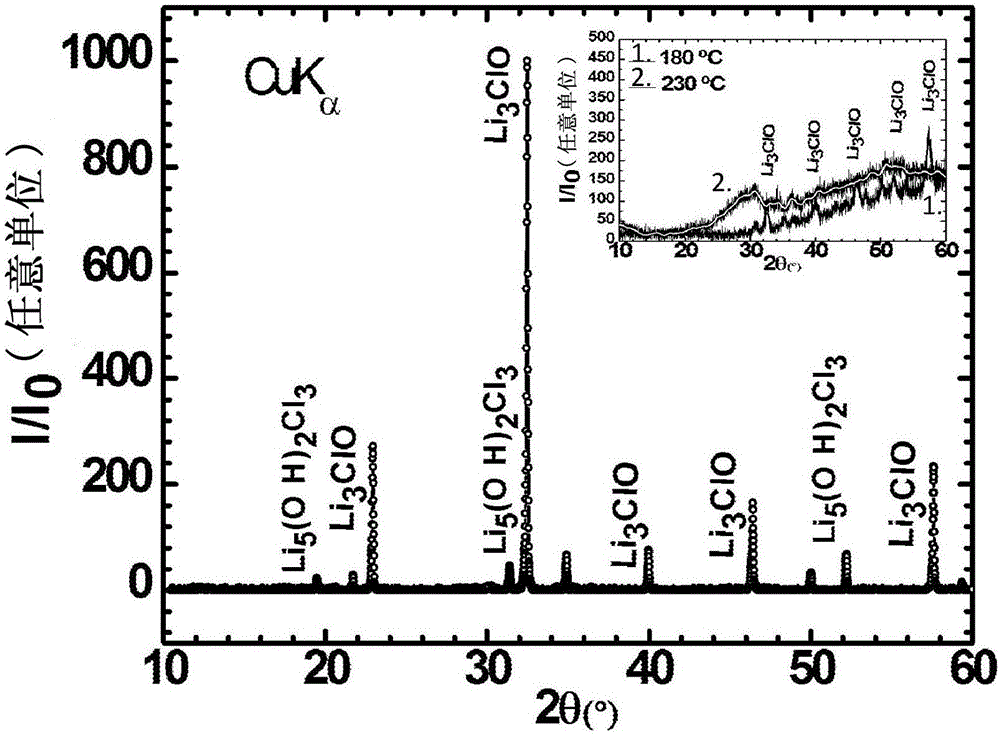
图1:在室温下Li3ClO样品的XRD衍射图。由于样品操作,存在少量氢氧化物相的迹象,其可能是Li5(OH)2Cl3。在180℃(图1(1),右上图),存在很少氢氧化物的迹象,但是晶体Li3ClO的存在仍是清楚的,尽管非晶相变得可见。在230℃(图1(2),右上图),仅非晶相是明显可分辨的。所使用的XRD辐射为CuKα。
图2:EIS测量之后(6次加热/冷却循环之后)在室温下Li3ClO-晶体样品(与图1(1)中相同)和Li3-2*0.005Ba0.005ClO-玻璃(2)的XRD衍射图。观察到了康普顿散射(Compton’s scatter),它是与玻璃有关的非弹性散射和无定形散射。存在氢氧化物相的迹象,其可能是Li5Cl3(OH)2(与图1中相同),这是由于样品的空气暴露操作是不可避免的并且开始在表面上形成。
图3:差示扫描量热法(DSC)。在以5℃/min的加热和冷却期间,Li3-2*0.005Mg0.005ClO的样品的DSC曲线最终显示了玻璃化转变(基线异常)和一级转变温度(熔融对应于吸热事件(加热曲线)并且对应于冷却曲线上的放热事件)。
图4:使用先前所述的等效电路的EIS实验和拟合数据。在25℃下,含有Li3-2*0.005Ba0.005ClO的样品的第2次循环的尼奎斯特阻抗和相应拟合曲线。A为表面积,A=1.76cm2,d是厚度,d=0.2cm。
图5:使用先前所述的等效电路的EIS实验和拟合数据。在玻璃化转变后,在不同的温度下,含有Li3-2*0.005Ba0.005ClO的样品的第2次循环的尼奎斯特阻抗。A是表面积,d是厚度。
图6:Li3-2*0.005Ca0.005ClO的玻璃状样品的照片。
图7:纯的(plain)和掺杂的Li3ClO的电学性能。a)使用VASP中实施的DFT-GGA,在布里渊区方向内,对Li3-2*0.04Ca0.04ClO固体晶体计算的电子能带结构。在对应于0eV的费米能级之后,突出显示了4.74eV的带隙。b)使用HSE06,在布里渊区方向内,Li3ClO计算的电子能带结构。6.44eV的带隙突出显示了通过DFT-GGA和HSE06计算的Eg之间的差异。c)在130℃,对于不同的电池和掺杂电解质的伏安法强调了电解质在高达8V时的稳定性。
图8:(Li3ClO中的Li+离子,Li3-2*0.005M0.005ClO中的掺杂离子(M),M=Mg2+、Ca2+、Sr2+、Ba2+,以及Li3-2*0.005M0.005Cl0.5I0.5O的)玻璃化转变温度与离子半径的关系。除了Sr2+,通过电化学阻抗谱(EIS)获得所有玻璃化转变温度。离子半径从文献获得。
图9:纯的和掺杂的Li3ClO的离子电导率。a)加热和冷却期间,Li3ClO、Li3-2*0.005Mg0.005ClO和Li3-2*0.005Ca0.005ClO的离子电导率的对数与1000/T[K]的关系。b)可以在Li3-2*xMxHalO合成期间形成的氢氧化物的离子电导率的对数之间的比较;Li离子电池中常用的一些已知的固体电解质和凝胶电解质;加热期间Li3ClO和Li3-2*0.005M0.005ClO(M=Mg、Ca、Sr和Ba)。对于Li3-2*0.005Ba0.005ClO玻璃状样品,在它们的第2次、第3次和第4次加热/冷却循环中分别为线和符号+、×。在加热期间进行EIS测量。
图10:Log(σT)与1000/T的关系的图,以突出显示当温度T接近无穷大时,固体样玻璃和过冷液体域中σT项的外推数据的相同的值;a)对于Li3ClO样品;b)对于Li3-2*0.005Ca0.005ClO样品。
图11:第4次加热/冷却循环期间,对于Li3-2*0.005Ba0.005ClO样品的假阿仑尼乌斯图和“表观”活化能。每次加热时,对样品进行EIS循环。样品是玻璃状的,并因此在至少高于Tg时,不预期阿仑尼乌斯行为。
图12:纯的和掺杂的Li3ClO的离子电导率。加热期间,Li3ClO(Y.Zhao and L.L.Daemen,J.Am.Chem.Soc.2012,134,15042)、Li3Cl0.5Br0.5O(Y.Zhao and L.L.Daemen,J.Am.Chem.Soc.2012,134,15042)、AgI(H.Mehrer,Diffusion in Solids Fundamentals,Methods,Materials,Diffusion-Controlled Processes,Springer Series in Solid-State Sciences,Vol.155,第1版,2007)、Li3-2*0.005Ba0.005ClO(第1次和第4次循环)和Li3-2*0.005Ba0.005Cl0.5I0.5O(第1次至第3次循环)的离子电导率对数与1000/T[K]的关系。
图13:对于Li3-2*xCaxClO和Li3-2*xMgxClO,实验离子电导率与浓度的关系。在不锈钢的未优化的电池中获得了这些结果。电极是不锈钢的。所述样品不能像金电池中一样是耐压密封的(pressure tight),并且很可能样品不能成为玻璃。
图14:固体电解质相对于Li金属的循环稳定性。a)在44℃,强调Li/Li3-2*0.005Ca0.005ClO/Li电池的循环稳定性的计时电位分析法。Voc代表开路电压。应用电流(Iapp)=±0.1mAcm-2。b):a)中图的放大,其显示了Li/Li3-2*0.005Ca0.005ClO/Li电池的稳定性。
图15:Li3ClO的晶格振动光谱。上图:对于黄铜/Li3ClO/黄铜电池(阻断电极),计算的光谱和IINS。下图:Li/Li3ClO/Li电池的IINS。根据应用频率,光谱峰强度的依赖性突出了跳变频率。这种影响以350cm-1周围的峰而熟知。在计算光谱中,未考虑每个要素的不相干横截面。另外,计算不考虑谐波(overtone)。
具体实施方式
本公开内容描述了新的玻璃类型及其获得方法。
合成、表征和中子散射
在一个实施方式中,Li3ClO以及相应掺杂固体电解质样品的制备在于预干燥LiCl和Li、Mg、Ca或Ba氢氧化物,因为它们中的大多数高度吸湿,称量化学计算量并将它们混合。然后,通过加入几滴去离子水,形成糊剂并将所述糊剂引入到特氟隆反应器中并封闭。将反应器在230-260℃加热2-3小时,然后将其打开使水分蒸发约1h。然后,将其在玻璃器皿中封闭,并使其冷却至室温。使用真空泵将水干燥。使样品成为100%的无定形Li3ClO或其掺杂同系物需要几小时。还获得了粒料(通过冷压)。
合成后,在空气中操作指定用于EIS实验的样品部分,这是因为它与对玻璃形成有益的氢氧化物的形成成比例。
在砂浴中进行冷却过程,它在螺旋挤压槽中缓慢,并且在大部分时间,EIS实验在冷却期间进行。氢氧化物消耗后获得玻璃(最终该相起封闭面的作用,从而帮助玻璃形成)。
在一个实施方式中,使用CuKα辐射在帕纳科仪器(Panalytical instrument)中对样品进行X射线衍射(XRD)以确定存在于样品中的产物的量,如图1所观察到的。还在EIS实验后进行XRD测量以确定材料是否是无定形的。可以在图2中观察后一种测量的实例。通过原子吸收光谱(AAS)进行Mg、Ca、Sr或Ba的定量分析。
玻璃的离子电导率对化学组成的高灵敏度是熟知的,因此合成了不同的掺杂元素和组合物(组成)Li3-2*xMxHalO(例如,在Li3ClO中,x=0;对于M=Mg和Ca,x=0.002、0.005、0.007和0.01;对于M=Ba和Hal=Cl或Hal=0.5Cl+0.5I,x=0.005)。为了获得玻璃,在空气气氛中将样品安装到金电池中(在离子和电子电导率测量中描述),并进行加热-冷却循环高达250℃。最终,在第一次加热-冷却循环(样品缓慢冷却并防止水分)之后,离子电导率突然上升。
使用干燥粉末和轻微压制的粉末,在氧化铝封闭的坩埚和Ar流动气氛中的差示扫描量热实验(DSC)显示在第一次循环后,氢氧化物的熔融峰不再能区分。如可以在图3中区分,后者还显示了可能由于玻璃转化所造成的基线异常以及对应于Li3-0.01Mg0.005ClO的熔融峰的清晰的一级转化。使用Labsys-Setaram仪器进行后一种测量。
通过中子非弹性非相干散射(neutron inelastic incoherent scattering)(IINS)建立了晶格在跳跃和扩散期间的作用。在洛斯阿拉莫斯中子散射中心(LANSCE),对这些实验制备了样品托棍和锂-金属对称电池单元(螺钉黄铜集电器,直径约2.5cm的石英玻璃管和锂电极之间约3cm的样品距离)。可以改变温度、电流和应用的频率。
离子和电子电导率的测量
使用在砂浴中加热的金或不锈钢(阻断电极),在空气气氛中或者在手套箱中在Ar和/或空气(水蒸汽<10%)中,在电池中进行电化学阻抗谱(EIS)。我们的金对称电池的表面积为约1.77cm2。它由两个被厚度为约小于5mm(通常1-3.0mm)的样品隔开的圆盘金箔组成,并通过螺钉将其压紧。我们的不锈钢电池较大,并且可以包含具有与金电池相同尺寸的样品。在后一种电池中,阻断电极可以是不锈钢或铜的(仅对于接近室温的温度)。这种电池较少使用。所使用的仪器为Bio-Logic SP240。在25至255℃的温度范围中进行实验。频率范围为5MHz-0.1Hz。使用含有无源电阻的等效电路的尼奎斯特阻抗计算离子电导率,所述无源电阻与常相元件串联,所述常相元件与含有与电阻并联的电容器的电路串联。后一种电阻是固体电解质的电阻,其在理想平行板电容器(ideal parallel-plate capacitor)中起电介质的作用。当离子导电的电阻变得过小并且在高频时由电缆所引起的法拉第电磁感应不可避免且显著时,将非理想感应元件串联加入到上述电路中。图4和图5显示了对于不同循环和温度含有在如前所述的对称金电池中测试的Li3-2*0.005Ba0.005ClO的样品的EIS测量数据。在空电池中和使用Agl实施测试以控制程序并建立分析方法。
在具有锂电极作为参比电极和铜或不锈钢的反电极的不锈钢电池中进行循环伏安法测试。在等价于如前所述的金电池的锂对称电池中进行计时电位分析法。实施了通过开路间隔设置的三个测量,其含有20次循环,每次40分钟(正电流20分钟,负电流20分钟)。在Ar-干燥手套箱中进行测量。
计算
在一个实施方式中,通过如在维也纳从头计算模拟软件包(Vienna Ab initio Simulation Package)(VASP)代码中所实施的投影扩充波(PAW)伪势进行密度功能理论(DFT)计算。使用了500eV的平面波截止能和4×4×4的k-网格。对实空间中的晶体电解质进行计算,并且在含有至少134个原子的P1空间群超晶胞内进行。一些超晶胞含有尽可能多的原子(270个原子或以上)以允许使用真实Ba2+、Ca2+或Mg2+浓度更好地近似。使用了广义梯度近似(GGA)和Perdew-Burke-Ernzerhof(PBE)函数,并且在模型中包含了无磁矩。使用Heyd-Scuseria-Erznerhof(HSE06)函数计算能带结构和电子能态密度(DOS)以确定最低空分子轨道(LUMO)和最高的占据分子轨道(HOMO)。
通过空位机理的离子从晶格位点向另一个晶格位点的跳跃在固体中发生了离子导电;因此,它便于具有能量等价或近似等价位点的不全占位。在有利结构中,缺陷可以是可动的,从而导致高离子电导率。尽管通过空位介导的离子转运的扩散性和浓度确定了结晶固体中离子转运的速率,但是无机玻璃状材料的开放结构有利于离子跳跃过程并导致导电性提高。因此,无机玻璃代表电解质应用的有吸引力的材料种类。无机玻璃的优势在于单个-阳离子导电;它们属于所谓的解耦系统,其中离子导电弛豫形式与结构弛豫形式解耦(decouple)。
将无机玻璃状液体的结构和导电的弛豫时间的温度依赖性与有机聚合物相比,也就是,有机聚合物显示前者表现出能够在玻璃态中获得较高单个离子导电的解耦特性(图6)。单个阳离子导电与较少的副反应和显著更宽的电化学稳定窗口有关,所述电化学稳定窗口可以高达10V。
还使用GGA函数和Hyed-Scuseria-Erznerhof(HSE06)函数通过DFT计算电子性能,如能带结构和状态密度(DOS)。在图7a中,显示了使用GGA的电子能带结构计算以及相应的4.74eV的带隙。图7b显示HSE06计算及其相应的6.44eV的带隙Eg值,其显示了晶体材料广泛的电化学稳定性范围。(使用HSE06杂化函数计算的带隙似乎比通常所期待的使用GGA函数计算的带隙与实验更一致。图7c显示了对应于四个实验的伏安法图,其中可以观察到在130℃,在高达8V,没有检测到显著的Li3ClO或Li3-2*0.005Ba0.005ClO氧化,其覆盖了Li电池所有的负-正极对电压窗。使用Hebb-Wagner(H-W)法从这些伏安法循环获得了电导率。在极化测定中,在稳态条件下,在具有离子阻断电极如Cu的Li/Li3ClO/Cu电池中,其中I是电流,V是施加电压(图7c中的E),A是电解质的横截面积(j=I/A),d是电解质的厚度并且σe是其电子电导率。在接近邻近于阻断电极的末端的电解质中,衍生出的获得了de电子电导率。
对于Li3ClO,在130℃,在1.4-2.5V间隔中,σe=9.2×10-9Scm-1,并且在2.55-2.82V间隔中,σe=1.18×10-7Scm-1。对于Li3-2*0.005Ba0.005ClO,在130℃,对于第一次循环并且在4.1-5.97V间隔内,σe=6.77×10-8Scm-1。对于第二次循环,并且在2.07-5.37V的范围内,σe=1.05×10-8Scm-1。后者获得了迁移数ti=σi/(σi+σe),接近良好质量的固体电解质所需的1;σi是离子电导率。
根据实验研究和DFT分析,可以观察到掺杂原子的离子半径在液/固-样转变中起重要作用;即,掺杂离子半径越大,玻璃化转变温度越低,如图8中所示。由于晶体结构中引入杂质的无序性,特别是与焓有关的部分,产生该影响。因此,在相对低的温度,例如,25℃或以下,在高离子半径掺杂的玻璃状样品中,可以获得很高的离子电导率。
图9显示了纯净和掺杂电解质的固体-样和过冷液体样品的离子电导率。在图9a中,不但可以观察到玻璃化转变,而且还可以观察到由加热和随后的冷却所导致的离子电导率滞后。
还观察到了紧邻遍历性断裂转变(ergodicity breaking transition)之前的峰值。可能由于扩散性与粘度的解耦,在图9a和9b中在非阿仑尼乌斯方式(non-Arrhenius regime)中观察到了离子电导率分散性。对于具有可以在高于和低于Tg测量的离子电导率σ的材料,当温度T接近无穷大时,两个域中对于σΤ项的外推数据应给出相同的值。在当前工作中验证了该发现,并且其可以在图10中观察到。
低于Tg时,Li3ClO起固体样玻璃作用(遵循阿仑尼乌斯定律);高于Tg时,它成为显示非阿仑尼乌斯性状的过冷液体。对于掺杂材料观察到了类似的性状类型,尽管该性状还取决于材料史(由于可以根据图9b中对Li3-2*0.005Ba0.005ClO的第二次和第四次循环之间的比较观察到)。此外,掺杂不是获得玻璃所必需的,但是它有助于在较低温度获得玻璃。
如所期望的,在第三次加热/冷却循环之后缓慢冷却-在加热时进行EIS测量-的Li3-2*0.005Ba0.005ClO样品在25℃显示出异乎寻常地高的离子电导率,并且如图9b所示(+符号)。在图11中,可以观察到第4次循环中后一种样品的假阿仑尼乌斯曲线。尽管不期望线性行为,但是至少高于Tg下,可以在35℃至74℃的温度范围中观察到低至0.06eV的活化能。可以在图9b(×符号)和图11中观察到玻璃化转变,尽管它比之前循环中要平滑得多,这可能表明了过冷液体和固体样材料之间较高的相似度,从而突出显示在其他因素中,玻璃的动态性高度取决于冷却速率。
尽管如此,对于锂电池,玻璃相Li3-2*xMxHalO提供了较高的离子电导率,如图9b所示,并且与那些材料相比,提供了优良的化学稳定性,如图7所示。此外,不同于含有Ti和Ge的材料,Li3-2*xMxHalO不与锂-金属反应并且提供了更宽的电化学稳定窗口。
此外,从空气中,应避免的唯一要素-至少在合成了高导电性玻璃之后-应为水蒸汽,这使我们的电解质成为在使用锂-金属阳极的锂-空气电池中使用的优异候选。
用Ba2+掺杂更进一步提高了这种作用,这是因为在这种情况下,较大的掺杂离子半径导致了更高的晶格各向异性,并且这似乎有利于更高的离子电导率。然而,这种提高受其它机制的限制,如掺杂离子附近的跳跃离子捕获;这在Li3-2*0.005Ba0.005Cl0.5I0.5O中几乎不可能发生,这是因为在立方体中心存在的I-将扩大晶格,如对Li3Cl0.5Br0.5O中发生的所描述的。图13显示了对于Li3-2xMgxClO和Li3-2xCaxClO的最佳组成(x)。
配置对称Li/Li3-2*0.005Ca0.005ClO/Li电池以显示具有金属锂的Li3-2*0.005Ca0.005ClO的可循环性和长期相容性。图14a和14b显示了在接近室温在44℃循环的电池的电压分布。在该温度,在0.1mAcm-2的电流密度,电池显示了46.0mV的电压。来源于对称电池的直流(dc)电导率为0.27mScm-1-通过计时电位分析法获得,如图14a和14b中所示-其相对接近于根据对44℃外推的电化学阻抗谱测量所获得的0.85mScm-1的交流电流(ac)电导率。在锂电极和固体电解质之间观察到小的界面电阻,这进一步确认Li3-2*0.005Ca0.005ClO与金属锂完全相容。如图14a和14b所示,电池在44℃显示出优异的可循环性,并且在超过460h期间未显示出电阻提高的迹象,并且比很多其它电解质更加稳定。这些结果证明了在用于电子设备的Li电池中使用的玻璃的能力。
此外,离子电导率提高,直至超过220h,如图14a所示,这表明即使在44℃,样品将最终由于电化学循环而成为部分无定形的。
固体电解质Li3ClO结构使用了大量Li+(高浓度的可移动电荷载子)和无毒元素并且在相对较低温度(240℃至310℃)下使用湿法化学易于处理,这是另一个廉价且环境友好地制备的理由。在高达250℃-在电池装置中,在耐压密封的Au晶片中,使样品退火。对于样品来说,很少需要超过1次循环来成为部分玻璃体和高度导体。在图6中并且如图2所示,在加热和冷却后,玻璃状表面和结构是目视可见的。熔融后,样品可以成为透明的。
有可能前体氢氧化物在产物形成中具有重要作用,从而促进试剂化合物粉末之间的接触。这些氢氧化物是反钙钛矿结构,它们中的大多数遵循通式Li3-n(OHn)Hal。它们的离子电导率显著小于Li3-2*xMxHalO玻璃电解质。事实上,循环形成的氢氧化物为Li5(OH)3Cl2和/或Li4(OH)3Cl,但是它在第一次循环之后转化为Li3-2*xMxHalO,如可以根据图3中所示的差示扫描量热计(DSC)测量推断的。
DSC测量中Li3-2*0.005Mg0.005ClO的玻璃化转变似乎在Tg~136℃发生,如图3中所观察到的,这与离子电导率结果一致。如图3中所示的相应吸热峰,Li3-2*0.005Mg0.005ClO在Tm=269℃发生熔融。通过经验关系,将玻璃化转变Tg与熔融温度Tm联系在一起,Tg~(2/3)Tm。我们通过DSC获得Tg/Tm~0.75,并且通过电导率测量获得Tg/Tm~0.71,这是对0.67的经验系数的良好近似。
使用DFT计算了声子态密度,并将其与非相干非弹性中子光谱(IINS)图谱相比较。通过实验,作为电极温度、电压和应用频率的函数,建立了跳跃和扩散期间晶格的作用。如图15中所观察到的,大部分振动形式通过应用频率维持恒定强度。由于实验条件不利于玻璃的形成,因此这种作用可能与晶体性状有关。
对于320-380cm-1波数(~1013Hz),强度随应用频率而改变,在f=100Hz时较高,而在f=104Hz时较低。
这很可能是跳变频率(~1013Hz),如与声子有关的本征向量所表明的,其表示在较高频率,更多离子已跳变。
重要的是提及Li3ClO-晶体密度低至2.07gcm-3(Li3-2*0.005Ca0.005ClO-晶体为2.09gcm-3,Li3-2*0.005Ba0.005ClO-晶体为2.28gcm-3)。在200℃,Li3ClO密度为~1.96gcm-3。锂-离子电池中的液体电解质由锂盐组成,如有机溶剂,如碳酸亚乙酯(1.3gcm-3)或碳酸二甲基酯(1.07gcm-3)中的LiPF6(1.50gcm-3)或LiClO4(2.42gcm-3)。
尽管仅通过相等体积的固体电解质替换液体并且即使同样必须避免水分,电池将不会更轻;仅需要没有隔离物或精巧包装的固体电解质薄膜,从而导致电池更轻。
本结果显示新型Li3-2xMxHalO玻璃状电解质或Na3-2xMxHalO玻璃状电解质(其中M是较高化合价阳离子,如Ca2+、Sr2+、Mg+2或Ba2+,Hal是卤素离子,如Cl-,或卤素离子,如F-、Cl-、Br-、I-的混合物)具有极高的离子电导率,其在T=在25℃下远高于任何其它超离子导体的锂离子电导率(25mScm-1)。
首次提供了从反钙钛矿晶体形成的玻璃。
另外,相对于Li金属,这种新型电解质在化学上非常稳定(大于260次循环),从而证明它可以在消费电子设备中使用,并且它是轻便的、优良的电子绝缘体、不易燃并且不含污染物。此外,这种新型电解质易于合成,热稳定并且在至少高达8V电化学稳定。因此,它对需要具有大功率和高能量密度的电池的应用,特别是,对于混合动力电动车辆和纯电动车辆是有前景的。
显而易见地,本发明不以任何方式受限于本文所述的实施方式,并且如所附权利要求中所限定的,根据每种情况的要求,本领域具有一般知识的人员可以预测相同发明的多种修改的可能性以及通过其它等价形式的技术特征的取代。
可以彼此合并上面描述的实施方式。所附权利要求进一步限定了本发明的优选实施方式。
日期:2015年2月26日。
- 还没有人留言评论。精彩留言会获得点赞!