用于碱水溶液再生的系统和方法与流程
本发明涉及包含金属离子的溶液的再生。具体来说,本发明涉及再生碱溶液,例如包含金属离子的废电解质溶液,例如金属/空气电池组或氢产生器中所用的碱性电解质溶液。
背景技术:
金属-空气电化学电源,具体来说Al-空气电池组和具有碱性电解质的燃料电池适于电动车、无人驾驶空中交通工具(UAV)、储备和应急电源以及其它应用。
具有碱性电解质的金属-空气系统具有大电化学容量(约8k Wh/kg)。然而,在金属-空气电池组操作期间,金属阳极的溶解产物在电解质中积聚,因此降低金属-空气电池组的效率。因此,在特定操作时间后,电解质溶液需要更换或再生。
一种再生电解质的方式为诱发固体三氢氧化铝(ATH)形式的铝阳极溶解产物沉淀,并且通过过滤去除ATH。然而,并非能够始终通过这一方法完成碱溶液的再生。因此,需要从碱性电解质溶液尽可能全部去除铝溶解产物的方法,并且优选地以有价值副产物形式去除。
除上述ATH之外,溶解铝的一个所要副产物群组可以转化成层化金属氢氧化物(LMH)。LMH由带正电的金属氢氧化物纳米层和夹层负离子和夹层中的水分子组成。层化金属氢氧化物用于离子交换剂、催化剂、抗酸药、磁性材料、控制释放调配物、医药产品和聚合物加强材料,以及透明电极和光电子装置行业中。
LMH可以根据结构和金属-配位体配合类型分成三个类别。一种是可以由通式[M2+1-xM3+x(OH)2]x+(An-)x/n·mH2O(M2+二价金属,M3+:三价金属,A:夹层客体负离子,0<x<1,m和n是整数)表示的层化双氢氧化物(LDH)。示范性LDH是天然存在的矿物质水滑石(HTC),它也称为羟基碳酸镁铝水合物并且一般由化学式Mg6Al2(OH)16CO3·4H2O表示。HTC在以下应用领域发现工业用途。
●药剂(抗酸药)
●聚合物添加剂(除酸剂、阻燃剂)
●催化剂或催化剂载体
●吸附剂
●离子交换材料
连同上文所述的HTC,存在其它LDH化合物并且已经在技术文献中描述。这些材料的界定特征是混合金属氢氧化物薄片通过夹层间隙区域隔开的层化结构,所述夹层间隙区域含有水分子和带负电化合物(负离子),例如碳酸根(CO3-2)。这一结构的表述显示于图12中。
夹层间隙中的带负电负离子用作电荷平衡位点来补偿最初仅含有Mg+2原子的结构中例如Al+3原子的存在而诱发的正电荷。碳酸根是天然形式的HTC矿物质中存在的负离子。然而,合成HTC可以使用夹层中的任何负离子(OH1-、Cl1-、NO31-、SO42-、PO43-等)制备。还可以用具有相等+2或+3电荷的其它金属离子(例如Ca、Zn、Fe、Ni、La离子等)置换初始正离子(Mg和Al)。
LDH材料的另一特性在于可以通过称为阴离子交换的方法用替代负离子置换夹层负离子。这允许通过从水性介质交换或吸附将例如砷酸根(AsCO4-3)或铬酸根(CrO4-2)的目标负离子并入到HTC结构中。这一特性形成Alcoa工业化学物质水处理吸附剂产品的基础。HTC和LDH家族化合物的全部当前工业应用是基于合成制造的材料。
技术实现要素:
在一个实施例中,本发明提供一种用于处理废碱水溶液的系统,所述废碱水溶液包含金属A的溶解氢氧根离子,所述系统包含:
●至少一个储集器;
●固-液分离构件;
●浓缩构件;
●搅拌构件;
●用于固体和液体试剂添加的入口;
其中所述系统消耗所述废碱水溶液;以及其中所述系统产生包含降低量的金属A的溶解氢氧根离子的再生碱水溶液或其中所述系统产生不含金属A的溶解氢氧根离子的再生碱水溶液。
在一个实施例中,本发明提供一种用于处理废碱水溶液的系统,所述废碱水溶液包含金属A的氢氧根离子,所述系统包含:
●至少一个储集器;
●固-液分离构件;
●浓缩构件;
●搅拌构件;
●用于固体和液体试剂添加的入口;
其中所述系统消耗富含铝酸根的废碱水溶液作为原料;并且其中所述系统产生包含降低量的溶解铝酸根或不含溶解铝酸根的再生碱水溶液。
在一个实施例中,本发明提供一种用于处理废碱水溶液的方法,所述废碱水溶液包含金属A的溶解氢氧根离子,所述方法包含:
○提供包含以下的系统:
●至少一个储集器;
●固-液分离构件;
●浓缩构件;
●搅拌构件;
●用于固体和液体试剂添加的入口;
○向所述系统引入包含金属A的溶解氢氧根离子的废碱水溶液;
○从所述废溶液制造和分离固体金属A氢氧化物、LDH或其组合以及减少所述废溶液中的金属A的溶解氢氧根离子的量,因此产生包含降低量的金属A的溶解氢氧根离子或不含金属A的溶解氢氧根离子的再生碱水溶液。
在一个实施例中,本发明提供一种用于处理废碱水溶液的方法,所述废碱水溶液包含铝酸根,所述方法包含:
○提供包含以下的系统:
●至少一个储集器;
●固-液分离构件;
●浓缩构件;
●搅拌构件;
●用于固体和液体试剂添加的入口;
○向系统中引入包含铝酸根的废碱水溶液;
○从所述废溶液制造和分离ATH、LDH或其组合以及减少所述废溶液中的铝酸根的量,因此产生包含降低量的铝酸根离子或不含铝酸根离子的再生碱水溶液。
在一个实施例中,本发明提供一种用于处理包含金属A的溶解氢氧根离子和金属B离子的废碱水溶液的方法,所述方法包含从所述废碱水溶液沉淀LDH。
在一个实施例中,本发明提供一种用于处理包含铝酸根和金属B离子的废碱水溶液的方法,所述方法包含从所述废碱水溶液沉淀LDH。
在一个实施例中,本发明提供一种用于产生能量的系统,所述系统包含能量产生单元和用于处理包含金属A的氢氧根离子的废碱水溶液的系统,其中能量产生单元包含阴极、阳极和电解质溶液,其中阳极包含金属或金属合金且其中所述合金包含金属A和B且其中
附图说明
视为本发明的主题被特别地指出并且在本说明书的结论部分中清楚地要求。然而,关于操作的组织和方法以及其对象、特征以及优点两方面的本发明可以通过在与随附图式一起阅读时参考以下详细说明来最佳地了解,在这些随附图式中:
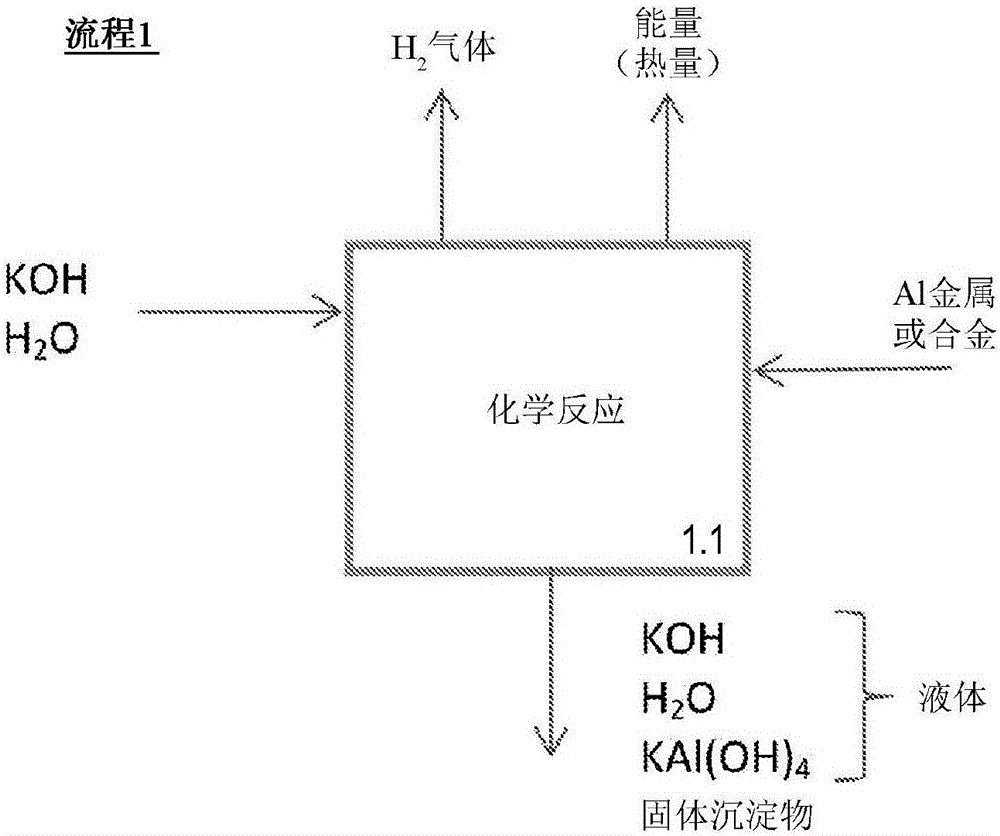
图1为显示Al或Al合金与碱溶液的化学反应的流程图。“固体沉淀物”是指三氢氧化铝(ATH)。
图2为显示Al或Al合金与碱溶液的电化学反应的流程图。“固体沉淀物”是指三氢氧化铝(ATH)。
图3为从包含铝酸根的碱溶液形成“新金属化合物”的流程图。“金属化合物”是指本发明的金属B离子。‘固体沉淀物”是指三氢氧化铝(ATH)。“新金属化合物”是指LDH形成。
图4为从包含铝酸根的废电解质溶液形成“新金属化合物”的流程图。“金属化合物”是指本发明的金属B离子。‘固体沉淀物”是指三氢氧化铝(ATH)。“新金属化合物”是指LDH形成。
图5为显示碱溶液的两步骤再生法的流程图。
图6为显示废电解质溶液的逐步处理的流程图。
图7为显示废电解质溶液在进行后续处理之前进行再消化的方法的流程图。
图8为显示逐步处理流程的流程图,其中第一步骤为添加金属化合物而非水解。
图9为显示逐步处理的流程图,其包括以下步骤:废电解质再消化(任选的)、水解和与金属化合物添加剂反应;而对水解步骤施加共溶剂来提高所述方法的效率。
图10为显示逐步处理的流程图,其包括以下步骤:废电解质再消化(任选的)、水解、与金属化合物添加剂反应以及最终再浓缩步骤(通过部分水蒸发),在用于电池组中之前校正再生电解质的浓缩。
图11为显示逐步处理的流程图,其包括以下步骤:废电解质再消化(任选的)、水解、与金属化合物添加剂反应以及通过在膜设备中正向渗透的过程再浓缩的最终步骤,与接着针对水解处理的废电解质流量对比。
图12为水滑石结构的表述。
图13为本发明的系统的示意图,所述系统包含能量产生单元和电解质再生单元,其中能量产生单元中消耗的铝金属以ATH形式从系统去除。
图14为本发明的系统的示意图,所述系统包括用于本发明的金属B离子的入口和用于LDH的出口。
应了解为了简单和清楚说明,图式中所示的元件并非必需按比例绘制。举例来说,为清楚起见,可相对于其它元件夸大一些元件的尺寸。另外,在认为适当时可在各图式中重复参考编号以指示对应或相似元件。
具体实施方式
工艺描述
在以下详细描述中,阐述许多具体细节以便提供对本发明的透彻理解。然而,所属领域的技术人员应理解,可以在没有这些具体细节的情况下实践本发明。在其它情况下,未详细地描述众所周知的方法、程序和组分以免混淆本发明。
在一个实施例中,本发明提供在用于能量产生工艺(废电解质)或化学过程中之后完全再生碱溶液的方法和系统,其中所述再生电解质溶液不含采用的产物(例如铝酸盐),且其中采用产物以有价值的纯化学物质形式(LDH和ATH)分离。
本发明的一个方面是根据所提议的方法,实现废电解质的完全再生。完全再生意思是再生的电解质的游离碱浓度恢复到其用于电池组或氢产生器(或化学过程)中之前相同的水平,且采用的产物(例如铝酸盐)从再生溶液完全去除(与其它碱溶液再生方法相比,例如拜耳方法(Bayer process)的液体再生)。根据本发明的一个方面,完全再生可能是由于采用了采用的产物(例如铝酸盐)与金属氧化物之间的不可逆化学反应,这导致LDH形成和释放游离碱。这一方法步骤呈现于所披露的图式中并且在下文中详细地描述。
在一个实施例中,如果需要以氢氧化物(例如ATH)形式分离部分所采用的产物(例如铝酸盐),那么可以在LDH形成步骤之前施加水解或共溶剂辅助水解。这允许减少LDH形成所需的金属氧化物的量,以及获得所要比率的LDH和ATH副产物。
在一个实施例中,本发明提供一种从包含碱和非碱金属离子的碱溶液制造LDH的方法。在一个实施例中,本发明提供一种从金属-空气电池组的电解质溶液中形成的材料制造LDH的方法。在一个实施例中,本发明提供一种再生电解质溶液用于随后使用的方法,所述方法包含从所用电解质形成LDH以及分离LDH与电解质。LDH与电解质分离之后,电解质可以重新用于金属空气电池组中。根据这一方面并且在一个实施例中,在阳极形成包含源自所述金属的金属离子的LDH以及将其与电解质溶液分离减少了所用电解质中粗壮乃的金属离子的量。分离此类金属离子与电解质导致具有低浓度金属离子(已沉淀)的电解质溶液并且因此可以重新用作电池组中的电解质。沉淀的“金属离子”是指溶液中事先存在的非碱金属离子,例如Al离子。
本发明的方法的一个优势在于形成的LDH可用于如上文所述的许多LDH应用中的一个。同时,电解质可以重新使用,因为其中氢氧化物污染物的量目前减少(以LDH形式与其分离),并且已重新形成所要碱性化合物。因此,根据本发明的方法的金属空气电池组的操作因为电解质重新使用而更高效。另外,其产生有价值的LDH材料。
在一个实施例中,本发明提供一种用于制造LDH的方法,所述方法包含:
●提供金属A;
●将所述金属A溶解于碱溶液中使得所述金属A在所述碱溶液中形成金属A离子;
●任选地使溶液中可获得的部分金属A以氢氧化物形式沉淀;
●分离所述氢氧化物;
●向所述碱溶液添加金属B离子诱发LDH沉淀;
●分离所述LDH与所述碱溶液;以及
●任选地干燥所述LDH。
在一个实施例中,本发明提供一种用于制造LDH的方法,所述方法包含:
●提供金属合金,其中所述合金包含金属A和B;
●在碱溶液中溶解所述金属合金使得金属A和B在所述碱溶液中形成金属A离子和金属B离子,随后沉淀LDH;
●分离所述LDH与所述碱溶液;以及
●任选地干燥所述LDH。
在一个实施例中,本发明提供一种从电化学方法制造层化双氢氧化物(LDH)的方法,所述方法包含:
●提供包含阴极、阳极和电解质溶液的电化学电池,其中所述阳极包含金属A;
●操作所述电化学电池,使得金属A在所述电解质溶液中形成金属A离子;
●任选地将所述电解质溶液转移到再生单元;
●任选地使溶液中可获得的部分金属A以氢氧化物形式沉淀;
●分离所述氢氧化物;向所述电解质添加金属B离子诱发LDH沉淀;
●分离所述LDH与所述电解质溶液;以及
●任选地干燥所述LDH。
在一个实施例中,本发明提供一种从电化学方法制造层化双氢氧化物(LDH)的方法,所述方法包含:
●提供包含阴极、阳极和电解质溶液的电化学电池,其中所述阳极包含金属合金且其中所述合金包含金属A和B;
●操作所述电化学电池,使得金属A和B在所述电解质溶液中形成金属A离子和金属B离子,随后LDH沉淀;
●任选地将所述电解质溶液转移到再生单元;
●分离所述LDH与所述电解质溶液;以及
●任选地干燥所述LDH。
在一个实施例中,本发明针对用于制造LDH和再生电解质的方法和系统。在另一实施例中,所述LDH包含Al离子。在另一实施例中,LDH包含羟镁铝石、水滑石(HTC)、水铝钙石或其组合。
在一个实施例中,本发明的方法或系统使用如下电化学电池或包含如下电化学电池,所述电化学电池包含具有金属A的阳极。在一个实施例中,本发明的方法或系统使用包含金属A的碱溶液或包含所述溶液。在一个实施例中,金属A为Al。在一个实施例中,金属A为Mg、Li、Sn、Zn。
在一个实施例中,本发明的方法和系统用途如下电化学电池或包含如下电化学电池,所述电化学电池包含具有(至少)金属A和金属B的合金的阳极。在一个实施例中,本发明的方法和系统使用如下碱溶液或包含如下碱溶液,所述碱溶液包含含有金属A和金属B的合金的阳极。在一个实施例中,本发明的合金为Al/Mg合金、Al/Ga或Al/Sn。在一个实施例中,合金包含Zn、Mg、Li、Ga、Sn或其组合。
在一个实施例中,本发明的方法和系统使用如下阴极或包含如下阴极,其中所述阴极为空气阴极。在另一实施例中,阴极包含银。
在一个实施例中,本发明的方法包含将金属A或金属合金溶解于碱溶液中,其中金属合金至少包含金属A和金属B;使得金属A形成金属A离子,并且金属A和B形成金属A离子和金属B离子。在另一实施例中,溶解步骤以化学或电化学方式进行。在一个实施例中,对金属A或金属A和B或金属合金中存在的任何额外金属进行化学溶解产生氢气。
在一个实施例中,本发明的方法和系统包括用于向电解质或碱溶液添加金属B离子的步骤或入口。在另一实施例中,金属B离子为金属氧化物、金属氢氧化物或盐。在另一实施例中,添加的金属B离子包括Mg2+、Ga2+、Sn2+、Ca2+、Li+或其组合。在另一实施例中,添加的金属B离子为Mg2+。在另一实施例中,在添加金属B离子之前,进行再消化步骤,其中所述再消化包含加热和搅拌溶液以重新溶解本发明的溶液中已经形成的三氢氧化铝沉淀物。在另一实施例中,在添加金属B离子之前或在溶解步骤之后,向所述碱溶液添加水,导致三氢氧化铝(ATH)沉淀。在另一实施例中,在LDH的分离步骤之后,碱溶液或电解质进行包含以下的处理步骤:通过沉淀三氢氧化铝从碱性/电解质溶液去除残余铝酸盐。在另一实施例中,通过水解、电化学反应或电泳沉淀ATH。在另一实施例中,从溶液去除或部分去除ATH,并且电解质由此可以重新使用(即电解质再生)。
在一个实施例中,本发明的方法和系统包含和使用电解质或其它碱溶液。在一个实施例中,电解质或碱溶液包括NaOH。在另一实施例中,电解质或碱溶液包括KOH。在另一实施例中,电解质或碱溶液包括NH4OH。在另一实施例中,所述KOH、NaOH、NH4OH、所述有机碱氢氧化物(例如胆碱)或其组合的溶液浓度为30%。在一个实施例中,碱溶液浓度在10wt%与50wt%之间的范围内。在一个实施例中,碱溶液浓度在20wt%与40wt%之间的范围内。在一个实施例中,碱溶液浓度在25wt%与35wt%之间的范围内。
在一个实施例中,本发明的方法包含任选地将所用电解质溶液转移到再生单元。在另一实施例中,再生单元是机载的。在另一实施例中,再生单元是非机载的。
在一个实施例中,本发明的方法包含LDH的分离步骤。在一个实施例中,分离步骤包括过滤、离心、洗涤、溶剂蒸发、压缩、倾析或其组合。
在一个实施例中,本发明提供如实例1中所述的方法。根据这一方面并且在一个实施例中,金属Al或Al合金与基本上不含溶解的碳酸盐的碱水溶液(pH>7)接触并且发生化学反应。可以使用多种可溶性腐蚀性化合物来提供pH>7的碱性条件,包括(但不限于)NaOH、KOH、NH4OH、LiOH、有机碱氢氧化物(例如胆碱)或其组合。反应产生能量(热)和由气体(H2)、液体(溶解的铝酸盐化合物)和悬浮于水相中的固体(金属氧化物/氢氧化物化合物)组成的化学产物。这一水相含有一些来自原始溶液的经溶解的残余腐蚀性化合物。Al合金可含有有益于Al-空气电池组操作的合金元素,例如(但不限于)Mg、Ga和Sn。显示此类方法的实施例的流程图显示于图1中。
在一个实施例中,本发明提供如实例2和图2中所述的方法。根据这一方面并且在一个实施例中,金属Al或Al合金阳极与碱性电解质水溶液(pH>7)接触,所述溶液在电化学电池中基本上不含溶解的碳酸盐。可使用多种可溶性腐蚀性化合物提供pH>7的碱性条件,包括(但不限于)NaOH、KOH、NH4OH、有机碱氢氧化物(胆碱)。发生的电化学反应产生能量(电+热)和由气体(H2)、液体(溶解的铝酸盐化合物)和悬浮于水相中的固体(金属氧化物/氢氧化物化合物)组成的化学产物。这一来自电化学电池的水相也称为废电解质并且含有一些来自原始溶液的经溶解的残余腐蚀性化合物。Al合金可含有有益于Al-空气电池组操作的合金元素,例如(但不限于)Mg、Ga和Sn。显示此类方法的实施例的流程图显示于图2中。
在一个实施例中,本发明提供一种用于再生来自金属-空气电池组的电解质的方法,所述方法包含:
●提供来自金属-空气电池组的用过的电解质溶液,其中所述溶液包含金属A离子;
●向所述用过的电解质添加金属B离子来诱发LDH沉淀;
●收集或分离固体LDH与所述用过的电解质溶液;以及
●从所述用过的电解质溶液收集或分离再生电解质,由此再生所述电解质。
在一个实施例中,本发明提供一种用于再生来自金属-空气电池组的电解质的方法,所述方法包含:
●提供来自金属-空气电池组的用过的电解质溶液,其中所述溶液包含LDH;
●收集或分离固体LDH与所述用过的电解质溶液;以及
●从所述用过的电解质溶液收集或分离再生电解质,由此再生所述电解质。
在一个实施例中,本发明提供通过分离LDH与电解质溶液从而再生电解质的方法。在另一实施例中,再生电解质的方法进一步包括再消化步骤(在提供步骤之后),其中再消化包含加热和搅拌电解质以再溶解三氢氧化铝沉淀物。在另一实施例中,再生电解质的方法进一步包括向电解质溶液添加水(在LDH的分离步骤之前),导致三氢氧化铝(ATH)沉淀。在另一实施例中,从所述溶液去除ATH。
在一个实施例中,所述方法通过从电解质溶液分离和收集LDH来再生电解质。在另一实施例中,在收集或分离固体LDH之后,电解质溶液进行包含以下的处理步骤:通过沉淀三氢氧化铝从所述电解质溶液去除残余铝酸盐,所述三氢氧化铝经进一步分离/收集。
在一个实施例中,本发明提供用于形成如实例3中所述的LDH的方法。根据这一方面并且在一个实施例中,例如实例1中形成的溶液的铝酸盐水溶液经处理以将铝酸盐化合物化学转化成悬浮于水溶液中的混合金属固体(例如LDH),并且产生溶解的腐蚀性化合物。混合的金属固体可以与溶液分离。溶解的腐蚀性化合物可以重新使用。通过向铝酸盐水溶液添加金属B离子(氧化物、氢氧化物、金属B离子的盐)实现转化/再生。金属B离子可作为固体粉末形式、溶解金属盐的水溶液形式或其混合物添加。溶解的铝酸盐和添加的金属B离子之间的反应产生保持溶解于水溶液中的腐蚀性化合物和悬浮于溶液中的固体沉淀物(ATH)。溶解的腐蚀性化合物通常是用于与金属Al或合金反应的初始腐蚀性化学物质。这些包括(但不限于)NaOH、KOH、NH4OH和有机碱氢氧化物(胆碱)。如果起始溶液基本上不含溶解的碳酸盐(并且通过排除空气的方式保持),那么沉淀物为不含碳酸盐的混合金属氢氧化物,其中一种形式称为羟镁铝石[Mg6Al2(OH)18·4H2O]。显示此类方法的实施例的流程图显示于图3中。
在一个实施例中,本发明提供用于形成如实例4中所述的LDH的方法。根据这一方面并且在一个实施例中,例如实例2中形成的溶液的电解质水溶液经处理以将溶解的铝酸盐化合物进行化学转化(再生)产生溶解的腐蚀性化合物和悬浮于电解质水溶液中的混合金属固体(LDH)。通过向电解质水溶液添加金属B离子(氧化物、氢氧化物、盐)实现转化/再生。金属B离子可作为固体粉末形式、溶解金属盐的水溶液形式或其混合物添加。溶解的铝酸盐与添加的金属B离子之间的反应产生固体沉淀物(LDH)并且产生保持溶解于电解质水溶液中的腐蚀性化合物(例如KOH)。溶解的腐蚀性化合物通常是用于与金属Al或合金发生电解反应的初始腐蚀性化学物质。这些包括(但不限于)NaOH、KOH、NH4OH和有机碱氢氧化物(胆碱)。如果起始电解质基本上不含溶解的碳酸盐(并且通过排除空气的方式保持),那么沉淀物为不含碳酸盐的混合金属氢氧化物,其中一种形式称为羟镁铝石[Mg6Al2(OH)18·4H2O]。显示此类方法的实施例的流程图显示于图4中。
在一个实施例中,本发明提供一种实例5和图5中所述的用于再生碱溶液以及形成LDH和ATH的方法。根据这一方面并且在一个实施例中,实例1中所述的铝酸盐水溶液在逐步处理方法中用于再生初始腐蚀性化合物以及依序产生两种不同固体沉淀(ATH和LDH)。在第一步骤中,向铝酸盐溶液添加水引起水解反应,产生三氢氧化铝[Al(OH)3]沉淀物,也称为ATH。水解反应还产生保持溶解于水溶液中的腐蚀性化合物以及未反应的铝酸盐。从溶液去除固体ATH并且不含固体的溶液进行第二处理步骤。在此第二步骤中,向铝酸盐水溶液添加金属B离子(氧化物、氢氧化物、盐)。金属B离子可作为固体粉末形式、溶解金属盐的水溶液形式或其混合物添加。溶解的铝酸盐和添加的金属B离子之间的反应产生保持溶解于水溶液中的腐蚀性化合物和悬浮于溶液中的固体沉淀物(LDH)。溶解的腐蚀性化合物通常是用于与金属Al或合金反应的初始腐蚀性化学物质。这些包括(但不限于)NaOH、KOH、NH4OH和有机碱氢氧化物(胆碱)。如果起始溶液基本上不含溶解的碳酸盐(并且通过排除空气的方式保持),那么沉淀物为不含碳酸盐的混合金属氢氧化物,其中一种形式称为羟镁铝石[Mg6Al2(OH)18·4H2O]。与空气或含有CO2的处理气体物料流接触导致从气体去除CO2以及向沉淀物固体结构中并入CO2作为碳酸盐。上文所述的与CO2接触导致气态CO2固定成固体形式并且产生固体羟基碳酸盐材料,其中一种形式称为水滑石[Mg6Al2(OH)18·4H2O]。显示此类方法的实施例的流程图显示于图5中。
在一个实施例中,本发明提供一种实例6中所述的用于再生电解质溶液以及形成LDH和ATH的方法。根据这一方面并且在一个实施例中,描述逐步方法,所述方法使用废电解质溶液,例如实例2中所述的溶液。逐步方法包含初始腐蚀性化合物的再生和依序产生两种不同固体沉淀物(ATH和LDH)。
在第一步骤中,向废电解质(铝酸盐)溶液添加水引起水解反应,产生三氢氧化铝[Al(OH)3]沉淀物,也称为ATH。水解反应还产生保持溶解于经处理电解质中的腐蚀性化合物以及未反应的铝酸盐。从溶液去除固体ATH并且不含固体的经处理电解质进行第二处理步骤。在此第二步骤中,向经处理的电解质溶液添加金属B离子(氧化物、氢氧化物、盐)。金属B离子可作为固体粉末形式、溶解金属盐的水溶液形式或其混合物添加。经处理电解质中溶解的铝酸盐与添加的金属B离子之间的反应产生保持溶解于水溶液中的腐蚀性化合物和悬浮于经处理电解质中的固体沉淀物(LDH)。溶解的腐蚀性化合物通常是用于与金属Al或合金反应的初始腐蚀性化学物质。这些包括(但不限于)NaOH、KOH、NH4OH和有机碱氢氧化物(胆碱)。如果起始溶液基本上不含溶解的碳酸盐(并且通过排除空气的方式保持),那么沉淀物为不含碳酸盐的混合金属氢氧化物,其中一种形式称为羟镁铝石[Mg6Al2(OH)18·4H2O]。与空气或含有CO2的处理气体物料流接触导致从气体去除CO2以及向沉淀物固体结构中并入CO2作为碳酸盐。上文所述的与CO2接触导致气态CO2固定成固体形式并且产生固体羟基碳酸盐材料,其中一种形式称为水滑石[Mg6Al2(OH)18·4H2O]。显示此类方法的实施例的流程图显示于图6中。
在一个实施例中,本发明提供如实例7中所述的方法。根据这一方面并且在一个实施例中,废电解质溶液(例如实例2中所述的溶液)进行初始处理步骤,随后进行后续处理。这一称为再消化的初始步骤由加热和搅拌废电解质以再溶解任何三氢氧化铝沉淀物,随后进行后续处理组成,所述沉淀物可以在废电解质储存期间形成。再消化步骤后,废电解质可以使用实例3、4、5或6中事先描述的任何方法处理。显示此类方法的实施例的流程图显示于图7中。
在一个实施例中,本发明提供如图8的实例中所述的方法。根据这一方面并且在一个实施例中,提供实例5、6和7中所述的逐步处理路径的顺序颠倒的方法,使得第一步骤变成添加金属化合物而非水解。对于这一情况,向废电解质溶液添加金属B离子(氧化物、氢氧化物、盐)。金属B离子可作为固体粉末形式、溶解金属盐的水溶液形式或其混合物添加。废电解质中溶解的铝酸盐与添加的金属B离子之间的反应产生保持溶解于电解质中的腐蚀性化合物,以及一些未反应的铝酸盐,和悬浮于经处理电解质中的固体沉淀物(LDH)。溶解的腐蚀性化合物通常是用于与金属Al或合金反应的初始腐蚀性化学物质。这些包括(但不限于)NaOH、KOH、NH4OH和有机碱氢氧化物(胆碱)。如果起始溶液基本上不含溶解的碳酸盐(并且通过排除空气的方式保持),那么沉淀物为不含碳酸盐的混合金属氢氧化物,其中一种形式称为羟镁铝石[Mg6Al2(OH)18·4H2O]。与空气或含有CO2的处理气体物料流接触将导致从气体去除CO2以及向沉淀物固体结构中并入CO2作为碳酸盐。上文所述的与CO2接触导致气态CO2固定成固体形式并且产生固体羟基碳酸盐材料,其中一种形式称为水滑石[Mg6Al2(OH)18·4H2O]。从经处理的电解质去除固体沉淀物,随后进行第二处理步骤。在第二处理步骤中,通过沉淀三氢氧化铝去除不含固体的经处理电解质溶液中的残余铝酸盐。通过许多方法实现沉淀。这些方法的实例包括(但不限于)水解(先前描述)、电化学反应和电泳技术。在沉淀方法期间,初始腐蚀性金属化合物再生且保持溶解于经处理的电解质溶液中。从适于重新用作Al-空气电池组中的电解质的经处理的电解质溶液和不含固体的溶液去除三氢氧化铝沉淀物。显示此类方法的实施例的流程图显示于图8中。
在一个实施例中,本发明提供一种从铝金属产生能量的系统,其中所述系统包括容易用于产生有价值的材料作为副产物的试剂再生系统。在一个实施例中,本发明提供一种用于从铝金属以化学方式生产能量的系统,所述系统包括容易用于产生有价值的材料作为副产物的试剂再生系统。在一个实施例中,本发明的系统为试剂再生系统。
在一个实施例中,本发明提供例如图9中所述的方法。根据这一方面并且在一个实施例中,图9显示包含实例5、6和7中所述的逐步处理路径的顺序的方法,其中对水解步骤的共溶剂应用作出改良(方法9.3)。所述共溶剂为水解步骤中与水一起添加到废电解质中的液体,这提高铝酸盐化合物转化成ATH的方法效率,并且对应于所述添加允许降低添加到电解质的水的量以及使碱浓度降低。水解法完成后,从混合物回收共溶剂(例如通过蒸馏)并且在工艺中再循环。可以在固体分离步骤之前(如图9中所示)或之后进行共溶剂回收。此类共溶剂的实例为醇(例如甲醇、乙醇、异丙醇)、酮或其它有机溶剂。
在一个实施例中,本发明提供如图10的实例中所述的方法。根据这一方面并且在一个实施例中,描述实例9所述的逐步处理路径的顺序的方法,其中添加再浓缩步骤。如前述实例(图9)中所述的工艺顺序产生不含固体的溶液,其具有相当低(或可忽略)含量的铝酸盐化合物,而几乎全部碱以游离氢氧化物形式回收。然而,这一溶液因为水解步骤添加的水而一定程度上被稀释了。为了恢复初始碱浓度(并且例如重新使用这一溶液作为用于电池组操作的电解质),通过蒸发去除过量的水(处理步骤10.8)。再浓缩步骤中从电解质蒸发的水重新用于水解反应过程中。
在一个实施例中,本发明提供如图11的实例中所述的方法。根据这一方面并且在一个实施例中,显示实例10所述的逐步处理路径的顺序的方法,同时通过在膜设备中正向渗透进行再浓缩工艺(代替蒸发工艺)。所述设备基本上由两个被半渗透膜分隔的腔室组成。所述膜具有选择性渗透碱,同时对铝酸盐化合物渗透性低得多(或几乎不可渗透)的特性。此类膜的实例为纤维素膜(例如电池组级Innovia CellophaneTM)、离子交换膜(例如DuPont NafionTM、Fumatech)或其它碱相容性渗透膜。所述方法可以在静态或连续流动设备中执行,所述设备提供碱从进入处理过程的废电解质流体通过半渗透膜到离开处理工序的再生电解质流体的质量转移。所述过程的驱动力是碱浓度梯度,这有利于碱传输到再生的电解质流体。视膜特性而定,还可以一定程度上传输水,而水浓度梯度是在相反方向中-从再生电解质流体(较高水含量)到废电解质(较低水含量)。这一处理步骤的结果是更浓的再生电解质(这有利于再生电解质的进一步利用),以及具有更低碱含量的废电解质(这有利于进一步再生处理)。
在一个实施例中,本发明提供一种用于从铝金属和氧气(空气)以电化学方式产生能量的系统,所述系统包括容易用于产生有价值的材料作为副产物的试剂再生系统。
在一个实施例中,本发明提供一种用于产生能量的系统,所述系统包含能量产生单元和试剂再生单元,其中所述能量产生单元包含阴极、阳极和电解质溶液,其中所述阳极包含金属或金属合金且其中所述合金包含金属A和B。
在另一实施例中,本发明的系统包括能量产生单元和试剂再生单元。在另一实施例中,能量产生单元和再生单元包含将材料引入和转移到所述单元以及从所述单元引入和转移材料的入口和出口。在另一实施例中,能量产生单元为氢产生器或铝-空气电池。在另一实施例中,能量产生单元利用来自所述空气的氧气。在另一实施例中,能量产生单元、试剂再生单元或其组合包含用于引入金属B离子的入口。在另一实施例中,金属B离子选自由Ca、Mg、Ba、Sr以及其化合物组成的群组。在另一实施例中,金属B离子为金属氧化物、或金属氢氧化物、或水溶性盐。
在一个实施例中,本发明的系统制造三氢氧化铝(ATH)。在一个实施例中,本发明的系统制造基于铝的层化双氢氧化物(LDH)。在一个实施例中,本发明的系统制造ATH和LDH。
在一个实施例中,本发明的系统制造ATH和LDH产物,而ATH与LDH产量之间的比率可以通过改变再生过程的条件在广泛范围内刻意变化。
在另一实施例中,在操作期间,通过能量产生单元产生能量,而固体LDH在能量产生单元、再生单元或其组合中产生。
在一个实施例中,本发明的系统包含两个主要单元,其可以单个单元形式并联操作,或可以两个独立单元形式独立地操作。显示此类系统的流程展现于图13中。所述系统包含能量产生单元(EU)和试剂再生单元(RU)。在一些实施例中,本发明的系统是指试剂再生单元。
在一个实施例中,能量产生单元包含以下中的一个:铝-空气电池组或连接到氢燃料电池的氢产生器(铝-碱性)。在两种情形中,EU的操作循环结束,使铝金属溶解于电解质水溶液中,形成反应产物输出流体,即废电解质(SE)。SE基本上包含水溶液铝酸盐溶液。SE转移到试剂再生单元(RU)中。
RU基本上由两个主要区块组成:
●沉淀反应器-其中SE进行处理,使铝酸盐化合物分解成ATH沉淀物和游离碱性。这一处理可以使用水解、电解、透析或其组合进行。
●分离区块-其中ATH沉淀物分离、洗涤并且以基本上固体产物形式传递离开系统,而增浓的碱溶液再循环回到EU操作循环。
在一个实施例中,在关于材料平衡的正常操作模式中,系统消耗铝金属、氧气(空气)和水,并且产生几乎固体的ATH,其可以用于技术需要或转移到用于铝金属制造的铝工厂。
在一个实施例中,本发明的系统包含两个主要单元,其可以单个单元形式并联操作,或可以两个独立单元形式独立地操作。显示此类系统的流程展现于图14中。所述系统包含能量产生单元(EU)和试剂再生单元(RU)。
在一个实施例中,本发明提供一种用于电解质溶液的试剂再生工艺,其中金属B离子(二价金属,例如Ca、Mg、Ba、Sr)可以在系统操作期间添加到系统中。在另一实施例中,金属B离子以不同形式添加:合金金属、氧化物、氢氧化物或水溶性盐形式,不影响能量产生操作循环,并且不影响能量产生性能。
向系统中添加金属B离子包括(但不限于)以下形式:
●合金形式-在铝金属“燃料”中;
●氧化物、氢氧化物或水溶性盐形式-在氢产生器的电解质或工作铝-空气电池组中;
●氧化物、氢氧化物或水溶性盐形式-在RU中处理之前的废电解质物料流中;
●氧化物、氢氧化物或水溶性盐形式-部分再生的碱溶液中(在其仍含有残余铝酸盐化合物的情况中)。
在碱性电解质水溶液的媒介中添加金属B离子形成相应氧化物-氢氧化物,其继而在铝酸盐化合物存在下将自发地形成混合金属氢氧化物,称为层化双氢氧化物(LDH),具有通式:MexIIAlyIII(OH)(2x+2y)](An-)(y/n)*mH2O(其中A为负离子,例如OH-、CO32-等)。
可以此方式制造的LDH的实例包括羟镁铝石、水滑石和水铝钙石。
在一个实施例中,LDH由金属B离子形成并且释放碱性的铝酸盐化合物分子。
因此,不具有任何大体改变的相同RU可以产生ATH以及再生的碱性(在常见操作模式下)并且如果向系统添加金属B离子,那么可产生LDH化合物和再生的碱性。
如图13、14所示,可以同时或独立地进行两个制造流程(ATH和LDH)。
在一个实施例中,本发明的操作系统从ATH制造模式容易并且灵活的切换成LDH制造模式或组合操作。
在一个实施例中,本发明的方法和系统制造的LDH化合物用作聚合物填充剂、阻燃剂、催化剂和催化剂载体、药物、负离子交换材料、杂质清除剂或高质量陶瓷前驱体。
在一个实施例中,本发明的金属合金包含超过两种金属。在一个实施例中,本发明的金属合金包含金属A、金属B和金属C。在一个实施例中,本发明的金属合金包含金属A、金属B和其它金属。在一个实施例中,本发明的金属合金包含多种金属。
在一个实施例中,本发明提供一种用于处理废碱水溶液的系统,所述废碱水溶液包含金属A的溶解的氢氧根离子,所述系统包含:
●至少一个储集器;
●固-液分离构件;
●浓缩构件;
●搅拌构件;
●用于固体和液体试剂添加的入口;
其中所述系统消耗所述废碱水溶液;以及其中所述系统产生包含降低量的金属A的溶解氢氧根离子的再生碱水溶液或其中所述系统产生不含金属A的溶解氢氧根离子的再生碱水溶液。
在一个实施例中,金属A是铝并且金属A的溶解氢氧根离子是铝酸根[Al(OH)4-]离子。
在一个实施例中,所述系统进一步产生含有金属A的固体产物。在一个实施例中,含有金属A的固体产物包含含有铝的固体产物,所述含有铝的固体产物包含ATH、LDH或其组合。
在一个实施例中,所述系统进一步包含温度控制构件;蒸馏和回流构件;膜分离构件或其组合。
在一个实施例中,包含金属A的溶解氢氧根离子的废碱水溶液的来源为来自包含金属A的氧化的化学过程的化学废溶液,或其中所述包含金属A的溶解氢氧根离子的废碱水溶液的来源为来自包含金属A的氧化的电化学工艺的废电解质。
在一个实施例中,所述系统经改良以在腐蚀性溶液环境中以及在有机共溶剂存在下操作,执行系统的所要操作。
在一个实施例中,所述系统在媒介上机载。在另一实施例中,系统在媒介上非机载。
在一个实施例中,本发明提供一种用于处理废碱水溶液的方法,所述废碱水溶液包含金属A的溶解氢氧根离子,所述方法包含:
○提供包含以下的系统:
●至少一个储集器;
●固-液分离构件;
●浓缩构件;
●搅拌构件;
●用于固体和液体试剂添加的入口;
○向系统引入包含金属A的溶解氢氧根离子的废碱水溶液;
○从废溶液制造和分离固体金属A氢氧化物、LDH或其组合以及减少废溶液中的金属A的溶解氢氧根离子的量,因此产生包含降低量的金属A的溶解氢氧根离子的再生碱水溶液,或产生不含金属A的溶解氢氧根离子的再生碱水溶液。
在一个实施例中,金属A为铝且金属A的氢氧根离子为铝酸根[Al(OH)4-],且固体金属A氢氧化物为ATH[Al(OH)3]。
在一个实施例中,包含金属A的溶解氢氧根离子的废碱水溶液的来源为来自包含金属A的氧化的化学过程的化学废溶液,或其中所述包含金属A的溶解氢氧根离子的废碱水溶液的来源为来自包含金属A的氧化的电化学工艺的废电解质。
在一个实施例中,在化学或电化学工艺期间,金属A溶解于碱溶液中使得金属A在碱溶液中形成溶解的金属A离子。
在一个实施例中,从废溶液制造固体金属A氢氧化物包含分离,或沉淀和分离固体金属A氢氧化物与溶液。
在一个实施例中,使用电解法、透析法、水解法、渗透、电泳或其组合进行固体金属A氢氧化物的沉淀。
在一个实施例中,水解法包含向废溶液添加水,因此导致固体金属A氢氧化物沉淀。
在一个实施例中,制造固体金属A氢氧化物涉及通过将金属A的溶解氢氧根离子分解成固体金属A氢氧化物和游离碱氢氧化物,从溶液去除金属A的溶解氢氧根离子。
在一个实施例中,从废溶液制造和分离LDH包含:
●向储集器中的废溶液添加金属B离子诱发LDH沉淀;
●分离LDH与废溶液;以及
●任选地干燥LDH。
在一个实施例中,在添加金属B离子之前,废溶液进行再消化,其中所述再消化包含加热和搅拌废溶液来再溶解金属A固体氢氧化物沉淀物。
在一个实施例中,本发明提供一种用于处理包含金属A的溶解氢氧根离子和金属B离子的废碱水溶液的方法,所述方法包含从废碱水溶液沉淀LDH。
在一个实施例中,自发地发生沉淀。
在一个实施例中,包含金属A的氢氧根离子和金属B离子的废碱水溶液的来源是包含金属A和金属B的金属合金。
在一个实施例中,包含金属A的氢氧根离子和金属B离子的废碱水溶液通过化学或电化学工艺从包含金属A和金属B的金属合金形成。
在一个实施例中,在化学或电化学工艺期间,金属A和金属B溶解于碱溶液中使得在碱溶液中金属A形成金属A离子并且金属B形成金属B离子。
在一个实施例中,金属B离子选自由Ca、Mg、Ba、Sr以及其化合物组成的群组。
在一个实施例中,电化学工艺是金属-空气电池组的操作。在一个实施例中,金属-空气电池组包含阴极、阳极和电解质溶液,其中阳极包含具有金属A和B的金属合金。
在一个实施例中,金属B离子包含Mg2+离子。在一个实施例中,金属A为铝。
在一个实施例中,废溶液包含NaOH、KOH、NH4OH、LiOH或有机碱氢氧化物(例如胆碱)。在一个实施例中,KOH或NaOH溶液的浓度在20wt%与45wt%之间变化。
在一个实施例中,所述方法进一步包含过滤、离心、固体饼状物压缩、洗涤和脱水和干燥、溶剂蒸发或其组合。
在一个实施例中,LDH包含Al。在一个实施例中,LDH包含羟镁铝石、水滑石(HTC)或其组合。
在一个实施例中,分离步骤包含过滤、离心、洗涤、溶剂蒸发、压缩、倾析或其组合。
在一个实施例中,本发明提供一种用于产生能量的系统,所述系统包含如上文所述的能量产生单元和溶液处理系统,其中所述能量产生单元包含阴极、阳极和电解质溶液,其中所述阳极包含金属或金属合金且其中所述合金包含金属A和B。
在一个实施例中,能量产生单元和溶液处理系统包含将材料引入和转移到所述单元以及从所述单元引入和转移材料的入口和出口。
在一个实施例中,能量产生单元为氢产生器或铝-空气电池组。在一个实施例中,能量产生单元利用来自空气的氧气。
在一个实施例中,在操作期间,通过能量产生单元产生能量,而固体LDH在能量产生单元、溶液处理系统或其组合中产生。
在一个实施例中,本发明工艺中所用的溶液中的非碱金属离子的量、铝酸根的量或其它非碱金属-氢氧根离子的量减少。在一个实施例中,此类金属离子或氢氧根离子的量通过本发明的工艺减少90%。在一个实施例中,其相对于工艺之前的量减少80%。在一个实施例中,此类离子的量减少到通过本发明的系统和方法处理之前这些离子的量的低于50%、低于40%、低于30%、低于20%、低于10%、低于5%或低于1%或低于0.1%。在一个实施例中,%是重量百分比。在一个实施例中,在通过本发明的系统和方法再生的溶液中这些离子的量是零。在一个实施例中,通过本发明的系统和方法再生的溶液中这些离子的量可忽略。
定义:
在本发明的描述中,术语“铝酸盐”和“铝酸盐化合物”是指通式MAl(OH)4(而M是除了铝以外的金属)的水合铝酸盐,其以溶解形式存在于水溶液中。
因此,本发明的描述中的术语“铝酸根离子”是指式Al(OH)4-的四羟基铝酸根离子。
在一个实施例中,本发明提供包含金属A的金属或包含金属A和金属B的金属合金溶解于碱溶液中的方法,其中所述溶解以化学或电化学方式进行。金属或金属合金的化学溶解意思是金属和试剂之间在溶液中发生的导致从金属A/金属B形成金属A离子/金属B离子的氧化/还原过程。形成金属A离子/金属B离子后,其溶解于与金属/金属合金接触的溶液或液体中。这一过程是化学过程。金属或金属合金的电-化学溶解意思是金属在一个电极中发生的氧化/还原过程以及另一电极上发生的氧化/还原过程,并且两个电极是电连接的(例如在电池组的放电模式中)。此类电化学工艺导致从金属A/金属B形成金属A离子/金属B离子。形成金属A离子/金属B离子后,其溶解于与金属/金属合金接触的溶液或液体中。这一过程是电-化学过程。。
“机载”意思是单元或系统置于或位于安装有电池组的媒介“上”或“中”或“内”或“上方”(例如汽车机载)。
非机载意思是单元或系统置放或位于携带本发明的电池组的媒介的外部位置或远离所述媒介的位置。非机载意思是不在安装有电池组的媒介“上”或“中”或“内”或“上方”(例如汽车非机载)。在一个实施例中,非机载位置为加气站、路旁台站、车库、停车坪、住宅、仓库、汽车养护中心等。
以纯金属或合金形式用于本发明的方法和系统中的金属A和/或金属B和其它金属包含所属领域中已知的任何金属。在一个实施例中,以纯金属或合金形式用于本发明的方法和系统中的金属A和/或金属B和其它金属包含Al、Ca、Zn、Fe、Ni、La、Mg、Li、Sn、Zn、Ga或其组合。在一个实施例中,本发明的系统和方法中所用的金属包含Cu、Cr、Co、In或其组合。
碱或碱溶液为碱性溶液。碱溶液是pH值高于7.0的溶液。碱溶液为包含碱的溶液。碱溶液的实例为KOH或NaOH溶解于水中的溶液。在一些实施例中,腐蚀性溶液为强碱性溶液或浓碱溶液。
涉及废电解质的本发明的实施例可以指包含氢氧化物和碱以及非碱离子的任何其它碱溶液。涉及废电解质的本发明的实施例可指包含非碱金属离子和氢氧根的任何其它碱溶液。
在一个实施例中,金属合金为包含两种或更多种金属的混合物。
铝酸根是包含铝离子和氢氧根离子的离子。铝酸根可以由Al(OH)4-表示。涉及铝酸根的本发明的实施例还可以指其它金属氢氧根离子(即金属并非Al而是另一金属的氢氧化物)。
在一个实施例中,用于处理废碱水溶液的系统为试剂再生单元。
在一个实施例中,废电解质为用过的电解质。在一个实施例中,废电解质为在电池组操作之后从电池组获得的电解质。
在一个实施例中,游离碱是未结合于铝酸盐的碱。溶解的KOH、NaOH是游离碱的实例。与游离碱相比,结合的碱是结合于铝酸盐或类似氢氧根离子(KAl(OH)4)的碱。
在一个实施例中,术语“一个(种)(a或one或an)”是指至少一个(种)。在一个实施例中,短语“两个或更多个”可能具有将适合具体目的的任何面值。在一个实施例中,“约”或“大约”可以包括离所指示的术语+1%、或在一些实施例中-1%、或在一些实施例中±2.5%、或在一些实施例中±5%、或在一些实施例中±7.5%、或在一些实施例中±10%、或在一些实施例中±15%、或在一些实施例中±20%、或在一些实施例中±25%的偏差。
为了更全面说明本发明的优选实施例,呈现以下实例。然而,这些实例决不应被理解为限制本发明的广泛范围。
实例
实例1
Al合金与碱溶液的化学反应
12.5Mg金属合金与30wt%KOH水溶液接触,所述溶液通过排除空气来保持基本上不含溶解的碳酸盐。所得化学反应产生热量,其使溶液温度从环境温度升高到>50℃。同时,反应产生氢气,溶解的铝酸钾[KAl(OH)4]和悬浮于水溶液中的羟镁铝石[Mg6Al2(OH)18·4H2O]固体沉淀物。最终溶液通常将还含有一些溶解的残余腐蚀性化合物(在这一实例中是KOH)。
实例2
Al合金与碱溶液的电化学反应
12.5Mg金属合金与30w%KOH水溶液接触,所述溶液通过排除电化学电池中的空气而保持基本上不含溶解的碳酸盐。所得电化学化学反应产生电和热,使溶液温度从环境温度升高到>50℃。同时,反应产生氢气,溶解的铝酸钾[KAl(OH)4]和悬浮于水溶液中的羟镁铝石[Mg6Al2(OH)18·4H2O]固体沉淀物。最终溶液通常将还含有一些溶解的残余腐蚀性化合物(在这一实例中是KOH)。
实例3
从包含铝酸盐的碱溶液形成羟镁铝石
向不含碳酸盐的水溶液添加氧化镁粉末,所述溶液由4w%KOH和56w%铝酸盐[KAl(OH)4]组成。所得化学反应产生保持溶解于溶液中的KOH和悬浮于溶液中的羟镁铝石[Mg6Al2(OH)18·4H2O]固体沉淀物。最终经处理水溶液还可以含有未反应的溶解铝酸钾。
实例4
从包含铝酸盐的废电解质溶液形成羟镁铝石
向不含碳酸盐的废电解质水溶液添加氧化镁粉末,所述溶液由4w%KOH和56w%铝酸盐[KAl(OH)4]组成。所得化学反应产生保持溶解于电解质中的KOH和悬浮于电解质溶液中的羟镁铝石[Mg6Al2(OH)18·4H2O]固体沉淀物。所得溶液还可以含有未反应的溶解铝酸钾。
实例5
碱溶液的两步骤再生方法
在碱溶液的初步处理步骤中,向不含碳酸盐的水溶液添加水,所述溶液由4wt%KOH和56wt%铝酸钾[KAl(OH)4]组成。添加的水的体积比可以是铝酸盐溶液的体积的0.5到3倍范围内。所得化学反应(水解)产生保持溶解于溶液中的KOH和悬浮于溶液中的三氢氧化铝[Al(OH)3]固体沉淀物。最终经处理水溶液还可以含有未反应的溶解铝酸钾。去除沉淀物[Al(OH)3]并且不含固体的铝酸盐溶液进行额外处理。在此第二处理步骤中,氧化镁粉末添加到KOH/铝酸钾溶液。所得化学反应产生保持溶解于电解质中的额外KOH和悬浮于电解质溶液中的羟镁铝石[Mg6Al2(OH)18·4H2O]固体沉淀物。所得溶液还可以含有未反应的残余溶解铝酸钾。需要时,与空气或含有CO2的处理气体物料流接触将导致从气体去除CO2以及向沉淀物固体结构中并入CO2作为碳酸盐。上文所述的与CO2接触导致气态CO2固定成固体形式并且产生称为水滑石[Mg6Al2(OH)18·4H2O]的固体羟基碳酸盐材料。
实例6
废电解质溶液的逐步处理
在电解质溶液的初步处理步骤中,向不含碳酸盐的废电解质水溶液添加水,所述溶液由4wt%KOH和56wt%铝酸钾[KAl(OH)4]组成。添加的水的体积比可以是废电解质溶液的体积的0.5到3倍范围内。所得化学反应(水解)产生保持溶解于溶液中的KOH和悬浮于溶液中的三氢氧化铝[Al(OH)3]固体沉淀物。最终经处理电解质溶液还可以含有未反应的溶解铝酸钾。去除沉淀物并且不含固体的经处理电解质溶液进行额外处理。在此第二处理步骤中,氧化镁粉末添加到KOH/铝酸钾溶液。所得化学反应产生保持溶解于电解质中的额外KOH和悬浮于电解质溶液中的羟镁铝石[Mg6Al2(OH)18·4H2O]固体沉淀物。所得溶液还可以含有未反应的残余溶解铝酸钾。需要时,与空气或含有CO2的处理气体物料流接触将导致从气体去除CO2以及向沉淀物固体结构中并入CO2作为碳酸盐。上文所述的与CO2接触导致气态CO2固定成固体形式并且产生称为水滑石[Mg6Al2(OH)16CO3·4H2O]的固体羟基碳酸盐材料。
虽然已经在本文示出和描述了本发明的某些特征,但所属领域的普通技术人员现在将想到许多修改、取代、改变和等效物。因此,应理解,所附权利要求书打算涵盖如属于本发明的真实精神内的所有此类修改和改变。
实例7
设备的描述
连同先前描述的多种处理选项,新颖装备组合已标识为执行必要方法步骤所需的设备。可以通过描述用于执行各处理步骤的装备来定义设备。
能量的产生和电解质的利用
在本发明的一个实施例中,金属或金属合金与碱性电解质水溶液接触。这一方法由基本上是耐碱材料制成的密闭容器的设备促进,所述设备的内部设置允许金属块以电解质可与金属块表面接触环流的方式排列。由于金属与电解质反应而逸出的氢气经容器顶部的排气管线离开容器,并且可进一步用作产生能量的燃料。反应热被电解质物料吸收,接着通过任何热交换方式从电解质流体去除以供进一步利用。由于反应,容器中的碱性电解质积聚金属溶解产物。在一个实施例中,金属为纯铝金属并且金属溶解产物为碱金属铝酸盐化合物。在一个实施例中,金属是铝合金,并且金属溶解产物是碱金属铝酸盐化合物和LDH固体沉淀物。这一设备包含密闭容器、使金属与电解质在容器中接触的构件、氢气排气管线、电解质循环的构件、热交换构件,在图1(1.1)、图3(3.1)和图5(5.1)中图示。
在一个实施例中,金属以电极的形状存在,并且电极与设备中的碱性电解质接触,所述设备基本上是供以氧气或空气的金属-空气电池组。在这一实施例中,金属的化学能优选地转化成电能和热。在产生电的方法的同时,还可以进行金属与电解质直接反应的方法,这将导致氢气逸出。有助于所述方法的设备包含金属-空气电池组、具有氢气排气管线的电解质槽、电解质循环构件以及热交换,在图2(2.1)、图4(4.1)、图6(6.1)、图7(7.1)、图8(8.1)、图9(9.1)、图10(10.1)以及图11(11.1)中图示。
这一部分提到的化学和电化学工艺中利用的电解质(称为废电解质)根据本发明的方法进行进一步处理。
从废电解质制造ATH
如先前所述,能量产生方法的废电解质由以下组成:溶解的金属(例如Al),它是碱金属铝酸盐形式(例如铝酸钾(KAl(OH)4));以及一部分起始氢氧化钾(KOH)电解质。为了从溶液回收ATH(Al(OH)3),必须改变KAl(OH)4的平衡溶解度。这可以通过降低KOH和KAl(OH)4的浓度实现。可以通过常用稀释,添加水或另一液相,或通过将水和/或KOH有效传输到另一流体,来降低浓度。当使用稀释法时,控制温度的搅拌反应器容器是所选设备。或者,可以通过在管道回路内产生扰流,在连续流动设备中实现相同程度的稀释/搅拌。这一设备显示于图3(3.2)、图4(4.2)、图5(5.2)、图3(3.2)、图6(6.2)、图3(3.2)、图3(3.2)、图8(8.3)、图9(9.3)、图10(10.3)以及图11(11.4)中。
当使用水和或KOH的主动传输去稳定化KAl(OH)4平衡时,使用膜电化学电池或膜透析/电泳设备。这些装置的示意图显示于图8(8.5)中。
分离ATH固体与溶液
沉淀ATH的行为还在溶液中产生额外游离KOH。需要从溶液回收先前ATH沉淀步骤期间产生的ATH固体和溶解的KOH。这一固体/液体分离可以使用分离装置实现,所述装置经改良来处理溶液的腐蚀性质。这些装置包括(但不限于)除尘器、压滤器、离心机、水力旋流器或功能上类似的用于固-液分离的装置。装置的关键特征在于固体ATH和KOH溶液的回收都必须最大化。这些装置的示意图显示于图3(3.2)、图4(4.3)、图5(5.3)、图6(6.3)、图8(8.4)、图9(9.5)、图10(10.5)以及图11(11.6)中。
共溶剂回收
当ATH沉淀中使用共溶剂时,必须在开始产生LDH之前从所得KOH溶液去除共溶剂。可以通过利用有机共溶剂和KOH水溶液之间的化学和物理性质差异来去除共溶剂。这些特性包括(但不限于)蒸气压、极性和分子大小。基于这些特性的分离装置是:
1.蒸发挥发性液体,随后使蒸气在较低温度下冷凝成液相。这可以在单阶段或多阶段蒸馏装备中实现;
2.液体全蒸发使用选择性膜并且在低于大气压的压力下操作;
3.尺寸排阻膜过滤使用在大体上高于大气压的压力下操作的聚合物或陶瓷膜装置;
4.扩散膜装置(正向或逆向渗透)使用并流或逆流液体流将化学成分从一种液体选择性转移到另一种液体。或者,这可以使用单批模式或多批模式操作。
共溶剂回收设备实例图示于图9(9.4)、图10(10.4)和图11(11.5)中。
LDH制造
共溶剂回收后的溶液现在适用于制造LDH产物。此时,适合固相材料必须添加到溶液中并且与固相材料在高温下紧密接触。固相材料的选择是基于所要LDH类型并且可以是(但不限于)MgO、Mg(OH)2、MgCO3、CaO、Ca(OH)2、CaCO3、LiO、LiOH、Li2CO3以及其它金属氧化物、氢氧化物或碳酸盐。还可向溶液添加可溶性金属盐产生所要LDH,例如(但不限于)金属氯化物、硝酸盐或硫酸盐。然而,必须注意选择不会对随后Al-空气电池组重新使用应用中的KOH溶液的效能产生不利影响的金属化学物质。
用于LDH制造的装置与先前用于ATH制造的装置功能上类似,例如控制温度的搅拌反应器容器和/或扰流循环液体系统。主要差异在于LDH制造需要的温度比ATH制造高并且不会受益于使用共溶剂。
这些装置的示意图显示于图9(9.6)、图10(10.6)和图11(11.7)中。
LDH和KOH回收
制造LDH的行为还在溶液中产生额外游离KOH。LDH固体和溶解的KOH都需要回收。这一固体/液体分离可以使用分离装置实现,所述装置经改良来处理溶液的腐蚀性质。这些装置包括(但不限于)压滤器、离心机或功能上类似的用于固-液分离的装置。装置的关键特征在于固体LDH和KOH溶液的回收都必须最大化。这些装置的示意图显示于图5(5.5)、图6(6.5)、图8(8.6)、图9(9.7)、图10(10.7)和图11(11.8)中。
KOH溶液浓度调整
ATH和LDH制造步骤之后剩余的KOH溶液最终打算重新用于Al-空气电池组应用中。因此,其必须以最优电池组操作所需的KOH浓度供应。ATH和LDH制造之后存在的KOH溶液将可能小于最优电池组重新使用的所要浓度并且将需要浓度调整。这一浓度调整可以通过几种方式实现,例如:
1.添加足以反应所要目标浓度的新KOH;
2.去除足以获得目标KOH浓度的水;
3.从例如引入的废电解质的较高浓度来源转移KOH
用于KOH添加的设备可以是搅拌混合容器,限制条件是定量添加固体或液体KOH。用于水去除的设备功能上类似于先前针对共溶剂去除描述的设备。
1.蒸发挥发性液体,随后使蒸气在较低温度下冷凝成液相。这可以在单阶段或多阶段蒸馏装备中实现,如图10(10.8)中所图示;
2.扩散膜装置(正向或逆向渗透)使用并流或逆流液体流将化学成分从一种液体选择性转移到另一种液体,如图11(11.2)所图示;
3.液体全蒸发使用选择性膜并且在低于大气压的压力下操作;
4.尺寸排阻膜过滤使用在大体上高于大气压的压力下操作的聚合物或陶瓷膜装置。
先前描述的装置可使用逐步方式以连续或分批模式操作。还可以根据需要组合、纳入或排除个别设备和/或方法步骤来实现所要工艺输出。
- 还没有人留言评论。精彩留言会获得点赞!