锂电池的制作方法
技术领域
实施例涉及一种锂电池。
背景技术:
锂电池可用作用于诸如摄影机、移动电话和膝上型电脑等的便携式电子装置的电源。可再充电的锂二次电池可具有比一般的铅蓄电池、镍镉电池、氢镍电池和镍锌电池等的每单位重量的能量密度大三倍或更多倍的每单位重量的能量密度,并可迅速地被充电。
技术实现要素:
实施例针对一种锂电池。
可通过提供锂电池来实现实施例,所述锂电池包括:正电极,所述正电极包括包含大约50mol%至大约100mol%的镍的锂镍基复合化合物;负电极;以及电解质,其中,电解质包括锂盐和由下面的式1表示的化合物:
<式1>
其中,在式1中,R1、R2、R3和R4均独立地为氢、未取代的C1-C10烷基、取代有一个或更多个卤素原子的C1-C10烷基、未取代的C6-C20芳基、取代有一个或更多个卤素原子的C6-C20芳基、未取代的C3-C20杂芳基或取代有一个或更多个卤素原子的C3-C20杂芳基。
在式1中,R1至R4可均独立地为氢、甲基或三氟甲基。
由式1表示的化合物可以是下面的化合物2至化合物6中的一种:
锂镍基复合化合物可由下面的式7表示:
<式7>
LixNiyM1-yO2
其中,在式7中,x可以是0.9至1.2,y可以是0.5至1.0,M可以是钴(Co)、锰(Mn)、铝(Al)或它们的组合。
由式7表示的化合物可以是由下面的式8和式9中的一个表示的化合物:
<式8>
LixNiyCozMn1-y-zO2
其中,在式8中,1≤x≤1.2,0.5≤y<1,0≤z≤0.5,1-y-z可以是0至0.5,
<式9>
LixNiyCozAl1-y-zO2
其中,在式9中,y可以是0.5至1.0,z可以是0至0.5。
由式7表示的化合物可以是LiNi0.6Co0.2Mn0.2O2或LiNi0.88Co0.1Al0.02O2。
基于电解质的总重量,可以以大约0.1wt%至大约10wt%的量包括由式1表示的化合物。
电解质可包括有机溶剂,所述有机溶剂包括碳酸二烷基酯、环状碳酸酯、链状酯或环状酯、链状酰胺或环状酰胺、脂肪腈、链状醚或环状醚或者它们的衍生物。
电解质可包括有机溶剂,所述有机溶剂包括碳酸二甲酯(DMC)、碳酸甲乙酯(EMC)、碳酸甲丙酯、碳酸乙丙酯、碳酸二乙酯(DEC)、碳酸二丙酯、碳酸亚丙酯(PC)、碳酸亚乙酯(EC)、碳酸亚丁酯、丙酸乙酯、丁酸乙酯、乙腈、丁二腈(SN)、二甲基亚砜、二甲基甲酰胺、二甲基乙酰胺、γ-戊内酯、γ-丁内酯或四氢呋喃。
锂盐可包括LiPF6、LiBF4、LiSbF6、LiAsF6、LiClO4、LiCF3SO3、Li(CF3SO2)2N、LiC4F9SO3、LiAlO2、LiCl、LiI、LiAlCl4、LiN(CxF2x+1SO2)(CyF2y+1SO2)或它们的混合物,其中,x和y均独立地为1至20。
电解质中锂盐的浓度可以为大约0.01M至大约2.0M。
附图说明
通过参照附图详细地描述示例性实施例,特征对于本领域技术人员来讲将是明显的,在附图中:
图1示出根据示例性实施例的锂电池的视图;
图2示出根据示例1和对比示例1制造的锂电池的微分容量曲线图;
图3示出展示示例1和对比示例1的锂电池的阻抗特性的曲线图;
图4示出展示根据示例2和对比示例4制造的锂电池的阻抗特性的曲线图;
图5示出展示根据对比示例2和对比示例5制造的锂电池的阻抗特性的曲线图;
图6示出展示根据对比示例3和对比示例6制造的锂电池的阻抗特性的曲线图;
图7示出展示示例1和对比示例1的锂电池在高温(45℃)下的充电和放电特性的曲线图;
图8示出展示示例2和对比示例4的锂电池在高温(45℃)下的充电和放电特性的曲线图;
图9示出展示对比示例2和对比示例5的锂电池在高温(45℃)下的充电和放电特性的曲线图;
图10示出展示对比示例3和对比示例6的锂电池在高温(45℃)下的充电和放电特性的曲线图;
图11示出展示示例1和对比示例1的锂电池在高温(60℃)下储存之后的阻抗特性的曲线图;
图12示出展示示例2和对比示例4的锂电池在高温(60℃)下储存之后的阻抗特性的曲线图;
图13示出展示对比示例2和对比示例5的锂电池在高温(60℃)下储存之后的阻抗特性的曲线图;以及
图14示出展示对比示例3和对比示例6的锂电池在高温(60℃)下储存之后的阻抗特性的曲线图。
具体实施方式
现在将参照附图在下文中更充分地描述示例实施例;然而,示例实施例可以以不同的形式实施,且不应当被解释为局限于在此阐述的实施例。相反,提供这些实施例使得本公开将是彻底的且完整的,并将向本领域技术人员充分地传达示例性实施方式。
在附图中,为了图示的清楚,会夸大层和区域的尺寸。还将理解的是,当层或元件被称为“在”另一层或元件“上”时,所述层或元件可直接在所述另一层或元件上,或者也可存在中间元件。另外,还将理解的是,当元件被称为“在”两个元件“之间”时,所述元件可以是这两个元件之间的唯一元件,或者也可存在一个或更多个中间元件。同样的附图标记始终指示同样的元件。
诸如“……中的至少一个(种)”的表述在一列元件(要素)之后时,修饰整列的元件(要素),而不是修饰该列中的个别元件(要素)。
在下文中,将更详细地描述根据示例性实施例的锂电池。
根据实施例的锂电池可包括例如正电极、负电极和电解质。正电极可包括例如包括50mol%或更多的镍的锂镍基复合化合物。“包括50mol%或更多的镍的锂镍基复合化合物”指在锂镍基复合化合物中镍的量相对于过渡金属的总量在大约50mol%或更大的范围内的锂镍基复合化合物。例如,在LixNiyM1-yO2中,过渡金属的总量表示Ni和M的总量。
在另一实施例中,“包括50mol%或更多的镍的锂镍基复合化合物”指镍的摩尔量是锂的摩尔量的50%至100%的锂镍基复合化合物。电解质可包括例如锂盐和由以下的式1表示的化合物。
<式1>
在式1中,R1、R2、R3和R4可均独立地为例如氢、未取代的C1-C10烷基、取代有一个或更多个卤素原子(例如,1至5个卤素原子,代表性地,1至3个卤素原子)的C1-C10烷基、未取代的C6-C20芳基、取代有一个或更多个卤素原子(例如,1至5个卤素原子,代表性地,1至3个卤素原子)的C6-C20芳基、未取代的C3-C20杂芳基或取代有一个或更多个卤素原子(例如,1至5个卤素原子,代表性地,1至3个卤素原子)的C3-C20杂芳基。
由式1表示并包括在电解质中的化合物可具有包含两个磺酰基的环状结构。当向电解质添加这样的化合物时,电解质可由于磺酰基而具有高温稳定性。由式1表示的化合物可由于环状结构而在电解质之前减少或分解,从而形成磺酸(-SO3-)类聚合物膜。这样的聚合物膜可覆盖电极的较大区域,此外,这样的磺酸(-SO3-)类聚合物膜可具有优异的高温稳定性。因此,可获得在高温下抑制电阻增大的强效果。
如上所述,当向电解质添加由式1表示的化合物时,可在负电极处更容易地形成稳定SEI层,因此锂电池可具有增强的寿命,例如,高温寿命。当在高温下储存锂电池时,可抑制副反应,因此可抑制例如内电阻的增大的电压降,由此增强高温储存特性。在实施方式中,在以上的式1中,R1至R4中的每个可独立地为例如氢、甲基或三氟甲基。
在实施方式中,由式1表示的化合物可以是下面的化合物2至化合物6中的一种。
在实施方式中,基于电解质的总重量,可以以大约0.1wt%至大约10wt%(例如,大约0.1wt%至大约7wt%)的量包括由式1表示的化合物。当电解质中的由式1表示的化合物的量在上述范围内时,可获得具有增强的寿命特性的电池。
在锂电池中,正电极可包括富镍的锂镍基复合氧化物。富镍的锂镍基复合氧化物可包括例如大约50mol%至大约100mol%的量的镍。当镍的含量在上述范围内时,可制造高输出和高容量的锂电池。然而,当镍的含量与上述范围一样高时,会严重地发生富镍的锂镍基复合氧化物的过渡金属的沉积并会使高温特性劣化。
当电解质包括由例如根据实施例的式1表示的化合物时,可增强负电极的保护作用,因此可产生较少量的副产物,其可帮助减少正电极的过渡金属的洗脱。此外,由式1表示的化合物可在正电极处具有聚合物膜效应,因此可减少由于副产物造成的对正电极的损害。这样,通过在电解质中包括由式1表示的化合物,可减少和/或防止例如高温特性劣化的上述问题。因此,可制造在高温下具有长寿命且抑制电阻增大的强效果的高输出和高容量锂电池。如果使用包含少于50mol%的镍的锂镍基复合氧化物,与使用包含大约50mol%至大约100mol%的镍的锂镍基复合氧化物的情况相比,前者则会发生较少的电池劣化。因此,如果向电解质添加由式1表示的化合物,且使用包括包含少于50mol%的镍的锂镍基复合氧化物的电极,则在高温下长寿命和抑制电阻增大的强效果会不明显。
当使用包括富镍的锂镍基复合氧化物的电极和包括由式1表示的化合物的电解质两者时,锂电池可在高温下具有改善的寿命和抑制电阻增大的好效果。在实施方式中,富镍的锂镍基复合氧化物可以是由下面的式7表示的化合物。
[式7]
LixNiyM1-yO2
在式7中,x可以是0.9至1.2,y可以是0.5至1.0,M可以是钴(Co)、锰(Mn)和/或铝(Al)。
由式7表示的化合物可以是例如由以下的式8表示的化合物或由以下的式9表示的化合物。
[式8]
LixNiyCozMn1-y-zO2
在式8中,1≤x≤1.2,0.5≤y<1,0≤z≤0.5,1-y-z可以是0至0.5,
[式9]
LixNiyCozAl1-y-zO2
在式9中,y可以是0.5至1.0,z可以是0至0.5。
在实施方式中,由式7表示的化合物可以是例如LiNi0.6Co0.2Mn0.2O2或LiNi0.88Co0.1Al0.02O2。
电解质的有机溶剂可包括低沸点溶剂。如在此使用的术语“低沸点溶剂”可指在25℃(环境温度)和1atm下具有200℃或更低的沸点的溶剂。
例如,有机溶剂可包括碳酸二烷基酯、环状碳酸酯、链状酯或环状酯、链状酰胺或环状酰胺、脂肪腈、链状醚或环状醚或者它们的衍生物。
在实施方式中,有机溶剂可包括例如碳酸二甲酯(DMC)、碳酸甲乙酯(EMC)、碳酸甲丙酯、碳酸乙丙酯、碳酸二乙酯(DEC)、碳酸二丙酯、碳酸亚丙酯(PC)、碳酸亚乙酯(EC)、碳酸亚丁酯、丙酸乙酯、丁酸乙酯、乙腈、丁二腈(SN)、二甲基亚砜、二甲基甲酰胺、二甲基乙酰胺、γ-戊内酯、γ-丁内酯或四氢呋喃。在实施方式中,可使用合适的低沸点溶剂。
在实施方式中,电解质中的锂盐的浓度可以是例如大约0.01M至大约2.0M。在实施方式中,可使用合适的锂盐的浓度。在上述浓度范围内,可实现增强的电池特性。
在电解质中使用的锂盐可包括合适的锂盐。在实施方式中,锂盐可包括例如LiPF6、LiBF4、LiSbF6、LiAsF6、LiClO4、LiCF3SO3、Li(CF3SO2)2N、LiC4F9SO3、LiAlO2、LiAlCl4、LiN(CxF2x+1SO2)(CyF2y+1SO2)(其中,x和y均独立地为1至20)、LiCl、LiI或它们的混合物等。在实施方式中,电解质的锂盐可以是例如LiPF6。
电解质可处于液体或凝胶状态。
锂电池的类型可包括诸如锂离子电池、锂离子聚合物电池和锂硫电池等的锂二次电池以及锂一次电池。
在锂电池中,石墨可用作负极活性物质。锂电池可具有4.5V或更大的高电压,例如,4.8V或更大。
可使用下面的方法制造根据实施例的锂电池。
首先,可制备正电极。
例如,可制备在其中混合有正极活性物质、导电物质、粘合剂和溶剂的正极活性物质组合物。可将正极活性物质组合物直接涂覆在金属集流体上以制造正电极板。在另一实施例中,可将正极活性物质组合物浇铸在单独的支撑件上,然后可将与支撑件分离的膜层压在金属集流体上,从而完成正电极的制造。在实施方式中,可使用其它方法来制造正电极。
作为正极活性物质,例如,可结合一般的含锂金属氧化物来使用上述富镍的锂镍基复合氧化物。含锂金属氧化物可包括锂以及从钴、锰、镍和它们的组合中选择的金属的复合氧化物。含锂金属氧化物可以是由下面的式中的任意一个表示的化合物:LiaA1-bB’bD2,其中,0.90≤a≤1.8,0≤b≤0.5;LiaE1-bB’bO2-cDc,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05;LiE2-bB’bO4-cDc,其中,0≤b≤0.5,0≤c≤0.05;LiaNi1-b-cCobB’cDα,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α≤2;LiaNi1-b-cCobB’cO2-αF’α,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α<2;LiaNi1-b-cCobB’cO2-αF’2,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α<2;LiaNi1-b-cMnbB’cDα,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α≤2;LiaNi1-b-cMnbB’cO2-αF’α,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α<2;LiaNi1-b-cMnbB’cO2-αF’2,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α<2;LiaNibEcGdO2,其中,0.90≤a≤1.8,0≤b≤0.9,0≤c≤0.5,0.001≤d≤0.1;LiaNibCocMndGeO2,其中,0.90≤a≤1.8,0≤b≤0.9,0≤c≤0.5,0≤d≤0.5,0.001≤e≤0.1;LiaNiGbO2,其中,0.90≤a≤1.8,0.001≤b≤0.1;LiaCoGbO2,其中,0.90≤a≤1.8,0.001≤b≤0.1;LiaMnGbO2,其中,0.90≤a≤1.8,0.001≤b≤0.1;LiaMn2GbO4,其中,0.90≤a≤1.8,0.001≤b≤0.1;QO2;QS2;LiQS2;V2O5;LiV2O5;LiI’O2;LiNiVO4;Li(3-f)J2(PO4)3,其中,0≤f≤2;Li(3-f)Fe2(PO4)3,其中,0≤f≤2;以及LiFePO4。
在以上的式中,A可以是Ni、Co、Mn或它们的组合,B’可以是A1、Ni、Co、Mn、Cr、Fe、Mg、Sr、V、稀土元素或它们的组合,D可以是O、F、S、P或它们的组合,E可以是Co、Mn或它们的组合,F’可以是F、S、P或它们的组合,G可以是A1、Cr、Mn、Fe、Mg、La、Ce、Sr、V或它们的组合,Q可以是Ti、Mo、Mn或它们的组合,I’可以是Cr、V、Fe、Sc、Y或它们的组合,J可以是V、Cr、Mn、Co、Ni、Cu或它们的组合。
例如,正极活性物质可以是LiCoO2、LiMnxO2x(其中,x=1或2)、LiNi1-xMnxO2x(其中,0<x<1)、LiNi1-x-yCoxMnyO2(其中,0≤x≤0.5,0≤y≤0.5,1-x-y>0.5)或LiFePO4等。
在实施方式中,上述化合物可在它们的表面处具有涂覆层。在实施方式中,可结合具有涂覆层的化合物来使用所述化合物。涂覆层可包括诸如涂覆元素的氧化物、涂覆元素的氢氧化物,涂覆元素的羟基氧化物,涂覆元素的碳酸氧盐(oxycarbonate)或涂覆元素的羟基碳酸盐(hydroxycarbonate)的涂覆元素化合物。涂覆元素化合物可以是非晶的或结晶的。包括在涂覆层中的涂覆元素可包括例如Mg、Al、Co、K、Na、Ca、Si、Ti、V、Sn、Ge、Ga、B、As、Zr或它们的混合物。可通过使用对正极活性物质的物理性质没有不利影响的各种方法(例如,喷涂或浸渍等)中的任意一种通过在上述化合物中使用涂覆元素来形成涂覆层。
导电物质可包括例如炭黑或石墨微粒等。在实施方式中,导电物质可以是合适的导电物质。
粘合剂的示例可包括偏二氟乙烯/六氟丙烯共聚物、聚偏二氟乙烯(PVDF)、聚丙烯腈、聚甲基丙烯酸甲酯、聚四氟乙烯、上述聚合物的混合物以及丁苯橡胶类聚合物。在实施方式中,粘合剂可包括合适的粘合剂。
溶剂可包括例如N-甲基吡咯烷酮、丙酮或水等。在实施方式中,溶剂可包括合适的溶剂。
正极活性物质、导电物质、粘合剂和溶剂的量可与在合适的锂电池中使用的正极活性物质、导电物质、粘合剂和溶剂的量处于同一水平。在实施方式中,可根据期望的锂电池的用途和构成而省略导电物质、粘合剂和溶剂中的至少一种。
接下来,制备负电极。
例如,可通过混合负极活性物质、导电物质、粘合剂和溶剂来制备负极活性物质组合物。可将负极活性物质组合物直接涂覆在金属集流体上并将其干燥以获得负电极板。在实施方式中,可将负极活性物质组合物浇铸在单独的支撑件上,并且可将从支撑件分离的膜层压在金属集流体上以完成负电极板的制造。
作为负极活性物质,可使用锂电池的合适的负极活性物质。例如,负极活性物质可包括锂金属、可与锂合金化的金属、过渡金属氧化物、非过渡金属氧化物和/或碳质物质。
例如,可与锂合金化的金属可包括硅(Si)、锡(Sn)、铝(Al)、锗(Ge)、铅(Pb)、铋(Bi)、锑(Sb)、Si-Y合金(Y是除了Si之外的碱金属、碱土金属、13族至16族元素、过渡金属、稀土元素或它们的组合)或Sn-Y合金(Y是除了Sn之外的碱金属、碱土金属、13族至16族元素、过渡金属、稀土元素或它们的组合)等。Y的示例可包括镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra)、钪(Sc)、钇(Y)、钛(Ti)、锆(Zr)、铪(Hf)、(Rf)、钒(V)、铌(Nb)、钽(Ta)、(Db)、铬(Cr)、钼(Mo)、钨(W)、(Sg)、锝(Tc)、铼(Re)、(Bh)、铁(Fe)、铅(Pb)、钌(Ru)、锇(Os)、(Hs)、铑(Rh)、铱(Ir)、钯(Pd)、铂(Pt)、铜(Cu)、银(Ag)、金(Au)、锌(Zn)、镉(Cd)、硼(B)、铝(Al)、镓(Ga)、锡(Sn)、铟(In)、锗(Ge)、磷(P)、砷(As)、锑(Sb)、铋(Bi)、硫(S)、硒(Se)、碲(Te)、钋(Po)或它们的组合。
例如,过渡金属氧化物可包括钛酸锂氧化物、氧化钒或氧化锂钒等。
例如,非过渡金属氧化物可包括SnO2或SiOx等,其中0<x<2。
碳质物质可包括例如结晶碳、非晶碳或它们的混合物。结晶碳的示例可包括天然石墨和人造石墨,它们中的每个具有不规则的形状或者是板、薄片、球体或纤维状的形状。非晶碳的示例可包括软碳(低温煅烧碳)、硬碳、中间相沥青碳化产物和煅烧焦。
在负极活性物质组合物中,可使用与在正极活性物质组合物中使用的导电物质和粘合剂相同的导电物质和粘合剂。
负极活性物质、导电物质、粘合剂和溶剂的量可与在合适的锂电池中使用的负极活性物质、导电物质、粘合剂和溶剂的量处于同一水平。可根据期望的锂电池的用途和构成而省略导电物质、粘合剂和溶剂中的至少一种。
接下来,制备将置于正电极与负电极之间的隔板。
可使用合适的隔板。关于隔板,可使用对于电解质中的离子迁移具有低阻力并具有高的电解质保持能力的隔板。隔板的示例可包括玻璃纤维、聚酯、特氟龙(Teflon)、聚乙烯、聚丙烯、聚四氟乙烯(PTFE)或它们的组合,它们中的每个可以是无纺织物或纺织物。例如,可在锂离子电池中使用由聚乙烯或聚丙烯等形成的可卷绕的隔板,可在锂离子聚合物电池中使用具有高的电解质保持能力的隔板。例如,可根据下面的方法来制造隔板。
可通过混合聚合物树脂、填料和溶剂来制备隔板组合物。可在电极的上部上直接涂覆隔板组合物并将其干燥,从而完成隔板的制造。在实施方式中,可在支撑件上浇铸隔板组合物并将其干燥,并且可在电极的上部上层压从支撑件分离的隔板的膜,从而完成隔板的制造。
在隔板的制造中使用的聚合物树脂可包括在电极板的粘合剂中使用的合适的物质。例如,聚合物树脂可包括偏二氟乙烯/六氟丙烯共聚物、PVDF、聚丙烯腈、聚甲基丙烯酸甲酯或它们的混合物等。
接下来,制备上述电解质。
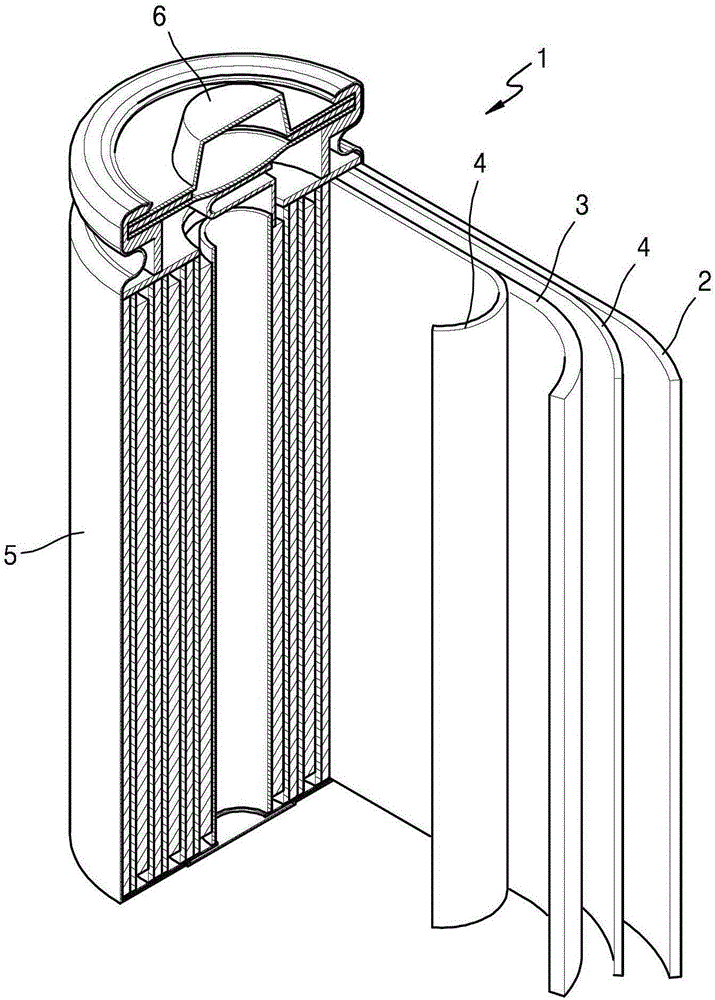
如图1所示,锂电池1可包括正电极3、负电极2和隔板4。可卷绕、堆叠或折叠正电极3、负电极2和隔板4,其后,将它们容纳在电池壳体5中。随后,可向电池壳体5中注入电解质,并用盖组件6来密封电池壳体5,从而完成锂电池1的制造。电池壳体5可具有圆柱形形状、矩形形状、袋形状或薄膜形状。例如,锂电池可以是大尺寸的薄膜型电池。例如,锂电池可以是锂离子电池。
隔板可设置在正电极与负电极之间以形成电池组件。可以以双电池单元结构堆叠多个电池组件并将其浸渍到电解质中,将所得物放进袋中并气密地密封,从而完成锂离子聚合物电池的制造。
在实施方式中,可堆叠电池组件以形成电池组,可在需要高容量和高功率输出的任何装置中使用这样的电池组。例如,可在笔记本电脑、智能手机和电动车辆等中使用电池组。
此外,锂电池可具有优异的寿命特性和高倍率特性,因此可用在电动车辆(EV)中。例如,锂电池可用在诸如插电式混合动力电动车辆(PHEV)等的混合动力车辆中。锂电池还可用在需要储存大量电力的领域中。例如,锂电池可用在电动自行车和电机驱动工具等中。
在此使用的术语“烷基”指完全饱和的支链或非支链(直链或链状)烃。
“烷基”的非限制性示例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、正戊基、异戊基、新戊基、异戊基、正己基、3-甲基己基、2,2-二甲基戊基、2,3-二甲基戊基和正庚基。
“烷基”的至少一个氢原子可被卤素原子、取代有卤素原子的C1-C20烷基(例如,CCF3、CHCF2、CH2F或CCl3等)、C1-C20烷氧基、C1-C20烷氧基烷基、羟基、硝基、氰基、氨基、脒基、肼基、腙基、羧基或其盐、磺酰基、氨磺酰基、磺酸基或其盐、磷酸基或其盐、C1-C20烷基、C2-C20烯基、C2-C20炔基、C1-C20杂烷基、C6-C20芳基、C6-C20芳烷基、C6-C20杂芳基、C7-C20杂芳烷基、C6-C20杂芳氧基、C6-C20杂芳氧烷基或C6-C20杂芳烷基取代。
术语“卤素”指氟、溴、氯和碘等。
在此使用的术语“芳基”也指芳环稠合到至少一个碳环的基团。“芳基”的非限制性示例包括苯基、萘基和四氢萘基。
此外,芳基的至少一个氢原子可被与上述烷基中的取代基相同的取代基取代。
术语“杂芳基”指包含从N、O、P和S中选择的至少一种杂原子并具有碳原子作为剩余成环原子的单环或二环有机化合物。杂芳基可包含例如1至5个杂原子和5至10环成员。S族或N族可通过氧化具有各种氧化态。
杂芳基的示例包括噻吩基、呋喃基、吡咯基、咪唑基、吡唑基、噻唑基、异噻唑基、1,2,3-噁二唑基、1,2,4-噁二唑基、1,2,5-噁二唑基、1,3,4-噁二唑基、1,2,3-噻二唑基、1,2,4-噻二唑基、1,2,5-噻二唑基、1,3,4-噻二唑基、异噻唑-3-基、异噻唑-4-基、异噻唑-5-基、噁唑-2-基、噁唑-4-基、噁唑-5-基、异噁唑-3-基、异噁唑-4-基、异噁唑-5-基、1,2,4-三唑-3-基、1,2,4-三唑-5-基、1,2,3-三唑-4-基、1,2,3-三唑-5-基、四唑基、吡啶-2-基、吡啶-3-基、2-吡嗪-2-基、吡嗪-5-基、2-嘧啶-2-基、4-嘧啶-2-基和5-嘧啶-2-基。
术语“杂芳基”包括杂芳环稠合到芳基、环脂族和杂环基中的至少一者的情形。
现在将参照下面的示例和对比示例更详细地描述电解质和锂电池。这些示例仅为了举例说明的目的而不旨在限制示例的范围。
为了强调一个或更多个实施例的特性,提供下面的示例和对比示例,但将理解的是,示例和对比示例将不被理解为限制实施例的范围,对比示例也不将理解为在实施例的范围之外。此外,将理解的是实施例不局限于在示例和对比示例中描述的具体细节。
示例1:锂电池的制造
首先,通过在EC和DMC的混合溶剂(体积比为3:7)中混合1wt%(相对于电解质的总重量)的由以下的式2表示的化合物(例如,化合物2)和LiPF6(以形成最终1.15M的LiPF6溶液)来制备电解质。
<式2>
使用下面的工艺来制造负电极。
将作为导电物质的97wt%的石墨颗粒(由三菱化工制造的MC20)和1.5wt%的BM408(由Daicel制造)以及作为粘合剂的1.5wt%的BM400-B(由Zeon制造)混合,将此混合物添加到蒸馏水,使用机械搅拌器搅拌得到的溶液60分钟以制备负极活性物质浆料。使用刮片(doctor blade)将负极活性物质浆料涂覆在具有10μm的厚度至大约60μm的厚度的铜(Cu)集流体上,将涂覆的集流体在热气式干燥器中在100℃下干燥0.5小时,随后在真空120℃的条件下进一步干燥4小时并辊压,从而完成负电极的制造。负电极具有1.55g/cc的混合密度和14.36mg/cm2的负载水平(L/L)。
根据下面的工艺单独地制造正电极。
将94wt%的LiNi0.6Co0.2Mn0.2O2(由Samsung SDI制造的NCM 622)、作为导电物质的3.0wt%的乙炔黑(Denka black)以及作为粘合剂的3.0wt%的PVDF(由Solvay制造的Solef6020)混合。将此混合物添加到作为溶剂的N-甲基-2-吡咯烷酮,使用机械搅拌器搅拌得到的混合物30分钟以制备正极活性物质浆料。使用刮片将正极活性物质浆料涂覆在具有20μm的厚度至大约60μm的厚度的铝(Al)集流体上。将涂覆的集流体在热气式干燥器中在100℃下干燥0.5小时,随后在真空120℃的条件下进一步干燥4小时并辊压,从而完成正电极的制造。正电极具有3.15g/cc的混合密度和27.05mg/cm2的负载水平(L/L)。
使用具有16μm的厚度的聚乙烯隔板(由SK Innovation制造)和根据上述工艺制备的电解质来制造锂电池(大约40mAh袋型电池单元)。
示例2:锂电池的制造
除了在制造正电极中使用LiNi0.88Co0.1Al0.02O2代替LiNi0.6Co0.2Mn0.2O2之外,以与示例1的方式相同的方式制造锂电池。
示例3和示例4:锂电池的制造
除了在电解质的制备中式2的化合物的量分别为0.1wt%和10wt%之外,以与示例1的方式相同的方式制造锂电池。
对比示例1:锂电池的制造
除了在电解质的制备中不添加式2的化合物之外,以与示例1的方式相同的方式制造锂电池。
对比示例2:锂电池的制造
除了在制造正电极中用LiCoO2代替LiNi0.6Co0.2Mn0.2O2之外,以与对比示例1的方式相同的方式制造锂电池。
对比示例3:锂电池的制造
除了在制造正电极中用LiNi0.33Co0.33Mn0.33O2代替LiNi0.6Co0.2Mn0.2O2之外,以与对比示例1的方式相同的方式制造锂电池。
对比示例4:锂电池的制造
除了在电解质的制备中不添加式2的化合物之外,以与示例2的方式相同的方式制造锂电池。
对比示例5:锂电池的制造
除了在制造正电极中使用LiCoO2代替LiNi0.6Co0.2Mn0.2O2之外,以与示例1的方式相同的方式制造锂电池。
对比示例6:锂电池的制造
除了在制造正电极中使用LiNi0.33Co0.33Mn0.33O2代替LiNi0.6Co0.2Mn0.2O2之外,以与示例1的方式相同的方式制造锂电池。
评价示例1:微分容量曲线(dQ/dV)
示例1和对比示例1的锂电池各自在环境温度(25℃)下使用0.5C倍率的恒流充电直到电压达到4.20V(相对于Li),然后在保持4.20V的恒压的情况下,以0.05C倍率的电流截止充电过程。随后,使用0.5C倍率的恒流使各个锂电池放电直到电压达到2.80V(相对于Li)(化成操作,第一循环)。
已经历化成操作的各个锂电池在25℃下使用0.5C倍率的恒流充电直到电压达到4.20V(相对于Li),然后在保持4.20V的恒压的情况下,以0.05C倍率的电流截止充电过程。随后,使用1.5C倍率的恒流使各个锂电池放电直到电压达到2.80V(相对于Li),重复此充电和放电循环300次。
评价所得锂电池的微分容量特性并在图2中示出评价结果。
参照图2,可以看出,示例1的锂电池在对比示例1的锂电池之前在大约2V下经历分解反应。从结果可看出当向电解质添加式1的化合物时,式1的化合物在电解质的其它组分之前分解,从而在负电极的表面处形成作为保护膜的SEI膜。
评价示例2:阻抗特性
1)示例1和对比示例1
示例1和对比示例1的锂电池各自在环境温度(25℃)下使用0.5C倍率的恒流充电直到电压达到4.20V(相对于Li),然后在保持4.20V的恒压的情况下,以0.05C倍率的电流截止充电过程。随后,使用0.5C倍率的恒流使各个锂电池放电直到电压达到2.80V(相对于Li)(化成操作,第一循环)。
根据2-探针方法在25℃下使用1260A阻抗/增益相位分析仪(Solartron)测量经历化成操作的锂电池的电阻。就这点而言,幅度为±10mV,频率范围是0.1Hz至1MHz。
在制造示例1和对比示例1的锂电池之后的24小时后测量其阻抗,在图3中示出针对阻抗测量结果的奈奎斯特曲线。在图3中,由半圆的位置和尺寸确定电极界面电阻。就这一点而言,半圆左侧和右侧上的x轴上的截距之间的差表示电极界面电阻。
2)示例2和对比示例4
使用与在示例1和对比示例1的锂电池的电阻测量中使用的评价方法相同的评价方法来测量示例2和对比示例4的锂电池的电阻,在图4中示出测量结果。
3)对比示例2和对比示例5
使用与在示例1和对比示例1的锂电池的电阻测量中使用的评价方法相同的评价方法来测量对比示例2和对比示例5的锂电池的电阻,在图5中示出测量结果。
4)对比示例3和对比示例6
使用与在示例1和对比示例1的锂电池的电阻测量中使用的评价方法相同的评价方法来测量对比示例3和对比示例6的锂电池的电阻,在图6中示出测量结果。
参照图3至图6,可看出与对比示例1至对比示例6的锂电池相比,示例1和示例2的锂电池展现出减小的界面电阻。对比示例3和对比示例6的锂电池使用具有少的镍含量的锂镍基复合氧化物,因此,与示例1的锂电池相比,前者展现出增加的界面电阻。从结果可看出,包含50mol%或更多的镍的富镍的正极活性物质具有显著的电阻减小效果。这些结果归因于:当包括式1的化合物的电解质与包括富镍的正极活性物质的正电极一起使用时,式1的化合物在Li负电极处比在正电极处形成更多的SEI层,SEI层用作有效的保护膜,抑制电解质的有机溶剂的还原分解。
评价示例3:高温(45℃)充电和放电特性
1)示例1和对比示例1
示例1和对比示例1的锂电池各自在25℃下使用0.1C倍率的恒流充电直到电压达到4.30V(相对于Li),然后在保持4.30V的恒压的情况下,以0.05C倍率的电流截止充电过程。随后,使用0.1C倍率的恒流使各个锂电池放电直到电压达到2.8V(相对于Li)(化成操作,第一循环)。
已经历化成操作(第一循环)的各个锂电池在25℃下以1.0C倍率的恒流充电直到电压达到4.20V(相对于Li),然后在保持4.20V的恒压的情况下,以0.05C倍率的电流截止充电过程。随后,使用0.2C倍率的恒流使各个锂电池放电直到电压达到3.0V(相对于Li)(化成操作,第二循环)。每个所得锂电池在45℃下使用1.0C倍率的恒流充电直到电压达到4.20V(相对于Li),然后在保持4.20V的恒压的情况下,以0.05C倍率的电流截止充电过程。随后,使用1.0C倍率的恒流使各个锂电池放电直到电压达到3.0V(相对于Li),重复此充电和放电循环200次。
在所有的充电和放电循环中,在每个循环结束时存在20分钟的休息期。
在图7中示出充电和放电实验结果的一部分。
2)示例2和对比示例4
使用与在示例1和对比示例1的锂电池的电阻测量中使用的评价方法相同的评价方法来测量示例2和对比示例4的锂电池的电阻,在图8中示出测量结果。
3)对比示例2和对比示例5
使用与在示例1和对比示例1的锂电池的电阻测量中使用的评价方法相同的评价方法来测量对比示例2和对比示例5的锂电池的电阻,在图9中示出测量结果。
4)对比示例3和对比示例6
使用与在示例1和对比示例1的锂电池的电阻测量中使用的评价方法相同的评价方法来测量对比示例3和对比示例6的锂电池的电阻,在图10中示出测量结果。
参照图6至图10,可看出与对比示例1至对比示例6的锂电池相比,示例1和示例2的锂电池展现出显著的增强的放电容量和寿命特性。
此外,使用与用于示例1和示例2的锂电池的方法相同的方法来评价示例3和示例4的锂电池的充电和放电实验结果。
作为评价的结果,示例3和示例4的锂电池展现出与示例1的锂电池的放电容量和寿命特性几乎相似的放电容量和寿命特性。
评价示例4:在高温(60℃)储存之后的阻抗特性
1)示例1和对比示例2
示例1和对比示例2的锂电池各自在25℃下使用0.1C倍率的恒流充电直到电压达到4.30V(相对于Li),然后在保持4.30V的恒压的情况下,以0.05C倍率的电流截止充电过程。随后,使用0.1C倍率的恒流使各个锂电池放电直到电压达到2.8V(相对于Li)(化成操作,第一循环)
已经历化成操作(第一循环)的各个锂电池在25℃下使用1.0C倍率的恒流充电直到电压达到4.20V(相对于Li),然后在保持4.20V的恒压的情况下,以0.05C倍率的电流截止充电过程。随后,使用0.2C倍率的恒流使各个锂电池放电直到电压达到3.0V(相对于Li)(化成操作,第二循环)。
各个锂电池在25℃下使用1.0C倍率的恒流充电直到电压达到4.30V(相对于Li),然后在保持4.30V的恒压的情况下,以0.05C倍率的电流截止充电过程以形成4.3V的完全充电状态(SOC=100%)
在烘箱中在60℃的高温下储存各个所得的锂电池20天,根据2-探针方法在25℃下使用1260A阻抗/增益相位分析仪(Solartron)测量其电阻。就这点而言,幅度为±10mV,频率范围是0.1Hz至1MHz。
在制造示例1和对比示例2的锂电池之后的24小时后测量其阻抗,在图11中示出针对阻抗测量结果的奈奎斯特曲线。
2)示例2和对比示例4
使用与在示例1和对比示例1的锂电池的电阻测量中使用的评价方法相同的评价方法来测量示例2和对比示例4的锂电池的电阻,在图12中示出测量结果。
3)对比示例2和对比示例5
使用与在示例1和对比示例1的锂电池的电阻测量中使用的评价方法相同的评价方法来测量对比示例2和对比示例5的锂电池的电阻,在图13中示出测量结果。
4)对比示例3和对比示例6
使用与在示例1和对比示例1的锂电池的电阻测量中使用的评价方法相同的评价方法来测量对比示例3和对比示例6的锂电池的电阻,在图14中示出测量结果。
参照图11至图14,可看出在高温(60℃)储存之后,示例1和示例2的锂电池展现出比对比示例2和对比示例3的锂电池的电阻增大更小的电阻增大。
通过总结和回顾,可在高的操作电压下操作锂电池,因此,可不使用与锂高度反应的水性电解液。例如,可在锂电池中使用有机电解质。可通过在有机溶剂中溶解锂盐来制备有机电解质。例如,有机溶剂可以是在高电压下稳定并可具有高离子传导率、高介电常数和低粘度的有机溶剂。
LiPF6可用作锂盐。然而,LiPF6可与电解质的有机溶剂反应,并因此可使有机溶剂的消耗和大量气体的产生加快。此外,当碳酸酯类极性非水溶剂被用作有机溶剂时,会进行在初始充电期间负电极/正电极与电解质之间的副反应使用过量电荷的不可逆反应。由于不可逆反应,可在负电极的表面上形成诸如固体电解质界面(SEI)层的钝化层。SEI层可防止在充电和放电期间的电解质的分解,并用作离子隧道。由于SEI层具有更高的稳定性和更低的电阻,因此锂电池可具有更长的寿命。
为了稳定SEI层,可使用各种添加剂。使用一些添加剂形成的一些SEI层在高温下会容易劣化。例如,SEI层会在高温下具有降低的稳定性。实施例可提供这样的电解质,其帮助抑制LiPF6的副反应并帮助形成具有增强的高温稳定性的SEI层。
从以上描述明显的是,根据实施例的锂电池展现增强的高温寿命特性并抑制电阻的增大。
实施例可提供具有增强的电池单元性能的锂电池。
已经在这里公开了示例实施例,尽管采用了具体术语,但仅以一般的和描述性的含义来使用和解释这些术语,而不是出于限制的目的。在一些情况下,如对截止到本申请提交时的本领域普通技术人员而言明显的是,除非另有明确说明,否则结合具体实施例描述的特征、特性和/或元件可单独使用,或者可与结合其它实施例描述的特征、特性和/或元件组合地使用。因此,本领域技术人员将理解的是,在不脱离如权利要求书中阐述的本发明的精神和范围的情况下,可以进行形式上和细节上的各种变化。
- 还没有人留言评论。精彩留言会获得点赞!