锂氧电池的制作方法
本发明是由美国政府支持在美国能源部授予的主合同de-ac02-05ch11231之下完成的。美国政府对本发明享有一定的权利。
相关申请
本案要求享有2015年7月20日提交的gb1512726.9的优先权和权益,以其全部内容通过引证结合于本文中。
本发明提供了用于锂氧电池的充电和放电的方法,以及用于这种方法的锂氧电池。
背景技术:
可充电的非水性li-氧(o2)电池在过去的十年中引起了相当大的兴趣,因为它们比传统的li离子电池具有高得多的理论比能量(girishkumaretal.;bruceetal.;lu,etal.)。典型的li空气电池由li金属负电极,非水性li+电解质和多孔正电极构成。在放电期间,o2被还原并与正电极上的li+结合,形成填充多孔电极的不溶性放电产物(通常为li2o2)(mitchelletal.;adamsetal.;gallantetal.2013)。多孔电极不是活性材料,而是一种容纳反应产物的导电性的稳定框架。因此,较轻的电极材料是有利的,从而提供较高的比能。在充电期间,需要彻底去除先前形成的放电产物,以防止电池在几个放电-充电循环之后就受到抑制,电极孔隙迅速被放电产物和来自有害副反应的产物堵塞(参见,例如,freunbergeretal.j.am.chem.soc;mccloskeyetal.j.phys.chem.lett.2011;freunbergeretal.angew.chem.int.ed.;mccloskeyetal.2012;gallantetal.2012;ottakamthotiyletal.j.am.chem.soc.;leskesetal.)。
几个基本的挑战仍然限制了锂li-氧电池的实际实现(girishkumaretal.;bruce,etal.;lu,etal.)。第一个涉及li-氧电池的可逆容量(以及因此的能量密度)。这由多孔电极的孔隙体积决定,其既限制了放电产物的总量又以及放电产物晶体可以生长多大。目前还远未达到的极限容量在理论上会在放电产物的大单晶生长而占据正极的整个几何体积的极端情况下达到。
本领域常用的介孔superp(sp)/科琴碳电极具有相对小的孔径和体积,其结晶放电产物尺寸通常小于2μm(girishkumaretal.;bruceetal;zhai,etal.);这会将容量限制为<5000mah/gc(通常基于1mg碳和粘合剂为至1.5mah)(freunbergeretal.j.am.chem.soc;mccloskeyetal.j.phys.chem.lett.2011;freunbergeretal.angew.chem.int.ed.;mccloskeyetal.2012;ottakamthotiyletal.j.am.chem.soc.;leskesetal.)。另外,使用较小的孔隙会导致孔隙堵塞,阻碍o2和li+的扩散,并在循环期间导致较高的超电势。
第二个问题涉及在循环时发生的严重副反应,涉及电极材料、电解质和中间体以及最终的放电产物(freunbergeretal.j.am.chem.soc;mccloskeyetal.j.phys.chem.lett.2011;freunbergeretal.angew.chem.int.ed.;mccloskeyetal.2012;gallantetal.2012;ottakamthotiyletal.j.am.chem.soc.;leskesetal.)。认为这些分解反应具有两个主要来源,首先,在氧还原时作为中间体形成的超氧离子容易进攻大多数电解质(freunbergeretal.;mccloskeyetal.;freunbergeretal.;nasybulinetal.),其次,通常除去绝缘性放电产物所需的充电大超电位会导致如主电极的电池组件的氧化(mccloskeyetal.;gallantetal.;ottakamthotiyletal.j.am.chem.soc.;leskesetal.)。研究表明,3.5v(相对于li/li+)代表了基于碳的电极在没有显著副反应的情况下可以耐受的最大电压(出处同上)。
第三个问题涉及在充电和放电(高达2v)之间观察到的较大迟滞,导致极低的能量效率,限制了这种电池在实际应用中的使用(mitchelletal.;adamsetal.;gallantetal.2013;freunbergeretal.j.am.chem.soc;mccloskeyetal.j.phys.chem.lett.2011;freunbergeretal.angew.chem.int.ed.;mccloskeyetal.2012;gallantetal.2012;ottakamthotiyletal.j.am.chem.soc.;leskesetal.)。
最后,电池对水分和二氧化碳非常敏感(gowdaetal.;limetal.j.am.chem.soc.;liuetal.;guoetal.)。在空气中的电池工作期间,h2o和co2容易与li2o2反应而形成更稳定的lioh和li碳酸盐相,其会逐渐积累于电池中,导致电池失效。也已知水分和co2对li-金属负极具有有害作用(girishkumaretal.;bruceetal.;lu,etal.)。
已经提出许多降低电压迟滞的策略,包括使用电催化剂(luetal.2011;mccloskeyetal.j.am.chem.soc.2011;hyoungetal.adv.energymater.;hyoungetal.nat.chem.;luetal.2013;jungetal.;yilmazetal.;sunetal.nanolett.),多孔电极结构(xiaoetal.;wangetal.;limetal.adv.mater.)和氧化还原介体(laceyetal.;chenetal.;sunetal.j.am.chem.soc.;limetal.angew.chem.int.ed.;kwaketal.)。值得注意的是,可溶性氧化还原介体如四硫富瓦烯(tetrathiafuvalene)(ttf)(chenetal.)和lii(limetal.angew.chem.int.ed.)已经用于降低充电过程的过电压,电压迟滞降低至约0.5v。它们的运作依赖于介体的电化学氧化,随后通过氧化的介体的li2o2的化学分解。充电电压因此被调至接近介体的氧化还原电势。对于放电,还使用了乙基紫精(ethylviologen)的氧化还原对。这种可溶性介体的作用是降低液体电解质中的o2,而不是降低固体电极表面上的o2,使得有助于防止由随后形成的导电性差的li2o2相所致的固体电极表面的迅速阻隔(laceyetal.)。
另一个重要的问题是li-空气电池中的湿敏化学:在电池于空气中工作期间,水可能逐渐积累在电池中,则很容易将li2o2转化成更稳定的lioh,从而废掉电池。
本发明人已经开发出具有极高的效率,大容量和很低的过电压的锂氧电池。
技术实现要素:
本发明总体提供了用于在锂氧电池内进行充电和/或放电步骤的方法,方法包括以下步骤:(i)在工作电极处由锂离子生成氢氧化锂(lioh),和/或(ii)在工作电极处由氢氧化锂(lioh)生成锂离子。
出乎意料地,本发明人已经发现,锂氧电池可以经由lioh晶体的可逆形成和除去而运行。因此,与此前的报道相反,lioh是锂氧电池中有用的放电产物。另外,在锂氧电池的充电步骤中,lioh是有用的氧源。
本发明的方法对电化学电池内高水平耐受的水的存在是不敏感的。实际上,水的存在可以允许在锂氧电池的初始和/或后续循环中形成lioh放电产物。因此,本发明的方法允许在真实、实际的条件下使用锂氧电池。
本发明人已经发现,利用氢氧化锂作为放电产物的锂氧电池具有高能量效率,优异的可循环性和相对低的过充电电位。例如,本发明人发现,这种电池具有0.2v的电压间隙(voltagegap),并且电池可以在1,000mah/g下循环超过2000个循环,而没有容量衰减。电池具有超过90%的计算效率。因此,本发明的锂氧电池直接解决了许多限制已知锂氧电池使用的关键问题。
在本发明的第一方面中,提供了用于锂氧电池的放电和/或充电的方法,方法包括:
(i)在放电步骤中,在锂氧电池中,如在工作电极上或工作电极内生成放电产物,其中放电产物包含lioh;和/或
(ii)在充电步骤中,在锂氧电池中,如lioh处于工作电极上或工作电极内的情况下,消耗lioh。
锂氧电池可以具有包含有机溶剂的电解质,并且在充电步骤之后可选地电解质的水含量为0.01wt%或更多。
在一个实施方式中,放电产物中的lioh的量大于li2o2的量。lioh可以是放电步骤中形成的主要锂产物。放电步骤与氧的消耗相关。lioh可以是放电步骤中消耗的氧的主要终产物。
充电步骤与氧和可选的水的生成有关。在一个实施方式中,充电步骤中消耗的lioh的量大于li2o2的量。lioh可以是充电步骤中的主要氧源。
在一个实施方式中,方法包括步骤(i)和步骤(ii)(充电和放电循环)。步骤(i)可以在步骤(ii)之前或之后进行。步骤(i)和(ii)可以,例如,以多个充电/放电序列(多个充电和放电循环)重复。本发明人已经发现这种系统与超高效率,大容量和优异的循环能力相关。
在一个实施方式中,充电步骤在氧化还原介体如碘基介体如基于碘化物的介体的存在下进行。例如,i/i3-可以在电池中可逆循环。
在本发明的另一方面中,提供了在锂氧电池的氧还原反应中氢氧化锂作为放电产物的用途。
在本发明的另一方面中,提供了氢氧化锂作为锂氧电池中的析氧反应中的试剂的用途。另外,氢氧化锂可以是用于在锂氧电池中产生水的试剂。
因此,氢氧化锂可以称为锂氧电池中的氧受体和供体,并且在已知的锂氧电池中,其使用优选于锂过氧化物和/或锂氧化物。
在进一步的方面中,提供具有包含锂放电产物的工作电极的放电的锂氧电池,其中锂放电产物中的lioh的量大于li2o2的量。
放电的锂氧电池可以是部分或完全放电的锂氧电池。因此,电池可以放电至其预定的放电极限,或放电至低于放电极限的放电值。
放电产物可以基本上不含li2o2。lioh可以是主要的放电产物。
在另一方面中,提供具有其中电解质的水含量为0.01wt%或更多的电解质的充电的锂氧电池。
充电的锂氧电池可以是部分或全充电的锂氧电池。
电解质的水含量可以为0.5wt%或更多,例如,1.0wt%或更多。
下面进一步详细描述本发明的这些和其他方面和实施方式。
附图说明
图1(a)显示了使用介孔sp和tic以及大孔rgo电极的li-o2电池的放电-充电曲线,其中容量限于500mah/g(基于碳或tic的质量)。所有电池都使用0.25mlitfsi/dme电解质。对于sp和rgo电极,在第二组电极中的litfsi/dme电解质中加入0.05mlii(紫色和红色曲线)。(a)中的所有电池以0.02ma/cm2循环。水平虚线表示li-o2电池的热力学电压的位置(2.96v)。图1(b)显示了含有0.05mlii和0.25mlitfsi的电池的恒电流充放电曲线,使用不同电极/电解质溶剂组合在ar气氛下循环。(b)中的所有电池以0.2ma/cm2循环。充放电曲线的交叉点(在图中标号)表示特定电极-电解质体系中i-/i3-的氧化还原电位的位置。图1(b)中的tic和rgo电池的容量分别放大5倍和0.2倍,以更清楚地示出lii的相应氧化还原电位;图15中给出了ar中的lii和li-o2电池的容量之间的直接比较。放电-充电曲线显示了电压(v)随着容量(mah/g碳)变化的变化。
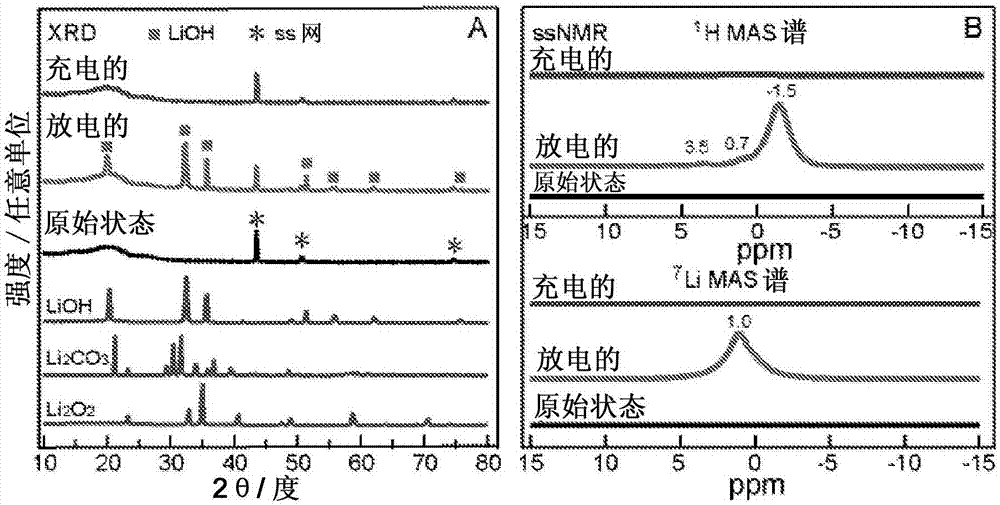
图2显示了在0.05mlii/0.25mlitfsi/dme电解质中原始状态的rgo电极与放电和充电结束时的电极的比较的xrd图谱(a)以及1h和7lissnmr谱图(b)。光谱图根据原始状态电极的质量和扫描次数缩放。图2(a)中的星号表示来自不锈钢网的衍射峰。值得注意的是,原始状态rgo电极中含质子官能团的1h共振在图2(b)中的1hssnmr谱中不可见,因为它们与lioh信号相比非常弱。1hnmr谱中在3.5和0.7ppm处的较弱信号分别归因于dme和油脂/背景杂质信号。xrd谱显示了强度(任意单位)随着2θ(度)变化的变化;nmr谱显示强度(任意单位)随化学位移(ppm)变化的变化。
图3显示了在第一个循环中使用0.05mlii/0.25mlitfsi/dme电解质获得的原始状态的、完全放电和充电的rgo电极的光学和sem图像。光学图像中的比例尺全部为5mm,而sem图像中的全部为20μm。
图4显示了使用rgo电极和0.05mlii/0.25mlitfsi/dme电解质的容量限制为1,000mah/gc(a),5,000mah/gc(b)和8,000mah/gc(c)以及以不同的速率循环(d)的li-o2电池的放电-充电曲线;(d)中每种速率进行3次循环。电池循环率基于rgo的质量,例如5a/gc等于0.1ma/cm2。放电-充电曲线显示了电压(v)随容量(mah/gc)变化的变化。
图5是(a)至(d)各种放大倍数下的多级大孔rgo电极,(e)介孔superp(sp)碳电极;和(f)介孔tic电极的一系列sem图像。在图像(a),(b)和(d)中所示的比例尺分别是100μm,50μm和5μm。在图像(c),(e)和(f)中所显示的比例尺为20μm。
图6显示(a)在ar气氛下在0.25mlitfsi/dme中使用rgo,superp(sp)和tic电极的电池的循环伏安图;(b)比较在ar气氛下0.05mlii/0.25mlitfsi/dme和tegdme电解质中使用rgo电极的电池的循环伏安图;和(c)在ar气氛下0.05mlii/0.25mlitfsi/dme中使用sp和tic电极的电池的循环伏安图。所有电池的扫描速度是5mv/s。循环伏安图显示了电流(ma)随电压(v)变化的变化。
图7显示了(a)在0.25mlitfsi/dme电解质中使用rgo电极的li-o2电池的电化学(蓝色曲线)和通过ssnmr(b)和sem(c)和(d)的放电的rgo电极的表征。放电-充电曲线显示了电压(v)随着容量(mah)变化的变化。nmr谱显示了随着强度(任意单位)随着化学位移(ppm)变化的变化。图7(c)和(d)中的比例尺分别为5.0μm和2.0μm。
图8显示在ar手套箱(<0.1ppmh2o)内用0.05mlii/0.25mlitfsi/dme电解质放电的li-o2电池中使用的rgo电极的ssnmr谱。分别在1h中-1.5ppm处和在7limas谱中1.0ppm处的主共振,以及7li静态谱的特征线形态均表明lioh是这种电池的主要放电产物。1h谱中标记的其他共振归因于电极中的残余dme。nmr谱显示了强度(任意单位)变化随着化学位移(ppm)变化的变化。
图9显示了(a)在0.05mlii/0.25mlitfsi/dme电解质中使用rgo电极以8a/gc速率循环的li-o2电池的放电-充电曲线,和(b)作为周期数的函数的相应端电压。图9(c)是来自(a)中的li-o2电池的rgo电极在42个循环之后的sem图像。图9(d)表示循环1,000次循环,容量限制于1,000mah/gc,而随后使用22,000mah/gc可逆容量以1a/gc的速率特意进行深得多的放电-充电循环(15次循环)的li-o2电池。除了由于许多之前的循环而导致的更大的电压极化之外,电池仍然表现出良好的可逆性。放电-充电曲线显示了电压(v)随着容量(mah/gc)随电压变化的变化。也随循环次数的变化示出电压(v)的变化。sem图像中的比例尺为10.0μm。
图10显示了来自使用0.05mlii/0.25mlitfsi/dme电解质的li-o2电池的放电的rgo电极在11.7t下获得的7li静态nmr谱与lioh、li2co3和li2o2的模型化合物的那些之间的对比。nmr谱显示了强度(任意单位)随化学位移(ppm)变化的变化。
图11(a)至(c)是在0.05mlii/0.25mlitfsi/dme电解质中完全放电的rgo电极的一系列sem图像。图11(a)显示了外表面,而图11(b)至(c)显示了内部空间。图11(d)是玻璃纤维隔板的sem图像。图11(a)中的比例尺是200.0μm。图11(b)至(d)中的比例尺为20.0μm。
图12显示了(a)在0.05mlii/0.25mlitfsi/tegdme电解质中使用rgo电极的li-o2电池的电化学;(b)通过ssnmr对放电的rgo电极的表征;和(c)通过sem对放电的rgo电极的表征。放电-充电曲线显示了电压(v)随容量(mah/gc)变化的变化。nmr谱显示了强度(任意变化)随化学位移(ppm)变化的变化。sem图像中的比例尺是20.0μm(顶部)和5.00μm(底部)。
图13显示了(a)在0.05mlii/0.25mlitfsi/dme电解质中使用sp碳电极的li-o2电池的电化学;(b)通过ssnmr对放电的sp电极的表征,在11.7t下获得;和(c)通过sem对放电的sp电极的表征,其中图像显示了原始状态的电极(顶部),完全放电的电极(中部)和完全充电的电极(底部)。放电-充电曲线显示了电压(v)随着电容(mah/gc)变化的变化。nmr谱显示了强度(任意单位)随着化学位移(ppm)变化的变化。sem图像中的比例尺是5.00μm。
图14显示了在0.05mlii/0.25mlitfsi/dme电解质中使用rgo电极循环的li-o2电池的放电-充电曲线,其中图14(a)显示了电解质中具有45,000ppm所加入的水的电池的曲线;而图14(b)显示了已使用通过水起泡器(湿o2)的o2气体吹扫的电池的曲线。放电-充电曲线显示了电压(v)随着电容(mah/gc)变化的变化。
图15显示了在电极为sp(左上),tic(右上)和rgo(下)的情况下在ar气氛中在0.25mlitfsi/tegdme和dme电解质中,用0.05mlii循环的电池的恒电流充电-放电曲线。每个电池首先充电,而随后放电。每个图中的灰色线显示了在相同的dme基电解质在o2气氛中放电的相应电极。放电-充电曲线显示了电压(v)随着电容(mah/gc)变化的变化。
具体实施方式
本发明人确定了氢氧化锂(lioh)作为锂氧电池(锂-空气电池)中有用的氧化还原活性物质。氢氧化锂可以用作锂氧电池中目前标准的氧化还原活性物质过氧化锂(li2o2)的替代放电产物。
充分研究了在锂-空气电池中氧还原步骤期间氢氧化锂的形成。氢氧化锂的形成被认为是有问题的,并且该产物被认为是产生li2o2的电化学反应中不期望的副产物。到目前为止,许多研究人员研究最小化或防止氢氧化锂的形成,以期增加放电反应期间形成的li2o2的量。
例如,kwaketal.研究在含有氧化还原介体(lii)的锂氧电池中的氢氧化锂的形成。此处作者解释,氢氧化锂连同期望的过氧化锂(li2o2)一起形成会降低电池的容量,并且据说这是所考虑的系统的主要缺点。作者将氢氧化锂(不期望的)的形成与电化学介体的存在相关联,并且降低介体的量以最小化氢氧化锂的形成。
limetal.也描述了使用lii介体的锂氧电池。作者还指出了在电化学电池的循环期间(在li2o2的正常形成和消耗期间)在竞争性副反应中不期望的氢氧化锂的形成。由作者开发的系统据称会抑制副反应,因为电池的工作电压低于与副产物形成相关的电压。
以下讨论的电压值是参照于li/li+的,这在本领域中是常见的。
us2012/0028164描述了一种锂氧电池。锂离子导电固体电解质膜形成于负极的表面上。这起到防止水性电解质中包含的水与负极包含的锂直接反应的保护层的作用。此处,lioh在放电步骤期间形成。lioh溶于水性电解质中。
类似地,us2007/029234描述了一种锂氧电池,其中水性电解质通过不透水离子膜与锂负极分隔。在放电反应期间会产生lioh,其在水性电解质中是高度可溶的。
cn102127763也描述了具有水性电解质的锂氧电池。这种电解质也通过仅允许锂离子通过的无机膜与锂阳极分隔开。锂阳极本身提供于容纳疏水离子液体的腔室中。阴极置于水基电解质中。在放电反应期间会产生lioh,其在水基电解质中是高度可溶的。
在本案的优先权日之后公开的wo2016/036175描述了使用非水性电解质四乙二醇二甲醚的锂氧电池。据称lioh通过包括形成作为与四乙二二甲醚反应的中间物质的li2o2的一系列复杂反应而作为放电产物产生。
本发明的方法
本案提供了用于锂氧电化学电池的充电和/或放电的方法。该方法基于电池内氢氧化锂的形成和/或降解,且特别是电池的工作电极上和/或工作电极内的氢氧化锂的形成和/或降解。
在本发明的第一方面中,提供了用于锂氧电池的放电和/或充电的方法,方法包括:
(i)在放电步骤中在锂氧电池中产生放电产物,其中放电产物包含lioh;和/或
(ii)在充电步骤中消耗锂氧电池中的lioh。
通常氢氧化锂是氧还原反应(放电步骤)的主要产物。因此,放电反应中形成的氢氧化锂的摩尔量可能大于形成的过氧化锂的摩尔量。
放电产物可以仅是指在工作电极上形成的产物。lioh的消耗量可以是指仅在工作电极上的放电产物的消耗量。
在一个实施方式中,在放电反应中形成的氢氧化锂的量为在放电反应中形成的氢氧化锂和过氧化锂的总摩尔量的至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、或至少95%,如作为参照。在进一步的实施方式中,总量可以是指在放电反应中形成的所有锂产物的总量,或可以是指在放电反应中形成的氢氧化锂,过氧化锂和氧化锂的总量。
在一个实施方式中,放电反应中形成的基本上全部锂产物是氢氧化锂。
在一个实施方式中,放电产物基本上不含li2o2。此外,第一次放电步骤后的放电产物基本上不含li2o2。
在步骤(ii)中,lioh的消耗与可选地与水一起的氧气的产生相关。这个步骤中的氧的析出可以通过质谱确定。
结果是氢氧化锂是氧释放反应中氧的主要来源。氢氧化锂也可以是析氧反应中的水源。
因此,析氧反应中消耗的氢氧化锂的摩尔量可能大于消耗的过氧化锂的摩尔量。
在一个实施方式中,在析氧反应中消耗的氢氧化锂的相对量是析氧反应中消耗的氢氧化锂和过氧化锂的总摩尔量的至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、或至少95%。在进一步的实施方式中,总量可以是指在析氧反应中消耗的所有锂产物的总量,或其可以是指在析氧反应中消耗的氢氧化锂、过氧化锂和氧化锂的总量。
在一个实施方式中,在析氧反应中消耗的全部锂产物基本上都是氢氧化锂。
在放电步骤中形成的氢氧化锂的量可以通过标准分析手段进行测定。例如,本发明人已经使用固态7li和1hnmr技术测定存在于碳电极内的锂产物。lioh与li2o2相比的相对量可以由17onmr光谱中的相关峰的积分而确定。本文中,由于不同的放电产物产生的17o共振在谱图中是特征性的(参见,例如,leskesetal.)。nmr技术可以用于测定放电和充电步骤中lioh的形成和分解。
7linmr测定通常给出定性信息,因为可能的放电产物(lioh、li2co3、li2o2)具有非常相似的7li共振。然而,它们各自的静态nmr谱具有不同的线形(例如,参见图10),并且在本案中,放电产物的静态nmr谱图清楚地表明lioh是主要的放电产物。
lioh的存在也可以通过放电后电极材料的xrd确定。在用于本发明的电池中,li2o2在放电的电极的xrd谱中不可见。ftir分析也可用于识别电极内的li2o2和lico3产物。
还可以通过横贯工作电极和工作电极内出现大量的白色产物目视观察lioh产物的形成。当工作电极是特征性的黑碳电极时,这种效果特别明显。例如,参见图3中的图像,其显示了原始状态碳工作电极(在这种情况下是rgo电极)的放电和充电之后的颜色变化。
在锂氧电池中形成氢氧化锂可能是由一系列相关的反应引起的。氢氧化锂不一定是锂离子和氧之间的反应的直接产物。
在本发明的优选方法中,使用了碘化物介体(i3-/i-)可逆地循环锂氧电池。在充电时,lioh被除去,并且认为本发明人认为这是通过lioh与i3-的反应而发生的,而锂离子和i-与o2一起产生。
放电步骤的化学过程可能是复杂的,因为i3-也可以反应而形成亚稳态io-,随后连同锂离子一起不成比例地形成io3-和i-。存在于用于本发明的锂氧电池的电解质中的相对较低浓度的水会驱动形成锂离子产物的反应。本发明人已经发现,lioh与i3-形成锂离子和i-的反应在水性条件下是占优势的。该反应速率显著减慢,但仍然会发生于含有3wt%至6wt%水的溶剂如dme中。
在本案中的工作表明,锂氧电池的重复循环提供了每个放电步骤中的lioh产物,并且肯定超过第一次充电/放电循环。
本发明的方法可以包括步骤(i)和(ii)。这些步骤的组合可以称为循环(如充电和放电循环)。步骤(i)和(ii)可以重复多次。放电和充电循环可以重复一次或多次,2次或更多次。因此,在一个实施方式中,方法包括2个或更多个循环、5个或更多个循环、10个或更多个循环、50个或更多个循环、100个或更多个循环、500个或更多个循环、1000个或更多个循环、或2000个或更多个循环。本发明人已经发现,用于本发明的方法中的电池可以循环多次而不会出现容量衰减。
在一个实施方式中,步骤(i)在步骤(ii)之前进行。
在一个实施方式中,在原始状态的电池上进行步骤(i)或步骤(ii)。原始状态的电池是先前未经历充电或放电步骤的电池。
形成lioh的反应也可以涉及介体,如基于碘化物的介体的使用。本案的工作被认为是利用了i-/i3-电对。
当在充电步骤期间存在碘化物介体时,在约3v处观察到lioh分解/溶解反应,这是本工作与其他人报道的分解/溶解反应的明显区别(参见limetal.;kwaketal.)。考虑到该充电电压与i-/i3-本身的充电电压的重叠,第一步骤必须涉及i-到i3-的直接电化学氧化。然后,i3-物质氧化lioh而形成o2和h2o。考虑到电池继续循环,尽管在这个反应中产生了大量的水,但是水显然必须不对电池性能具有不利的影响。
因此,该反应的方法包括使用锂离子,氧和氢源来形成氢氧化锂的步骤。氢氧化锂的形成可以发生在电极的表面和/或多孔电极的孔内。在本情况的方法中,lioh的氢源可以是电解质中的水。优选地,lioh的主要氢源不是电解质溶剂。
下面将进一步详细描述用于方法的电极。
本发明的方法涉及放电步骤期间氢氧化锂产物的形成。本发明人已经确定,这种形成在电池内是可逆的。氢氧化锂形成为具有相对较大尺寸的产物,如结晶产物。广义上,氢氧化锂可以形成为颗粒,并且这些可以形成更大的团聚体。
lioh在放电期间形成为不溶产物,并且其形成位于工作电极上。lioh产物可以存在于电极的外表面上和/或多孔电极的孔内。因此,电化学电池的容量很大,因为在整个工作电极上允许形成大量的氢氧化锂。
在一个实施方式中,放电步骤在工作电极的表面上形成lioh产物,如团聚体,其中lioh产物的平均最大尺寸为至少0.1μm、至少1μm、至少10μm或在至少25微米。
在一个实施方式中,放电步骤在多孔工作电极的孔内形成lioh产物,如颗粒。lioh产物可以具有至少1μm、至少5μm、至少10μm或至少15μm的平均最大尺寸。在其中li2o2是放电产物的相应系统中,本发明人已经发现产物具有小于1μm的平均最大尺寸。
本发明人认为,使用氧化还原介体允许在放电步骤中形成作为主要产物的lioh,并且还允许形成增大的产物材料,如团聚体和大颗粒。
lioh颗粒的尺寸可以由放电步骤后的电极的sem图像确定。
通过眼睛也可以观察到lioh产物的形成,在整个电极上会出现大量白色产物。当工作电极是黑色时(如当使用碳基电极时),这是特别明显的。
充电的电化学电池的sem图像也表明,工作电极之上和之内残留的lioh量是极小的:只有在更高的放大倍数下可以观察到电极表面上未消耗的(残留的)lioh。观察到残余的lioh的量会随着循环次数而增加。然而,在一个或多个充电步骤期间,可以通过有意的过充电而去除这种残留的lioh。以这种方式,在大量的充电和放电循环中可以最小化容量的损失。
锂氧电池
锂氧电池通常可以是指用于通过电池内锂物质的反应而产生电的电化学电池。通常,电池具有用于锂化学过程的工作电极和反电极。在电极间空间内提供锂电解质,如非水性电解质。电化学电池的顶部空间具有含氧气氛。也可以存在参比电极。电化学电池也可以称为锂氧电池或锂-空气电池。
在电池中的工作电极和反电极之间可以提供隔板。隔板可以是锂离子和其它离子可渗透的。隔板可以是玻璃纤维隔板(例如,如jungetal.andxiaoetal.)。通常使用多孔隔板,如celgard。也可以使用陶瓷膜。
通常,隔板在反电极(负极)处几乎不阻止氧气还原。通常通过在li金属反电极上形成称为固体电解质中间相(或sei)的钝化层而阻止氧气还原。该层也似乎会最小化或阻止介体的还原/氧化。
工作电极在放电步骤期间是阴极,其中氧与电解质中的锂物质反应而最终产生lioh。
在放电步骤中反电极是阳极。
工作电极可以与反电极电连接。
下面进一步详细讨论电解质溶剂的选择。
在本发明中,锂氧电池适于形成除了li2o2之外或li2o2的替代物的lioh。正如本文描述的,lioh是放电反应的主要产物,并且可以形成而基本排除li2o2。
充电是指将氢氧化锂转化为锂离子和氧气的步骤。充电步骤是氢氧化锂的电化学氧化。
应注意,尽管在环境空气环境中操作电池是不典型的,本技术领域中仍使用术语“空气电池”。通常现有技术实验使用无水的氧气氛下的锂-空气电池,并且通常处于大于环境压力的压力下。为此,一些研究人员更准确地称为使用锂氧电池(例如,参见kwaketal.)而不是锂-空气电池。
例如,xiaoetal.描述了在2个大气压(202.5kpa)的氧气氛下的锂氧电池的运行。chenetal.描述了在1个大气压(101.3kpa)的氧气氛下的锂氧电池的运行。
因此,尽管迄今为止研究的目的是开发用于空气中的系统,但是目前举例说明系统通常对水敏感,或更普遍地对促进在电极处氢氧化锂形成的条件敏感。高纯度氧气氛的使用也旨在限制电化学电池内二氧化碳的存在。二氧化碳的存在可能会使电池内的电化学反应复杂化,并可能产生不期望的副产物。
应该注意的是,使用封闭的氧气系统并不一定是缺点,因为锂氧气电池的一些用途可能适应封闭系统。然而,为了普遍适用性,耐水的锂氧电池的高度期望的。
在一个实施方式中,电化学电池提供于基本上纯的氧气氛中。气氛可以是基本无水的。气氛可能基本上无二氧化碳。电化学电池可以容纳于密封系统内,并且气氛可以称为电化学电池的顶空。
在一个实施方式中,气氛具有100ppm或更少,如50ppm或更少,如10ppm或更少的水含量。
在一个实施方式中,气氛具有200ppm或更少,如100ppm或更少,如50ppm或更少,如10ppm或更少的二氧化碳含量。
用于制备气氛如基本无水且基本上不含二氧化碳的氧气氛的方法在本领域中是公知的。这种类型的氧气也可以从商业来源获得。
如下面进一步详细解释的,电化学电池是耐水的。因此,气氛可以具有10ppm或更多、50ppm或更多、100ppm或更多、500ppm或更多、或1000ppm或更多的水含量。
水含量可以是指原始状态的电池的气氛中的水含量或已经循环多次,例如,如2次或更多次、10次或更多次、5次或更多次、或100次或更多次循环的电池的气氛中的水含量。
可以以与标准大气压力相等的压力,如101.3kpa提供气氛。可替换地,可以以比这更大的压力提供气氛。例如,可以以至少1.5个大气压(至少152.0kpa)、至少2个大气压(至少202.5kpa)或至少5个大气压(至少506.6kpa)的压力提供气氛。
电化学电池可以适用于在高于标准大气压力的压力下使用。
电化学电池可以保持于环境温度,如25℃下。
部分放电的锂氧电池是指其中在工作电极上形成至少一些lioh产物的电化学电池。当系统的放电电压降到实用水平之下时,锂氧电池可以视为完全放电。例如,放电电压下降至低于2.0v、如低于1.7v、如低于1.5v的情况。放电电压的下降在放电产物堵塞工作电极的孔隙,或一般没有可用于提供电子的电极表面(例如,因为电极表面覆盖有厚的绝缘产物)时发生。
可替代地或另外地,当电池内的氧气被完全消耗(例如,在封闭的系统中)时,锂氧电池可视为完全放电。
可替代地或另外地,当反电极中的锂被完全消耗时,锂氧电池可以认为完全放电。
部分充电的锂氧电池是指其中工作电极之上或之中存在的至少一部分lioh转化为锂离子的电化学电池。当氧析出降低至低于可测水平时,锂氧电池可视为完全充电。
可替换地或另外地,当充电电压升高超过实用水平时,锂氧电池可视为完全充电。例如,充电电压超过3.5v、如超过4.0v、如超过4.5v的情况。通常,充电电压限制于3.5v或更低以防止碳电极的分解。
当容量达到期望的水平时,电池可视为完全充电。如果容量还没有达到这个水平,则电池可以视为部分充电。以下将进一步详细讨论典型的容量限制。
在本发明中使用的电池基本上没有容量衰减,并且在多次放电和充电循环内电压极化的变化极小并处于高比容量下。
在一个实施方式中,电池以至少1,000、至少2,000、至少5,000、或至少10,000mah/g的最小容量使用。期望的是具有至少1000mah/g的容量,因为这是电池实际使用的有用容量。
在一个实施方式中,电池以最多15,000、最多20,000、最多25,000、或最多40,000mah/g的最大容量使用。期望的是具有至多40,000mah/g,例如,至多25,000mah/g的容量,因为这允许电池以实用的循环速率充电而达到最大容量,而不会出现电池电压的快速极化。
本发明人已经确定,电池可以以大于20,000mah/g的容量使用。例如,参见图9,其显示了以22,000mah/g的容量以高循环速率循环电池。在更高的循环速率下,电池电压迅速极化,这可能是由于在更大的还原(放电)和氧化(充电)电化学势下的更多副反应以及放电产物去除不完全所致。
在一个实施方式中,电池以上文给出的任何最大值和最小值中选择的范围内的容量使用。例如,电池以2,000至40,000mah/g,如2,000至15,000mah/g的范围内的容量使用。
在一个实施方式中,电池具有至少500、至少1,000、至少2,000、至少5,000wh/kg的比能量。
电池的比能量可以由放电后电极的重量增加得出。本发明人已经发现,在放电期间rgo电极(约0.1mg;200μm厚)的重量会显著增加(在2.7v的放电电压下,以32,000mah/g的容量,这对于所讨论的电极为3.2mah,增加至约1.5mg)。
电化学电池的比能量明显高于已知的磷酸铁锂电池的报道值。例如,与sawetal.描述的电极(lfp,18650以3.2v放电至0.13mah的容量,重量增加至1.5mg)相比,本案中使用的电极可以提供20倍以上的比能量。stevensetal.已经描述了用于水性锂氧电池的500wh/kg的目标比能,并且用于本案中的电池具有远远超过其(10倍以上)的比能量。
电池的比能量可以是在规定容量,如1,000、5,000、8,000或32,000mah/g的容量下测定的能量值。电池的比能量可以是在规定的充电电压,如2.7、2.8、2.9、3.0、3.1或3.2v下测定的能量值。
本发明人已经发现,在多次充电和放电循环中,电池的充电容量没有显著降低。
因此,如上文描述的电池的最大容量在规定次数的充电和放电循环中没有显著变化。
例如,在规定的循环次数之后、电池的最大容量是电池在最初的充电和放电循环时的最大容量的至少75%、至少85%、至少90%、至少95%、或至少99%。
规定的循环数可以是5个循环、10个循环、50个循环、100个循环、500个循环、1,000个循环、或2,000个循环。
在一个实施方式中,在指定数量的充电和放电循环中的第一次循环是原始状态的电池的第一循环。
电池的最大容量可以在规定的循环速率,例如在1或5a/g下测定。
电池可以以至少0.5,至少1,至少2,至少3,或至少4a/g的比率循环速率循环。期望的是具有至少0.5a/g的循环速率,因为这允许获得更高的电池容量。
本发明人已经发现电池可以耐受非常高的循环速率。然而,非常高的循环速率是较不优选的,因为每个循环会使电池电压迅速极化。还注意到,充放电平台之间的电压间隙随着循环速率的增加而增加。例如,当电池以1a/g循环时,电压间隙仅为至0.2v;在更高的循环速率下,间隙会变宽,在8a/g的速率下会增加到0.7v(例如,参见图4)。
在较高的循环速率下,电池在每次循环都会被极化,并且在40次循环之后,电极表面被大量累积颗粒(与lioh的那些不同)覆盖,这在充电期间似乎不容易除去。在这些更高的超电位下可能发生更大量的寄生反应,通过增加其电阻并阻止电子传输穿过电极-电解质界面而使电池快速极化。
因此在一个实施方式中,循环速率为至多5、至多8、或至多10a/g。
在一个实施方式中,循环速率为至多1、至多2、至多3、至多4、或至多5a/g。
在本案的方法中,电池可以在不会导致工作电极降解的电压下运行。例如,电池可以在小于3.5v的电压下运行,这是碳电极的稳定性区域。如下面进一步详细解释的,使用介体可以允许使用比3.5v更少且通常显著更小的充电电压。
在本发明进一步的方面中,提供了具有高含水量的锂氧电池。本发明人已经发现,利用lioh放电产物的锂氧电池可以在水的存在下使用,而不损失性能,例如,没有容量损失。
在一个实施方式中,锂氧电池如充电的锂氧电池具有含水电解质。会参考用于锂氧电池的电解质在下面描述这种电解质。例如,电解质可以含有0.25wt%或更多的水。
电极
电化学电池具有用于进行锂电化学过程的工作电极。在本领域内,该电极称为锂氧电池内的阴极或正电极。
工作电极是导电性的,并且,例如,在可驱动或动力系统内可电连接到反电极。
在使用多孔工作电极的情况下,锂氧电池的容量会增加。锂氧电池的最终容量最终由工作电极内可用的容纳放电产物的总孔体积确定。
当然,工作电极内存在较大孔隙并不意味着这些孔隙将被放电产物完全占据。本发明人已经发现li2o2产物会在多孔电极的孔内形成为小(通常小于2μm)的颗粒。
在一个实施方式中,工作电极是多孔电极。
在一个实施方式中,工作电极是大孔电极。
在一个实施方式中,工作电极具有至少50m2/g、至少60m2/g、至少70m2/g、至少80m2/g、至少90m2/g、至少100m2/g、至少150m2/g、至少200m2/g、至少300m2/g或至少400m2/g的孔隙率。
在一个实施方式中,工作电极具有至少0.1cm3/g、至少0.2cm3/g、至少0.4cm3/g、至少0.5cm3/g、至少0.7cm3/g、至少0.8cm3/g、至少0.9cm3/g、至少1.0cm3/g、至少1.5cm3/g或至少2.0cm3/g的孔体积。
电极材料的孔隙率和孔体积可以是已知的,或可以使用标准分析技术如n2吸附等温线分析而测定。
在一个实施方式中,多孔工作电极的孔隙具有至少1nm、至少5nm、至少10nm、至少20nm、至少30nm、至少40nm、至少50nm或至少10nm的平均孔径(最大截面)。
在一个实施方式中,多孔工作电极具有大孔结构。因此,电极可以包含具有至少200nm、至少500nm、至少1μm或至少5μm的最大截面的孔隙。
在锂氧电池中,不可溶固体产物在放电期间从电解质溶液中沉淀出来,占据电极内可用的孔体积。大孔电极(与介孔或微孔电极相反)允许放电产物连续生长至几十微米大小。由于在互连的导电大孔网络内li+和o2扩散更有效,在此处会连续供应反应物。在本案中,优选使用如rgo电极的大孔电极。
在介孔或微孔电极中,当较小孔隙堵塞时放电停止,而电活性物质不再可能扩散。
在一个实施方式中,工作电极包含多孔碳,如石墨烯,如多孔还原氧化石墨烯。
多孔碳电极通常是轻质且导电的,并且可以提供大的孔体积,其可以提供大的容量。
在一个实施方式中,工作电极包含还原的氧化石墨烯,科琴黑或superp碳。
工作电极可以具有多级结构。limetal.已经观察到具有多级结构的电极与据称具有封闭孔结构的的其他碳类型如科琴黑相比不易被放电产物堵塞。
在一个实施方式中,工作电极包括多级的还原氧化石墨烯(rgo)。
本发明人已经发现,使用如rgo电极的大孔工作电极与同sp和tic相比充电电压的降低相关。大孔电极,如rgo电极,也与放电电压的降低有关。因此,使用大孔电极与充电和放电平台之间的电压间隙减小相关。当使用rgo电极代替sp或tic电极时,这在图1中可以看出。这种放电超电势的降低与介体的使用无关。然而,应该注意的是,使用介体可以进一步降低充电电位,从而进一步降低电压间隙。
在锂氧电池中使用多级多孔石墨烯在本领域中是已知的。例如,xiaoetal.描述了由氧化石墨的热膨胀和还原生产的石墨烯电极的制备和使用。
可替换地,工作电极可以用于代替包含多级还原氧化石墨烯的电极,然而,这些较不优选。例如,基于科琴黑(kb)的工作电极与基于还原氧化石墨烯的电极相比通常具有更低的孔隙体积,并且科琴黑系统中的放电产物通常据发现是尺寸更小的。xiaoetal.已经观察到,与基于石墨烯的电极相比,科琴黑电极具有更低的放电容量。
多孔电极可以提供在导电基底上。在本领域内,基底称为集电器。例如,基底可以是不锈钢基底,如通常与基于石墨烯的电极一起使用的那些。基底可以是板材或网。
在一个实施方式中,工作电极基本上不含粘合剂。
在一个实施方式中,电极在其表面上提供有介体。以下将关于电解质描述合适的介体。jungetal.已经描述了负载于适用于锂氧电池的rgo电极上的电催化剂的用途。
电化学电池提供有反电极。这也可以称为负电极。
在一个实施方式中,反电极是含锂电极,其可以是锂金属电极(如limetal.,kwaketal.,jungetal.描述的),含锂材料如lifepo4(如chenetal.描述的)或含锂的另一种电极材料如li4ti5o12和livo2电极。这种电极常用于本领域中已知的锂氧电池中。
锂金属电极可能比lifepo4电极是优选的,因为后者会降低电池的运行电压并具有低的比容量。
在一个实施方式中,工作电极(正电极)可以提供有锂源,锂源可以是如lioh或li2o2的盐,或锂化材料如锂化的sn或锂化的硅。锂源盐可以在预处理步骤中添加到电极中。
在这些实施方式中,反电极(负电极)没有必要是含锂电极,并且在反电极上可以使用替代材料。例如,可以使用含有sn和si的反电极。另外,可以使用含s的,如s-c复合材料。
反电极不一定是导电材料。电极可以简单地是与li可逆地反应的材料。
电解质
锂氧电池具有电解质。通常,充电和放电电池中的电解质含有锂离子。在电池放电期间锂离子转化为氢氧化锂。这些锂离子被来自反电极(负极)的锂离子取代。
锂离子溶解于电解质中。
通常,锂离子以litfsi(双(三氟甲烷)磺酰亚胺锂盐)的形式提供,其是锂氧电池内常用的盐(参见,例如,limetal.)。在另一个实施方式中,锂离子可以以lipf6(出处同上)或litf(三氟甲磺酸锂;参见kwaketal.)的形式提供。
锂离子可以以至少0.05m、至少0.1m、至少0.2m、或至少0.25m的浓度存在于电解质中。
锂离子可以以至多0.5m、至多1.0m、或至多2.0m的浓度存在于电解质中。
在一个实施方式中,锂离子以选自具有上述给出的上限和下限的范围内的浓度存在于电解质中。例如,介体以0.25至2.0m,如0.25至0.5m范围内的浓度存在于电解质内。
在一个实施方式中,锂离子浓度为约0.25m。
在一个实施方式中,锂离子浓度是指锂离子的总浓度,其可以包括由litfsi和lii介体提供的锂离子。
在一个实施方式中,锂离子的浓度可以指主要的li盐,如litfsi,lipf6或litf的浓度。
用于本发明方法中的电解质是适用于溶解锂离子的电解质。
电解质可以是液体电解质,如在环境温度,例如,在25℃下的液体。
电解质可以是非水性电解质。如下讨论的,认为在充电步骤期间,当lioh放电产物可以转化为氧气和水时,电解质的水含量增加。
电解质可以包含有机溶剂。用于溶解锂离子的有机溶剂在本领域中是公知的。
在一个实施方式中,溶剂具有中等或高的供体数(dn)。先前在本领域中已经注意到,电解质溶剂溶剂化放电产物的能力(通过供体数表征)是控制放电期间的反应机理的重要因素(参见,例如,adamsetal.;johnsonetal.;aetukurietal.)。因此,在其中li2o2是放电产物的那些锂氧电池中,已经证明,lio2溶解度越高越有利于溶液沉淀机理,导致大的环形li2o2晶体并因此具有更高的放电容量。相反,较低的lio2溶解度倾向于驱动其中li2o2在电极表面上形成薄膜的表面机理并且倾向于更低的容量。
在一个实施方式中,供体数为至少10、至少12、至少15、至少16或至少17kcal/mol。当溶剂具有至少10kcal/mol的供体数时,放电产物将发生溶液沉淀,导致电池的容量更高。
在一个实施方式中,供体数为至多22、至多25或至多30kcal/mol。
在一个实施方式中,供体数目处于选自上面给出的上限和下限的范围内。例如,供体数量处于15至22kcal/mol的范围内。
供体数是在溶剂和标准路易斯酸sbcl5(五氯化锑)之间在非配位溶剂1,2-二氯乙烷中的稀溶液中形成1:1加合物的焓值。
已经证明具有中间供体数如15至22kcal/mol范围内的溶剂如dme允许同时的溶液沉淀和表面还原机理(johnsonetal.)。
认为具有对放电产物的高溶解度的溶剂有利于放电产物的形成。
在一个实施方式中,溶剂是非质子溶剂。
在一个实施方式中,溶剂是有机溶剂。
在一个实施方式中,溶剂是聚亚烷基二醇二烷基醚溶剂,如聚乙二醇二烷基醚溶剂。
在一个实施方式中,有机溶剂如聚乙二醇二烷基醚溶剂选自由乙二醇二甲醚(dme)、二乙二醇二甲醚、三乙二醇二甲醚和四乙二醇二甲醚(tegdme)组成的组。
已知这些溶剂中的每一种适用于锂氧电池。
在一个实施方式中,有机溶剂是dme。本发明人已经发现dme允许在放电步骤期间形成大的lioh颗粒,而使用如tegdme的溶剂与在电极表面上形成薄膜相关。此外,本发明人还发现,使用dme与同tegdme相比电池超电势的降低有关。
dme具有20kcal/mol的供体数。tegdme具有16.6kcal/mol的供体数。例如,参见文献gittlesonetal.的支持信息。
如之前的解释,本发明的方法耐受水,以及在电化学电池中,如电解质内水的存在。因此,电解质中的水量为0.01wt%或更多、0.25wt%或更多、0.5wt%或更多、1wt%或更多、2wt%或更多、或4wt%或更多。这些最小值可以是指在电池首次放电之前(即,在原始状态的系统中)电解质中的水含量。可替换地或另外地,这些最小值可以是指规定数量的充电和放电循环之后电解质中的水含量。例如,电解质在1次循环、50次循环、100次循环、500次循环、1000次循环或2000次循环后的含水量。
在一个实施方式中,电解质中的水含量为至多5wt%、至多10wt%、至多15wt%、至多20wt%、或至多25wt%。
电解质的水含量可以是指充电的电池的电解质的水含量。
工作进行例表明,当电解质的水含量为约4.7wt%(373mgh2o/783mgdme,约45000ppmh2o)时,锂氧电池可以毫无问题地循环。电池也可以无问题地在潮湿的o2气氛下循环。在这两种情况下,与使用无水电解质的电池相比,没有观察到电化学性能的明显变化。看起来尽管dme有明显的分解倾向,但在初始充电过程中会产生足够的水而使电池可以继续循环多个循环。
在替代实施方式中,电解质中水的量是较低的,如1wt%或更少、0.5wt%或更少、0.25wt%或更少、或0.01wt%或更少。
在一个实施方式中,电解质基本上是无水的。这些最大值可以是指在电池首次放电之前(即在原始状态的系统中)电解质中的水含量。
本文中,电解质的含水量可以是指放电的电池的水含量。因此,在放电反应期间几乎所有的水被消耗(即,在放电反应中生成lioh)。
电解质中的水含量可以随着循环次数而增加。如在下面和工作实施例中的讨论,在具有含水量非常低的电解质(如无水电解质)中,lioh的初始h源被认为是电解质溶剂(如dme)。然而,在充电步骤期间,认为lioh随后转化为锂离子,氧和水。在随后的放电步骤中,认为水是lioh的主要h源,而溶剂的贡献减少或极小。
在本发明的优选方法中,lioh放电产物的主要氢源不是溶剂。
因此,在循环之前,用于本发明的锂氧电池中的电解质可以含有很少水或不含水。例如,含水量可以存在于上面给出的最大值之内。在一系列放电和充电步骤之后,电解质的水含量可能增加。
本发明的方法分别要求在放电和充电步骤期间形成和消耗氢氧化锂。由此推断,氢氧化锂应该有正式的氢源,用于与锂离子和氧结合。
氢源没有特别的限制,而一般来源于电解质中的具有适度的酸性氢的化合物。氢可以由电解质内的一种或多种组分提供。氢源可以是水。氢源可以是有机溶剂,如用于溶解锂离子的有机溶剂。
在本发明的方法中,氢源可以在电池的循环期间改变。最初,特别是在电解质最初是无水的情况下,氢源可以是溶剂。认为循环步骤会产生作为充电产物的水。在随后的放电步骤期间,水可以是氢源。如果初始电解质含有水,则水可以是最初的氢源而不是溶剂。
本发明人已经确定,溶剂如dme是用于本发明的电池中可能的初始h源。先前的dft计算表明,碘自由基倾向于从dme分子中提取h+,形成hi并导致dme聚合(参见,wuetal.)。
在锂氧电池中,在放电步骤期间,有可能在o2,o2-或o22-存在下将i-氧化成碘自由基。可替换地,lio2的直接亲核攻击也可能导致从dme分子中提取h+,形成liooh中间体,其最终通过lii和liio的作用而转化为lioh。sunetal.在他们最近研究在锂氧电池内lii在tegdme中的作用的研究中提出了这种机理。
电解质中也可能具有溶解在内的氧。氧也存在于电池所处的气氛中,并且氧至少存在于顶部空间中。
电解质可以提供有介体,其在本领域中也称为催化剂。对于锂氧电池使用介体在本领域中是已知的。例如,limetal.描述了使用介体(或催化剂)改进电池的可再充电性和效率。kimetal.证明了使用介体物质可以降低电化学电池的超电势,从而改进系统的可循环性。介体可以认为是固体电极和固体放电产物之间的电子-空穴转移剂(或电子转移剂)。
如上所述,介体也可以提供于工作电极的表面上。例如,jungetal.描述了负载于用于锂氧电池的碳电极上的介体(电催化剂)的用途。然而,优选的是介体位于电解质中。
介体的氧化和还原形式可溶于电解质中。介体的氧化和还原形式在充电和放电的电池内也应该具有化学稳定性。因此,介体预期在电池内应具有可再循环性,从而实现其作为系统内催化剂的作用。
应注意,介体的氧化还原化学过程可能是复杂的,且介体可能具有多种氧化态和/或多种化学形式。例如,本案描述了碘化物化学的使用。基本的介体电对可以是i-/i3-或i-/i2。另外,在电池中存在氧的情况下,也可能存在由氧与i-和i2的反应而形成的io-和io3-物质。
本发明人还发现,介体能够控制放电产物的特性以及改变放电产物的总体结构。
例如,在电池内不存在介体的情况下,本发明人已经发现li2o2是主要的放电产物。加入介体有利于形成lioh作为主要放电产物。
此外,本发明人已经发现,在不存在介体的情况下,在电极孔隙中形成的li2o2产物具有小于1μm的平均最大尺寸。相反,在存在介体的情况下,在电极孔隙中形成的lioh产物具有大于15μm的平均最大尺寸。
因此,本发明人认为介体在电池内具有多种作用。如上所述,介体作为传统的介体运作而引导电池中的充电电压,如降低充电电压,其由此改变电池的循环稳定性,通常改善循环稳定性。
limetal.、kwaketal.和chenetal.已经证明,在锂氧电池中使用介体会改进再充电速率,并有利于放电产物分解期间的氧析出。
介体也可以降低电池放电的超电势。
在一个实施方式中,介体是能够在充电反应期间降低超电势的化合物。在一个实施方式中,介体会将超电势降低0.1v或更多、0.2v或更多、0.3v或更多、0.4v或更多、或0.5或更多。
超电势的降低是与其中不存在介体的电池的比较。
在一个实施方式中,介体将电池的充电电位降低至低于li-o2反应的热力学电压。因此,充电电位可以小于2.96v,如2.95v或更小。
本发明人认为,在充电期间,氧化还原介体首先在电极上被电化学氧化,然后该氧化的形式化学分解lioh放电产物。因此,在充电电压小于2.96v的情况下,充电电压反映了电池中氧化还原介体的氧化还原电位(相对于li/li+),而不是与固体放电产物(即lioh)的氧化有关的氧化还原电位。因此,介体的氧化还原电位可以强烈影响锂氧电池中的充电电压曲线,并因此影响o2电极的长期稳定性。
在一个实施方式中,介体将充电和放电平台之间的电压间隙降低至0.4v或更小、0.3v或更小、或者0.2v或更小。本发明人已经发现带隙可以减小至约0.2v。
超电势值或电压间隙值可以是在充电/放电循环期间以规定的容量,例如以100、200或300mahg-1,以规定的循环速率,如0.01或0.02ma/cm2测定的。
在一个实施方式中,充电电位在充电期间保持基本恒定。
本发明人已经发现,当介体与多级大孔电极如多级大孔rgo电极一起使用时,充电电位保持基本恒定。使用多级大孔电极相对于其他电极类型,如在充电循环期间充电电位据观察会增加的sp碳电极是优选的。性能的差异认为是由于大孔网络与介孔体系相比允许更有效的介体扩散。即使在大孔充满不溶性放电产物时也可以观察到这种益处。
在一个实施方式中,在规定的循环速率下,如0.01或0.02ma/cm2,在两个指定容量,如选自100、200、300、400和500mahg-1的两个指定容量下,充电电位基本相同。如果测量的电位相差不超过10%,不超过5%,不超过2%或不超过1%,则充电电位基本相同。例如,图1显示了具有rgo电极和dme中的lii介体的电池中的充电电位在100和500mahg-1之间基本不变。
介体的氧化还原电位可能受到电解质溶剂的影响。本发明人已经发现,溶剂的变化可以降低充电电压。例如,发现当电解质中的溶剂由tegdme改变为dme时,充电电位降低。对于所有测试的电极材料(例如,rgo,tic和sp)都观察到这种效应。
溶剂的变化也可以降低充放电平台之间的电压间隙(如工作实施例所示,在cv实验的氧化还原峰中也观察到这种效应)。例如,发现当电解质中的溶剂由tegdme变为dme时电压间隙减小。
认为这些效应与溶剂的粘度有关,其中粘度较小的溶剂如dme会表现出更大的充电电位降低和更大的电压间隙减小。高粘度溶剂的使用认为会降低介体的扩散速率。实际上,本发明人还观察到电池的放电容量总是小于先前的充电容量,这表明介体在氧化之后已经扩散到本体电解质中。在具有低粘度溶剂如dme的那些电池中,这种容量差异更为显著。这表明与tegdme相比,如dme的溶剂中的介体扩散速度更快。
因此,在一个实施方式中,溶剂具有低粘度,如低的动态粘度。在一个实施方式中,溶剂具有在25℃下测量的0.30cp或更小、如0.30cp或更小,、20cp或更小、如0.15cp或更小的粘度。例如,dme在25℃下具有0.122cp的动态粘度。
介体允许lioh放电产物在充电循环中以非常低的超电势被去除。因此,在锂氧电池中可以使用lioh代替li2o2。一个直接的后果是这种电池会变得对相对较高的水污染水平不敏感。
介体的使用也与大lioh晶体的生长有关,并因此有效地占据多孔工作电极的孔体积。因此电池会具有非常大的实验观察到的容量。
介体应该可溶于电解质中。此外,介体不与电解质溶剂反应,并且也不会与反电极(通常是li金属阳极)反应。
在一个实施方式中,介体具有高于lioh形成的平衡电位的氧化还原电位。
在一个实施方式中,介体的氧化形式能够分解lioh。介体氧化lioh,从而产生氧。
在一个实施方式中,介体是基于碘的介体,如碘化物介体(i/i3-电对或i-/i2电对)。介体可以作为lii提供于电解质中。分子碘(i2)也可以额外地添加到电解质中。kwaketal.和limetal.描述了碘离子(碘化物)作为介体的用途。如上所述,碘化物介体化学过程还可能涉及io-和io3-物质的形成和降解。
在本案的方法中,主要的放电产物是lioh而不是li2o2,li2o2是本领域中描述的常见放电产物。lioh产物的形成与使用介体如碘化物介体有关。尽管在放电产物存在差异,但是在形成lioh和li2o2期间可能会观察到相同的现象。
在放电时,第一步似乎是电化学反应,其中o2在电极表面上还原并与li+离子化合而形成lio2。这与在添加和不添加lii时观察到的在2.75v处的重叠放电电压一致(参见图1a)。使用如此小的超电势(0.2v),o2直接还原成o22-或甚至分解还原成o2-(或lioh)是不可能的。在接下来的步骤中,li2o2或lioh可以通过lii/hi的化学还原或通过歧化从溶液中沉淀,如在之前对li2o2的研究中提出的(参见adamsetal.;pengetal.)。
通过溶液机理形成lioh受到在电极和不与集电器电连接的绝缘玻璃纤维隔板两者上观察到lioh生长的事实支持。如以前的工作(kwaketal.)中所见,在低lii浓度下lio2歧化机理可能会占主导地位。即使在以高速率进行电池循环时,由于没有观察到作为产物的li2o2,则lioh不太可能通过li2o2(固体)中间体形成,至少对于0.05mlii而言是不可能的。
在一个实施方式中,介体是氧化还原活性的有机化合物,如四硫富瓦烯(ttf)。chenetal.描述了这种化合物作为介体的用途。
介体可以以至少1mm、至少5mm、至少10mm、或至少20mm的浓度存在。
介体可以以至多100mm,、至多200mm、至多500mm、至多1m、或至多5m的浓度存在。
在一个实施方式中,介体以选自具有由以上给出的值选取的上限和下限的范围的浓度存在于电解质中。例如,介体以10至100mm范围内的浓度存在于电解质中。
在一个实施方式中,介体以约20mm或约50mm存在。
介体的浓度是指包括介体的氧化和还原形式的介体的总浓度。
可选地,电解质可以包含其他组分,以辅助放电步骤期间形成lioh,以及在充电步骤期间消耗lioh。可以提供这些试剂以提高电池的速率性能或使反应区域问题最小化。
用途
本发明还提供了在锂氧电池的充电中氢氧化锂作为氧源,如主要的氧源的用途。如上所述,在本领域中典型的是使用li2o2作为锂氧电池中的氧源。
此外,本发明还提供了在锂-空气电池的放电中氢氧化锂作为主要的锂放电产物的用途。如上所述,在本领域中典型的是使用li2o2作为锂氧电池中的主要锂放电产物。
其他优选项
以上描述的实施方式的每个相容的组合都在本文中被明确地公开,如同每个组合被单独并明确地叙述。
鉴于本公开内容,本发明的各个进一步的方面和实施方式对于本领域技术人员而言将是显而易见的。
“和/或”在本文中使用时被认为是具有或不具有其它特征或组分的两个指定特征或组分中的每一个的具体公开。例如,“a和/或b”应该视为(i)a,(ii)b和(iii)a和b中的每一个的具体公开,如每个在本文中单独列出一样。
除非上下文另有规定,否则上述特征的描述和定义不限于本发明的任何具体方面或实施方式,并同样适用于所描述的所有方面和实施方式。
现在将通过举例的方式并参考上述附图而举例说明本发明的某些方面和实施方式。
实验
概述
作为实例,用li金属阳极,具有0.05mlii添加的0.25m双(三氟甲基)磺酰亚胺锂(litfsi)/二甲氧基乙烷(dme)电解质和各种不同的电极结构,包括介孔sp碳,介孔碳化钛(tic)和大孔还原氧化石墨烯(rgo)电极制成li-o2电池。使用了多级大孔rgo电极(无粘合剂),因为它们较轻,导电并且具有可以潜在地导致大容量的较大孔体积。研究比较介孔sp碳和tic(ottakamthotiyletal.)电极。
循环伏安法(cv)测定结果证实,在litfsi/dme电解质中,rgo、sp和tic电极在2.4至3.5v的电压窗口内都表现出了良好的电化学稳定性,并可以用于使可逆循环lii(i3-+2e-)(hansonetal.)。
如下所述,还研究了电解质溶剂的变化。
详细的实验工作描述如下。
材料
在分馏之前,将1,2-二甲氧基乙烷(dme)(sigmaaldrich,99.5%)和四乙二醇二甲醚(tegdme)(sigmaaldrich,99%)溶剂与金属钠一起回流,然后储存于
电极制作
介孔sp碳电极由24wt%sp碳黑、38wt%聚偏二氟乙烯(pvdf,共聚物)粘合剂和38wt%邻苯二甲酸二丁酯(dbp,sigma-aldrich)在丙酮中的混合物制成。然后将浆液铺展成自支撑膜并切成直径1/2英寸(约1.27厘米)的圆盘,并用乙醚洗涤以除去dbp。然后将所获得的膜在120℃下在真空中退火12小时,然后转移到手套箱中而不暴露于空气。电极中的最终碳含量为39wt%。
介孔tic电极通过类似的方法制备,其中碳被tic取代。使用丙酮将49wt%的tic、8wt%的pvdf和44wt%的dbp的混合物制成浆液。随后的制膜和干燥方法与制造sp碳电极的方法完全相同。
水性氧化石墨烯溶液通过修改的hummer方法合成(46)。简言之,将浓h2so4(96ml)加入到石墨片(2g)和硝酸钠(2g)的混合物中,将其在0℃下在水/冰浴中搅拌。然后逐渐加入kmno4(12g),并将混合物在0℃下持续搅拌90分钟。随后升高反应温度并在35℃下保持2小时,然后向悬浮液中缓慢加入去离子水(80ml)。引入另外的水(200ml)和h2o2(30%,10ml)。此时,获得氧化石墨的悬浮液。使该氧化石墨悬浮液沉降,并反复去除顶部的澄清溶液并用去离子水代替,直到悬浮液变成中性。将所获得的氧化石墨浆液进行多次超声波处理和离心分离循环,直至离心管底部不再发现沉淀物。最后合成分散良好的水性氧化石墨烯溶液。
为了制作还原氧化石墨烯(rgo)电极,首先将获得的氧化石墨烯溶液在80-100℃下在小瓶中退火而形成具有10mg/ml的氧化石墨烯浓度的粘性凝胶。使用容量移液管将凝胶浇注到不锈钢(ss)网(adventresearchmaterials)上,并随后在液氮中冷冻并储存于小瓶中。将ss网上的氧化石墨烯电极在真空中冷冻干燥12小时,并随后在ar下在550℃的炉中热解2小时,获得rgo电极。在用于制作电池之前,将这些电极在150℃真空下进一步干燥。通过将几个裸网的质量与其在rgo电极完成涂层之后的各自质量相比,仔细测量rgo电极的质量,对于特定批次的电极选取平均值。
li-o2电池组装
本文所描述的所有li-o2电池均基于swagelok设计。电池通过堆叠锂箔(0.38mm厚,sigma-aldrich)盘,2块浸泡有电解质的硼硅酸盐玻璃纤维隔板(whatman)和o2正极(sp,tic或rgo)组装。
本研究中使用的电解质包括添加/不添加0.05mlii的0.25mlitfsi/dme或0.25mlitfsi/tegdme。钻出通过集电器的0.5cm2的孔,使得正电极可以很容易地获得o2。然后将组装的swagelok电池放入150mlli-o2玻璃室中,两个电极电线连接到两个钨接头。将纯o2经由两个杨氏孔口(young’stap)穿过该室吹扫25分钟,然后在循环之前放置10小时。电池中使用的含有tegdme的电解质的体积通常为0.2ml。发现含有dme的电解质在o2吹扫期间更易挥发并迅速蒸发,而吸收到电缆的氟橡胶涂层中(该后一个问题是由于我们的li-o2电池的电流内置设计的原因,并可以使用更好的电池设计避免)。因此,在电解质中使用的dme约0.7至1ml用于电池。
在这项工作中的电极加载范围为0.01至0.15mg,且rgo电极的厚度从30μm至200μm变化。对于经历更长时间循环的li-o2电池,使用了更薄的电极(30至50μm)。循环速率是基于电极中碳的质量引用的。例如,0.01mg电极的5a/gc速率(参见图4b)相当于以50μa的电流循环电池,得到每单位面积的速率为0.1ma/cm2。使用arbin电池循环仪或biologicvmp进行电化学测量(恒电流放电/充电,循环伏安法)。
所有的电位都相对li/li+参照。
电极表征
对于所有电池,所涉及的电极的表征首先分解电池,在干燥乙腈(<1ppmh2o,每次用2ml乙腈30分钟)中冲洗o2正电极两次。然后将洗涤的电极真空干燥过夜用于进一步表征。
用cukα1辐射
用hitachis-5500以透镜场发射电子显微镜中记录扫描电子显微镜(sem)图像。在转移到电子显微镜中期间气密性密封电极样品。一旦密封被打开,在10秒内将样品装入高真空sem室中。
所有固态nmr(ssnmr)光谱在16.4tbrukeravanceiii或11.7tbrukeravanceiii光谱仪上使用1.3mmhx探针获得。使用转子同步哈恩回波脉冲(hahn-echopulse)序列以60khz的旋转速度(除非另有说明)采集1h魔角自旋(mas)谱和125khz的rf场强。使用单脉冲序列在mas和静态条件下获得7linmr光谱,而rf场强为167khz。1h和7li位移分别外部参考1.8ppm的固体金刚烷和0ppm的碳酸锂。采用相同的接收器增益,扫描次数和再循环延迟值(使用10至20秒之间的优化值)测量电极(来自同一批次)以允许光谱之间的定量比较。
锂氧电池的电化学
图1(a)比较了有和没有添加的lii介体的sp,tic和rgo电极的电化学。在不存在lii的情况下,与使用介孔sp碳电极获得的超电势相比,使用介孔tic或大孔rgo的电池在充电期间显示出更小的超电势。超电势的降低暂时与tic的较高电催化活性(adamsetal.)以及li+和溶剂化的o2在rgo电极的微米级孔隙内的较快扩散有关。
向sp电极中加入氧化还原介体lii与仅用sp观察到的相比导致了超电势显著下降,表明在充电期间的极化很大程度上是由放电产物的绝缘性引起的。然而,充电电压曲线不是平坦的,而是随着充电进行到3.5v以上而逐渐增加的。相反,当lii与多级大孔rgo电极一起使用时,在2.95v处观察到非常平坦的过程,表示相比对sp观察到的超电势进一步降低了约0.5v。这种降低归因于rgo电极中的互连大孔网络,即使当大孔充满不溶性放电产物时,其也允许比介孔sp电极中更高效的介体扩散。
lii/dmeli-氧电池在2.95v下充电的观察结果是值得注意的,因为其略微低于li-o2反应的2.96v的热力学电压。在充电期间,认为氧化还原介体首先在电极上被电化学氧化,并且这种氧化形式随后化学分解放电产物(参见chenetal.)。因此,此处的充电电压反映了电极/电解质体系中i-/i3-氧化还原介体的氧化还原电位(相对于li/li+),而不是与固体放电产物的氧化有关的氧化还原电位。介体的氧化还原电位强烈影响li-o2电池中的充电电压分布曲线,并因此影响o2电极的长期稳定性。
为了研究影响氧化还原电位的因素,将lii在具有不同电极/电解质组合的ar气氛中恒电流循环(图1(b))。发现电解质溶剂对i-/i3-电对的氧化还原电位的影响大于电极材料,而dme电解质对于所有三种电极始终表现出比tegdme(四乙二醇二甲醚)低的充电电压。另外,对于dme,充放电平台之间的电压间隙比tegdme电解质要小,这与它们各自的cv曲线(见图6)中氧化还原峰之间看到的较小电压分离是一致的。这一观察结果表明在相同速率下在tegdme中驱动氧化还原反应(3i-→i3-+2e-)所需的电位高于dme。鉴于使用相同的电极材料和结构,这种现象暂时与tegdme的较高粘度有关,这导致介体扩散更缓慢。
如图1(b)所示,对于所有电池,放电容量总是小于先前的充电容量,表明一些介体被氧化后已经扩散到了本体电解质中。这个观察结果在采用dme电解质的电池中更显著,也表明了在dme中介体扩散比在tegdme中更快。
电极材料的sem和电化学研究
为了评价电极材料对充电超电势的影响,如不同电极材料的催化效果,由电极活性物质扩散引起的浓度极化,以及由绝缘放电产物引起的欧姆损耗,测试了三种类型的工作电极。电极是rgo,sp和tic工作电极。
rgo电极比sp电极具有大得多的孔径和孔体积,这将导致更低的弯曲度并由此在rgo中的电解质中的活性物质(li+,溶剂化的o2,介体等)比在sp扩散更高效(参见rgosem图像的图5(a)至(d),和spsem图像的图5(e))。因此,与sp相比,rgo电极的更小超电势归因于相互连接的大孔骨架。
sp碳和tic电极由类似尺寸(至50nm)的颗粒组成,并且通过相同的制作方法制成(参见ticsem图像的图5(f))。sp和tic具有相似的介孔电极结构。sp和tic电极之间的电化学性能的差异假设归因于它们固有的催化活性的差异(参见图1(a))。
重要的是注意很难明确区分对超电势的不同贡献(例如,反应的活化障碍,欧姆损失,活性物质的扩散)。例如,当将sp与tic电极比较时,即使孔结构相似,也很难以保电极的电阻和表面积是相同的。因此,目前的比较方法(如图1所示)给出了充电超电势的各种来源的定性估算,而不是定量评估。
如图6(a)中所示,rgo和sp碳电极在电压窗口2.4-3.5v内表现出良好的稳定性,并且在该电压范围外观察到逐渐升高的正极和负极电流。与rgo和sp电极相比,tic电极是litfsi/dme中惰性较小的电极材料:在2.5和3.75v以下分别观察到快速升高的阴极和阳极电流。
图6(b)和(c)显示,rgo、sp和tic电极都可逆地循环lii
用于lioh形成的氢源
对于这项工作中的所有电池,遵循相同的实验方案用于电解质溶剂纯化、电极制作、各个电池组件(溶剂,li盐,隔板,swagelok电池部件等)的干燥和电极表征。
如果在0.25mlitfsi/dme电解质中不添加lii,则li2o2是放电后的主要产物。ssnmr和sem图像与li2o2放电产物一致(参见图7,并在下面进一步讨论)。
这些实验结果排除了许多可能的h源,包括来自o2气体中的h2o杂质,湿玻璃纤维隔板和swagelok电池部件以及用于清洗循环的电极的湿乙腈。
假定lioh放电产物的氢源是rgo电极上的表面官能团。具有0.1mg的原始状态重量的代表性电池电极在放电之后发现重约1.6mg。xrd和nmr测定结果表明增加的重量是由于形成lioh晶体,即1.5mglioh。为了产生1.5mg的lioh,需要0.0625mg的h,这是原始状态的rgo电极的一半以上的重量。因此推论,rgo中的h不可能是lioh的h源。原始状态的rgo电极的1hssnnr只揭示了低质子含量。
使用的dme溶剂的含水量由卡尔费什装置测定为小于10ppm。对于电池使用了约1ml电解质溶剂,这在溶剂中带来了1cm3×0.8683g/cm3×10ppm=0.0086mgh2o的水含量。这比产生1.5mglioh所需的(1.1mg水)少两个数量级。因此,湿电解质溶剂也不可能是h的来源。
h源有可能是泄漏到密封的li-o2电池中的湿空气中的水。为了测试这是否可能,将li-o2电池在ar手套箱(h2o<0.1ppm)内放电。在放电的rgo电极的11.7t下进行的ssnmr测定结果(图8)表明,lioh仍然是主要的放电产物。因此进入电池的潮湿空气作为lioh放电产物的可能h源被排除。
如果h由dme溶剂提供,则为了产生1.5mglioh,需要62.5μmolh,即需要5.6mgdme(62.5μmol×90.12g/mol)(假设消耗的dme与h的摩尔比为1:1)。这相当于只有6.4μldme(5.6mg/868.3mg/cm3)。在这项工作中,约1mldme被用作电解质溶剂。
这表明在第一次放电过程期间,dme是产生lioh的h源。然而,重要的是要指出,水可能在随后的充电过程期间形成,并随着循环次数累积。这种累积的水也可能参与放电过程,并提供h而形成lioh,减缓dme溶剂的分解。
以更高的速率循环的li-o2电池
当电池以更高的速率,如8a/gc循环时,电池电压随循环而快速极化,这可能是由于在这些更大的还原(放电)和氧化(充电)电化学电势下更多的副反应以及放电产物的不完全去除所致。因此,rgo电极表面在仅40个循环之后被许多颗粒覆盖(如在图9(c)中所示的sem图像中的观察的)。
在lii和o2存在下的放电产物的7linmr表征
通过7li静态nmr分析lioh、li2co3和li2o2,并将记录的光谱与放电的rgo电极样品的7li静态nmr谱比较。合并的谱图如图10所示。
放电的rgo电极样品的特征四极线形状与lioh的而不是li2co3和li2o2的重叠,这表明放电产物绝大部分是lioh(也参见leskesetal.(2012)和leskesetal.(2013))。
采用lii的放电产物的sem表征
通过sem分析放电的rgo电极。看到许多大颗粒填充了rgo电极的孔隙(见图11(a))。将rgo电极切开并研究内部空间(如图11(b)至(c)中的观察结果)。观察到大量大于15μm的花状颗粒。这些颗粒中的一些甚至在绝缘玻璃纤维隔板(d)上生长,表明这些lioh晶体通过溶液沉淀过程形成。
高浓度的水存在下循环的li-o2电池
进行实验以显示li-o2电池对水的不敏感性。电化学性能与用无水电解质和干燥o2循环的电池相比没有看出明显差别,这证实电池至少在本文中的研究的水平(373mgh2o/783mgdme,即45,000ppmh2o)下对h2o污染不敏感。电池循环了100次。
使用tegdme中的lii的电池的研究
在使用tegdme溶剂代替dme的电池中研究放电反应。
当电池以100ma/gc的相对缓慢的速率放电时,观察到在2.7v处的电压平台(图12(a))。在16.4t下获得的ssnmr谱(b)中,在1hmas谱中的-1.5和8.3ppm处的共振分别指示lioh和甲酸li的存在,lioh是主要产物;在4.8ppm处的共振归因于水,而在3.3ppm和0.7ppm处的共振归因于电极中残留的tegdme溶剂。具有卫星跃迁峰(satellitetransitionpeak)的四极7li静态ssnmr谱的1.0ppm处的单共振和特征线形进一步证实了lioh是主要的放电产物。
放电的rgo电极的sem图像(如图12(c)所示)显示,与用dme基电解质所看到的形成大的花状颗粒不同,lioh作为覆盖rgo电极表面的薄膜存在。这导致更低的放电容量,因为电极被较低的放电容量的绝缘膜覆盖。
使用sp电极的电池的研究
在使用sp碳电极代替rgo电极的电池中研究放电反应。
当电池以70ma/gc放电时,观察到2.65v处的电压平台(图13(a))。在ssnmr谱(b)中,在1h中的-1.5ppm处的主共振和在7li-ssnmr谱中的1.0ppm处的单共振表明lioh是主要的放电产物(参见图13(b))。7li静态谱进一步证实了这一点。1hnmr谱中4.8ppm处的共振归因于水,而3.3、2.6和1.0ppm处的共振归因于电极中残留的dme溶剂。
放电的电极的sem图像表明lioh表现出盘状和片状形态(参见图13(c))。值得注意的是,即使使用相同的电解质,这些盘/片状的lioh也具有至500nm的尺寸,比rgo电极中观察到的要小得多(参见图11)。完全充电后,sp电极的许多表面区域再次变得裸露,尽管在一些区域仍然观察到残留的lioh。这一观察结果表明,lioh在电流/电解质体系中,在充电期间lioh确实可以去除,即使其未完全去除。
在不存在lii的情况下放电产物的7li和1hnmr及sem表征
图7(a)表明,与其中不存在lii的系统(蓝色曲线)相比,当lii存在于电解质中(红色曲线)时,rgo电极表现出更高的放电容量。在后一种情况下,放电产物(lioh)的浓度大得多(见图11),可以更有效地占据大孔rgo电极中的孔体积而导致更高的容量。
图7(a)中的黑色曲线表示在ar气氛中恒流放电的0.05mlii/0.25mlitfsi/dme电解质中采用rgo电极的电池:其容量与在o2气氛中循环的容量(红色曲线)相比可忽略不计。
通过nmr分析来自不存在lii的电池的放电的rgo电极。nmr谱显示于图7(b)中。在7limasssnmr谱(在16.4t下获得)中的0ppm处的单个共振和在7li静态ssnmr谱中不存在卫星跃迁峰表明当lii不存在时,li2o2是主要的放电产物(参见图10)。1hmasssnmr测定结果显示了-1.5ppm处的共振,表明lioh也存在于放电产物中。在2.3和8ppm处的共振归因于电极中残留的dme溶剂和甲酸锂。
放电电极的sem图像显示于图7(c)和(d)中。图像表明电极表面完全被环形颗粒(至500nm)覆盖,这是li2o2的特征形态,与ssnmr测定结果一致。
i-/i3-氧化还原活性与li-o2电池之间的容量比较
li-碘氧化还原电池的容量通常基于给出211mah/g的理论容量(即[(96485/3.6)ma]/127g)的碘(活性材料)的质量评估。参见,例如,hummersetal.。
在本案中使用的含tegdme的电解质中,所使用的i-的摩尔数为2.1×10-5mol,即2.7×10-3g。在ar气氛下从sp、tic和rgo电池提取的电荷分别为2.5×10-4、5×10-4和7×10-4mah,仅给出0.09、0.18、0.26mah/gi,比基于i-/i3-电对和存在于电池中的总i-的理论容量低得多。这表明大部分活性物质并不参与电化学反应。然而,这不是出乎意料的,因为电池中没有可用的对流。因此,容量完全取决于电活性物质的自扩散。对于使用dme电解质的电池获得相似的值,对于sp、tic和rgo电池而言分别为0.18、0.18、0.07mah/gi。
在适用于本发明的li-o2电池中,仅基于电极材料(sp碳,tic或rgo)的质量计算容量。为了允许比较有和无o2获得的容量,基于电极材料质量计算了lii电池的容量,如图15所示。显然,在ar下循环的所有三个电极的比容量在使用相同的电极材料时比li-o2电池小得多。
参考文献
本说明书中提到的所有文献均以其全部内容通过引证结合于本文中。
adamsetal.acsnano,8,12483(2014).
adamsetal.energyenviron.sci.6,1772(2013).
aetukuri,etal.,nat.chem.7,50(2015).
bruceetal.nat.mater.11,19(2012).
chenetal.nat.chem.5,489(2014).
chenetal.nat.chem.5,489(2014).
freunbergeretal.angew.chem.int.ed.50,8609(2011).
freunbergeretal.j.am.chem.soc.133,8040(2011).
gallantetal.energyenviron.sci.6,2518(2013).
gallantetal.j.phys.chem.c116,20800(2012).
girishkumaretal.j.phys.chem.lett.1(14),2193(2010).
gittlesonetal.phys.chem.chem.phys.16,3230(2014).
gowdaetal.j.phys.chem.lett.4,276(2013).
guoetal.j.powersources264,1(2014).
hansonetal.j.electrochem.soc.134,2204(1987).
hummersetal.j.am.chem.soc.80(6),1339(1958).
hyoungohetal.adv.energymater.2,903(2012).
hyoungohetal.nat.chem.4,1004(2012).
johnsonetal.nat.chem.6,1091(2014).
jungetal.acsnano7,3532(2013).
kwaketal.j.mater.chem.a,3,8855(2015).
laceyetal.electrochem.commun.26,74(2013).
leskesetal.angew.chem.int.ed.51,8560(2012).
leskesetal.j.phys.chem.c117(51),26929(2013).
leskesetal.j.phys.chem.c117(51),26929(2013).
limetal.angew.chem.int.ed.,126,4007(2014).
limetal.j.am.chem.soc.135,9733(2013).
lim,etal.adv.mater.25,1348(2013).
liuetal.energyenviron.sci.7,677(2014).
luetal.energyenviron.sci.6,750(2013).
luetal.nat.comm.4,1(2013).
lu,etal.j.am.chem.soc.133,19048(2011).
mccloskeyetal.j.am.chem.soc.135,18038(2011).
mccloskeyetal.j.phys.chem.lett.3,997(2012).
mccloskeyetal.,j.phys.chem.lett.2,1161(2011).
mitchelletal.j.phys.chem.lett.4,1060(2013).
nasybulinetal.j.phys.chem.c,117,2635(2013).
ottakamthotiyletal.j.am.chem.soc.135,494(2013).
ottakamthotiyletal.nat.mater.12,1050(2013).
pengetal.angew.chem.int.ed.50,6351(2011).
sawetal.energyconvers.manage.75,162(2013).
stevensetal.,ecstrans.28(32),1(2010).
sunetal.j.am.chem.soc.136,8941(2014).
sunetal.nanolett.14,3145(2014).
wang,etal.adv.funct.mater.22,3699(2012).
wu,etal.,adv.mater.27,101(2015).
xiao,etal.nanolett.11,5071(2011).
yilmazetal.nanolett.13,4679(2013).
zhaietal.j.am.chem.soc.135,15364(2013)。
- 还没有人留言评论。精彩留言会获得点赞!