一种制备细胞因子释放综合征小鼠模型的方法及应用与流程
本发明涉及生物,具体涉及一种制备细胞因子释放综合征小鼠模型的方法及应用。
背景技术:
1、嵌合抗原受体t细胞(chimeric antigen receptor t cell,car-t)疗法开辟了肿瘤免疫治疗的新领域,针对b细胞表面标志物cd19的car-t细胞临床试验已显示出对多种血液系统恶性肿瘤的显著疗效。虽然car-t临床表现积极结果,但同时也带来许多不良反应。其中细胞因子释放综合征(cytokine release syndrome,crs)是最常见的一种严重并发症,由于car-t细胞治疗过程中活化的免疫细胞释放过量细胞因子而引起的超常免疫反应,表现为大量细胞因子短暂地、显著地升高,严重的crs可危及患者生命。建立合适的动物模型是设计预防或减轻crs策略的有效手段。负荷肿瘤的nsg小鼠通常用作car-t治疗的临床前模型,以及scid-beige小鼠模型、cd20 car-t引起的免疫激活级联反应的恒河猴模型等。但建立这些模型价格昂贵,实验成本很高,不便于大规模开展相关的实验研究。
2、为了更好研究crs发生的免疫机制及对治疗药物的疗效评估,需要建立技术方法简单、易于重复、便于大规模推广的的crs小鼠模型。已报道的常用car-t相关crs小鼠模型有两种,但是均重复性、稳定性较差。一种为scid-beige小鼠腹腔内注射3×106个raji-gfp-flu白血病细胞,肿瘤生长3周后通过生物发光成像评估肿瘤负担,再腹腔注射3×107个cd19.28z car-t细胞,car-t输注2~3天后,小鼠发生crs,血清细胞因子升高,并最终死亡。但是这些小鼠不同个体肿瘤负荷偏差较大,导致小鼠死亡时间不均一,crs治疗观察窗较窄,不利于实验研究。此外该模型采用人源car-t细胞,使得ifn-γ、il-6等重要细胞因子及受体无法跨物种识别,这限制了该模型对人体crs反应的模拟程度。另一种为通过肝内注射将人脐带血造血干细胞和祖细胞移植到亚致死剂量照射的新生nsg小鼠,或者表达人类干细胞因子、粒细胞-巨噬细胞集落刺激因子和il-3的nsg-sgm3小鼠,重建淋巴造血系统,得到人源化nsg或者sgm3小鼠。这种模型对人crs模拟程度更高,但小鼠品系很难获得,国内缺乏正式引进,造价昂贵,不利于实验的常规广泛开展。目前这两种小鼠模型已被多次报道应用,能较好反应临床car-t crs的症状,另外也有研究用lps诱发小鼠的crs,但不能完全反应car-t crs的病理特征和免疫学机制。目前缺乏造价低廉、稳定、能降低小鼠肿瘤负担的car-t crs模型。
技术实现思路
1、发明目的:本发明的发明目的为提供一种体内细胞因子释放综合征小鼠模型及其构建方法,该模型消除小鼠肿瘤负担,简化实验过程,提高实验的稳定性,便于推广应用。
2、为了解决上述技术问题,本发明公开了一种制备细胞因子释放综合征小鼠模型的方法,其通过将2×106~1×107个car-t细胞通过尾静脉回输至小鼠体内得到,其中,所述car-t细胞表达识别鼠源抗原的car和外源性的il12。
3、其中,其中所述鼠源抗原为mcd19。
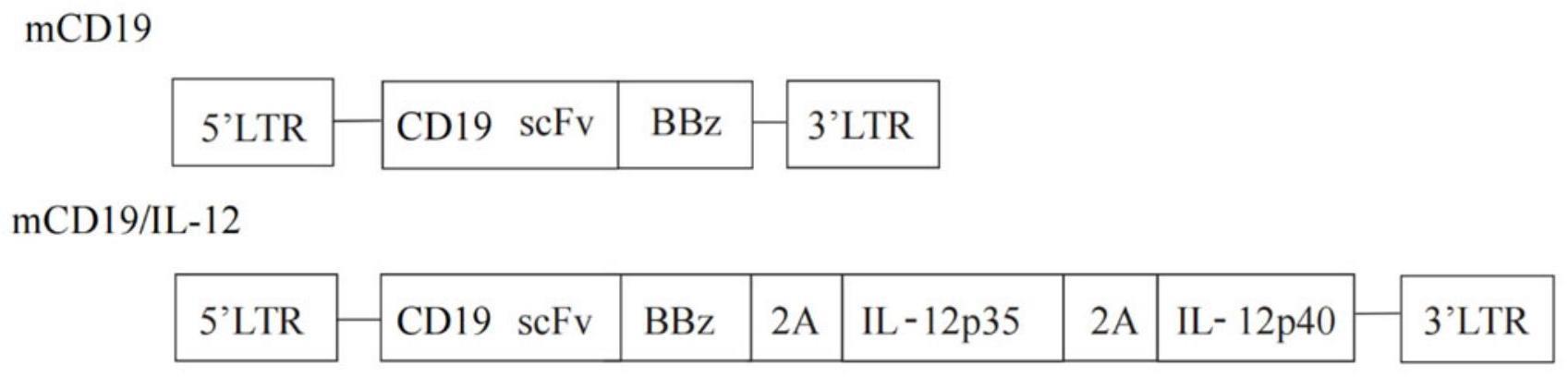
4、所述car的结构为抗mcd19 scfv-bbz。
5、具体地,抗mcd19 scfv的序列如seq id no:1所示;所述il12的序列如seq id no:4所示,bbz结构包括mcd8a tm-m41bb icos-mcd3ζ,所述bbz的序列如sequence id no.2所示。
6、其中car-t细胞的施用剂量为2×106~1×107个细胞。
7、优选地,向小鼠施用car-t细胞之前,先向小鼠注射环磷酰胺。
8、具体地,向普通小鼠体内腹腔注射环磷酰胺两天后通过尾静脉注射回输2×106~1×107个mcd19/il-12-car-t细胞得到。
9、其中所述环磷酰胺的剂量为150-200mg/kg,施用car-t细胞和注射环磷酰胺之间间隔2-4天。
10、其中所述小鼠为c57bl/6j小鼠。
11、通过上述方法构建得到的细胞因子释放综合征小鼠模型也在本发明的保护范围值呢。
12、本发明进一步提出了上述细胞因子释放综合征小鼠模型在制备筛选抗细胞因子释放综合征药物的产品中的应用。
13、有益效果:与先有技术相比,本申请具有如下优点:
14、(1)本申请的模型使用普通品系c57bl/6j小鼠及通过尾静脉回输体外培养的小鼠car-t细胞即可建立,crs的产生不依赖于接种肿瘤的大小和类型,避免了小鼠在实验期间因肿瘤生长速度的差异及负担过重而导致的不均一死亡,crs发生时间主要在car-t回输后的1~6天,小鼠表现出典型crs症状,如体重减轻,血清细胞因子显著升高等,符合临床car-t诱发crs表征,此模型更稳定,制作周期短,降低了实验成本,重复性高;
15、(2)目前crs的治疗首选使用激素治疗,抗il-6受体拮抗剂托珠单抗联合或者不联合皮质类固醇的给药是主要的治疗方法。托珠单抗干预的最佳时机尚不清楚,并且是正在进行的临床试验的主要解决问题,本发明为crs治疗药物的有效性、安全性及药物筛选提供了合适的工具模型,为crs治疗药物的有效性、安全性及药物筛选提供了合适的工具模型,保证其模型的重复性和高效性,具有广泛的应用前景。
技术特征:
1.一种制备细胞因子释放综合征小鼠模型的方法,其特征在于,包含以下步骤:
2.根据权利要求1所述的方法,其中所述鼠源抗原为mcd19。
3.根据权利要求1所述的方法,其中所述car的结构为抗mcd19 scfv-bbz。
4.根据权利要求3所述的方法,其中抗mcd19 scfv的序列如seq id no:1所示;所述il12的序列如seq id no:4所示。
5.根据权利要求1所述的方法,其中car-t细胞的施用剂量为2×106 ~1×107个细胞。
6.根据权利要求1所述的方法,其特征在于,向小鼠施用car-t细胞之前,先向小鼠注射环磷酰胺。
7.根据权利要求6所述的方法,其中所述环磷酰胺的剂量为150-200 mg/kg,施用car-t细胞和注射环磷酰胺之间间隔2-4天。
8.根据权利要求1所述的方法,其中所述小鼠为c57bl/6j小鼠。
9.通过权利要求1-8任一项所述的方法获得的细胞因子释放综合征小鼠模型。
10.权利要求9所述的细胞因子释放综合征小鼠模型在制备筛选抗细胞因子释放综合征药物的产品中的应用。
技术总结
本发明提出了一种制备细胞因子释放综合征小鼠模型的方法及应用。本发明尝试通过回输IL‑12 CAR‑T细胞诱发小鼠CRS,建立一种新的CRS模型。结果发现mCD19/IL‑12‑CAR‑T细胞体外和体内均分泌高水平IL‑12,低剂量1×10<supgt;6</supgt;个mCD19/IL‑12‑CAR‑T细胞回输小鼠未诱发严重CRS,但可以抑制胰腺癌实体瘤的生长,高剂量回输mCD19/IL‑12‑CAR‑T细胞后,出现激发小鼠体内多种CRS相关炎性因子IL‑6、IL‑1a、IFN‑γ、IL‑10、TNF‑α、MCP‑1等迅速升高,体重减轻、肝脏肺脏等组织损伤,最终导致死亡等一系列典型CRS表现,从而建立一种新的CRS小鼠模型。
技术研发人员:朱学军,黎陈铖,刘细细,邢芸,任江涛,张玮光,杨箐,陈碧清,田芳
受保护的技术使用者:江苏省中医院
技术研发日:
技术公布日:2024/1/12
- 还没有人留言评论。精彩留言会获得点赞!