双特异性四价抗体及其制造和使用方法与流程
本申请要求2014年12月22号提交的美国临时申请第62095348号,名称为“双特异性抗体”的优先权,该文件全部内容在此引入作为参考。序列表与本申请相关联的序列表是以文本格式代替纸件副本的形式来提供,并且以引用方式并入本说明书中。包含所述序列表的文本文件名是序列表_ST25_0003PCT2.txt。所述文本文件大约227KB,在2015年12月18号创建,并经由EFS-Web进行电子提交。
技术领域:
本公开总体涉及抗体治疗试剂
技术领域:
,尤其涉及针对EGFR家族两个不同成员的双特异性四价抗体。
背景技术:
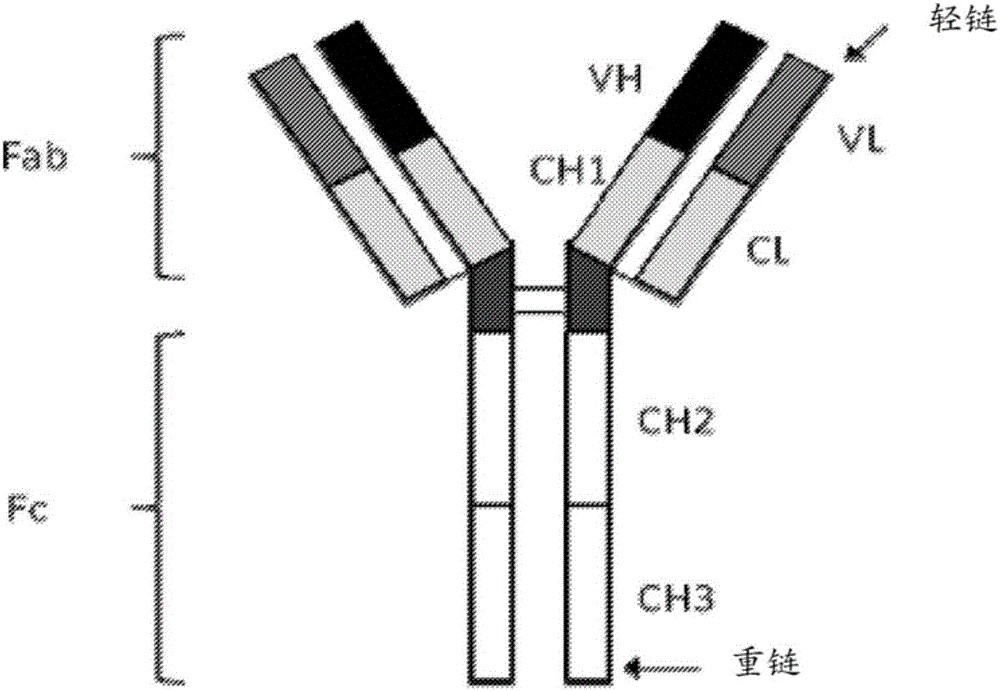
:ErbB/HER受体家族成员例如EGFR、HER2、HER3、HER4的过量表达和/或失调,已经表明在癌症的肿瘤发生中起重要作用。EGFR或者HER2的突变和扩增产生异常生长信号,其激活促成肿瘤发生的下游信号途径。针对EGFR和HER2的治疗性抗体和小分子抑制剂已被批准用于癌症的治疗(Arteaga等人,NatureReviewsClinicalOncology916-32,January2012)。针对EGFR家族成员,如EGFR和HER2的单克隆抗体已经在结肠癌(Price等人.,TheLancetOncology15(6),Pages569-579,May2014)、头颈部鳞状细胞瘤(Cohen,CancerTreatmentReviews40(2014)567-577)、乳癌和胃癌(Arteaga等人,NatureReviewsClinicalOncology916-32,January2012)中表现出良好的临床反应。几种治疗性抗EGFR抗体,包括西妥昔单抗、帕尼单抗和尼妥珠单抗是已获准用于几种癌症包括转移性结肠直肠癌、头颈部鳞状细胞癌和神经胶质瘤的疗法(Price和Cohen,CurrTreatOptionsOncol.2012Mar;13(l):35-46;Bode等人,ExpertOpinBiolTher.2012Dec;12(12):1649-59)。令人遗憾的是最初对这些治疗剂反应的许多肿瘤由于对药剂的获得性抗性而最终发生进展(Jackman等人.JClinOncol2010;8:357-60)。因此仍然存在着对更好的癌症治疗方法需求。技术实现要素:本公开提供了双特异性四价抗体。双特异性四价抗体可以包括具有两条重链和两条轻链的免疫球蛋白G(IgG)部分,以及与重链或轻链的C或N末端共价连接的两个scFv部分。IgG部分可具有与EGFR家族第一成员结合的特异性。scFv部分可具有与EGFR家族第二成员结合的特异性。IgG部分和两个scFv部分共价连接以作为双特异性四价抗体起作用。为使本公开的目的和有益效果更加清楚,下面将结合相应的附图详细阐述优选实施例。附图说明现在参考附图详细描述本公开的优选实施例,其中类似的参考标号表示类似的元件。图1是示出了实例二价单特异性免疫球蛋白G(IgG)抗体的结构域结构的图。图2是示出了根据本发明的一个实施例,包含IgG部分和2个scFv部分的实例四价双特异性抗体的结构域的图。图3示出了实例四价双特异性抗体1X1、1X2、1X3、1X4、1X4.2、1X5和1X6的结构域结构图。图4示出了SI-1X4和SI-1X4.2之间的VH结构域序列比较,示出了5个氨基酸差异。图5和6是示出了利用BLI的单体EGFR结合的图。图7、8和9是示出了双特异性ELI结合的图。图10是示出了二聚EGFRELISA的图。图11示出了SI-1C5.2和SI-1X4.2与单体EGFR通过Octet分析的结合动力学。图12示出了SI-1X抗体与A431细胞结合的流式细胞仪分析。图13示出了SI-1X抗体与BxPC3细胞结合的流式细胞仪分析。图14示出了SI-1X4.2抗体与Fadu细胞结合的流式细胞仪分析。图15示出了SI-1X4.2抗体与A431细胞结合的流式细胞仪分析。图16示出了SI-1X抗体对A431细胞增殖的作用。图17示出了SI-1X抗体对A431细胞增殖的作用。图18示出了SI-1X抗体对BxPC3细胞增殖的作用。图19示出了SI-1X抗体对BxPC3细胞增殖的作用。图20示出了SI-1X4.2抗体对Fadu细胞增殖的作用。图21示出了SI-1X4.2抗体对A431细胞增殖的作用。图22示出了SI-1X抗体对Fadu细胞的ADCC活性。图23示出了SI-1X抗体对NCI-H1975细胞的ADCC活性。图24示出了SI-1X抗体的热熔性以展示其热稳定性。图25示出SI-1X抗体在七天时间内的血浆稳定性。图26是示出经EGFR包被的ELISA用于大鼠PK研究的结果图。图27是示出经HER3包被的ELISA用于大鼠PK研究的结果图。图28是示出夹心ELISA用于大鼠PK研究的结果图。图29是示出小鼠异种移植研究中平均肿瘤体积对天数的曲线图图30是示出小鼠异种移植研究中相对体重对周数的曲线图。具体实施方式本公开提供了较目前已知的抗EGFR抗体,具有更优异治疗特性或者疗效的双特异性四价抗体。在一个实施例中,抗体靶向EGFR家族的两个成员,包括但不限于EGFR和HER3。双特异性四价抗体可同时抑制EGFR和HER3介导的信号传导,因而克服EGFR抑制剂或单克隆抗体治疗中的耐药性。必须注意,如本文和所附权利要求书中所用,贯穿本说明书和权利要求书的单数形式“一(a)”、“一个(an)”以及“所述(the)”、单词“包含(comprise)”或变形例如“包含(comprises)”或“包含(comprising)”应理解为意味着包括所叙述的整体或者整体的组合,但是并不排除任何其他的整体或者整体的组合,包括复数对象,除非上下文另外清楚地说明。“抗体片段”包含完整抗体的部分,优选完整抗体的抗原结合区或可变区。抗体片段的实例包括Fv、Fab、Fab'、F(ab')2、Fab'-SH;diabodies;线性抗体(参考美国专利第5641870号实例2;Zapata等,ProteinEng.8(10):1057-1062(1995));单链抗体分子(例如scFv)尽管在本描述中,并且在整个说明书中,提到了抗体和抗体的各种性质,但是相同的公开内容也适用于功能性抗体片段,例如,双效Fab片段。在一方面,双特异性四价抗体可以包括具有两条重链和两条轻链的免疫球蛋白G(IgG)部分,以及与重链或轻链的C或N末端共价连接的两个scFv部分。IgG部分可具有与EGFR家族第一成员结合的特异性。scFv部分可具有与EGFR家族第二成员结合的特异性。IgG部分可以为scFv部分提供稳定性。双特异性四价抗体可阻断AKT和MAPK/ERK途径的信号传导,并且可以介导针对表达一种或两种抗原的细胞的抗体依赖性细胞介导的细胞毒性(ADCC)。在一个实施例中,双特异性四价抗体能够同时结合两种抗原。在一些实施例中,与单特异性抗体亲本对照或单特异性抗体亲本对照的组合相比,双特异性四价抗体在体外和体内增殖试验中提供更强的肿瘤抑制。在一个实施例中,本公开提供具有两条IgGl重链、两条κ轻链和两条单链Fv(scFv)结构域的双特异性四价抗体。两条IgG1重链和κ轻链形成对EGFR家族的第一成员具有结合特异性的IgG部分。两个scFv结构域具有对EGFR家族第二成员的结合特异性,并且每个scFv结构域通过具有氨基酸序列(gly-gly-gly-gly-ser)n(也称为(G4S)2)的连接体连接到IgG1重链的C末端,以提供IgG1-连接体连接,n是至少为1的整数。例如,n可以是2、3、4、5、6、7、8、9、10或17。每个scFv结构域具有“N末端-可变重链-连接体-可变轻链-C末端”的结构顺序。连接体可具有氨基酸序列(gly-gly-gly-gly-ser)m,也称为(G4S)m。m可以是至少2或至少3的整数。例如m可以是3、4、5、6、11或12。在一些实施例中,IgGl重链中至少一个或两个是人源化或人的。在一些实施例中,κ轻链中至少一个或两个是人源化或人的。EGFR家族成员可包括EGFR、HER2、HER3、片断或其衍生物。在一些实施例中,EGFR家族的第一成员可以是EGFR、HER2、其片段或衍生物。在一些实施例中,EGFR家族的第二成员可以是HER3、其片段或衍生物。在一个实施例中,IgG部分可具有针对HER3的结合特异性。在一个实施例中,scFv结构域可以具有针对EGFR的结合特异性。在一个实施例中,IgG部分可具有针对HER3的结合特异性,且scFv结构域可以具有针对EGFR的结合特异性。在一个实施例中,IgG部分可以具有针对EGFR的结合特异性。在一个实施例中,scFv结构域可以具有针对HER3的结合特异性。在一个实施例中,IgG部分可以具有针对EGFR的结合特异性,且scFv结构域可以具有针对HER3的结合特异性。在一些实施例中,IgGl重链中的一条或两条的C末端缺失一个氨基酸残基。例如在连接体被融合到C末端上之前,赖氨酸残基可从IgGl链的C末端缺失。赖氨酸残基的缺失导致IgGl-连接体连接对蛋白酶活性具有抗性。在一些实施例中,IgGl重链中的一条或两条含有两个在CH3结构域中的突变。例如,两个突变可以回复成人CH3结构域中的通用残基。在一些实施例中,IgG1重链可以具有与SEQIDNO7、15、23、31、39、47和127有至少95%、98%或99%相似性的氨基酸序列。在一些实施例中,IgG1重链、连接体和scFv结构域可以具有与SEQIDNO56、66、76、86、98、108、118和136有至少95%、98%或99%相似性的氨基酸序列。在一些实施例中,κ轻链可具有与SEQIDNO3、11、19、27、35、43、51、61、71、81、92、103、113、123和131有至少95%、98%或99%相似性的氨基酸序列。在一些实施例中,可变轻链可具有与SEQIDNO4、12、20、28、36、44、52、62、72、82、93、104、114、124和132有至少95%、98%或99%相似性的氨基酸序列。在一些实施例中,可变重链可具有与SEQIDNO8、16、24、32、40、48、57、67、77、87、99、109、119、128和137有至少95%、98%或99%相似性的氨基酸序列。在一些实施例中,IgG部分可以具有针对HER3的结合特异性,且scFv结构域可以具有针对EGFR的结合特异性。在一个实施例中,IgGl重链、连接体和scFv结构域具有SEQIDNO56的氨基酸序列,并且κ轻链具有SEQIDNO51的氨基酸序列。在一个实施例中,IgGl重链、连接体和scFv结构域具有SEQIDNO76的氨基酸序列,并且κ轻链具有SEQIDNO71的氨基酸序列。在一个实施例中,IgGl重链、连接体和scFv结构域具有SEQIDNO108的氨基酸序列,并且κ轻链具有SEQIDNO103的氨基酸序列。在一些实施例中,IgG部分具有针对EGFR的结合特异性,且scFv结构域具有针对HER3的结合特异性。在一个实施例中,IgGl重链、连接体和scFv结构域具有SEQIDNO66的氨基酸序列,并且κ轻链具有SEQIDNO61的氨基酸序列。在一个实施例中,IgGl重链、连接体和scFv结构域具有SEQIDNO86的氨基酸序列,并且κ轻链具有SEQIDNO81的氨基酸序列。在一个实施例中,IgGl重链、连接体和scFv结构域具有SEQIDNO98的氨基酸序列,并且κ轻链具有SEQIDNO92的氨基酸序列。在一个实施例中,IgGl重链、连接体和scFv结构域具有SEQIDNO118的氨基酸序列,并且κ轻链具有SEQIDNO113的氨基酸序列。在一个实施例中,IgGl重链、连接体和scFv结构域具有SEQIDNO136的氨基酸序列,并且κ轻链具有SEQIDNO131的氨基酸序列。双特异性四价抗体具有抑制癌细胞生长的活性。在某些实施例中,本发明的抗体对其靶标EGRF或HER3具有解离常数(Kd)≤80nM、≤50nM、≤30nM、≤20nM、≤10nM、或≤0.1nM。抗体可同时结合两个靶标。在一些实施例中,抗体以低于50nM的Kd结合EGRF和HER3。在一些实施例中,抗体以低于40、30、25、20、19、18或者10nM的Kd结合EGRF和/或HER3。在一个实施例中,抗体以低于30nM的Kd结合EGRF并且以低于30nM的Kd结合HER3。在一个实施例中,抗体以低于50nM的Kd结合EGRF并且同时以低于50nM的Kd结合HER3。在另一方面中,本公开提供了分离的核酸,其编码在此公开的双特异性四价抗体或其亚组分。亚组分可以是IgGl重链、κ轻链、可变轻链或可变重链。在另一方面中,本公开提供了具有分离的核酸的表达载体,核酸编码在此公开的双特异性四价抗体或其亚组分。载体在宿主细胞内是可表达的。宿主细胞可以是原核细胞或真核细胞。在另一方面中,本公开提供了宿主细胞,其具有分离的核酸或包括这些核酸序列的表达载体,核酸编码在此公开的双特异性四价抗体。在另一方面中,本公开提供产生双特异性四价抗体的方法。在一个实施例中,该方法可包括培养上述宿主细胞使得产生抗体。在另一方面中,本公开提供免疫偶联物,其包括本文所述的双特异性四价抗体以及细胞毒性剂。在另一方面中,本公开提供了药物组成。该药物组成可包括本文所述的双特异性四价抗体或免疫偶联物和药学上可接受的载剂。在一些实施例中,组成可进一步包括放射性同位素、放射性核素、毒素、治疗剂、化学治疗剂或其组合物。在另一方面,本公开提供治疗癌症受试者的方法。在一个实施例中,该方法包括给受试者施用有效量的本文所述的双特异性四价抗体的步骤。该癌症可以包括表达EGFR家族至少两个成员(包括例如EGFR、HER2、HER3、其片段或衍生物)的细胞。癌症可以是乳癌、结肠直肠癌、胰腺癌、头颈癌、黑素瘤、卵巢癌、前列腺癌和非小细胞肺癌、神经胶质瘤、食管癌、鼻咽癌、肛门癌、直肠癌、胃癌、膀胱癌、子宫颈癌和脑癌。在一个实施例中,所述方法可进一步包括施用有效量的治疗剂。该治疗剂可以是例如抗体、化学治疗剂、细胞毒性剂、酶或其组合物。在一些实施例中,该治疗剂可以是抗雌激素剂、受体酪氨酸抑制剂或者其组合。在一些实施例中,该治疗剂可以是生物制剂。在一个实施例中,该治疗剂可以是检查点抑制剂。在一些实施例中,治疗剂可包括PD1、PDL1、CTLA4、4-1BB、OX40、GITR、TIM3、LAG3、TIGIT、CD40、CD27、HVEM、BTLA、VISTA、B7H4、其衍生物、偶联物或片段。在一些实施例中,治疗剂可以是卡培他滨、顺铂、曲妥单抗、氟维司群、他莫昔芬、来曲唑、依西美坦、阿那曲唑、氨鲁米特、睾内酯、伏氯唑、福美司坦、法罗唑、来曲唑、埃罗替尼、拉法替尼、达沙替尼、吉非替尼、伊马替尼、帕唑帕尼、拉帕替尼、苏尼替尼、尼洛替尼、索拉非尼、纳米微粒白蛋白结合型紫杉醇或其衍生物。在一些实施例中,有此治疗需要的受试者是人。在一个实施例中,本公开提供了通过给受试者施用有效量的双特异性四价抗体以抑制HER受体的生物活性来治疗受试者的方法。在一实施例中,本公开提供具有有效浓度的双特异性四价抗体的溶液。在一个实施例中,该溶液是受试者的血浆。IgG的一般结构图在图1中示出。根据一些实施例的双特异性四价抗体典型结构图在图2中示出。在这个实例中,双特异四价抗体包括两条人IgGl重链、两条人κ轻链和两条单链Fv(scFv)结构域。两条人IgG1重链和人κ轻链形成对EGFR家族的一个成员具有结合特异性的IgG部分,并且两个scFv结构域中的每个通过具有氨基酸序列gly-gly-gly-gly-ser-gly-gly-gly-gly-ser((G4S)2)的连接体连接到人IgG1重链中的任一条的C末端残基。每个scFv结构域按如下顺序:N末端-可变重链-接头-可变轻链-C末端。接头由氨基酸序列为gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-gly-gly-gly-gly-ser,也称为(G4S)3构成。对于双特异性四价抗体的一些实施例,CH1、CH2、CH3、CL、连接体和接头氨基酸序列是相同的。每个双特异性四价抗体在抗体的一个末端具有二价抗HER3结合的特异性和在另一个末端上具有二价抗EGFR结合特异性。一对抗HER3可变重链和可变轻链命名为1C1,且四对抗EGFR可变重链和可变轻链分别命名为1C3、1C5、1C5.2、1C6和1C6.4。双特异性四价抗体命名为1X1、1X2、1X3、1X4、1X4.2、1X5、1X5.2、1X6和1X6.4。此外,参照物分子1C4(也命名为SI-1C4)在一些研究中使用。1C4是在由Schaefer等人2011(Schaefer等人,CancerCell.2011Oct18;20(4):472-86)所述的2-in-1平台上针对EGFR和HER3构建的双特异性抗体。IC4具有类似于单克隆抗体的结构。所述分子在每个Fab臂上能结合EGFR或HER3,但是不能在每个Fab臂上同时接合两个靶标。可变轻链、可变重链和单链Fv(scFv)DNA片段经由外部供应商通过基因合成生成。人γ-1重链和人κ轻链DNA片段经由外部供应商通过基因合成生成。使用限制性位点通过DNA连接将片段装配在一起,并克隆到设计用于在哺乳动物细胞中瞬时表达的载体中。载体含有强CMV衍生启动子以及瞬时表达所需的其他上游和下游元件。通过DNA测序验证所得IgG表达质粒含有预期的DNA序列。如在别处所述,使用线性PEI转染悬浮适应的HEK293F细胞实现抗体构建体的瞬时表达(参见CSHProtocols;2008;doi:10.1101/pdb.prot4977)。如果有必要的话,从所得转染上清液中使用蛋白亲和层析和尺寸排阻层析纯化抗体。通过Superdex200柱来分析蛋白质质量。用于所有试验的蛋白质都具有大于90%的纯度。双特异性抗体可用于治疗具有EGFR和HER3共表达的癌症类型,包括但不限于结肠癌、头颈部鳞状细胞癌、肺癌、神经胶质瘤、胰腺癌、鼻咽癌和其他癌症类型。双特异性抗体具有四价双重特异性。实例抗体可以包括一个IgG和两个scFv,相比于单特异性抗体IgG,其提供了两种不同的结合特异性。与仅使用scFv的其他双特异性抗体例如BiTE技术(Lutterbuese等人,ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica107.28(2010):12605-12610.PMC.Web.2Dec.2014)和其他(例如,US7332585B2)相比,IgG组分提供了稳定性和改善的血浆半衰期。其还能够介导ADCC,而不具有Fc组分的那些则不能(例如,US7332585B2)。四价双重特异性性质为双特异性抗体提供优于一些其他双特异性抗体的同时结合能力,后者仅可一次结合一种抗原(Schanzer等人,Antimicrob.AgentsChemother.2011,55(5):2369;EP272942A1)。为了叙述方便,双特异性抗体序列或其相关序列概括在下表1中。表1双特异性抗体的核苷酸和氨基酸序列或其相关的核苷酸和氨基酸序列的概括实例虽然以下实例仅提供作为举例说明而用,而非用于限制,但是本领域技术人员应该容易地识别各种各样的非关键参数,这些参数可被更改或修改以生成基本上相同或相似的结果。实例1:SI-1X4和SI-1X4.2之间的序列差异SI-1X4.2为SI-1X4分子的变型,含有如下5个氨基酸变化:使用Kabat编号系统的V71A、T75S、N76S、A93T和S107T。对于一些位点,特别是75、76和93位,虽然这些位点不位于CDR区,但是它们能与抗原发生相互作用,对于结合和活性是必要的。图4示出了SI-1X4.2和SI-1X4之间的5个氨基酸差异。实例2:使用BLI表征抗表皮生长因子受体(EGFR)抗体通过BLItz仪器(ForteBio公司)以生物膜层干涉法(BLI)结合试验测定抗体与EGFR胞外结构域单体的结合能力。将25μg/mL的SI-1C3、SI-1C4、SI-1C6、SI-1X1、SI-1X2、SI-1X5和SI-1X6稀释于PBS中并经120秒俘获在抗人lgGFcBLItz生物传感器的尖端上。尖端于PBS中洗涤30秒,然后转移至588nMEGFR(ProSpecBio,PKA-344)样品中用于结合。在120秒的结合时间内,EGFRECD与尖端的结合记录为生物膜层干涉法信号(Δnm)。尖端移至PBS中并观察解离240秒(观察*SI-1C6的解离时间仅为120秒)。图5和6记录了从EGFR与负载抗体的生物传感器的结合步骤开始的数据。各图都示出了与作为基准抗体的SI-1C4的对比。由于SI-1C3和SI-1X2共用它们的以Fab示出的EGFR结合域,它们的结合谱相似并强于SI-1X1上示出的scFv形式(图6)。与SI-1C4相比,每个均对EGFR具有非常慢的解离速率,且不受它们的结合速率的影响。SI-1X1在与EGFR结合时可能示出较弱的结合速率,但会保持极强的结合。在图5中观察到相同的趋势,其中SI-1C6和SI-1X6上示出的EGFR结合域的Fab变体以比S1-1X5上示出的其典型的scFv高的速率结合。在双特异性抗体的Fab侧具有EGFR结合域似乎会以快于scFV变体的结合速率而结合,但表现出相似的解离速率。在这个试验(数据未示出)中,SI-1X3和SI-1X4没有表现出单体EGFR结合,在下面的ELISA中,进行二聚EGFR结合的研究。实例3:使用BLI表征抗EGFR和Her3的抗体与EGFR和Her3胞外域的双特异性结合在BLItz仪器(ForteBio公司)上以生物膜层干涉法(BLI)结合试验进行测量。将200nM的SI-1C1、SI-1C3、SI-1C4、SI-1C6、SI-1X1、SI-1X2、SI-1X3、SI-1X4、Sl-1X5和SI-1X6稀释于IX动力学缓冲液KB(ForteBio公司)中并经120秒俘获在抗人lgGFcBLItz生物传感器的尖端上。尖端于KB中洗涤30秒,然后转移至200nMEGFR样品(ProSpecBio,PKA-344)中用于结合。在120秒的结合时间内,EGFRECD与尖端的结合记录为生物膜层干涉法信号(Δnm)。尖端移至KB中并观察解离60秒。用Her3ECD样品(SinoBiological,10201-H08H-10)在200nM下重复该过程120秒,以及在KB中进行相似的解离步骤60秒。图8-10、7-9记录了从EGFR与负载抗体的生物传感器的结合步骤开始的数据。抗体在通过Fc结合到传感器上时能够表现出同时特异性结合EGFR和Her3。如图7和图8中所观察到的,示出为Fab(SI-1X2、SI-1X6)的EGFR结合域比它们的scFv形式(分别为SI-1X1、SI-1X5)在结合时具有更强的结合速率。此时,EGFR和Her3两者都表现出相同的Fab>>scFv结合速率趋势。SI-1X3和SI-1X4没有表现出与单体EGFR结合,然而,正如所预期的那样,各自都具有结合Her3的能力,这是由于每个分子使用相同的如SI-1X1、SI-1X2、SI-1X5和SI-1X6等aHer3结合域。在下面的ELISA中研究SI-1X3和SI-1X4的二聚EGFR结合。实例4:二聚EGFRELISA试验正如早些时候所观察到的,在BLI试验中SI-1X3和SI-1X4不能结合单体形式的EGFR(图9)。为了使SI-1C5、SI-1X3和SI-1X4中使用的aEGFR结合域在体外与EGFR结合,有人建议需进行二价结合(Perez等人,临床肿瘤学杂志2014;3(1):5)。为了对其进行观察,相对于其他使用EGFR二聚形式的EGFR结合抗体,我们将ELISA用于抗体结合。使用与实验室自制的兔Fc融合的二聚EGFRECD试剂SI-2C1来进行ELISA。将EGFR以3μg/mL在PBS中在4℃下包被在Maxisorp免疫板(Nunc)上过夜。免疫板在室温下用3%BSA和0.05%Tween20于PBS中封闭2小时。除了SI-1C5、SI-1X3和SI-1X4起始为50μg/mL(以nM记录)外,抗体起始以10ug/mL在室温下俘获1小时,所有都在PBST(1%BSA)中进行3倍稀释。使用山羊抗人IgG-HRP抗体(JacksonImmunoResearch,109-035-098)在PBST(1%BSA)中以1:2000稀释度检测抗体的Fc部分,并在TMB(ThermoScientific)中显色5分钟,用H2SO4作为终止溶液。在各个步骤之间用PBST(1%BSA)洗涤三次。所有的数据点都进行三次重复,并在450nm下收集(图10)。与其他分子相比,在该ELISA方式中SI-1C5、SI-1X3和SI-1X4都以高浓度与二聚EGFRECD结合。实施例5:使用Octet测定1C5.2和1X4.2的结合动力学使用具有抗人Fc传感器的ForteBioOctetRed96仪器(ForteBio,AHC#18#-5060)测定动力学。结合实验在1000RPM的搅拌下于30℃下进行。EGFR蛋白质为人EGFR的胞外域(Met1-Ser645),其具有C末端多组氨酸标签。所有样品都稀释于10X动力学缓冲液(ForteBio#18#-5032)中。1C5.2、1X6和1X4.2各自以10μg/ml加载到8个传感器上,计300秒,然后在10X动力学缓冲液中检测基线60秒。以单浓度的EGFR蛋白质(300、100、33.33、11.11、3.705、1.235、0.4116和0nM)用各个传感器进行EGFR蛋白质结合300秒。然后,在10X动力学缓冲液中解离900秒。图11中示出了1C5.2和1X4.2的典型结合和解离曲线。使用ForteBio数据分析软件v9.0进行数据分析。进行软件曲线拟合,对于各1C5.2(表2)、1X4.2(表3)和1X6(表4),使用四个最佳曲线拟合并取平均值以测定KD、k(结合)和k(解离)。SI-1C5.2和Sl-1X4.2的平均KD分别是19.2nM和18.4nM。SI-1C6的平均KD是3.04nM。如实例1中所述,与1C5和1X4相比,1C5.2和1X4.2含有5个氨基酸变化。当与图10中针对1C5和1X4产生的数据相比时,这些变化导致对EGFRECD的结合改善。表21C5.2的KD、KON和KDIS的概括EGFR(NM)KD(M)KON(1/MS)KDIS(1/S)SI-1C5.23003.74E-084.61E+041.72E-03SI-1C5.21002.23E-087.89E+041.76E-03SI-1C5.233.39.94E-091.60E+051.59E-03SI-1C5.211.17.08E-092.12E+051.50E-03平均值1.92E-081.24E+051.64E-03表31X4.2的KD、KON和KDIS的概括EGFR(NM)KD(M)KON(1/MS)KDIS(1/S)SI-1X4.23003.69E-084.63E+041.71E-03SI-1X4.21003.69E-087.88E+041.65E-03SI-1X4.233.39.44E-091.58E+051.49E-03SI-1X4.211.16.19E-092.18E+055.14E-02平均值1.84E-081.25E+051.35E-03表41X6的KD、KON和KDIS的概括实例6:实例双特异性抗体对肿瘤细胞系的的结合测试通过流式细胞术测试双特异性抗体SI-1X1、SI-1X2、SI-1X3、SI-1X4、SI-1X5和SI-1X6,以及同型对照抗体与肿瘤细胞系A431(表皮样癌,ATCCCRL-1555)和BxPC3(胰腺癌,ATCCCRL-1687)的结合。细胞生长于含有10%胎牛血清的RPMI-1640培养基中并在指数生长期时收集用于分析。5x106细胞的各等份在PBS中洗涤一次,然后重悬于250μl的PBS+1%胎牛血清(BSA)中并在4℃下培养15分钟以阻止细胞膜进行非特异性结合。将在PBS/1%BSA中稀释至10μg/ml的250μl的抗体加入各样品中以达到5μg/ml的抗体终浓度。细胞在混匀后于4℃下在一抗中培养1小时。然后,细胞用1ml的PBS/1%BSA洗涤两次,然后重悬于500μl的PE-偶联小鼠抗人IgG-Fc中并在混匀后于4℃下孵育45分钟。样品用1ml的PBS/1%BSA再次洗涤两次,重悬于300ml的PBS中并使用FACScalibur流式细胞仪分析。对于各样品,在FL-2通道中收集10000个数据采集点。使用FCSExpress软件生成直方图,且SI-1X直方图与同型对照抗体染色得到的直方图叠加。所有六种双特异性抗体显示相对于指示细胞结合的对照染色的直方图位移。该数据在图12(A431细胞结合)和图13(BxPC3细胞结合)中示出。实例7:通过细胞结合试验表征SI-1C5.2和SI-1X4.2通过流式细胞术测试双特异性抗体SI-1X4.2、单特异性抗体SI-1C5.2和SI-1C1以及同型对照抗体与肿瘤细胞系A431(表皮样癌,ATCCCRL-1555)(图14)和FaDu(BxPC3(下咽鳞癌,ATCCHTB-43)(图15)的结合。细胞生长于含有10%胎牛血清的RPMI-1640培养基中并在指数生长期时收集用于分析。细胞在PBS中洗涤一次,然后以5x106个细胞/ml的浓度重悬于PBS+5%胎牛血清白蛋白(FBS)中并在4℃下培养15分钟以阻止细胞膜进行非特异性结合。100μl等份细胞加入96孔板中的100μl等份抗体(也在PBS+5%FBS中稀释)中。样品于冰上在一抗中孵育45分钟。然后,细胞用200μl的PBS+5%FBS洗涤两次,然后重悬于100μl的PE偶联小鼠抗人IgG-Fc中并于冰上孵育30分钟。样品用200μl的PBS+5%FBS再次洗涤两次,重悬于200μl的PBS中并使用FACScalibur流式细胞仪分析。对于各样品,在FL-2通道中收集10000个数据采集点。使用FCSExpress软件生成直方图,并测定各数据集合的几何平均荧光强度(GMFI)。通过使用GraphpadPrism软件对GMFI相对抗体浓度绘图来测定EC50结合值。双特异性抗体SI-1X4.2示出了与单特异性抗EGFR抗体SI-1C5.2相似的结合谱,在两个细胞系中具有相似的EC50。其他单特异性抗Her3抗体SI-1C1与这两个细胞系结合较弱,这可能是由于Her3在细胞表面上的表达水平较低。如实例1中所述,与1C5和1X4相比,1C5.2和1X4.2含有5个氨基酸变化。与亲本分子1X4相比,这些变化可使得与靶细胞的结合改善。实例8:SI-1X抗体对肿瘤细胞系的抗增殖作用为了评价抗Her3/EGFR双特异性抗体的生长抑制潜能,测试对于A431细胞(ATCCCRL-1555,Manassas,Va.)的增殖的作用,A431细胞是表皮样癌肿瘤细胞系。还测试对于胰腺腺癌细胞系BxPC3(ATCCCRL-1687,Manassas,Va.)的增殖的作用。对于各个细胞系,细胞以6000个细胞/孔的密度接种到100μl的含1%胎牛血清的RPMI-1640培养基中的96孔组织培养板之中。4小时之后,加入0.0015nM至100nΜ之间范围内的各个浓度的测试抗体。细胞在测试抗体存在下培养72小时。向各个孔中加入20μl的MTS试剂(Promega,Madison,Wl),且细胞在37℃下孵育2小时。MTS很容易地被活的增殖细胞摄入,还原成甲臜(其很容易地吸收490nM波长的光),然后分泌到培养基中。在孵育之后,使用BioTek(Winooski,VT)ELx800吸光度读取仪测量OD490值。为建立基准代谢活动,也以这种方式加入抗体到细胞中,以此时的对照细胞OD490nM吸光值作为对照细胞吸光值。。增殖可通过从72小时OD490中减去对照基准OD490来计算。抗体滴定的数据根据以下公式以对照组的%来表示:对照组的%=(测试增殖/对照增殖)*100。各种双特异性抗Her3/抗EGFR抗体对于A431细胞增殖的作用在图16和图17中示出。SI-1X2展示出比对照抗体SI-1C1(抗Her3)、SI-1C3(抗EGFR)或SI-1C1和SI-1C3联用更有效的抗增殖作用。SI-1X1也表现出抗增殖作用,尽管未到可于SI-1C3和SI-1C1与SI-1C3的组合所见的程度。抑制曲线以及IC50值在图17中示出。对于SI-1X5和SI-1X6观察到相似结果,其中SI-1X6比SI-1X5和对照抗体S1-1C1(抗Her3)更有效,然而它却示出出与对照抗体S1-1C6(抗EGFR)和SI-1C1与SI-1C6的组合相似的抗增殖潜能。这可连同IC50值一起见于图17中。还测试这些分子在BxPC3细胞系中的抗增殖作用(图18和图19)。SI-1X2再次显示出比对照抗体SI-1C1(抗Her3)、SI-1C3(抗EGFR)或SI-1C1和SI-1C3联用更有效的抗增殖作用。SI-1X1比SI-1C1更有效,但比SI-1C3和SI-1C1与SI-1C3的组合弱。抑制曲线和IC50值示出在图19中。与对照抗体SI-1C1(抗Her3)、SI-1C6(抗-EGFR)或SI-1C1和SI-ICS组合相比,BxPC3增殖被SI-1X5和SI-1X6两者更强地抑制。该数据连同IC50值一起见于图19中。实例9:SI-1C5.2和SI-1X4.2对肿瘤细胞系的抗增殖作用为了评价抗Her3/EGFR双特异性抗体的生长抑制潜能,测试对于FaDu(鼻咽部鳞状细胞癌系,ATCCHTB-43)和A431(表皮样癌ATCCCRL-1555)细胞的增殖的作用。细胞以6000个细胞/孔的密度接种到100μl的含1%胎牛血清的RPMI-1640培养基中的96孔组织培养板之中。4小时之后,加入0.0015nM至100nΜ之间范围内的各个浓度的测试抗体。细胞在测试抗体存在下培养72小时。在各个孔中加入11μl的阿尔玛蓝试剂(ThermoScientific),细胞在37℃下培养2小时。阿尔玛蓝很容易地被活的增殖细胞摄入,还原,然后分泌到培养基中。阿尔玛蓝的还原形式具有很强的荧光性。在培养之后,荧光使用分子仪器公司(Sunnyvale,CA)FilterMaxF5多模式板读取仪进行测量,该读取仪使用535nm的激发波长和595nm的发射波长。为建立基准代谢活动,也以这种方式加入抗体到细胞后,以此时的荧光值作为对照细胞荧光值。增殖可通过从72小时荧光值中减去对照基准荧光来计算。抗体滴定的数据根据以下公式以对照组的%来表示:对照组的%=(测试增殖/对照增殖)*100。SI-1C5.2和SI-1X4.2对于Fadu和A431细胞增殖的作用分别在图20和图21中示出。在这两个细胞系中,SI-1X4.2展示出比对照抗体SI-1C5.2(抗EGFRMab)、SI-1C1(抗Her3Mab))或SI-1C1和SI-1C7联用改善的有效的抗增殖作用。实例10:SI-1X双特异性抗体的ADCC活性测试SI-1X抗体介导针对多个肿瘤细胞系的细胞毒性的能力。获取正常、健康志愿者的全血。血液用等体积的磷酸缓冲盐水(PBS)稀释。将20ml等份的稀释血液小心地分装于15ml的FicolPacquePLUS(GELifeSciences目录号17-1440-02;Pittsburgh,PA)上。试管在300g下不间断离心40分钟。在离心之后,小心地吸出大部分的血浆层,并用移液管以尽可能最小地体积小心地移除血沉棕黄色层(含有PBMC)。PBMC合并入50ml的试管内并加入PBS以使每个试管定容至50ml。试管在1300RPM下离心10分钟,并小心地吸出上清。细胞重悬于40ml的PBS中并再次离心。该过程共重复两次洗涤。在最后一次洗涤后,细胞重悬于30ml的RPMI-1630+10%FBS中并在37℃下在5%CO2中过夜培养。测试的靶细胞是头颈部鳞状细胞癌细胞系FaDu(ATCCHTB-43,Manassus,VA)和非小细胞肺腺癌细胞系NCI-H1975(ATCCCRL-5908,Manassus,VA)。如下所述,利用钙黄绿素标记靶细胞。细胞以单层生长然后经细胞消化液孵育后去贴壁。在不含血清的RPMI中洗涤细胞两次。将1ml4xl06个细胞/ml的细胞与1mlRPMI(不含血清)+20μΜ钙黄绿素AM(Sigma目录号C1359;St.Louis,MO)混合。将细胞在37℃下培养30分钟,每隔10分钟进行温和混合。标记后,利用14mlRPMI+10%FBS+2.5mM丙磺舒(试验培养基)洗涤细胞两次。丙磺舒(Sigma目录号P8761;St.Louis,MO)是一种阴离子转运蛋白抑制剂并被认为减少细胞内钙黄绿素的自发释放。将细胞重悬在20ml试验培养基中并允许在37℃,5%CO2下恢复2小时。然后,利用试验培养基洗涤细胞一次并稀释至200,000个细胞/ml。将50μl(10,000个细胞)钙黄绿素标记的细胞的等份试样等分量加到96孔圆底平板中。将50μl抗体(以3X最终浓度)加到细胞中并在冰上允许结合40分钟。使来自前一天的PBMC在300g下离心5分钟,重悬在20ml新鲜试验培养基中,计数并稀释至6x106个细胞/ml。将50μlPBMC(300,000)加入每个孔中并在37℃,5%CO2下,将平板培养4小时。将每个抗体通过10倍连续稀释一式三份滴定,从50nM开始并递减到0.00005nM。也建立在抗体和效应细胞不存在下含有标记靶细胞的对照孔以测定最大和自发钙黄绿素释放。在4小时的培养结束时,将50μl含有8%IGEPALCA-630(Sigma目录号18896;St.Louis,MO)的试验培养基加入只含有标记靶细胞的对照孔中(以测定最大钙黄绿素释放)。将50μl试验培养基加入所有其他孔中以使每个孔的总体积到200μl。使平板在2000RPM下离心10分钟并将150μl上清液小心地转移到V型底96孔平板中。使这些平板在2000RPM下再离心10分钟并将100ml上清液小心地转移到黑色、透明底的96孔平板中。通过利用485nM的激发波长和535nM的发射波长测定每个样品的荧光来定量上清液中的钙黄绿素。将特异性裂解的百分比如下计算:%特异性裂解=[(测试样品值-自发释放)/(最大释放-自发释放)]*100数据示出在图22和图23中。对于两种细胞系,SI-1X6.4介导细胞毒性,但并不特别地比对照抗体SI-1C6.2、SI-1C7、或SI-1C6.2+SI-1C7的组合更有效。Sl-1X6.4以比我们的基准抗体SI-1C4更低的EC50介导细胞毒性。对于两种细胞系,SI-1X4.2以与对照抗体大致相同的程度介导细胞毒性。但是,其在介导细胞毒性方面,不像基准SI-1C4那么有效。这可能是因为SI-1X4.2的较低亲和性。实例11:SI-1X双特异性抗体的热稳定性进行蛋白热转移研究用于蛋白热稳定性分析。建立利用蛋白热转移缓冲液TM和蛋白热转移染料TM(AppliedBiosystems)的蛋白熔解反应。简单地讲,20μl反应混合物含有5μg蛋白、5μl蛋白热转移缓冲液TM和2.5μl8X稀释的蛋白热转移TM染料。对于阴性对照,使用PBS来代替。将反应混合物加入MicroAmp光学反应平板中并利用MicroAmp光学粘合剂薄膜密封。每个样品由4个重复样组成。在AppliedBiosystem实时PCR系统上从25到90℃以1%增量运行蛋白熔解反应,然后利用蛋白热转移软件TM分析。图24示出了SI-1X2、SI-1X4.2、SI-1X6.4、SI-1C3、SI-1C3、SI-1C6.2、SI-1C5.2和SI-1C7的熔解曲线。表5示出了这些分子的Tm。Tm被定义为去折叠50%蛋白所需的温度。双特异性分子1X2、1X4.2和1X6都具有约66℃的Tm,这与所有MAb(1C3、1C6.2、1C5.2)和Fc-scFv(1C7)分子相当。表5蛋白名称Tm(℃)SI-1X266.52SI-1C370.06SI-1X4.266.94SI-1C5.270.26SI-1X6.466.50SI-1C6.270.12SI-1C766.40实例12:SI-1X双特异性抗体的血浆稳定性在37℃下在95%人类血浆(AtlantaBiologies,S40110)中以100μg/mL培养0、3和7天时间点以及第7天的55℃的额外时间点以提供发生降解的已知条件后,通过ELISA比较分子SI-1C5.2、SI-1C6.2、SI-1X4.2和Sl-1X6.4与单体EGFRECD的结合来测定这些分子的血浆稳定性。利用3μg/mL单体EGFRECD(SI-2R4)的PBS在4℃下包被ELISA平板过夜。在25℃下利用3%BSAPBST封闭包被的ELISA平板2小时,然后利用PBST洗涤3次。利用1%BSAPBST以1:10稀释SI-1C6.2和SI-1X6.4并在整个平板上以4x稀释。利用1%BSAPBST以1:2稀释SI-1C5.2和SI-1X4.2并在整个平板上以4倍稀释,以及在25℃下培养1小时。利用PBST再洗涤3次,然后利用1μg/mLHer3ECD兔IgGl(SI-1R1)在25℃下在1%BSAPBST中抗原俘获1小时。利用PBST再洗涤3次,然后在25℃下施加以1:5000稀释于1%BSAPBST中的山羊抗兔IgG-HRP(Bio-Rad172-1019)二抗,保持1小时。利用PBST洗涤最后3次,然后利用100μlPierce1-stepUltraTMBELISA(Pierce,34028)显色10分钟,利用100μl2MH2SO4最终终止反应。在450nm下读取平板。将ELISA数据作图并利用GraphPadPrism6产生曲线。ELISA的结果由图25中的EC50记录且当保持在37℃时表现出少许降解的有利特征。当置于55℃时,因为分子经历降解条件,所以EC50移动约一个对数。在37℃下,SI-1C5.2的EC50值从第0天的589.7pM变成第7天的755.2pM(Δ165.5pM)且在55℃下变为第7天的6.522nM(Δ5932.3pM)。在37℃下,SI-1C6的EC50值从第0天的218.2pM变为第7天的226.6pM(Δ8.4pM)且在55℃下变为第7天的1.322nM(Δ1103pM)。在37℃下,SI-1X4.2的EC50值从第0天的429.3pM变为第7天的466.7pM(Δ37.4pM)且在55℃下变为第7天的4.248nM(Δ3818.7pM)。在37℃下,SI-1X6的EC50值从第0天的209.3pM变为第7天的237.3pM(Δ28pM)在55℃下偏移到第7天的4.112nM(Δ3902.7pM)。实例13:SI-1X分子的PK半衰期为了测试其体内半衰期,在SD大鼠中进行药物动力学试验。将双特异性Abs的单次静脉内尾静脉注射(1C6lOmg/kg、1X6lOmg/kg、1X2lOmg/kg、1X432mg/kg)给予按体重随机化(190-212g范围)的4只雌性大鼠组。在每个时间点从眼眶血管丛抽取血液(~150μl),制备成血浆,并储存在-80℃下直到分析。研究持续时间是28天。利用三个ELISA试验测定抗体浓度。在试验1中(EGFRECD包被的ELISA),将重组EGFR-兔Fc包被到平板上,利用PBST(具有0.05%吐温的磷酸盐缓冲盐水)洗涤孔并利用1%BSA的PBST封闭。然后添加血清或血清稀释的标准物,随后PBST洗涤,添加HRP标记的兔抗人IgG(BOSTER),并再次PBST洗涤。然后添加TMB并在暗处将平板孵育2.5分钟。通过添加2M硫酸终止颜色反应。在450nm波长下读取平板。对于试验2(Her3包被的ELISA),利用类似ELISA检测血清,但是将重组HER3-His用作俘获试剂。对于试验3(夹心ELISA),包被重组HER3-His,添加血清或血清稀释的标准物,然后PBST洗涤,添加含EGFR-兔Fc的PBST,再次PBST洗涤。然后添加HRP标记的山羊抗兔IgG(BOSTER)。利用非房室模型测定PK参数。图26-28示出了分别利用三个不同试验得到的四个抗体的血清浓度数据。表6中提供体内PK研究的拟合PK参数。PK数据包括半衰期,其表示表征抗体从血清去除的β相以及Cmax,Cmax表示观察到的最大血清浓度,AUC,其表示浓度时间曲线下的面积。表6实例14:小鼠异种移植研究实例测试Fadu的临床前模型(头颈鳞状细胞癌异种移植模型)中伴随阻断EGFR、HER3的SI-1X2、SI-1X4.2和SI-1X6的活性并对它们、西妥昔单抗、西妥昔单抗和抗-HER3抗体的组合的效力进行比较。所有小鼠研究通过研究所动物照管(InstitutionalAnimalcare)进行并根据指导方针使用委员会批准的动物方案。六周大的雌性Balb/c裸鼠从北京VitalRiverLaboratories购买并关在空气过滤的层流柜中,进行12小时的白天循环并随意获取食物和水。计算动物组的尺寸以测量25%的安慰剂组与治疗组之间的平均差异,具有80%的功效和0.01的P值。携带异种移植物的宿主小鼠被随机地并同等地分配到对照或治疗组。以受控及非盲性方式进行动物试验。对于细胞系来源的异种移植物研究,对小鼠进行皮下注射含2x106Fadu的150μl的细胞悬液(每只小鼠)。一旦肿瘤达到100-250mm3的平均体积,将小鼠随机化为9组,每组具有6只小鼠。媒剂对照,1C6(25mg/kg)、1C4(25mg/kg)、1C6+1C1(25mg/kg+50mg/kg)、SI-1X2(25mg/kg)、SI-1X6(10mg/kg)、SI-1X6(25mg/kg)和SI-1X4.2(10mg/kg)SI-1X4(25mg/kg)。通过静脉内注射每周一次施用所有试验制品。在整个治疗期每隔3天通过数字式卡尺测定肿瘤并利用下式测定体积:l/2x长度x宽度2。在第一次给药前记录小鼠的体重以及随后在治疗期和恢复期每隔一周记录。与阳性对照(除了低剂量SI-1X4.210mg/kg组)相比,SI-1X2、SI-1X6以及SI-1X4.2和SI-1X6组合的所有测试组明显地产生肿瘤生长抑制(图29-30)。并且,在治疗停止后2周,没有观察到复发,除了低剂量SI-1X4.210mg/kg组外。药物组合物术语“有效量”是指有效实现所需效果(例如改善受试者的疾病)的药物的量。当疾病是癌症时,有效量的药物可抑制(例如,在一定程度上减缓、抑制或停止)以下实例特征的一个或多个,包括但不限于,癌细胞生长、癌细胞增殖、癌细胞运动、癌细胞渗入外周器官、肿瘤转移和肿瘤生长。其中疾病是癌症时,有效量的药物当施用于受试者时或者可进行以下中的一种或多种:减缓或停止肿瘤生长、减小肿瘤尺寸(例如,体积或质量)、在一定程度上缓解与癌症相关的一个或多个症状、延长无进展生存期、得到目标响应(包括,例如,部分响应或完全响应)、以及增加总存活时间。在一定程度上,药物可阻止生长和/或杀死现有癌细胞,其具有细胞抑制性和/或细胞毒性。关于施用给受试者(例如需要治疗的人类患者)的适宜组合物的调配,可将文中所公开的抗体与该领域已知的药学上可接受的载剂混合或组合,这取决于所选择的施用途径。对文中公开的抗体的施用模式没有特定的限制,适宜的施用途径和适宜组合物的选择在该领域是已知的,而无需过多试验。虽然许多施用形式是可能的,但是一个实例施用形式会是注射用溶液,特别是用于静脉内或动脉内注射。通常,用于注射的适宜药物组合物包括药学上的适宜载剂或赋形剂,例如但不限于缓冲液、表面活性剂或稳定剂。实例缓冲液可包括但不限于乙酸盐、磷酸盐或柠檬酸盐缓冲液。实例表面活性剂可包括,但不限于聚山梨醇酯。实例稳定剂可包括但不限于人白蛋白。同样,技术人员具有确定有效治疗症状(例如癌症)的文中所公开抗体的有效量或浓度的能力。其他参数(例如药物组合物中多种组分的比例、施用剂量和频率)可由技术人员得到,而无需过多试验。例如,用于注射的适宜溶液可含有但不限于约1至约20、约1至约10mg抗体/ml。实例剂量可以是但不限于约0.1至约20、约1至约5mg/Kg体重。实例施用频率可以是但不限于每天一次或每周三次。虽然本公开内容已参照特定实施例或实例加以描述,但是应了解,实施例是说明性的以及所公开内容范围不如此受限。本公开的其他实施例对本公开所属的该领域的技术人员是显而易见的。这些其他实施例被视为涵盖在本公开的范围内。因此,本公开的范围由所附的权利要求限定并由上述说明支持。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺