干扰素调节因子6及其抑制剂在治疗血管损伤后再狭窄中的功能和应用的制作方法
本发明属于基因的功能与应用领域,特别涉及一种干扰素调节因子6(interferon regulatory factor-6,IRF6)作为药物靶标在筛选治疗血管损伤后再狭窄的药物中的应用。
背景技术:
随着人类社会经济的飞速发展、人民生活水平的提高以及人口老龄化进程的加快,心血管疾病的发病率逐年升高,已成为严重危害全球性公众健康的重大疾病之一,目前对这类疾病尚无根治办法。血管外科的治疗手段包括球囊扩张、支架置入及动脉旁路等方式,但是血管重建后再狭窄极大地影响了治疗效果。有关血管再狭窄的研究已进行了多年,但是迄今为止还没有明确。已有研究表明,在损伤形成的过程中,新生内膜及中膜组织过度增生以及同时伴随的细胞外基质形成,是造成血管重建后再狭窄的主要病理基础。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的两种不同的表型状态,即分化/收缩型和去分化/合成型的转化在新生内膜形成过程中扮演着重要的角色。其由收缩型向合成型转化时,增殖、迁移能力增强并分泌、合成大量的细胞外基质,从而形成新生内膜,进而导致严重的血管增生性疾病的发生。因此,寻找新的血管再狭窄的干预靶点具有重要的理论意义。
哺乳动物体内,干扰素调节因子家族(IRFs)是由9个家族成员组成(IRF1-IRF9),目前的研究公认其为免疫和细胞存活的主要调节因子[1-3]。与其他IRF成员不同之处,IRF6的功能研究都集中在表皮发育和分化的调节作用,而其对免疫细胞的影响仍然未知[4]。有2个主要IRF6缺陷小鼠模型得到发现:其中一个为在翼状胬肉综合征病人身上发现的,敲除最常见的IRF6蛋白突变(R84C)[5],另一个是功能完全缺失的等位基因[4]。IRF6功能无论是部分或完全缺失都能导致肢体和皮肤发育严重缺陷以及在滤泡间上皮角质细胞妥协的增殖与分化[4,5]。除了翼状胬肉综合征,IRF6的突变也已与另一常染色体显性遗传疾病,范德伍兹综合征相关,其特征是唇裂,指畸形,皮肤皱褶,和生殖器异常[6]。在这些综合征里,DeltaNp63亚型p63和正性激活IRF6表达的IRF6增强剂之间的相互作用已经建立,导致了p63水平的负调节和随后抑制角质细胞的增殖[7]。
参考文献
1.Tamura,T.,Yanai,H.,Savitsky,D.&Taniguchi,T.The IRF family transcription factors in immunity and oncogenesis.Annu.Rev.Immunol.26,535–584(2008).
2.Ikushima,H.,Negishi,H.&Taniguchi,T.The IRF family transcription factors at the interface of innate and adaptive immune responses.Cold Spring Harb.Symp.Quant.Biol.78,105–116(2013).
3.Yanai,H.,Negishi,H.&Taniguchi,T.The IRF family of transcription factors:inception,impact and implications in oncogenesis.Oncoimmunology 1,1376–1386(2012).
4.Ingraham CR,Kinoshita A,Kondo S,Yang B,Sajan S,Trout KJ,Malik MI,Dunnwald M,Goudy SL,Lovett M,Murray JC,Schutte BC(2006)Abnormal skin,limb and craniofacial morphogenesis in mice deficient for interferon regulatory factor 6(Irf6).Nat Genet 38:1335-1340doi:10.1038/ng1903
5.Richardson RJ,Dixon J,Malhotra S,Hardman MJ,Knowles L,Boot-Handford RP,Shore P,Whitmarsh A,Dixon MJ(2006)Irf6is a key determinant of the keratinocyte proliferation-differentiation switch.Nat Genet 38:1329-1334doi:10.1038/ng1894
6.Kondo S,Schutte BC,Richardson RJ,Bjork BC,Knight AS,Watanabe Y,Howard E,de Lima RL,Daack-Hirsch S,Sander A,McDonald-McGinn DM,Zackai EH,Lammer EJ,Aylsworth AS,Ardinger HH,Lidral AC,Pober BR,Moreno L,Arcos-Burgos M,Valencia C,Houdayer C,Bahuau M,Moretti-Ferreira D,Richieri-Costa A,Dixon MJ,Murray JC(2002)Mutations in IRF6cause Van der Woude and popliteal pterygium syndromes.Nat Genet 32:285-289doi:10.1038/ng985
7.Moretti F,Marinari B,Lo Iacono N,Botti E,Giunta A,Spallone G,Garaffo G,Vernersson-Lindahl E,Merlo G,Mills AA,Ballaro C,Alema S,Chimenti S,Guerrini L,Costanzo A(2010)A regulatory feedback loop involving p63and IRF6links the pathogenesis of 2genetically different human ectodermal dysplasias.J Clin Invest 120:1570-1577doi:10.1172/JCI40267
技术实现要素:
为解决上述现有技术的缺陷和不足,本发明的目的在于确定IRF6的表达和血管损伤后再狭窄的相互关系,提供一种IRF6作为药物靶标在筛选防治血管损伤后再狭窄的药物中的应用,进而提供一种IRF6的抑制剂在制备防治血管损伤后再狭窄的药物中的应用。
本发明的目的通过下述技术方案实现:
本发明以野生型C57BL/6小鼠与IRF6基因敲除小鼠(IRF6-KO小鼠)为实验对象,通过颈动脉导丝损伤模型诱导获得小鼠血管损伤模型(vascular injury,VI),进行了血管损伤模型(VI)小鼠内膜新生测定、血管壁细胞增殖水平的检测和平滑肌细胞表型的检测和研究,结果表明:与野生型C56BL/6小鼠对比,IRF6基因敲除小鼠表现出内膜新生及细胞增殖明显小于WT小鼠;IRF6基因敲除可以抑制细胞增殖核抗原(Proliferating Cell Nuclear Antigen,PCNA)和细胞周期蛋白(Cyclin D1)的表达,可抑制平滑肌细胞的增殖和内膜增生;IRF6基因敲除可以促进平滑肌细胞分化特异性抗原(smoothelin)、平滑肌肌动蛋白(Smooth Muscle Actin,SMA)和平滑肌22α(smooth muscle 22alpha,SM22α)的表达,可抑制平滑肌细胞由收缩型向合成型的表型转换,从而抑制内膜增生。上述结果表明IRF6基因敲除会抑制血管损伤后再狭窄的发生,IRF6能够促进血管损伤后再狭窄的形成,为研究预防、缓解和/或治疗血管损伤后再狭窄的新靶点和新策略提供了理论依据和临床基础。
因此,IRF6基因可作为药物靶点,构建IRF6基因过表达的体外细胞模型或动物模型,用于筛选预防、缓解和/或治疗血管损伤后再狭窄的药物;IRF6基因也可作为基因治疗中的靶基因,设计并制备预防、缓解和/或治疗血管损伤后再狭窄的目的。例如以IRF6为靶基因,设计可干扰IRF6表达的双链siRNA,通过化学方法合成以后,注射入人体通过RNA干扰的方法使IRF6基因沉默来治疗血管损伤后再狭窄;还可以设计并构建IRF6的突变体,注射后进入细胞,竞争IRF6原形的作用底物,从而抑制IRF6的功能,起到治疗目的;此外,还可以以IRF6为靶点设计小分子化合物抑制剂,利用IRF6基因过表达的体外模型或动物模型,通过筛选,发现其中能够特异性抑制IRF6的分子,从而为血管损伤后再狭窄的治疗提供新的治疗性分子。
针对IRF6的上述功能,提供IRF6作为药物靶标在筛选治疗血管损伤后再狭窄的药物中的应用。
针对IRF6的上述功能,提供IRF6的抑制剂在制备血管损伤后再狭窄的药物中的应用。
一种保护血管功能的药物,包含IRF6的抑制剂。
一种治疗血管损伤后再狭窄的药物,包含IRF6的抑制剂。
一种预防、缓解和/或治疗血管损伤后再狭窄的动脉支架,其包被有IRF6的抑制剂。
所述的IRF6的抑制剂优选为IRF6基因的siRNA、IRF6基因的RNA干扰载体,IRF6的抗体及其他能够抑制IRF6表达的抑制剂。
在本发明中,所述血管损伤主要是动脉血管损伤。
在本发明中,所述血管损伤是指动脉粥样硬化引起的血管损伤,或者在治疗动脉粥样硬化时引起的血管损伤,例如通过球囊扩张或放入支架引起的血管损伤,或者移植后动脉病或肺动脉高压引起的血管损伤。
在本发明中,所述动脉粥样硬化既包括动脉粥样硬化较早期阶段的血管狭窄期,也包括动脉粥样硬化严重时的血管梗塞期。
在本发明中,所述动脉支架是指用于支撑人体内因病变而狭窄、闭塞的血管,恢复血液流通的管状器件,采用金属或高分子材料加工制成,可长期或暂时留于人体血管内。在管腔球囊扩张成形的基础上,在病变段置入支架以达到支撑狭窄闭塞段血管、减少血管弹性回缩及再塑形、保持管腔血流通畅的目的,既包括外周动脉支架,也包括冠状动脉支架。
在本发明中,所述再狭窄是指在局部血管发生损伤时,所作出的导致血管管腔再狭窄的普遍性生物学反应。这里主要指医源性损伤引起的血管再狭窄,损伤过程主要由动脉重塑和内皮增生组成。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明发现IRF6的新功能,即IRF6具有恶化血管损伤后再狭窄的作用。
(2)基于IRF6在恶化血管损伤后再狭窄中的功能,其为研制预防、缓解和/或治疗血管损伤后再狭窄的药物提供靶标。
(3)IRF6的抑制剂可用于制备预防、缓解和/或治疗血管损伤后再狭窄的药物。
(4)IRF6的抑制剂可用于制备预防、缓解和/或治疗血管损伤后再狭窄的动脉支架。
附图说明
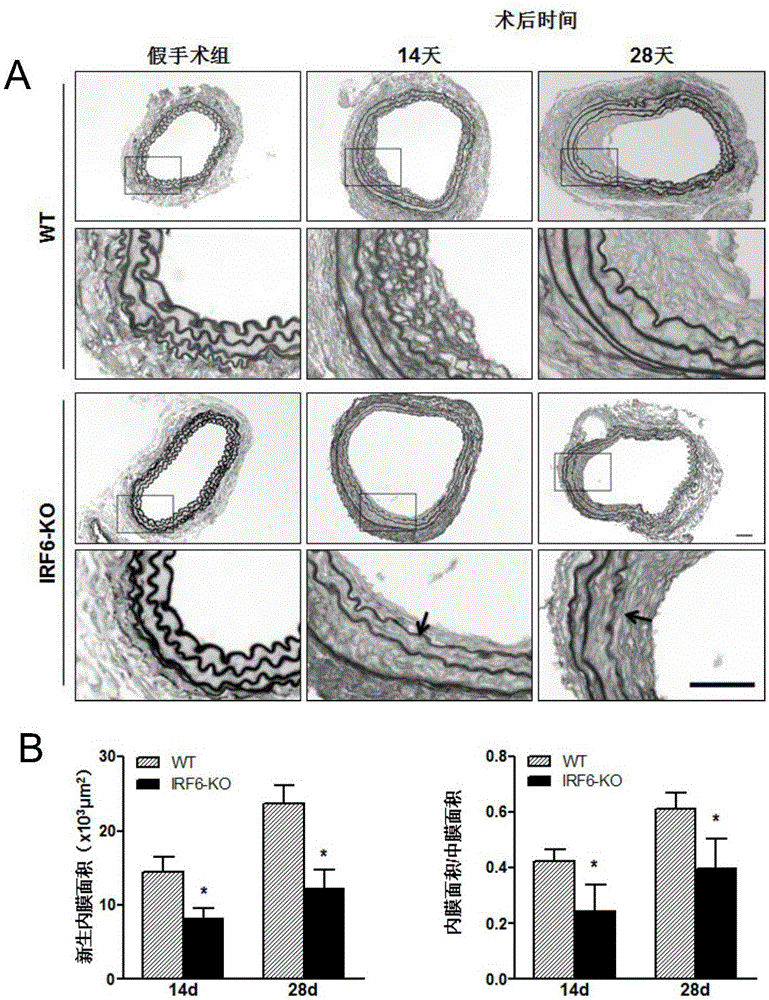
图1是WT和IRF6-KO小鼠术后14、28天的EVG染色及内膜面积结果统计柱状图;
其中,A:EVG染色图,B:内膜面积统计柱状图(*:p<0.05vs WT VI组)。
图2是WT和IRF6-KO小鼠术后14、28天血管壁细胞增殖水平标志物PCNA、CyclinD1表达的免疫荧光染色及结果统计柱状图;
其中,A:免疫荧光染色,B:结果统计柱状图(*:p<0.05vs WT VI组)。
图3是WT和IRF6-KO小鼠术后14、28天平滑肌细胞表型转换标志物smoothelin、SMA、SM22α表达的免疫荧光染色及结果统计柱状图;
其中,A:免疫荧光染色,B:柱状图(*:p<0.05vs WT VI组)。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
实验用动物及饲养
实验动物:选用8-10周龄、体重在24-27g,雄性,C57BL/6小鼠(WT小鼠,购自北京华阜康生物科技有限公司),IRF6基因敲除小鼠(IRF6-KO,购自美国The Jackson Laboratory公司,货号:016902)。
饲养环境:所有实验小鼠均饲养在武汉大学SPF级实验动物中心。SPF级小鼠饲料购自北京华阜康生物科技有限公司,饲养条件:室温在22-24℃之间,湿度在40-70%之间,明暗交替照明时间为12h,自由饮水摄食。
【实施例1】小鼠血管损伤模型(VI)获得
1.实验动物分组:使用8-10周龄,体重24-27g的WT和IRF6-KO小鼠,共分为2组:WT血管损伤组,IRF6-KO血管损伤组,每组各20只小鼠。分别在手术后14天和28天处死小鼠,取损伤节段血管进行分析。
2.小鼠血管损伤模型操作流程:
1)用电子天平于动态模式下准确称取小鼠体重(g),用双蒸水准确配置3%戊巴比妥钠溶液,轻轻摇动使其充分溶解,采用80mg/kg体重剂量,计算所需戊巴比妥钠溶液体积后用1mL注射器准确抽取相应体积溶液,行腹腔注射麻醉小鼠,待小鼠充分麻醉倒(约3min)后,8%硫化钠颈部脱毛。
2)分离颈内和颈外动脉。
3)在颈内动脉和颈外动脉分叉处用8-0线结扎颈外动脉,同时用血管夹(WPI,501784-G)暂时性阻断颈内动脉及颈总动脉供血。
4)用显微剪(WPI,501839)在颈外动脉结扎线的上方横向剪一个小口。经此血管切口插入直径0.015英寸的导丝(No.C-SF-15-15,Cook,Bloomington,Indiana),旋转导丝进退5-6次。
5)在切口进心端结扎颈外动脉,松开颈内及颈总动脉置留的血管夹,剪断线头,清理术野,缝合颈部切口。
【实施例2】血管损伤模型(VI)小鼠内膜新生测定
1.小鼠取材
1)麻醉小鼠,剪破心脏放血。
2)从颈动脉近分叉处剪下颈动脉,取0.5-0.6cm长,保留颈外动脉线结。
3)将颈动脉放入PBS中,用显微镊轻柔排干管腔内的残血。
4)将血管放入装有1mL 4%多聚甲醛的1.5mL EP管中固定。
2.病理学检测
2.1制备石蜡标本切片
由实验室专业病理工作人员制备石蜡标本切片,主要操作程序包括:4%多聚甲醛中隔夜固定后,将血管用滤纸小心包好,放入包埋框→流水冲洗→脱水→透明→浸蜡→包埋→切片(3μm)→摊片→晾干或烘烤后备用。
2.2EVG染色
主要步骤为:55℃烘烤30min→二甲苯5min,3次→100%酒精3min,2次→95%酒精3min,1次→70%酒精3min,1次→双蒸水1min→高锰酸钾溶液5min(珠海贝索,BA-4083B)→水洗1min→草酸溶液5min(珠海贝索,BA-4083B)→水洗1min→95%酒精分化2-3秒→Elastin染液(珠海贝索,BA-4083B)8-24小时→95%酒精迅速分化1s→流水冲洗10min→双蒸水1min→Van Gieson染液(珠海贝索,BA-4083B)1min→95%酒精迅速分化2-3s→100%酒精2min,2次→二甲苯2min,3次→趁二甲苯未干立即封片→通风橱内吹干,显微镜拍照。
以血管内弹力纤维和外弹力纤维为界,内弹力板以内为血管内膜,外弹力板以外为血管外膜,内外弹力板之间为血管中膜。用Image-Pro Plus 6.0软件分别圈各血管管腔面积。
内膜面积大小的计算参照公式如下:
新生内膜面积=内弹力板面积-管腔面积;
中膜面积=外弹力板面积-内弹力板面积。
小鼠EVG染色后的血管内膜新生的结果如图1。正常的血管壁结构完整,排列整齐,血管内膜为单层内皮细胞,结构完整,中膜平滑肌细胞排列整齐。通过HE染色观察到,血管损伤组(VI组)血管壁结构不完整,血管内皮细胞缺失,新生内膜增生明显,并伴有大量炎症细胞浸润;IRF6-KO组在术后14、28天新生内膜面积明显比WT小鼠要减小。同样,内膜面积/中膜面积的比值在VI术后IRF6-KO组要低于WT组。这说明IRF6基因的缺失可以抑制血管损伤后引起的内膜新生。
【实施例3】血管壁细胞增殖水平的检测
免疫荧光染色检测细胞增殖核抗原(Proliferating Cell Nuclear Antigen,PCNA)、细胞周期蛋白(Cyclin D1)的表达。所需一抗信息:PCNA(#2586;1:100;mouse;Cell Signaling Technology),cyclin D1(#2978;1:25;rabbit;Cell Signaling Technology);所需二抗信息:Alexa Fluor 568-conjugated goat anti-rabbit IgG(A11011;Invitrogen,Carlsbad,CA),Alexa Fluor 568-conjugated goat anti-mouse IgG(A11004;Invitrogen,Carlsbad,150d,CA)。
主要步骤为:
1)烤片:将石蜡切片置于55℃烤箱中60min以上。
2)脱蜡:二甲苯8min×3。
3)水合:100%乙醇5min×2;95%乙醇5min;70%乙醇5min;ddH2O浸洗5min×2。
4)柠檬酸盐组织抗原修复(高压修复):取一定量的pH6.0柠檬酸盐抗原修复工作液(购自福州迈新生物科技有限公司,货号MVS-0100)于修复盒中,修复工作液的量必须能足够浸没整张切片,将修复盒放入已加入适量自来水的高压锅中,大火加热至沸腾,将脱蜡水合后的组织切片置于耐高温染色架上,再将染色架缓慢放入修复盒中,盖上锅盖,扣上压力阀,继续加热至喷气,开始计时5min后,压力锅断开电源,去阀开盖,取出修复盒;室温放置20min自然冷却后取出切片。
5)ddH2O漂洗5min×2次,PBS漂洗5min×2次。
6)组化笔划圈,滴加10%驴血清(GTX27481,GeneTex)封闭,于湿盒中37℃封闭60min。
7)弃封闭液,滴加适当比例稀释的一抗,4℃孵育过夜,37℃复温30min,弃去一抗,PBS洗8min×4次。
8)滴加二抗,于湿盒中37℃孵育60min,弃去二抗,PBS浸洗5min×4次。
9)SlowFade Gold antifade reagent with DAPI(S36939,Invitrogen)封片。
10)荧光镜下观察,拍照。若需保存,于暗湿盒中4℃保存。
荧光统计方法:PCNA免疫荧光染色统计采用IPP软件计数,PCNA阳性细胞百分比=PCNA阳性细胞个数/(内膜+中膜)的总DAPI个数*100%;CyclinD1免疫荧光染色统计采用IPP软件直接测阳性吸光度。
免疫荧光法观察平滑肌细胞增殖标志物PCNA、CyclinD1在WT和IRF6-KO小鼠血管损伤后的表达变化,结果见图2。PCNA、CyclinD1在血管组织中有表达,IRF6-KO小鼠在术后14、28天PCNA的阳性细胞个数及CyclinD1的荧光强度均要降低于同组的WT小鼠,表明IRF6基因敲除可以抑制PCNA、CyclinD1的表达,可抑制平滑肌细胞的增殖和血管内膜新生。
【实施例4】平滑肌细胞表型的检测
免疫荧光染色检测平滑肌细胞分化标志物:平滑肌细胞分化特异性抗原(smoothelin)、平滑肌肌动蛋白(Smooth Muscle Actin,SMA)、平滑肌22α(smooth muscle 22alpha,SM22α)的表达。所需一抗信息:SMA(ab5694;1:100;rabbit;Abcam)and SM22α(ab14106;1:100;rabbit;Abcam);所需二抗信息:Alexa Fluor 488-conjugated goat anti-rabbit IgG(A11008;Invitrogen,Carlsbad,CA)。
主要步骤参照实施例3。
荧光统计方法:采用IPP软件直接测阳性吸光度。
在正常生理状态下,血管平滑肌细胞处于静止状态,主要表现为收缩型;血管损伤后,血管平滑肌细胞由中膜向内膜迁移,平滑肌细胞的增殖凋亡失平衡,表型由收缩型向合成型转变,血管壁不适重塑,从而引起内膜增生。免疫荧光观察smoothelin、SMA、SM22α在WT和IRF6-KO小鼠血管损伤后的表达变化,结果见图3。smoothelin、SMA、SM22α在血管组织中有表达,IRF6-KO小鼠在术后14、28天smoothelin、SMA、SM22α的荧光强度均要高于同组的WT小鼠,表明IRF6基因敲除可以促进smoothelin、SMA、SM22α的表达,可抑制平滑肌细胞由收缩型向合成型的表型转换,从而抑制内膜增生。
以上实施例结果显示,野生型小鼠和IRF6-KO小鼠在血管损伤模型(VI)的诱导下均发生血管损伤后再狭窄。IRF6基因敲除小鼠的内膜新生、细胞增殖水平以及平滑肌细胞表型转换均比野生型小鼠不明显。这些结果表明,IRF6可以加重血管损伤诱导的平滑肌细胞的增殖、表型转化和血管新生内膜形成。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 干扰素调节因子8(irf8)在脑卒中疾病中的应用的制作方法
- 通过抑制干扰素相关发育调节因子1(ifrd1)的天然反义转录物而治疗ifrd1相关疾病的制作方法
- 通过抑制干扰素调节因子8(irf8)的天然反义转录物而治疗irf8相关疾病的制作方法
- 干扰素调节因子4基因在治疗动脉粥样硬化中的应用的制作方法
- 干扰素调节因子1基因在治疗动脉粥样硬化中的应用的制作方法
- 重组人干扰素调节因子4结合蛋白表达体系及制备方法与应用的制作方法
- 干扰素调节因子9(irf9)及其抑制剂在冠状动脉粥样硬化性心脏病中的应用的制作方法
- 分析活检样品中干扰素调节因子-1特异性核糖核酸以诊断癌症,癌变前状态的方法
- 在致瘤性诊断中的干扰素调节因子1和2的制作方法
- 一种新的多肽——干扰素调节因子10.34和编码这种多肽的多核苷酸的制作方法
- 肾外髓质钾通道的抑制剂的制作方法与工艺
- 一种抑制植物细胞组织在培养中褐化的方法与流程
- 干扰素调节因子5及其抑制剂在脑卒中疾病中的应用的制作方法与工艺
- 干扰素调节因子6(IRF6)及其抑制剂在治疗心肌肥厚中的应用的制作方法与工艺
- 人喉组织中水通道的表达定位方法与流程
- 补体因子H抑制剂及与之相关的用途的制作方法与工艺
- 干扰素调节因子5(IRF5)及其抑制剂在治疗心肌肥厚中的应用的制作方法与工艺
- 作为因子XIA抑制剂的环状P1连接体的制作方法与工艺
- 作为补体因子B抑制剂用于治疗眼科疾病的2‑(1H‑吲哚‑4‑基甲基)‑3H‑咪唑并[4,5‑B]吡啶‑6‑甲腈衍生物的制作方法与工艺
- 能够结合组织因子途径抑制剂(1‑161)上的两个表位的抗体的制作方法与工艺
- 干扰素调节因子5(IRF5)及其抑制剂在治疗心肌肥厚中的应用的制作方法与工艺
- 作为因子XIA抑制剂的环状P1连接体的制作方法与工艺
- 能够结合组织因子途径抑制剂(1‑161)上的两个表位的抗体的制作方法与工艺
- 针对组织因子途径抑制剂(TFPI)的优化的单克隆抗体的制作方法与工艺
- 一种作为自分泌运动因子抑制剂的咔唑类化合物及其制备方法和应用与流程
- 外周血单核细胞活化抑制剂在制备治疗急性肝衰竭的药物中的用途的制造方法与工艺
- 对NEDD8活化酶(NAE)抑制剂的反应的生物标记的制造方法与工艺
- 一种肺癌调节因子SRSF5及其抑制剂与应用的制造方法与工艺
- 自分泌运动因子抑制剂的制造方法与工艺
- 一种BCL‑2抑制剂Venetoclax的合成方法与流程