一种具有肿瘤靶向性的叶酸‑壳聚糖‑Cy7聚合物及其制备方法与流程
本发明属于生物医药技术领域,涉及一种叶酸-壳聚糖-cy7聚合物(cf7)及其制备方法及用途,还涉及由该聚合物形成的纳米粒及其制备方法和用途。
背景技术:
癌症是当今威胁人类健康的主要原因之一。传统的药物化疗会给正常细胞和组织带来损害,成为肿瘤治疗的最大难关。由于肿瘤组织和正常组织间在病理及生理特征方面存在着显著的不同,肿瘤部位血管渗透性增强,大分子药物、纳米载体等很容易穿透血管内皮细胞进入肿瘤组织,又由于清除障碍,可长时间、高浓度蓄积在肿瘤部位,这种作用称为渗透和滞留增强(epr)效应(ghaz-jahanian,m.a.;abbaspour-aghdam,f.;anarjan,n.;berenjian,a.;jafarizadeh-malmiri,h.,applicationofchitosan-basednanocarriersintumor-targeteddrugdelivery.molecularbiotechnology2015,57,(3),201-218.)。另外一方面,肿瘤组织细胞膜上存在多种特异性受体,如叶酸受体。肿瘤细胞的靶向治疗是利用肿瘤细胞表面的特异性抗原和受体作为靶点的治疗方法。大部分肿瘤细胞表面高表达叶酸受体(fr),而正常细胞表面低表达叶酸受体。我们可以利用叶酸偶联抗癌药物从而达到主动靶向肿瘤细胞的目的。
近红外(nir)荧光染料由于具有了良好的组织渗透性,吸收的近红外光在生物组织中的穿透深度较大,而激发的荧光受生物组织本身的影响较小,所以可检测到深层组织的荧光信号。该类染料作为非侵入性的分子影像试剂在癌症的早期检测中具有良好的应用前景。其中最具代表性的为近红外菁染料。七甲川花菁染料(heptamethinecyanine,cy7)是其中一种性能优良的荧光标记染料,摩尔吸光系数在荧光染料中是最高的,已广泛用于蛋白、抗体、核酸及其他生物分子的标记和检测(xiao,l.;zhang,y.;berr,s.s.;chordia,m.d.;pramoonjago,p.;pu,l.;pan,d.,anovelnear-infraredfluorescenceimagingprobeforinvivoneutrophiltracking.molecularimaging2012,11,(5),372-82.)。光动力疗法(photodynamictherapy,pdt)是利用光动力效应进行疾病诊断和治疗的一种新技术。其作用基础是光动力效应。其过程是,特定波长的激光照射使组织吸收的光敏剂受到激发,而激发态的光敏剂又把能量传递给周围的氧,生成活性很强的单态氧,单态氧和相邻的生物大分子发生氧化反应,产生细胞毒性作用,进而导致细胞受损乃至死亡。目前已有许多研究将cy7作为光敏剂用于光动力治疗。所以我们选择cy7用作近红外荧光成像和光动力治疗。
壳聚糖(化学名:β-(1→4)-2-氨基-2-脱氧-d-葡萄糖)是由自然界广泛存在的几丁质(chitin)经过脱乙酰作用得到的。壳聚糖具有很好的生物相容性,生物降解性及低毒性等特点。其结构中既有氨基又有羟基,易于化学修饰,是一种具有广泛应用前景的新型药物载体。此外壳聚糖还广泛应用于生物医药领域,如组织工程、伤口愈合、生物成像和药物输送等。但是由于壳聚糖溶解度差,所以要对其进行化学修饰。因此目前大多数文献均在其2位上引入官能团,增加其溶解度。
2001年诺贝尔化学奖获得者sharpless提出“click”化学反应。其代表反应为将末端带有炔基和叠氮基团的单体反应形成带有三唑环结构的化合物。该反应快速、高效且具有高选择性,已被广泛应用于合成各种材料。
基于以上背景,本发明设计了一种聚合物,该聚合物由叠氮化的壳聚糖衍生物与炔基化的叶酸(alk-fa)以及炔基化的cy7(alk-cy7)通过click化学反应偶联,并可通过自组装形成纳米粒。通过连接fa和cy7,使其不仅具有高效地识别靶肿瘤细胞的能力,并能用于近红外荧光成像和光动力治疗。
技术实现要素:
基于以上研究背景,本发明人利用“click”反应将alk-fa和alk-cy7与6-叠氮-6-脱氧-n-邻苯二甲酰亚胺基-壳聚糖反应,合成叶酸-壳聚糖-cy7聚合物(cf7)。本发明的聚合物cf7能自组装形成纳米粒,可用做肿瘤的纳米诊疗剂,其骨架上偶联的叶酸分子可靶向识别叶酸受体高表达的肿瘤细胞,cy7分子可用于近红外荧光成像和光动力治疗。
因此本发明的目的是为了提供一种聚合物cf7及其制备方法。本发明的另一目的在于提供该聚合物形成的纳米粒及其制备方法和用途。
本发明提供了一种聚合物cf7,其结构式为:
其中n为壳聚糖衍生物重复单元的个数。
本发明的聚合物cf7可以通过以下方法制备,反应式如下:
其中n为壳聚糖衍生物重复单元的个数。
反应式中,1为壳聚糖;2为n-邻苯二甲亚胺基壳聚糖;3为6-溴-6-脱氧-n-邻苯二甲酰亚胺基-壳聚糖;4为6-叠氮-6-脱氧-n-邻苯二甲酰亚胺基-壳聚糖;5为聚合物cf7。
本发明的cf7的合成方法,包括以下步骤:
步骤a:称取壳聚糖1,与邻苯二甲酸酐反应取代氨基,得到n-邻苯二甲亚胺基壳聚糖2;
步骤b:将产物2上的6位羟基进行溴取代反应,得到产物6-溴-6-脱氧-n-邻苯二甲酰亚胺基-壳聚糖3;
步骤c:将产物3上的6位溴进行叠氮基取代反应,得到6-叠氮-6-脱氧-n-邻苯二甲酰亚胺基-壳聚糖4;
步骤d:将产物4与alk-fa和alk-cy7在无水硫酸铜和维生素c钠盐的催化作用下进行click反应,得到产物5;其中alk-fa是由叶酸和丙炔胺反应得到(guo,z.;zhang,p.;song,m.;wu,x.;liu,c.;zhao,z.;lu,j.;zhang,x.,synthesisandpreliminaryevaluationofnoveltc-99m-labeledfolatederivativeviaclickreactionforspectimaging.appliedradiationandisotopes2014,91,24-30),alk-cy7是由苯肼和3-甲基-2-丁酮经过一系列反应得到(yang,z.;lee,j.h.;jeon,h.m.;han,j.h.;park,n.;he,y.;lee,h.;hong,k.s.;kang,c.;kim,j.s.,folate-basednear-infraredfluorescenttheranosticgemcitabinedelivery.jamchemsoc2013,135,(31),11657-11662)。
本发明中用到的壳聚糖1(cs)的重均分子量为10-1000千道尔顿。
本发明的聚合物cf7具体的反应步骤如下:
步骤a:称取壳聚糖1,溶于无水dmf,加入邻苯二甲酸酐,氮气保护,120℃油浴搅拌加热。反应结束时,将反应液倒入冰水中,析出黄白色沉淀。抽滤,固体用乙醚、丙酮洗涤,干燥,得到n-邻苯二甲亚胺基壳聚糖2;
步骤b:称取产物2,溶于n-甲基吡咯烷酮(nmp),加入n-溴代丁二酰亚胺(nbs)和三苯基膦(tpp)。氮气保护下,80℃反应两个小时。反应结束后,将反应液倒入乙醇中,析出固体。离心,收集产物,并用乙醇、丙酮各清洗三遍并干燥,得到棕红色固体3;
步骤c:称取3,将其溶于n-甲基吡咯烷酮。加入叠氮化钠(nan3),氮气保护,80℃反应4小时。反应结束后,将反应液倒入乙醇中,析出固体。离心,收集产物,产物先后用乙醇、二次水、丙酮各洗涤三遍。干燥得到棕色固体4;
步骤d:将产物4溶于二甲基亚砜(dmso),然后加入alk-fa和alk-cy7,氮气保护,然后将无水硫酸铜和维生素c钠盐溶于水,慢慢滴加入烧杯。80℃反应72个小时。反应结束后,将反应液加到透析袋中,用纯水透析72h,冻干,得到产物5(cf7);其中alk-fa是由叶酸和丙炔胺反应得到,alk-cy7是由苯肼和3-甲基-2-丁酮经过一系列反应得到。
本发明中所述聚合物cf7的分子量为100-1000千道尔顿。
步骤d中,产物4和alk-fa和alk-cy7的质量比为:2∶1∶1。透析袋截留分子量为10000~14000。
本发明中所述的该聚合物可以形成纳米粒及其制备方法。该方法为将聚合物cf7溶于二甲基亚砜中,然后用注射器将其慢慢滴加入装有纯水的烧杯中,搅拌混合,室温静置。该聚合物通过自组装形成纳米粒。具体步骤为:将本发明中所述的聚合物用二甲基亚砜配成0.1~1毫克/毫升溶液,然后用注射器吸取1毫升,将其慢慢滴加入装有20~50毫升纯水的烧杯中,搅拌,室温静置0.5~1小时,聚合物通过自组装形成纳米粒。
本发明的聚合物cf7用于肿瘤细胞的近红外荧光成像和光动力治疗。
本发明的作用原理为:1,改善壳聚糖的溶解度;2,将cy7靶向输送到癌细胞,并用于近红外荧光成像和光动力治疗。
本发明的有益效果在于:
1,本发明的聚合物通过自组装形成的纳米粒,粒径小于300纳米,可以通过静脉给药,靶向输送到肿瘤部位。
2,本发明的聚合物及其形成的纳米粒,即克服了壳聚糖溶解度差的缺陷,同时利用纳米载体表面的叶酸与肿瘤细胞表面叶酸受体的主动靶向作用选择性地浓集于肿瘤细胞,而且还可利用纳米粒中的cy7分子进行肿瘤细胞的近红外荧光成像和光动力治疗。
附图说明
图1实施例1,实施例2制备的cs-n3,c7和cf7的红外图谱。
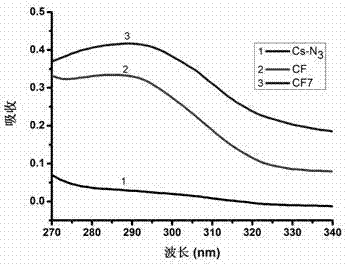
图2实施例1,实施例3制备的cs-n3,cf7和cf的紫外图谱。
图3实施例1,实施例2制备的cs-n3,cf7和c7的荧光图谱。
图4实施例4,实施例5制备的纳米粒cf7ns和c7ns的共聚焦成像图。
图5实施例4,实施例5制备的纳米粒cf7ns和c7ns的体外细胞毒性。
具体实施方式
下面,将通过实施例,对本发明进行进一步说明,但发明并不局限于这些实施例,在本发明权利要求所阐明的范围内,可进行各种改变或等同替换。
壳聚糖1购于上海伯奥生物科技有限公司,分子量为60千道尔顿,脱乙酰度为90%。
实施例1
聚合物cf7的合成:
步骤a:称取800mg壳聚糖溶于60ml无水dmf中,随后加入1.6g邻苯二甲酸酐,氮气保护,120℃油浴搅拌加热。当反应液变澄清时,终止反应。将反应液倒入适量冰水中,析出白色沉淀。抽滤,固体用乙醚、丙酮分别洗涤3次,除去多余的邻苯二甲酸酐,干燥得产物2。
步骤b:称取100mg产物2,加入10mln-甲基吡咯烷酮(nmp),加热搅拌溶解。当溶液冷却后置于冰水中,加入616mgn-溴代丁二酰亚胺(nbs),902mg三苯基膦(tpp)。氮气保护下80℃反应两个小时。反应结束后,将混合物倒入100ml乙醇中,析出固体。通过离心(5000r/min),收集产物,并用乙醇、丙酮各清洗三遍。干燥后得到棕色固体3。
步骤c:称取50mg产物3溶于5mln-甲基吡咯烷酮,加入50mg叠氮化钠(nan3),氮气保护,80℃下搅拌加热4小时。反应结束后,将反应液倒在50ml乙醇中,析出固体。通过离心(8000r/min)收集产物,产物先后用乙醇、二次水、丙酮各洗涤三遍。干燥后得到棕色固体4(cs-n3)。通过红外谱图分析,产物3上6位溴被叠氮基取代。通过红外谱图分析,如图1所示,产物4(cs-n3)在2100cm-1有红外吸收峰,表明叠氮基已经成功取代6位溴。
步骤d:称取20mg产物4,溶于5ml二甲亚砜,加入10mgalk-fa,10mgalk-cy7。烧瓶用橡胶塞密封,抽真空后,用氮气保护。用1ml注射器往烧瓶先滴加2.5mg五水硫酸铜(溶于100μl二次水中),后滴加2mg抗坏血酸钠(溶于100μl二次水中)。反应物在50℃下,避光反应72h。反应结束后将反应液用规格为14000的透析袋透析72h。透析后,将透析袋中的固体冻干。通过红外谱图分析,产物4中6位叠氮基与alk-fa和alk-cy7中的炔基反应,生成三唑环。通过红外谱图分析,如图1所示,cf7在2100cm-1没有红外吸收峰,表明叠氮基已经成功与炔基反应生成三唑环。而且在1531cm-1、1638cm-1有两个吸收峰,表明叶酸成功的连接到壳聚糖骨架上。将产物溶于二甲基亚砜测紫外吸收,如图2所示,cf7在280nm处有紫外吸收,表明叶酸已成功连接到壳聚糖骨架上。将产物溶于二甲基亚砜,激发波长633nm,测其荧光强度。如图3所示,cf7在801nm处有alk-cy7的特征峰,表明alk-cy7也已成功连接到壳聚糖骨架上。
实施例2
壳聚糖-cy7聚合物(c7)的合成:
称取10mg实施例1的产物4,溶于5ml二甲亚砜,加入10mgalk-cy7。烧瓶用橡胶塞密封,抽真空后,用氮气保护。用1ml注射器往烧瓶先滴加2.5mg五水硫酸铜(溶于100μl二次水中),后滴加2mg抗坏血酸钠(溶于100μl二次水中)。反应物在50℃下,避光反应72h。反应结束后将反应液用规格为14000的透析袋透析72h。透析后,将产物冻干。通过红外谱图分析,产物4中6位叠氮基与alk-cy7中的炔基反应,生成三唑环。如图1所示,壳聚糖-cy7聚合物(c7)在2100cm-1没有红外吸收峰,表明叠氮基已经成功与alk-cy7中的炔基反应生成三唑环。将产物溶于二甲基亚砜,激发波长633nm,测其荧光光谱。如图3所示,cf7在801nm处有alk-cy7的特征峰,表明alk-cy7也已成功连接到壳聚糖骨架上。
实施例3
壳聚糖-fa聚合物(cf)的合成:
称取10mg实施例1的产物4,溶于5ml二甲亚砜,加入10mgalk-fa。烧瓶用橡胶塞密封,抽真空后,用氮气保护。用1ml注射器往烧瓶先滴加2.5mg五水硫酸铜(溶于100μl二次水中),后滴加2mg抗坏血酸钠(溶于100μl二次水中)。反应物在50℃下,避光反应72h。反应结束后将反应液用规格为14000的透析袋透析72h。透析后,将产物冻干。通过红外谱图分析,产物4中6位叠氮基与alk-fa中的炔基反应,生成三唑环。如图1所示,壳聚糖-fa聚合物(cf)在2100cm-1没有红外吸收峰,表明叠氮基已经成功与alk-fa中的炔基反应生成三唑环。而且在1531cm-1、1638cm-1有两个吸收峰,这表明alk-fa成功的连接到壳聚糖骨架上。将产物溶于二甲基亚砜测紫外吸收,如图2所示,cf7在280nm处有紫外吸收,表明alk-fa已成功连接到壳聚糖骨架上。
实施例4
聚合物cf7用于药物纳米粒的制备方法:
将实施例1制得的cf7溶于二甲基亚砜中,然后用注射器将其慢慢滴加入装有纯水的烧杯中,搅拌混合,室温静置。该聚合物通过自组装形成纳米粒。具体步骤为:将cf7用二甲基亚砜配成0.1~1毫克/毫升溶液,然后用注射器吸取1毫升,将其慢慢滴加入装有20~50毫升纯水的烧杯中,搅拌,室温静置0.5~1小时,聚合物通过自组装形成纳米粒(cf7ns)。
实施例5
壳聚糖-cy7聚合物(c7)用于药物纳米粒的制备方法:
将c7溶于二甲基亚砜中,然后用注射器将其慢慢滴加入装有纯水的烧杯中,搅拌混合,室温静置。该聚合物通过自组装形成纳米粒。具体步骤为:将c7用二甲基亚砜配成0.1~1毫克/毫升溶液,然后用注射器吸取1毫升,将其慢慢滴加入装有20~50毫升纯水的烧杯中,搅拌,室温静置0.5~1小时,聚合物通过自组装形成纳米粒(c7ns)。
实施例6
以人宫颈癌细胞系hela细胞(叶酸受体过表达细胞)和人肝癌细胞系hepg2细胞(叶酸受体低表达)为测试细胞系(细胞购自中国科学院上海生命科学研究所细胞资源中心)。
细胞培养方法:从液氮罐中取出hela细胞保种管,在37℃水浴锅中快速溶化解冻,然后1000rpm离心5min,吸弃上清液,取1mldmem完全培养液将细胞沉淀吹打均匀,转移至培养瓶中使得瓶中培养基为4ml,置于37℃,5%(v/v)co2培养箱中培养。取出液氮中冻存的hepg2细胞,在37℃的水中解冻,将细胞悬液移入1.5ml离心管中,1000rpm离心5min,弃去上清液,加入1mlrpmi1640完全培养液,轻轻吹打均匀,将细胞悬液转移发到培养瓶中,补加3mlrpmi1640完全培养液,将培养瓶置于5%(v/v)co2、37℃培养箱中培养。
共聚焦成像实验:将hela细胞与hepg2细胞消化后铺到24孔板中,过夜,细胞完全贴壁后,pbs洗涤2遍,分别与20µg/ml实施例4和实施例5的cf7ns和c7ns在37℃下孵育4h。然后用pbs洗涤2遍,用4wt%多聚甲醛孵育固定10min,pbs洗涤2遍,然后加入dapi,室温避光孵育10min,然后pbs洗涤2遍。激光共聚焦成像。
纳米粒共聚焦成像结果如图4所示。从图4中可以看出,在hela细胞中,cf7ns的荧光强度比c7ns强,而在hepg2细胞中,cf7ns的荧光强度和c7ns效果相当,表明叶酸的修饰可增加叶酸受体过表达肿瘤细胞株对纳米药物的摄取。而且cf7ns可以靶向输送到叶酸受体高表达的细胞株成像,为肿瘤治疗提供有效的手段。
实施例7
以人宫颈癌细胞系hela细胞(叶酸受体过表达细胞)和人肝癌细胞系hepg2细胞(叶酸受体低表达)为测试细胞系(细胞购自中国科学院上海生命科学研究所细胞资源中心)。
细胞培养方法:从液氮罐中取出hela细胞保种管,在37℃水浴锅中快速溶化解冻,然后1000rpm离心5min,吸弃上清液,取1mldmem完全培养液将细胞沉淀吹打均匀,转移至培养瓶中使得瓶中培养基为4ml,置于37℃,5%(v/v)co2培养箱中培养。取出液氮中冻存的hepg2细胞,在37℃的水中解冻,将细胞悬液移入1.5ml离心管中,1000rpm离心5min,弃去上清液,加入1mlrpmi1640完全培养液,轻轻吹打均匀,将细胞悬液转移发到培养瓶中,补加3mlrpmi1640完全培养液,将培养瓶置于5%(v/v)co2、37℃培养箱中培养。
细胞毒性实验:选取对数期生长且状态良好的hela或hepg2细胞经胰蛋白酶消化后,使得细胞浓度为0.5-1×105个/ml,配制成细胞悬液。按每孔100µl细胞悬液的量接种到96孔板,培养24h后,分别加入实施例1中的40μg/mlcs-n3,40μg/ml的实施例4和实施例5的cf7ns和cfns,另设溶剂对照组和空白对照组,,为了考察光动力治疗效果,本发明将加入cf7ns和cfns的实验组分为四组,有两组用红外光照射(nir),另外两组不用红外光照射。孵育24h后,吸弃旧培养基,pbs洗3遍,并于每孔中加入90µl无血清、无酚红的1640培养基和10µlmtt溶液,继续孵育4h后,小心吸弃上清液,于每孔中加入150µl二甲基亚砜,避光振荡10min,使蓝紫色结晶全部溶解,用多功能酶标仪于570nm波长处测定各孔的吸收度,并按下式计算细胞的存活率。存活率(%)=(实验组吸收值-溶剂对照组吸收值)/(空白组吸收值-溶剂对照组吸收值)。
纳米粒的细胞毒性结果如图5所示。从图5中可以看出,cs-n3对两种细胞毒性较小,cf7ns和c7ns均可以在不同程度上杀死细胞。在hela细胞中,cf7ns的毒性比c7ns强,当细胞暴露在红外灯下时,cf7ns+nir(红外光照射)的毒性比cf7ns的毒性强,c7ns+nir的毒性也比c7ns的毒性强;而在hepg2细胞中,c7ns与cf7ns毒性相当,cf7ns+nir的毒性和c7ns+nir相当。这表明叶酸的修饰可增加纳米药物对叶酸受体过表达肿瘤细胞的毒性,从而提高抗肿瘤选择性。同时也表明光动力治疗会增强抗肿瘤效果。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!