使用6-硫代-dG、检查点抑制剂和放射治疗的顺序癌症治疗
使用6-硫代-dg、检查点抑制剂和放射治疗的顺序癌症治疗
1.优先权要求
2.本技术要求2020年3月13日提交的美国临时申请序列号62/989,041的优先权权益,其全部内容在此通过引用并入。
3.联邦资助支持声明
4.本发明是在由美国国家癌症研究所(national cancer institute)授予的基金号2p50ca070907-21a1的政府支持下完成的。政府对本发明享有一定的权利。
技术领域
5.本公开内容涉及医学、药理学、分子生物学和肿瘤学领域。更具体地,本公开内容涉及使用6-硫代-dg、检查点抑制剂和/或放射治疗的顺序治疗来治疗癌症的方法和组合物。
背景技术:
6.免疫治疗彻底改变了免疫肿瘤学领域中许多癌症的治疗(brahmer et al.,2012;hodi et al.,2010;ribas and wolchok,2018;topalian et al.,2012)。最常用的免疫治疗是pd-l1/pd-1检查点阻断,其已被fda批准用于晚期癌症,例如黑素瘤、非小细胞肺癌、乳腺癌、宫颈癌、结肠癌、头颈癌、霍奇金淋巴瘤(hodgkin lymphoma)、肝癌、肺癌、肾细胞癌、胃癌、直肠癌和任何不能修复其dna在复制期间发生的错误的实体瘤(garon et al.,2015;ribas et al.,2016;rizvi et al.,2015b;socinski et al.,2018;national cancer institute)。尽管免疫治疗取得了成功,但由于免疫抑制性肿瘤微环境、肿瘤免疫原性以及原发性和适应性抗性的出现,许多患者对这些治疗的响应不佳(chen and han,2015;gide et al.,2018)。尽管最近的研究表明,大量的肿瘤突变和新抗原部分决定了癌症患者对检查点阻断的响应,但仍有相当数量的具有高突变和新抗原的患者响应不佳(le et al.,2017;mandal et al.,2019;rizvi et al.,2015a),表明新抗原不足以引发抗肿瘤免疫应答。因此,迫切需要鉴定其他因子以用于更好的免疫应答,并开发新的方法来提高患者的总存活。
7.有效的抗肿瘤适应性免疫应答的产生需要通过抗原呈递细胞来呈递肿瘤抗原,抗原呈递细胞的活化很大程度上依赖于足够的固有感知。固有感知通常由危险信号例如高迁移率族框1蛋白、胞外atp和从应激肿瘤细胞释放的肿瘤dna提供(kroemer et al.,2013;pitt et al.,2017)。最近的研究强调了胞质dna感知在放射和dna损伤治疗中的重要性(deng et al.,2014;sen et al.,2019)。细胞质中dna的存在,例如,以失去核包膜的微核(含有dna的小细胞器)的形式,可以触发免疫应答。微核是在细胞分裂期间由于基因毒性应激和染色体错误分离导致的染色体损伤的产物(fenech et al.,2011)。胞质dna感知器cgas识别微核并将gtp(三磷酸鸟苷)和atp(三磷酸腺苷)转化成第二信使cgamp(环状gmp-amp)(wu et al.,2013)。然后,接头蛋白,ifn基因刺激因子(stimulator of ifn gene,sting),与cgamp结合(ablasser et al.,2013;diner et al.,2013;gao et al.,2013;
936558、shr1210、ibi308、pdr001、bgb-a317、bcd-100、js001和amp-515中的一种或更多种。
13.在一些实施方案中,pd-l1抑制剂选自阿特珠单抗、阿维鲁单抗、柯希利单抗(cosibelimab)、bintrafusp alfa、德瓦鲁单抗(durvalumab)、mgd013、kno35、kn046、aunp12、ca-170和bms-9986189中的一种或更多种。
14.在一些实施方案中,ctla-4抑制剂选自伊匹单抗(ipilimumab)和曲美木单抗(tremelimumab)中的一种或更多种。
15.在本文中公开的方法的一些实施方案中,每个治疗周期施用6-硫代-dg约1至约5天。在一些实施方案中,每个治疗周期施用检查点抑制剂约1至约3天。
16.本文中使用的术语治疗周期意指施用治疗之间的约1至约12周。
17.在本文中公开的方法的一个实施方案中,6-硫代-dg和检查点抑制剂与化学治疗剂、激素治疗、毒素治疗或手术组合施用。
18.在另一个实施方案中,本文中公开了在需要治疗的对象中治疗癌症的方法,其包括向所述对象施用6-硫代-dg并随后用西米普利单抗进行治疗,其中所述癌症选自以下中的一种或更多种:胰腺癌、肺癌、间皮瘤、胃癌、食管癌、肝癌、胆道癌、膀胱癌、头颈癌、口腔癌、鼻咽癌、成人脑癌、结肠癌、直肠癌、结直肠癌、前列腺癌、卵巢癌、宫颈癌、子宫癌、睾丸癌、淋巴瘤、白血病、皮肤癌、乳腺癌、肾癌、神经母细胞瘤、默克尔细胞癌、骨髓增生异常综合征、骨髓纤维化和多发性骨髓瘤。在所述方法的一些实施方案中,每个治疗周期施用6-硫代-dg约1至约5天。在所述方法的一些实施方案中,每个治疗周期施用西米普利单抗约1至约3天。在所述方法的一个实施方案中,6-硫代-dg和西米普利单抗与化学治疗剂、激素治疗、毒素治疗或手术组合施用。
19.在一个实施方案中,本文中公开了在对象中治疗癌症的方法,其包括向所述对象施用6-硫代-dg并随后用阿特珠单抗进行治疗,其中所述癌症选自以下中的一种或更多种:胰腺癌、肺癌、间皮瘤、胃癌、食管癌、肝癌、胆道癌、膀胱癌、头颈癌、口腔癌、鼻咽癌、成人脑癌、结肠癌、直肠癌、结直肠癌、前列腺癌、卵巢癌、宫颈癌、子宫癌、睾丸癌、淋巴瘤、白血病、皮肤癌、乳腺癌、肾癌、神经母细胞瘤、默克尔细胞癌、骨髓增生异常综合征、骨髓纤维化和多发性骨髓瘤。在所述方法的一些实施方案中,每个治疗周期施用6-硫代-dg约1至约5天。在所述方法的一些实施方案中,每个治疗周期施用阿特珠单抗约1至约3天。在所述方法的一个实施方案中,6-硫代-dg和阿特珠单抗与化学治疗剂、激素治疗、毒素治疗或手术组合施用。
20.在本公开内容的另一个方面中,本文中公开了在对象中治疗癌症的方法,其包括向所述对象施用6-硫代-dg并随后用与放射治疗组合施用的免疫检查点抑制剂进行治疗。在一些实施方案中,检查点抑制剂是pd-l1、pd-1或ctal-4抑制剂。在一些实施方案中,pd-l1抑制剂选自阿特珠单抗、阿维鲁单抗、柯希利单抗、bintrafusp alfa、德瓦鲁单抗、mgd013、kno35、kn046、aunp12、ca-170和bms-9986189中的一种或更多种。在一些实施方案中,pd-l1抑制剂是阿特珠单抗。在一些实施方案中,pd-1抑制剂选自派姆单抗、纳武单抗、西米普利单抗、jtx-4014、萨善利单抗、布格利单抗、bi 754091、斯巴达珠单抗、卡瑞利珠单抗、信迪利单抗、替雷利珠单抗、赛帕利单抗、特瑞普利单抗、多塔利单抗、incmga00012、amp-224、regn2810、bms-936558、shr1210、ibi308、pdr001、bgb-a317、bcd-100、js001和amp-515中的一种或更多种。在一些实施方案中,pd-1抑制剂是西米普利单抗。在一些实施
方案中,ctla-4抑制剂是伊匹单抗或曲美木单抗。在一些实施方案中,所治疗的癌症选自以下中的一种或更多种:胰腺癌、肺癌、间皮瘤、胃癌、食管癌、肝癌、胆道癌、膀胱癌、头颈癌、口腔癌、鼻咽癌、成人脑癌、结肠癌、直肠癌、结直肠癌、前列腺癌、卵巢癌、宫颈癌、子宫癌、睾丸癌、淋巴瘤、白血病、皮肤癌、乳腺癌、肾癌、神经母细胞瘤、默克尔细胞癌、骨髓增生异常综合征、骨髓纤维化和多发性骨髓瘤。在一些实施方案中,所治疗的癌症是胰腺癌、肺癌、胃癌、肝癌、膀胱癌、头颈癌、口腔癌、鼻咽癌、脑癌、结肠癌、前列腺癌、卵巢癌、宫颈癌、睾丸癌、淋巴瘤、白血病、皮肤癌或乳腺癌。在一些实施方案中,脑癌是成人脑癌。在一些实施方案中,首先施用放射治疗,随后是一种或更多种检查点抑制剂。在一些实施方案中,在施用一种或更多种检查点抑制剂之后施用放射治疗。
21.在所公开方法的一些实施方案中,所治疗的癌症是肺癌、结直肠癌、肝癌、黑素瘤、胰腺癌、卵巢癌或脑癌(成人)。
22.在所公开方法的一些实施方案中,所治疗的癌症是胰腺癌、肺癌、胃癌、肝癌、膀胱癌、头颈癌、口腔癌、鼻咽癌、脑癌、结肠癌、前列腺癌、卵巢癌、宫颈癌、睾丸癌、淋巴瘤、白血病、皮肤癌或乳腺癌。
23.在所公开方法的另一些实施方案中,在约1至5天的治疗期间施用的6-硫代-dg的总剂量为每个治疗周期约10至2000mg或约15至2000mg或约20至2000mg或约10至4800mg。
24.在所公开方法的一个实施方案中,所治疗的癌症是转移性的。
25.在所公开方法的一些实施方案中,所治疗的癌症是复发性的或再现性的。
26.在所公开方法的一些实施方案中,所治疗的癌症具有治疗抗性。在一个实施方案中,治疗抗性癌症具有检查点抑制剂治疗抗性。在另一个实施方案中,治疗抗性癌症对pd-1抑制剂、pd-l1抑制剂和/或ctla-4抑制剂中的一种或更多种具有抗性。在一些实施方案中,癌症对酪氨酸激酶抑制剂(例如但不限于厄洛替尼(erlotinib))具有抗性。
27.在本文中公开的方法的一些实施方案中,所治疗的对象先前用检查点抑制剂治疗进行了治疗。在一个实施方案中,对象先前用pd-1、pd-l1或ctla-4中的一种或更多种进行了治疗。在另一个实施方案中,对象先前用酪氨酸激酶抑制剂治疗进行了治疗。
28.在本文中公开的方法的一些实施方案中,重复以下至少一次:施用6-硫代-dg并随后用检查点抑制剂进行治疗。
29.在本文中公开的方法的一些实施方案中,6-硫代-dg和检查点抑制剂全身施用。在另一些实施方案中,6-硫代-dg和检查点抑制剂局部或区域性地施用于肿瘤部位。在一个实施方案中,6-硫代-dg局部或区域性地施用于肿瘤部位并且检查点抑制剂全身施用。
30.在本文中公开的方法的一些实施方案中,施用6-硫代-dg和检查点抑制剂导致抑制肿瘤生长。
31.在本文中公开的方法的一些实施方案中,施用6-硫代-dg和检查点抑制剂导致缓解所治疗的癌症。
32.在本文中公开的方法的一些实施方案中,施用6-硫代-dg和一种或更多种检查点抑制剂导致降低肿瘤负荷。
33.在本文中公开的方法的一些实施方案中,施用6-硫代-dg和一种或更多种检查点抑制剂导致抑制癌细胞转移。
34.在本文中公开的方法的一些实施方案中,施用6-硫代-dg和一种或更多种检查点
抑制剂导致肿瘤根除。
35.在另一个方面中,本文中公开了在对象中治疗癌症的方法,其包括向所述对象施用治疗有效剂量的6-硫代-dg并随后用放射治疗进行治疗。在一些实施方案中,所述癌症选自胰腺癌、肺癌、间皮瘤、胃癌、食管癌、肝癌、胆道癌、膀胱癌、头颈癌、口腔癌、鼻咽癌、成人脑癌、结肠癌、直肠癌、结直肠癌、前列腺癌、卵巢癌、宫颈癌、子宫癌、睾丸癌、淋巴瘤、白血病、皮肤癌、乳腺癌、肾癌、神经母细胞瘤、默克尔细胞癌、骨髓增生异常综合征、骨髓纤维化和多发性骨髓瘤。在一些实施方案中,所治疗的癌症是胰腺癌、肺癌、胃癌、肝癌、膀胱癌、头颈癌、口腔癌、鼻咽癌、脑癌、结肠癌、前列腺癌、卵巢癌、宫颈癌、睾丸癌、淋巴瘤、白血病、皮肤癌或乳腺癌。在一些实施方案中,脑癌是成人脑癌。
36.在另一个方面中,本文中公开了在对象中治疗癌症的方法,其包括向所述对象施用治疗有效剂量的6-硫代-dg,在此之前先用放射治疗进行治疗。在一些实施方案中,所述癌症选自胰腺癌、肺癌、间皮瘤、胃癌、食管癌、肝癌、胆道癌、膀胱癌、头颈癌、口腔癌、鼻咽癌、脑癌(成人)、结肠癌、直肠癌、结直肠癌、前列腺癌、卵巢癌、宫颈癌、子宫癌、睾丸癌、淋巴瘤、白血病、皮肤癌、乳腺癌、肾癌、神经母细胞瘤、默克尔细胞癌、骨髓增生异常综合征、骨髓纤维化和多发性骨髓瘤。在一些实施方案中,所治疗的癌症是胰腺癌、肺癌、胃癌、肝癌、膀胱癌、头颈癌、口腔癌、鼻咽癌、脑癌、结肠癌、前列腺癌、卵巢癌、宫颈癌、睾丸癌、淋巴瘤、白血病、皮肤癌或乳腺癌。在一些实施方案中,癌症是成人脑癌。
37.在本文中公开的方法的一个实施方案中,6-硫代-dg和放射治疗的施用重复至少一次。
38.癌症可表现出端粒酶活性。6-硫代-dg以及pd-1抑制剂、pd-l1抑制剂和ctla-4抑制剂例如阿特珠单抗、阿维鲁单抗、柯希利单抗、bintrafusp alfa、德瓦鲁单抗、mgd013、kno35、kn046、aunp12、ca-170、bms-9986189派姆单抗、纳武单抗、西米普利单抗、jtx-4014、萨善利单抗、布格利单抗、bi 754091、斯巴达珠单抗、卡瑞利珠单抗、信迪利单抗、替雷利珠单抗、赛帕利单抗、特瑞普利单抗、多塔利单抗、incmga00012、amp-224、regn2810、bms-936558、shr1210、ibi308、pdr001、bgb-a317、bcd-100、js001 amp-515、伊匹单抗和曲美木单抗可与化学治疗剂、放射治疗、激素治疗、毒素治疗或手术组合施用。所施用的6-硫代-dg的日剂量可以为约0.15mg/kg至约70mg/kg。6-硫代-dg施用与pd-l1抑制剂、pd-1抑制剂和/或ctla-4抑制剂施用之间的间隔可以为约1至14天,例如约1至4天、或约2至4天、或约2至5天、或约2至6天、或约2至7天、或约2至8天、或约2至9天、或约2至10天、或约2至11天、或约2至12天或约2至13天。该方法还可包括评估来自所述对象的成人脑癌细胞中端粒酶活性的步骤。6-硫代-dg以及pd-1抑制剂、pd-l1抑制剂和/或ctla-4抑制剂的施用可导致抑制肿瘤生长、缓解所述癌症、降低肿瘤负荷、抑制癌细胞转移或肿瘤根除。
39.癌症可以是胰腺癌、肺癌、胃癌、肝癌、膀胱癌、头颈癌、口腔癌、鼻咽癌、脑癌、结肠癌、前列腺癌、卵巢癌、宫颈癌、睾丸癌、淋巴瘤、白血病或皮肤癌。癌症可以是转移性的和/或复发性的和/或具有治疗抗性。治疗抗性癌症可以具有检查点抑制剂治疗抗性,例如pd-l1、pd-1和/或ctla-4抗性。对象之前可能已经用检查点抑制剂治疗例如pd-l1、pd-1和/或ctla-4治疗进行了治疗。重复以下至少一次:施用6-硫代-dg并随后用pd-1抑制剂、pd-l1抑制剂和/或ctla4抑制剂进行治疗。6-硫代-dg以及pd-1抑制剂、pd-l1抑制剂和/或ctla4抑制剂可以是全身施用的或者局部或区域性施用于肿瘤部位。6-硫代-dg可以与pd-1抑制剂、
pd-l1抑制剂和/或ctla4抑制剂以相同或不同的途径施用。
40.根据以下具体实施方式,本公开内容的其他目的、特征和优点将变得明显。然而,应理解,具体实施方式和具体实例,虽然指出了本公开内容的一些具体实施方案,但仅以举例说明的方式给出,因为通过该具体实施方式,在本公开内容的精神和范围内的多种变化方案和改变方案对于本领域技术人员来说将变得明显。
附图说明
41.以下附图构成本说明书的一部分并且被包括在内以进一步说明本公开内容的某些方面。通过参照这些附图中的一幅或更多幅并结合本文中给出的具体实施方案的详细描述,可以更好地理解本公开内容。
42.图1a至1g。6-硫代-dg的治疗作用依赖于cd8+t细胞。(图1a)6-硫代-dg在mc38细胞中的细胞生存力(ic
50
)。将细胞用6-硫代-dg处理5天。(图1b和图1c)13天中在指定剂量下mc38细胞中6-硫代-dg的集落形成测定。每3天用6-硫代-dg处理细胞,然后固定并用结晶紫染色。三个生物学重复的代表性图像在图1b中示出并且定量数据在图1c中示出。(图1d和图1e)将wt(图1d)或rag1-/-(图1e)c57bl/6小鼠(n=5)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。(图1f和图1g)将c57bl/6小鼠(n=5)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。在处理开始之前一天施用200μg抗-cd4(图1f)或抗-cd8(图1g),并随后每周进行两次,持续3周。每3天测量肿瘤生长。数据示出为来自两至三个独立实验的平均值
±
sem。p值由双尾未配对t检验(图1c)或双因素anova(图1d至1g)确定。另参见图9a至9d。
43.图2a至2f。6-硫代-dg处理提高了肿瘤特异性t细胞响应。(图2a和图2b)将c57bl/6小鼠(n=4至5)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。在最后一次处理之后六天,分析肿瘤浸润性t细胞的总t细胞(图2a)和ki67+cd8+t细胞(图2b)的频率。(图2c)将荷mc38-ova肿瘤的c57bl/6小鼠(n=5)用6-硫代-dg(3mg/kg,第7、8、9天)处理。在最后一次处理之后三天,用h-2k
b-ova
257-264
四聚体分析肿瘤浸润t细胞的ova特异性cd8+t细胞。(图2d和图2e)与(a)中相同的实验方案,收集脾细胞并用经辐照的mc38肿瘤细胞再刺激48小时。通过elispot测定确定产生ifn-γ的细胞。代表性点在图2d中示出和定量数据(n=5)在图2e中示出。(图2f)将ifn-γ报道小鼠(n=3)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。在最后一次处理之后十一天,将肿瘤切碎并消化用于yfp+t细胞的流式细胞术检测。p值由双尾未配对t检验(图2a至2c、图2e和图2f)确定。另参见图102a至f。
44.图3a至3f。6-硫代-dg处理增强了树突细胞的交叉致敏能力。(图3a)将c57bl/6小鼠(n=5)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。在处理开始之前一天施用200μg抗csf1r,并随后每周进行两次,持续3周。(图3b)将batf3-/-小鼠(n=5)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。每3天测量肿瘤生长。(图3c)6-硫代-dg处理之后wt和batf3-/-小鼠(n=5)中无肿瘤小鼠的百分比。(图3d)将bmdc与用200nm 6-硫代-dg或载剂预处理的mc38肿瘤细胞一起培养过夜,并随后纯化dc并将其与初始ot-1t细胞共培养。48小时后,收集上清液并通过细胞计数珠阵列(cytometric bead array,cba)测试ifn-γ产生。(图3e)将bmdc与用200nm 6-硫代-dg或载
剂预处理的mc38肿瘤细胞一起培养18小时,收集上清液用于ifn-βelisa。(f)将ifnar1-/-小鼠(n=5)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。每3天测量肿瘤生长。数据示出为来自两至三个独立实验的平均值
±
sem。p值由双因素anova(图3a、图3b和图3f)或双尾未配对t检验(图3c至3e)确定。
45.图4a至4g。6-硫代-dg诱导的固有感知需要宿主中的sting信号传导。(图4a和图4b)将myd88-/-(图4a)或tmem173-/-(图4b)小鼠(n=5)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。每3天测量肿瘤生长。(图4c和图4d)将c57bl/6小鼠(n=5)用5
×
105tmem173 ko(图4c)或mb21d1 ko(图4d)mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。每3天测量肿瘤生长。(图4e和图4f)将mc38肿瘤细胞用1μm 6-硫代-dg处理24小时。tif(端粒功能障碍诱导的病灶(telomere dysfunction induced foci))测定确定了在mc38细胞中用6-硫代-dg处理诱导tif。n=100(对照),n=100(6-硫代-dg)。(图4g)将bmdc与用500nm 6-硫代-dg或载剂预处理的hct116人结肠癌细胞一起培养4小时,然后纯化dc并提取胞质dna。通过qpcr检测dc的细胞溶胶中mt-co1和人18s的相对丰度。数据示出为来自二至三个独立实验的平均值
±
sem。p值由双因素anova(a至d)或双尾未配对t检验(图4f和图4g)确定。另参见图11a至11h。
46.图5a至5f.6-硫代-dg在晚期肿瘤模型中克服了pd-l1阻断抗性。(图5a)将荷mc38肿瘤的c57bl/6小鼠(n=4至5)用6-硫代-dg(3mg/kg,第7、8、9天)处理。第一次处理之后7天,测试pd-1+cd8+t细胞频率(左)和pd-1mfi(右)。(图5b和图5c)将c57bl/6小鼠用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第10、11天)处理。在第13天和第17天施用50μg抗pd-l1抗体。示出了肿瘤生长(图5b)和生存能力(图5c)。(图5d)将荷mc38肿瘤的c57bl/6小鼠(n=5)用6-硫代-dg(3mg/kg,第10、11天)或抗pd-l1(2.5kg/mg,第10天)或二者的组合处理进行处理。在第一次处理之后7天,收获引流淋巴组织并用经辐照的mc38肿瘤细胞或llc肿瘤细胞刺激用于ifn-γelispot。(图5e和图5f)将c57bl/6小鼠(n=5)用1
×
106个llc鼠肺肿瘤细胞接种并用6-硫代-dg(3mg/kg,第4、5、6和10、11天)处理。在第8天和第13天施用200μg抗pd-l1抗体。每3至4天测量肿瘤生长(图5e)。六周后,将顺序处理组中的无肿瘤小鼠(n=4)和对照小鼠用5
×
106个llc(右胁腹)和5
×
106个mc38(左胁腹)肿瘤细胞再次攻击。每3至4天测量肿瘤生长(图5f)。数据示出为来自两个独立实验的平均值
±
sem。p值由双尾未配对t检验(图5a、图5d)或双因素anova(图5b、图5e和图5f)或对数秩检验(图5c)确定。另参见图12。
47.图6a至6e。6-硫代-dg在人源化小鼠模型中降低了人结肠癌负荷。(图6a)来自tcga数据库的高和低tert(端粒酶逆转录酶,其是端粒酶的催化亚基)表达结直肠腺癌患者中的总存活。(图6b)6-硫代-dg在hct116人结肠癌细胞中的细胞生存力(ic
50
)。将细胞用6-硫代-dg处理5天。(图6c)用于人源化小鼠肿瘤模型的方案。(图6d和图6e)将nsg-sgm3小鼠(n=5)(图6d)或人源化nsg-sgm3小鼠(n=4)(图6e)用1
×
106个hct116肿瘤细胞接种并用6-硫代-dg(3mg/kg,第8、9、10天)处理。每3天测量肿瘤生长。数据示出为来自两个独立实验的平均值
±
sem。p值由对数秩检验(图6a)或双因素anova(图6d和图6e)确定。另参见图13a至13f。
48.图7。c-gas/sting/ifn的6-硫代-dg诱导的示意图。
49.图8a至8b。6-硫代-dg随后是pd-l1导致完全肿瘤缓解和免疫原性记忆的证据。
50.图9a至9d(与图1a至1g相关)。(图9a)6-硫代-dg在llc鼠肺癌细胞中的细胞生存力
(ic
50
)。将细胞用6-硫代-dg处理4天。(图9b)将c57bl/6小鼠(n=5)用1
×
106个llc肿瘤细胞接种并用6-硫代-dg(3mg/kg,第4、5、6天)处理。每3天测量肿瘤生长。(图9c)6-硫代-dg在ct26鼠结肠癌细胞中的ic
50
。(图9d)将balb/c小鼠(n=5)用5
×
105个ct26肿瘤细胞接种并用6-硫代-dg(3mg/kg,第5、6、7天)处理。每3天测量肿瘤生长。数据示出为来自两个独立实验的平均值
±
sem。p值由双因素anova确定。
51.图10a至10f(与图2a至2g相关)。(图10a至10d)将c57bl/6小鼠(n=4至5)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。在第一次处理之后7天,针对cd45+细胞(图10a)和总肿瘤细胞(图10b)中的cd8+t细胞分析肿瘤,分析肿瘤浸润t细胞的cd4
+
foxp3
+
treg细胞(图10c)和nk细胞(图11d)的频率。(图10e)将c57bl/6小鼠(n=5)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。在处理开始之前一天施用200μg抗nk1.1,并随后每周进行两次,持续3周。(图10f)将ifn-γ报道小鼠(n=3)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7、8、9天)处理。在最后一次处理之后十一天,将肿瘤切碎并消化用于yfp+t细胞的流式细胞术检测。示出了代表性的流式细胞术设门。数据示出为来自两个独立实验的平均值
±
sem。p值由(图10a至10d)中的双尾未配对t检验或双因素anova(图10e)确定。
52.图11a至11h(与图4a至4g相关)。(图11a)将bmdc与用0.2μm或1μm 6-硫代-dg预处理的mc38肿瘤细胞一起培养6小时,并随后用磁珠纯化dc并进行western印迹。(图11b)将来自野生型(wt)或tmem173ko小鼠的bmdc与用200nm 6-硫代-dg预处理的mc38肿瘤细胞一起培养过夜,并随后用磁珠纯化dc并进行qpcr以测试ifn-β的相对丰度。(图11c和11d)将c57bl/6小鼠(n=3)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第10、11、12天)处理。在最后一次注射之后3天,处死小鼠;收集肿瘤并固定用于tif(端粒功能障碍诱导的病灶)染色。通过荧光显微镜(100
×
)获得图像。红点表示dna损伤(γ-h2ax),绿点表示端粒并且黄点表示tif(端粒上的dna损伤)。比例尺,10μm。(图11e和11f)6-硫代-dg处理诱导mc38细胞中的微核。(图11e)处于晚末期的两个子细胞的代表性图片包含端粒信号以及mc38细胞中的包被和未包被的微核。绿点表示端粒信号,并且红色表示核纤层蛋白a/c(核包膜生物标志物)。(图11f)对48小时之后1μm 6-硫代-dg处理诱导的微核的定量。(图11g和11h)将100,000个mc38细胞接种在6孔板中并用25μm edu标记细胞。2天后,冲洗细胞并用1μm新鲜培养基o/n中的6-硫代-dg一起孵育。然后冲洗细胞并用dc o/n共培养。第二天,用磁珠纯化dc。然后将纯化的dc固定并进行细胞离心涂片(cytospun)用于免疫fish。端粒探针:绿色,edu:红色,dapi:蓝色。用配备有自动捕获系统的axio imager z2在63
×
放大倍率下捕获图像并用isis软件(相机:coolcube 1-metasystems)进行分析。示出了代表性成像(图11g)和定量数据(图11h),n=100。数据示出为来自二至三个独立实验的平均值
±
sem。p值由双尾未配对t检验(b、f和h)确定。
53.图12(与图5a至5g相关)。将c57bl/6小鼠(n=5)用5
×
105个mc38肿瘤细胞接种并用6-硫代-dg(3mg/kg,第10、11天)处理。在第13天和第17天施用50μg抗pd-l1抗体。测量小鼠体重。数据示出为平均值
±
sem。
54.图13a至13f(与图6a至6e相关)。(图13a至13c)在人源化小鼠重构之后12周,通过流式细胞术测试小鼠外周血中的人cd45+细胞和cd3+t细胞。在图13a中示出了代表性的流式细胞术图。在图13b和13c中示出了在处理之前的对照组和6-硫代dg组中的cd45和cd3频
率,n=5。(图13d)6-硫代-dg在a375人黑素瘤癌细胞中的细胞生存力(ic
50
)。将细胞用6-硫代-dg处理4天。(图13e)将nsg-sgm3小鼠(n=5)用2
×
106个a375肿瘤细胞接种并用6-硫代-dg(3mg/kg,第7天和第8天)或抗pd-l1加抗ctla-4(200μg i.p.,第10天和第13天)或6-硫代-dg加抗pd-l1和抗ctla-4的组合处理。每3天测量肿瘤生长。(图13f)将人源化nsg-sgm3小鼠(n=5至7)用2
×
106个a375肿瘤细胞接种并用6-硫代-dg(3mg/kg,第13天和第14天)或抗pd-l1加抗ctla-4(200μg i.p.,第16天和第19天)或6-硫代-dg加抗pd-l1和抗ctla-4的组合处理。每3天测量肿瘤生长。数据示出为平均值
±
sem。p值由双尾未配对t检验(图13b和13c,n.s.p》0.05)或双因素anova(图13f)确定。
55.图14示出了6-硫代-dg与抗pd-1药剂西米普利单抗对携带llc细胞来源的肿瘤(nsclc)的小鼠的肿瘤体积的影响。给药为6-硫代-dg 3mg/kg(i.p)和西米普利单抗-10mg/kg(i.p)。如下表中所示对不同组进行给药。第1天(12/31/2020):将1000k llc细胞接种至35只b6小鼠。第11至13天:开始实验。本研究中使用了3mg/kg 6-硫代-dg和10mg/kg libtayo。
56.表a-给药方案
[0057][0058]
图15示出了6-硫代-dg与抗pd-1药剂西米普利单抗对携带llc细胞来源的肿瘤(nsclc)的小鼠的肿瘤体积的影响。给药为6-硫代-dg 3mg/kg(i.p)和西米普利单抗-10mg/kg.p(i.p)。如上表中所示对不同组进行给药。第1天(12/31/2020):将1000k llc细胞接种至35只b6小鼠。第11至13天:开始实验。在本研究中使用了3mg/kg 6-硫代-dg和10mg/kg libtayo。
[0059]
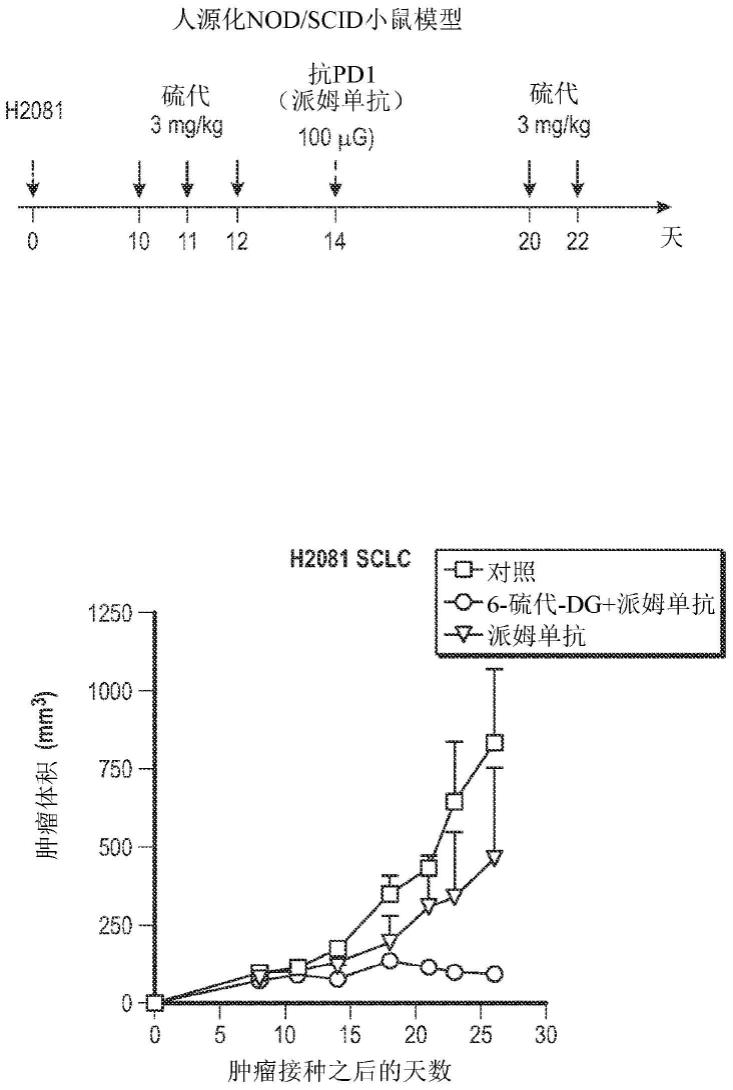
图16示出了与pd-1药剂派姆单抗组合的6-硫代-dg在小细胞肺癌(small cell lung cancer,sclc)人源化小鼠模型中的作用。
[0060]
图17示出了在hcc小鼠模型中的与pd-l1抑制剂和辐射组合的6-硫代-dg。
[0061]
图18a至18d示出了在hcc小鼠模型中的与pd-l1和辐射组合的6-硫代-dg。图18a:给药方案。图18b:将hcc53n肝癌细胞(p53和nras敲除)在体内最初用病灶性ir处理随后用6-硫代-dg进行3次给药随后用抗pd-l1抗体处理2次导致完全肿瘤缓解。图18c:用10倍多的hcc53n细胞再次攻击,没有肿瘤再次生长,这表明免疫记忆;和图18d:当测试初始小鼠时,肿瘤快速生长。
具体实施方式
[0062]
端粒酶在肿瘤细胞中几乎普遍表达。端粒酶介导的端粒靶向药物6-硫代-dg通过
直接诱导端粒酶阳性癌细胞中而不是正常端粒酶沉默细胞中的端粒损伤而缩短了初始治疗与对治疗作出响应之间的滞后时间。在该研究中,发明人旨在探索在端粒酶阳性癌细胞中诱导端粒应激的6-硫代-dg是否可以启动用于固有感知的快速dna损伤。使用同基因野生型小鼠和遗传缺陷小鼠来评价6-硫代-dg如何触发固有感知以及其如何有助于宿主抗肿瘤免疫。重要的是,证明了6-硫代-dg克服了晚期肿瘤中的pd-l1阻断抗性。出乎意料地,6-硫代-dg以宿主sting依赖性方式诱导dna介导的固有感知和免疫应答的活化,导致抗肿瘤效力提高。此外,顺序地6-硫代-dg随后是抗pd-l1治疗可完全消除晚期肿瘤。因此,6-硫代-dg是可在临床上使端粒酶阳性且pd-l1抗性癌症患者受益的靶向肿瘤和刺激免疫的药物。
[0063]
下面详细描述本公开内容的这些和另一些方面。
[0064]
i.端粒、端粒酶和端粒功能障碍
[0065]
在有丝分裂期间,细胞进行其遗传物质的复制。一半的遗传物质进入每个新的子细胞。为了确保信息成功地从一代传至下一代,每条染色体具有位于其“臂”末端的特殊的保护帽,称为端粒。通过酶端粒酶的存在控制端粒。
[0066]
端粒是机体染色体末端处的重复dna序列(例如,ttaggg)。端粒可以达到15,000个碱基对的长度。端粒的功能是防止染色体丟失其末端的碱基对序列。其还阻止染色体相互融合。然而,每次细胞分裂时,都会失去端粒的一部分(每次分裂通常是25至200个碱基对)。当端粒变得太短时,染色体达到“临界长度”并且不再能够复制。这意味着细胞变老并通过称为凋亡的过程死亡或经历衰老。端粒活性由两种机制控制:侵蚀和增加。侵蚀,如所述,每次细胞分裂时都会发生,这是因为滞后链dna合成一直到最后也未能完成。增加由端粒酶的活性决定。
[0067]
端粒酶,也称为端粒末端转移酶,是由蛋白质和rna亚基构成的酶,其可通过向现有染色体的末端添加ttaggg序列来延长染色体。端粒酶存在于胎儿组织、成人生殖细胞以及肿瘤细胞中。端粒酶活性在发育期间被调节,并且在体细胞(机体)细胞中具有非常低、几乎检测不到的活性。由于这些体细胞不经常使用端粒酶,因此其会衰老。衰老细胞的结果是机体衰老。如果端粒酶在细胞中被活化,则细胞将继续生长和分裂。这种“永生细胞”理论在两个研究领域:衰老和癌症中是重要的。
[0068]
细胞衰老或老化是细胞变老并停止生长或死亡的过程。这是由于染色体端粒缩短至染色体达到临界长度的点。细胞衰老类似于装有发条的时钟(wind-up clock)。如果时钟保持上发条,则细胞变得永生并且不断地产生新的细胞。如果时钟慢下来(wind down),则细胞停止产生新的细胞并经历所谓的复制性衰老或死亡。细胞不断地衰老。能够使身体的细胞扩展其复制能力无疑会产生一些令人兴奋的可行性,特别是对于与短端粒的基因遗传相关的疾病(称为端粒病或端粒谱系病症)。因此,端粒酶研究可以产生与衰老过程相关的重要发现。
[0069]
癌细胞避开了正常的短端粒衰老现象并变成恶性细胞。恶性细胞繁殖直至其形成肿瘤,该肿瘤不受控地生长并扩散至整个人体的远端组织。在几乎所有的人癌细胞中都检测到了端粒酶。这为许多类型的肿瘤提供了选择性生长优势。如果端粒酶活性关闭,则癌细胞中的端粒将会逐渐缩短,就像其在正常体细胞中所进行的那样。这将防止癌细胞在其早期发育阶段不受控制地分裂。如果肿瘤已经完全发育,可以将其移除并施用抗端粒酶治疗以防止复发。本质上,阻止端粒酶发挥其功能将使癌细胞从永生变为不能永生。然而,直接
的端粒酶抑制剂从开始治疗直至出现肿瘤缩小需要一段滞后期,并且由于毒性提高而在临床开发中进展不佳。因此,本发明提供了缩短滞后期但需要端粒酶活性以有效且潜在地降低副作用的方法。
[0070]
ii.治疗癌症
[0071]
a.用于顺序治疗的治疗剂
[0072]
1.在一些实施方案中,pd-l1抑制剂选自阿特珠单抗、阿维鲁单抗、柯希利单抗、bintrafusp alfa、德瓦鲁单抗、mgd013、kno35、kn046、aunp12、ca-170和bms-9986189中的一种或更多种。在一些实施方案中,pd-l1抑制剂是阿特珠单抗。
[0073]
阿特珠单抗(商品名)是针对蛋白质程序性细胞死亡配体1(pd-l1)的igg1亚型的完全人源化改造单克隆抗体。2015年,其在临床试验中作为用于数种类型的实体瘤的免疫治疗。2016年5月,其由fda批准用于膀胱癌治疗,但在2017年5月,其针对二线膀胱癌的iii期试验失败。2016年10月,fda批准阿特珠单抗用于尿路上皮癌和治疗疾病在含铂化学治疗期间或之后发生进展的患有转移性非小细胞肺癌(nsclc)的患者。患有egfr或alk基因组学肿瘤畸变的患者在接受阿特珠单抗之前应对fda批准的针对这些畸变的治疗具有疾病进展。2018年9月,根据在加拿大多伦多举行的第19届世界肺癌大会(world conference on lung cancer,wclc)上展示的研究结果,宣布阿特珠单抗在广泛期小细胞肺癌治疗中延长了存活。2018年10月,该药物与白蛋白结合型紫杉醇(nab-paclitaxel)对患有晚期三阴性乳腺癌的患者的组合临床试验结束。2019年3月,其在美国被批准与蛋白质结合紫杉醇组合用于患有不可切除的局部晚期或转移性三阴性乳腺癌(triple-negative breast cancer,tnbc)的成人患者,这些患者的肿瘤表达pd-l1(任何强度的pd-l1染色肿瘤浸润免疫细胞的覆盖≥1%的肿瘤面积),如由fda批准的测试所确定的。2019年3月,其在美国被批准与卡铂和依托泊苷组合用于患有广泛期小细胞肺癌(es-sclc)的成人患者的一线治疗。研究中最常见的不良作用是疲劳、食欲下降、恶心和感染。尿道感染是最常见的严重不良作用。
[0074]
阿特珠单抗阻断pd-l1与程序性细胞死亡蛋白1(programmed cell death protein 1,pd-1)和cd80受体(b7-1r)的相互作用。pd-l1可以在某些肿瘤上高度表达,这被认为导致可在其他情况下识别和攻击癌症的免疫细胞(特别是细胞毒性t细胞)的激活降低。阿特珠单抗对pd-l1的抑制可以除去该抑制作用,并由此产生抗肿瘤响应。其是阻断与t细胞活化相关的抑制信号的数种方法中的一种,是已知作为免疫检查点抑制的更通用的策略。对于一些癌症(尤其是膀胱癌),受益的可行性与pd-l1表达相关,但是大多数具有pd-l1表达的癌症仍然不发生响应,而一些(约15%)不具有pd-l1表达的癌症发生响应。
[0075]
阿维鲁单抗是由merck serono和pfizer开发的完全人igg1抗体。阿维鲁单抗被fda批准用于治疗转移性默克尔细胞癌。其未能通过胃癌的iii期临床试验。
[0076]
德瓦鲁单抗是由astrazeneca开发的完全人igg1抗体。德瓦鲁单抗被fda批准用于在化学放射治疗(chemoradiation)之后治疗尿路上皮癌和不可切除的非小细胞肺癌。
[0077]
kn035是目前在美国、中国和日本进行临床评价的具有皮下制剂的唯一的pd-l1抗体。
[0078]
aunp12是作为由aurigene和laboratoires pierre fabre开发的第一个消化性pd-1/pd-l1抑制剂的29聚体肽,其正在用于治疗癌症的临床试验中进行评价。
[0079]
由aurigene/curis发现的作为pd-l1和vista拮抗剂的ca-170目前正处于用于治疗间皮瘤的i期临床试验中。
[0080]
2.pd-1抑制剂例如西米普利单抗、派姆单抗、纳武单抗、jtx-4014、萨善利单抗、布格利单抗、bi 754091、斯巴达珠单抗、卡瑞利珠单抗、信迪利单抗、替雷利珠单抗、赛帕利单抗、特瑞普利单抗、多塔利单抗、incmga00012、amp-224、regn2810、bms-936558、shr1210、ibi308、pdr001、bgb-a317、bcd-100、js001和amp-515。在一些实施方案中,pd-1抑制剂是西米普利单抗或派姆单抗。
[0081]
西米普利单抗以商标名销售,其是用于治疗鳞状细胞皮肤癌、基底细胞癌皮肤癌和非小细胞肺癌的单克隆抗体药物。西米普利单抗属于一类与程序性死亡受体-1(pd-1)结合的药物,阻断了pd-1/pd-l1途径。2018年9月,其被美国食品和药物监督管理局(food and drug administration,fda)批准用于治疗不是治愈性手术或治愈性照射的候选者的患有转移性皮肤鳞状细胞癌(cscc)或局部晚期cscc的人。西米普利单抗正在被研究以用于治疗黑素瘤宫颈癌、脑癌、头颈癌、肾细胞癌和霍奇金淋巴瘤。
[0082]
姆派单抗(以前是兰罗利珠单抗(lambrolizumab),以商标名销售)是用于癌症免疫治疗的人源化抗体。姆派单抗于2014年在美国被批准用于医学用途。2017年,美国食品和药物管理局(fda)批准其用于任何具有某些遗传异常(错配修复缺陷或微卫星不稳定性)的不可切除或转移性实体瘤。目前已批准的适应证包括转移性黑素瘤、nsclc、头颈癌、霍奇金淋巴瘤和转移性食管鳞状细胞癌等适应证。派姆单抗通过缓慢注射到静脉中进行施用。
[0083]
3.硫嘌呤,例如6-硫鸟嘌呤和6-巯基嘌呤,目前在临床实践中用作抗炎、抗白血病和免疫抑制的药剂。在活化反应中,6-硫鸟嘌呤通过次黄嘌呤鸟嘌呤磷酸核糖基转移酶(hprt)转化为单磷酸6-硫鸟苷。然后,单磷酸6-硫鸟苷通过激酶和rna还原酶进一步代谢为6-硫代-2
’‑
脱氧鸟苷5
’‑
三磷酸,其最终可在dna复制期间并入到dna链中。并入dna的6-硫鸟嘌呤还可产生活性氧类,其可对dna、蛋白质和其他细胞大分子造成另外的损伤,并因此阻断细胞复制。尽管硫嘌呤在临床上用于治疗一些类型的白血病,但其对实体瘤治疗的效用受到限制,部分是由于毒性提高和其他治疗的发展。
[0084]
一种特定的硫嘌呤是6-硫代-dg。该化合物是核苷类似物并且已被证明是端粒酶介导的端粒破坏化合物。因此,癌细胞对6-硫代-dg非常敏感,其中观察到的ic
50
值为0.7至2.9μm(取决于细胞类型),甚至包括治疗抗性癌症(mender et al.,2018)。结构在以下示出:
[0085][0086]
b.治疗方案
[0087]
本公开内容提供了使用6-硫代-dg治疗随后是pd-l1、pd-1和/或ctla-4治疗的顺序癌症治疗。每种治疗的时间段可不同,并且预期治疗之间的短间隔将是有利的。例如,6-硫代-dg治疗可以短至2天,但可以是3、4或更多天,包括2至4天。在pd-l1、pd-1和/或ctla-4治疗之前的间隔应至少为1天,并且可以长至14天,例如2至4天。由于6-硫代-dg对活化的效应t细胞的潜在有害作用,因此应避免6-硫代-dg与pd-l1、pd-1和/或ctla-4之间的重叠。
[0088]
6-硫代-dg的日剂量将是0.5mg/kg至10mg/kg,优选是静脉内或经口的。pd-l1、pd-1和/或ctla-4的剂量将与目前批准的给药方案一致。
[0089]
c.端粒酶阳性癌症
[0090]
端粒酶阳性癌症比端粒酶阴性癌症远远更易受到本公开内容的方法的影响。因此,检测活检物来确定癌症是否为端粒酶阳性的是非常有用的,尽管不是必需的。
[0091]
用于检测端粒酶活性的最常用方法是端粒重复扩增方案(telomeric repeat amplification protocol,trap),其允许人们使用它的一些修饰(称为ddtrap,作为微滴式数字化trap(droplet digital trap))进行半定量和定量分析。在这些修饰中有闪烁邻近测定、杂交保护测定、转录扩增测定和基于磁珠的提取测定。
[0092]
端粒重复扩增方案可细分为三个主要阶段:引物延伸、端粒酶合成dna的扩增以及最后的对其的检测。在延伸阶段,通过细胞提取物中存在的端粒酶将端粒重复添加至端粒模拟寡核苷酸。用端粒模拟和反向引物进行端粒酶合成dna的pcr扩增。可将不同的标记并入到端粒酶合成dna中。然后该阶段之后是检测(例如,pcr产物的电泳分离和成像)。
[0093]
还有其他方法涉及端粒酶的定量分离,以及随后对来自给定细胞量的端粒酶的总体活性的测量,其可与适当的标准进行比较。一旦端粒酶在体外被分离和测试,就可以使用广泛多种标记和检测方法。
[0094]
d.药物抗性癌症
[0095]
抗肿瘤抗性,通常与化学治疗抗性互换使用,是对肿瘤(癌性)细胞的抗性,或者是尽管进行抗癌治疗但癌细胞仍存活和生长的能力。在某些情况下,癌症会进化出对多种药物的抗性,称为多重药物抗性。
[0096]
存在两种抗肿瘤治疗失败的一般原因:固有遗传特征(其赋予癌细胞以抗性)和在药物暴露之后的获得性抗性(其植根于癌细胞异质性的概念)。抗性细胞的特征包括改变膜转运、增强dna修复、凋亡途径缺陷、改变靶分子、蛋白质和途径机制,例如酶失活。由于癌症是遗传性疾病(genetic disease),因此两个基因组事件是获得性药物抗性的基础:基因组改变(例如基因扩增和缺失)和表观遗传修饰。癌细胞不断地使用多种工具,包括基因、蛋白
质和改变的途径,以确保其对抗抗肿瘤药物的存活。
[0097]
抗肿瘤抗性与化学治疗抗性同义,是指癌细胞即使进行了不同的抗癌治疗仍存活和生长的能力(即其多重药物抗性)。存在两种抗肿瘤治疗失败的一般原因:(i)固有抗性(例如遗传特征),从开始就赋予癌细胞抗性,其植根于癌细胞异质性的概念;和(ii)在药物暴露之后的获得性抗性。
[0098]
由于癌症是遗传性疾病,因此两个基因组事件是获得性药物抗性的这些机制的基础:基因组改变(例如基因扩增和缺失)和表观遗传修饰。
[0099]
由于基因组不稳定性引起的染色体重排可导致基因扩增和缺失。基因扩增是染色体区域拷贝数的提高。其在实体瘤中频繁地发生并且可通过改变基因表达促进肿瘤进化。
[0100]
1993年的仓鼠细胞研究表明,参与dna合成的dhfr基因的扩增开始于该基因下方的染色体断裂,并且随后的桥断裂融合形成的循环导致大量染色体内重复。癌基因的过度扩增可响应于化学治疗而发生,被认为是数类抗性的潜在机制。例如,dhfr扩增响应于甲氨蝶呤而发生,tyms(参与dna合成)扩增响应于5-氟尿嘧啶而发生,并且bcr-abl扩增响应于甲磺酸伊马替尼而发生。在来自癌症患者的细胞中确定基因扩增的区域具有重要的临床意义。基因缺失与基因扩增相反,其中染色体的区域丢失,并且通过丢失肿瘤抑制基因(例如tp53)而发生药物抗性。
[0101]
当复制叉在其迁移中被干扰或停滞时可发生基因组不稳定。这可在具有复制叉障碍、蛋白质(例如ptip、chd4和parp1)的情况下发生,其通常被细胞的dna损伤感应子、检测子和响应子brca1和brca2清除。
[0102]
抗肿瘤药物抗性的表观遗传修饰在癌症发生和药物抗性中发挥重要作用,因为其有助于基因表达的调节。两种主要类型的表观遗传控制是dna甲基化和组蛋白甲基化/乙酰化。dna甲基化是向dna添加甲基的过程,通常在上游启动子区域中,其在该区域中使dna转录停止并有效地使单个基因沉默。组蛋白修饰(例如去乙酰化)改变了染色质形成并使大的染色体区域沉默。在基因表达的正常调节被破坏的癌细胞中,癌基因通过低甲基化被活化,而肿瘤抑制因子通过高甲基化被沉默。类似地,在药物抗性开发中,已提出表观遗传修饰可导致前药抗性基因的激活和过表达。
[0103]
对癌细胞系的研究已表明,mdr1基因启动子的低甲基化(甲基化丢失)导致过表达和多重药物抗性。
[0104]
在没有药物摄取和叶酸载体表达的甲氨蝶呤抗性乳腺癌细胞系中,给予dac(dna甲基化抑制剂)提高了药物摄取和叶酸载体表达。
[0105]
黑素瘤细胞对烷基化药物福莫司汀(fotemustine)的获得性抗性表现出与mgmt基因外显子的高甲基化相关的高mgmt活性。
[0106]
在伊马替尼抗性细胞系中,通过甲基化使socs-3基因沉默已被证明导致stat3蛋白活化,从而导致不受控的增殖。
[0107]
癌细胞可通过改变膜转运、增强dna修复、使凋亡途径缺陷、改变靶分子、蛋白质和途径机制(例如酶失活)来对多种药物产生抗性。
[0108]
许多类别的抗肿瘤药物作用于胞内组分和途径,如dna、核组分,这意味着它们需要进入癌细胞。p-糖蛋白(p-gp)或多重药物抗性蛋白是磷酸化和糖基化的膜转运体,其可将药物运出细胞,从而降低或消除药物效力。这种转运体蛋白由mdr1基因编码并且还被称
为atp结合盒(atp-binding cassette,abc)蛋白。mdr1具有混杂的底物特异性,使得其跨细胞膜转运许多结构不同的化合物,主要是疏水性化合物。研究发现,mdr1基因可响应于药用药物而被活化和过表达,从而形成针对许多药物的抗性的基础。癌细胞中mdr1基因的过表达用于使抗肿瘤药物的胞内水平保持低于细胞杀伤水平。
[0109]
例如,已发现抗生素利福平诱导mdr1表达。在不同药物抗性细胞系和患者dna中的实验揭示了启动mdr1的活化或过表达的基因重排。mdr1的外显子226中的c3435t多态性也与p-糖蛋白活性强烈相关。
[0110]
mdr1通过nf-κb活化,nf-κb是充当转录因子的蛋白质复合物。在大鼠中,nf-κb结合位点与mdr1b基因相邻,nf-κb可活跃于肿瘤细胞中,因为其突变的nf-κb基因或其抑制性iκb基因在化学治疗下发生突变。在结直肠癌细胞中,抑制nf-κb或mdr1导致响应于化学治疗剂的凋亡提高。
[0111]
增强的dna修复在使癌细胞具有克服药物诱导的dna损伤的能力中发挥重要作用。
[0112]
基于铂(例如顺铂)的化学治疗通过交联其dna链来靶向肿瘤细胞,导致突变和损伤。这样的损伤将触发癌细胞中的程序性细胞死亡(例如,凋亡)。当癌细胞通过从dna中去除顺铂并修复造成的任何损伤而产生增强的逆转这样的损伤的能力时,出现顺铂抗性。顺铂抗性细胞上调切除修复交叉互补(excision repair cross-complementing,ercc1)基因和蛋白质的表达。
[0113]
一些化学治疗剂是烷化剂,这意味着其将烷基连接至dna以阻止其被读取。o6-甲基鸟嘌呤dna甲基转移酶(mgmt)是dna修复酶,其从dna中去除烷基。mgmt表达在许多癌细胞中上调,这保护其免受烷化剂的影响。在结肠癌、肺癌、非霍奇金淋巴瘤、乳腺癌、胶质瘤、骨髓瘤和胰腺癌中发现了提高的mgmt表达。
[0114]
tp53是编码p53蛋白的肿瘤抑制基因,其通过dna修复、细胞周期阻滞或凋亡响应于dna损伤。通过基因缺失而丢失tp53可使得细胞尽管在dna损伤下仍继续复制。dna损伤的耐受性可赋予癌细胞以对通常通过dna损伤诱导凋亡的那些药物之抗性的方法。
[0115]
参与凋亡途径相关药物抗性的另一些基因包括h-ras和bcl-2/bax。已发现致癌h-ras提高了ercc1的表达,从而增强dna修复(见上文)。发现抑制h-ras提高了胶质母细胞瘤细胞中的顺铂敏感性。白血病细胞(非霍奇金淋巴瘤)中bcl-2的上调表达导致响应于化学治疗剂的凋亡的水平降低,因为bcl-2是促存活癌基因。
[0116]
在靶向治疗期间,靶标通常自我修饰并使其表达降低至治疗不再有效的程度。这样的一个实例是在乳腺癌的抗雌激素治疗之后雌激素受体(estrogen receptor,er)和孕激素受体(progesterone receptor,pr)的丢失。丢失er和pr的肿瘤不再对他莫昔芬或另一些抗雌激素治疗作出响应,并且虽然癌细胞在某种程度上保留对雌激素合成抑制剂的响应,但其最终变得对内分泌操作无响应并且不再依赖雌激素而生长。
[0117]
用于治疗乳腺癌的另一个治疗线是靶向激酶,如来自egfr家族的人表皮生长因子受体2(human epidermal growth factor receptor 2,her2)。在用抑制剂治疗之后,her2基因中经常发生突变,其中约50%的患有肺癌的患者被发现具有egfr-t790m看门人(gatekeeper)突变。
[0118]
慢性髓性白血病(chronic myeloid leukemia,cml)的治疗涉及靶向bcr/abl融合基因的酪氨酸激酶抑制剂,称为伊马替尼。在一些对伊马替尼具有抗性的人中,bcr/abl基
因被重新活化或扩增,或者在该基因上发生单点突变。这些点突变增强了bcr-abl蛋白的自磷酸化,导致atp结合位点稳定成其活性形式,使其不能被伊马替尼结合以进行适当的药物激活。
[0119]
由于拓扑异构酶在dna复制中作为酶的关键作用,其是用于癌症治疗的有利的靶标,并且已经制备了许多拓扑异构酶抑制剂。当拓扑异构酶水平降低时,或者当拓扑异构酶的不同异构体在细胞内分布不同时,就产生了抗性。还在患者白血病细胞以及在另一些癌症中赋予对拓扑异构酶抑制剂的抗性的突变中报道了突变体酶。
[0120]
抗肿瘤抗性的机制之一是药物代谢酶或载体分子的过表达。通过提高代谢酶的表达,药物更快地转化为药物缀合物或非活性形式,然后可被排出。例如,提高谷胱甘肽的表达促进了药物抗性,因为谷胱甘肽的亲电特性使得其与细胞毒剂反应,使其失活。在一些情况下,药物代谢酶的表达降低或表达丧失赋予了抗性,因为该酶是将药物从非活性形式加工成活性形式所需的。阿拉伯糖苷(用于白血病和淋巴瘤常用化学治疗剂)通过脱氧胞苷激酶转化成胞嘧啶阿拉伯糖苷三磷酸。脱氧胞苷激酶的突变或表达的丧失导致对阿拉伯糖苷的抗性。这是酶失活的形式。
[0121]
生长因子表达水平也可促进对抗肿瘤治疗的抗性。在乳腺癌中,发现药物抗性细胞表达高水平的il-6,而敏感细胞不表达显著水平的生长因子。il-6激活了ccaat增强子结合蛋白转录因子(其激活mdr1基因表达)。
[0122]
另一类型的抗肿瘤抗性是对检查点抑制剂的抗性。在约40%至65%的用基于抗pd-1的治疗所治疗的患有黑素瘤的患者中出现了对免疫检查点阻断的原发性抗性。当在癌症免疫周期的三个阶段中的任一个阶段都未能诱导有效的抗肿瘤免疫应答时,就会出现这种临床问题。迄今为止,与原发性抗性相关的因素包括基线血清ldh的水平升高、基线肿瘤负荷提高、基线黑素瘤组织样品中pd-l1表达的缺乏、t细胞浸润的缺乏、在治疗早期获得的黑素瘤活检物中不存在pd-1t细胞和pd-l1巨噬细胞、新抗原不足和突变负担低、存在固有抗pd-1抗性特征(innate anti
–
pd-1 resistance signature,ipres)转录特征或不存在干扰素特征。
[0123]
当选择具有遗传和表观遗传特征的肿瘤细胞亚群使其避开免疫系统时,可发生对免疫治疗的获得性抗性。一个实例是在来自已经用免疫治疗和细胞因子基因治疗进行了治疗的患者的黑素瘤细胞系中报道了b2m表达的丢失。这导致mhc i类表达的丢失,并因此随后减少被cd8
+
t细胞识别。jak1/2突变最近也被鉴定作为黑素瘤中免疫治疗获得性抗性的遗传标志物。肿瘤细胞中的这些突变导致对ifn-γ的敏感性降低,最终阻止ifn-γ诱导的细胞生长停滞。在对基线和进展活检进行全外显子组测序之后,在再现性肿瘤中发现了编码jak1或jak2的基因的功能突变的丢失;所有患者均对用派姆单抗进行的治疗具有客观响应,并随后进展。另外,获得性抗性也可发生在单个细胞水平上,其中肿瘤细胞响应于肿瘤微环境中的免疫分子来改变其基因表达。例如,pd-l1可响应于免疫细胞因子(例如由t细胞释放的ifn-γ)而被肿瘤细胞上调,因此限制t细胞功能,并且可在原发性抗性和获得性抗性二者中发生。
[0124]
iii.药物制剂和施用途径
[0125]
在考虑临床应用的情况下,制备适合于预期应用的形式的药物组合物。通常而言,这将需要制备基本上不含致热原(pyrogen)以及可对人或动物有害的其他杂质的组合物。
[0126]
人们将通常期望使用适当的盐和缓冲剂以使药物稳定并允许被靶细胞摄取。本公开内容的水性组合物包含溶解或分散在可药用载体或水性介质中的有效量的药物。短语“可药用的或药理学上可接受的”是指当向动物或人施用时不产生不利的、变应性的或其他不良反应的分子实体和组合物。本文中使用的,“可药用的载体”包括用于配制药物(例如适合向人施用的药物)的可接受的溶剂、缓冲液、溶液、分散介质、包衣、抗细菌剂和抗真菌剂、等张剂和吸收延迟剂等。这样的介质和试剂用于药物活性物质的用途是本领域中公知的。除非到了任何常规介质或试剂与本公开内容的活性成分不相容的程度,否则考虑其在治疗组合物中的用途。补充的活性成分也可并入到组合物中,前提是它们不使组合物的试剂失活。
[0127]
本公开内容的活性组合物可包含经典的药物制剂。根据本公开内容的这些组合物的施用可通过任何常见途径进行,只要靶组织通过该途径可及即可,但通常包括全身施用。这包括经口、经鼻或口含(buccal)。或者,施用可通过皮内、皮下、肌内、腹膜内或静脉内注射,或通过肿瘤内或肿瘤区域(例如在肿瘤脉管系统中)进行。如上文所述,这样的组合物通常作为可药用组合物施用。
[0128]
活性化合物还可经肠胃外或腹膜内施用。以举例说明的方式,作为游离碱或药理学上可接受的盐的活性化合物的溶液可在与表面活性剂(例如羟丙基纤维素)适当混合的水中制备。也可在甘油、液体聚乙二醇、及其混合物中和在油中制备分散体。在普通储存和使用条件下,这些制备物通常包含防腐剂以防止微生物的生长。
[0129]
适合于可注射使用的药物形式包括例如无菌水溶液或分散体和用于临时制备无菌可注射溶液或分散体的无菌粉末。通常而言,这些制备物是无菌的并且存在为达到易注射性的程度的流体。制备物在制造和储存条件下应当是稳定的,并且应当针对微生物(例如细菌和真菌)的污染作用进行防腐。合适的溶剂或分散介质可包含例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)、其合适的混合物,以及植物油。例如,可通过使用包衣(例如卵磷脂)、通过在分散体情况下维持所需的颗粒尺寸和通过使用表面活性剂来维持适当的流动性。可通过多种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等实现防止微生物的作用。在许多情况下,将优选包含等张剂,例如糖或氯化钠。通过在组合物中使用延迟吸收的试剂(例如单硬脂酸铝和明胶)可实现可注射组合物的延长吸收。
[0130]
可通过将合适量的活性化合物以及所期望的任何其他成分(例如如上所列的)一起并入到溶剂中,随后过滤灭菌来制备无菌可注射溶液。通常来说,通过将多种无菌活性成分并入到包含基础分散介质和所期望的其他成分(例如如上所列的)的无菌载剂中来制备分散体。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法包括真空干燥和冷冻干燥技术,其产生来自其先前无菌过滤溶液的活性成分加上任何另外的期望成分的粉末。
[0131]
本公开内容的组合物可以以中性或盐形式配制。可药用盐包括例如来源于无机酸(例如,盐酸或磷酸),或来源于有机酸(例如乙酸、草酸、酒石酸、扁桃酸等)的酸加成盐(与蛋白质的游离氨基形成的)。与蛋白质的游离羧基形成的盐也可来源于无机碱(例如,氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁)或来源于有机碱(例如,异丙胺、三甲胺、组氨酸、普鲁卡因等)。
[0132]
在配制时,优选以与剂量制剂相容的方式和以治疗有效量施用溶液。制剂可易于以多种剂型施用,例如可注射溶液、药物释放胶囊等。对于水溶液中的肠胃外施用,例如,溶液通常进行适当地缓冲,并且首先例如用足够的盐水或葡萄糖使液体稀释剂等张。这样的水溶液可用于例如静脉内、肌内、皮下和腹膜内施用。优选地,特别是根据本公开内容,使用本领域技术人员已知的无菌水性介质。以举例说明的方式,单剂量可溶解在1ml的等张nacl溶液中,并且添加至1000ml的皮下输液流体(hypodermoclysis fluid)或在所推荐的输注部位注射(参见例如“remington’s pharmaceutical sciences”第15版,第1035至1038页和第1570至1580页)。根据所治疗对象的病症,剂量必然发生一些变化。在在任何情况下,负责施用的人将确定个体对象的适当剂量。此外,对于人施用,制剂应满足fda生物制品标准办公室要求的无菌性、致热原性、一般安全性和纯度标准。
[0133]
iv.组合治疗
[0134]
在本公开内容的上下文中,还预期6-硫代-dg/抗pd-l1(例如阿特珠单抗)或6-硫代-dg/抗pd-1(例如)或抗ctal-4可与化学或放射治疗干预或其他治疗联合使用。其也可被证明是有效的,特别是将6-硫代-dg、抗pd-l1、抗pd-1或抗ctla-4与针对癌细胞功能的不同方面的其他治疗组合。
[0135]
为了使用本公开内容的方法和组合物杀伤细胞、抑制细胞生长、抑制转移、抑制血管发生或以其他方式逆转或降低肿瘤细胞的恶性表型,通常使“靶”细胞与6-硫代-dg和至少一种其他试剂接触。这些组合物将以有效杀伤或抑制细胞增殖的顺序或组合量提供。该过程可涉及使细胞同时与6-硫代-dg/抗pd-l1、抗pd-1或抗ctla-4以及其他试剂或因子接触。这可通过使细胞与包含这两种药剂的单一组合物或药理制剂接触,或者通过使细胞与两种不同的组合物或制剂同时接触来实现,其中一种组合物包含根据本公开内容的干扰素前药并且另一种包含其他药剂。
[0136]
或者,6-硫代-dg/抗pd-l1、抗pd-1或抗ctla-4治疗可在其他药剂治疗之前或之后,间隔数分钟至数周进行。在其中另外药剂和干扰素前药单独施加于细胞的一些实施方案中,通常应确保每次递送之间的重要时间段没有满期,使得药剂和表达构建体仍能够对细胞发挥有利组合作用。在这种情况下,考虑在彼此约12至24小时内使细胞与这两种形式接触,并且更优选地在彼此约6至12小时内,并且延迟时间为仅约12小时是最优选的。在一些情况下,可期望显著延长治疗时间段,然而,在各施用之间间隔数天(2、3、4、5、6或7天)至数周(1、2、3、4、5、6、7或8周)。
[0137]
还可想到的是,干扰素前药或另一种药剂的多于一次施用是期望的。可采用多种组合,其中6-硫代-dg/抗pd-l1、抗pd-1或抗ctla-4治疗为“a”,而另一种治疗为“b”,如下所示:
[0138][0139]
考虑其他组合。再次,为了实现细胞杀伤,将这两种药剂以有效杀伤细胞的组合量递送至细胞。
[0140]
适合于癌症治疗的药剂或因素包括在向细胞施加时诱导dna损伤的任何化学化合
物或治疗方法。这样的药剂和因素包括诱导dna损伤的辐射和波,例如辐照、微波、电子发射等。可使用多种化学化合物,其也描述为“化学治疗剂”或“遗传毒性剂”。这可通过对局部肿瘤部位进行辐照来实现;或者,可通过向对象施用治疗有效量的药物组合物来使肿瘤细胞与药剂接触。
[0141]
考虑将多种类别的化学治疗剂与本公开内容一起使用。imetelstat在以下论述。其他化学治疗剂包括选择性雌激素受体拮抗剂(selective estrogen receptor antagonist,“serm”),例如他莫昔芬、4-羟基他莫昔芬(afimoxfene)、氟维司群(falsodex)、雷洛昔芬(raloxifene)、巴多昔芬(bazedoxifene)、氯米芬(clomifene)、femarelle、拉索昔芬(lasofoxifene)、奥美昔芬(ormeloxifene)和托瑞米芬(toremifene)。药剂喜树碱、放线菌素-d和丝裂霉素c是常用的化学治疗药物。本公开内容还涵盖使用一种或更多种dna损伤剂(无论是基于辐射还是真实的化合物)的组合,例如使用x射线与顺铂或使用顺铂与依托泊苷。所述药剂可被制备并用作组合的治疗组合物。
[0142]
热休克蛋白90是发现于许多真核细胞中的调节蛋白。已经表明hsp90抑制剂可用于治疗癌症。这样的抑制剂包括格尔德霉素(geldanamycin)、17-(烯丙基氨基)-17-去甲氧基格尔德霉素、pu-h71和利福布汀(rifabutin)。
[0143]
还设想了直接交联dna或形成加合物的药剂。可使用药剂(例如顺铂)和其他dna烷化剂。顺铂已被广泛用于治疗癌症,临床应用中使用的有效剂量为每三周20mg/m
2 5天,总共三个疗程。顺铂经口不吸收,并去因此必须通过静脉内、皮下、瘤内或腹膜内注射来递送。
[0144]
损伤dna的药剂还包括干扰dna复制、有丝分裂和染色体分离的化合物。这样的化学治疗化合物包括阿霉素(adriamycin)(也称为多柔比星(doxorubicin))、依托泊苷、维拉帕米(verapamil)、鬼臼毒素(podophyllotoxin)等。在用于治疗赘生物的临床环境中广泛使用时,这些化合物通过静脉内快速推注(bolus injection)施用,剂量对于多柔比星为每隔21天25至75mg/m2,对于依托泊苷为静脉内35至50mg/m2或者经口给药为静脉内的2倍。还预期了微管抑制剂,例如紫杉烷。这些分子是由红豆杉(taxus)属植物产生的二萜并包括紫杉醇和多西他赛(docetaxel)。
[0145]
表皮生长因子受体抑制剂,例如易瑞沙(iressa),哺乳动物雷帕霉素靶蛋白mtor(也称为fk506结合蛋白12-雷帕霉素相关蛋白1(fk506-binding protein 12-rapamycin associated protein 1,frap1)),是丝氨酸/苏氨酸蛋白激酶,其调节细胞生长、细胞增殖、细胞运动性、细胞存活、蛋白质合成和转录。因此,根据本公开内容,考虑将雷帕霉素及其类似物(“rapalogs”)用于癌症治疗。在此特别有用的另一种egfr抑制剂是吉非替尼(gefitinib)。
[0146]
另一种可能的治疗是tnf-α(肿瘤坏死因子-α(tumor necrosis factor-alpha)),其是参与全身炎症的细胞因子并且是刺激急性期反应的一组细胞因子的成员。tnf的主要作用是调节免疫细胞。tnf还能够诱导凋亡细胞死亡,诱导炎症以及抑制肿瘤发生和病毒复制。
[0147]
破坏核酸前体和亚单位的合成和保真度的药剂也导致dna损伤。因此,已经开发了许多核酸前体。特别有用的是经历广泛测试并且容易获得的药剂。因此,药剂(如5-氟尿嘧啶(5-fu))优先被赘生性组织所使用,使得这种药剂特别可用于靶向赘生性细胞。尽管具有非常大的毒性,5-fu可适用于多种载体中(包括表面),但是常用的是以3至15mg/kg/天的剂
量静脉内施用。
[0148]
造成dna损伤并且已经广泛使用的其他因素包括通常已知的γ-射线、x-射线和/或直接向肿瘤细胞递送放射性同位素。还考虑了其他形式的dna损伤因素,例如微波和uv辐照。最可能的是所有这些因素对dna、dna前体、dna的复制和修复以及染色体的组装和维持造成广泛的损伤。x射线的剂量范围为从50至200伦琴的每日剂量持续延长的一段时间(3至4周)到2000至6000伦琴的单剂量。放射性同位素的剂量范围变化很大,并且取决于同位素的半衰期、所发射的放射的强度和类型以及赘生性细胞的摄取。
[0149]
另外,还考虑了可使用不同的免疫治疗、激素治疗、毒素治疗和/或手术。
[0150]
技术人员受“remington’s pharmaceutical sciences”第15版,第33章,特别是第624至652页的指导。根据所治疗对象的病症,必然发生剂量的一些变化。在任何情况下,负责施用的人将确定个体对象的适当剂量。此外,对于人施用,制剂应符合fda生物制品标准办公室要求的无菌性、致热原性、一般安全性和纯度标准。
[0151]
v.实施例
[0152]
以下实施例部分提供了关于多个实施方案的实施例的进一步细节。本领域技术人员应理解,在随后实施例中公开的技术代表了由发明人发现的功能良好的技术和/或组合物。然而,根据本公开内容,本领域技术人员应理解,在不脱离本公开内容的精神和范围的情况下,可在所公开的具体实施方案中进行许多改变并且仍然获得相同或类似的结果。这些实施例是对本文中所述方法和系统的举例说明并且不旨在限制本公开内容的范围。这样的非限制性实例包括但不限于以下给出的那些。
[0153]
实施例1-材料和方法
[0154]
小鼠。c57bl/6j背景中的雌性c57bl/6j、balb/c、myd88-/-、tmem173-/-、batf3-/-和ot-1cd8+t细胞受体转基因小鼠和nsg-smg3小鼠购自杰克逊实验室(the jackson laboratory)。c57bl/6背景下的rag1-/-小鼠和ifn报道小鼠(ifng
tm3.1lky
/j)购自ut西南小鼠育种中心(ut southwestern mice breeding core)。ifnαr1-/-小鼠由来自芝加哥大学(university of chicago)的anita chong博士提供。所有小鼠均维持在无特定病原体的条件下。动物护理和实验根据机构和国立卫生研究院(national institutes of health)的方案和指南进行。该研究已通过德克萨斯大学西南医学中心(university of texas southwestern medical center)机构动物护理和使用委员会(institutional animal care and use committee)的批准。
[0155]
细胞系和试剂。mc38、ct26、llc a375和hct116细胞购自atcc。mc38-ova细胞通过ova基因的慢病毒转导制备。所有细胞系均使用支原体污染试剂盒(mycoplasma con-tamination kit,r&d)常规检测并在补充有10%热灭活胎牛血清、100u/ml青霉素和100u/ml链霉素的dulbecco改良的eagle培养基中在5% co2下于37℃下培养。
[0156]
抗cd4(gk1.5)、抗nk1.1(pk136)、抗cd8(53-5.8)和抗csf1r(afs98)mab购自bioxell。抗pd-l1(阿特珠单抗)和抗ctla-4(伊匹单抗)由ut西南西蒙斯癌症中心药房(ut southwestern simmons cancer center pharmacy)友情提供。6-硫代-dg购自metkinen oy。对于体外研究,将6-硫代-dg溶解在dmso/水(1:1)中以制备10mm储备溶液。对于体内研究,在5% dmso(在1
×
pbs中)中制备3mg/kg 6-硫代-dg以用于腹膜内注射。将药物在-20℃下保持冷冻直至使用。
[0157]
细胞生存力测定。为了用细胞增殖测定确定ic
50
,在96孔板中的8个不同点中用2倍稀释系列的6-硫代-dg筛选鼠和人癌细胞系。在添加药物之前24小时将细胞铺板,孵育4至5天,并根据制造商的说明(promega)使用celltiter 96aqueous单溶液细胞增殖测定(celltiter 96aqueous one solution cell proliferation assay)进行测定。每孔的细胞数为每孔1,000至10,000个细胞,与倍增时间成反比。生成剂量响应曲线并使用graphpad prism计算ic
50
。所有样品一式三份进行分析,并且标准偏差来自2至3个独立实验。
[0158]
集落形成测定。将mc38细胞以三种不同浓度接种在六孔板上(1000至4000个细胞/孔),并且每3至4天用不同的药物浓度处理。在处理13天之后,将细胞固定并用6%戊二醛(fisher scientific)加0.5%结晶紫(sigma)溶液染色。在用自来水洗涤之后,将细胞风干并使用g-box(syngene,型号:g-box f3)捕获图像。
[0159]
端粒功能障碍诱导的病灶(tif)和微核测定。tif测定使用端粒序列特异性肽核酸(peptide nucleic acid,pna)探针,基于针对dna损伤响应因子(例如γ-h2ax、53bp1)的抗体和针对端粒蛋白或端粒的抗体对dna损伤的共定位检测(mender and shay,2015)。简言之,将细胞接种到4孔室载玻片中。第二天,将细胞用1μm 6-硫代-dg处理24小时(用于tif测定)或用1至3μm 6-硫代-dg处理48小时(用于微核测定)。然后将载玻片用pbs冲洗两次,并在pbs中的4%甲醛(thermo fisher)中固定10分钟。然后,将细胞用pbs洗涤两次,并在pbs中的0.5% triton x-100中透化10分钟。透化之后,将细胞用pbs洗涤3次。将细胞用0.1%pbst(tritonx-100)中的10%山羊血清封闭1小时。将γ-h2ax(tif测定,小鼠,1:1000)(millipore)或核纤层蛋白a/c(微核测定,小鼠,1:500)(santa cruz)在封闭溶液中稀释并在细胞上孵育2小时。在用pbst(0.1%triton中的1
×
pbs)洗涤3次并用pbs洗涤3次之后,将细胞与alexaflour 568缀合的山羊抗小鼠(1:500)(invitrogen)一起孵育40分钟,然后用0.1% pbst洗涤5次。在rt下将细胞在pbs中的4%甲醛中固定20分钟。将载玻片依次用70%、90%、100%乙醇脱水,随后用含有以下的杂交缓冲液在80℃下在加热块上变性7分钟,随后在rt下过夜孵育:fam缀合的端粒序列(富含c)特异性pna探针、70%甲酰胺、30%2
×
ssc、10%(w/v)mgcl2.6h2o(fisher sci)、用于核酸杂交和检测(roche)的0.25%(w/v)阻断试剂。将载玻片依次用70%甲酰胺(ambion)/0.6
×
ssc(invitrogen)(2
×
1小时)、2
×
ssc(1
×
15分钟)、pbs(1
×
5分钟)洗涤,并用70%、90%、100%乙醇依次脱水,然后用具有dapi(vector laboratory)的vectashield封固介质进行封固(mount)。用荧光显微镜使用100
×
物镜捕获图像。使用image j对tif进行定量。
[0160]
骨髓来源的树突细胞中dna的检测。如前所述(min et al.,2019)用edu标记细胞。简言之,将100,000个mc38细胞接种至6孔板并用25μm edu标记。两天后,冲洗细胞并用1μm 6-硫代-dg处理24小时。再次冲洗细胞并与bmdc共培养过夜。第二天,用磁珠分选dc,洗涤、固定并进行细胞离心。然后在新鲜的自制edu染色溶液(含有1mm cuso4、2mm抗坏血酸的pbs)中将载玻片用6-羧基四甲基罗丹明荧光叠氮化物(invitrogen)染色30分钟。然后将载玻片用pbs剧烈洗涤持续至少1小时,并随后根据如在“端粒功能障碍诱导的病灶(tif)和微核测定”方法部分中所述,使用fam-telg探针进行端粒fish步骤。用配备有自动中期捕获系统(coolcube1相机)的axio imager z2在63
×
放大倍率下捕获图像并用isis软件(metasystems)进行分析。
[0161]
免疫fish。简言之,将5μm组织切片用二甲苯(2
×
5分钟)、100%乙醇(2
×
2分钟)、95%乙醇(1
×
2分钟)、75%乙醇(1
×
2分钟)和50%乙醇(1
×
2分钟)进行脱蜡,并随后用自来水洗涤(2
×
3分钟)。将脱蜡的组织切片在柠檬酸钠缓冲液(10mm柠檬酸钠,0.05%吐温20,ph=6.0)中在微波下孵育20分钟以回收抗原。在使组织切片冷却之后,将其用1
×
pbs冲洗5分钟并随后在95%乙醇中脱水3分钟。用含有fitc缀合的端粒序列(ttaggg)3特异性pna探针的杂交缓冲液(70%甲酰胺、30%2
×
ssc、10%(w/v)mgcl2.6h2o(fisher sci),0.25%(w/v)封闭试剂(roche))在80℃下在加热块上变性7分钟。将载玻片依次用70%甲酰胺/0.6
×
ssc(3
×
15分钟)、2
×
ssc(1
×
15分钟)、pbs(1
×
5分钟)、pbst(pbs+0.1%吐温20;1
×
5分钟)洗涤并与封闭缓冲液(pbst中的4% bsa)一起孵育30分钟。将切片在rt下在封闭缓冲液中与磷酸组蛋白h2ax抗体(1:500)(细胞信号传导)一起孵育1小时。在用pbst洗涤2
×
5分钟之后,将组织切片在rt下在封闭缓冲液中与alexaflour 568缀合的山羊抗兔一起孵育1小时。将切片依次用pbst(3
×
5分钟)和pbs(1
×
5分钟)洗涤。将载玻片用具有dapi的vectashield封固介质进行封固。用荧光素显微镜使用100
×
物镜捕获图像。使用image j对tif进行定量。
[0162]
肿瘤生长和处理。将在100μl磷酸盐缓冲盐水(pbs)中总共为5
×
105个mc38、5
×
105个ct26或1
×
106个llc细胞皮下接种到小鼠的右背侧。当肿瘤生长至约100mm3时,将荷瘤小鼠随机分成处理组。对于6-硫代-dg单一处理,在mc38肿瘤和llc肿瘤中在第7、8和9天并且对于ct26肿瘤在第5、6、7天腹膜内给予3mg/kg 6-硫代-dg。对于csf1r、nk1.1、cd4+和cd8+t细胞耗竭,在处理开始之前1天腹膜内注射200μg抗体,并随后每周两次,持续2周。对于mc38模型中的pd-l1阻断组合治疗,在第10天和第11天给予6-硫代-dg,在第13天和第17天腹膜内注射50μg pd-l1。对于llc模型中的pd-l1阻断组合治疗,在第4、5、6、10和11天给予6-硫代-dg,在第8天和第13天腹膜内注射200μg pd-l1。通过长度(a)、宽度(b)和高度(h)测量肿瘤体积并计算为肿瘤体积=abh/2。
[0163]
人源化小鼠肿瘤模型。先前描述了人源化小鼠重组(qiao et al.,2019)。简言之,在人cd34+细胞转移之前一天,用100cgy(使用x-rad320辐照器的x射线辐照)对4周龄nsg-sgm3雌性小鼠进行辐照。脐带血从ut西南帕克兰医院(ut southwestern parkland hospital)获得。通过密度梯度离心(paque plus,ge healthcare)从脐带血中纯化人cd34+细胞,随后用抗人cd34微珠(stemcell)进行阳性免疫磁性选择。1
×
105个cd34+细胞静脉内注射到每只接受体小鼠中。在移植之后12周,将具有超过50%人cd45+细胞重建的人源化小鼠和年龄和性别匹配的非人源化小鼠在右胁腹上皮下接种1
×
106个hct116肿瘤细胞。在第7、8和9天腹膜内给予3mg/kg 6-硫代-dg。每周两次测量肿瘤体积。实验是按照utsw人调查委员会协议(utsw human investigation committee protocol)和utsw机构动物护理和使用委员会(utsw institutional animal care and use committee)进行的。
[0164]
tmem173和mb21d1敲除mc38细胞系。通过crispr/cas9技术敲除mc38细胞中的tmeml73和mb21d1基因。将tmem173的指导序列5
’‑
cacctagcctcgcacgaact-3’(seq id no:1)和mb21dl的5
’‑
cgcaaaggggggctcgatcg-3’(seq id no:2)克隆到px458质粒(具有gfp选择标志物的非整合质粒)中,并随后使用lipofectamine 2000(thermo fisher)将其瞬时转染到肿瘤细胞中。24小时后,分选gfp阳性细胞并再培养一周。然后将分选的细胞接种到96孔板中。又一周后,将gfp阴性克隆转移到12孔板中,并进行western印迹以鉴定敲除克隆。
最后,将所有敲除克隆汇集在一起进行实验。
[0165]
ifn-γ酶联免疫吸附斑点测定(enzyme-linked immunosorbent spot assay,elispot)。在c57bl/6的右胁腹上皮下注射mc38肿瘤。对于6-硫代-dg单一处理,在第7、8、9天腹膜内给予3mg/kg 6-硫代-dg;对于mc38模型中的pd-l1阻断组合治疗,在第10天和第11天给予3mg/kg6-硫代-dg,在第11天腹膜内注射50μg pd-l1。在最后一次处理之后7天,收集来自荷瘤小鼠的肿瘤引流淋巴和脾并制备单细胞悬液。经辐照的mc38肿瘤细胞和对照llc肿瘤细胞可用于再刺激肿瘤特异性t细胞。将1.5
×
105个引流淋巴结细胞或脾细胞和7.5
×
104个经辐照的肿瘤细胞共培养48小时,并根据制造商的说明使用ifn-γelispot试剂盒(bd bioscience)进行elispot测定。用ctl-immunospots6分析仪(cellular technology limited)对ifn-γ斑点进行计数。
[0166]
骨髓树突细胞(bmdc)和t细胞的体外共培养。从c57bl/6小鼠的胫骨和股骨中收集骨髓(bone marrow,bm)细胞的单细胞悬液。将bm细胞置于10cm培养皿中,并用含有20ng/ml重组小鼠gm-csf(biolegend)的完全rpmi 1640培养基培养。在第3天和第6天将新鲜培养基添加到培养物中。第7天收获bmdc。用阴性cd8+t细胞分离试剂盒(stemcell)从ot-1转基因小鼠的淋巴结和脾中分离出cd8+t细胞。将mc38-ova细胞用200nm 6-硫代-dg预处理4小时。然后将药物洗掉,将肿瘤细胞继续培养72小时并在bmdc收获的同一天收获。然后将mc38-ova细胞与bmdc共培养过夜。收集上清液以用于ifn-βelisa测试(pbl)。用cd11c+阳性选择试剂盒(stemcell)分选bmdc并将其与ot-1 cd8+t细胞共培养48小时。收集上清液并通过流式微珠阵列测定(bd biosciences)测量ifn-γ。
[0167]
胞质dna提取和定量实时pcr。将hct116细胞用500nm 6-硫代-dg预处理4小时。然后将药物洗掉,将肿瘤细胞继续培养72小时并在bmdc收获的同一天收获。然后将hct116细胞与1
×
106个bmdc 1:1混合4小时。纯化bmdc并分成两个相等的等分试样。用purelink基因组dna试剂盒(invitrogen)提取一个等分试样的总基因组dna并用作标准化对照。将另一个等分试样重悬于含有150mm nacl、50mm hepes和25mg/ml洋地黄皂苷(sigma)的100μl胞质提取缓冲液中,并在rt下孵育10分钟以进行质膜透化(west et al.,2015)。然后将细胞离心以使完整细胞沉淀。收集胞质上清液并以12000g离心10分钟以沉淀剩余的细胞碎片。然后用purelink基因组dna试剂盒(invitrogen)提取胞质dna。使用人dna引物和小鼠dna引物对全细胞提取物和胞质级分进行定量pcr(xu et al.,2017)。
[0168]
肿瘤消化。切下肿瘤组织并用1mg/ml胶原酶i(sigma)和0.5mg/ml dna酶i(roche)在37℃下消化30分钟,然后将肿瘤通过70μm细胞过滤器以去除大的未消化的肿瘤块。将肿瘤浸润细胞用含有2mm edta的pbs洗涤两次。
[0169]
流式细胞术分析。将细胞的单细胞悬液与抗fcγiii/ii受体(克隆2.4g2)一起孵育15分钟以阻断非特异性结合,然后用缀合的抗体染色,并随后在4℃下在黑暗中与指定抗体一起孵育30分钟。使用可固定生存力染料eflour 506或eflour 780(ebioscience)来排除死细胞。按照制造商的说明通过使用真核转录因子缓冲液组(biolegend)对foxp3和ki67进行胞内染色。数据收集在cytoflex流式细胞仪(beckman coulter,inc)上,并通过使用flowjo(tree star inc.,ashland,or)软件进行分析。
[0170]
定量实时pcr。根据制造商的说明用以下的不同引物组使用ssoadvanced
tm universal green supermix(bio-rad)进行实时pcr:(人mt-co1,正向引物5
’‑
cgccacactccacggaagca-3’(seq id no:3),反向引物5
’‑
cggggcattccg gataggcc-3’(seq id no:4);人18s rrna,正向引物5
’‑
accgattggatggtttagtgag-3’(seq id no:5),反向引物5
’‑
cctacggaaaccttgttacgac-3’(seq id no:6);小鼠ifn-β,正向引物5
’‑
atgagtggtggttgcaggc-3’(seq id no:7),反向引物5
’‑
tgacctttcaaatgcagtagattca-3’(seq id no:8);小鼠gapdh,正向引物5
’‑
catcaagaa ggtggtgaagc-3’(seq id no:9),反向引物5
’‑
cctgttgctgtagccgtatt-3’)(seq id no:10),小鼠gapdh用作内部对照。2-δδct
法用于计算相对表达变化。
[0171]
免疫印迹。bmdc和mc38处理与“骨髓树突细胞的体外共培养”相同。在共培养6小时之后,用cd11c+阳性选择试剂盒(stemcell)分离dc。如前所述(liu et al.,2019)进行蛋白质样品制备和免疫印迹程序。用针对psting(cell signaling,72971)、sting(cell signaling,50494)、ptbk1(cell signaling,5483)、tbk1(cell signaling,3504)的兔单克隆抗体检测蛋白质。用针对亲环蛋白a(cell signaling,2175)的抗体确定蛋白上样量。抗兔(在5%bsa中为1∶2000)用于二抗(cell signaling,7074)。x-射线胶片(genemate,f-9024-8x10)用于使膜显影。clarity max western ecl底物(biorad,1705062)或supersignal west picoplus化学发光底物(thermoscientific,34577)用于化学发光western印迹。
[0172]
定量和统计分析。所有数据分析均用graphpad prism统计软件进行,并示出为平均值
±
sem。p值对于肿瘤生长由双因素anova确定或对于存活由对数秩检验确定或对于其他分析由未配对双尾t检验确定。p<0.05的值被认为具有统计学意义。
[0173]
实施例2-结果
[0174]
6-硫代-dg的治疗作用依赖于cd8+t细胞。先前的所有异种移植模型研究表明,用6-硫代-dg密集日处理超过10天可部分控制许多肿瘤模型中的肿瘤生长(mender et al.,2015a;mender et al.,2018;zhang et al.,2018)。然而,这种药物对肿瘤与适应性免疫系统之间的相互作用的潜在作用尚不清楚。为了探索6-硫代-dg是否诱导基于端粒的dna感知来用于t细胞响应,本发明人首先确定了通过6-硫代-dg对免疫活性宿主中端粒酶阳性鼠结肠癌细胞(mc38)的细胞生存力的抑制。mc38肿瘤细胞对6-硫代-dg敏感,ic
50
浓度为370nm(图1a)。还通过单独的集落形成测定确定了6-硫代-dg在mc38细胞中的敏感性。将mc38细胞每三天用6-硫代-dg处理,持续13天,导致在0.5μm 6-硫代-dg处理下少于50%的细胞形成集落(图1b和1c)。为了评价6-硫代-dg是否在体内同基因小鼠模型中降低肿瘤负荷,本发明人将mc38细胞皮下接种到免疫活性野生型(wt)c57bl/6小鼠中。在肿瘤接种之后7天(当肿瘤体积为约100mm3时),每日施用3mg/kg 6-硫代-dg,仅持续三天,并且与对照肿瘤相比肿瘤生长显著降低(图1d)。这不是对mc38肿瘤模型的独特响应,因为本发明人还在具有仅三天处理的端粒酶阳性llc(来源于c57bl/6小鼠的路易斯肺鼠癌)和ct26(来源于balb/c小鼠的结肠鼠癌)肿瘤模型中观察到体外细胞生存力抑制和体内显著的肿瘤生长延迟(图9a至9d)。
[0175]
因为与异种移植模型中的密集给药策略(每日5mg/kg,持续两周)相比,本发明人使用6-硫代-dg给出了如此短的治疗持续时间,并且在同基因小鼠模型中实现了更好的抗肿瘤作用,因此推测6-硫代-dg可在体内具有免疫刺激作用。因此,在不能产生成熟t细胞和b细胞的rag1敲除小鼠上接种肿瘤。事实上,6-硫代-dg的治疗作用被完全削弱(图1e),表明
适应性免疫细胞是体内肿瘤控制大量所需的。为了找出哪个t细胞亚群有助于6-硫代-dg介导的抗肿瘤作用,本发明人在给予6-硫代-dg处理的同时使cd4+或cd8+t细胞耗竭,并观察到了cd4+t细胞耗竭的边际影响(图1f)。然而,cd8+t细胞的耗竭完全消除了6-硫代-dg的治疗作用(图1g)。数据共同可解释为表明cd8+t细胞在6-硫代-dg处理中的重要作用。
[0176]
6-硫代-dg处理提高了肿瘤特异性t细胞响应。由于6-硫代-dg的治疗作用取决于t细胞,因此本发明人推断6-硫代-dg处理可改变肿瘤微环境中的免疫细胞扩增。为了测试这一点,在三个每日剂量的6-硫代-dg处理的最后一次之后6天,分析了肿瘤浸润淋巴细胞(til)的数量。本发明人发现在6-硫代-dg处理之后til中的cd3+t细胞和cd8+t细胞的频率提高(图2a、10a和10b)。还观察到由升高的ki67表达指示的cd8+t细胞增殖的显著上调(图2b),但treg细胞没有显著变化(图10c)。尽管肿瘤浸润性nk细胞同样增加,但本发明人并未发现nk细胞耗竭对6-硫代-dg的治疗作用的影响(图10d和10e)。连同cd8耗竭实验,这表明在6-硫代-dg介导的抗肿瘤作用中nk细胞不是必需的,但需要cd8+t细胞响应。
[0177]
通过使用允许追踪肿瘤组织中的抗原特异性t细胞的mc38-ova肿瘤模型,本发明人进一步测试了在6-硫代-dg处理之后的抗原特异性t细胞响应。事实上,在6-硫代-dg处理之后6天观察到在肿瘤中肿瘤特异性cd8+t细胞增加(图2c)。还通过在6-硫代-dg处理之后测量产生ifn-γ的t细胞而在mc38肿瘤模型中观察到增强的肿瘤特异性细胞毒性t细胞响应(图2d和2e)。为了直接评估t细胞在体内产生ifn-γ的能力,本发明人利用了允许追踪具有yfp表达的产生ifn-γ的t细胞的ifn-γyfp报道小鼠(reinhardt et al.,2009)。6-硫代-dg处理显著提高了肿瘤中的yfp+t细胞,表明t细胞的ifn-γ产生能力增强(图2f和10f)。适应性免疫应答的标志是记忆的形成,当相同的抗原出现时会启动快速的回忆响应。为了确定6-硫代-dg处理是否诱导记忆响应,在6-硫代-dg处理之后使具有完全缓解的肿瘤的小鼠休息5周,并在对侧胁腹(左胁腹)上用相同的mc38肿瘤(但具有10倍更多的肿瘤细胞)再次攻击,并且在右胁腹接种llc肿瘤细胞作为对照。当初始小鼠(从未暴露于mc38细胞或6-硫代-dg)被注射相同数量的mc38细胞时,肿瘤侵袭性地生长。值得注意的是,通过6-硫代-dg处理而治愈的所有小鼠均自发地排斥mc38肿瘤的再次攻击。
[0178]
6-硫代-dg处理增强了树突细胞的交叉致敏能力。抗原呈递细胞(antigen presenting cell,apc)例如dc或巨噬细胞的抗原交叉呈递是肿瘤特异性cd8+t细胞活化的原因。为了探索哪个apc亚群有助于6-硫代-dg诱导的t细胞活化,本发明人首先使用抗csf1r抗体来使巨噬细胞耗竭。发现6-硫代-dg在巨噬细胞耗竭组中甚至更好地发挥作用(图3a),其可通过去除免疫抑制性肿瘤相关巨噬细胞的累加作用来解释。batf3(碱性亮氨酸拉链atf样转录因子3)依赖性dc对于引发抗原特异性cd8+t细胞至关重要(broz et al.,2014;edelson et al.,2010)。batf3缺陷小鼠中的6-硫代-dg处理部分延迟了肿瘤生长,但与wt小鼠相比显著地不太有效(图3b)。值得注意的是,60%的wt小鼠完全没有肿瘤,但在batf3-/-小鼠中没有一只小鼠是无肿瘤的(图3c),表明batf3依赖性dc在6-硫代-dg的治疗作用中的重要作用。
[0179]
为了直接证明6-硫代-dg处理增强了dc的交叉致敏能力,本发明人将6-硫代-dg预处理的mc38-ova肿瘤细胞与骨髓来源的dc(bone marrow derived dc,bmdc)共培养过夜。然后纯化dc并与表达特异性识别ova
257至264
表位的tcr的初始ot-1转基因cd8+t细胞共培养。在6-硫代-dg处理组中观察到由cd8+t细胞产生的ifn-γ显著增加(图3d),这表明在6-硫
代-dg处理之后,dc的交叉致敏能力提高。因为ifn-i信号传导促进dc的交叉致敏能力(diamond et al.,2011;le bon et al.,2003;sanchez-paulete et al.,2017),因此在将dc与6-硫代-dg处理的肿瘤细胞共培养之后,本发明人测试了由dc产生的ifn-β。事实上,在6-硫代-dg处理组中,ifn-β产生显著提高,表明提高了dc的固有感知(图3e)。还探究了ifn-i途径是否是6-硫代-dg介导的抗肿瘤作用所必需的。使用ifnar1-/-小鼠,本发明人表明宿主中ifn-i信号传导的丢失消除了6-硫代-dg的抗肿瘤作用(图3f),表明了ifn-i信号传导在6-硫代-dg治疗中不可或缺的作用。
[0180]
宿主中的sting信号传导是6-硫代-dg诱导的固有感知所需的。应激下的肿瘤细胞可能会释放危险相关分子模式(danger-associated molecular pattern,damp)以参与apc中的tlr/myd88途径并启动ifn-i信号传导。肿瘤来源的dna还可触发胞质dna感知cgas/sting途径并激活ifn-i途径(deng et al.,2014;li et al.,2019)。为了进一步描述在宿主细胞中6-硫代-dg触发的ifn-i信号传导激活中哪个上游途径是必不可少的,本发明人将mc38肿瘤接种到myd88-/-和tmem173-/-(tmem173编码sting)小鼠中。6-硫代-dg处理在myd88-/-小鼠中良好控制肿瘤生长,但在tmem173-/-小鼠中完全丧失效力(图4a和4b),表明宿主sting信号传导在6-硫代-dg触发的固有感知中的至关重要的作用。还探究了6-硫代-dg处理是否激活宿主sting/ifn-i途径。观察到在与6-硫代-dg预处理的肿瘤细胞共培养之后,dc中的tbk1磷酸化提高,并且tmem173dc中的磷酸化完全减少(图11a)。6-硫代-dg处理以sting依赖性方式诱导dc中的ifn-β产生(图11b)。由于先前的研究报道了肿瘤内在sting信号传导在固有感知诱导癌症治疗中是至关重要的(sen et al.,2019;vanpouille-box et al.,2017),因此本发明人测试了肿瘤内在sting信号传导是否也有助于6-硫代-dg治疗效力。使用crispr/cas9来敲除mc38肿瘤细胞中的tmem173和mb21d1(mb21d1编码cgas)。与其他研究相比,肿瘤内在sting信号传导发挥了非必要作用,因为6-硫代-dg处理仍控制了荷有tmem173ko和mb21d1ko肿瘤细胞的小鼠的肿瘤生长(图4c和4d)。
[0181]
然后,发明人试图确定经6-硫代-dg处理的肿瘤细胞如何触发dc中的固有感知。由于6-硫代-dg是端粒靶向药物,因此6-硫代-dg诱导的端粒应激可通过释放dna有助于dc的固有感知。因此,本发明人首先通过tif(端粒功能障碍诱导的病灶)测定分析了端粒应激,并表明6-硫代-dg在mc38细胞中诱导端粒损伤(图4e和4f)。由于端粒只是基因组dna的一小部分(约1/6000),因此端粒与dna损伤的任何共定位都是显著的。还在来自荷有mc38肿瘤的小鼠的经6-硫代-dg处理的肿瘤组织中观察到类似的tif提高(图11c和11d)。6-硫代-dg还在末期期间诱导两个子细胞之间的间期桥,并且因此许多子细胞包含端粒序列,这可解释为什么当细胞在有丝分裂之后重新进入间期时,许多含有端粒的微核发出信号(图11e)。这些胞质片段形成具有脆性核包膜的微核(图11e和11f),其最终可被识别为危险信号。这些dna片段从细胞中释放出来并且可被dc吸收。
[0182]
为了证实这一假设,本发明人用6-硫代-dg处理hct116(人结肠癌细胞系)并将其与小鼠bmdc共培养4小时,并且随后分离dc并提取胞质dna。人肿瘤细胞系与小鼠bmdc的短时间共培养使得能够区分不同来源的dna。发现在6-硫代-dg处理之后,小鼠dc胞质溶胶中的人dna(mt-co1和人18s)提高,这表明来自肿瘤的dna进入了宿主dc(图4g)。为了确定6-硫代-dg处理是否提高了dc对独特端粒dna的摄取,本发明人用edu标记肿瘤细胞,然后洗涤该细胞。接下来,用6-硫代-dg处理,然后再次洗涤细胞。最后,将肿瘤细胞与dc共培养,并随后
分离dc以用于分析。在在胞质溶胶中具有肿瘤dna(edu
+
dc)摄取的dc中,本发明人观察到在6-硫代-dg处理之后端粒与edu的共定位提高,表明对肿瘤来源的端粒dna的显著摄取(图11g和11h)。总之,本发明人证明了6-硫代-dg通过激活宿主胞质dna感知sting/ifn-i途径触发固有感知。
[0183]
6-硫代-dg克服了晚期肿瘤中的pd-l1阻断抗性。虽然6-硫代-dg处理活化了cd8+t细胞,但其还在总cd8+t细胞的频率方面和每个细胞基础上上调了pd-1表达(图5a)。pd-1是限制t细胞活化的共抑制分子。在6-硫代-dg处理之后,升高的pd-1表达可最终抑制细胞毒性cd8+t细胞功能。因此,本发明人推断6-硫代-dg与pd-1/pd-l1阻断组合可增强整体抗肿瘤免疫应答,特别是在晚期肿瘤环境中,所述晚期肿瘤环境具有包含限制单一治疗效力的多种抗性机制的更具免疫抑制性的微环境。由于6-硫代-dg单一处理仅对相对较小的肿瘤尺寸(约100mm3)有效,因此对于晚期肿瘤治疗,本发明人使肿瘤尺寸达到150至200mm3,并随后用6-硫代-dg和/或抗pd-l1治疗进行处理。在这样的晚期癌症中,用6-硫代-dg进行两次日处理或通过用抗pd-l1进行两次处理难以控制肿瘤体积(图5b)。然而,顺序施用6-硫代-dg和抗-pd-l1完全抑制了肿瘤生长(图5b)。值得注意的是,只有组合处理组中的小鼠达到了100%存活率(图5c),表明了6-硫代-dg处理与pd-l1阻断的协同作用。另外,本发明人在组合处理组中没有观察到小鼠的任何体重减轻(图12)。还分析了在引流淋巴结(draining lymph node,dln)中的肿瘤特异性t细胞响应,并发现抗pd-l1处理对晚期肿瘤中的t细胞活化几乎没有影响。相反,与其他组相比,组合治疗显著提高了ifn-γ产生。免疫应答是mc38肿瘤特异性的,因为在对照llc肿瘤刺激组中几乎没有ifn-γ斑点(图5d)。
[0184]
已知mc38是免疫原性肿瘤模型。为了测试组合治疗是否还可以克服免疫原性较低的肿瘤模型中的pd-l1阻断抗性,本发明人采用了已被报道对pd-l1阻断具有抗性的小鼠llc肿瘤模型(bullock et al.,2019;li et al.,2017)。与之前的报道一致,用抗pd-l1进行的单一治疗没有治疗作用(图5e)。值得注意的是,6-硫代-dg与抗pd-l1的组合显著降低了小鼠肿瘤负荷,并且40%的小鼠最终完全排斥肿瘤(图5e)。本发明人在肿瘤消退之后6周再次攻击无肿瘤小鼠以检查记忆响应。所有经组合处理的小鼠均自发地排斥llc肿瘤,但不排斥mc38肿瘤,表明了持久的肿瘤特异性免疫记忆(图5f)。基于这些结果,6-硫代-dg处理克服了晚期肿瘤中的pd-l1阻断抗性。这将潜在地使临床中的pd-1/pd-l1阻断抗性患者受益。
[0185]
6-硫代-dg在人源化小鼠模型中降低了人结肠癌负担。先前的研究表明,高tert(端粒酶的催化亚基)表达患者在多种癌症(例如非小细胞肺癌和b细胞慢性淋巴细胞白血病)中的临床结果较差(terrin et al.,2007;wang et al.,2002)。因此,本发明人分析了来自tcga数据库的结直肠腺癌患者,并发现与具有低tert表达的结肠癌患者相比,具有异常高tert表达的患者具有显著更差的总存活率(图6a)。为了在临床更相关的模型中直接表明6-硫代-dg诱导的端粒应激是否可使癌症患者受益,本发明人用nsg-sgm3小鼠开发了人源化小鼠模型,所述小鼠具有人scf-1、gm-csf和il-3转基因表达,支持人髓样细胞的更好的发育。在nsg-sgm3小鼠中用人cd34+造血干细胞(hematopoietic stem cell,hsc)重建了人免疫系统。在hsc转移之后12周,在循环中的人cd45+细胞中,人源化小鼠具有平均超过60%的人cd45+细胞和超过20%的人t细胞(图13a至13c)。然后,本发明人将hct116(对6-硫代-dg处理敏感的人结肠癌细胞系,ic
50
为0.73μm(图6b))接种到nsg-sgm3对照小鼠和人源
et al.,2017;kroemer et al.,2013)。此外,这些密集给药策略通常会导致肿瘤抗性机制的出现。在本研究中,发明人利用具有完整免疫系统的同基因小鼠模型和具有更多临床相关性的人源化小鼠模型来充分评价6-硫代-dg的较低剂量和较短处理方案对荷瘤小鼠中宿主免疫应答的影响。6-硫代-dg是免疫刺激药物的这一发现可允许设计更好的组合治疗(包括免疫治疗)以扩大初始免疫。
[0191]
越来越多的研究表明,肿瘤dna介导的固有感知对于诱导抗肿瘤免疫应答至关重要,并且sting/ifn i途径主要参与抗肿瘤免疫应答的启动,但究竟是宿主自主sting更重要还是肿瘤自主sting更重要取决于不同的治疗方案(deng et al.,2014;li et al.,2019;qiao et al.,2017;sen et al.,2019;vanpouille-box et al.,2017;woo et al.,2014)。这种差异可能由宿主与肿瘤细胞的相对sting激活强度来解释,例如,肿瘤细胞可具有sting途径抑制或低活性(xia et al.,2016)。本发明人表明,6-硫代-dg处理触发的固有感知是宿主sting信号转导依赖性的,因为6-硫代-dg在tmem173缺陷型小鼠中完全丧失其效力,但在tmem173缺陷型肿瘤中则没有。由于sting信号传导活跃于mc38肿瘤中,一种解释是在6-硫代-dg处理之后,肿瘤内在sting被激活但大多数肿瘤细胞死亡,因此可产生很少的i型ifn。另一种可能性是,可能存在限制肿瘤细胞中的sting活化的内在机制,这仍是定义不明确的。最近的报道表明,sting信号传导也可参与自噬活化,这不太可能有助于6-硫代-dg的治疗作用(gui et al.,2019;nassour et al.,2019),因为本发明人在6-硫代-dg处理之后没有看到肿瘤细胞中自噬的活化(数据未显示)。此外,6-硫代-dg在ifnar1缺陷小鼠中丧失效力,表明ifn i信号传导的参与。然而,自噬的sting活化是不依赖ifn i信号传导的。
[0192]
与一般的dna损伤诱导方法(例如在所有增殖细胞中非选择性诱导dna损伤的放射治疗或化学治疗)相比,6-硫代-dg的一个独特特征是在表达端粒酶的细胞(主要是肿瘤细胞)中特异性诱导端粒相关的dna损伤,但不影响免疫细胞和其他端粒酶沉默体细胞。重要的是,6-硫代-dg可优先并入到从头合成的端粒中并导致快速的肿瘤收缩。然而,直接端粒酶抑制剂通过抑制端粒酶活性发挥作用,并依赖于端粒的逐渐缩短。相反,无论初始端粒长度如何,6-硫代-dg都能迅速发挥作用。与直接端粒酶抑制剂相比,这在降低毒性方面是至关重要的(gryaznov et al.,2007;mender et al.,2015b)。本发明人表明,6-硫代-dg诱导的dna损伤与端粒显著共定位,表明形成端粒功能障碍诱导的病灶(tif)。端粒仅占基因组dna的1/6000,因此任何tif均是高度显著的。此外,一些tif被dc摄取并进一步触发sting依赖性ifn i信号传导。
[0193]
尽管检查点阻断(尤其是pd-1/pd-l1阻断)具有压倒性成功,但在临床中,只有少数患者响应良好。原发性抗性和适应性抗性二者均限制了pd-1/pd-l1治疗的临床益处(chen and han,2015;gide et al.,2018;zaretsky et al.,2016;zou et al.,2016)。本发明人认为,缺乏适当的固有感知可限制肿瘤微环境内的t细胞活化,因此迫切需要靶向固有免疫细胞和适应性免疫细胞二者的组合治疗。pd-l1阻断通过“松开刹车(releasing the brake)”重新激活适应性免疫应答,而6-硫代-dg通过“添加燃料(adding fuel)”诱导固有感知。本发明人假设6-硫代-dg与pd-l1阻断的组合将增强总体的抗肿瘤免疫应答。事实上,该研究表明,6-硫代-dg和抗pd-l1的顺序施用在晚期肿瘤和pd-l1阻断抗性肿瘤中具有协同作用。应针对最佳组合方案进行进一步研究。
response.science 364,485-491.
[0229]
mceachern,m.j.,and blackburn,e.h.(1996).cap-prevented recombination between terminal telomeric repeat arrays(telomere cpr)maintains telomeres in kluyveromyces lactis lacking telomerase.genes&development 10,1822-1834.
[0230]
mender,i.,gryaznov,s.,dikmen,z.g.,wright,w.e.,and shay,j.w.(2015a).induction of telomere dysfunction mediated by the telomerase substrate precursor 6-thio-2
′‑
deoxyguanosine.cancer discov 5,82-95.
[0231]
mender,i.,gryaznov,s.,and shay,j.w.(2015b).a novel telomerase substrate precursor rapidly induces telomere dysfunction in telomerase positive cancer cells but not telomerase silent normal cells.oncoscience 2,693-695.
[0232]
mender,i.,laranger,r.,luitel,k.,peyton,m.,girard,l.,lai,t.p.,batten,k.,cornelius,c.,dalvi,m.p.,ramirez,m.,et al.(2018).telomerase-mediated strategy for overcoming non-small cell lung cancer targeted therapy and chemotherapy resistance.neoplasia 20,826-837.
[0233]
mender,i.,and shay,j.w.(2015).telomere dysfunction induced foci(tif)analysis.bio-protocol 5.
[0234]
min,j.,wright,w.e.,and shay,j.w.(2019).clustered telomeres in phase-separated nuclear condensates engage mitotic dna synthesis through blm and rad52.genes dev 33,814-827.
[0235]
morin,g.b.(1989).the human telomere terminal transferase enzyme is a ribonucleoprotein that synthesizes ttaggg repeats.cell 59,521-529.
[0236]
nakamura,t.m.,morin,g.b.,chapman,k.b.,weinrich,s.l.,andrews,w.h.,lingner,j.,harley,c.b.,and cech,t.r.(1997).telomerase catalytic subunit homologs from fission yeast and human.science 277,955-959.
[0237]
nassour,j.,radford,r.,correia,a.,fuste,j.m.,schoell,b.,jauch,a.,shaw,r.j.,and karlseder,j.(2019).autophagic cell death restricts chromosomal instability during replicative crisis.nature 565,659-663.
[0238]
pitt,j.m.,kroemer,g.,and zitvogel,l.(2017).immunogenic and non-immunogenic cell death in the tumor microenvironment.adv exp med biol 1036,65-79.
[0239]
qiao,j.,liu,z.,dong,c.,luan,y.,zhang,a.,moore,c.,fu,k.,peng,j.,wang,y.,ren,z.,et al.(2019).targeting tumors with il-10 prevents dendritic cell-mediated cd8(+)t cell apoptosis.cancer cell 35,901-915 e904.
[0240]
qiao,j.,tang,h.,and fu,y.x.(2017).dna sensing and immune responses in cancer therapy.curr opin immunol 45,16-20.
[0241]
reinhardt,r.l.,liang,h.e.,and locksley,r.m.(2009).cytokine-secreting follicular t cells shape the antibody repertoire.nat immunol 10,385-393.
[0242]
ribas,a.,hamid,o.,daud,a.,hodi,f.s.,wolchok,j.d.,kefford,r.,joshua,
telomere dysfunction prolongs disease control of therapy-resistant melanoma.clin cancer res 24,4771-4784.
[0265]
zhang,x.,shi,h.,wu,j.,zhang,x.,sun,l.,chen,c.,and chen,z.j.(2013).cyclic gmp-amp containing mixed phosphodiester linkages is an endogenous high-affinity ligand for sting.molecular cell 51,226-235.
[0266]
zijlmans,j.m.,martens,u.m.,poon,s.s.,raap,a.k.,tanke,h.j.,ward,r.k.,and lansdorp,p.m.(1997).telomeres in the mouse have large inter-chromosomal variations in the number of t2ag3 repeats.proceedings of the national academy of sciences of the united states of america 94,7423-7428.
[0267]
zou,w.,wolchok,j.d.,and chen,l.(2016).pd-l1(b7-h1)and pd-1pathway blockade for cancer therapy:mechanisms,response biomarkers,and combinations.sci transl med 8,328rv324.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1