一种含有组织型纤溶酶原激活剂改构体的药物组合物及其制备方法与流程
1.本发明涉及生物医药技术领域,尤其是涉及一种含有组织型纤溶酶原激活剂改构体的药物组合物及其制备方法。
背景技术:
2.血栓性疾病是临床上常见且重要的疾病,具有患病率、致残率、病死率均高的特点,严重危害人类健康,分为静脉血栓性疾病和动脉血栓性疾病两类。动脉血栓性疾病以缺血性心脏病和缺血性中风为主,静脉血栓性疾病(venous thromboembolism,vte)以深静脉血栓(deep-vein thrombosis,dvt)和肺栓塞(pulmonary embolism,pe)为主。血栓性疾病的发病率与年龄密切相关,45岁后发病率明显上升,并且有明显的性别倾向,男性高于女性。最新全球疾病负担(global burden of disease study,gbd)研究显示,血栓栓塞性疾病为全球死亡病因之首,占全球总死亡人数的1/4。
3.组织型纤溶酶原激活剂改构体(替奈普酶,tnk-tpa)是人体内天然存在的蛋白组织型纤溶酶原激活剂(t-pa)的改构体,是一种由527个氨基酸组成的糖蛋白,属于第三代基因重组溶栓药,具有安全、高效、使用方便的特点,临床上广泛用于急性心肌梗死、急性缺血性卒中的溶栓治疗。在溶纤过程中组织型纤溶酶原激活剂改构体(tnk-tpa)分子被切割,形成活性更高的双链分子,弥补纤溶系统中t-pa的不足,将纤溶酶原转化成纤溶酶,纤溶酶进一步将纤维蛋白降解为可溶性片段使血栓溶解。单链含量与药物组合的安全性有关,单链含量越高在溶栓过程中出血风险越低,安全性越好。
4.但是组织型纤溶酶原激活剂改构体(tnk-tpa)属于生物大分子,具有天然的不稳定性,现有技术中以此制备的药物组合物中在长期储存后其中的组织型纤溶酶原激活剂改构体的活性以及单链含量下降严重,因此,有必要提供一种新的技术方案以克服上述缺陷。
技术实现要素:
5.本发明的目的在于提供一种含有组织型纤溶酶原激活剂改构体的药物组合物,并进一步的提供了一种用于制备该药物组合物的方法。
6.为达到本发明之目的,采用如下技术方案:
7.一种含有组织型纤溶酶原激活剂改构体的药物组合物,该药物组合物由如下组分原料制成:替奈普酶15~30mg/瓶、精氨酸200~215mg/瓶、磷酸65~75mg/瓶、注射用水2~6mg/瓶、聚山梨酯20 1.2~2.0mg/瓶。
8.优选的,该药物组合物由如下组分原料制成:替奈普酶20mg/瓶、精氨酸209.5mg/瓶、磷酸71.2mg/瓶、注射用水4mg/瓶、聚山梨酯20 1.64mg/瓶。
9.优选的,该药物组合中,替奈普酶的单链含量>65%。
10.优选的,该药物组合物的储存温度为2~8℃。
11.优选的,该药物组合物的制备方法如下:
12.s1:用磷酸将注射用水ph调至7.5~8.5,而后用0.22um滤器过滤,得到半成品缓冲液;
13.s2:用半成品缓冲液将替奈普酶稀释至5.5mg/ml,而后用0.22μm的滤器除菌,得到半成品,并进行灌装;
14.s3:灌装完成后,用药用真空冷冻干燥机进行冻干,即得到所述药物组合物。
15.优选的,所述步骤s3中冻干的步骤如下:
16.将药用真空冷冻干燥机的冷凝器的温度保持在≤-45℃,190分钟后,运行真空泵,真空度控制在0.09~0.25mbar,进入冻干程序对灌装完成的产品依次进行一次干燥、二次干燥。
17.优选的,所述冻干的步骤中,进行一次干燥的温度为-25℃~-5℃,时间为3000~3200min。
18.优选的,所述冻干的步骤中,进行二次干燥的温度为0~30℃,时间为900~1100min。
19.与现有技术相比,本发明具有如下有益效果:
20.本发明所采用的配料以及制备方法,有效的解决了现有技术中以组织型纤溶酶原激活剂改构体制备的药物组合物在长期存放后活性下降的问题,在经过长期试试储存后,仍具备较高的活性以及单链含量。
具体实施方式
21.为了使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的部分实施例,而不是全部实施例。
22.本发明提供的一种含有组织型纤溶酶原激活剂改构体的药物组合物,该药该药物组合物由如下组分原料制成:替奈普酶15~30mg/瓶、精氨酸200~215mg/瓶、磷酸65~75mg/瓶、注射用水2~6mg/瓶、聚山梨酯20 1.2~2.0mg/瓶。该药物组合物的储存温度为2~8℃。
23.基于上述组分原料,本发明还提供了一种用于制备上述药物组合物的方法;步骤如下:
24.s1:用磷酸将注射用水ph调至7.5~8.5,而后用0.22um滤器过滤,得到半成品缓冲液;
25.s2:用半成品缓冲液将替奈普酶稀释至5.5mg/ml,而后用0.22μm的滤器除菌,得到半成品,并进行灌装;
26.s3:灌装完成后,用药用真空冷冻干燥机进行冻干,即得到所述药物组合物;具体的,冻干的步骤如下:
27.将药用真空冷冻干燥机的冷凝器的温度保持在≤-45℃,190分钟后,运行真空泵,真空度控制在0.09~0.25mbar,进入冻干程序对灌装完成的产品依次进行一次干燥、二次干燥;其中一次干燥的温度为-25℃~-5℃,时间为3000~3200min;进行二次干燥的温度为0~30℃,时间为900~1100min。
28.实施例1
29.一种含有组织型纤溶酶原激活剂改构体的药物组合物,该药该药物组合物由如下组分原料制成:替奈普酶15mg/瓶、精氨酸200mg/瓶、磷酸65mg/瓶、注射用水2mg/瓶、聚山梨酯20 1.2mg/瓶。
30.该药物组合物的制备方法如下:
31.s1:用磷酸将注射用水ph调至7.5~8.5,而后用0.22um滤器过滤,得到半成品缓冲液;
32.s2:用半成品缓冲液将替奈普酶稀释至5.5mg/ml,而后用0.22μm的滤器除菌,得到半成品,并进行灌装;
33.s3:灌装完成后,用药用真空冷冻干燥机进行冻干,即得到所述药物组合物;具体的,冻干的步骤如下:
34.将药用真空冷冻干燥机的冷凝器的温度保持在≤-45℃,190分钟后,运行真空泵,真空度控制在0.09~0.25mbar,进入冻干程序对灌装完成的产品依次进行一次干燥、二次干燥;其中一次干燥的温度为-25℃~-5℃℃,时间为3000min;进行二次干燥的温度为0~30℃,时间为900min。
35.实施例2
36.一种含有组织型纤溶酶原激活剂改构体的药物组合物,该药该药物组合物由如下组分原料制成:替奈普酶20mg/瓶、精氨酸209.5mg/瓶、磷酸71.2mg/瓶、注射用水4mg/瓶、聚山梨酯20 1.64mg/瓶。
37.该药物组合物的制备方法如下:
38.s1:用磷酸将注射用水ph调至7.5~8.5,而后用0.22um滤器过滤,得到半成品缓冲液;
39.s2:用半成品缓冲液将替奈普酶稀释至5.5mg/ml,而后用0.22μm的滤器除菌,得到半成品,并进行灌装;
40.s3:灌装完成后,用药用真空冷冻干燥机进行冻干,即得到所述药物组合物;具体的,冻干的步骤如下:
41.将药用真空冷冻干燥机的冷凝器的温度保持在≤-45℃,190分钟后,运行真空泵,真空度控制在0.09~0.25mbar,进入冻干程序对灌装完成的产品依次进行一次干燥、二次干燥;其中一次干燥的温度为-25℃~-5℃℃,时间为3120min;进行二次干燥的温度为0~30℃,时间为1000min。
42.实施例3
43.一种含有组织型纤溶酶原激活剂改构体的药物组合物,该药该药物组合物由如下组分原料制成:替奈普酶30mg/瓶、精氨酸215mg/瓶、磷酸75mg/瓶、注射用水6mg/瓶、聚山梨酯20 2.0mg/瓶。
44.该药物组合物的制备方法如下:
45.s1:用磷酸将注射用水ph调至7.5~8.5,而后用0.22um滤器过滤,得到半成品缓冲液;
46.s2:用半成品缓冲液将替奈普酶稀释至5.5mg/ml,而后用0.22μm的滤器除菌,得到半成品,并进行灌装;
47.s3:灌装完成后,用药用真空冷冻干燥机进行冻干,即得到所述药物组合物;具体
的,冻干的步骤如下:
48.将药用真空冷冻干燥机的冷凝器的温度保持在≤-45℃,190分钟后,运行真空泵,真空度控制在0.09~0.25mbar,进入冻干程序对灌装完成的产品依次进行一次干燥、二次干燥;其中一次干燥的温度为-25℃~-5℃℃,时间为3200min;进行二次干燥的温度为0~30℃,时间为1100min。
49.对比例
50.tnkasetm,市售。
51.分别对实施例2以及对比例的药物进行检测,检测项目包括蛋白浓度、ph值、蛋白活性、单链含量、hplc纯度,结果如下表1所示。
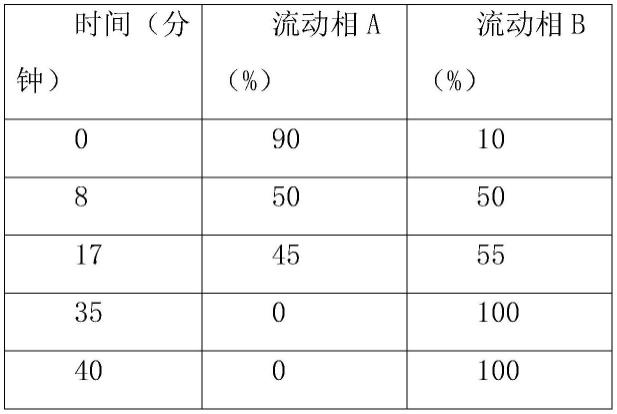
52.其中,蛋白浓度的检测方法参照中国药典2020版通则(0731)第四法(bca法)。
53.ph测定方法参照中国药典2020版通则(0731)第四法(bca法)。
54.蛋白活性测定方法,采用气泡裂解法测定。
55.本公开中单链含量测定依现行《中华人民共和国药典》(通则0512)法测定;用高效液相色谱法测定单链的含量。
56.hplc纯度的测定依现行《中华人民共和国药典》(通则0512)法测定。色谱柱采用辛基硅烷键合硅胶为填充剂,孔径粒度5μm,直径4.6mm,长25cm;以a相(0.1%三氟乙酸溶液)、b相(0.1%三氟乙酸的乙腈溶液)为流动相,在室温条件下,进行梯度洗脱。进样量20ul,在波长280nm处检测,以tnk-tpa色谱峰计算理论板数应不低于2000。按面积归一化法计算,替奈普酶单体主峰面积应不低于总面积的95.0%。
57.梯度洗脱程序:
[0058][0059]
表1实施例2和对比例的药物组合物在2~8℃下储存36个月后质量属性(cqa)变化结果
[0060][0061]
所述对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1