转基因干细胞及其用于治疗失眠症或睡眠障碍的用途的制作方法
ofevidence.drug saf.2016;39(2):93
–
107)。此外,一些研究表明,在患者死亡前几周,苯二氮卓类药物或其他催眠药物的使用量有所增加,这表明这些药物可能会导致严重的不良反应。因此,目前临床上迫切需要开发出新型的治疗失眠症的疗法或药物,在保持有效性的同时,尽可能降低毒副作用。
6.近年来干细胞治疗成为了用于疾病基础研究和临床治疗的新型工具,其中间充质干细胞(mesenchymal stem cells,mscs)是一类多能干细胞,具有较强的自我复制、更新能力和多向分化能力,在特定条件下可分化为神经细胞,因而被应用于多种神经相关疾病的治疗,失眠症也是其应用场景之一。王亚莉等(王亚莉等,静脉输注人脐带间充质干细胞治疗慢性失眠的临床观察,中国临床心理学杂志.2017,25(02):378-385)选择慢性失眠病人39例,随机分为移植组19例,对照组20例,移植组给予人脐带间充质干细胞移植治疗1次,对照组采用阿普唑仑口服1月,两组患者均采用sf-36健康调查简表和匹兹堡睡眠质量指数来评价临床疗效,两组患者均随访观察12个月;发现细胞移植组患者在细胞移植治疗后1个月生活质量评分和睡眠质量评分明显好于治疗前,并在后续的随访中持续好于治疗前;对照组口服阿普唑仑治疗后2周睡眠质量评分即开始明显好于治疗前,但治疗后3个月患者的生活质量及睡眠质量评分出现下降,且同治疗前无差异,并持续到随访结束;两组比较发现,治疗后2周,对照组的睡眠质量评分明显高于移植组,治疗后1个月两组睡眠质量和生活质量评分无差异,治疗后2个月细胞移植组的睡眠质量评分明显好于对照组,并持续到随访结束。治疗后3个月移植组的生活质量评分明显好于对照组,并持续到随访结束;阿普唑仑停药后对照组患者有80%出现失眠症状的反弹,而细胞移植组患者经一次治疗患者的睡眠质量和生活质量改善作用可持续12个月,并且无明显不良反应。boika等在研究骨髓mscs对帕金森病的治疗作用中发现,移植mscs可降低睡眠障碍的严重程度(aliaksandr boika et al,mesenchymal stem cells in parkinson’s disease:motor and nonmotor symptoms in the early posttransplant period,surg neurol int.2020;11:380)。邹邦银等(cn110791476)、王宁等(cn111759863)也分别就干细胞治疗失眠症的技术方案申请了中国专利,用于保护mscs治疗失眠症的技术。尽管mscs治疗失眠症取得了进步,但是仍面临疗效不稳定,给药困难等困境,故该疗法仍需进一步优化。
7.神经生长因子(nerve growth factor,ngf)是神经营养因子家族中第一个被发现的成员,1950年代初期,r.levi-montalcini开始对实验动物和分离细胞进行开创性研究,重点关注ngf的生物作用,研究表明,ngf不仅在退化的周围神经细胞的存活中具有保护作用,而且在调节交感和感觉神经细胞的神经递质和神经肽合成方面也具有保护作用(shooter e.m.early days ofthe nerve growth factor proteins.annu.rev.neurosci.2001;24:601
–
629)。外源性ngf给药会影响神经元的可塑性,使成人神经系统能够根据刺激改变其结构和功能,此外还证明了成人组织中ngf的组成型合成与周围神经系统(pns)神经元表型特征相关,例如神经支配密度、细胞体大小、轴突末端发芽、树突生长、神经肽的诱导和/或抑制和神经递质或产生递质的酶。ngf在睡眠调控中也发挥重要作用,有研究表明神经生长因子是一些已被证明可以增强睡眠的细胞因子(kuem sun han,et al,stress and sleep disorder,exp neurobiol.2012dec;21(4):141
–
150),但是这一作用又似乎是有争议的,因为ngf还可以增强人体对疼痛的敏感程度,从而干扰睡眠过程。为此,有研究人员试图通过基因突变的方式改造ngf,在保留ngf对中枢
神经系统和周围神经系统营养作用、促进、修复作用的同时,降低其对疼痛的增敏程度,如cn108314723a、cn107286233a等都在这方面做出了有益的尝试。
8.为改善对失眠症的治疗效果,本发明中提供了一种经过改造的间充质干细胞,该细胞来源于骨髓组织,并携带有经过基因改造的神经生长因子基因,能够在体内有效分泌所述神经生长因子,促进神经细胞的增殖和损伤后修饰,加之干细胞本身具有的神经保护及修复、免疫调节、影响睡眠-觉醒相关神经递质等功能,使得该疗法能够有效延长睡眠时间,改善睡眠质量,调节细胞因子分泌,全面抑制失眠不良影响,同时该方法不具有明显成瘾性和戒断反应,毒副作用较低,为失眠症的治疗提供了新的方向。
技术实现要素:
9.为解决上述技术问题,本发明中提供了一种用于治疗失眠症的药物组合物,所述药物组合物包括经过基因修饰的干细胞,所述干细胞中含有编码氨基酸序列如seq id no:2所示的神经生长因子突变体的多核苷酸。
10.神经生长因子是一种对神经系统具有广泛调节作用的因子,既具有神经修复作用,又能够促进神经递质,还能够提高疼痛敏感性,因此使用天然ngf治疗失眠的效果欠佳;本发明中根据已有研究成果,结合神经生长因子的结构特点,创造性地对神经生长因子进行定点突变,以便降低其致疼痛或疼痛敏感性,进而开发治疗失眠症的药物。
11.进一步的,所述神经生长因子突变体的核苷酸序列如seq id no:3所示。
12.进一步的,所述干细胞为间充质干细胞。
13.进一步的,所述间充质干细胞为骨髓间充质干细胞、脐带间充质干细胞和/或脂肪间充质干细胞。
14.进一步的,所述间充质干细胞为骨髓间充质干细胞,其制备方法包括:将人骨髓血放入洁净无菌离心管中,加入人淋巴细胞分离液,使用密度梯度离心法分离人骨髓间充质干细胞;将所述干细胞接种于含有10%fbs的dmem/f12培养基中,37℃、5%co2、饱和湿度培养,培养72h后更换培养液,并弃取悬浮的非贴壁细胞,以后每两或三天换液1次;倒置相差显微镜下观察细胞生长状态,当细胞融合度达到80%以上时进行传代培养;用流式细胞仪检测细胞cd44、cd90、cd34表面抗原表达,筛选获得高纯度的人骨髓间充质干细胞
15.进一步的,编码神经生长因子突变体的多核苷酸导入干细胞的方法包括:构建携带所述神经生长因子突变体多核苷酸的重组慢病毒载体,按照细胞/病毒1:10比例加入重组慢病毒载体,37℃、5%co2、饱和湿度培养12h,弃去细胞培养液,无菌pbs洗涤三次,加入0.25%胰酶,37℃消化5min,加入含血清的完全培养基终止消化,1000rpm离心5min收集细胞。
16.本发明中选用间充质干细胞携带ngf基因,所述间充质干细胞具有睡眠调节作用,还能够突破血脑屏障,在中枢神经系统中发挥治疗作用,进而显著改善睡眠状况,提高睡眠质量。
17.进一步的,所述药物组合物还包括药用载体、辅料或稀释剂。
18.提供了一种所述用于治疗失眠症的药物组合物在制备用于治疗失眠症药物中的用途。
19.进一步的,所述失眠症包括急性失眠、亚急性失眠和慢性失眠。
20.有益效果
21.本技术提供了一种用于治疗失眠症或睡眠障碍的药物或药物组合物,具有以下优势:
22.(1)对ngf氨基酸序列进行定点突变,提高神经修复能力,同时降低致疼痛功能;
23.(2)以间充质干细胞为基础构建抗失眠药物,能够持续而有效的提高睡眠质量,改善睡眠状况;
24.(3)对间充质干细胞进行基因改造,使其携带有突变的ngf基因,可在体内发挥长效作用。
附图说明
25.图1:mwt实验;
26.图2:ngf突变体促细胞增殖能力;
27.图3:睡眠时间检测;
28.图4:da表达水平;
29.图5:5-ht表达水平;
30.图6:gaba表达水平。
具体实施方式
31.以下非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何形式限制本发明。凡基于本发明上述内容所实现的技术均应当属于本技术要求保护的范围之中。
32.以下实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂生物材料、检测试剂盒,如无特殊说明,均可从商业途径获得。
33.实施例1神经生长因子突变体设计和筛选
34.1.1神经生长因子突变体设计和获得
35.神经生长因子包含α、β、γ三个亚单位,β亚单位是活性区,由两条单链通过非共价键结合而成,天然ngf的氨基酸序列如seq id no:1所示。ngf使用过程中会引起较严重的疼痛,部分病人无法耐受,导致其临床使用受限,尤其是在治疗失眠症的过程中,ngf所介导的严重疼痛反应或疼痛敏感效应,可能引起适得其反的效果,故需要采取适当手段对其进行“钝化”处理。现有技术中已经提出使用点突变方式,降低ngf的致痛作用,如cn112409471a提出d30n、t27e、k34a、e35a及i31n等点突变可抑制疼痛,cn108314723a提出r100 w/e/p可缓解疼痛,cn102911265a、cn102898514a等则提出缺失c端或n端部分氨基酸可提高ngf的稳定性,在上述研究基础上,本技术创造性的提出了新的突变位点或位点组合,以便缓解疼痛,提高ngf活性,具体如表1所示。所示突变体采用crispr技术进行定点突变,将相关基因导入大肠杆菌表达载体后,经阳离子交换色谱纯化获得ngf突变体蛋白,具体操作步骤按已知成熟蛋白质制备和分离纯化方法进行。
36.表1 ngf突变体设计
37.突变体名称突变设计ngf-m01k32p,e35s,q96t
ngf-m02d30e,k34h,r100wngf-m03k32g,v87p,r100s,
△
c5ngf-m04k32w,a89t,,r100sngf-m05i31s,k34v,a89nngf-m06i31p,e35p,r103p,
△
n3ngf-m07k34e,v87h,r100f,
△
n3
38.1.2神经生长因子突变体的疼痛敏感实验
39.选择体重为250-300g的清洁级雄性sd大鼠,大鼠饲养室内温度(23
±
1)℃,12h照明/12h黑暗,饲喂一周适应环境后进行动物实验。本实施例中采用机械痛敏法检测ngf突变体对疼痛的敏感效应。
40.大鼠足底分别注射1μg ngf及其突变体,实验当天记为第0天,分别在第0天、第3天和第6天检测机械刺激缩足反射阈值(mechanical withdrawal threshold,mwt)。将大鼠置于底部为铁丝网的塑料笼中,适应30min后,采用vonfrey细针丝刺激大鼠右后足趾面,每次持续刺激4-6s,每次刺激最小间隔2min。以细针丝出现肉眼可见的稍微弯曲为完全受力标准,当大鼠出现快速缩足时为阳性反应,记录此时刺激力度,计算大鼠的mwt(g),每只大鼠测试5次取平均值。结果如图1所示,经过点突变后,使得大鼠的疼痛敏感度有不同程度的变化,其中m03、m04和m05突变体的疼痛感明显降低,而其余突变体在降低疼痛感方面无显著改善,甚至m07突变体的敏感程度高于天然ngf。
41.1.3神经生长因子突变体的促细胞增殖实验
42.pc12是一种常用的神经细胞株,在代谢方式和生理特性上与体内神经细胞具有高度相似性,且相对于原代培养的神经细胞更易获取和培养,故本实施例中选用pc12细胞验证ngf突变体的促细胞增殖作用。
43.复苏并培养pc12细胞(购自atcc),待细胞融合率达90%时,传代培养。收集细胞,使用培养基重悬细胞,调节细胞密度至5x106个/ml,然后将其接种于96孔板中,每孔100μl,37℃、5%co2、饱和湿度培养12h后,分别加入50μg/ml的ngf突变体和野生型ngf,并设置调零孔和空白对照孔(等量细胞培养基),每组3个复孔。处理24h后,每孔加入10μl mtt溶液和90μl基础培养基,继续培养4h后,加入dmso溶解液,摇床摇匀10min。在490nm处检测吸光度(od值),计算细胞活力,细胞活力(%)=[a(加药)-a(调零)]/[a(空白对照)-a(调零)]
×
100%。
[0044]
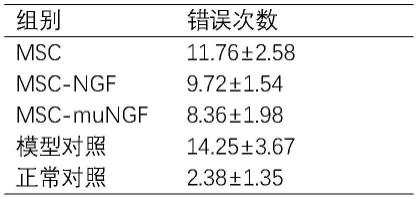
如图2所示,加入ngf后,pc12的增殖活性得到增强,但是各个突变体的促增殖能力展现了不同的变化趋势,其中m03和m05的促增殖能力较强,而m02、m04、m06、m07的促增殖能力与天然ngf相比无显著差异,m01的促增殖活性却有明显下降。
[0045]
综上,本发明中选择疼痛敏感性低,且促神经细胞增殖活性较强的m03突变体进行后续实验。
[0046]
实施例2基因修饰干细胞的制备
[0047]
2.1骨髓间充质干细胞的提取
[0048]
取人骨髓血(来源于5名健康成年人,平均年龄35岁),将所述骨髓血放入洁净无菌离心管中,加入10ml人淋巴细胞分离液(购自北京索莱宝科技有限公司),使用密度梯度离心法分离人骨髓间充质干细胞。将所述干细胞接种于含有10%fbs的dmem/f12培养基中,37
℃、5%co2、饱和湿度培养,培养72h后更换培养液,并弃取悬浮的非贴壁细胞,以后每两或三天换液1次。倒置相差显微镜下观察细胞生长状态,当细胞融合度达到80%以上时进行传代培养。用流式细胞仪检测细胞cd44、cd90、cd34表面抗原表达,结果显示:cd44阳性表达大于95%,cd90阳性表达也大于94%,cd34基本不表达,说明培养得到了纯度较高的骨髓间充质干细胞。
[0049]
2.2慢病毒载体的制备
[0050]
通过pcr方法,向所述神经干细胞因子突变体ngf核苷酸序列两端添加hindiii和bamhi酶解位点,将所获得的突变体核苷酸与pflag-cmv-2载体在37℃下进行hindiii/bamhi双酶切;酶切产物经凝胶纯化后,使用t4连接酶进行4℃反应过夜连接,收获质粒载体。然后,在1.8kv、25μf和200ω条件下电转化至将所述质粒载体dh5α感受态细胞,取100μl菌液涂布至含有氨苄霉素抗性的lb板上,37℃过夜培养,挑取单克隆进行测序鉴定,保存测序结果正确的阳性克隆菌株。
[0051]
从液氮中取出冻存的293t细胞(购自atcc),迅速放到37℃水浴中复苏,1200rpm离心5min收集细胞,然后放入含10%fbs的dmem培养中,在37℃、5%co2、饱和湿度下培养,待细胞汇合度达90%以上时,进行传代培养,共培养3-5代。取细胞状态良好的293t细胞,按每个培养皿中6
×
106个细胞数接种于培养皿中,37℃,5%co2的培养箱中培养过夜;去除原培养基,使用无菌pbs洗涤细胞三次,然后加入10ml opti-mem培养液;取10μg慢病毒表达质粒、10μg包装质粒del8.9、20μg疱疹性口腔炎病毒糖蛋白(vesicular stomatitis virus-g protein,vsvg)(购自美国clontech公司)和40μllipofectamine2000加入1ml opti-mem培养液中,混合均匀得到混合液体;将所述混合液体缓慢滴加至293ft细胞的培养液中,轻轻混匀,于37℃、5%co2、饱和湿度细胞培养箱中培养。
[0052]
培养72h后,使用超速离心法制备慢病毒载体,具体包括:在4℃下,4000g离心10min,除去细胞碎片;分别采用以0.45μm、0.22μm滤器过滤获得上清液,放入40ml超速离心管中;在4℃下,20000g离心2h,离心结束后,弃去上清收集病毒样品,使用细胞培养基重悬溶解慢病毒载体。将所述病毒进行分装并保存于-80℃超低温冰箱,采用荧光法测定病毒滴度,经测定所述病毒滴度为2.8
×
109tu/ml,满足后续实验要求。
[0053]
2.3骨髓间充质干细胞的基因修饰
[0054]
将2.1步骤中获得的骨髓间充质干细胞接种于培养皿中,37℃、5%co2、饱和湿度培养,待细胞融合度达到80%以上,使用移液器吸取细胞培养液,使用无菌pbs洗涤三次,加入新鲜培养液,按照细胞/病毒1:10比例加入重组慢病毒载体,37℃、5%co2、饱和湿度培养12h,弃去细胞培养液,无菌pbs洗涤三次,加入0.25%胰酶,37℃消化5min,加入含血清的完全培养基终止消化,1000rpm离心5min收集细胞,记为msc-mungf。
[0055]
使用相同方法,制备携带天然ngf核酸序列的间充质干细胞,记为msc-ngf。
[0056]
实施例3基因修饰干细胞治疗失眠症动物模型
[0057]
3.1动物模型制备
[0058]
本实施例中氯苯丙氨酸(pcpa)造模法制备大鼠失眠模型。选取健康sd大鼠,正常饲喂一周适应环境,饲养条件为:室温20~26℃,相对湿度为40%~60%,白昼循环模式下自然光照,定时喂食,自由饮水。配置pcpa弱碱性溶液,腹腔注射sd大鼠(300mg/kg),每日1次,连续注射2天。第1次注射约30h后,大鼠昼夜节律消失,而对照组大鼠昼夜节律正常,说
明大鼠失眠模型建立成功。
[0059]
3.2给药处理
[0060]
将模型动物随机分为4组,每组10只,分别为:msc组:尾静脉注射1
×
106个msc细胞;msc-ngf组:尾静脉注射1
×
106个msc-ngf细胞;msc-mungf组:尾静脉注射1
×
106个msc-mungf细胞;对照组:注射等体积的生理盐水。注射治疗试剂一周后进行后续检测。
[0061]
3.3行为学检测
[0062]
采用y型迷宫实验评价实验动物的行为学表现。正式开始实验前,将大鼠放入迷宫中先适应5min,在迷宫中设置安全区和电击区,当大鼠在电击下逃窜至灯光区后再保持10s以上确定为完成一次测试。观察错误反应次数,每个实验日进行30次测试。实验结果如表2所示,对照组动物的出现大量错误,而注射msc细胞使得该状况得到改善,使用携带神经生长因子的msc细胞效果更为明显,说明一方面msc细胞具有较好的神经系统修复作用,另一方面msc细胞可作为递送载体,突破血脑屏障进入中枢神经系统中,进而释放ngf或其突变体,从而发挥系统修复作用,进一步缓解神经损伤症状,但是在该实验中msc-ngf和msc-mungf未见显著差异。
[0063]
表2迷宫实验观测结果
[0064][0065]
3.4睡眠时间观察
[0066]
给药1周后,记录各组大鼠翻正反射消失的时间及出现翻正反射的时间,以翻正反射消失30s以上即为进入睡眠,入睡至翻正反射再现即为睡眠时间。最后计算各组大鼠睡眠潜伏期和睡眠持续时间。结果如图3所示,造模成功后,大鼠睡眠时间明显缩短,而睡眠潜伏期延长,说明深度睡眠时间缩短;给药治疗后,睡眠状况出现好转,但是在三个治疗组中msc-ngf的睡眠改善效果最差,可能是由于ngf具有促进神经修复和致痛觉敏感双重功能,使用具有天然结构的ngf难以显著改善睡眠质量,而采用msc-mungf治疗,不仅最大程度地保留了ngf的神经修复功能,还削弱了致痛觉敏感作用,使得模型动物的睡眠潜伏期和睡眠持续时间大大延长,已接近正常状态。
[0067]
3.5分子水平检测
[0068]
给药结束后,脱颈处死大鼠,解剖取出整体大脑组织,剪取约20mg大脑皮层组织,加入一定量pbs(ph 7.4),置于冰上使用匀浆器匀浆;以3000r/min、4℃离心20min,收集上清;使用elisa试剂盒(购自美国r&dsystems公司)检测多巴胺(dopamine,da)、5-羟色胺(5-hydroxytryptamine,5-ht)、γ-氨基丁酸(γ-aminobutyric acid,gaba)等因子浓度,具体步骤按照试剂盒说明书进行。
[0069]
da是一种来自儿茶酚胺家族的神经递质,被认为是关键的神经生物学底物,传统上一直是运动障碍、精神障碍和在较小程度上抑郁症的药物治疗的目标。有证据还表明,da是促进和维持唤醒状态的组成部分,da神经传递被认为是外源性兴奋剂(如苯丙胺、可卡因
和哌醋甲酯)促进觉醒作用的主要机制,研究人员发现甲基苯丙胺和莫达非尼均通过阻断调节da再摄取的da转运蛋白(dat)受体增加细胞外da;使用安非他明和莫达非尼治疗后,嗜睡症犬的daergic张力和清醒度增加,而这两种药物在dat基因敲除小鼠中都没有促醒作用。如图4所示,相对于正常组,模型组中的da含量大幅度提高,使用msc治疗后,da水平有所降低;但msc-ngf组降低幅度较小,msc-mungf组降低幅度最大,表明其能够阻断神经递质传递,降低机体清醒程度,有助于睡眠。
[0070]
5-ht作为一种抑制性神经递质,参与调节昼夜节律系统和认知功能,高水平的5-ht被认为能够介导睡眠时间的延长,据报道唑吡坦、地西泮、莲子等具有促睡眠功能的药物均可通过调节5-ht水平而发挥作用。如图5所示,相对于正常组,模型组中的da含量显著降低;使用msc治疗后仅有小幅度恢复,但使用msc-ngf和msc-mungf治疗后,5-ht水平大幅度上升,已接近正常范围。
[0071]
gaba是一种重要的中枢神经系统抑制性神经递质,研究表明,失眠与γ-氨基丁酸(gaba)能系统通路中gaba的合成代谢、传导及转运3个方面密切相关,在促进“觉醒-睡眠”周期gaba有3个受体亚型,其中gaba a受体属于离子通道型受体,通过激活氯离子通道发挥作用,gaba arα1、gaba arγ2受体在这一过程中发挥重要作用,可作为神经、精神类药物活性筛选的作用靶点,参与调节抑制/兴奋平衡。如图6所示,造模后大脑组织中的gaba表达水平明显下降,使用msc治疗后可使得gaba表达水平显著上调,虽然msc-mungf的效果似乎更加明显,但未显示出显著差异。
[0072]
虽然本发明参考其示例性的实施例已经进行了具体显示和描述,本领域的技术人员应当理解的是,在不偏离由所附权利要求书所涵盖的本发明的范围的情况下,可以在其中做出在形式和细节方面的多种改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1