一种治疗原发性痛经的药物及其制备方法和应用
1.本发明涉及生物医药领域,尤其涉及一种治疗原发性痛经的药物及其制备方法和应用。
背景技术:
2.痛经是一种长期以来一直困扰广大女性患者且难以治愈的临床疾病,一般表现为行经前后或月经期下腹部疼痛、坠胀,同时伴有腰酸或其他不适,严重者甚至呕吐或昏厥。目前痛经已成为妇科最常见的病症之一,且发病率仍不断上升,严重影响了女性朋友的工作和生活。
3.根据发病机制的不同,痛经可分为继发性痛经和原发性痛经。其中继发性痛经与生殖器官器质性病变有关,发病率较低。而原发性痛经确切发病机制不明确,涉及多种因素,且发病率较高。古今中医医家认为主要病因有两点,一个是虚证,“不荣则痛”;另一个是实证,“不通则痛”。具体可分为气滞血瘀型、寒凝血瘀型、湿热瘀阻型、气血虚弱型和肾气亏损型痛经。现代西医理论认为原发性痛经的发作原因与内分泌因素有关。
4.红糖是一种药食两用的传统滋补品,在其生产过程中很多营养物质都被保留下来,包括维生素、矿物质、氨基酸和多酚类化合物等。众所周知,多酚类化合物具有清除机体内自由基、抗氧化、延缓机体衰老、抗肿瘤、减缓骨质疏松、预防心血管疾病、防癌、抗辐射等生物活性功能,在化工、医药、食品、材料、农业等领域应用广泛。目前红糖中多酚类化合物在治疗原发性痛经方面的活性尚无报道。
技术实现要素:
5.鉴于上述现有技术存在的缺陷,本发明的目的是提出一种治疗原发性痛经的药物及其制备方法和应用,用于治疗原发性痛经和缓解原发性痛经带来的不适感。
6.本发明的目的将通过以下技术方案得以实现:
7.本发明的目的之一在于提供一种治疗原发性痛经的药物,包含红糖多酚,所述红糖多酚包括没食子酸、原儿茶酸、p-羟基苯甲酸、绿原酸、香草酸、咖啡酸、丁香酸、香豆酸、阿魏酸和芥子酸中的一种或多种。
8.本发明的另一个目的是提供一种上述的药物在制备治疗原发性痛经和缓解原发性痛经带来的不适感的药物中应用。
9.进一步的,所述治疗原发性痛经和缓解原发性痛经带来的不适感的药物为口服剂型。
10.本发明的另一个目的是提供一种上述的药物的制备方法,包括以下步骤:
11.步骤1、配制1g/ml-5g/ml的红糖水溶液,过滤除去不溶性颗粒物后,经过树脂柱,用乙醇水溶液进行洗脱,收集洗脱液,减压浓缩得到浓缩液;
12.步骤2、将浓缩液经过固相萃取柱,加入淋洗液洗去杂质,用混合溶液洗脱,收集洗脱液,减压浓缩至固形物,真空干燥,即得所述红糖多酚。
13.进一步的,步骤1中的所述树脂柱为h103树脂柱。
14.进一步的,步骤1中的所述乙醇水溶液为50%乙醇水溶液。
15.进一步的,步骤1中的所述洗脱流速为10ml/min。
16.进一步的,步骤2中的所述固相萃取柱为c18固相萃取小柱。
17.进一步的,步骤2中的所述混合溶液为甲醇-2%乙酸混合溶液。
18.进一步的,步骤2中的所述洗脱流速为1ml/min。
19.本发明的突出效果为:
20.本发明提供一种治疗原发性痛经的药物及其制备方法和应用,本发明中的红糖多酚是天然活性物质,具有显著的镇痛效果,可以调节动物激素水平,具有治疗原发性痛经和缓解原发性痛经带来的不适感的作用,而且其制备方法简单,利于产业化应用。
21.以下便结合实施例,对本发明的具体实施方式作进一步的详述,以使本发明技术方案更易于理解、掌握。
附图说明
22.图1为本发明实施例1中没食子酸的标准曲线;
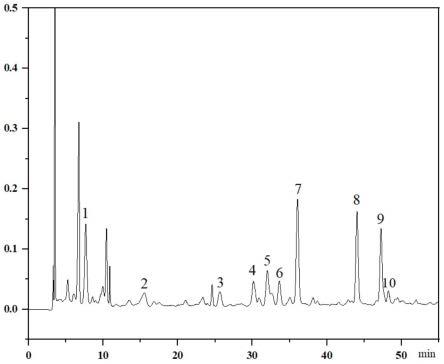
23.图2为本发明实施例1中制备得到的红糖多酚的色谱图;
24.图3为本发明实施例1中混合标准品色谱图;
25.图4为本发明实施例3中各组痛经小鼠血清no的浓度图谱;
26.图5为本发明实施例3中各组痛经小鼠血清ca
2+
的浓度图谱;
27.图6为本发明实施例3中各组痛经小鼠血清e2的浓度图谱;
28.图7为本发明实施例3中各组痛经小鼠血清il-1β的浓度图谱;
29.图8为本发明实施例3中各组痛经小鼠血清mda的浓度图谱;
30.图9为本发明实施例3中各组痛经小鼠子宫组织pgf2α的浓度图谱;
31.图10为本发明实施例3中各组痛经小鼠子宫组织6-keto-pgf1α的浓度图谱;
32.图11为本发明实施例3中各组痛经小鼠子宫组织pge2的浓度图谱。
具体实施方式
33.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
34.实施例1
35.红糖多酚的制备方法和成分测定
36.本实施例的一种治疗原发性痛经的药物,包含红糖多酚,其制备方法如下:
37.配制适量红糖水溶液(1g/ml-5g/ml),过0.45μm滤膜除去不溶性颗粒物,然后经过h103树脂柱,流速控制为10ml/min,待样品吸附后,使用50%乙醇水溶液进行洗脱,洗脱速度为10ml/min,收集洗脱液减压浓缩。将浓缩液过c18固相萃取小柱,加入淋洗液洗去杂质,最后使用甲醇-2%乙酸混合溶液洗脱,收集洗脱液,减压浓缩至固形物,真空干燥,即为红糖多酚。
38.采用福林酚法进行总多酚含量测定,称取没食子酸对照品2.5mg置于25ml容量瓶中,用蒸馏水定容至刻度,即得对照品储备液。分别吸取储备液0、0.25、0.5、0.75、1.0、
1.25ml置于25ml容量瓶,加入1.5ml福林酚试剂,8min后加入1.5ml 10%na2co3溶液,用蒸馏水定容至刻度,25℃反应1h,测定765nm处吸光度。得到线性回归方程:y=0.0031x+0.1003(400μg/ml≥x≥40μg/ml,r2=0.9956,没食子酸在0.04mg/ml~0.40mg/ml浓度范围内线性关系良好。没食子酸标准曲线如图1所示。红糖多酚含量为153.02
±
3.54mg gae/kg。
39.表1没食子酸线性数据
40.没食子酸浓度(μg/ml)04080100200300400吸光度值0.0470.1970.3410.4200.7741.0131.327
41.采用高效液相色谱法测定红糖多酚组成。色谱条件如下:流动相a为2%乙酸水溶液,b为乙腈,梯度洗脱0-10min,90%a,10-30min,90%-75%a,30-60min,75%-50%a。流速,0.8ml/min。色谱柱,apollo c18(150
×
4.6mm,5μm)。柱温,30℃。进样体积,20μl。红糖多酚色谱图如图2所示,图3为混合标准品色谱图根据标准品对照(1没食子酸,2原儿茶酸,3p-羟基苯甲酸,4绿原酸,5香草酸,6咖啡酸,7丁香酸,8香豆酸,9阿魏酸,10芥子酸),由此可知,红糖多酚中含有没食子酸、原儿茶酸、p-羟基苯甲酸、绿原酸、香草酸、咖啡酸、丁香酸、香豆酸、阿魏酸、芥子酸。
42.实施例2
43.红糖多酚对原发性痛经动物模型的镇痛效果
44.实验动物:spf级雌性未怀孕icr小鼠,4-6周龄,18-22g,所有动物均饲养在温度为22℃~24℃,所有动物实验前禁食12h,可自由饮水。
45.造模及分组、给药:60只雌性icr小鼠分为6组(每组10只),分别为正常组、模型组、阳性组和红糖多酚高、中、低剂量组。除正常组小鼠外,其余各组小鼠均连续灌胃戊酸雌二醇片12d(每日0.5mg/kg,溶于含0.5%吐温-80的生理盐水中)。在造模期间,阳性组小鼠灌胃布洛芬混悬液(0.1g/kg),实验组小鼠给予不同浓度红糖多酚(高剂量组0.4g/kg,中剂量组0.2g/kg,低剂量组0.1g/kg,溶于含0.5%吐温-80的生理盐水中灌胃)12d。正常组和模型组小鼠给予生理盐水(含0.5%吐温-80)。各组小鼠每日灌胃给药1次,连续给药12d。于末次给药后1h腹腔注射催产素(2u/只)。以小鼠后肢伸直,腹部内凹,臀部抬起为扭体指标。记录注射催产素后15min内扭体次数。
46.表2扭体次数
47.分组扭体次数扭体发生率正常组00模型组26.8
±
6.81100%阳性药组3.1
±
3.1870%红糖多酚低剂量组11.3
±
5.54**100%红糖多酚中剂量组11.1
±
4.43**100%红糖多酚高剂量组7.1
±
3.70**100%
48.表2中*表示与模型组相比p《0.05;**表示与模型组相比p《0.01。扭体发生率以出现扭体现象的小鼠数量除以本组小鼠总数量进行计算。
49.从表2中可见,红糖多酚高、中、低剂量组(p《0.01)的扭体次数均低于模型组,并且差异具有统计学意义。可见红糖多酚对原发性痛经小鼠模型具有良好的镇痛效果。
50.实施例3
51.红糖多酚对原发性痛经动物模型的激素水平调节效果
52.实验动物:spf级雌性未怀孕icr小鼠,4-6周龄,18-22g,所有动物均饲养在温度为22℃~24℃,所有动物实验前禁食12h,可自由饮水。
53.造模及分组、给药:60只雌性icr小鼠分为6组(每组10只),分别为正常组、模型组、阳性组和红糖多酚高、中、低剂量组。除正常组小鼠外,其余各组小鼠均连续灌胃戊酸雌二醇片12d(每日0.5mg/kg,溶于含0.5%吐温-80的生理盐水中)。在造模期间,阳性组小鼠灌胃布洛芬混悬液(0.1g/kg),实验组小鼠给予不同浓度红糖多酚(高剂量组0.4g/kg,中剂量组0.2g/kg,低剂量组0.1g/kg,溶于含0.5%吐温-80的生理盐水中灌胃)12d。正常组和模型组小鼠给予生理盐水(含0.5%吐温-80)。各组小鼠每日灌胃给药1次,连续给药12d。给药周期结束后眼眶取血,分离血清,按试剂盒说明书操作步骤测定小鼠血清no、ca
2+
、mda、e2和il-1β含量。取血后处死小鼠,于冰上迅速取新鲜小鼠子宫组织,生理盐水冲洗干净,滤纸吸干水分。加入约10倍量生理盐水,匀浆器匀浆制成子宫内膜组织匀浆液,随后于4℃3000r/min离心10min,取上清液,于-20℃以下低温保存。使用elisa酶联免疫吸附试剂盒测定小鼠子宫匀浆中pgf2α、pge2和6-keto-pgf1α水平。
54.图4-5为各组痛经小鼠血清no和ca
2+
影响的比较,与正常组比较,#p<0.05,##p<0.01;与模型组比较,*p<0.05,**p<0.01。结果表明,与正常组相比,模型组小鼠血清no含量降低(##p<0.01),ca
2+
浓度升高(##p<0.01);与模型组比较,阳性药布洛芬混悬液组小鼠血清no含量升高(*p<0.05),ca
2+
浓度升高(**p<0.01);与模型组比较,红糖多酚高剂量组小鼠血清no含量升高(*p<0.05),ca
2+
浓度升高(*p<0.05)。差异均具有统计学意义。
55.图6-7为各组痛经小鼠血清e2和il-1β影响的比较,与正常组比较,#p<0.05,##p<0.01;与模型组比较,*p<0.05,**p<0.01。结果表明,与正常组比较,模型组小鼠血清e2浓度升高(##p<0.01),il-1β浓度升高(##p<0.01);与模型组比较,阳性药布洛芬组小鼠血清e2浓度降低(*p<0.05),il-1β浓度降低(*p<0.05);与模型组比较,红糖多酚高剂量组小鼠血清e2浓度降低(*p<0.05),而红糖多酚高中低剂量组小鼠血清il-1β无明显改善(p>0.05),差异无统计学意义。
56.图8为各组痛经小鼠血清mda影响的比较,与正常组比较,#p<0.05,##p<0.01;与模型组比较,*p<0.05,**p<0.01。结果表明,与正常组比较,模型组小鼠血清mda增高(##p<0.01);与模型组比较,阳性药布洛芬组小鼠血清,mda下降(*p<0.05);与模型组比较,红糖多酚高剂量组小鼠血清mda升高(**p<0.01)。差异均具有统计学意义。
57.图9-11为各组痛经小鼠子宫组织pgf2α、6-keto-pgf1α和pge2影响的比较,与正常组比较,#p<0.05,##p<0.01;与模型组比较,*p<0.05,**p<0.01。结果表明,与正常组比较,模型组小鼠子宫内pgf2α含量明显升高(##p<0.01),6-keto-pgf1α含量明显降低(##p<0.01),pge2含量明显降低(##p<0.01);与模型组比较,阳性药布洛芬组小鼠子宫内pgf2α含量明显降低(*p<0.05),6-keto-pgf1α含量明显升高(**p<0.01),pge2含量明显升高(**p<0.01);与模型组比较,红糖多酚高中低剂量组小鼠6-keto-pgf1α含量明显升高(**p<0.01),红糖多酚中、高剂量组小鼠子宫pge2含量明显升高(*p<0.05),差异具有统计学意义,但对pgf2α含量无显著影响,差异无统计学意义(p>0.05)。
58.因此,红糖多酚对原发性痛经具有一定的缓解与治疗作用,其与增加小鼠血清中no含量,降低ca
2+
、mda、e2含量有关,也与可以调节pge2及6-keto-pgf1α含量有关。
59.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1