一种siRNA递送系统及其制备方法与应用与流程
一种sirna递送系统及其制备方法与应用
技术领域
1.本发明涉及一种sirna递送系统及其制备方法与应用。
背景技术:
2.小干扰rna(small interfering rna,sirna),也被称为沉默rna、短干扰rna或非编码rna,天然存在于动植物细胞基因调控系统中。sirna长度一般为21~25bp,是宿主细胞针对外源侵入基因所表达的双链rna(double stranded rna,dsrna)进行切割后生成的具有特定序列的小片段rna,可激发与之互补的目标mrna的沉默。sirna作为药物发挥作用,需要克服血管屏障、实现细胞内吞及溶酶体逃逸,同时还需避免核酸酶降解。脂质体和聚合物纳米颗粒递送系统已被广泛用于提高sirna的稳定性并改善其药代动力学特性,但存在递送效率低下、免疫原性高等问题。开发低系统毒性、高递送效率、可精准靶向的递送系统是未来sirna药物研发的关键。
3.外泌体(exosome,ev)是由细胞分泌的、直径范围50~200nm、具有双层磷脂膜的胞外囊泡结构。真核和原核生物细胞均可分泌外泌体。外泌体天然存在于哺乳动物的血液、唾液、尿液、脑脊液和乳汁等体液中。外泌体作为细胞间信息交流的载体,包裹来自上游细胞的蛋白质、rna、糖类、脂类等分子,再被下游细胞内吞后实现对接收细胞的刺激和调节。外泌体的纳米尺度、低免疫原性、可携带多种生物活性分子的特点使其具有成为天然药物、药物载体、诊断工具的潜力,吸引了众多药企和生物技术公司的热情投入。
4.利用外泌体装载sirna进行细胞或体内递送,理论上可以克服血管屏障,逃逸细胞内溶酶体,对sirna实现有效保护,并可通过工程化修饰实现组织靶向性,从而有效改善sirna药物的药效和药代特性。但是,目前尚缺乏将sirna装载到外泌体中并确保其有效敲低靶基因的方案。直接将sirna导入外泌体,装载效率低,单个外泌体装载的sirna的数量通常仅为个位数,难以实现功能性递送。另外,在装载sirna进入外泌体的过程中,易对外泌体造成破坏,导致装载sirna的有效外泌体比例下降,制备效率低下,同样制约了该技术的应用。
5.如何在提高单个外泌体装载sirna的数量并确保其有效敲低靶基因的同时,提高有效外泌体的制备效率,是实现基于外泌体的sirna递送系统功能性递送的关键。
技术实现要素:
6.本发明所解决的技术问题是克服现有技术的不足,提供一种新的sirna递送系统及其制备方法。
7.为克服现有技术不足,本发明采用如下技术方案:
8.一种sirna递送系统,其通过包括如下步骤的方法制备得到:
9.提供含有sirna与第一培养基的第一组合物;
10.提供含有脂质体lipo3000与第二培养基的第二组合物;
11.将所述第一组合物与第二组合物混合并添加外泌体,获得混合物;
12.孵育所述混合物,以获得内部装载有sirna的外泌体。
13.优选地,所述孵育在30~40℃条件下进行,例如30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃。
14.进一步优选地,所述孵育采用的温度为35~40℃。
15.根据一些具体实施方式,所述孵育采用37℃恒温水浴的方式。
16.优选地,所述孵育的时间为1.5~2.5h,例如1.5h、1.8h、2h、2.2h、2.5h。
17.优选地,每100μl孵育体系中,含有1~5μl脂质体lipo3000、1
×
10-5
~10
×
10-5
μmol sirna以及0.1
×
10
10
~10
×
10
10
个外泌体。
18.进一步优选地,每100μl所述混合物中,含有1~2μl脂质体lipo3000、4
×
10-5
~6
×
10-5
μmol sirna以及1
×
10
10
~10
×
10
10
个外泌体。
19.优选地,所述第一培养基、第二培养基均为opti-mem减血清培养基。
20.优选地,所述第一组合物中,脂质体lipo3000的体积浓度为1%~5%;所述第二组合物中,sirna的摩尔浓度为0.05~1.5μmol/l;所述添加的外泌体是含有外泌体的缓冲液,其中外泌体的浓度为0.1
×
10
12
个/ml及以上。在一些具体实施方式中,外泌体的浓度为0.1
×
10
12
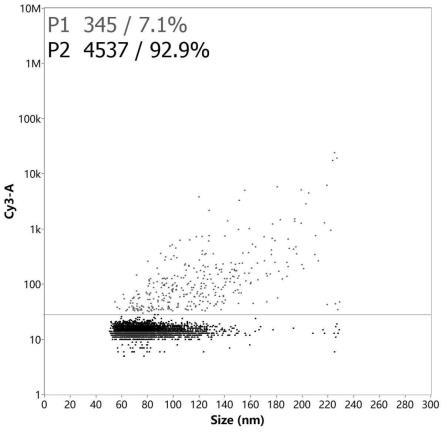
~10
×
10
12
个/ml。
21.优选地,所述第一组合物、所述第二组合物和所述外泌体的投料体积之比为3~5:4~6:1。
22.根据一些具体实施方式,所述第一组合物和第二组合物在制备完成后,先分别静置5~10min,之后再混合。
23.根据本发明的一些具体实施方式,在孵育所述混合物后,所述脂质体lipo3000与所述sirna形成复合物并与所述外泌体的囊泡融合,所述外泌体以及与其融合的脂质体lipo3000与sirna复合物构成所述sirna递送系统。
24.优选地,单个所述内部装载有sirna的外泌体所装载的sirna的平均个数超过10个。
25.进一步优选地,单个所述内部装载有sirna的外泌体所装载的sirna的平均个数超过50个。
26.更进一步优选地,单个所述内部装载有sirna的外泌体所装载的sirna的平均个数超过100个。再进一步优选地,单个所述内部装载有sirna的外泌体所装载的sirna的平均个数超过150个。
27.优选地,所述内部装载有sirna的外泌体的平均颗粒大小为50~200nm。
28.进一步优选地,所述内部装载有sirna的外泌体的平均颗粒大小为60~190nm。
29.更进一步优选地,所述内部装载有sirna的外泌体的平均颗粒大小为70~180nm。
30.本发明还提供一种sirna递送系统的制备方法,其包括如下步骤:
31.提供含有sirna与第一培养基的第一组合物;
32.提供含有脂质体lipo3000与第二培养基的第二组合物;
33.将所述第一组合物与第二组合物混合并添加外泌体,获得混合物;
34.在温度30~40℃下孵育所述混合物,控制孵育时间为1.5~2.5h,获得孵育液,所述孵育液中含有内部装载有sirna的外泌体,所述内部装载有sirna的外泌体的平均颗粒大小为50~200nm,且单个所述内部装载有sirna的外泌体所装载的sirna的平均个数在100个
以上;
35.对所述孵育液进行纯化,以除去所述孵育液中装载有sirna的外泌体以外的颗粒物质,得到所述sirna递送系统。
36.所述纯化的目的在于将孵育液中除了装载有sirna的外泌体之外的颗粒物质去除,例如脂质体lipo3000、未装载有sirna的外泌体和被破坏的外泌体等。
37.优选地,所述第一培养基、第二培养基均为opti-mem减血清培养基。
38.优选地,所述第一组合物中,lipo3000的体积浓度为1%~5%,例如1%、2%、3%、4%和5%。
39.优选地,所述第二组合物中,sirna的摩尔浓度为0.05~1.5μmol/l,例如0.05μmol/l、0.08μmol/l、1.0μmol/l、1.2μmol/l、1.5μmol/l。
40.优选地,所述添加的外泌体是含有外泌体的缓冲液,其中外泌体的浓度为0.1
×
10
12
~10
×
10
12
个/ml
×
10
12
个/ml,例如0.1
×
10
12
个/ml、0.5
×
10
12
个/ml、1
×
10
12
个/ml、2
×
10
12
个/ml、5
×
10
12
个/ml、8
×
10
12
个/ml、10
×
10
12
个/ml。
41.在一些优选实施方式中,所述纯化采用离心超滤方式来进行。优选地,采用截留分子量为90~150kda的超滤管并收集其中被截留的部分。
42.进一步优选地,采用截留分子量为95~110kda的超滤管并收集其中被截留的部分。
43.在一些具体实施方式中,采用截留分子量为100kda的超滤管并收集其中被截留的部分。
44.进一步优选地,所述离心超滤的离心力为2500~3500g。
45.进一步优选地,所述离心超滤采用pbs缓冲液作为洗涤液,并在离心超滤后采用pbs缓冲液作为sirna递送系统的存储液。
46.更进一步地,所述离心超滤包括:一次或多次向截留有sirna递送系统的超滤管的上室中加入pbs缓冲液,在2500~3500g离心力下离心,去除超滤管的下室中的液体的步骤。
47.在一些具体实施方式中,所述纯化包括:
48.(1)将孵育液和pbs缓冲液加入超滤管的上室,2500~3500g离心力下离心,去除超滤管的下室中的液体;
49.(2)向超滤管的上室中加入pbs缓冲液,2500~3500g离心力下离心,去除超滤管的下室中的液体;
50.(3)重复步骤(2)2~4次;
51.(4)向超滤管的上室中加入pbs缓冲液,2500~3500g离心力下离心,直到超滤管的上室中的液体的体积与所述含有sirna递送系统的反应液处理前体积大致相同,超滤管的上室中的液体即为纯化后的sirna递送系统溶液。
52.优选地,所述内部装载有sirna的外泌体的平均颗粒大小为50~200nm,更优选为60~190nm,进一步优选为70~180nm。
53.在一些具体实施方式中,单个所述内部装载有sirna的外泌体所装载的sirna的平均个数在150个以上。
54.本发明制备方法所制备的sirna递送系统,单个外泌体中装载有较高数量的sirna,并且能够更好地为细胞所内吞,有助于实现sirna向靶细胞的功能性递送。为此,本
发明还涉及上述sirna递送系统用于向哺乳动物细胞靶向递送sirna的用途。
55.由于采用上述技术方案,本发明与现有技术相比具有如下优点:
56.本发明方法获得的sirna递送系统,包括作为载体的外泌体和装载于外泌体囊泡内的数量众多的sirna,能够更好地为细胞所内吞,细胞靶向递送效果更好,能够实现sirna向靶细胞的功能性递送。
57.本发明sirna递送系统的制备方法,能够将sirna有效地装载到外泌体中,显著提高单个外泌体中sirna的数量,并且含有sirna的有效外泌体比例高,一方面,确保sirna递送系统具有良好的细胞靶向递送效果、实现sirna向靶细胞的功能性递送,另一方面,该方法制备效率高,成本可控,适于推广应用。
附图说明
58.图1为实施例1制备的sirna递送系统的纳米流式nanofcm检测结果图;
59.图2为实施例1制备的sirna递送系统中总外泌体的粒径分布图;
60.图3为实施例1制备的sirna递送系统中cy3-sirna阳性外泌体粒径分布图;
61.图4为hepg2细胞对实施例1制备的sirna递送系统的内吞效果图;
62.图5为对比例1制备的sirna递送系统的纳米流式nanofcm检测结果图;
63.图6为对比例1制备的sirna递送系统中总外泌体的粒径分布图;
64.图7为对比例1制备的sirna递送系统中cy3-sirna阳性外泌体粒径分布图;
65.图8为hepg2细胞对对比例1制备的sirna递送系统的内吞效果图;
66.图9为对比例2制备的sirna递送系统的纳米流式nanofcm检测结果图;
67.图10为对比例2制备的sirna递送系统中总外泌体的粒径分布图;
68.图11为对比例2制备的sirna递送系统中cy3-sirna阳性外泌体粒径分布图;
69.图12为hepg2细胞对对比例2制备的sirna递送系统的内吞效果图。
具体实施方式
70.以外泌体作为sirna细胞靶向递送载体具有天然的优势,但目前还没有使用外泌体递送sirna的药品被批准上市。本技术发明人基于研究发现,以外泌体作为载体来装载sirna,容易出现装载sirna数量少、外泌体裂解导致外泌体回收率低等一个或多个问题,如此,很难实现sirna向靶细胞的功能性递送。为了解决前述问题,实现外泌体作为载体对于sirna的有效递送,发明人开展了大量的研究实验。发明人意外发现,借助于脂质体lipo3000和特定的装载方式,既能够有效提高单个外泌体装载的sirna的数量,又能够提高装载了sirna的有效外泌体的回收率,从而实现sirna向靶细胞的高效递送。
71.下面结合具体的实施例对本发明的技术方案做进一步描述,但本发明不只限于以下实施例。
72.以下实施例中采用的实施条件可以根据具体要求做进一步调整,未注明的实施条件通常为常规实验中的条件。以下实施例和对比例仅以cy3标记的sirna为例,其他靶基因的sirna,同样适用于上述制备方法。exofect转染试剂为可商购(如品牌sbi)获得的核酸转染试剂;opti-mem减血清培养基通过商购获得;cy3-sirna指荧光染料cy3标记的sirna,通过商购获得。
73.本发明中,如无特殊说明,使用的仪器、原料和试剂均可通过商购获得。
74.本发明中,如无特殊说明,术语具有如下所述的含义。
75.术语“sirna”(短干扰rna),是指短双链rna复合物,典型长度为19~25个碱基对。sirna可以使用本领域技术人员已知的方法制备或者通过商购获得。
76.术语“靶细胞”,是指期望sirna被递送入的细胞。靶细胞可以是在体内或体外。在一些实施方案中,靶细胞是哺乳动物(包括人类)细胞。
77.术语“lipo3000”可与“lipofectamine 3000”互换。
78.实施例1
79.本实施例提供一种sirna递送系统的制备方法,其具体步骤如下:
80.将lipo3000 1.5μl和opti-mem 43.5μl混匀,得到lipo3000溶液,放置5min;
81.将20μmol/l cy3-sirna 2.5μl和opti-mem 47.5μl混匀,得到sirna溶液,放置5min;
82.将lipo3000溶液和sirna溶液混合,同时添加外泌体pbs缓冲液10μl(颗粒浓度约为1
×
10
12
个/ml),混合均匀,得到混合液;
83.将混合液于37℃水浴,孵育2h,得到含有sirna递送系统的孵育液。
84.将pbs缓冲液过0.22μm滤膜后备用;吸取1ml pbs缓冲液加入截留分子量为100kda的超滤管的上室中,在3000g离心力下离心1min,弃掉所有pbs缓冲液,得到润洗后的超滤管;
85.向含有sirna递送系统的孵育液中添加1ml pbs并混匀,转移至润洗后的超滤管上室中,继续添加pbs缓冲液到4ml,在3000g离心力下离心1min,使上室中液体体积减少到1ml左右;
86.将超滤管下室中的液体弃掉,再向超滤管上室中添加pbs至4ml,在3000g离心力下离心1min,使体积减少到1ml左右,重复3次,最后一次超滤将上室中液体体积浓缩至100μl,即为纯化后的sirna递送系统溶液(为便于描述和区分,以下将该溶液用ev-lipo3000-cy3-sirna表示),转移至1.5ml离心管中。
87.对比例1
88.本对比例提供一种sirna递送系统的制备方法,其包括如下步骤:
89.将20μmol/l cy3-sirna 2.5μl、opti-mem 87.5μl和外泌体pbs缓冲液10μl(颗粒浓度约为1
×
10
12
个/ml)混匀,得到混合液;
90.将混合液于37℃水浴,孵育2h,得到孵育液;
91.对孵育液进行纯化,操作同实施例1,最终得到100μl sirna递送系统溶液(为便于描述和区分,以下将该溶液用ev-cy3-sirna表示)。
92.对比例2
93.本对比例提供一种sirna递送系统的制备方法,其包括如下步骤:
94.将20μmol/l cy3-sirna 2.5μl、exofect转染试剂10μl、外泌体pbs缓冲液10μl(颗粒浓度约为1
×
10
12
个/ml)和pbs缓冲液77.5μl混匀得到混合液;
95.将混合液于37℃水浴,孵育2h,得到孵育液;
96.对孵育液进行纯化,操作同实施例1,最终得到100μl sirna递送系统溶液(为便于描述和区分,以下将该溶液用ev-exofect-cy3-sirna表示)。
97.外泌体装载sirna的能力鉴定实验
98.1、采用酶标仪(tecan)检测荧光强度,对单个外泌体装载sirna个数进行定量检测。检测方法为:将20μmol/l cy3-sirna用pbs缓冲液稀释400倍,再按照1:2梯度稀释10个点,外加一个空白点作为标准曲线样品,tecan酶标仪中以激发光525nm,发射光580nm检测样品,绘制标准曲线。取ev-lipo3000-cy3-sirna、ev-cy3-sirna及ev-exofect-cy3-sirna样品,分别稀释10倍后进行检测,代入标准曲线计算cy3-sirna的摩尔浓度,用nanosight ns300检测回收的外泌体颗粒浓度,据此计算单个外泌体中cy3-sirna的个数以及回收率,结果见表1。
99.表1
[0100][0101]
由表1可见,对比例1不使用任何试剂,单个外泌体装载sirna的数量非常少,仅为个位数,对比例2使用exofect试剂,可实现单个外泌体装载102个sirna,但是会显著降低装载sirna后超滤法纯化外泌体的回收率。而采用脂质体lipo3000的实施例1,则可实现单个外泌体装载102个sirna,同时保证了装载sirna后超滤法纯化外泌体的回收效率。整体来看,只有实施例1的sirna递送系统同时保证了装载效率和回收效率,有望实现对靶细胞的功能性递送。
[0102]
2、使用纳米流式(nanofcm)检测装载阳性率、颗粒粒径和颗粒浓度,ev-lipo3000-cy3-sirna检测结果见图1~3,ev-cy3-sirna检测结果见图5~7,ev-exofect-cy3-sirna检测结果见图9~11,将关键数值汇总于表2。
[0103]
表2
[0104][0105]
nanofcm检测结果显示,根据对比例1、对比例2制备的sirna递送系统阳性率均很
低。相比之下,实施例1可实现外泌体有效装载sirna,并且装载后的外泌体具有合适的粒径大小。
[0106]
3、使用人源肝癌细胞系hepg2观察ev-lipo3000-cy3-sirna、ev-cy3-sirna、ev-exofect-cy3-sirna的内吞效果。
[0107]
处理方法为:96孔板每孔铺2
×
104~4
×
104个hepg2细胞,每孔中按照定量结果计算相同sirna的量添加不同的ev-lipo3000-cy3-sirna、ev-cy3-sirna、ev-exofect-cy3-sirna体积,24h后用pbs洗细胞,进行dapi核染色,观测内吞的cy3荧光信号。
[0108]
ev-lipo3000-cy3-sirna的内吞效果见图4,ev-cy3-sirna的内吞效果见图8,ev-exofect-cy3-sirna的内吞效果见图12。
[0109]
结果显示,实施例1制备的sirna递送系统的内吞信号显著强于对比例1和对比例2,由此可以预测实施例1的sirna递送系统的递送效果显著优于对比例1和对比例2。
[0110]
综上,由实施例1所代表的本发明的sirna递送系统,单个外泌体装载的sirna数量高且外泌体回收率更高,细胞靶向递送效果好,能够实现sirna的功能性递送。
[0111]
以上对本发明做了详尽的描述,目的在于让本领域内的技术人员了解本发明的内容并加以实施,并不能以此限制本发明的保护范围,且本发明不限于上述的实施例,凡根据本发明的精神实质所做的等效变化或修饰,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1