多酚聚合物在制备饥饿疗法抗肿瘤药物中的应用
1.本发明属于抗肿瘤药物技术领域,具体涉及一种多酚聚合物在制备饥饿疗法抗肿瘤药物中的应用。
背景技术:
2.癌症,一种严重威胁着人类生命健康的重大疾病,具有高发病率和高死亡率等特点,不仅给患者带来巨大的身心痛苦和沉重的医疗负担,而且消耗大量的医疗卫生资源。随着人口老龄化的加剧和人们饮食不规律、长期熬夜等不良生活方式的增加,恶性肿瘤发病率逐年上升。
3.随着对癌症研究的不断深入,越来越多的新型抗癌治疗策略被开发出来。其中,饥饿治疗主要是通过使肿瘤细胞长期处于能量不足的“饥饿”状态,使得代谢紊乱,从而实现其坏死或凋亡。作为一种有潜力的癌症治疗新策略,饥饿治疗可以通过抑制肿瘤血管生成、破坏或阻断肿瘤血管、肿瘤内葡萄糖、氧等物质的加速耗竭以及其他过程选择性地剥夺营养物质和氧气等的供应。比如:通过注射栓塞剂(阻断肿瘤血管)、血管抑制剂(抑制新血管生成)或血管破坏剂(破坏原始血管)等直接干扰肿瘤血管以阻断其对肿瘤细胞的营养供应;或者在肿瘤细胞中引入外源性葡萄糖氧化酶(gox),快速消耗细胞内部的葡萄糖和o2,使肿瘤细胞进入过度饥饿状态并最终死亡。
技术实现要素:
4.本发明的目的在于提供多酚聚合物的新用途,即在制药中的新应用。
5.实际上,本发明涉及多酚聚合物在制备饥饿疗法抗肿瘤药物中的应用。多酚聚合物富含大量酚羟基,可响应性地与肿瘤组织微环境中的活性氧发生氧化交联反应,在肿瘤或癌细胞周围形成无规交联的致密结构的聚合物网络,该致密网络结构可以限制分子扩散,能够阻碍肿瘤或癌细胞对营养物质的摄入,紊乱细胞的正常代谢过程,使细胞长期处于饥饿状态并最后死亡,从而实现对癌症饥饿治疗的目的。
6.本发明所述多酚聚合物是通过在富含氨基或羧基的聚合物上接枝多酚小分子获得的接枝多酚小分子的聚合物;或者所述多酚聚合物是由多酚单体与羧基单体共聚获得的共聚物,其中多酚单体是由不饱和酸酐与盐酸多巴胺反应获得;所述共聚物的数均分子量为5000~25000。
7.上述富含氨基的聚合物为ε-聚赖氨酸、聚乙烯亚胺、聚酰胺-胺树状大分子等中任意一种;富含羧基的聚合物为壳聚糖、聚丙烯酸、透明质酸等中任意一种;多酚小分子为3,4-二羟基苯甲酸、没食子酸、儿茶素、茶多酚、单宁酸、表儿茶素没食子酸酯、表没食子儿茶素、多巴胺、表没食子儿茶素没食子酸酯等中任意一种;不饱和酸酐为甲基丙烯酸酐、丙烯酸酐、马来酸酐(顺丁烯二酸酐)等中任意一种;羧基单体为丙烯酸、甲基丙烯酸、富马酸、马来酸(顺丁烯二酸)等中任意一种。
8.上述接枝多酚小分子的聚合物通过自由基诱导法制备,具体制备方法为:分别称
取富含氨基或羧基的聚合物、多酚小分子加入到有机溶剂中,搅拌并超声使各自充分溶解,分别得到聚合物溶液和多酚小分子溶液;将抗坏血酸加入到过氧化氢中充分搅拌至完全溶解,所得溶液加入到聚合物溶液中孵育2~3小时,最后加入多酚小分子溶液持续反应1~7天。反应结束后,反应液旋蒸除去有机溶剂,用乙醇重新分散后,将溶液加入乙酸乙酯中洗涤,然后将溶液离心后固液分离,向固体中加乙醇分散均匀,再加入乙醚中沉降,离心后固液分离,向固体中加入水冻干,得到接枝多酚小分子的聚合物。其中,所述富含氨基或羧基的聚合物、多酚小分子、抗坏血酸和过氧化氢的重量比为1:0.5~10:0.5~10:10~60。
9.上述多酚单体与羧基单体的共聚物的制备方法由下述步骤组成:
10.(1)将保护试剂和盐加入去离子水中,持续通氩气除去溶液中溶解的氧气,然后加入盐酸多巴胺,搅拌溶解,得到反应液;将不饱和酸酐溶于有机溶剂后,逐滴加入反应液中,在氩气保护下,室温搅拌12~16小时,反应过程中不断加氢氧化钠调节ph,使整个反应体系保持ph》8。反应完成后,固液分离,得滤液,将乙酸乙酯加入到滤液中萃取,萃取过程中用盐酸酸化至ph≤2,分液后取上层有机溶液,加入无水硫酸镁冷藏干燥过夜,除去有机溶液中多余的水分,然后将冷藏干燥的溶液除去无水硫酸镁,旋蒸浓缩后加入正己烷中,剧烈搅拌直至出现褐色固体,冷藏重结晶,固液分离后,取固体干燥即为多酚单体。其中,所述保护试剂、盐、盐酸多巴胺和不饱和酸酐的重量比为10~20:1~5:5~10:5~10。所述保护试剂为偏硼酸钠、十水硼砂、五水硼砂、无水硼砂、四硼酸钾中任意一种或多种,所述盐为碳酸钠、碳酸钾、醋酸钠、亚硫酸钠、亚硫酸氢钠、硫化氢钠、磷酸钠,碳酸氢铵中任意一种或多种。
11.(2)称取多酚单体、羧基单体、偶氮二异丁腈(aibn)加入到有机溶剂中,搅拌使之充分溶解,用氩气鼓泡一段时间以除尽溶液中的氧气,然后将反应液于60~70℃的油浴中持续反应10~12小时。反应结束后,反应液用截留分子量为3kd的透析袋透析,以除去副产物。透析之后,取截留液冻干。其中,所述多酚单体、羧基单体和aibn的重量比为1:1.5~2.5:0.1~0.2。
12.上述的有机溶剂为二甲基亚砜、n,n-二甲基甲酰胺、四氢呋喃、乙醇等。
13.本发明抗肿瘤药物包括治疗有效量的多酚聚合物和医药学上可接受的载体,所述药物为注射试剂,通过尾静脉注射或原位注射方式进行治疗。
14.本发明抗肿瘤药物所针对的肿瘤为固体的实体瘤。
15.本发明所述多酚聚合物用于肿瘤饥饿治疗的工作原理在于:聚合物中的多酚结构在肿瘤微环境中会响应性地与肿瘤组织周围活性氧发生交联反应,在癌细胞附近形成无规交联网络,粘附于细胞表面。该致密网络结构可以限制分子扩散,能够阻碍细胞对营养物质的摄入,同时可长时间滞留和富集,紊乱细胞的代谢过程,从而达到对肿瘤组织的饥饿治疗的效果。
16.与现有技术相比,本发明的有益效果如下:
17.1.本发明通过接枝反应或自由基共聚合制备多酚聚合物,并且其具有肿瘤酸环境中过表达的过氧化氢响应交联的特性。
18.2.本发明多酚聚合物在肿瘤富含过氧化氢环境下能够无序交联,在细胞表面呈现明显的凝胶纤维网络结构,且能够通过抑制细胞对葡萄糖等营养物质的吸收,达到良好的饥饿治疗效果。
19.3.本发明多酚聚合物到达肿瘤后可响应性交联,实现饥饿治疗抗肿瘤效果,这将
为开发新的抗肿瘤试剂提供新的思路,也将对肿瘤的临床治疗和探索肿瘤治疗新方案具有重要意义,具有一定的研究意义及临床转化潜力。
附图说明
20.图1是epl、ta、epl-ta的核磁共振氢谱图。
21.图2是epl、epl-ta的傅立叶变换红外光谱图。
22.图3是dma的核磁共振氢谱图。
23.图4是pmaa-dma的核磁共振氢谱图。
24.图5是pmaa-dma的傅立叶变换红外光谱图。
25.图6是epl、gtp、epl-gtp的核磁共振氢谱图。
26.图7是epl、epl-gtp的傅立叶变换红外光谱图。
27.图8是epl、ga、epl-ga的核磁共振氢谱图。
28.图9是epl、epl-ga的傅立叶变换红外光谱图。
29.图10是epl-ta(a)、pmaa-dma(b)和被氧化后epl-ta(c)的扫描电镜图。
30.图11是未经任何处理hela多细胞肿瘤球(a)、epl-ta与hela多细胞肿瘤球共孵育(b)活性氧荧光成像结果以及活性氧荧光随划线距离变化曲线(c)。
31.图12是对照组(上)以及epl-ta(下)与hela多细胞肿瘤球共孵育后的扫描电镜照片。
32.图13是pmaa-dma或pbs处理的hela多细胞肿瘤球培养基中葡萄糖浓度曲线图。
33.图14是epl-ta或pbs处理的hela多细胞肿瘤球培养基中葡萄糖浓度曲线图。
34.图15是epl-ta或pbs处理的hela多细胞肿瘤球培养基中gsh浓度曲线图。
35.图16是pmaa-dma与hela贴壁细胞共孵育后的细胞存活率结果。
36.图17是epl-ta与hela贴壁细胞共孵育后的细胞存活率结果。
37.图18是epl-gtp与hela贴壁细胞共孵育后的细胞存活率结果。
38.图19是epl-ga与hela贴壁细胞共孵育后的细胞存活率结果。
39.图20是pmaa-dma与hela多细胞肿瘤球共孵育后的细胞存活率结果。
40.图21是epl-ta与hela多细胞肿瘤球共孵育后的细胞存活率结果。
41.图22是epl-gtp与hela多细胞肿瘤球共孵育后的细胞存活率结果。
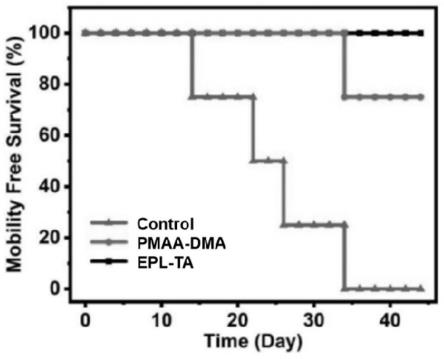
42.图23是epl-ga与hela多细胞肿瘤球共孵育后的细胞存活率结果。
43.图24是pmaa-dma与兔子血红细胞共孵育后溶血率的结果。
44.图25是未经任何处理hela多细胞肿瘤球(a)、epl-ta与hela多细胞肿瘤球共孵育(b)细胞侵袭实验结果以及对照组和实验组细胞侵袭数统计图(c)。
45.图26是对照组、pmaa-dma组、epl-ta处理后荷瘤小鼠的体重统计图。
46.图27是对照组、pmaa-dma组、epl-ta处理后荷瘤鼠的肿瘤体积变化曲线。
47.图28是对照组、pmaa-dma组、epl-ta处理后荷瘤鼠的存活率统计图。
48.图29是对照组、pmaa-dma组、epl-ta处理后荷瘤鼠的主要器官(心、肝、脾、肺、肾)和肿瘤的h&e染色图。
具体实施方式
49.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图和具体实施例对本发明的内容作进一步的详细描述,有必要指出的是,以下实施例仅对本发明进行解释和说明,并不用于限定本发明。本领域技术人员根据上述发明内容所做出的一些非本质的改进和调整,仍属于本发明的保护范围。
50.实施例1
51.分别称取72mgε-聚赖氨酸(epl)、450mg单宁酸(ta)加入到30ml二甲基亚砜(dmso)中,搅拌并超声使各自充分溶解;将50mg抗坏血酸加入到1ml过氧化氢中充分搅拌至完全溶解,再将该溶液加入到ε-聚赖氨酸溶液中孵育2小时,最后加入ta溶液持续反应5天。反应结束后,反应液旋蒸除去dmso,用乙醇重新分散后,将溶液加入乙酸乙酯中洗涤,将溶液离心后固液分离,向固体中加乙醇分散均匀,然后加入乙醚中沉降,离心后固液分离,向固体中加入适量水冻干,得到接枝ta的聚合物(记为epl-ta),结构表征结果见图1和图2。
52.实施例2
53.1、称取5g碳酸氢钠和20g十水合四硼酸钠加入100ml去离子水中,用氩气鼓泡30分钟以除去溶液中的氧气;随后,在溶液中加入6g盐酸多巴胺,搅拌5分钟使其溶解,得到反应液;将6g甲基丙烯酸酐溶于15ml四氢呋喃后,逐滴加入到反应液中,在氩气保护下,室温搅拌反应14小时,反应过程用不断加1mol/l naoh水溶液调节ph,使整个反应体系保持ph》8。反应后的混合液减压抽滤,除去碳酸氢钠和十水合四硼酸钠固体,澄清透明的滤液用乙酸乙酯萃取3次,萃取过程中用浓盐酸调节ph≤2。将萃取后的上层有机溶液中加入无水mgso4密封于冰箱中冷藏干燥过夜,除去有机溶液中多余的水分,然后将冷藏干燥后的溶液抽滤除去mgso4,旋蒸浓缩至50ml左右,在剧烈搅拌下逐滴滴入450ml冰正己烷中,剧烈搅拌直至出现褐色固体,置于冰箱中冷藏过夜重结晶,抽滤得到最终固体产物并于真空干燥箱中室温烘干,得到3-甲基丙烯酰多巴胺(记为dma),结构表征结果见图3。
54.2、取0.3g dma、0.6g甲基丙烯酸(maa)和0.045g aibn加入到5ml二甲基亚砜(dmso)中,搅拌使之充分溶解,用氩气鼓泡30分钟以保证除尽溶液中的氧气。然后将反应液于65℃的油浴中持续反应12小时。反应结束后,反应液用3kd的透析袋透析48小时,每12小时换一次水,以除去副产物。透析之后,取截留液用液氮冰冻后放入冻干机中冻干,得到dma与甲基丙烯酸的共聚物(记为pmaa-dma),结构表征结果见图4和图5。
55.实施例3
56.分别称取36mgε-聚赖氨酸(epl)、200mg茶多酚(gtp)加入到20ml二甲基亚砜(dmso)中,搅拌并超声使各自充分溶解;将80mg抗坏血酸加入到2g过氧化氢中充分搅拌至完全溶解,再将该溶液加入到ε-聚赖氨酸溶液中孵育2小时,最后加入gtp溶液持续反应7天。反应结束后,反应液旋蒸除去dmso,用乙醇重新分散后,将溶液加入乙酸乙酯中洗涤,将溶液离心后固液分离,向固体中加乙醇分散均匀,然后加入乙醚中沉降,离心后固液分离,向固体中加入适量水冻干,得到接枝gtp的聚合物(记为epl-gtp),结构表征结果见图6和图7。
57.实施例4
58.分别称取80mgε-聚赖氨酸(epl)、58mg没食子酸(ga)加入到15ml二甲基亚砜(dmso)中,搅拌并超声使各自充分溶解;将50mg抗坏血酸加入到1g过氧化氢中充分搅拌至
完全溶解,再将该溶液加入到ε-聚赖氨酸溶液中孵育2小时,最后加入ga溶液持续反应24小时。反应结束后,反应液旋蒸除去dmso,用乙醇重新分散后,将溶液加入乙酸乙酯中洗涤,将溶液离心后固液分离,向固体中加乙醇分散均匀,然后加入乙醚中沉降,离心后固液分离,向固体中加入适量水冻干,得到接枝gtp的聚合物(记为epl-ga),结构表征结果见图8和图9。
59.图10的sem图表明,pmaa-dma与epl-ta的纳米粒子在100nm左右,epl-ta被活性氧氧化交联后形成无规则的聚合物网络。
60.应用例1
61.实施例1~4制备的多酚聚合物的体外抗肿瘤活性
62.将hela多细胞肿瘤球与pmaa-dma的培养基溶液(500μg/ml)共孵育24小时,再加入20μm dcfh-da荧光探针的d-pbs溶液继续孵育30分钟。以未经处理hela多细胞肿瘤球作为对照。在492nm激光激发下,用共聚焦显微镜拍摄荧光成像并进行分析,见图11。未经任何处理hela多细胞肿瘤球对照组具有强烈的绿色荧光,表明其中的活性氧含量较高(见图11a),而与pmaa-dma共孵育后的hela多细胞肿瘤球的绿色荧光减弱许多(见图11b),表明pmaa-dma消耗一定量的活性氧,以左边为起点对其进行划线荧光强度分析,可以更明显看出与pmaa-dma共孵育后的hela多细胞肿瘤球荧光强度的减弱。
63.将0.5mg/ml的epl-ta与在琼脂糖凝胶中的hela多细胞肿瘤球孵育48小时。然后取琼脂糖凝胶在2.5%戊二醛水溶液中浸泡1小时,用去离子水洗涤5次(每次5分钟),然后依次用体积浓度为20%、40%、60%、80%、85%、90%、95%和100%乙醇水溶液(每个浓度孵育15分钟)脱水。接下来,将样品置于六甲基二硅氮烷和乙醇(1:3体积比)的混合物中15分钟,然后浸入纯六甲基二硅氮烷中15分钟,在空气中干燥一夜。将干燥后的在琼脂糖凝胶中的hela多细胞肿瘤球进行sem拍摄,以未经任何处理的hela多细胞肿瘤球为参照,见图12。由图可见,没有与epl-ta共孵育的hela多细胞肿瘤球表面光滑整洁,而与epl-ta共孵育的hela多细胞肿瘤球共孵育的hela多细胞肿瘤球表面被厚且密集的聚合物网络所覆盖。
64.将培养好的hela多细胞肿瘤球与pmaa-dma共孵育,分别在24小时、48小时、72小时通过血糖仪检测细胞培养基中葡萄糖的含量,以未经处理hela多细胞肿瘤球作为对照,见图13。由图可见,对照组培养基葡萄糖含量比pmaa-dma组要明显的下降的更快,因此证明了包覆后的hela多细胞肿瘤球对葡萄糖的吸收减少。
65.将培养好的hela贴壁细胞与epl-ta共孵育,在不同时间点通过试剂盒来检测细胞中营养物质如葡萄糖、谷胱甘肽(gsh)的含量,以未经处理hela贴壁细胞作为对照,见图14~15。由图可见,对照组培养基葡萄糖含量比epl-ta组要明显的下降的更快,gsh含量比epl-ta组要明显下降的更慢。因此证明了包覆后的hela多细胞肿瘤球对葡萄糖的吸收减少。
66.将培育好的hela贴壁细胞用pbs缓冲液清洗一次,再分别加入含pmaa-dma、epl-ta、epl-gtp和epl-ga的培养基溶液共孵育。然后弃掉培养基,并用新鲜dmem培养基清洗一次以除去残留的材料,清洗之后每孔加入100μl alamar blue染液(以新鲜dmem培养基配制为10%)于37℃、5%co2细胞培养箱培养4小时后,用酶标仪在530nm激发和590nm发射下测得各组的荧光强度,并计算出各组的细胞存活率,见图16~19。实验结果说明epl-ta、epl-gtp、epl-ga对hela贴壁细胞具有一定的抗肿瘤效果。
67.多细胞肿瘤球体对于研究肿瘤行为和评估药理活性药物的反应很有意义,我们使用一种商业化模具3d petri dish制备hela多细胞肿瘤球。在这种方法中,细胞沉降到3d petri dish制备的微成型非粘性的琼脂糖凝胶小凹槽中,并聚集成多细胞球。将制备好的hela多细胞肿瘤球分别用含pmaa-dma、epl-ta、epl-gtp和epl-ga的培养基溶液轻轻从琼脂糖凝胶上吹下,然后继续在37℃、5% co2环境下孵育。置换新鲜培养液后,向每个孔内加入100μl10% alarm bule溶液,继续孵育4小时,用酶标仪测定每个孔溶液530nm激发、590nm处的发射。计算出各组的细胞存活率,见图20~23。实验结果说明pmaa-dma对hela多细胞肿瘤球具有较强毒性,产生了饥饿治疗效果。同时pmaa-dma对贴多细胞球具有一定的治疗效果,而对贴壁细胞治疗效果不明显,是因为多细胞球的三维结构使得聚合物更容易包覆住多细胞球,实现饥饿治疗。
68.从新西兰兔耳静脉中得到新鲜的肝素钠抗凝的全血,在室温静置2小时后,于1000r.p.m转速下离心10分钟得到富含血红细胞溶液,并用无菌生理盐水清洗至上清液无色后,将其用生理盐水配成5%(v/v)的血红细胞溶液待用;将等体积500μl pmaa-dma生理盐水溶液和血红细胞溶液加入1.5ml无菌ep管中轻晃混匀(pmaa-dma的最终浓度为0、0.0125、0.025、0.05、0.1、0.2、0.4、0.8、1.6、3.2、6.4mg/ml),并以生理盐水作为阴性对照,0.1%(v/v)的曲拉通(triton x-100)的生理盐水溶液作为阳性对照,同样处理;将所有的ep管放入37℃摇床150r.p.m孵育1小时;孵育完之后,将ep管置于离心机中于1000r.p.m转速下离心10分钟后,取每个ep管上层清液80μl分别加到96孔板中,并在每个孔中再加入80μl的生理盐水至每孔溶液体积为160μl,混合均匀。最后,用酶标仪测定每孔溶液在545nm处的吸光度,计算出各组的溶血率,结果如图24所示。由图可见,红细胞在与阴性对照生理盐水和不同浓度的pmaa-dma共孵育1小时后,没有出现明显的溶血现象,而在与阳性对照组0.1% tritonx-100共孵育1小时后,ep管中的溶液呈现鲜明的红色,离心后仍为均一的红色溶液,表现出明显的溶血现象,这是因为0.1%tritonx-100使红细胞细胞膜破裂,并释放出了大量的血红蛋白所致。浓度为0、0.0125、0.025、0.05、0.1、0.2、0.4、0.8、1.6、3.2mg/ml pmaa-dma对红细胞的溶血率均低于5%,远低于阳性对照组0.1%tritonx-100的溶血率(约为100%)。以上结果表明pmaa-dma具有良好的血液相容性,能够在体内长效循环。
69.肿瘤侵袭性研究主要通过transwell和基质胶(matrigel)进行分析。将在-20℃保存的基质胶放在4℃冰箱冰浴过夜溶解,枪头和离心管在使用前在-20℃保存,保证matrigel在包被过程中不会提前凝固。用8.1mg/ml matrigel和无血清的dmem培养基按1:8稀释,取50μl包被transwell小室底部膜的上室面,4℃下风干,置于37℃培养箱30分钟使matrigel聚合成凝胶。加入hela多细胞肿瘤球前先让细胞球用无血清dmem培养基饿24小时,进一步去除血清的影响。用pbs缓冲液洗2遍包被好matrigel的transwell,用200μldmem培养基溶解epl-ta并使其浓度为300mg/ml,分散好hela多细胞肿瘤球后加入上室中,在下室加入具有fbs的dmem培养基。具有侵袭能力的细胞在血清诱导下开始穿膜运动,24小时后观察结果。穿过滤膜的细胞多数粘附在滤膜下表面,用棉签将上表面的细胞拭去,然后用2.5%戊二醛水溶液固定滤膜20分钟,无菌d-pbs冲洗2遍后用浓度为0.1%结晶紫无菌d-pbs溶液染色20分钟,用无菌d-pbs冲洗3遍。用棉签轻轻擦拭transwell上层膜,擦去上层细胞。然后用智能全自动活细胞荧光显微成像系统拍摄transwell下层膜,然后用imagej软件对穿过膜的细胞进行计数,结果见图25。通过结晶紫染色后,可以看出未经任何处理的对照
组肿瘤细胞侵袭数(25a)明显较epl-ta组肿瘤细胞侵袭数(图25b)要多,通过imagej软件分析细胞数,对照组肿瘤细胞侵袭数(80个)为epl-ta组肿瘤细胞侵袭数(20个)的4倍(图25c),表明hela多细胞肿瘤球与epl-ta共孵育后,细胞侵袭能力下降了3倍。
70.以上证明多酚聚合物可以通过使癌细胞饥饿,阻碍细胞对营养物质的吸收以及抑制细胞侵袭来实现抗肿瘤效果。
71.应用例2
72.实施例1~4制备的多酚聚合物的体内抗肿瘤活性
73.将hela荷瘤鼠随机分为三组,待肿瘤体积生长至75mm3时,分别:(1)尾静脉注射200μl无菌d-pbs;(2)尾静脉注射200μl pmaa-dma(1mg/ml);(3)尾静脉注射200μl epl-ta(1mg/ml)。经不同处理后,每两天统计裸鼠的体重、肿瘤体积变化及死亡率,见图26~28。结果显示pmaa-dma和epl-ta具有良好的抗肿瘤能力。
74.将hela荷瘤鼠随机分为三组,待肿瘤体积生长至75mm3时,分别:(1)尾静脉注射200μl无菌d-pbs;(2)尾静脉注射200μl pmaa-dma(1mg/ml);(3)尾静脉注射200μl epl-ta(1mg/ml),利用苏木精伊红(h&e)染色法对肿瘤及主要器官进行病理分析,见图29。结果显示小鼠器官均并没有出现明显病变和炎症,表明pmaa-dma和epl-ta在小鼠体内具有较低的生物毒性。对于肿瘤组织而言,可以观察到对照组的肿瘤细胞没有受到任何破坏;pmaa-dma组部分肿瘤细胞遭到破坏,而epl-ta组肿瘤细胞大部分死亡,与肿瘤生长统计结果一致。
75.以上证明多酚聚合物在动物模型中具有良好的抗肿瘤效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1