一种吲达帕胺片及其制备方法与流程
本发明涉及药物制备,具体为一种吲达帕胺片及其制备方法。
背景技术:
1、高血压是现代社会最常见的慢性病,也是心脑血管病最主要的危险因素。吲达帕胺为含吲哚基的磺胺类利尿降压药,是一种长效的、作用较强的抗高血压药,具有利尿和钙拮抗作用,对血管平滑肌有较高选择性,能阻滞钙离子内流,使外周血管阻力下降,产生降压作用,用于治疗原发性高血压。
2、吲达帕胺原始配方由法国施维雅(servier)公司研制,并于1989年在国内批准进口上市,商品名为natrilix。我国是仿制药生产大国,在过去的几十年中仿制药在我国发挥了重要的社会效益。由于历史原因,过去一段时间内市场上的吲达帕胺剂型控制缺乏管理标准,质量不统一,批准的仿制药并未严格的与原研药物进行质量上的对比研究,即由于质量上的差异导致了产品在临床疗效和安全性上存在差异,不能很好的发挥药品治病救人的效果。为了提升仿制药行业的整体水平,我国于2012年开始推行仿制药一致性评价政策,要求仿制药的质量疗效必须达到和原研药一样的效果。
3、体外溶出试验常用于指导药物制剂的研发、评价制剂批内批间质量的一致性、评价药品处方工艺变更前后质量和疗效的一致性等。普通口服固体制剂,可采用比较仿制制剂与参比制剂体外多条溶出曲线相似性的方法,评价仿制制剂的质量,降低两者出现临床疗效差异的风险。
4、目前常规的吲达帕胺片剂主要采用直接混合、湿法制粒工艺或直接压片工艺制备。直接压片工艺容易引起api(api即为活性医药物成分)分布不均,并且粉末流动性差导致片重差异较大,进而导致批内或批间差异大。常规的湿法制粒工艺容易出现原辅料的粒径大小不均匀,从而影响吲达帕胺溶出速率,造成药剂溶出过快或过慢,不易控制药物释放量的问题,且湿法制粒过程容易产生杂质。中国专利文献cn202110469904.9公开了一种吲达帕胺制剂,所述制剂由吲达帕胺、填充剂、预胶化淀粉、阻滞剂及助流剂构成,填充剂选自糖粉、糊精、玉米淀粉、微晶纤维素、预胶化淀粉、甘露醇、二水硫酸钙、乳糖、蔗糖中的一种或几种组成,通过使用羟丙甲纤维素e3作为粘合剂,将辅料对吲达帕胺制剂的基因毒性杂质的影响降至最低,使吲达帕胺制剂使用更安全,同时使用直接混合的方法,避免湿法制粒中水分对吲达帕胺的水解生成基因毒性杂质c,但是该专利采用直接混合,使制剂的混合均匀性与药剂释放均匀性和湿法制粒工艺相比存在一定差距;中国专利文献cn201810787639.7公开了一种吲达帕胺缓释片的制备方法,采用直接压片工艺,以高分子物质羟甲基纤维素作为骨架材料,以吲达帕胺为活性成分,并加入一定量的释放速度调节剂,使所制备的吲达帕胺片的体外和体内特征与参比制剂保持一致,且对杂质的影响小;但是该专利采用的直接压片工艺,使制剂的混合均匀性与药剂释放均匀性和湿法制粒工艺相比存在一定差距。因此需要寻找一种降低吲达帕胺片溶出释放过程的处方工艺,并提高制剂的混合均匀性与药剂释放均匀性,使得制备的吲达帕胺片与原研具有相似的体外溶出度,相似性高,从而保证吲达帕胺片产品的质量和疗效。
技术实现思路
1、针对现有技术中存在的问题,本发明提供了一种吲达帕胺片及其制备方法,通过改进吲达帕胺片处方量配比和工艺参数,优化处方量配比和工艺参数对吲达帕胺片溶出曲线的影响,降低吲达帕胺片溶出释放速度,控制其与原研药体外溶出行为差异,提高吲达帕胺片产品的质量和疗效。
2、本发明提供一种吲达帕胺片,按重量份数计,包括吲达帕胺25-30份、乳糖750-900份、预胶化淀粉50-120份、聚维酮30-50份、硬脂酸镁9-11份、滑石粉9-11份和包衣粉40-50份。
3、本发明还提供一种吲达帕胺片的制备方法,包括如下步骤:
4、s1、原料预处理:将乳糖、预胶化淀粉、硬脂酸镁、滑石粉和吲达帕胺过筛备用;
5、s2、预混及湿法制粒:将乳糖、部分预胶化淀粉、吲达帕胺置于湿法制粒机中进行预混,再加入预胶化淀粉浆进行湿法制粒,得到湿粒;
6、s3、干燥:将湿颗粒置于流化床进行干燥,将干燥好的颗粒进行整粒,得到干粒;
7、s4、总混:将干粒加入聚维酮、硬脂酸镁和滑石粉进行总混,得到总混颗粒;
8、s5、压片、包衣:将总混颗粒进行压片、加入包衣液进行包衣,即得吲达帕胺片。
9、进一步地,所述步骤s2中的预胶化淀粉浆为剩下的预胶化淀粉添加纯水配成浓度为8%-15%的预胶化淀粉浆。
10、进一步地,所述步骤s1中的过筛包括:先将乳糖用100目筛进行过筛,再依次将预胶化淀粉、硬脂酸镁、滑石粉和吲达帕胺分别用80目筛进行过筛。
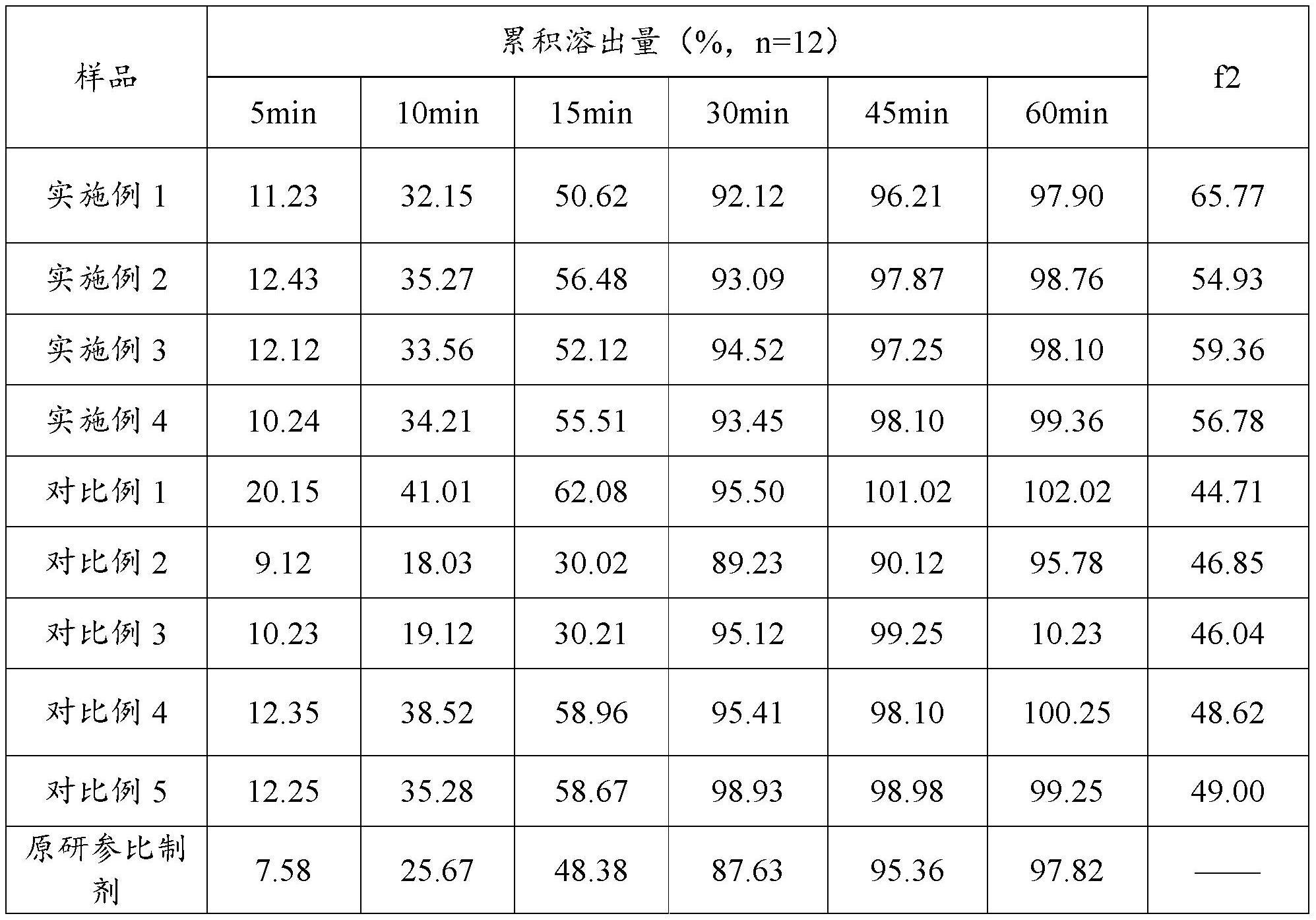
11、进一步地,所述步骤s2中的预混包括设置搅拌速度为50-120rpm和设置切割速度为800-1500rpm。
12、进一步地,所述步骤s2中的预混时间为200-400s。
13、进一步地,所述步骤s2中的湿法制粒时间为10-25min。
14、进一步地,所述步骤s3中的干燥包括控制进风温度在100℃以内,控制水分<2.0%。
15、进一步地,所述步骤s4中的总混包括先加入聚维酮在转速8-10rpm下混合5-15min,再加入硬脂酸镁和滑石粉继续混合5-15min。
16、更进一步地,所述步骤s4中的聚维酮、硬脂酸镁和滑石粉的质量比为(3-7):1:1。
17、与现有技术相比,本发明的有益效果是:
18、1、本发明通过改进吲达帕胺片的处方配比和制备工艺参数,调整合适的预胶化淀粉浆浓度,减少辅料的不良影响,从而降低吲达帕胺片溶出释放速度,控制其溶出行为与原研一致,相似因子达到50以上,最终实现和原研药品质量和疗效一致,保证了吲达帕胺片的产品疗效,并且制备工艺更简单。
19、2、本发明通过在步骤s2中先将吲达帕胺与填充剂乳糖、崩解剂预胶化淀粉充分混合,再加入质量百分比浓度为8%-15%的预胶化淀粉浆混合,进行湿法制粒,可以确保吲达帕胺与辅料充分混合均匀,使得原辅料的粒径大小均匀,保证吲达帕胺溶出速率和药物释放量与原研药品一致,实现药品质量和疗效一致。
20、3、本发明通过将湿法制粒得到的湿粒先进行干燥,然后加入聚维酮在转速8-10rpm下混合5-15min,再加入硬脂酸镁和滑石粉继续混合5-15min,通过调整聚维酮、硬脂酸镁和滑石粉的质量比,控制混合时间,从而控制吲达帕胺片合适的溶出速率和保证吲达帕胺片的溶出度与原研一致。
技术特征:
1.一种吲达帕胺片,其特征在于,按重量份数计,包括吲达帕胺25-30份、乳糖750-900份、预胶化淀粉50-120份、聚维酮30-50份、硬脂酸镁9-11份、滑石粉9-11份和包衣粉40-50份。
2.一种如权利要求1所述的吲达帕胺片的制备方法,其特征在于,包括如下步骤:
3.根据权利要求2所述的吲达帕胺片的制备方法,其特征在于,所述步骤s2中的预胶化淀粉浆为将剩下的预胶化淀粉添加纯水配成浓度为8%-15%的预胶化淀粉浆。
4.根据权利要求2所述的吲达帕胺片的制备方法,其特征在于,所述步骤s1中的过筛包括:先将乳糖用100目筛进行过筛,再依次将预胶化淀粉、硬脂酸镁、滑石粉和吲达帕胺分别用80目筛进行过筛。
5.根据权利要求2所述的吲达帕胺片的制备方法,其特征在于,所述步骤s2中的预混包括设置搅拌速度为50-120rpm和设置切割速度为800-1500rpm。
6.根据权利要求2所述的吲达帕胺片的制备方法,其特征在于,所述步骤s2中的预混时间为200-400s。
7.根据权利要求2所述的吲达帕胺片的制备方法,其特征在于,所述步骤s2中的湿法制粒时间为10-25min。
8.根据权利要求2所述的吲达帕胺片的制备方法,其特征在于,所述步骤s3中的干燥包括控制进风温度在100℃以内,控制水分<2.0%。
9.根据权利要求2所述的吲达帕胺片的制备方法,其特征在于,所述步骤s4中的总混包括先加入聚维酮在转速8-10rpm下混合5-15min,再加入硬脂酸镁和滑石粉继续混合5-15min。
10.根据权利要求9所述的吲达帕胺片的制备方法,其特征在于,所述步骤s4中的聚维酮、硬脂酸镁和滑石粉的质量比为(3-7):1:1。
技术总结
本发明公开了一种吲达帕胺片及其制备方法,所述吲达帕胺片的配方包括:按重量份数计,吲达帕胺25‑30份、乳糖750‑900份、预胶化淀粉50‑120份、聚维酮30‑55份、硬脂酸镁9‑11份、滑石粉9‑11份和包衣粉40‑50份;本发明的吲达帕胺片的制备方法包括原料预处理、预混及湿法制粒、干燥、总混、压片及包衣,制备工艺简单。本发明通过改进吲达帕胺片的处方配比和制备工艺参数,并调整合适的预胶化淀粉浆浓度,控制吲达帕胺片的溶出行为与原研吲达帕胺片一致,相似因子达到50以上,最终实现和原研药品质量和疗效一致,从而保证吲达帕胺片疗效。
技术研发人员:黄慧云,潘翠萍,吴继丽,方淑玲,王春彬
受保护的技术使用者:广东安诺药业股份有限公司
技术研发日:
技术公布日:2024/1/12
- 还没有人留言评论。精彩留言会获得点赞!