赛洛西宾组合物、其制备方法和使用方法与流程
背景技术:
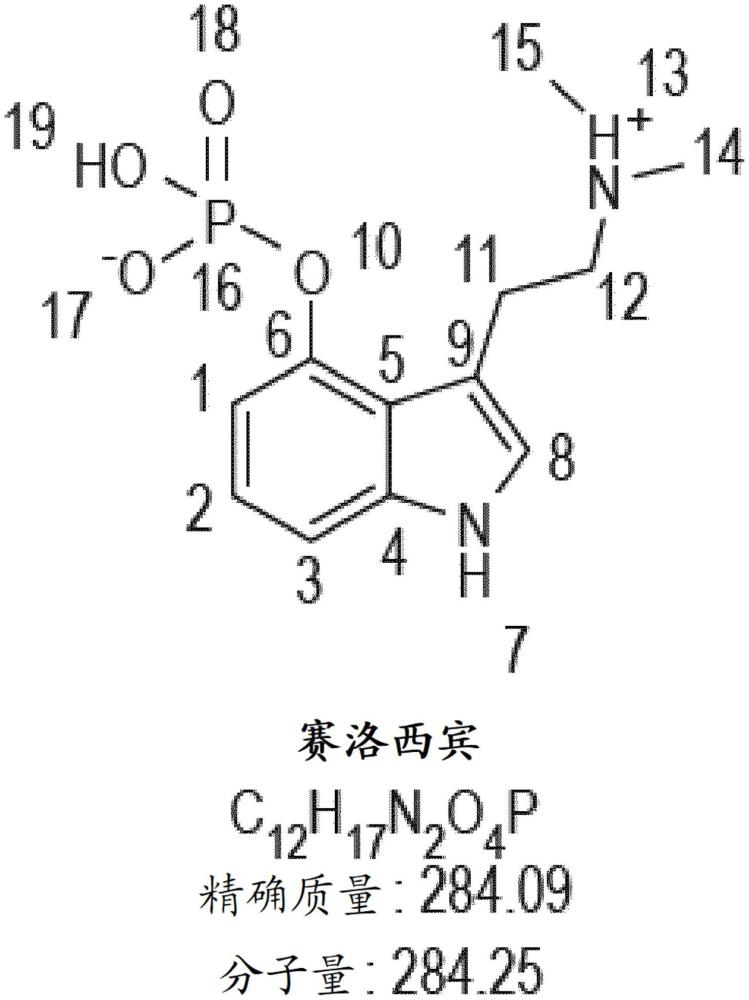
1、赛洛西宾(psilocybin)属于迷幻药(“精神显现(mind-manifesting)”药物)类的药物。具体来说,赛洛西宾被视为一种5-羟色胺能(血清素能)迷幻剂,不同于其他色胺如二甲基色胺(dmt)、麦角灵(ergoline)如麦角酸二乙酰胺(lsd)、和苯乙胺如麦司卡林(mescaline)。赛洛西宾最初是从裸盖菇(psilocybe mushroom)中分离出来的,后来在实验室中合成。
2、为提供潜在的治疗应用,本领域中需要满足核准的药品监管标准(例如,在产品储存期间稳定和可接受的含量均一性)的赛洛西宾的药物组合物。
技术实现思路
1、赛洛西宾由于其物理特性和潜在的化学不稳定性(例如,容易水解成赛洛辛(psilocin)),是一种在配制时具有挑战性的活性药物成分(active pharmaceuticalingredient,api)。结晶赛洛西宾是一种针状、棒状晶体,具有高纵横比,并且因此具有较差的流动性(特别是水合物形式),这对于直接混合配制规模放大和商业制造而言是非所需的。此外,在药物开发期间(参见实施例1),申请人发现在ich稳定性测试条件下储存药品时,含有某些常用的含二氧化硅赋形剂的固体剂型提供了不理想的结果(例如,药品变色并且效力损失而没有相应增加赛洛西宾相关物质杂质)。最后,鉴于赛洛西宾的迷幻性质,其应作为低剂量药物施用(例如,对于一些适应症可使用1mg的赛洛西宾)。因此,合适的制剂必须允许适应低api负载,但提供药学上可接受的含量均一性(如通过欧洲药典2.96.或usp<905>所测量)。
2、本公开涉及含有赛洛西宾的药物组合物和其制备方法。
3、在一个方面,本公开提供了一种药物组合物,其包含:治疗有效量的赛洛西宾;和一种或多种药学上可接受的赋形剂,其中在工业和药学上可接受的储存条件(例如,欧洲药典,usp)下,所述组合物中赛洛西宾的效力和所述组合物中赛洛西宾和相关物质的质量平衡保持在工业和药学上可接受的水平(例如,欧洲药典,usp),并且赛洛西宾是以药学上可接受的含量均一性来提供(如通过欧洲药典2.96.或usp<905>所测量)。
4、在一个方面,本公开提供了一种药物组合物,其包含:治疗有效量的赛洛西宾;和一种或多种药学上可接受的赋形剂,其中,所述组合物在40℃和75%相对湿度下储存一个月后,所述组合物中赛洛西宾的效力降低小于5%,并且赛洛西宾和相关物质的质量平衡大于97%。
5、在一个方面,本公开提供了一种制备药物组合物的方法,所述方法包括:(a)将赛洛西宾与一种或多种药学上可接受的赋形剂直接混合以提供掺合物,以及(b)用所述掺合物填充胶囊以提供药物组合物,其中所述组合物的含量均一性符合欧洲药典2.96.或usp<905>。
技术特征:
1.一种药物组合物,所述药物组合物包含:
2.如权利要求1所述的药物组合物,其中所述一种或多种药学上可接受的赋形剂包含稀释剂。
3.如权利要求1-2中任一项所述的药物组合物,其中所述一种或多种药学上可接受的赋形剂包含润滑剂。
4.如权利要求1-3中任一项所述的药物组合物,其中所述组合物包含:
5.如权利要求1-4中任一项所述的药物组合物,其中所述组合物包含约1重量%-10重量%的赛洛西宾。
6.如权利要求1-4中任一项所述的药物组合物,其中所述组合物包含约1重量%-15重量%的赛洛西宾。
7.如权利要求1-6中任一项所述的药物组合物,其中所述稀释剂是预糊化淀粉。
8.如权利要求1-7中任一项所述的药物组合物,其中所述稀释剂的卡尔指数为约12%至约21%。
9.如权利要求1-8中任一项所述的药物组合物,其中所述稀释剂的卡尔指数为约21%。
10.如权利要求1-9中任一项所述的药物组合物,其中所述稀释剂的平均粒度为约60微米至约120微米。
11.如权利要求1-10中任一项所述的药物组合物,其中所述稀释剂的平均粒度为约90微米。
12.如权利要求1-11中任一项所述的药物组合物,其中所述稀释剂的流速为约2g/sec至约10g/sec,如使用sotax ft300流动性测试仪所测量(振动设定在1.7g)。
13.如权利要求1-12中任一项所述的药物组合物,其中所述润滑剂选自由以下组成的组:硬脂基反丁烯二酸钠、硬脂酸镁、硬脂酸钙、硬脂酸锌、单硬脂酸甘油酯、山嵛酸甘油酯、棕榈硬脂酸甘油酯、月桂基硬脂酸镁、硬脂酸、滑石和氢化蓖麻油。
14.如权利要求13所述的药物组合物,其中所述润滑剂是硬脂基反丁烯二酸钠。
15.如权利要求1-14中任一项所述的药物组合物,其中通过hplc分析所确定,所述组合物中赛洛西宾的化学纯度大于97%。
16.如权利要求1-14中任一项所述的药物组合物,其中通过hplc分析所确定,所述组合物中赛洛西宾的化学纯度大于97%并且不含大于2%的单一杂质。
17.如权利要求1-14中任一项所述的药物组合物,其中通过hplc分析所确定,所述组合物中赛洛西宾的化学纯度大于97%并且不含大于1%的单一杂质。
18.如权利要求1-17中任一项所述的药物组合物,其中所述组合物包含1mg至40mg的赛洛西宾。
19.如权利要求1-17中任一项所述的药物组合物,其中所述组合物包含1mg的赛洛西宾。
20.如权利要求1-17中任一项所述的药物组合物,其中所述组合物包含5mg的赛洛西宾。
21.如权利要求1-17中任一项所述的药物组合物,其中所述组合物包含10mg的赛洛西宾。
22.如权利要求1-17中任一项所述的药物组合物,其中所述组合物包含25mg的赛洛西宾。
23.如权利要求1-17中任一项所述的药物组合物,其中所述组合物包含40mg的赛洛西宾。
24.如权利要求1-23中任一项所述的药物组合物,其中所述赛洛西宾包含结晶赛洛西宾。
25.如权利要求24所述的药物组合物,其中所述结晶赛洛西宾是结晶多晶型物a。
26.如权利要求24所述的药物组合物,其中所述结晶赛洛西宾是结晶水合物a。
27.如权利要求24所述的药物组合物,其中所述结晶赛洛西宾是结晶多晶型物a'。
28.如权利要求24所述的药物组合物,其中所述结晶赛洛西宾是结晶多晶型物b。
29.如权利要求1-23中任一项所述的药物组合物,其中所述赛洛西宾包含非晶形赛洛西宾。
30.如权利要求1-29中任一项所述的药物组合物,其中所述组合物是胶囊。
31.如权利要求30所述的药物组合物,其中所述胶囊材料包含甲基纤维素、结冷胶、角叉菜胶、果胶、甘油、羟丙基(hp)淀粉、增塑剂、缓冲剂(例如,磷酸盐缓冲剂)、非晶形淀粉(例如,支链淀粉)、软化剂或其组合。
32.如权利要求30所述的药物组合物,其中所述胶囊材料包含羟丙基甲基纤维素。
33.如权利要求30所述的药物组合物,所述胶囊材料包含淀粉(例如,羟丙基淀粉或支链淀粉)。
34.如权利要求30所述的药物组合物,所述胶囊材料包含约1%至约7%的水分含量。
35.如权利要求30所述的药物组合物,其中所述胶囊材料包含小于约6%的水分含量。
36.如权利要求1-29中任一项所述的药物组合物,其中所述组合物是片剂。
37.如权利要求1-23中任一项所述的药物组合物,其中所述组合物是溶液。
38.如权利要求1-36中任一项所述的药物组合物,其中所述组合物的含量均一性符合欧洲药典2.96.或usp<905>。
39.一种制备药物组合物的方法,所述方法包括:
40.如权利要求39所述的方法,其中所述组合物在40℃和75%相对湿度下储存一个月后,所述组合物中赛洛西宾和相关物质的质量平衡降低小于3%。
41.如权利要求39-40中任一项所述的方法,其中所述掺合物包含约1重量%至约10重量%的赛洛西宾。
42.如权利要求39-41中任一项所述的方法,其中所述胶囊含有1mg、5mg、10mg或25mg的赛洛西宾。
43.如权利要求39-42中任一项所述的方法,其中所述一种或多种药学上可接受的赋形剂包含稀释剂。
44.如权利要求39-43中任一项所述的方法,其中所述掺合物还包含润滑剂。
45.如权利要求39-44中任一项所述的方法,其中所述掺合物不含助流剂。
46.如权利要求39-45中任一项所述的方法,其中所述胶囊材料包含甲基纤维素、结冷胶、角叉菜胶、果胶、甘油、羟丙基(hp)淀粉、增塑剂、缓冲剂(例如,磷酸盐缓冲剂)、非晶形淀粉(例如,支链淀粉)、软化剂或其组合。
47.如权利要求39-45中任一项所述的方法,其中所述胶囊材料包含羟丙基甲基纤维素。
48.如权利要求39-47中任一项所述的方法,其中所述胶囊材料包含淀粉(例如,羟丙基淀粉或支链淀粉)。
49.如权利要求39-47中任一项所述的方法,其中所述胶囊材料包含约1%至约7%的水分含量。
50.如权利要求39-47中任一项所述的方法,其中所述胶囊材料包含小于约6%的水分含量。
51.一种通过权利要求39-51中任一项所述的方法制备的药物组合物。
52.一种治疗心境障碍的方法,所述方法包括施用治疗有效量的权利要求1-38和51中任一项所述的组合物。
技术总结
本公开提供包含治疗有效量的赛洛西宾和一种或多种药学上可接受的赋形剂的药物组合物。还公开了制备此类组合物的方法和所述组合物在治疗抑郁症中的用途。
技术研发人员:D·P·埃尔德,N·理查森
受保护的技术使用者:指南针探路者有限公司
技术研发日:
技术公布日:2024/2/1
- 还没有人留言评论。精彩留言会获得点赞!