索托拉西布制剂的制作方法
背景技术:
1、从1982年被鉴定为第一批人类致癌基因之一(der等人,1982)以来,kras(kirsten大鼠肉瘤病毒致癌基因同源物)作为mapk信号转导通路中的一个关键节点,作为平行效应通路网络中的转化因子(例如,pi3k/akt)(vojtek等人,1998)以及作为抗癌剂的潜在靶标(malumbres等人,2003),一直是大量学术和工业研究的焦点。尽管在mapk通路(例如,egfr(sridhar等人,2003)、braf(holderfield等人,2014)和mek(caunt等人,2015))中的上游和下游节点抑制剂的开发方面取得了进展,但从历史上来看,kras蛋白已被证明对直接抑制具有抗性。
2、kras是一种g蛋白,其可将细胞外促有丝分裂信号与细胞内促增殖反应相结合。kras充当细胞内的“开/关”开关。丝裂原刺激诱导gtp与kras结合,引起构象变化,使kras与下游效应蛋白相互作用,从而导致细胞增殖。通常,促增殖信号受gtp酶激活蛋白(gap)的作用调节,以使kras恢复到其gdp结合的非增殖状态。kras的突变会削弱kras在这些gdp和gtp结合状态之间的调节循环,导致gtp结合活性状态的积累和失调的细胞增殖(simanshu等人,2017)。
3、开发突变kras蛋白抑制剂的尝试历来因蛋白质表面缺乏可成药口袋而受阻(cox等人,2014)。随后该领域的发现为kras抑制剂研究注入了重大的新努力,最近在kras抑制剂进入人体临床试验中达到了高潮。参见https://clinicaltrials.gov/:例如,nct03600883和nct04185883(索托拉西布(sotorasib),amg 510)(最后访问时间为2021年4月23日)。这些努力最近最终导致向美国食品和药物管理局提交了一份关于索托拉西布的新药申请(美商安进公司新闻稿,2020年12月16日;https://wwwext.amgen.com/newsroom/press-releases/2020/12/amgen-submits-sotorasib-ne w-drug-application-to-u-s--fda-for-advanced-or-metastatic-non-small-cell-lung-cancer-with-kras-g12c-mutation,最后访问时间为2021年4月21日)。
4、因此,需要适合患者的索托拉西布制剂。
技术实现思路
1、本文提供了索托拉西布的制剂。在一方面,本文描述了包含索托拉西布、40%-95%(w/w)的量的稀释剂、0.5%-5%(w/w)的量的崩解剂和0.25%-5%(w/w)的量的制剂。在一些实施例中,制剂包含1%-20%(w/w)的量的索托拉西布。在一些实施例中,制剂包含20%-45%(w/w)的量的索托拉西布。在一些实施例中,制剂包含61%-91%(w/w)的量的稀释剂。在一些实施例中,制剂包含51%-77%(w/w)的量的稀释剂。
2、在另一个方面,本文所述的制剂用作药物或用于治疗癌症。
3、在另一个方面,本文描述了治疗患者癌症的方法,该方法包括向患者施用以本文所述的制剂提供的治疗有效量的索托拉西布,其中该制剂以一个或多个剂量单位提供治疗有效量。
4、术语“受试者”和“患者”在本文中可互换使用。术语“多个受试者”和“多个患者”在本文中可互换使用。
技术特征:
1.一种制剂,其包含
2.如权利要求1所述的制剂,其包含1%-50%(w/w)的量的索托拉西布。
3.如权利要求1或权利要求2所述的制剂,其中该稀释剂包含乳糖、磷酸氢钙(dcp)、甘露醇、山梨糖醇、木糖醇、碳酸钙、碳酸镁、磷酸三钙、海藻糖、微晶纤维素和淀粉中的一种或多种。
4.如权利要求1-3中任一项所述的制剂,其中该稀释剂包含乳糖、磷酸氢钙(dcp)、甘露醇、微晶纤维素和淀粉中的一种或多种。
5.如权利要求1-4中任一项所述的制剂,其中该稀释剂包含乳糖和微晶纤维素中的一种或多种。
6.如权利要求1-4中任一项所述的制剂,其中该稀释剂包含乳糖和淀粉中的一种或多种。
7.如权利要求1-4中任一项所述的制剂,其中该稀释剂包含乳糖、磷酸氢钙(dcp)和甘露醇中的一种或多种。
8.如权利要求1-4和6中任一项所述的制剂,其中该淀粉是预糊化淀粉或玉米淀粉。
9.如权利要求3-7中任一项所述的制剂,其中乳糖是乳糖一水合物。
10.如权利要求1所述的制剂,其包含1%-20%(w/w)的量的索托拉西布。
11.如权利要求10所述的制剂,其包含20%(w/w)的量的索托拉西布。
12.如权利要求10或权利要求11所述的制剂,其包含61%-91%(w/w)的量的该稀释剂。
13.如权利要求10或权利要求11所述的制剂,其包含76%(w/w)的量的该稀释剂。
14.如权利要求10-13中任一项所述的制剂,其中该稀释剂包含塑性稀释剂和脆性稀释剂,其中按重量计该塑性稀释剂比该脆性稀释剂的比率范围为2.5:1至3.5:1。
15.如权利要求10-13所述的制剂,其中该稀释剂包含塑性稀释剂和脆性稀释剂,其中按重量计该塑性稀释剂比该脆性稀释剂的比率为3:1。
16.如权利要求1所述的制剂,其包含20%-45%(w/w)的量的索托拉西布。
17.如权利要求16所述的制剂,其包含20%(w/w)的量的索托拉西布。
18.如权利要求16所述的制剂,其包含32%(w/w)的量的索托拉西布。
19.如权利要求16或权利要求18所述的制剂,其包含51%-77%(w/w)的量的该稀释剂。
20.如权利要求16或权利要求18所述的制剂,其包含64%(w/w)的量的该稀释剂。
21.如权利要求16-21中任一项所述的制剂,其中该稀释剂包含塑性稀释剂和可选的脆性稀释剂,其中按重量计该塑性稀释剂比索托拉西布和如果存在时的该脆性稀释剂合计的比率范围为1.2:1至1.7:1。
22.如权利要求16-21中任一项所述的制剂,其中该稀释剂包含塑性稀释剂和可选的脆性稀释剂,其中按重量计该塑性稀释剂比索托拉西布和如果存在时的该脆性稀释剂合计的比率范围为1.4:1至1.5:1。
23.如权利要求1所述的制剂,其包含61%-91%(w/w)的量的该稀释剂。
24.如权利要求1所述的制剂,其包含76%(w/w)的量的该稀释剂。
25.如权利要求1所述的制剂,其包含51%-77%(w/w)的量的该稀释剂。
26.如权利要求1所述的制剂,其包含64%(w/w)的量的该稀释剂。
27.如权利要求23-26中任一项所述的制剂,其中稀释剂包含塑性稀释剂和可选的脆性稀释剂,并且其中
28.如权利要求27所述的制剂,其中该稀释剂包含塑性稀释剂和脆性稀释剂,并且其中该第一比率大于或等于3:1,并且该第二比率大于或等于1.4:1且小于3:1。
29.如权利要求23-26中任一项所述的制剂,其中该稀释剂包含塑性稀释剂且不含脆性稀释剂,并且其中按重量计该塑性稀释剂比索托拉西布的比率大于或等于1.4:1且小于3:1。
30.如权利要求14-15、21、22和27-29中任一项所述的制剂,其中该塑性稀释剂包含微晶纤维素和淀粉中的一种或多种。
31.如权利要求30所述的制剂,其中该塑性稀释剂是微晶纤维素。
32.如权利要求30所述的制剂,其中该塑性稀释剂是淀粉。
33.如权利要求30或权利要求32所述的制剂,其中该淀粉是预糊化淀粉或玉米淀粉。
34.如权利要求14-15、21、22、27和28中任一项所述的制剂,其中该脆性稀释剂包含乳糖、磷酸氢钙(dcp)、甘露醇、山梨糖醇、木糖醇、碳酸钙、碳酸镁、磷酸三钙和海藻糖中的一种或多种。
35.如权利要求34所述的制剂,其中该脆性稀释剂包含乳糖、磷酸氢钙(dcp)或甘露醇中的一种或多种。
36.如权利要求34所述的制剂,其中该脆性稀释剂是乳糖。
37.如权利要求34-36中任一项所述的制剂,其中该乳糖是乳糖一水合物。
38.如权利要求1-37中任一项所述的制剂,其包含1%-5%(w/w)的量的崩解剂。
39.如权利要求1-37中任一项所述的制剂,其包含3%(w/w)的量的崩解剂。
40.如权利要求1和38-39中任一项所述的制剂,其中该崩解剂包含交联的羧基甲基纤维素钠(交联羧甲基纤维素钠)、交联聚乙烯吡咯烷酮(交聚维酮)、羧基乙酸淀粉钠、预糊化淀粉、羧甲基纤维素钙、低取代羟丙基纤维素、和硅酸铝镁中的一种或多种。
41.如权利要求40所述的制剂,其中该崩解剂包含交联羧甲基纤维素钠或羧基乙酸淀粉钠中的一种或多种。
42.如权利要求40所述的制剂,其中该崩解剂是交联羧甲基纤维素钠。
43.如权利要求1-42中任一项所述的制剂,其包含0.5%-3%(w/w)的量的润滑剂。
44.如权利要求1-42中任一项所述的制剂,其包含1%(w/w)的量的润滑剂。
45.如权利要求1和43-44中任一项所述的制剂,其中该润滑剂包含硬脂酸镁、硬脂酸钙、油酸、辛酸、硬脂酸、异戊酸镁、月桂酸钙、棕榈酸镁、山嵛酸、山嵛酸甘油酯、硬脂酸甘油酯、硬脂酰富马酸钠、硬脂酰富马酸钾、硬脂酸锌、油酸钠、硬脂酸钠、苯甲酸钠、乙酸钠、氯化钠、滑石、聚乙二醇和氢化植物油中的一种或多种。
46.如权利要求45所述的制剂,其中该润滑剂是硬脂酸镁。
47.如权利要求1-46中任一项所述的制剂,其包含1mg至360mg的量的索托拉西布。
48.如权利要求1-46中任一项所述的制剂,其包含120mg的量的索托拉西布。
49.如权利要求1-46中任一项所述的制剂,其包含240mg的量的索托拉西布。
50.如权利要求1-46中任一项所述的制剂,其包含320mg的量的索托拉西布。
51.如权利要求1-9、40-42、45和46中任一项所述的制剂,其包含16%-24%(w/w)的量的索托拉西布、61%-91%(w/w)的量的稀释剂、2.4%-3.6%(w/w)的量的崩解剂和0.8%-1.2%(w/w)的量的润滑剂。
52.如权利要求1-9、40-42、45和46中任一项所述的制剂,其包含20%(w/w)的量的索托拉西布、76%(w/w)的量的稀释剂、3%(w/w)的量的崩解剂和1%(w/w)的量的润滑剂。
53.如权利要求51-52中任一项所述的制剂,其包含120mg的量的索托拉西布。
54.如权利要求1-9、40-42、45和46中任一项所述的制剂,其包含26%-38%(w/w)的量的索托拉西布、51%-77%(w/w)的量的稀释剂、2.4%-3.6%(w/w)的量的崩解剂和0.8%-1.2%(w/w)的量的润滑剂。
55.如权利要求1-9、40-42、45和46中任一项所述的制剂,其包含32%(w/w)的量的索托拉西布、64%(w/w)的量的稀释剂、3%(w/w)的量的崩解剂和1%(w/w)的量的润滑剂。
56.如权利要求54-55中任一项所述的制剂,其包含240mg的量的索托拉西布。
57.如权利要求54-55中任一项所述的制剂,其包含320mg的量的索托拉西布。
58.如权利要求1-57中任一项所述的制剂,其中该制剂是固体剂型。
59.如权利要求58所述的制剂,其中该固体剂型用于口服施用。
60.如权利要求58或权利要求59所述的制剂,其中该固体剂型是片剂。
61.如权利要求60所述的制剂,其中该片剂用包衣组合物包衣。
62.如权利要求64所述的制剂,其中该包衣组合物包含聚乙烯醇。
63.如权利要求62所述的制剂,其中该包衣组合物进一步包含二氧化钛、聚乙二醇、滑石和着色剂中的一种或多种。
64.如权利要求1-63中任一项所述的制剂,其中如通过使用usp<711>装置2以75rpm桨速、在37℃、在ph为6.7的包含50mm磷酸钠和表面活性剂以维持漏槽状态的900ml水的溶出介质中进行的溶出试验所测,该制剂中至少50%的索托拉西布在30分钟内释放。
65.如权利要求64所述的制剂,其中该制剂中至少80%的索托拉西布在30分钟内释放。
66.如权利要求64所述的制剂,其中该制剂中至少85%的索托拉西布在15分钟内释放。
67.如权利要求64-66中任一项所述的制剂,其中该表面活性剂是0.2%-0.6%(w/v)十二烷基硫酸钠(sds)。
68.如权利要求64-67中任一项所述的制剂,其中该制剂包含120mg的量的索托拉西布,并且该溶出介质包含0.5%(w/v)十二烷基硫酸钠(sds)。
69.如权利要求64-67中任一项所述的制剂,其中该制剂包含240mg的量的索托拉西布,并且该溶出介质包含0.3%(w/v)十二烷基硫酸钠(sds)。
70.如权利要求64-67中任一项所述的制剂,其中该制剂包含320mg的量的索托拉西布,并且该溶出介质包含0.4%(w/v)十二烷基硫酸钠(sds)。
71.一种治疗患者的癌症的方法,该方法包括向该患者施用以如权利要求1-66中任一项所述的制剂提供的治疗有效量的索托拉西布,其中该制剂以一个或多个剂量单位提供该治疗有效量。
72.如权利要求71所述的方法,其中该癌症的一个或多个细胞表达kras g12c突变蛋白。
73.如权利要求71或权利要求72所述的方法,其中该治疗有效量是240mg。
74.如权利要求73所述的方法,其中该治疗有效量由如权利要求48或权利要求53所述的制剂以两个剂量单位提供。
75.如权利要求73所述的方法,其中该治疗有效量由如权利要求49或权利要求56所述的制剂以一个剂量单位提供。
76.如权利要求71或权利要求72所述的方法,其中该治疗有效量是960mg。
77.如权利要求76所述的方法,其中该治疗有效量由如权利要求48或权利要求53所述的制剂以八个剂量单位提供。
78.如权利要求76所述的方法,其中该治疗有效量由如权利要求49或权利要求56所述的制剂以四个剂量单位提供。
79.如权利要求76所述的方法,其中该治疗有效量由如权利要求50或权利要求57所述的制剂以三个剂量单位提供。
80.如权利要求71-79中任一项所述的方法,其中该癌症是非小细胞肺癌、结直肠癌、胰腺癌、阑尾癌、子宫内膜癌、食道癌、原发灶不明癌、壶腹癌、胃癌、小肠癌、鼻窦癌、胆管癌或黑色素瘤。
81.如权利要求71-80中任一项所述的方法,其中该方法进一步包括在施用给该患者之前通过搅拌将作为一个或多个剂量单位提供的该治疗有效量分散在水中。
82.如权利要求81所述的方法,其中该水是非碳酸的。
83.如权利要求81或权利要求82所述的方法,其中该水具有室温。
84.如权利要求81-83中任一项所述的方法,其中该水具有120ml的体积。
85.如权利要求81-84中任一项所述的方法,其中在施用给该患者之前立即或2小时内将该治疗有效量分散在水中。
86.如权利要求81-85中任一项所述的方法,其中该患者难以吞咽固体。
技术总结
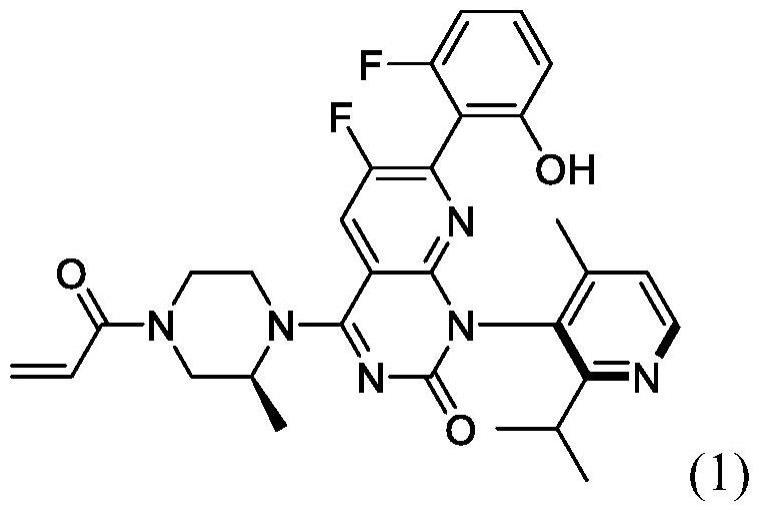
本披露提供了包含索托拉西布(1)、稀释剂、崩解剂和润滑剂的制剂。
技术研发人员:F·A·阿尔瓦雷斯-努涅兹,J·包,S·P·查马提,D·P·道里欧,N·杜吉腊拉,B·E·霍克,Y·江,A·乌洛夫斯基,N·萨万特
受保护的技术使用者:安进公司
技术研发日:
技术公布日:2024/1/15
- 还没有人留言评论。精彩留言会获得点赞!