改善抗体制剂的稳定性的方法与流程
本发明涉及一种抗体分子的稳定水性高浓度制剂,其中制剂中存在的抗体用具有物理化学稳定性的赋形剂溶解。所公开的制剂稳定约50mg/ml至约200mg/ml的抗体,其适用于静脉或皮下的给药途径。
背景技术:
0、发明背景
1、在过去的二十年里,重组dna技术导致了许多蛋白质的商业化,尤其是抗体治疗法。这些治疗用抗体的有效性主要取决于其稳定性、给药途径、剂型和浓度。这反过来需要适当制备治疗用抗体,以保持治疗用抗体的稳定性和活性。
2、每种给药途径和剂型的制剂都可以是独特的,因此,制剂具有特定的要求。固体剂型(例如冻干粉末)通常比液体(水性)制剂更稳定。然而,相较于液体制剂,冻干制剂的重构需要大量的小瓶过量灌装、小心处理并且生产成本较高。虽然液体制剂在这些方面具有优势,并且通常优选用于注射蛋白质治疗法(在方便最终用户和便于制造商制备方面),但是鉴于蛋白质在压力(温度、ph变化、搅拌等)下变性、聚集、氧化的易发性,这种剂型可能不是总是可行的。所有的这些压力因素都可导致治疗用蛋白质/抗体的生物活性的丧失。
3、特别是,高浓度的液体蛋白质/抗体制剂具有较低的溶解度,并且容易降解和/或聚集。这可能导致胶体不稳定和蛋白质的功能丧失。尽管如此,高浓度制剂可能适用于皮下注射或静脉注射的给药途径,因为这降低了给药的频率和注射体积。另一方面,特定的治疗计划和剂量可能需要低浓度制剂,并且优选静脉注射的给药途径,以实现更高的递送可预测性和治疗用药物的完全生物利用度。
4、此外,具有较高的表面疏水性的单克隆抗体通常具有较低的溶解度。这种较低的溶解度是由于较高的分子间的相互作用,且在高浓度抗体时更为明显,并且可能导致胶体不稳定或乳光(opalescence)的形成。溶液的乳光/浑浊外观损害了蛋白质制剂的美观性,并且还表明溶液中存在聚集体,或者体系有发生液-液相分离的趋势,这表明产品不稳定,可能是潜在的安全问题。
5、选择用于稳定(高浓度)制剂的赋形剂需要考虑上述所有因素。此外,当制剂以治疗为目的时,还需要考虑减少任何赋形剂在注射部位造成的疼痛。例如,已知在治疗用制剂中使用柠檬酸会引起注射部位中的疼痛或者注射部位疼痛,并且疼痛会随着这种赋形剂的浓度的增加而增加(shi,g.h.,pisupati,k.,parker,j.g.et al.subcutaneous injectionsite pain of formulation matrices.pharm res 38,779–793(2021).https://doi.org/10.1007/s11095-021-03047-3)。
6、因此,设计一种在高浓度的治疗用蛋白质/抗体的条件下稳定并且同时又能够改善用户体验的制剂,是一项重大的研发挑战。因此,为了改善药物分子的生物利用度和功能疗效,改善现有的治疗用药物蛋白质的制剂是持续需求。本发明旨在解决上述挑战和需求。
技术实现思路
0、发明简述
1、本发明公开了一种α4β7抗体的高浓度制剂,其中包含约100mg/ml至约200mg/ml的抗体。特别是本发明公开了一种在组氨酸缓冲液组合物中的无柠檬酸高浓度α4β7抗体制剂。本制剂的缓冲液组合物包含不同于柠檬酸的羧酸,并且该羧酸组分是单羧酸或二羧酸,或其衍生物。
2、所述制剂中的抗体是稳定的,且,即使在40℃下储存4周;在25℃下储存6个月;以及在2-8℃下储存6个月或更长时间,制剂中的抗体仍然保持至少97%的单体含量。此外,制剂组合物不需要抗氧化剂来维持其稳定性,并且尤其是公开的α4β7抗体制剂不含柠檬酸盐。
3、具体而言,本发明公开了一种方法,该方法是在抗体生产的预配制和/或配制阶段,通过向抗体组合物中添加乙酸或乳酸或琥珀酸或谷氨酸或其衍生物,减少α4β7抗体组合物中α4β7抗体的电荷变体、脱酰胺作用、和/或聚集。
4、本发明还公开了一种控制α4β7抗体组合物的乳光的方法,该方法包括,在抗体生产的预配制和/或配制步骤,向抗体组合物中添加乙酸或乳酸或琥珀酸或谷氨酸盐或其衍生物,以保持抗体在组合物中的可溶形式,从而保持乳光。此外,上述步骤获得的制剂的乳光与参考乳光标准(ros)ⅲ或ⅳ一致。
5、本发明还公开了一种方法,该方法是通过将抗体制备于缓冲液组合物中,赋予α4β7抗体胶体稳定性,所述缓冲液组合物包含组氨酸缓冲液、以及乙酸或乳酸或琥珀酸或谷氨酸或其衍生物。
6、本发明的α4β7抗体制剂在至少一种下述条件下储存时具备稳定性,例如在2-8℃下储存6个月;在25℃下储存6个月;在40℃下储存1个月。在上述条件下储存时,α4β7抗体制剂的聚集体含量低于2.5%。
7、此外,本发明公开了一种控制α4β7抗体组合物中,特别是维得利珠单抗(vedolizumab)抗体组合物中亚可见颗粒(sub-visible particle)的方法,,其中该方法包括在组氨酸缓冲液组合物中制备抗体组合物,组氨酸缓冲液组合物ph为6.3至6.8,并且包含单羧酸或二羧酸、精氨酸、表面活性剂,以及任选地包含糖或氨基酸。具体来说,本公开的方法控制亚可见颗粒,其尺寸范围是≥10μm,以及≥25μm,远低于可接受的监管限制。此外,在组氨酸缓冲液、单羧酸/二羧酸、精氨酸以及表面活性剂的组合物中制备的维得利珠单抗抗体在室温下储存六个月后,其中包含更少的聚集体含量,少于2%。
技术特征:
1.一种高浓度的α4β7抗体的药物制剂,所述制剂包含α4β7抗体、组氨酸缓冲液、和单羧酸或二羧酸、或其衍生物,其中所述制剂不含柠檬酸。
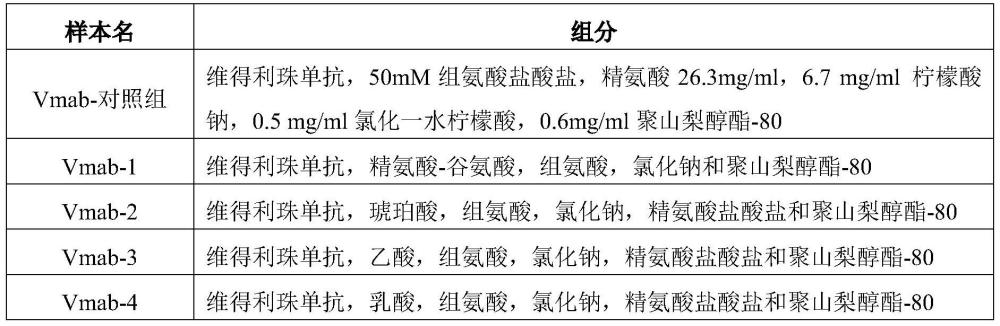
2.一种高浓度的维得利珠单抗抗体的药物制剂,所述制剂包含160mg/ml维得利珠单抗抗体、ph为6.3-6.8的40mm组氨酸缓冲液、5-50mm乙酸或乳酸或琥珀酸或谷氨酸、约120mm精氨酸、以及2mg/ml聚山梨醇酯-80,其中所述制剂不含柠檬酸。
3.一种控制α4β7抗体中的亚可见颗粒的形成的方法,其中所述方法包括在组合物中制备抗体,所述组合物包含组氨酸缓冲液、单羧酸或二羧酸、精氨酸和表面活性剂。
4.一种控制高浓度的α4β7抗体组合物中所述抗体的电荷变体或聚集体的形成或所述抗体的片段化的方法,其中所述方法包括在组合物中制备抗体,所述组合物包含组氨酸缓冲液、单羧酸或二羧酸、精氨酸和表面活性剂。
5.一种控制高浓度的α4β7抗体组合物的乳光的方法,其中所述方法包括,在抗体生产的预配制期间和/或在抗体生产的配制步骤,向抗体组合物中添加组氨酸缓冲液,所述组氨酸缓冲液包含单羧酸或二羧酸或其衍生物,其中所述方法保持抗体于可溶形式,从而控制乳光。
6.根据权利要求1、2、3、4或5的所述制剂,所述制剂还包含海藻糖或山梨醇或甲硫氨酸或甘氨酸。
7.根据权利要求1、2、3、4或5的所述制剂中的所述抗体,所述抗体是维得利珠单抗。
8.根据权利要求1、2、3、4或5的所述制剂,所述制剂包括抗体浓度为约160mg/ml-180mg/ml。
9.一种制备α4β7抗体组合物的方法,用于控制/减少所述组合物中亚可见颗粒的数量,该方法包括:
技术总结
本发明公开了一种α4β7抗体的稳定制剂,其中所述制剂包含α4β7抗、氨基酸、单羧酸或二羧酸、以及表面活性剂。所公开的抗体制剂是液体高浓度制剂,其也适于不同的给药方式(皮下/静脉)。所公开的制剂在各种加速压力条件下表现出稳定性。
技术研发人员:M·贾亚拉曼,S·瓦苏迪欧帕哈勒,S·高希,S·R·P·尔勒,A·萨哈,S·拉巴拉,M·英戈尔
受保护的技术使用者:雷迪博士实验室有限公司
技术研发日:
技术公布日:2024/2/19
- 还没有人留言评论。精彩留言会获得点赞!