光热纳米药物及其制备方法、应用与流程
本申请涉及生物医用材料,特别是涉及一种光热纳米药物及其制备方法、应用。
背景技术:
1、近年来发展迅速的免疫治疗手段可以通过阻断ctla-4、pd-1/pd-l1通路,重新激活免疫系统对肿瘤细胞进行清除。其中,pd-1抗体nivolumab、pembrolizumab等和pd-l1抗体atezolizumab等免疫检查点抑制已经被fda批准在临床上用于黑色素瘤、非小细胞肺癌、霍奇性淋巴癌等多种癌症的治疗。
2、光热肿瘤疫苗,即光触发的光热纳米药物,采用体内可降解、生物相容性良好的高分子材料来包载肿瘤免疫治疗药物和光热治疗、光动力学治疗药物,形成纳米尺度的药物粒子并进行功能化修饰,避免光热治疗药、光敏剂和免疫治疗抗体等药物在体内输送中被降解和清除,将其靶向输送到肿瘤部位,提高肿瘤局部药物浓度,同时降低免疫治疗副作用;光热治疗和光动力学治疗能引起肿瘤细胞免疫原性死亡,激活肿瘤内免疫细胞,协同提高抗肿瘤治疗效果。构建肿瘤微环境多重刺激响应性的多功能纳米载体,联合输送光热治疗药物、光疗试剂和免疫治疗药物(pd-1抗体等)组合“光热肿瘤疫苗”,通过肿瘤靶向药物传递和瘤内分级定向输送,杀死肿瘤细胞并激活免疫应答,实现协同、精准治疗。
3、然而,目前所开发的光热纳米药物并没有起到良好的治疗肿瘤疾病的效果。
技术实现思路
1、基于此,本申请提供了一种能够增强肿瘤疾病治疗效果的光热纳米药物及其制备方法、应用。
2、本申请一实施例提供了一种光热纳米药物的制备方法,包括如下步骤:
3、将cdm-peg-pasp(icg-co-his)溶解,充入co,反应,制备第一纳米载体;
4、将所述第一纳米载体与ab-peg-pasp(icg-co-his)和peg20k-peg-pasp(icg-co-his)于溶剂中混合,制备第一混合溶液;
5、将多聚-l-赖氨酸溶液和氨水溶液混合,制备第二混合溶液;
6、将所述第一混合溶液和所述第二混合溶液混合,制备光热纳米药物;
7、所述cdm-peg-pasp(icg-co-his)的结构式为:
8、;
9、所述ab-peg-pasp(icg-co-his)的结构式为:
10、;
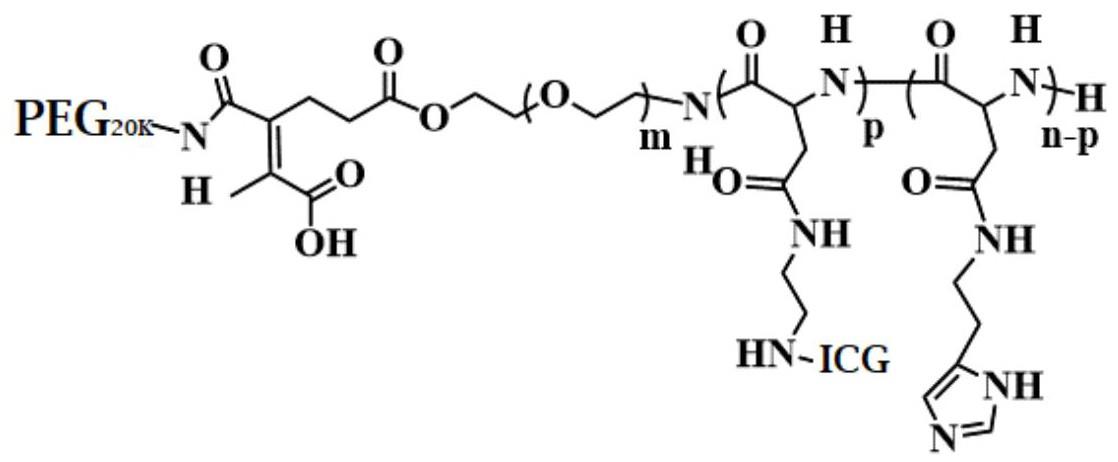
11、所述peg20k-peg-pasp(icg-co-his)的结构式为:
12、。
13、在其中一个实施例中,所述cdm-peg-pasp(icg-co-his)的制备包括如下步骤:
14、将天冬氨酸环内酸酐与氨基聚乙二醇混合,反应,制备peg-pbla;
15、向所述peg-pbla中加入乙二胺和组氨酸,反应,制备peg-pasp(eda-co-his);
16、向所述peg-pasp(eda-co-his) 加入靛青绿羧酸、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺和n-羟基丁二酰亚胺,反应,制备peg-pasp(icg-co-his);
17、将所述peg-pasp(icg-co-his)和3-(4-甲基-2,5二氧基-2,5二氢呋喃-3-基)丙酰氯混合,反应,制备所述cdm-peg-pasp(icg-co-his);
18、所述peg-pbla的结构式为:
19、;
20、所述peg-pasp(eda-co-his)的结构式为:
21、;
22、所述peg-pasp(icg-co-his)的结构式为:
23、。
24、在其中一个实施例中,在制备所述peg-pbla的过程中,反应条件包括:温度为30℃~40℃,时间为1.5天~2.5天。
25、在其中一个实施例中,在制备所述peg-pasp(eda-co-his)的过程中,反应条件包括:温度为30℃~40℃,时间为10h~14h。
26、在其中一个实施例中,在制备所述peg-pasp(icg-co-his)的过程中,反应条件包括:温度为室温,时间为1h~2h。
27、在其中一个实施例中,在制备所述cdm-peg-pasp(icg-co-his)的过程中,反应条件包括:温度为室温,时间为4h~6h。
28、在其中一个实施例中,所述ab-peg-pasp(icg-co-his)的制备包括如下步骤:
29、将所述cdm-peg-pasp(icg-co-his)与ab-nh2混合,反应,制备所述ab-peg-pasp(icg-co-his);
30、所述ab-nh2为具有末端氨基的抗体。
31、在其中一个实施例中,所述peg20k-peg-pasp(icg-co-his)的制备包括如下步骤:
32、将所述cdm-peg-pasp(icg-co-his)与peg20k混合,反应,制备所述peg20k-peg-pasp(icg-co-his)。
33、本申请一实施例还提供了一种光热纳米药物,如上述任一实施例中所述的制备方法制备得到。
34、本申请一实施例还提供了上述一实施例中所述的光热纳米药物在制备抗肿瘤药物中的应用。
35、本申请提供了一种光热纳米药物,通过将cdm-peg-pasp(icg-co-his) 、ab-peg-pasp(icg-co-his)和peg20k-peg-pasp(icg-co-his)三者复合制备得到,三个聚合物原料中均共价连接有光热试剂icg,且ab-peg-pasp(icg-co-his)连接有免疫检查点抗体ab-nh2,peg20k-peg-pasp(icg-co-his)中含有长链peg,三者复合后,长链peg可将光热试剂icg和抗体ab-nh2包裹遮蔽,在长链peg的遮蔽保护下,上述光热纳米药物可以通过epr作用安全地靶向递送抗体和光光热试剂到肿瘤部位,在肿瘤胞外酸性环境中将peg遮蔽层卸除,同时暴露和释放免疫检查点抗体于肿瘤微环境,纳米药物进一步被肿瘤细胞内吞,在近红外激光作用下,icg高效产生热量,高温杀伤肿瘤细胞,同时介导免疫原性细胞死亡(icd),诱导肿瘤组织产生系列免疫反应,促进t淋巴细胞的浸润,增强肿瘤局部的免疫检查点阻断治疗,协同实现强效抗肿瘤治疗,同时能够产生免疫记忆效应,有效抑制肿瘤复发与转移。
技术特征:
1.一种光热纳米药物的制备方法,其特征在于,包括如下步骤:
2.根据权利要求1所述的光热纳米药物的制备方法,其特征在于,所述cdm-peg-pasp(icg-co-his)的制备包括如下步骤:
3.根据权利要求2所述的光热纳米药物的制备方法,其特征在于,在制备所述peg-pbla的过程中,反应条件包括:温度为30℃~40℃,时间为1.5天~2.5天。
4.根据权利要求2所述的光热纳米药物的制备方法,其特征在于,在制备所述peg-pasp(eda-co-his)的过程中,反应条件包括:温度为30℃~40℃,时间为10h~14h。
5.根据权利要求2所述的光热纳米药物的制备方法,其特征在于,在制备所述peg-pasp(icg-co-his)的过程中,反应条件包括:温度为室温,时间为1h~2h。
6.根据权利要求2所述的光热纳米药物的制备方法,其特征在于,在制备所述cdm-peg-pasp(icg-co-his)的过程中,反应条件包括:温度为室温,时间为4h~6h。
7.根据权利要求2所述的光热纳米药物的制备方法,其特征在于,所述ab-peg-pasp(icg-co-his)的制备包括如下步骤:
8.根据权利要求2所述的光热纳米药物的制备方法,其特征在于,所述peg20k-peg-pasp(icg-co-his)的制备包括如下步骤:
9.一种光热纳米药物,其特征在于,如权利要求1~8任一项所述的制备方法制备得到。
10.权利要求9所述的光热纳米药物在制备抗肿瘤药物中的应用。
技术总结
本申请涉及一种光热纳米药物及其制备方法、应用。光热纳米药物的制备方法包括如下步骤:将CDM‑PEG‑PAsp(ICG‑co‑His)溶解,充入CO,反应,制备第一纳米载体;将所述第一纳米载体与Ab‑PEG‑PAsp(ICG‑co‑His)和PEG20k‑PEG‑PAsp(ICG‑co‑His)于溶剂中混合,制备第一混合溶液;将多聚‑L‑赖氨酸溶液和氨水溶液混合,制备第二混合溶液;将所述第一混合溶液和所述第二混合溶液混合,制备光热纳米药物。
技术研发人员:李伟华,曾剑锋,郭冕,徐建凯
受保护的技术使用者:深圳市第二人民医院(深圳市转化医学研究院)
技术研发日:
技术公布日:2024/1/15
- 还没有人留言评论。精彩留言会获得点赞!