一种具有肝脏靶向性的核酸药物递送系统及其制备方法
本发明属于生物医药,涉及一种高效且安全的肝靶向核酸递送系统及其制备方法。
背景技术:
1、肝脏是重要的代谢器官,在许多代谢中起到关键作用如碳水化合物、脂质及蛋白质的代谢。肝功能障碍会导致肝脏特异性和全身性疾病。基因治疗是用正常的基因整合入细胞,以校正和置换致病基因的一种治疗方法。由于肝脏具有大量分泌蛋白的功能和运输潜力,同时也是遗传载体在体内递送时主要富集的场所之一,因此成为当前基因治疗技术的理想靶器官。纳米载药系统作为一类新的递送手段,将药物包裹在纳米粒内部,减少药物与正常细胞的接触,降低毒副作用,生物组织的相容性也更好。
2、双子表面活性剂(gemini surfactant,以下简称 gs)可缩合 pdna,且形成的纳米粒粒径小、荷正电,可与带负电的细胞膜结合而具有较高的基因转染能力 [bombelli c,faggioli f, luciani p, mancini g, sacco mg. pegylated lipoplexes: preparationprotocols affecting dna condensation and cell transfection efficiency. j medchem. 2007;50(24):6274-6278. ]。但其前期研究发现双子表面活性剂纳米粒的细胞毒性较大且缺乏肝实质细胞的靶向性,限制了其应用。
3、cn113425849a公开了一种 sirna 递送载体及其制备方法与应用。所述 sirna 递送载体包括纳米囊泡以及负载于所述纳米囊泡内的 sirna,所述纳米囊泡由红细胞膜制得。制得核酸适配体靶向的 sirna 递送载体,其具有较好的靶向性,环境响应性及 sirna稳定性。已有报道发现,用红细胞膜(red blood cell membrane,以下简称 rbcm)修饰 gs与 pdna 缩合形成的纳米粒(gs-pdna-rbcm)能够降低gs-pdna 纳米粒的细胞毒性,增加所载 pdna 在肝脏细胞中的表达效率 [lu z, zongjie g, qianyu z, et al. preparationand characterization of a gemini surfactant-based biomimetic complex for genedelivery. eur j pharm biopharm. 2023;182:92-102]。在红细胞膜仿生化纳米粒递送入细胞的摄取过程中,主要通过小窝介导的内吞途径。这种途径与纳米粒的表面电荷和粒径大小有关 [sahay g, kim jo, kabanov av, bronich tk. the exploitation ofdifferential endocytic pathways in normal and tumor cells in the selectivetargeting of nanoparticulate chemotherapeutic agents. biomaterials. 2010;31(5):923-933 ]。研究发现如果当纳米粒表面电荷为负值时,更可能通过小窝介导的内吞途径,且此途径会高效的保护所载基因,实现更高的表达效率 [hillaireau h, couvreur p.nanocarriers' entry into the cell: relevance to drug delivery. cell mol lifesci. 2009;66(17):2873-2896 ]。
4、这一发现促使我们提出设计一种新型的具有更高基因表达效率的纳米粒,与rbcm 修饰相比,其更倾向于通过小窝介导的内吞途径进入细胞进行基因递送。目前尚无通过此途径改进肝脏靶向核酸递送的技术。
技术实现思路
1、针对现有技术的不足,本发明的目的在于提供一种肝靶向核酸递送系统及其制备方法,其具有安全、高效、制备技术简单且无需依赖受体-配体技术摄取入肝细胞的特点,表现出高的包载能力、高效的肝细胞摄取效率和转染效率,以及较低的毒性。为实现上述目的,本发明采用以下技术方案。
2、第一方面,本发明提供一种核酸递送系统,所述核酸递送系统由双子表面活性剂(gs)、所载核酸(pdna)和肝细胞膜(hepatocyte cell membrane,以下简称hcm)组成。gs 所提供的正电性可提高核酸的装载效率,并提高 pdna 的细胞摄取效率。hcm 纳米囊泡具有良好的生物相容性和肝同型靶向性,在摄取过程中主要以小窝介导的内吞途径,可保护核酸在递送过程中的分子稳定性,使核酸免受核酸酶和溶酶体的降解,增加核酸的细胞摄取效率,并延长其释放时间。最终制得的核酸递送系统具有良好的核酸包载能力,可有效地将核酸药物递送至肝细胞内,具有转染率高、细胞毒性低的优点。其中,所述的gs载体的结构式如式1所示:
3、(式1)
4、第二方面,本发明提供了前述核酸递送系统的制备方法,其包括:
5、将 dna 与 gs 通过孵育的方式,制得 gs-pdna 纳米粒。
6、将 hcm 制备成纳米囊泡。
7、将所述gs-pdna 纳米粒通过静电结合的自组装方式负载于 hcm 纳米囊泡内,获得 gs-pdna-hcm 纳米粒。
8、优选地,所述 hcm 纳米囊泡与 pdna 的质量比为1.00:1.00 ~10.00:1.00,本发明所涉及的核酸递送系统中 gs 和 hcm 的质量比特定选择上述范围内,使得gs与hcm的配合效果更佳,具有更显著的核酸包载能力,细胞转染率更高,稳定性更强; 所述(1-10)是指具体值可以选择1、2、3、4、5、6、7、8、9、10 等,该数值范围内的其他具体点值均可选择。
9、现有技术相比,本发明的有益效果在于:
10、本发明采用的 gs 介导的核酸负载方法,包封效率高、操作简单快捷,能有效保护pdna 不被核酶降解。
11、本发明将 hcm 纳米囊泡修饰的 gs-pdna 作为核酸药物递送载体,与目前较常用的外泌体载体相比,其制备方法更为简单、成本低廉、产量较高、成分简单,且本发明利用过膜挤压制备 hcm 纳米囊泡的方法,能够实现纳米粒的大量、低成本制备。
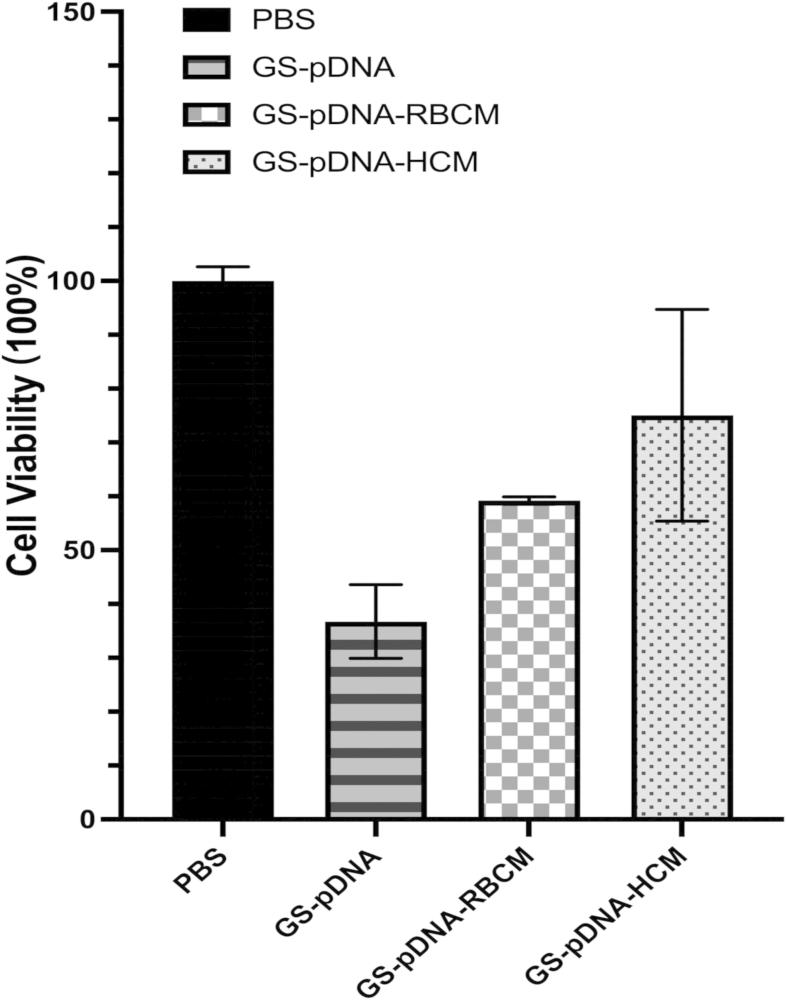
12、相对于未经修饰的 gs-pdna,hcm 纳米囊泡修饰能够显著降低 gs-pdna 的毒性。
13、相对于 rbcm 修饰,本发明优选的 hcm 修饰 gs-pdna 对 pdna 包载能力更强,肝细胞转染率更高,稳定性更强,安全性更高,且主要通过小窝介导的内吞方式摄取入肝细胞。
14、本发明中 hcm 制备方法能够保留 hcm 上原有的功能蛋白,使 hcm 修饰的 gs-pdna 具有特定的生物学功能。
技术特征:
1.一种双子表面活性剂-核酸纳米粒-肝细胞膜递送载体(gs- pdna-hcm),其特征在于,由双子表面活性剂(gs)、核酸(pdna)和肝细胞膜(hcm)共同组成。
2.根据权利要求1所述的 gs-pdna-hcm,优选的,反应加入的 gs与 pdna 的质量比为4.00:1.00 ~ 8.00:1.00。
3.根据权利要求1所述的 gs-pdna-hcm,其特征在于,所述 gs-pdna-hcm 通过如下步骤制备:
4.根据权利要求1所述的gs-pdna-hcm,其特征在于,反应加入的 hcm 纳米囊泡与pdna的比例为1.00:1.00 ~ 10.00:1.00。其中纳米粒挤压采用滤膜采用100~300nm 孔径聚碳酸酯膜。
5.根据权利要求3所述的制备方法,其特征在于,所述步骤(1)中使用超声破碎仪,功率为20 ~ 60 w,频率20 ~ 25 khz,超声时间1 ~ 3 min。
6.根据权利要求3所述的制备方法,其特征在于,所述步骤(2)中 hcm 纳米囊泡浓度为5 ~ 10 μg/ml。
7.根据权利要求3所述的 gs-pdna-hcm,其特征在于,反应的时间为0.5 ~ 1 h。
8.根据权利要求3所述的 gs-pdna-hcm,其特征在于,反应的温度为20 ~ 40 ℃。
9.权利要求1中所述的 gs-pdna-hcm 治疗肝脏疾病等方面的应用。
技术总结
本发明属于生物医药技术领域,涉及一种高效且安全的肝靶向核酸递送系统及其制备方法。具体涉及一种新型仿生化膜修饰纳米粒的制备方法,该方法设计了一种与红细胞膜相比在小窝介导的内吞途径中更高表达的肝细胞膜纳米囊泡修饰的纳米粒,从而增强其在基因递送过程中的效率和特异性。其制备方法是:由一定质量比的双子表面活性剂分子,核酸和肝细胞膜在室温条件孵育一段时间,通过自组装方式,得到由肝细胞膜修饰的双子表面活性剂分子纳米粒。本发明制备过程简单,不需要额外的受体‑配体型;所得由肝细胞膜修饰的双子表面活性剂分子纳米粒不仅改善了双子表面活性剂分子在应用中的缺陷,而且比由红细胞膜修饰的双子表面活性剂分子纳米粒细胞存活率更高,安全性更高,递送效率和肝靶向性更高效。总之,其在治疗肝脏疾病的方面的具有非常潜在应用的价值。
技术研发人员:陈华黎,吴可欣,甘宗捷
受保护的技术使用者:重庆医科大学
技术研发日:
技术公布日:2024/2/19
- 还没有人留言评论。精彩留言会获得点赞!