一种氧化铝膜及其制备方法和应用与流程
1.本发明涉及氧化铝膜技术领域,具体涉及一种氧化铝膜及其制备方法和应用。
背景技术:
2.脓毒症(sepsis)是由细菌等病原微生物侵入机体引起的全身炎症反应综合征。除全身炎症反应综合征和原发感染病灶的表现外,重症患者还常有器官灌注不足的表现。脓毒症发病时,患者的内源性炎性介质,包括血管活性物质、细胞因子、趋化因子、氧自由基、急性期反应物质、生物活性脂质、血浆酶系统产物及血纤维蛋白等相互作用引起全身各系统、器官的广泛损伤。
3.脓毒症引起的肾炎、肾功能衰竭,在临床上常用血液滤过治疗。美国专利(公开号为us6653131b2)公开了一种通过使患者的体液与体外肾小管细胞接触来治疗全身炎症反应综合征(sirs)的方法,其将肾小管细胞种植在多孔微珠(材质为微孔明胶、胶原包裹的葡聚糖)上从而制备成肾小管辅助装置,血液滤过机滤过患者血液后,血液再经肾小管辅助装置后再回输给患者。这种治疗方式依靠肾小管辅助装置中的肾小管主动摄取转运走患者血液中的炎症因子。细胞对炎症因子的摄取转运属于细胞的生命活动,其摄取转运效率与细胞微环境相关。现有技术已经可在透析膜上附着肾系细胞实现重吸收功能,但在常规的人工半透膜上培养细胞,如在聚醚砜、聚砜和聚丙烯等材料的半透膜上培养肾系细胞,肾系细胞生长较缓慢,长期培养下细胞活力会下降,对蛋白摄取转运能力较弱。
技术实现要素:
4.本发明旨在提高氧化铝膜上的肾小管细胞的活力,继而促进肾小管细胞转运蛋白。本发明通过对氧化铝膜的制备工艺进行改进,制备所得的氧化铝膜提供相对适宜肾小管细胞生长的微环境,能够相对提高肾小管细胞活力,促进其对蛋白(炎症因子)摄取转运。本发明的氧化铝膜附着肾小管细胞可用于血液滤过治疗脓毒症,不需要额外利用生物材料(如多孔微珠)制备肾小管辅助装置。
5.本发明的目的之一在于提供一种氧化铝膜,本发明的目的之二在于提供这种氧化铝膜的制备方法,本发明的目的之三在于提供一种氧化铝生物膜,本发明的目的之四在于提供这种氧化铝膜及氧化铝生物膜的应用。
6.为了实现上述目的,本发明所采取的技术方案是:
7.本发明第一方面提供了一种氧化铝膜的制备方法,包括以下步骤:
8.(1)对铝片一侧表面进行恒压阳极氧化处理,得到一侧表面具有多孔结构的氧化铝膜;
9.(2)采用物理加工的方法去除步骤(1)所述氧化铝膜的另一侧未被氧化的铝,扩孔处理,得到两侧面孔洞相通的膜;
10.(3)对经过步骤(2)物理加工的一侧膜表面沉积硅涂层,得到所述的氧化铝膜。
11.优选的,这种氧化铝膜的制备方法中,步骤(1)中,铝片在进行恒压阳极氧化前进
120nm。
25.优选的,这种氧化铝膜上硅涂层的厚度为5-100nm;进一步优选的,硅涂层的厚度为10-50nm;再进一步优选的,硅涂层的厚度为15-30nm。
26.优选的,这种氧化铝膜中,所述硅涂层包括二氧化硅、氮化硅、多晶硅中的至少一种;进一步优选的,硅涂层为二氧化硅。
27.本发明第三方面提供了一种氧化铝生物膜,包括上述氧化铝膜;氧化铝膜未沉积硅涂层的一侧表面附着肾小管上皮细胞。
28.优选的,这种氧化铝生物膜上肾小管上皮细胞的负载量为5*10
2-5*105个/cm2;进一步优选的,肾小管上皮细胞的负载量为5*10
3-5*105个/cm2;再进一步优选的,肾小管上皮细胞的负载量为5*10
4-5*105个/cm2。
29.本发明第四方面提供了上述氧化铝膜及氧化铝生物膜在制备血液滤过装置、血液透析装置、防治脓毒血症装置、转运炎症因子装置中的应用。
30.本发明的有益效果是:
31.本发明的氧化铝膜的制备方法中,一侧面氧化后采用物理加工方式蚀刻掉另一面未反应的铝,而不是采用化学蚀刻的方式,采用物理加工方法避免了化学试剂腐蚀形成的氧化铝晶型对血小板膜蛋白的吸附作用;本发明通过采用沉积硅涂层,能有效减少血小板的吸附,同时促进另一侧面(透析液侧)的细胞摄取转运炎症因子和重吸收能力。
32.本发明的氧化铝膜直接提供适宜的微环境供肾小管上皮细胞生长,不需要额外利用生物材料(如多孔微珠)制备肾小管辅助装置,维持肾小管上皮细胞高效的蛋白(炎症因子)转运能力。
33.本发明的氧化铝膜因对血小板的吸附作用较小,不溶血,作为半透膜/透析膜应用于血液透析或血液滤过时不容易出现堵塞问题。
34.本发明的氧化铝膜亲水性高、生物相容性高和细胞粘附率高。
附图说明
35.图1为实施例1中氧化铝膜背面(反面)在沉积二氧化硅前的电镜图。
36.图2为实施例1中氧化铝膜背面(反面)在沉积二氧化硅后的电镜图。
37.图3为对比例1中氧化铝膜背面(反面)在沉积二氧化硅前的电镜图。
38.图4为对比例1中氧化铝膜背面(反面)在沉积二氧化硅后的电镜图。
39.图5为对比例3中氧化铝膜背面(反面)在沉积二氧化硅前的电镜图。
40.图6为对比例3中氧化铝膜背面(反面)在沉积二氧化硅后的电镜图。
41.图7为实施例2中氧化铝固定的培养小盒装置示意图。
42.图8为实施例3中采用实施例1的氧化铝膜接种细胞后的细胞活死染色图。
43.图9为实施例3中采用对比例1的氧化铝膜接种细胞后的细胞活死染色图。
44.图10为实施例3中采用对比例2的氧化铝膜接种细胞后的细胞活死染色图。
45.图11为实施例3中采用对比例3的氧化铝膜接种细胞后的细胞活死染色图。
46.图12为实施例3中采用对比例4的氧化铝膜接种细胞后的细胞活死染色图。
47.图13为实施例4的氧化铝膜对脓毒症毒素清除的装置示意图。
具体实施方式
48.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
49.实施例1
50.本实施例的氧化铝膜的制备方法,包括以下步骤:
51.(1)取厚度为0.2mm,长宽为10cm
×
10cm的铝片进行脱脂处理,铝片浸泡乙醇5min,然后置于电解槽中,恒定电流法进行电化学抛光,电解液为100g/l磷酸与40g/l聚乙二醇-400的乙醇溶液,设定抛光电流值为2.63a,抛光电压不超过130v,抛光时间约15min。抛光后得到表面光亮平整的铝片。
52.(2)等面积的铝片和铂片分别作为阳极电极与阴极电极组成两电极,阳极铝片用夹具使其只暴露铝片一侧表面于电解液中(此称正面),另一面(此称反面或背面)被夹具覆盖不与电解液接触。两电极浸没在0.3m的草酸电解液中,40v的电压下进行阳极氧化48h,得到具有多孔结构的氧化铝膜。
53.(3)取出具有多孔结构的氧化铝膜,利用光纤激光打标机蚀刻具有多孔结构的氧化铝膜的反面,将未被氧化的铝蚀刻掉,得到大片完整无任何破损的氧化铝膜。
54.(4)将步骤(3)制备的氧化铝膜浸泡于45℃的5%质量分数的磷酸溶液中约45min,再用大量超纯水冲洗,n2吹干后得到正反面孔道相通的氧化铝膜。
55.(5)采用等离子体增强化学的气相沉积法技术将二氧化硅沉积于氧化铝膜的反面,基板温度为300℃,射频功率为200w,n2流量为200sccm,sih4流量为11sccm,n2o流量为37sccm,气体压强为1000mt,通过控制反应时间最后得到厚度为20nm的二氧化硅涂层,得到本实施例的氧化铝膜。
56.本实施例步骤(5)中多孔氧化铝膜背面(反面)在二氧化硅沉积前电镜图如图1所示;沉积二氧化硅后电镜图如图2所示。
57.膜的制备方法中可以通过调节夹具中暴露于电解液的开口尺寸大小和数量来控制氧化膜的面积、以及一次工艺中用于氧化的铝片数量。另外,通过控制激光刻蚀的工艺,可以制备出圆形、方形、或者流道形状的氧化铝膜。
58.对比例1
59.本例的氧化铝膜的制备方法步骤与实施例1的区别点在于:步骤(3)不同,其余步骤与实施例1相同。本例的步骤(3)为:对步骤(2)中得到的具有多孔结构的氧化铝膜进行化学腐蚀,采用0.3m的cucl2和10wt%hcl的混合溶液在室温下腐蚀掉未被氧化的铝,得到孔洞贯通的氧化铝膜。
60.本例步骤(5)中氧化铝膜背面(反面)在二氧化硅沉积前电镜图如图3所示;沉积二氧化硅后电镜图如图4所示。
61.对比例2
62.本例的氧化铝膜的制备方法步骤与实施例1的区别点在于:不含实施例1的步骤(5),即得到不沉积二氧化硅的氧化铝膜。
63.对比例3
64.本例的氧化铝生物膜的制备方法步骤与实施例1的区别点在于:步骤(2)不同,其余步骤与实施例1相同。本例的步骤(2)中采用6m的磷酸溶液作为电解液,在100v的电压下进行阳极氧化,得到氧化铝膜。
65.本例步骤(5)中氧化铝膜背面(反面)在二氧化硅沉积前电镜图如图5所示;沉积二氧化硅后电镜图如图6所示。
66.对比例4
67.本例的氧化铝生物膜制备方法与实施例1的制备方法区别在于:步骤(5)不同,其余步骤与实施例1相同。本例的步骤(5)采用等离子体增强化学的气相沉积法将二氧化硅沉积于氧化铝的正面。
68.对比例5
69.本例的氧化铝膜制备方法与实施例1的制备方法区别在于:不含实施例1的步骤(3),其余步骤与实施例1相同。本例的步骤(2)多孔氧化铝膜没有利用光纤激光打标机蚀刻多孔氧化铝膜的反面,而是直接进入步骤(4)磷酸扩孔。
70.结果表明:因为膜中间存在铝单质层,磷酸没有办法完成扩孔,膜的正反面孔洞不连通。
71.实施例1及对比例1-4中步骤(5)制备得到的氧化铝膜的孔道参数如下表1所示。
72.表1
[0073][0074]
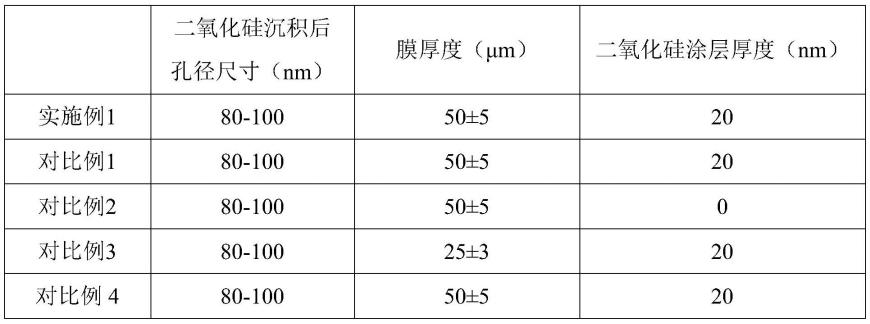
实施例2
[0075]
氧化铝膜的血液相容性和水接触角测试
[0076]
当氧化铝膜用于血液过滤、血液透析等方面时,氧化铝膜反面(背面)与血液接触,而氧化铝膜正面与透析液接触,因此对氧化铝膜反面(硅涂层)的血液相容性和正面(用于附着肾小管细胞)的亲水性具有一定要求。
[0077]
血液相容性试验:将实施例1和对比例1-4中步骤(5)制备得到的氧化铝膜分别固定于培养小盒中,如图7所示,氧化铝膜反面朝上(简言之,实施例1,对比例1和对比例3为有二氧化硅涂层那面;对比例2和对比例4,其反面是没有硅涂层的光纤激光打标机蚀刻的那面)。分别加入1ml血浆(内含约20*106个兔血小板)于氧化铝膜反面,用石蜡密封培养小盒。培养小盒在37℃下振荡1h后,用生理食盐水润洗膜三次,采用3%的戊二醛水溶液对膜上的血液成分进行固定,超纯水清洗后干燥处理,采用扫描电子显微镜对样品进行观察,记数视野中(约1
×
103μm2)薄膜上附着的血小板数目,取该膜不同的10个视野中的附着血小板数的平均值,作为血小板附着数。
[0078]
亲水性试验:根据gb/t 30447-2013《纳米薄膜接触角测量方法》中的座滴法,利用水形成的探测液滴形状而计算出水滴与氧化铝膜正面接触角。
[0079]
每组测量三次,最终的测量结果按三次测量结果的平均数值计算,亲水性(接触角)及兔血小板吸附数如下表2所示。
[0080]
表2
[0081][0082]
如表2所示,实施例1和对比例1-3的氧化铝膜的接触角没有太大差异,均能润湿。据报道二氧化硅的表面具有丰富的羟基,羟基可以和分子以氢键形式结合而形成多分子单层吸附层,会对血小板产生了一定的化学吸附。但比较实施例1,对比例2和对比例4,可见膜反面具有二氧化硅涂层的实施例1的膜吸附血小板更少,可能因为二氧化硅在血液环境中带负电,血小板也带负电,两者相排斥。对比例1采用化学腐蚀通孔制备得到氧化铝膜,其吸附血小板量最大,可能是由于采用化学试剂腐蚀形成的氧化铝晶型和表面化学性质对血小板产生更强的吸附作用。实施例1和对比例3相比较,可能是因为电解液不同造成膜晶型和/或膜微观结构不同,继而造成其对兔血小板吸附数有所差异。
[0083]
实施例3
[0084]
细胞活力检测
[0085]
使用pbs溶液清洗实施例1和对比例1-4的氧化铝膜1-2次,分别在氧化铝膜的正面接种肾小管上皮细胞。分别取人肾小管上皮细胞按1*105/cm2密度接种于膜的正面(膜面积大小为2cm2),在培养箱环境中静置4小时待细胞贴壁。对膜上细胞进行如下检测:
[0086]
1.使用无菌pbs清洗膜1-2次,加入检测液(培养基及cck-8试剂体积比=10:1混合均匀)后于培养箱孵育1-2h,收集检测液于96孔板,使用酶标仪对其吸光度值进行检测。注意设置空白对照组、阴性对照、阳性对照。
[0087]
2.使用calcein-am/pi双染液对膜上细胞染色,荧光显微镜对细胞活死和形态进行观察。
[0088]
3.pbs清洗膜2-3次,采用特异性抗体标记(fitc)对膜上的细胞进行标记,然后消化后收集,再使用流式进行分析,通过膜上粘附细胞量与种植细胞的总量之比,得到细胞的粘附率,每组测量三次,平均粘附率按三次测量结果的平均数值计算,结果如表3所示,实施例1和对比例1-4的氧化铝膜接种细胞后的细胞活死染色图分别见图8-12。
[0089]
表3
[0090]
膜的组别实施例1对比例1对比例2对比例3对比例4肾小管上皮细胞平均粘附率(%)82
±
2.573
±
5.681
±
3.283
±
1.965
±
3.5
[0091]
对比例1的细胞粘附率比较低,可能是因为没有采用物理方法去除未被氧化的铝,而是采用化学腐蚀掉未被氧化的铝所致。对比例4细胞粘附率比较低,是因为二氧化硅对细胞的生物相容性不如氧化铝。对比例4的氧化铝膜,其细胞粘附率比较低,不再继续进行后
续试验。
[0092]
实施例4
[0093]
氧化铝膜对脓毒症毒素的清除
[0094]
①
脓毒症血浆的配制:
[0095]
(1)取92.5mmol nacl、2.5mmol cacl2、1.1mmol mgcl2、4.3mmol kcl、24mmol nahco3、2.5mmol nah2po4和11.5mmol na2hpo4,加水配制成1l无机盐溶液。
[0096]
(2)在无机盐溶液中加入葡萄糖和氨基酸,工作浓度分别为990mg/l和600mg/l。
[0097]
(3)加入肌酐(终浓度为120μmol/l)和尿素溶解(终浓度为5mmol/l),再加入脓毒血标志物il-6(终浓度为300ng/l),最后加入血浆白蛋白(终浓度60g/l)和β2-微球蛋白(终浓度2mg/l)调整溶液胶体渗透压,得到模拟的脓毒症患者血浆的脓毒症血浆。
[0098]
②
氧化铝生物膜制备(细胞培养):
[0099]
分别取肾小管上皮细胞按1*105/cm2密度接种于实施例1和对比例1-3的氧化铝膜的正面(膜面积大小为100cm2),培养细胞24小时,形成氧化铝生物膜。
[0100]
③
炎症因子清除试验:
[0101]
分别将上述负载肾小管上皮细胞的氧化铝生物膜夹在特制的夹具装置(相当于透析装置)中,以氧化铝膜相隔搭建两个隔膜腔室,两个隔膜腔室分别和蠕动泵、管道组成循环体系,装置如图13所示。
[0102]
膜的反面与脓毒症血浆模拟液溶液相接触,而膜正面(粘附肾小管上皮细胞的那面)与市售的血液透析液相接触,其中膜两侧的物质交换只能通过膜作为媒介进行。膜两侧流速设置:脓毒症血浆流速为20ml/min,透析液侧流速为10ml/min,溶液循环时间为24h。在24h时间点上取样检测透析液中il-6(人白介素6)的物质含量和透析液体积,采用il-6elisa检测试剂盒对透析液侧的il-6进行定量检测,并根据酶标仪采集的λ=450nm处的光吸收值a。取标准品、空白对照、样本的平均光吸收值,减去空白对照的平均光吸收值,得到标准品、样品的光吸收校准值。以标准品浓度为横坐标,校准后的标准品光吸收值为纵坐标绘制标准曲线。il-6的清除率按照透析液侧il-6的增加量与初始时血浆所含il-6的总量比计算,每组测量三次,il-6的平均清除率按三次测量结果的平均值计算。
[0103]
il-6的清除率按以下公式进行计算:
[0104][0105]
ct为t时透析液在λ=450nm处的吸光度对应的浓度,vt为t时透析液在循环24小时后的体积;
[0106]
c0为0时原始血浆在λ=450nm处的吸光度对应的浓度,v0为原始血浆的总体积。
[0107]
il-6清除率如表4所示。
[0108]
表4
[0109]
生物膜组别实施例1对比例1对比例2对比例3il-6的平均清除率(%)35.1
±
1.426.9
±
0.728.7
±
0.529.1
±
1.2
[0110]
根据表3的结果,在培养基环境下,实施例1、对比例2和对比例3的氧化铝的细胞粘附率没有太大差异,可能是因为培养基环境下相对稳定,细胞状态表现出的差异不大。而在透析液体流动的环境下,加上液体中含有炎症因子等因素,不同的氧化铝膜上的细胞,其状
态表现差异较大,如表4中,实施例1的氧化铝膜的肾小管上皮细胞对il-6清除率显著高于其它对比例的氧化铝膜的肾小管上皮细胞,间接反映在血液透析/血液滤过的环境下,实施例1的氧化铝膜的肾小管细胞仍然维持比较好的状态,转运蛋白的能力仍然比较强。这可能由于实施例1的氧化铝生物膜提供的微环境更适合肾小管上皮细胞。结果表明,涂层、电解液和除铝工艺均会对氧化铝膜的微环境造成影响,对细胞的摄取转运有影响。
[0111]
实施例5
[0112]
氧化铝生物膜对β2-mg蛋白的重吸收
[0113]
β2-微球蛋白(β2-mg)蛋白是由淋巴细胞、血小板和多形核白细胞产生的一种小分子球蛋白,分子量为11800。正常人体内的β2-mg从肾小球自由滤过,99.9%在近端肾小管吸收,故肾小管上皮细胞对β2-mg的重吸收功能也发挥着重要的作用,对脓毒症患者有着重要的治疗意义。
[0114]
生物膜对蛋白的重吸收能力,取决于透析液侧的微球蛋白经过生物膜上的细胞重吸收回到血浆的总量。重吸收实验中,脓毒症血浆的配制、细胞培养、循环灌流装置(实验装置)以及膜两侧流速设置如实施例4,而透析液中加入了肌酐(终浓度为120μmol/l)和尿素溶解(终浓度为5mmol/l),再加入脓毒血标志物il-6(终浓度为300ng/l),最后加入血浆白蛋白(终浓度60g/l)和β2-微球蛋白(终浓度2mg/l),在调整溶液胶体渗透压的同时,得到与脓毒症血浆中相等β2-mg蛋白浓度的透析液。
[0115]
在循环24h时间点上分别取样检测透析液侧β2-mg的物质含量,采用β2-mg elisa检测试剂盒对透析液侧的β2-mg进行定量检测,并根据酶标仪采集的λ=450nm处的光吸收值a。根据光吸收值和透析液体积计算出细胞对β2-mg的重吸收的总量。取标准品、空白对照、样本的平均光吸收值,减去空白对照的平均光吸收值,得到标准品、样品的光吸收校准值。以标准品浓度为横坐标,校准后的标准品光吸收值为纵坐标绘制标准曲线。每组测量三次,最后膜对微球蛋白的平均重吸收量按三次测量结果的平均值计算。
[0116]
β2-mg蛋白的重吸收总量按以透析液侧β2-mg蛋白的减少总量来计算,公式为:
[0117][0118]
c0为0时透析液在λ=450nm处的吸光度对应的浓度,v0为0时的透析液的体积;
[0119]ct
为t时透析液在λ=450nm处的吸光度对应的浓度,vt为t时的透析液的体积;
[0120]
k为摩尔吸光系数,b为吸收层厚度1cm。
[0121]
生物膜对β2-mg蛋白的重吸收总量如表5所示。
[0122]
表5
[0123][0124]
上述表5数据可知,氧化铝能够有效促进细胞对β2-mg蛋白的重吸收。特别是,采用实施例1中的工艺方案制备出的氧化铝,能够有效促进膜上细胞对β2-mg蛋白的重吸收功能;另外将二氧化硅沉积在膜血液侧,有效地降低了膜对蛋白的粘附从而提高了膜对蛋白的物质交换效率和总滤过量。
[0125]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1