微生物基因丰度及胞外酶活性在秸秆还田固碳中的应用
本发明涉及固碳
技术领域:
,更具体的说是涉及微生物基因丰度及胞外酶活性在秸秆还田固碳中的应用。
背景技术:
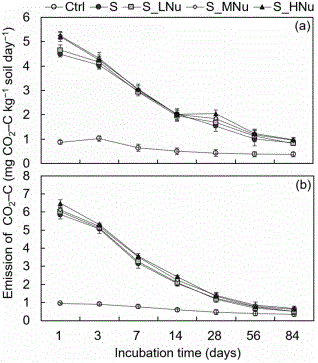
:农业生态系统中的土壤碳固存是缓解气候变化的主要措施。农作物秸秆还田作为一种有效的田间管理实践已经被广泛推荐,用以提高土壤有机碳。养分管理被认为是富碳秸秆投入下调控土壤新碳生成的关键措施。秸秆还田同时伴随某些养分(例如,氮(n),磷(p)和/或硫(s))的添加可以增强秸秆碳的腐殖化进程,从而引起soc的升高或降低。然而,在综合管理养分的条件下,土壤新碳的生成与主要微生物分类单元的活性和丰度之间的关系仍不清楚。环境资源可利用性的变化加速了各种策略微生物(主要是富养生物和寡养生物)的生长。通常,寡养生物(如acidobacteria和fungi)可能更倾向于在养分缺乏的环境中使用天然som来满足其能量和养分需求。当土壤环境中有充足的碳源和养分底物时,大多数微生物类群(包括变形菌、放线菌和真菌)的生长速率均会出现快速的增长。因此,微生物活动的变化会导致易分解有机物料和天然som的分解和矿化加速,从而调节土壤中新碳和老碳的周转。也就是说,主要的微生物类群(富养生物和寡养生物)随养分可利用性的高低而变化,它们的活性和丰度决定了土壤新碳的形成和天然som的分解。因此,根据土壤新碳生成与养分可利用性、微生物分类单元、功能胞外酶之间的联系来阐明微生物活动策略的具体途径,对优化秸秆还田下养分的精准管理有重要意义。技术实现要素:有鉴于此,本发明提供了微生物基因丰度及胞外酶活性在秸秆还田固碳中的应用。为了实现上述目的,本发明采用如下技术方案:微生物基因丰度及胞外酶活性在秸秆还田固碳中的应用,利用bg、ap、mbc、酸杆菌丰度和变形菌丰度的变化表征新碳的生成。bg、ap、mbc、酸杆菌丰度和变形菌丰度越高,则新碳生成量越多。进一步的,所述新碳为秸秆碳转移进入土壤的碳,用nfc表示,计算公式如下:nfc=(net-13c×100–net-c×atom%13csoil)/(atom%13cresidue–atom%13csoil)(1)其中,net-13c(mgkg−1soil)是样品atom%13c的净变化;net-c(mgkg−1soil)是样品稳定soc的净变化;atom%13csoil(%)是初始土壤的atom%13c;atom%13cresidue(%)是初始秸秆的atom%13c。net-13c=[(csample×atom%13csample–csoil×atom%13csoil)×1000]/100(2)net-c=(csample–csoil)×1000(3)其中csample(gkg−1)是样品的稳定soc含量,atom%13csample(%)是样品的atom%13c,csoil(gkg−1)是初始土壤稳定soc含量。进一步的,酸杆菌丰度和变形菌丰度的增长及酸杆菌和变形菌通过对bg和ap获取酶的投资以从作物秸秆中进行微生物碳同化。进一步的,所述酸杆菌丰度随时间延长而增加。进一步的,mbc含量随时间延长先增加后减少。进一步的,bg、ap和mbc直接影响新碳的生成。进一步的,酸杆菌丰度通过影响bg、ap和mbc,间接影响新碳的生成。进一步的,bg通过影响ap间接影响mbc途径。进一步的,所述秸秆还田的具体操作为,在待改善土壤中施入如下组分:12.5g/kg的秸秆、16.3~49.0mg/kg的硝酸铵、12.2~36.5mg/kg的磷酸二氢钾和3.3~10.0mg/kg的硫酸铵。经由上述的技术方案可知,与现有技术相比,本发明取得的有益效果为:针对养分可利用性与土壤新碳生成强度的关系,本发明又通过先进的多因子分析方法,定量分析微生物生物量、胞外酶活性和微生物分类单元等关键因子对土壤新碳生成的贡献率及潜在微生物机制。增强和扩展了对不同土壤状况、不同n、p和s养分添加水平下,秸秆添加对土壤新碳生成潜在微生物机制的理解,为揭示soc动态变化的关键微生物步骤和优化农业生态系统中的养分管理提供了新的证据。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。图1附图为本发明实施例1中培养期间公主岭(a)和海伦(b)土壤呼吸;图2附图为本发明实施例1中添加或不添加秸秆和养分对(a)新碳形成和(b)老碳分解的影响;图3附图为本发明实施例1中培养期间公主岭(a)和海伦(b)土壤mbc演变;图4附图为本发明实施例1中公主岭和海伦土壤胞外酶活性变化,其中(a)为公主岭7d胞外酶活性变化,(b)为公主岭84d胞外酶活性变化,(c)为海伦7d胞外酶活性变化,(d)为海伦84d胞外酶活性变化;图5附图为本发明实施例1中公主岭(a,c)和海伦(b,d)土壤中的碳(c)获取酶活性与氮(n)获取酶活性和磷(p)获取酶活性的计量比;图6附图为本发明实施例1中公主岭(a,b,c,d)和海伦(e,f,g,h)土壤中各处理下主要微生物分类单元的基因丰度;图7附图为本发明实施例1中mbc,bg,ap,酸杆菌和变形菌对在公主岭(a)和海伦(b)土壤新碳生成的相对影响;图8附图为本发明实施例1中养分添加,mbc,胞外酶活性和基因丰度对公主岭(a)和海伦(b)土壤新碳生成的路径分析。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明实施例中所需药剂为常规实验药剂,采购自市售渠道;实施例中未提及的实验方法为常规实验方法,在此不再一一赘述。实施例1(1)土样收集和制备在2018年10月,我们选择东北黑土区两个作物秸秆还田的长期定位试验,采集表层0至20cm处土壤作为本发明供试土壤样品:(1)吉林公主岭(北纬43°30′,东经124°48′);(2)黑龙江海伦(北纬47°27′,东经126°55′)。两个试验点位均是自1990年开始进行作物秸秆和化学氮、磷和钾肥配施的还田试验(详细信息见表1)。定位试验开展之前,公主岭和海伦点位已经分别进行农业耕作了至少150年和60年。采集的土样在阴凉通风处自然风干,同时用手将土壤团聚体沿着弱化纹理的边缘轻轻压碎,然后通过2mm的筛子。过筛时,小心清除所有可识别的砾石,碎屑和类植物材料(coarsefractionofsom,cf-som≥2mm)。通过2mm筛子的土样进一步借助0.4mm筛子进行筛分,按照kirkby等描述的方法去除0.4mm筛子上部剩余的cf-som。本发明以去除cf-som后剩余的土壤(som的细小部分)为研究对象。土样基本理化属性见表2。表1长期定位试验点秸秆和施肥管理介绍公主岭海伦玉米玉米/大豆/小麦n(kghm−1yr−1)112.0127.5/90.0/17.9p2o5(kghm−1yr−1)82.545.8k2o(kghm−1yr−1)82.572.3作物残渣(thm−1yr−1)7.57.5还田方法覆盖犁地面积(m2)400224表2试验点和土壤基础属性概况公主岭海伦坐标43°30′n,124°48′e47°27′n,126°55′e年平均气温(℃)4.52.3年平均降水量(mm)525550试验时间段1990~20181990~2018种植方式单作单作轮作玉米玉米/大豆/小麦土壤种类(fao)黑土黑土土壤质地壤土重壤土黏土(<0.002mm)(%)31.134.5土壤有机碳含量(%)1.67±0.12.86±0.02总氮(%)0.13±0.0040.23±0.003有机磷(%)0.029±0.00090.044±0.0007总硫(%)0.022±0.00050.036±0.002atom13c(‰)1.0908±0.00021.0948±0.0004ph7.6±0.26.1±0.1注:“±”后的数字是平均值的标准误差(n=3)。选择适量土样通过0.15mm筛子,并使用元素分析仪(hanau,germany)分析其c,n和s的含量。土壤有机磷通过煅烧-萃取(ignition-extraction)程序来测定。使用与pdzeuropa20-20同位素质谱仪连接的元素分析仪(serconltd,cheshire,uk)分析土壤的atom%13c。土壤ph值在1:5的土壤:水的比例下用电极ph检测计测定。(2)秸秆和养分处理为了凸显土壤新碳形成的差异变化,我们将玉米秸秆的添加量设置为12.5gkg−1soil(土壤干重),相当于0~20cm土体7.5tha−1的秸秆还田当量的两倍(土壤容重1.24tm−3)。通过收获13co2脉冲标记的成熟玉米的地上部分作为富标秸秆供体,并在60℃下恒温烘干。玉米秸秆与土样混合前将其切碎成2mm长的碎片。13c标记秸秆的最终化学分析为:总碳为42.8%;总氮0.97%;总磷0.12%;总硫0.11%和atom%13c1.48%。每种土壤设置五种处理:土壤对照(s),土壤+秸秆(s+st),土壤+秸秆+低量养分(s+st+lnu),土壤+秸秆+中量养分(s+st+mnu)和土壤+秸秆+高量养分(s+st+hnu)(表3)。该养分梯度的设置基于以下研究发现:n、p和s养分补充可以增强秸秆-c的腐殖化效率。低量养分的添加水平是基于秸秆c中有30%腐殖化(理想化腐殖系数)以形成土壤新碳,并且在秸秆c转化中遵循c:n:p:s=10000:860:169:129养分需求比例。中量和高量养分添加水平分别设为低量养分添加水平的2倍和3倍。养分n、p和s以硝酸铵、磷酸二氢钾和硫酸铵配置的营养液添加。用10m氢氧化钠溶液将营养液的ph调节至7。表3秸秆和养分添加处理(3)培养设置将准备好的秸秆和土壤在光滑柔软的塑料板上均匀混合。首先,将营养溶液添加或不添加到土壤和秸秆的混合物中,然后,再添加蒸馏水以确保土壤获得60%的田间持水量。将两个地点不同养分添加处理的土样置于恒温培养箱(25℃)避光培养84天。每个处理包含15个40g土壤的重复样品,每个重复样品放在一个两端开口的圆形塑料管中,该塑料管的直径为50mm,高为60mm。每个塑料管的底部都用尼龙布(0.074mm)包裹,以防止土样溢出,但允许气体交换。装有土样的塑料管置于配有三通阀的500ml梅森瓶中。每个瓶底部铺上蒸馏水以防止培养期间水分散失。塑料管通过圆形支架(直径50mm,高30mm)支撑在水面之上。每个土壤和秸秆混合后的样品首先加入营养液,然后加入蒸馏水以获得60%的田间持水量。另外,用50ml注射器定期(第1、7、14、28、56、84天)从每个处理的三个重复样本中收集二氧化碳气体,并使用气象色谱法(6890,agilent,usa)进行检测。各采样时期co2排放量用如下公式计算:f=[(qt-q0)×v×m×273×1000×24)]/[22.4×m×t×(273+t)]其中,f是co2的排放量(mgco2kg−1soilday−1),qt是培养后在室温下检测到的co2浓度(co2/air,×10−1molmol−1),q0是培养前在室温下检测到的co2浓度(co2/air,×10−1molmol−1),v是梅森瓶的体积(l),m是土壤样品干重(kg),t是密闭培养时间(h),m是co2的摩尔质量(gmol−1),t是培养温度。采集完气体后,将来自每个盛样管中的混合物铺展到柔软光滑的塑料板上重新均匀混合。然后,用蒸馏水重新调节土壤湿度,以保持盛样管的恒定重量。另外,在将盛样管放回原处之前,使用100ml注射器将周围空气反复注入梅森瓶中。(4)土样分析和土壤新碳计算培养结束后,选取一部分培养样品自然风干。通过干筛-风选法去除残留的部分降解的秸秆残留物。将各处理3个重复的样品通过0.15mm筛子,并按照步骤(1)介绍的方法分析其总c含量和atom%13c(表1)。我们将秸秆碳转移进入土壤的碳定义为土壤新碳(nfc),并使用公式(1),(2)和(3)进行计算:nfc=(net-13c×100–net-c×atom%13csoil)/(atom%13cresidue–atom%13csoil)(1)其中,net-13c(mgkg−1soil)是样品atom%13c的净变化;net-c(mgkg−1soil)是样品稳定soc的净变化;atom%13csoil(%)是初始土壤的atom%13c;atom%13cresidue(%)是初始秸秆的atom%13c。net-13c=[(csample×atom%13csample–csoil×atom%13csoil)×1000]/100(2)net-c=(csample–csoil)×1000(3)其中csample(gkg−1)是样品的稳定soc含量,atom%13csample(%)是样品的atom%13c,csoil(gkg−1)是初始土壤稳定soc含量。表4培养结束后土样atom%13c和soc含量注:“±”后的数字是平均值的标准误差(n=3)。nfc和net-c之间的差异被认为是土壤原有老c的矿化。在培养的第7、28、56和84天,分别取样并通过氯仿熏蒸-萃取法对鲜土样品的微生物量碳(mbc)进行分析。渗滤液中的mbc含量使用toc/tn分析仪测量(multin/c3100,analytikjenaag,germany),计算中的转换系数采用0.45。(5)胞外酶活性在培养试验的第7、28、56和84天分别检测5种水解酶,包括β-葡萄糖苷酶(bg),纤维二糖水解酶(cbh),β-n-乙酰氨基葡萄糖苷酶(nag),亮氨酸氨肽酶(lap)和酸性磷酸酶(ap)。5种酶的活性测定依据96微孔板-荧光测定法。酶活具体测定方法和步骤如下:首先,在每份重复样品的1g鲜土中加入100ml50mm醋酸钠缓冲液(ph=7.0,对应于两种土壤的ph),并通过磁力搅拌器搅动5分钟以制备土壤悬浮液。平板上设置对照孔、底物孔、淬火对照孔和标准孔,并分别注入200μl悬浮液+50μl的ch3coona溶液,50μl底物溶液+200μlch3coona溶液,50μl标准液(mub或amc)+200μl的悬浮液和50μl的标准液+200μl的ch3coona溶液。将所有平板密封并在黑暗中于25℃培养4小时。在培育过程中,为了确保平板内样品混合物完全反应,每小时都要摇动平板。培养4小时后,向每个微孔中加入1ml1mnaoh溶液,并使用具有自动增益调节功能的酶标仪测量荧光强度(365nmexcitationand450nmemission,synergyh1m,usa),以评估5个水解酶的活性(nmolg−1soilhr−1)。(6)微生物基因丰度测定土壤胞外酶的同时,我们也在培养第7、28、56和84天,通过土壤dna提取试剂盒从0.25g土样中提取每种处理的三份重复样品的dna(transgenbiotech,china)。然后,使用abi7500仪器通过实时定量聚合酶链反应(qrt-pcr)确定细菌(16sv3-v4)和真菌(its1)的基因丰度。本研究使用338f(gtactcctacgggaggcagca)和806r(gtggactachvgggtwtctaat)引物扩增细菌16srrna基因片段;使用its1f(cttggtcatttagaggaagtaa)和its1r(tgcgttcttcatcgatgc)引物扩增its基因片段。qrt-pcr系统如下:2µlofdna,10µlof2×mastermix,0.5µlof10um正向引物,0.5µlof10um反向引物。从各处理3个重复样本中均提取30ng纯化的dna,借助ap221-02transstartfastpfudna聚合酶进行扩增。同时,使用miseq平台(illuminamiseppe300/pe250,usa)分析每个样品中等量的pcr产物,以定量主要微生物分类单元的基因丰度(actinobacteria,proteobacteria,acidobacteria,andascomycota)。配对末端(pe)序列的质量控制和统计分析通过trimmomatic(v0.36)完成。碱基序列末端质量为20或更小的序列片段(tailmassof20orless)、pe序列的重叠部分小于10bp,嵌合体(chimeras)和不匹配序列(unmatchedsequences)被去除。去除序列条码和引物后,可通过进一步去除嵌合体和短序列来获得更加纯化的序列(cleantags)。对于细菌16srrna来说,依据silva数据库v128并且使用uparse分类器,在97%相似性基础上将纯化序列聚类并分级为不同的操作分类单位(otu)。对于真菌its区,依据unitev7数据库通用使用uparse分类器,对清除完嵌合体的纯化序列在97%相似性上聚类为不同out。最后,根据细菌和真菌的绝对基因丰度和主要微生物分类单元在整体群落的相对丰度来确定主要微生物分类单元的绝对基因丰度。(7)统计分析所有数据均输入excel2016并整理(microsoft,redmond,wa,usa)。所有结果呈现均为三个重复的平均值±标准误差。首先,使用spss20,通过单向方差分析(anova)和邓肯多重比较(p<0.05)确定nfc,mbc,胞外酶活性和基因丰度在不同养分添加水平下的差异(ibm,chicago,il,usa)。然后,在r3.3.3中使用gbm软件包和elith等人的代码进行了回归树(brt)分析,以量化10个变量对土壤新碳生成相对影响。筛选后保留了五个变量(mbc,bg,ap,acidobacteria和proteobacteria)。最后,通过amosgraphics21.0(ibm,chicago,il,usa)建立可能的结构方程模型(sem),以检测不同养分添加水平是否通过影响主要微生物分类单元生长及其对相关功能胞外酶的投资来直接或间接影响微生物生物量的积累和土壤新碳的生成。(8)结果(81)土壤呼吸在整个培养期间,两个点位土壤的co2排放量相对较低(0.4~1.0mgco2–ckg−1soilday−1)(图1)。在培养早期阶段(第1天至第28天),在土壤中添加秸秆或者补充n、p和s养分后两个点位的co2排放速率均显著增加,整体排放水平是对照土壤的4.5倍(变化范围是2.5~6.5倍)。在培养的后期(第56天,第84天),各点位不同养分处理的土壤的呼吸速率逐渐趋于一致。添加秸秆或养分后,海伦土壤培养前期(第1天至第14天)的co2排放速率高于公主岭土壤的co2排放率,前者排放速率的变化范围为2.2~6.5mgco2–ckg−1soilday−1,后者排放速率的变化范围为1.9~5.2mgco2–ckg−1soilday−1。(82)土壤新碳变化与对照土壤相比,秸秆的添加提高了两种土壤中的土壤新碳的生成,同时引起了土壤原soc的矿化(图2)。与海伦土壤相比,添加n、p和s养分更利于公主岭土壤新碳生成强度的提高。通过提高养分添加水平,公主岭土壤新碳的生成量逐步增加,从1155.9mgkg−1soil升高到1722.4mgkg−1soil(从低量养分添加到高量养分添加)。在高量养分添加水平下,土壤新碳生成量占投入秸秆碳的30.4%。养分补充同样也增强了海伦土壤的新碳生成量,其变化范围为725.1~1067.5mgkg−1soil,占添加秸秆碳总量的12.8~18.8%。可见,秸秆和养分的输入导致了土壤原有soc的矿化,同时进一步提高了土壤新碳形成的强度。(83)mbc、胞外酶和基因丰度演变(831)mbc在两种土壤的所有处理中,土壤mbc均随时间先增加然后减少(图3)。与对照土壤相比,添加秸秆后各点位土壤的mbc显著提高,在添加秸秆的基础上补充养分进一步提高了土壤mbc。在高量添加养分的条件下,两种土壤mbc在培养前期(第7天和第28天)明显提高,并在第28天达到最大值。从不同点位来看,海伦土壤中的mbc含量高于公主岭土壤中的mbc含量。然而,从第7天到第28天,公主岭土壤的mbc含量提高了近1.6倍,而海伦土壤的mbc含量提高了约1.1倍。(832)胞外酶两种土壤中的土壤胞外酶活性随培养时间延长均呈总体下降趋势(图4)。与对照土壤相比,添加秸秆的土壤中bg+cbh,lap+nag和ap的活性分别提高了2.4倍,2.9倍和4.5倍。在公主岭和海伦土壤中,不同采样时间下bg和ap的活性随养分添加水平的提高而明显增加,并且在海伦土壤中p获取酶(ap)的活性高于n获取酶(lap+nag)的活性。公主岭土壤中c(bg+cbh)和n(lap+nag)获取酶的活性明显高于海伦,而海伦土壤中的p获取酶(ap)的活性表现出较强的活性。与添加养分和秸秆的土壤相比,我们在对照土壤中观察到最高的c:n[(bg+cbh):(nag+lap)]和c:p[(bg+cbh):(ap)]酶活比例(图5)。在培养前期(主要是第7天和第28天),单独添加秸秆的土壤中其c与n获取酶活性比例和c与p获取酶活性的比例显著低于秸秆和养分联合添加土壤中的c:n和c:p的获取酶活性比例。(833)基因丰度在整个培养期间,两种土壤不同处理下酸杆菌(acidobacteria)的基因丰度随时间延长而增加,而其他微生物类群的基因丰度先增加,然后略有下降(图6)。单独添加秸秆会导致两种土壤中酸杆菌(第7天)和子囊菌(ascomycota,第7天,84天)的基因丰度明显增加,并且显著高于秸秆和养分联合添加下土壤中酸杆菌和子囊菌的基因丰度。随着养分添加水平的提高,两种土壤中的变形菌(proteobacteria)和放线菌(actinobacteria,仅针对公主岭土壤)的基因丰度也逐渐提高。与公主岭的土壤相比,海伦土壤中的四中微生物分类单元的基因丰度值更高。另外,从培养第7天到第28天,公主岭土壤的4个分类单元的基因丰度提高了1.2~1.8倍,高于海伦土壤分类单元基因丰度的提高幅度(1.0~1.3倍)。(9)新碳生成的驱动因子和作用路径回归树(brt)分析结果解释了公主岭土壤新碳生成变异的75%和海伦土壤新碳生成变异的84%(图7)。bg、ap、mbc、酸杆菌(acidobacteria)和变形菌(proteobacteria)对公主岭土壤新碳生成的相对影响分别为27.8%、18.5%、14.7%、8.1%和6.1%;对海伦土壤新碳生成的相对影响分别为25.9%、29.5%、10.1%、13.9%和5.0%。结构方程模型(sem)分析表明,养分n(p和s),mbc和bg直接影响了公主岭土壤的新碳生成(路径系数:0.52,-0.19和-0.54)(图8a)。酸杆菌,它与养分n的添加水平直接正相关(路径系数:0.18),并通过mbc和bg间接影响土壤新碳生成nfc(路径系数分别为:-0.46,-0.62)。对于海伦定位来说,养分n添加水平,mbc和ap直接影响土壤新碳生成(路径系数分别为:0.42,-0.21和-0.48),而酸杆菌通过mbc和ap间接影响土壤新碳生成(路径系数分别为:-0.86和-0.16)(图8b)。路径分析解释了公主岭土壤新碳生成方差值变异的80%(r2=0.80),解释了海伦土壤新碳生成方差变异的76%(r2=0.76)。本发明增强和扩展了我们对不同土壤状况(soc,ph)、不同n、p和s养分添加水平下,秸秆添加对土壤新碳生成潜在微生物机制的理解。在培养试验早期,单独添加秸秆的土壤(相对于有养分添加的土壤)中酸杆菌和子囊菌的基因丰度较高,c获取酶与n获取酶或p获取酶活性的比例较低。这表明在养分相对匮乏的环境中,寡养生物对秸秆的分解贡献更大,并通过投资更多的n和p养分获取酶来主要进行养分开采而不是微生物碳获取。随着n、p和s养分添加水平的提高,秸秆的添加促进了土壤新碳的积累,该积累过程有赖于不同养分水平下酸杆菌和变形菌的生长变化及其对c获取酶(bg)和p获取酶(ap)的投资以从作物秸秆中进行微生物碳同化。这些结果综合表明,依据土壤稳定som中的c:n:p化学计量比补充无机n、p和s养分可以满足微生物化学计量分解的需要,从而促进秸秆的高效腐殖和土壤新碳的生成。此外,在两个点位土壤中均观察到了ap与bg,mbc和酸杆菌之间存在直接的路径关系,并且bg通过ap间接影响mbc的途径,这些结果表明p素的可用性可能对于调整微生物c的获取策略至关重要。从不同点位来看,公主岭土壤的新碳生成强度高于海伦土壤,表明土壤状况(如soc水平和ph值)也明显影响新碳生成。这项研究可以为揭示soc动态变化的关键微生物步骤和优化农业生态系统中的养分管理提供新的证据。本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1