双表达小干扰RNA的复制缺损型乙型肝炎病毒载体、其制备方法及应用与流程
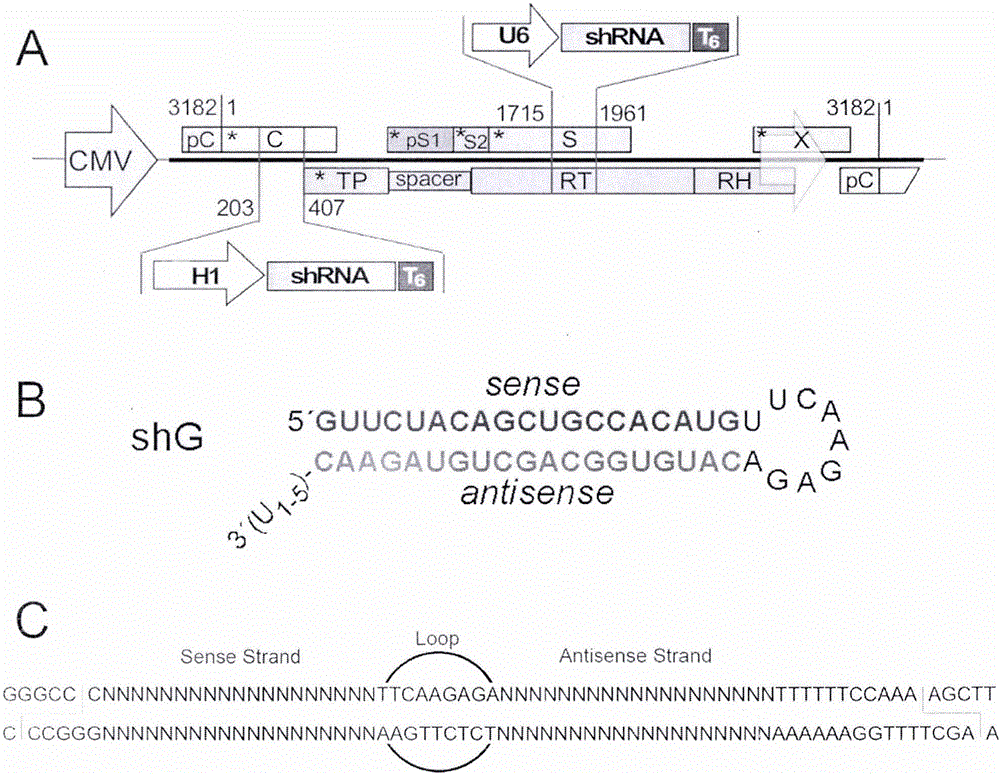
本发明属于医学领域,涉及一种乙型肝炎病毒载体,具体涉及一种双表达小干扰RNA的复制缺损型乙型肝炎病毒载体、其制备方法及应用。
背景技术:
乙型肝炎病毒(HBV)是一种以逆转录方式复制的DNA病毒,其基因组结构紧凑,长度只有3.2kb。据WHO估计,全球有2.4亿人慢性感染HBV,HBV是导致慢性肝炎、肝硬化和肝细胞癌等终末肝病的主要致病因素。当前正式批准用于临床的药物包括干扰素(IFN)和核苷(酸)类似物(NAs),但IFN治疗常常受限于药物不良反应,NAs类药物往往需要患者终生服药,这是由于宿主细胞核内持续存在共价闭合环状(ccc)DNA。以cccDNA为模板转录产生前基因组RNA(pgRNA)以及几种亚基因组RNA,NAs可以有效的抑制pgRNA的逆转录复制,进而阻断新病毒的产生,但并不能影响亚基因组RNA产生多种病毒抗原,而研究发现大量产生的病毒抗原会影响获得性免疫应答,因此不能减少病毒抗原成为NAs治疗的一个缺憾。
RNA干扰(RNAi)是一种强有力的基因沉默技术,能够抑制许多种病毒的复制。RNAi对HBV复制及基因表达的抑制效应尤其明显,因为HBV的复制直接依赖于pgRNA,而且HBV的多种转录产物共用3’端的重叠序列,所以只需一个RNAi效应子就可以靶向抑制病毒的多条RNA。然而,抗HBV的RNAi疗法走向临床还面临诸多严重的挑战,其中包括脱靶效应和刺激产生有害的免疫反应,尽管近年在siRNA非病毒载体的化学稳定性和递送的器官靶向性方面取得了长足的进步,但在彻底清除cccDNA池或者说达到免疫控制之前,合成的siRNA仍需要多次重复给药。载体表达的短发夹RNA(shRNA)也面临如何靶向性递送到肝脏并且到达所有肝细胞的问题,采用病毒载体可以实现高效的递送,例如腺病毒(Ad)、腺相关病毒(AAV)以及慢病毒,然而,非整合病毒载体只能短暂的表达shRNA,也需要重复给药,这可能要受到抗病毒免疫应答的影响,对于整合病毒载体来说,则有插入突变、异常拼接等危险。
如果把HBV作为递送shRNA的载体,以一种在特定条件下才具有复制能力的工作方式,则有希望克服前述大部分的难题。像自发产生的复制缺损型HBV病毒颗粒一样,HBV载体作为真正的HBV具有肝组织靶向性,经过设计,在居住病毒反式互补作用下可以产生新的载体颗粒并播散,并且当野生型(wild-type,wt)HBV消失后载体的播散即停止。但将HBV改造为载体要克服几个重要的难题,首先是HBV的基因组结构非常紧凑,每一个核苷酸都是某个开放读码框(open reading frame,ORF)的编码核苷酸,并且超过半数的核苷酸处于两个ORF内;而且,所有的调节原件诸如启动子、增强子以及众多的复制顺式作用元件,都与ORF重叠,因此,即使是所需的反式互补因子全部存在的情况下,不恰当的基因序列编辑也很容易导致载体的复制能力受损。第二,所递送的shRNA必须有效地靶向HBV,而且shRNA能达到产生设计沉默效应水平所需要的数量,还要把脱靶效应降至最小。第三,载体产生的shRNA不能靶向载体自身。至少,用HBV载体重复感染已经感染HBV的细胞看上去无效,但在NAs治疗时,野生型HBV最终被耐NA变异病毒取代,这种现象显示重复感染的确发生了,而且,在土拨鼠肝炎病毒模型中直接显示了重复感染的现象。
因此,研究一种HBV-shRNA双表达载体及其构建方法,具有重要的意义。
技术实现要素:
本发明要解决的技术问题,是提供一种双表达小干扰RNA的复制缺损型乙型肝炎病毒载体、其制备方法及应用,采用以野生型HBV的质粒pCH-9/3093为载体进行基因修饰,构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体pCH-203H1shG-1715U6shG,抑制hrGFP的表达;构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体pCH-203H1sh6-1715U6sh8,抑制HBV的表达与复制。
为解决上述技术问题,本发明所采取的技术方案是:
一种双表达小干扰RNA的复制缺损型乙型肝炎病毒载体,以表达野生型HBV的质粒pCH-9/3093为载体进行基因修饰,构建HBV-shRNA双表达载体:首先,通过点突变,在基因组各蛋白起始密码ATG后添加终止密码;其次,将C基因区的203-407位和S基因区的1715-1961位的序列删除;最后,在C基因区的203-407位之间插入H1-shRNA表达框;在S基因区的1715-1961位之间插入U6-shRNA表达框,构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体;
其中,所述的H1-shRNA表达框包括H1启动子、shRNA序列和终止信号T6;
所述的U6-shRNA表达框包括U6启动子、shRNA序列和终止信号T6;
所述的H1启动子和U6启动子的长度分别为103和122bp。
作为本发明的一种限定,所述的H1-shRNA表达框的序列为:
AAGAATATTT GCATGTCGCT ATGTGTTCTG GGAAATCACC ATAAACGTGA AATGTCTTTG
GATTTGGGAA TCTTATAAGT TCTGTATGAG ACCACTCGGG CCC-茎环状靶序列-TTTTTTCCAA AAGCTT;
所述的U6-shRNA表达框的序列为:
ATATGCAAAT ATGAAGGAAT CATGGGAAAT AGGATCCCAA AATGGACTAT CATATGCTTA
CCGTAACTTG AAAGTATTTC GATTTCTTGG CTTTATATAT CTTGTGGAAA GGACGAGGGCCC-茎环状靶序列-TTTTTTCCAAA AGCTT。
作为本发明的另一种限定,所述的shRNA序列为包括正义链-环-反义链的发卡状RNA结构。
作为上述限定的进一步限定,所述的shRNA序列为shG、sh6或sh8中的一种,其中,shG为靶向人化的绿色荧光蛋白,即hrGFP;sh6或sh8为HBV RNA。
作为上述限定的更进一步限定,所述的sh6和sh8的靶向位分别位于S基因区内的1698-1716位和1953-1971位。
作为上述限定的另一种更进一步限定,所述的sh6和sh8为除了HBx mRNA以外的所有HBV RNA。
本发明还提供了制备上述双表达小干扰RNA的复制缺损型乙型肝炎病毒载体的方法,它按照以下步骤顺序进行:
1)在pCH-9/3093质粒上引入突变点,以终止各基因翻译蛋白质,形成质粒pCH-9/3093M6;
2)在HBV核心蛋白区插入含有H1启动子的序列,构建质粒pCH-M6-203H1;
3)构建在核心蛋白区表达H1-shG的载体pCH-M6-203H1shG;
4)构建在核心蛋白区表达H1-sh6的载体pCH-M6-203H1sh6;
5)在S区插入U6-shRNA表达盒,shRNA靶向hrGFP,以构建质粒pCH-M6-1715U6shG;
6)构建在S区表达U6-sh8的载体pCH-M6-1715U6sh8;
7)构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体pCH-203H1shG-1715U6shG,抑制hrGFP的表达;
8)构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体pCH-203H1sh6-1715U6sh8,抑制HBV的表达与复制。
作为本发明的一种限定,其制备方法的具体表现形式为:
1)在pCH-9/3093质粒上引入突变点,突变点包括:核心区-G28 T、聚合酶区-T444A、preS1区-C954T、preS2区-C1275T、S区-C1482T以及X区-C2677T,以点突变技术引入突变点,其中,所应用的主引物分别为:
核心区-G28T:5’-CCCTTATAAAGAATTTtGAGCTACTG;
聚合酶区-T444A:5’-ACACTTCCGGAGACTACTGTaGTTAGAC;
preS1区-C954T:5’-AACAAGATCTACAGCATGGGGtAGAATC;
preS2区-C1275T:3’-CAGGCCATGtAGTGGAATTCCA;
S区-C1482T:5’-ATTCCTAGGACCCCTTCTCGTGTTAtAGGCGGGG;
X区-C2677T:3’-TGCTGCtAACTGGATCCTGC;
以终止各基因翻译蛋白质,形成质粒pCH-9/3093M6;经序列测定均正确;
2)在HBV核心蛋白区插入含有H1启动子的序列,构建质粒pCH-M6-203H1:
在HBV核心蛋白203-407之间插入如下序列:TAAGAATATT TGCATGTCGC TATGTGTTCT GGGAAATCAC CATAAACGTG AAATGTCTTT GGATTTGGGA ATCTTATAAG TTCTGTATGA GACCACTCGG GCCCGATGGA AGCTTGTT;
利用引物5’-CAATTGTCGACACCATGCAACTTTTTCACCTCTGCCTA和5’-TCTTA
AGAGTCATTAGTTCCCC,以经过了核心区-G28T突变的pCH-9/3093M6为模板,经PCR反应,琼脂糖凝胶电泳获得PCR片段1;
利用引物5’-GGGGAACTAATGACTCT TAAGAATATT TGCATGTCGC TATGTGTTCT GGGAAATCAC CATAAACGTG AAATGTCTTT GGATTTGGGAATCTTA和
5’-AGTCTCCGGAAGTGTTGATAGGATAAGGGGCATAACAAGCTTCGATCGGGCCCGAGTGGTCTCATACAGAACTTATAAGATTCCCAAATCC AA,以H1启动子为模板,经PCR反应,琼脂糖凝胶电泳获得PCR片段2;
再以片段1和片段2的混合物为模板,利用引物5’-CAATTGTCGACACCATGCAACTTTTTCACCTCTGCCTA和
5’-AGTCTCCGGAAGTGTTGATAGGATAAGGGGCATAACAAGCTTCGATCGGGCCCGAGTGGTCTCATACAGAACTTATAAGATTCCCAAATCCAA进行扩增PCR片段3,经纯化后插入到pCH-9/3093M6质粒的Sall-BspE I位点之间,制得质粒pCH-M6-203H1;
3)构建在核心蛋白区表达H1-shG的载体pCH-M6-203H1shG
具体方式为将上述质粒pCH-M6-203H1,用ApaI和HindIII酶切,插入并连接如下两条寡核苷酸退火后的小双链DNA序列,以构建表达靶向hrGFP的小干扰RNA的载体;
hrG(+):5’CGTTCTACAGCTGCCACATGTTCAAGAGACATGTGGCAGCTGTAGAACTTTTTTCCAAA
hrG(-):5’AGCTTTTGGAAAAAAGTTCTACAGCTGCCACATGTCTCTTGAACATGTGGCAGCTGTAGAACGGGCC
插入小干扰RNA时,最终制得载体pCH-M6-203H1shG;
4)构建在核心蛋白区表达H1-sh6的载体pCH-M6-203H1sh6:
将载体pCH-M6-203H1,用ApaI和HindIII酶切,插入并连接如下两条寡核苷酸退火后的小双链DNA序列,最终制得载体pCH-M6-203H1sh6;
sh6(+):5’-CAGAAGATGAGGCATAGCAGGACAAGAGACTGCTATGCCTCATCTTCTTTTTTTCCAAA
sh6(-):5’-AGCTTTTGGAAAAAAAGAAGATGAGGCATAGCAGTCTCTTGTCCTGCTATGCCTCATCTTCTGGGCC;
5)在S区插入插入U6-shRNA表达盒,shRNA靶向hrGFP,以构建质粒pCH-M6-1715U6shG:
在pCH-9/3093-M6质粒的1586位MscI至1962位SpeI之间酶切,插入如下一段合成的DNA片段,其中包含了sh6和sh8位点的多个突变,含有U6启动子,驱动表达靶向shG的小干扰RNA,连接后不再被SpeI酶切,序列如下所示:
CCAAAATTCGCAGTCCCCAACCTCCAATCACTCACCAACCTCTTGTCCTCCAACTTGTCCTGGTTATCGCTGGATGTGTCTGCGGCGTTTTATCATCTTCCTCTTCATCCTGCAGCAATGCCCCACTTACTAGAGACCTAGTAGTCAGTTCTTAAGATATGCAAATATGAAGGAATCATGGGAAATAGGATCCCAAAATGGACTATCATATGCTTACCGTAACTTGAAAGTATTTCGATTTCTTGGCTTTATATATCTTGTGGAAAGGACGAGGGCCCGTTCTACAGCTGCCACATGTTCAAGAGACATGTGGCAGCTGTAGAACTTTTTTCCAAAAGCTTATCGATACCGTCG
6)构建在S区表达U6-sh8的载体pCH-M6-1715U6sh8:
在质粒pCH-M6-1715U6shG的基础上,用ApaI和HindIII酶切,插入并连接如下两条寡核苷酸退火后的小双链DNA序列,以构建表达靶向sh8的小干扰RNA载体;
Sh8(+):CATGGCACTAGTAAACTGAGCCCAAGAGACTCAGTTTACTAGTGCCATTTTTTTCCAAA
Sh8(-)AGCTTTTGGAAAAAAATGGCACTAGTAAACTGAGTCTCTTGGGCTCAGTTTACTAGTGCCATGGGCC
7)构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体pCH-203H1shG-1715U6shG,抑制hrGFP的表达:
pCH-M6-203H1shG和pCH-M6-1715U6shG均用SalI和EcoRI酶切,琼脂糖凝胶电泳后,前者取小片段,后者取大片段,按1∶43比例混合,加入T4 DNA连接酶混匀16℃水浴连接过夜;将20μl连接产物加入100μl TOP10中混匀,冰浴30min,42℃水浴热休克90s,迅速冰浴冷却5min,将混合物平均涂布于含氨苄青霉素的琼脂平板表面,37℃平放2h后将平板倒置继续培养14h,次日可见琼脂平板上可见多个针眼大小的单菌落,从中挑取6个大小相近的单菌落分别接种于5mL浓度为100mg/ml生物含氨苄青霉素的LB培养液中,37℃,180rpm恒温摇床培养过夜,然后用质粒提取试剂盒提取并获得载体质粒;
8)构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体pCH-203H1sh6-1715U6sh8,抑制HBV的表达与复制;
pCH-M6-203H1sh6和pCH-M6-1715U6sh8均用SalI和EcoRI酶切,琼脂糖凝胶电泳后,前者取小片段,后者取大片段,连接酶连接。
本发明还提供了上述双表达小干扰RNA的复制缺损型乙型肝炎病毒载体的应用,其应用于与病毒载体构建嵌合载体。
作为本发明的一种限定,所述的病毒载体为腺病毒、腺相关病毒或慢病毒。
由于采用了上述的技术方案,本发明与现有技术相比,所取得的技术进步在于:
本发明采用以野生型HBV的质粒pCH-9/3093为载体进行基因修饰,构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体pCH-203H1shG-1715U6shG,抑制hrGFP的表达;构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体pCH-203H1sh6-1715U6sh8,抑制HBV的表达与复制。
与现有技术相比所取得的技术进步如下:
1.与化学合成的siRNA相比
因为不能彻底清除cccDNA池,化学合成的siRNA需要多次重复给药。本发明所述的携带双表达shRNA表达框的复制缺损型HBV载体在野生型HBV存在时,可成功进行复制,产生具有囊膜的完整子代重组病毒颗粒,从而持续不断的发挥抗HBV作用。
2.与其他表达shRNA的病毒载体相比
腺病毒、腺相关病毒以及慢病毒载体尚未解决肝组织靶向性的问题,并且不能将shRNA递送到所有肝细胞。本发明所述的HBV载体天然具有嗜肝性,在野生型HBV辅助下,可产生具有感染性的完整子代重组病毒颗粒,可以播散至所有肝细胞。
3.与复制型HBV载体相比
复制型HBV载体可以长期表达,带来脱靶效应等无法预料的不良反应。本发明所述的复制缺损型HBV载体自身不具备复制能力,但在野生型HBV反式互补作用下可以产生新的载体颗粒并播散,并且当野生型HBV消失后载体的播散即停止。
4.与单shRNA表达框载体相比
针对同一mRNA,采用双shRNA表达框靶向mRNA链上的不同靶位,可以显著提高沉默效应,并且减少目标病毒的逃逸突变。
本发明适用于双表达小干扰RNA的复制缺损型乙型肝炎病毒载体及其制备。
本发明下面将结合说明书附图与具体实施例作进一步详细说明。
附图说明
图1为本发明实施例1双表达shRNA的HBV载体及shRNA表达框的结构示意图;
图2为本发明实施例2中Southern blotting检测HBV-shRNA复制水平示意图;
图3为本发明实施例2中HBV-shG对细胞表达GFP的抑制效应示意图;
图4为本发明实施例2中重组HBV颗粒感染HepG2-NTCP细胞系后HBeAg的表达示意图;
图5为本发明实施例2中重组HBV颗粒感染HepG2-NTCP细胞系后流式细胞术分析HBV核心蛋白的表达示意图;
图6为本发明实施例3中HBV-shRNA载体抑制野生型HBV复制的示意图;
图7为本发明实施例3中抗HBV-shRNA载体抑制野生型HBV基因的表达的示意图;
图8为本发明实施例3中检测细胞外载体衍生的被膜病毒颗粒中的DNA的示意图;
图9为本发明实施例4中非转基因小鼠体重的时间变化示意图;
图10为本发明实施例4中非转基因小鼠ALT的时间变化示意图;
图11为本发明实施例4中血清HBsAg水平的时间变化示意图;
图12为本发明实施例4中肝组织HBV核心蛋白的表达示意图;
图13为本发明实施例4中肝组织中病毒总RNA示意图;
图14为本发明实施例4中血清中HBV DNA的时间变化示意图;
图15为本发明实施例4中HBV转基因小鼠血清中检测到载体衍生的HBV DNA结构示意图。
具体实施方式
实施例1 一种双表达小干扰RNA的复制缺损型乙型肝炎病毒载体、其制备方法及应用
一种双表达小干扰RNA的复制缺损型乙型肝炎病毒载体,以表达野生型HBV的质粒pCH-9/3093为载体进行基因修饰,构建HBV-shRNA双表达载体:首先,通过点突变,在基因组各蛋白起始密码ATG后添加终止密码;其次,将C基因区的203-407位和S基因区的1715-1961位的序列删除;最后,在C基因区的203-407位之间插入H1-shRNA表达框;在S基因区的1715-1961位之间插入U6-shRNA表达框,构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体,用于表达靶向hrGFP的小干扰RNA,其序列如下所示:
其中,HBV核心蛋白起始密码子ATG:1
终止突变:G28T对应野生型HBV核心蛋白
H1启动子:205-307
克隆位点:ApaI 302-307
转录起始:308
发夹状序列(来自hrGFP序列):308-354
聚合酶III终止密码:355-360
克隆位点:HindIII 365-370
终止突变:T411A对应野生型HBV P蛋白T444A
终止突变:C921T对应野生型HBV preS1蛋白C954T
终止突变:C1242T对应野生型HBV prS2蛋白C1275T
终止突变:C1449T对应野生型HBV S蛋白C1482T
U6启动子:1709-1830
转录起始:1831
发夹状序列(来自hrGFP序列):1831-1877
聚合酶III终止密码:1878-1883
克隆位点:HindIII 1888-1893
终止突变:C2622T对应野生型HBV X蛋白(C2677T)
CMV启动子:5608-6187
载体pCH-203H1sh6-1715U6sh8的序列为:
其中,HBV核心蛋白起始密码子ATG:1
终止突变:G28T对应野生型HBV核心蛋白
H1启动子:205-307
克隆位点:ApaI 302-307
转录起始:308
发夹状序列(来自HBV nt 1698-1716序列):308-354
聚合酶III终止密码:355-360
克隆位点:HindIII 365-370
终止突变:T411A对应野生型HBV P蛋白T444A
终止突变:C921T对应野生型HBV preS1蛋白C954T
终止突变:C1242T对应野生型HBV prS2蛋白C1275T
终止突变:C1449T对应野生型HBV S蛋白C1482T
U6启动子:1709-1830
转录起始:1831
发夹状序列(来自HBV nt 1953-1971):1831-1877
聚合酶III终止密码:1878-1883
克隆位点:HindIII 1888-1893
终止突变:C2622T对应野生型HBV X蛋白(C2677T)
CMV启动子:5608-6187
其中,所述的H1-shRNA表达框包括H1启动子、shRNA序列和终止信号T6;
所述的U6-shRNA表达框包括U6启动子、shRNA序列和终止信号T6;
所述的H1启动子和U6启动子的长度分别为103和122bp。
其中,所述的H1-shRNA表达框的序列为:
AAGAATATTT GCATGTCGCT ATGTGTTCTG GGAAATCACC ATAAACGTGA AATGTCTTTG
GATTTGGGAA TCTTATAAGT TCTGTATGAG ACCACTCGGG CCC-茎环状靶序列-TTTTTTCCAAAAGCTT;
所述的U6-shRNA表达框的序列为:
ATATGCAAAT ATGAAGGAAT CATGGGAAAT AGGATCCCAA AATGGACTAT CATATGCTTA
CCGTAACTTG AAAGTATTTC GATTTCTTGG CTTTATATAT CTTGTGGAAA GGACGAGGGCCC-茎环状靶序列-TTTTTTCCAAA AGCTT。
其中,所述的shRNA序列为包括正义链-环-反义链的发卡状RNA结构,为shG、sh6或sh8中的一种,其中,shG为靶向人化的绿色荧光蛋白,即hrGFP;sh6或sh8为HBV RNA。
所述的sh6和sh8的靶向位分别位于S基因区内的1698-1716位和1953-1971位。
作为上述限定的另一种更进一步限定,所述的sh6和sh8为除了HBx mRNA以外的所有HBV RNA。
制备上述双表达小干扰RNA的复制缺损型乙型肝炎病毒载体的方法,它按照以下步骤顺序进行:
1)在pCH-9/3093质粒上引入突变点,以终止各基因翻译蛋白质,形成质粒pCH-9/3093M6;
在pCH-9/3093质粒上引入突变点,突变点包括:核心区-G28T、聚合酶区-T444A、preS1区-C954T、preS2区-C1275T、S区-C1482T以及X区-C2677T,以点突变技术引入突变点,其中,所应用的主引物分别为:
核心区-G28T:5’-CCCTTATAAAGAATTTtGAGCTACTG;
聚合酶区-T444A:5’-ACACTTCCGGAGACTACTGTaGTTAGAC;
preS1区-C954T:5’-AACAAGATCTACAGCATGGGGtAGAATC;
preS2区-C1275T:3’-CAGGCCATGtAGTGGAATTCCA;
S区-C1482T:5’-ATTCCTAGGACCCCTTCTCGTGTTAtAGGCGGGG;
X区-C2677T:3’-TGCTGCtAACTGGATCCTGC;
以终止各基因翻译蛋白质,形成质粒pCH-9/3093M6;经序列测定均正确;
2)在HBV核心蛋白区插入含有H1启动子的序列,构建质粒pCH-M6-203H1:
在HBV核心蛋白203-407之间插入如下序列:TAAGAATATT TGCATGTCGC TATGTGTTCT GGGAAATCAC CATAAACGTG AAATGTCTTT GGATTTGGGA ATCTTATAAG TTCTGTATGA GACCACTCGG GCCCGATGGA AGCTTGTT;
利用引物5’-CAATTGTCGACACCATGCAACTTTTTCACCTCTGCCTA和5’-TCTTAAGAGTCATTAGTTCCCC,以经过了核心区-G28T突变的pCH-9/3093M6为模板,经PCR反应,琼脂糖凝胶电泳获得PCR片段1;
利用引物5’-GGGGAACTAATGACTCT TAAGAATATT TGCATGTCGC TATGTGTTCT GGGAAATCAC CATAAACGTG AAATGTCTTT GGATTTGGGAATCTTA和5’-AGTCTCCGGAAGTGTTGATAGGATAAGGGGCATAACAAGCTTCGATCGGGCCCGAGTGGTCTCATACAGAACTTATAAGATTCCCAAATCC AA,以H1启动子为模板,经PCR反应,琼脂糖凝胶电泳获得PCR片段2;
再以片段1和片段2的混合物为模板,利用引物
5’-CAATTGTCGACACCATGCAACTTTTTCACCTCTGCCTA和
5’-AGTCTCCGGAAGTGTTGATAGGATAAGGGGCATAACAAGCTTCGATCGGGCCCGAGTGGTCTCATACAGAACTTATAAGATTCCCAAATCCAA进行扩增PCR片段3,经纯化后插入到pCH-9/3093M6质粒的SalI-BspE I位点之间,制得质粒pCH-M6-203H1;
3)构建在核心蛋白区表达H1-shG的载体pCH-M6-203H1shG
具体方式为将上述质粒pCH-M6-203H1,用ApaI和HindIII酶切,插入并连接如下两条寡核苷酸退火后的小双链DNA序列,以构建表达靶向hrGFP的小干扰RNA的载体;
hrG(+):5’CGTTCTACAGCTGCCACATGTTCAAGAGACATGTGGCAGCTGTAGAACTTTTTTCCAAA
hrG(-):5’AGCTTTTGGAAAAAAGTTCTACAGCTGCCACATGTCTCTTGAACATGTGGCAGCTGTAGAACGGGCC
插入小干扰RNA时,最终制得载体pCH-M6-203H1shG;
4)构建在核心蛋白区表达H1-sh6的载体pCH-M6-203H1sh6:
将载体pCH-M6-203H1,用ApaI和HindIII酶切,插入并连接如下两条寡核苷酸退火后的小双链DNA序列,最终制得载体pCH-M6-203H1sh6;
sh6(+):5’-CAGAAGATGAGGCATAGCAGGACAAGAGACTGCTATGCCTCATCTTCTTTTTTTCCAAA
sh6(-):5’-AGCTTTTGGAAAAAAAGAAGATGAGGCATAGCAGTCTCTTGTCCTGCTATGCCTCATCTTCTGGGCC;
5)在S区插入插入U6-shRNA表达盒,shRNA靶向hrGFP,以构建质粒pCH-M6-1715U6shG:
在pCH-9/3093-M6质粒的1586位MscI至1962位SpeI之间酶切,插入如下一段合成的DNA片段,其中包含了sh6和sh8位点的多个突变,含有U6启动子,驱动表达靶向shG的小干扰RNA,连接后不再被SpeI酶切,序列如下所示:
CCAAAATTCGCAGTCCCCAACCTCCAATCACTCACCAACCTCTTGTCCTCCAACTTGTCCTGGTTATCGCTGGATGTGTCTGCGGCGTTTTATCATCTTCCTCTTCATCCTGCAGCAATGCCCCACTTACTAGAGACCTAGTAGTCAGTTCTTAAGATATGCAAATATGAAGGAATCATGGGAAATAGGATCCCAAAATGGACTATCATATGCTTACCGTAACTTGAAAGTATTTCGATTTCTTGGCTTTATATATCTTGTGGAAAGGACGAGGGCCCGTTCTACAGCTGCCACATGTTCAAGAGACATGTGGCAGCTGTAGAACTTTTTTCCAAAAGCTTATCGATACCGTCG
6)构建在S区表达U6-sh8的载体pCH-M6-1715U6sh8:
在质粒pCH-M6-1715U6shG的基础上,用ApaI和HindIII酶切,插入并连接如下两条寡核苷酸退火后的小双链DNA序列,以构建表达靶向sh8的小干扰RNA载体;
Sh8(+):CATGGCACTAGTAAACTGAGCCCAAGAGACTCAGTTTACTAGTGCCATTTTTTTTCCAAA
Sh8(-):AGCTTTTGGAAAAAAATGGCACTAGTAAACTGAGTCTCTTGGGCTCAGTTTACTAGTGCCATGGGCC
7)构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体pCH-203H1shG-1715U6shG,抑制hrGFP的表达:
pCH-M6-203H1shG和pCH-M6-1715U6shG均用SalI和EcoRI酶切,琼脂糖凝胶电泳后,前者取小片段,后者取大片段,按1∶43比例混合,加入T4 DNA连接酶混匀16℃水浴连接过夜;将20μl连接产物加入100μl TOP10中混匀,冰浴30min,42℃水浴热休克90s,迅速冰浴冷却5min,将混合物平均涂布于含氨苄青霉素的琼脂平板表面,37℃平放2h后将平板倒置继续培养14h,次日可见琼脂平板上可见多个针眼大小的单菌落,从中挑取6个大小相近的单菌落分别接种于5mL浓度为100mg/ml生物含氨苄青霉素的LB培养液中,37℃,180rpm恒温摇床培养过夜,然后用质粒提取试剂盒提取并获得载体质粒;
8)构建双表达小干扰RNA的复制缺损型乙型肝炎病毒载体pCH-203H1sh6-1715U6sh8,抑制HBV的表达与复制;
pCH-M6-203H1sh6和pCH-M6-1715U6sh8均用SalI和EcoRI酶切,琼脂糖凝胶电泳后,前者取小片段,后者取大片段,连接酶连接。
上述双表达小干扰RNA的复制缺损型乙型肝炎病毒载体的应用,其应用于与病毒载体构建嵌合载体,其中,病毒载体为腺病毒、腺相关病毒或慢病毒。
实施例2 复制缺损型HBV载体抑制肝癌细胞系表达hrGFP
双表达shG的复制缺损型HBV载体转染肝癌细胞系HepG2,;此外其缺乏自我复制能力,只有在居住病毒帮助下可以产生新的载体颗粒并播散,并且当野生型HBV消失后载体的播散即停止。
1.复制缺损型HBV载体双表达shG抑制肝癌细胞表达hrGFP
1.1.细胞培养:肝癌细胞系HepG2;
1.2.转染细胞:分为3组,转染试剂为Fugene6 HD(Roche);
第一组细胞:载体pCH-203H1-shG、pCH-203U6-shG、pCH-1715U6-shG、pCH-203H1-shG-1715-U6-shG与pCH-9/3142以1ug∶1ug比例共转染双份细胞,以pCH-9/3093为对照;
第二组细胞:载体pCH-203H1-shG、pCH-1715U6-shG、pCH-203H1-shG-1715-U6-shG分别与pCH-9/3142(+)或pcDNA3.1(-)以1ug∶1ug比例共转染共转染;
第三组细胞:表达hrGFP的质粒plRES-hrGFP-1质粒与pCH-203H1-shG、pCH-1715U6-shG、pCH-203H1-shG-1715-U6-shG、pBSII-H1-shG、pBSII-U6-shG分别以1∶2和1∶4的摩尔比共转染,与pcDNA3.1共转染作为无shRNA的对照;
1.3转染后96h,提取第一、第二组细胞胞浆中核壳体DNA,并用α-32P标记的HBV特异的探针Southern blotting检测载体的复制情况。结果显示:在辅助质粒pCH-9/3142存在的情况下,1715U6-shG载体产生高水平的总HBV DNA,RC-DNA的比例也最高;与S区插入的载体相比,在C区携带单shRNA表达框的两个载体都产生大约两倍的总DNA,但RC-DNA比例较低;双重shRNA载体与C基因区的单shRNA载体相比,产生的复制产物数量中等,但产生RC-DNA的效率更高,如图2A所示,在不与辅助质粒共转染的情况下,所有shRNA载体均未产生任何可检测得到的复制中间体如图2B所示,证明HBV载体严格地依赖辅助质粒。
1.4转染后72小时用荧光显微镜观察第三组细胞的荧光强度并拍照,以每个培养孔为单位Glomax发光检测仪(Promega)定量荧光强度,将pcDNA3.1对照组荧光强度设为100%,标准化载体组各孔信号。各shG载体均显著抑制GFP荧光的表达,并随载体量的增加抑制效应增强(p<0.001),其中,pCH-203H1-shG-1715-U6-shG所产生的沉默效应最强(>80%),与pCH-203H1-shG相比有显著差异,阳性对照组pBSII-U6载体沉默效率更高(~90%),但与pCH-203H1-shG-1715-U6-shG组没有显著差异,如图3所示。
1.5大量制备重组HBV颗粒,感染HepG2-NTCP细胞系,利用X蛋白决定HBV基因表达的原理,本组实验分如下5组:①无病毒组;②细胞系来源的野生型HBV颗粒;③质粒转染Huh7细胞产生的HBV颗粒;④表达X蛋白的重组HBV载体颗粒;⑤不表达X蛋白的重组HBV载体颗粒。分别于第0、1、4、7和8天收集细胞培养上清液,ELISA定量检测HBeAg,可观察到在表达X蛋白的重组HBV载体颗粒组HBeAg的表达逐步升高,而不表达X蛋白的重组HBV载体颗粒组无变化,如图4所示。进一步通过流式细胞术观察核心蛋白阳性细胞,证实了在表达X蛋白的重组HBV载体颗粒组HBV核心蛋白阳性细胞达到9.97%,而在不表达X蛋白的重组HBV载体颗粒组仅为2.03%,如图5所示,证明重组HBV颗粒具有感染性。
实施例3 复制缺损型HBV载体双表达抗HBV shRNA抑制肝癌细胞系中HBV复制和表达
双表达抗HBV shRNA的HBV载体和pCH-9/3093共转染HepG2细胞,观察shRNA载体对野生型HBV复制和表达的影响,包括:用HBV全序列探针Southern blotting检测细胞质核壳体DNA,再用被置换的C或S基因片段序列或插入的H1或U6启动子序列特异的探针,分别重新进行Southern blotting,并对条带信号强度进行半定量分析;Western blotting检测细胞裂解液中HBsAg、HBcAg、甲胎蛋白、白蛋白及微管蛋白;并以跨shRNA表达框的引物PCR检测细胞外具有囊膜的病毒颗粒中HBV DNA,证明载体在野生型HBV存在时的复制能力。
1.HepG2细胞按前述方法培养;
2.转染细胞:双份细胞用恒定质量(0.4ug)的野生型HBV载体pCH-9/3093分别与抗HBV shRNA载体共转染,包括:pCH-203H1-sh6、pCH-1715U6-sh8和pCH-203H1-sh6-1715-U6-sh8,所用载体质量递增为0.2ug、0.4ug、0.8ug、1.6ug;空白对照组只转染0.4ug的pCH-9/3093,以不携带抗HBV成份的pCH-203H1-shG-1715U6-shG与pCH-9/3093共转染作为对照,通过添加空质粒pcDNA3.1来控制各组加入质粒的总质量相等。
3.Southern blotting检测野生型HBV和载体产的DNA
以完整HBV基因组序列为探针(可以同时检测野生型HBV和载体衍生的DNA)进行Southern blotting检测,显示抗HBV shRNA载体抑制了复制型DNA中间体的产生,并具有剂量依赖效应。以204-406序列探针,如图6的泳道1-4所示,对C基因中插入shRNA的载体,以1716-1960序列探针对其他载体,如图6的泳道5-17所示,即各个载体缺失区域的HBV序列为探针(仅能检测野生型HBV DNA)重新进行Southern blotting检测,与用HBV全序列探针时相比,DNA复制中间体减少更显著,具有剂量依赖效应。
4.Western blot检测HBV表面蛋白、核心蛋白、甲胎蛋白、白蛋白和微管蛋白的表达
用免疫印迹法可以检测抗HBV shRNA载体抑制野生型HBV蛋白表达,检测细胞裂解液中的HBV表面蛋白、核心蛋白以及甲胎蛋白、白蛋白和微管蛋白。抗HBV shRNA载体治疗组的HBsAg信号显著地降低,其中C基因区单shRNA载体,如图7A中的泳道2所示,和双重shRNA载体,如图7A中的泳道10所示,的抑制效应约为S基因区shRNA载体的2倍,如图7A中的泳道7所示,对照组抗hrGFP载体只在最高载体剂量时方可抑制HBsAg的表达,如图7A中的泳道17所示。所有三种抗HBV shRNA载体均导致HbcAb的水平降低,降低的程度与载体量正相关,各个载体组间差异不大,如图7A所示,但与对照组抗hrGFP载体相比有显著差别。用等量的细胞裂解物检测细胞的甲胎蛋白、白蛋白和微管蛋白,如图7B所示,然而与对照组相比未检测到任何差异,表明载体本身对细胞无明显的细胞毒性。
5.PCR检测细胞培养基中分泌型颗粒的DNA片段
载体病毒再感染其它细胞还需要在载体基因组包装后,再进一步添加囊膜并分泌到细胞外,因此,用提取的细胞外病毒颗粒的DNA作为模板进行PCR,使用的HBV引物跨过插入的shRNA表达框,由于与HBV序列相比其序列稍短,使得到的PCR产物较小,例如跨越C基因区的引物产生片段251bp,而原片段为284bp,跨越S基因区的引物产生片段556bp,而原片段为589bp,如图8A所示。为了确保只有完整病毒颗粒产生的DNA被扩增,细胞外病毒颗粒首先用链霉蛋白酶加DNase及微球菌核酸酶处理,这样可以有效消化掉游离质粒DNA和常见的从HBV感染细胞中泄露出的无包膜(裸)病毒颗粒,而有包膜的病毒颗粒不被消化。
与对照组如图8A中的泳道13比较,各抗HBV载体治疗组中载体特异的较短的PCR产物的比例有所升高,并与载体量正相关;而在抗hrGFP载体组比较不明显,因为抗HBV shRNA载体可以有效减少野生型pgRNA,在pgRNA衣壳化时,可以降低野生型和载体所产生pgRNA之间的竞争。PCR产物分别进行凝胶电泳溴化乙啶染色,照片,用Image J2x软件定量分析载体产生条带亮度占总亮度的比例,图8B显示了野生型HBV和载体DNA之间的相对比例。因此载体基因组的确成功地减少了野生型HBV。
实施例4 复制缺损型HBV载体双表达抗HBV shRNA抑制HBV转基因小鼠的HBV复制和表达
由于小鼠肝细胞对HBV不易感,我们把HBV载体基因组插入一种复制缺损型腺病毒载体,即Ad-HBV-H1sh6-U6sh8,这种嵌合载体可以有效的把HBV载体基因组递送到小鼠肝脏组织。
HBV转基因小鼠的基因组整合有1.3倍的HBV基因组,可以产生病毒抗原和完全病毒颗粒,而且病毒可以长期高水平复制。给HBV转基因小鼠注射Ad-HBV嵌合双表达shRNA的HBV载体,通过ELISA检血清HBsAg的水平、免疫组化检测肝组织HBcAg水平、Southern blotting检测血清中HBV DNA水平、Northern blotting检测血清病毒RNA水平评估抗载体的沉默效应,用载体特异的引物PCR检测血循环中被膜颗粒的DNA,检测载体在体内的自我更新。由于腺病毒载体存在诸如免疫原性较强、用量较大时有一定的毒性等不良影响,对于Ad-HBV嵌合载体潜在的毒性应该有所考虑。我们先给普通BALB/c小鼠经尾静脉注射较小剂量的嵌合载体颗粒,并观察小鼠的体重、ALT随时间变化曲线。
1.构建复制缺损型Ad-HBV嵌合载体Ad-HBV-H1sh6-U6sh8和Ad-HBV-H1shG-U6shG
复制缺损型腺病毒载体质粒pBHGLoxΔE1,3Cre分别与重组质粒pCH-203H1-sh6-1715U6-sh8、pCH-203H1shG-1715U6shG转染293细胞。待有较明显的病毒克隆斑或蚀斑形成后(转染10-12d),将293细胞自培养皿内刮下,收集培养物于50ml离心管中,800g/min离心10min,收集沉淀用1mlHBS悬浮,于-70℃/37℃水浴中反复冻融3次裂解细胞,10000g/min离心10分钟,收集上清即为收获的病毒液,分别命名为Ad-HBV-H1shG-U6shG和Ad-HBV-H1sh6-U6sh8,加入10%体积甘油,于-80℃冻存备用。经测序质粒序列正确后,进行重组嵌合病毒大量扩增,氯化铯不连续密度梯度离心纯化。纯化的腺病毒用核酸蛋白分析仪测定A260,然后根据公式病毒颗粒数=A260×稀释倍数×1.1×1012病毒颗粒数/ml(VP/mL)算出腺病毒的滴度。重组腺病毒感染293细胞检测空斑形成能力。
2.评估复制缺损型Ad-HBV嵌合载体的毒性
30只普通BALB/c小鼠,随机分为3组,每组10只;对照组经尾静脉注射0.5ml生理盐水,实验组经尾静脉注射2x1011/kg的AdHBV anti-HBV或anti-hrGFP shRNA载体颗粒(粒子浓度约为HEK293细胞空斑形成单位(PFU)浓度的十分之一,对于20g重小鼠约~0.4x109PFU),溶于0.5ml生理盐水。接种后监测小鼠体重、并每周检测小鼠血清丙氨酸氨基转移酶,至第8周末处死。
Ad载体接种后,小鼠仅在第1周体重增长变缓,如图9所示,随后小鼠的生长恢复正常;在第1周血清丙氨酸氨基转移酶(ALT)升高,但低于3倍正常值上限,第2周ALT基本恢复正常,如图10所示,表明Ad-HBV嵌合载体本身没有明确的毒性,在后续的实验中可以使用相同的剂量。
3.转基因小鼠分组及处理
3.1 30只HBVtg BALB/c小鼠被随机分配到三个组,每组10只;组1注射0.5ml的生理盐水,组2注射AdHBV-H1shG-U6shG,组3注射AdHBV-H1sh6-U6sh8,每只小鼠4x109病毒颗粒。
3.2标本留取
分别在治疗后第0、4、8、12、16、20天经尾尖活体取血备用;
分别在接种后第0、2、4、6、8、10、12、14、16、18、20测量小鼠体重;
接种后第4天,从三个组中分别取出3只小鼠处死,接种后第12天再处死3只,接种后第20天处死剩余的4只小鼠;分别经腹主动脉取血,分离血清;取部分肝组织,0.5×0.5×0.5cm,10%福尔马林固定,剩余肝组织液氮保存备用;
4.ELISA试剂盒(Abbott)检测小鼠血清中的HBsAg。
HBsAg滴度在生理盐水对照组稳定在7-8x103IU/ml,抗HBV载体治疗组小鼠HBsAg滴度显著降低,如图11所示,在接种后第20天,与生理盐水相比降低3-4倍(p=0.018)。治疗组与抗hrGFP组相比,HBsAg滴度差异在第12天最明显,第16天和第20天的P值分别为p=0.058和p=0.094。两个对照组之间的HBsAg滴度在各个时间点均无明显差异,说明在第3组,腺病毒穿梭载体本身导致的非特异效应对HBsAg滴度的影响有限。
5.免疫组织化学检测肝内HBV核心蛋白的表达。
接种后第20天所取各组小鼠肝脏,用4%甲醛溶液固定,室温过夜后石蜡包埋常规切片,采用核心蛋白特异的单克隆抗体mc312进行染色,显微镜下观察。与两个对照组相比,治疗组肝脏切片中肝细胞核核心蛋白染色变弱或消失,表明肝组织中HBV核心蛋白的表达受到明显地抑制,如图12所示。
6.Northern blotting检测第20天各组小鼠肝内HBV RNA
接种后第20天所取各组小鼠肝脏,分别提取总RNA,以全长HBV探针检测HBV特异转录产物,以3-磷酸甘油醛脱氢(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的mRNA作为对照,如图13A所示,第1和第2对照组中的小鼠显示pgRNA和shRNA水平只有微小的差异,而治疗组小鼠的病毒RNA平均减少~70%,如图13B所示。
7.qPCR分析小鼠的HBV DNA水平
定量分析各组HBV的病毒滴度评估病毒的复制情况,采用qPCR方法检测每毫升血清中HBV DNA。各组取等量血清,用链霉蛋白酶加Dnase处理,然后用qPCR检测,每个组的所有小鼠的HBV DNA水平用vge/ml表示,获得均数±SD;
在生理盐水对照组,病毒滴度与治疗前无差别,仍为~105vge/ml水平;在抗hrGFP载体对照组,病毒滴度有微弱的降低;在抗HBV载体组,病毒滴度稳定持续下降,在接种后第20天降低18-20倍,如图14所示。表明抗HBV载体对血循环中HBV DNA的影响非常显著。
8.PCR检测小鼠血清中的被膜载体颗粒的DNA
如果复制缺损的HBV shRNA载体再野生型HBV帮助下具有复制能力,血清中的完整HBV病毒颗粒中应该包括一部分载体衍生的病毒颗粒,因此通过跨连接区引物扩增,PCR方法可检测到血清中与野生型HBV DNA大小不同的HBV载体衍生DNA的片段,从而分析载体特异的产物的水平。自三个组中各取3只小鼠,将它们的血清(接种后第20天采集)用链蛋白酶加Dnase处理,然后作为DNA模板,所有来自载体治疗组动物的样品,均检测到载体特异的PCR产物,并且抗HBV组与抗hrGFP组相比血清中载体衍生的DNA比例更高,如图15所示,表明HBV shRNA载体基因组在野生型HBV辅助下成功的产生子代分泌病毒颗粒。
以上的实验结果证实,HBVtg小鼠接种嵌合双重抗HBV shRNA载体后,有效抑制HBV复制和表达:与对照组相比,血循环中的HBV DNA降低了~20倍,血清HBsAg减少3-4倍,核心蛋白阳性的肝细胞比例下降,肝内病毒RNA显著减少;并且,HBV shRNA载体基因组成功的产生子代分泌病毒颗粒,其抗HBV的活性与第一代Ad-HBV载体相当。
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述技术内容作为启示加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作出的简单修改,等同变化与改型,仍属于本发明权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!