抗糖-MUC1抗体及其用途的制作方法
1.相关申请的交叉引用
本申请要求2018年6月29日提交的美国临时申请第62/691,887号和2019年2月8日提交的美国临时申请第62/802,865号的优先权,其各自的内容通过引用整体并入本文。
2.序列表
本申请包含序列表,该序列表已经以ascii格式以电子方式提交,并且通过引用整体并入本文。所述ascii副本于2019年6月26日创建,名为got-002wo_sl,并且大小为33,365字节。
3.
背景技术:
人粘蛋白muc1是多态性跨膜糖蛋白,表达于单层上皮和腺上皮的顶表面(taylor-papadimitriouetal.,1999,biochim.biophys.acta,1455:301–313)。muc1在腺癌中高度过表达且异常地o-糖基化。粘蛋白的细胞外结构域包含20个氨基酸残基的可变数目的串联重复(tr)(25-125),该串联重复具有五个潜在的o-糖基化位点。o-聚糖在癌细胞中的加工不完全,从而导致泛癌碳水化合物抗原tn(galnacα1-o-ser/thr)的表达(springer,1984,science224:1198–1206)。简单的粘蛋白型o-聚糖tn在腺癌(包括乳腺癌和卵巢癌)中广泛表达,并在正常成人组织中显示出有限的分布(springer,1984,science224:1198–1206)。这些o-聚糖在癌症中的表达与不良预后相关,并且癌症患者中针对这些碳水化合物半抗原的天然抗体增加(miles,etal.,1995,br.j.cancer.71:1074–1076;soaresetal.,1996,pathol.res.pract.192:1181–1186;wertheretal.,1996,int.j.cancer.69:193–199)。本领域需要利用在癌细胞中过表达的糖-muc1表位的治疗方式。
4.发明概述
本公开通过提供基于对糖-muc1的癌症特异性表位具有选择性的抗体和抗原结合片段的治疗剂和诊断剂来捕获糖肽变体的肿瘤特异性。
本公开提供了结合muc1的癌症特异性糖基化变体的抗糖-muc1抗体及其抗原结合片段。本公开还提供了包含抗糖-muc1抗体和抗原结合片段的融合蛋白和抗体药物缀合物,以及编码抗糖-muc1抗体、抗原结合片段和融合蛋白的核酸。
本公开还提供了使用抗糖-muc1抗体、抗原结合片段、融合蛋白、抗体药物缀合物和核酸用于癌症疗法的方法。
在某些方面,本公开提供了结合muc1的癌症特异性糖基化变体和第二表位的双特异性和其他多特异性抗糖-muc1抗体和抗原结合片段。第二表位可以在muc1本身上,在与muc1共同表达于癌细胞上的另一种蛋白质上,或在呈现于不同细胞例如活化的t细胞上的另一种蛋白质上。此外,还公开了编码此类抗体的核酸,包括包含密码子优化的编码区的核酸和包含未被密码子优化用于在特定宿主细胞中表达的编码区的核酸。
抗糖-muc1抗体和结合片段可以是含有融合配偶体的融合蛋白的形式。融合配偶体可用于提供第二功能,例如t细胞信号传导蛋白的信号传导结构域的信号传导功能、t细胞活化的肽调节剂或标记系统的酶促组分。示例性的t细胞信号传导蛋白包括4-1bb、co3c和融合肽,例如cd28-cd3-ζ和4-1bb-cd3-ζ。4-1bb或cd137是t细胞的共刺激受体;cd3-ζ是t细胞抗原受体的信号转导组分。提供第二功能的部分可以是t细胞活化的调节剂,例如il-15、il-15ra或il-15/il-15ra融合体,或者其可以编码标记或用于监测体内或体外结合的程度和/或位置的标记系统的酶促组分。在本公开的一些实施方案中,编码位于t细胞如自体t细胞的背景中的这些具有预防和治疗活性的生物分子的构建体提供了用于募集过继转移的t细胞以预防或治疗多种癌症的强有力平台。
在某些方面,本公开的抗糖-muc1抗体和抗原结合片段包含表1a和表1b中所示的重链可变序列和/或轻链可变序列(或由核苷酸序列编码)。为了清楚起见,当在本文中使用术语“抗糖-muc1抗体”时,除非上下文另有说明,其旨在包括单特异性和多特异性(包括双特异性)抗糖-muc1抗体、单特异性和多特异性抗体的抗原结合片段以及含有抗体及其抗原结合片段的融合蛋白和缀合物。同样,当使用术语“抗糖-muc1抗体或抗原结合片段”时,除非上下文另有说明,其也旨在包括单特异性和多特异性(包括双特异性)抗糖-muc1抗体及其抗原结合片段,以及含有此类抗体和抗原结合片段的融合蛋白和缀合物。
在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含表1-3中列出的重链和/或轻链cdr序列(或由核苷酸序列编码)。表1a和表1b中列出的cdr序列包括根据用于限定cdr界限的imgt(lefrancetal.,2003,devcomparatimmunol27:55-77)、kabat(kabatetal.,1991,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md.)和chothia(al-lazikanietal.,1997,j.mol.biol273:927-948)方案所定义的cdr序列。表1c、表1d和表1e中列出的cdr序列是分别根据imgt、kabat和chothia定义衍生自表1a和表1b中列出的cdr序列的共有序列。表2a和表2b中列出的cdr序列分别是表1a和表1b中列出的cdr序列的重叠的组合区域,其中imgt、kabat和chothia序列以带下划线的粗体文本显示。表2c中列出的cdr序列是表1c、表1d和表1e中列出的共有cdr序列的重叠的组合区域。表3a和表3b中列出的cdr序列分别是表1a和表1b中所示的cdr序列的重叠的共同区域。表3c中列出的cdr序列是表1c、表1d和表1e中列出的cdr序列的重叠的共同区域。此类抗糖-muc1抗体和抗原结合片段的框架序列可以是表1a或表1b中列出的vh和vl序列的天然鼠框架序列,或者可以是非天然的(例如人源化的或人的)框架序列。
在某些方面,本公开的抗糖-muc1抗体或抗原结合片段包含cdr,其包含在编号的实施方案3至41中列出的任何cdr组合的氨基酸序列。因此,在某些实施方案中,本公开的抗糖-muc1抗体或抗原结合片段包含含有seqidno:93的氨基酸序列的cdr-h1、含有seqidno:94的氨基酸序列的cdr-h2、含有seqidno:95的氨基酸序列的cdr-h3、含有seqidno:96的氨基酸序列的cdr-l1、含有seqidno:97的氨基酸序列的cdr-l2和含有seqidno:98的氨基酸序列的cdr-l3。在一些实施方案中,cdr-h1包含seqidno:3、9、15、25、31、37、45、51、57、63、69、75、81、87或93的氨基酸序列。在一些实施方案中,cdr-h2包含seqidno:4、10、16、26、32、38、46、52、58、64、70、76、82、88或94的氨基酸序列。在一些实施方案中,cdr-h3包含seqidno:5、11、17、27、33、39、47、53、59、65、71、77、83、89或95的氨基酸序列。在一些实施方案中,cdr-l1包含seqidno:6、12、18、28、34、40、48、54、60、66、72、78、84、90或96的氨基酸序列。在一些实施方案中,cdr-l2包含seqidno:7、13、19、29、35、41、49、55、61、67、73、79、85、91或97的氨基酸序列。在一些实施方案中,cdr-l3包含seqidno:8、14、20、30、36、42、50、56、62、68、74、80、86或92的氨基酸序列。
在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:3-5的重链cdr和seqidnos:6-8的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:9-11的重链cdr和seqidnos:12-14的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:15-17的重链cdr和seqidnos:18-20的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:25-27的重链cdr和seqidnos:28-30的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:31-33的重链cdr和seqidnos:34-36的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:37-39的重链cdr和seqidnos:40-42的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:45-47的重链cdr和seqidnos:48-50的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:51-53的重链cdr和seqidnos:54-56的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:57-59的重链cdr和seqidnos:60-62的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:63-65的重链cdr和seqidnos:66-68的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:69-71的重链cdr和seqidnos:72-74的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:75-77的重链cdr和seqidnos:78-80的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:81-83的重链cdr和seqidnos:84-86的轻链cdr。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含seqidno:87-89的重链cdr和seqidnos:90-92的轻链cdr。
本公开的抗体和抗原结合片段可以是鼠的、嵌合的、人源化的或人的。
在其他方面,本公开的抗糖-muc1抗体或抗原结合片段与包含分别为seqidno:1和2的重链和轻链可变区的抗体或抗原结合片段竞争。在其他方面,本公开提供了具有重链和轻链可变区的抗muc1抗体或抗原结合片段,该重链和轻链可变区分别与seqidno:1和2具有至少95%、98%、99%或99.5%的序列同一性。
在其他方面,本公开的抗糖-muc1抗体或抗原结合片段与包含分别为seqidno:23和24的重链和轻链可变区的抗体或抗原结合片段竞争。在其他方面,本公开提供了具有重链和轻链可变区的抗muc1抗体或抗原结合片段,该重链和轻链可变区分别与seqidno:23和24具有至少95%、98%、99%或99.5%的序列同一性。
在其他方面,本公开的抗糖-muc1抗体或抗原结合片段是单链可变片段(scfv)。示例性的scfv包含位于轻链可变片段n末端的重链可变片段。在一些实施方案中,scfv重链可变片段和轻链可变片段共价结合至4-15个氨基酸的接头序列。scfv可以是双特异性t细胞衔接子的形式,也可以在嵌合抗原受体(car)内。
抗糖-muc1抗体和抗原结合片段可以是单链可变片段的多聚体、双特异性单链可变片段和双特异性单链可变片段的多聚体的形式。在一些实施方案中,单链可变片段的多聚体选自二价单链可变片段、三体(tribody)或四体(tetrabody)。在这些实施方案的一些中,双特异性单链可变片段的多聚体是双特异性t细胞衔接子。
本公开的其他方面涉及编码本公开的抗糖-muc1抗体和抗原结合片段的核酸。在一些实施方案中,对编码抗糖-muc1抗体或抗原结合片段的核酸的部分进行密码子优化以在人细胞中表达。在某些方面,本公开提供了具有重链和轻链可变区的抗糖-muc1抗体或抗原结合片段,所述重链和轻链可变区由与seqidno:21或seqidno:43具有至少95%、98%、99%或99.5%序列同一性的重链核苷酸序列和与seqidno:22或seqidno:44具有至少95%、98%、99%或99.5%序列同一性的轻链核苷酸序列编码。包含核酸的载体(例如病毒载体,如慢病毒载体)和宿主细胞也在本公开的范围内。重链和轻链编码序列可以存在于单个载体或分开的载体。
本公开的另一方面是药物组合物,其包含根据本公开的抗糖-muc1抗体、抗原结合片段、核酸(或核酸对)、载体(或载体对)或宿主细胞和生理上合适的缓冲液、佐剂或稀释剂。
本公开的另一方面是制备嵌合抗原受体的方法,其包括在适合于编码区表达的条件下孵育包含根据本公开的核酸或载体的细胞,并收集嵌合抗原受体。
本公开的另一方面是检测癌症的方法,其包括使细胞或组织样品与本公开的抗糖-muc1抗体或抗原结合片段接触,并检测抗体是否与细胞或组织样品结合。
本公开的另一方面是根据本公开的抗糖-muc1抗体或抗原结合片段,其用于检测癌症。
本公开的另一方面是治疗癌症的方法,其包括向有此需要的受试者施用预防或治疗有效量的根据本公开的抗糖-muc1抗体、抗原结合片段、核酸、载体、宿主细胞或药物组合物。
本公开的另一方面是根据本公开的抗糖-muc1抗体、抗原结合片段、核酸、载体、宿主细胞或药物组合物,其用于治疗癌症。
本公开的另一方面是根据本公开的抗糖-muc1抗体、抗原结合片段、核酸、载体、宿主细胞或药物组合物在制备用于治疗癌症的药物中的用途。
5.附图简要说明
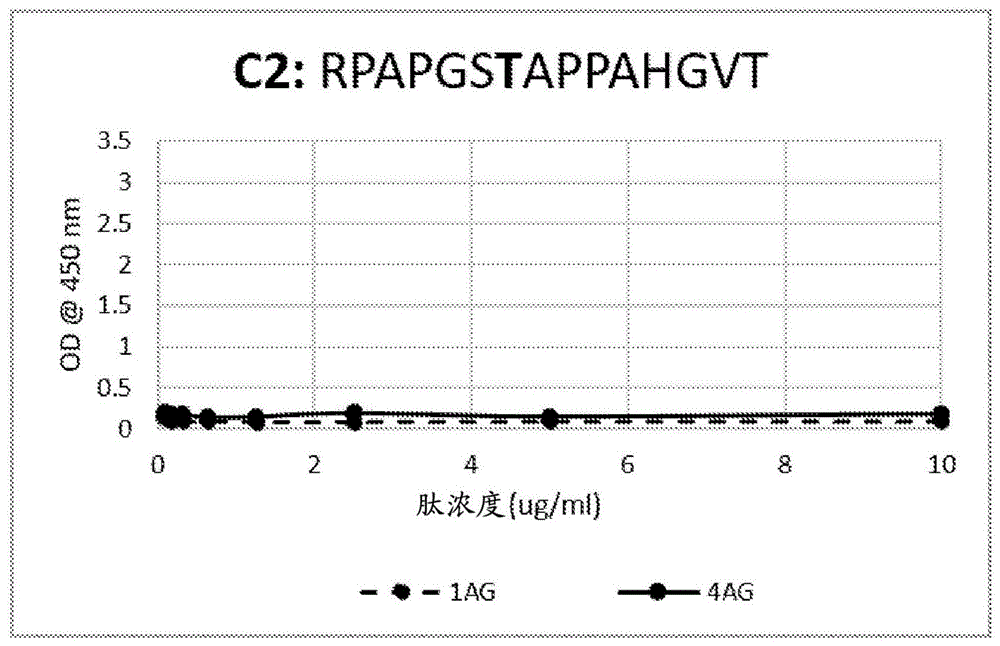
图1a-ef:elisa测定的结果,其显示了1ag和4ag与糖基化和非糖基化muc1肽结合的特异性。图1a:肽c2;图1b:肽c3;图1c:肽c4;图1d:肽70;图1e:gst;图1f:bsa封闭的孔(对照)。
图2:elisa测定的结果,其显示了1ag(图2a)和4ag(图2b)与不同的糖基化和非糖基化muc1肽结合的特异性。
图3:用1ag和4ag进行的针对抗原gsta的抗体滴定测定的结果。
图4:用肿瘤微阵列bcn721a进行抗体1ag免疫组织化学筛选的结果。
图5:用肿瘤微阵列bcn721a进行抗体4ag免疫组织化学筛选的结果。
图6:用肿瘤微阵列ov241c进行抗体1ag免疫组织化学筛选的结果。
图7:用肿瘤微阵列ov241c进行抗体4ag免疫组织化学筛选的结果。
图8:用肿瘤微阵列bc000119进行抗体1ag免疫组织化学筛选的结果。
图9:用肿瘤微阵列bc000119进行抗体4ag免疫组织化学筛选的结果。
图10:用抗体5e5进行丙氨酸扫描的结果。
图11:用抗体1ag进行丙氨酸扫描的结果。
图12:用抗体4ag进行丙氨酸扫描的结果。
6.发明详述
6.1抗体
本公开提供了针对存在于肿瘤细胞上的muc1的糖型的新型抗体。这些抗体以抗体1ag和4ag为例。在抗体的筛选中鉴定了1ag和4ag,所述抗体结合muc1中存在的糖基化15-mer,即
以抗体1ag和4ag为例的本公开的抗糖-muc1抗体可用作癌症诊断和疗法中的工具。
因此,在某些方面,本公开提供了与存在于肿瘤细胞上的muc1的糖型(在本文中称为“糖-muc1”)结合,并优选与15-mer肽
本公开的抗糖-muc1抗体可以是多克隆的、单克隆的、基因工程化的和/或在性质上以其他方式修饰的,包括但不限于嵌合抗体、人源化抗体、人抗体、灵长类抗体、单链抗体、双特异性抗体、双可变结构域抗体等。在各种实施方案中,抗体包含抗体恒定区的全部或部分。在一些实施方案中,恒定区是选自以下的同种型:iga(例如iga1或iga2)、igd、ige、igg(例如igg1、igg2、igg3或igg4)和igm。在具体的实施方案中,本公开的抗糖-muc1抗体包含igg1恒定区同种型。
如本文所用的术语“单克隆抗体”不限于通过杂交瘤技术产生的抗体。单克隆抗体通过本领域可用或已知的任何方式衍生自单个克隆,包括任何真核克隆、原核克隆或噬菌体克隆。可以使用本领域已知的多种技术,包括使用杂交瘤技术、重组技术和噬菌体展示技术或其组合来制备可用于本公开的单克隆抗体。在本公开的多种用途中,包括在人类中体内使用抗糖-muc1抗体,可以适当地使用嵌合抗体、灵长类化抗体、人源化抗体或人抗体。
如本文所用的术语“嵌合”抗体是指具有衍生自非人免疫球蛋白例如大鼠或小鼠抗体的可变序列和通常选自人免疫球蛋白模板的人免疫球蛋白恒定区的抗体。产生嵌合抗体的方法是本领域已知的。参见例如,morrison,1985,science229(4719):1202-7;oietal.,1986,biotechniques4:214-221;gilliesetal.,1985,j.immunol.methods125:191-202;美国专利号5,807,715;4,816,567;和4,816397,其通过引用整体并入本文。
“人源化”形式的非人(例如鼠)抗体是嵌合的免疫球蛋白,其包含衍生自非人免疫球蛋白的最小序列。通常,人源化抗体将包含至少一个、且通常两个基本上整个可变结构域,其中全部或基本上全部的cdr区对应于非人免疫球蛋白的那些,并且全部或基本上全部的fr区是人免疫球蛋白序列的那些。人源化抗体还可包含免疫球蛋白恒定区(fc)的至少一部分,通常是人免疫球蛋白共有序列的一部分。抗体人源化的方法是本领域已知的。参见例如,riechmannetal.,1988,nature332:323-7;queen等人的美国专利号5,530,101;5,585,089;5,693,761;5,693,762;和6,180,370;ep239400;pct公开文本wo91/09967;美国专利号5,225,539;ep592106;ep519596;padlan,1991,mol.immunol.,28:489-498;studnickaetal.,1994,prot.eng.7:805-814;roguskaetal.,1994,proc.natl.acad.sci.91:969-973;和美国专利号5,565,332,其全部通过引用整体并入本文。
“人抗体”包括具有人免疫球蛋白氨基酸序列的抗体,并且包括从人免疫球蛋白文库分离或从针对一种或多种人免疫球蛋白转基因且不表达内源性免疫球蛋白的动物分离的抗体。可以通过本领域已知的多种方法,包括使用衍生自人免疫球蛋白序列的抗体文库的噬菌体展示方法来制备人抗体。参见美国专利号4,444,887和4,716,111;以及pct公开文本wo98/46645;wo98/50433;wo98/24893;wo98/16654;wo96/34096;wo96/33735;和wo91/10741,其各自通过引用整体并入本文。也可以使用不能表达功能性内源性免疫球蛋白但可以表达人免疫球蛋白基因的转基因小鼠来产生人抗体。参见例如,pct公开文本wo98/24893;wo92/01047;wo96/34096;wo96/33735;美国专利号5,413,923;5,625,126;5,633,425;5,569,825;5,661,016;5,545,806;5,814,318;5,885,793;5,916,771;和5,939,598,其通过引用整体并入本文。可以使用称为“指导选择”的技术来生成识别选定表位的完全人抗体。在这种方法中,使用选定的非人单克隆抗体,例如小鼠抗体来指导识别相同表位的完全人抗体的选择(参见,jespersetal.,1988,biotechnology12:899-903)。
“灵长类化抗体”包含猴可变区和人恒定区。产生灵长类化抗体的方法是本领域已知的。参见例如,美国专利号5,658,570;5,681,722;和5,693,780,其通过引用整体并入本文。
本公开的抗糖-muc1抗体包括全长(完整)抗体分子,以及能够结合糖-muc1的抗原结合片段两者。抗原结合片段的实例包括但不限于fab、fab'、f(ab')2、fv片段、单链fv片段和单结构域片段。
fab片段包含轻链的恒定结构域(cl)和重链的第一恒定结构域(ch1)。fab'片段与fab片段的区别在于在重链ch1结构域的羧基末端添加了几个残基,包括来自抗体铰链区的一个或多个半胱氨酸。f(ab')片段通过切割在f(ab')2胃蛋白酶消化产物的铰链半胱氨酸处的二硫键而产生。抗体片段的其他化学偶联是本领域普通技术人员已知的。fab和f(ab')1片段缺少完整抗体的fc片段,从动物循环中清除得更快,并且可比完整抗体具有更少的非特异性组织结合(参见例如,wahletal.,1983,j.nucl.med.24:316)。
“fv”片段是包含完整靶标识别和结合位点的抗体的最小片段。该区域由紧密非共价缔合的一个重链可变结构域和一个轻链可变结构域的二聚体(vh-vl二聚体)组成。在该构型下,每个可变结构域的三个cdr相互作用以在vh-vl二聚体的表面上限定靶标结合位点。通常,六个cdr赋予靶标与抗体的结合特异性。然而,在一些情况下,即使单个可变结构域(或仅包含三个对靶标特异性的cdr的fv的一半)也具有识别和结合靶标的能力,尽管其亲和力比整个结合位点低。
“单链fv”或“scfv”抗原结合片段包含抗体的vh和vl结构域,其中这些结构域存在于单个多肽链中。通常,fv多肽还包含位于vh和vl结构域之间的多肽接头,其使得scfv能够形成靶标结合所期望的结构。
“单结构域抗体”由对糖-muc1呈现出足够亲和力的单个vh或vl结构域组成。在具体的实施方案中,单结构域抗体是骆驼化抗体(参见例如,riechmann,1999,journalofimmunologicalmethods231:25-38)。
本公开的抗糖-muc1抗体也可以是双特异性抗体和其他多种特异性抗体。双特异性抗体是对相同或不同抗原上的两个不同表位具有结合特异性的单克隆抗体,通常是人抗体或人源化抗体。在本公开中,一种结合特异性可以针对糖-muc1,另一种可以针对任何其他抗原,例如针对细胞表面蛋白、受体、受体亚基、组织特异性抗原、病毒衍生蛋白、病毒编码的包膜蛋白、细菌衍生蛋白或细菌表面蛋白等。在某些优选的实施方案中,双特异性和其他多特异性抗糖-muc1抗体和抗原结合片段特异性结合第二muc1表位,在癌细胞上与muc1共表达的另一种蛋白上的表位或在不同细胞例如活化的t细胞上呈现的另一种蛋白上的表位。本公开的双特异性抗体包括igg形式的双特异性抗体和基于单链的双特异性抗体。
本公开的igg形式的双特异性抗体可以是本领域已知的各种类型的igg形式双特异性抗体中的任一种,例如四源杂交瘤双特异性抗体、“突出-入-孔(knobs-in-holes)”双特异性抗体、crossmab双特异性抗体、电荷配对双特异性抗体、共同轻链双特异性抗体、单臂单链fab-免疫球蛋白γ双特异性抗体、二硫化物稳定化的fv双特异性抗体、duetmab、受控fab臂交换双特异性抗体、链交换工程化结构域体双特异性抗体、两臂亮氨酸拉链异二聚体单克隆双特异性抗体、κλ体双特异性抗体、双可变结构域双特异性抗体和交叉双可变结构域双特异性抗体。参见例如,
在一些实施方案中,本公开的双特异性抗体是crossmab。crossmab技术详细描述于wo2009/080251、wo2009/080252、wo2009/080253、wo2009/080254、wo2013/026833、wo2016/020309和schaeferetal.,2011,procnatlacadsciusa108:11187-92,其通过引用整体并入本文。简而言之,crossmab技术基于双特异性igg的一条fab臂内的重链和轻链之间的结构域交叉,从而促进正确的链缔合。本公开的crossmab双特异性抗体可以是“crossmabfab”抗体,其中双特异性igg抗体的一条臂的fab部分的重链和轻链被交换。在其他实施方案中,本公开的crossmab双特异性抗体可以是“crossmabvh-vl”抗体,其中仅双特异性igg抗体的一条臂的fab部分的重链和轻链的可变结构域被交换。在其他实施方案中,本公开的crossmab双特异性抗体可以是“crossmabch1-cl”抗体,其中仅双特异性igg抗体的一条臂的fab部分的重链和轻链的恒定结构域被交换。与crossmabfab和crossmabvh-vl相比,crossmabch1-cl抗体没有预测的副产物,因此,在某些实施方案中,crossmabch1-cl双特异性抗体是优选的。参见,kleinetal.,2016,mabs,8(6):1010-1020。
在一些实施方案中,本公开的双特异性抗体是受控fab臂交换双特异性抗体。制备fab臂交换双特异性抗体的方法描述于pct公开号wo2011/131746和labrijnetal.,2014natprotoc.9(10):2450-63,其通过引用整体并入本文。简而言之,可通过分别表达两个在ch3结构域中包含单个匹配点突变的亲本igg1,在体外氧化还原条件下混合亲本igg1以使半分子重组,并去除还原剂以允许链间二硫键再氧化,从而形成双特异性抗体来制备受控fab臂交换双特异性抗体。
本公开的双特异性抗体可以包含由第一亚基和第二亚基组成的fc结构域。在一个实施方案中,fc结构域是iggfc结构域。在具体的实施方案中,fc结构域是igg1fc结构域。在另一个实施方案中,fc结构域是igg4fc结构域。在更具体的实施方案中,fc结构域是igg4fc结构域,其在位置s228(kabateu索引编号)处包含氨基酸取代,特别是氨基酸取代s228p。除非本文另有说明,否则fc结构域或恒定区中氨基酸残基的编号根据eu编号系统,也称为eu索引,如kabatetal.,1991,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md中所述。该氨基酸取代减少了igg4抗体的体内fab臂交换(参见stubenrauchetal.,2010,drugmetabolismanddisposition38:84-91)。在更具体的实施方案中,fc结构域是人fc结构域。在甚至更具体的实施方案中,fc结构域是人igg1fc结构域。人igg1fc区的示例性序列在seqidno:42中给出。
在具体的实施方案中,fc结构域包含促进fc结构域的第一和第二亚基缔合的修饰。人iggfc结构域的两个亚基之间最广泛的蛋白质-蛋白质相互作用的位点在ch3结构域中。因此,在一个实施方案中,所述修饰在fc结构域的ch3结构域中。
在具体的实施方案中,所述促进fc结构域的第一和第二亚基缔合的修饰是所谓的“突出-入-孔”修饰,其包括在fc结构域的两个亚基的一个中的“突出”修饰和fc结构域的两个亚基的另一个中的“孔”修饰。突出-入-孔技术描述于例如us5,731,168;us7,695,936;ridgwayetal.,1996,proteng9:617-621,和carter,j,2001,immunolmeth248:7-15。通常,该方法涉及在第一多肽的界面处引入突起(“突出”),并在第二多肽的界面中引入相应的腔(“孔”),使得突起可置于腔中以促进异二聚体形成并阻碍同二聚体形成。通过将来自第一多肽的界面的小氨基酸侧链替换为较大的侧链(例如酪氨酸或色氨酸)来构建突起。通过将大的氨基酸侧链替换为较小的氨基酸侧链(例如丙氨酸或苏氨酸),在第二多肽的界面中产生与突起相同或相似大小的补偿腔。
因此,在一些实施方案中,将fc结构域的第一亚基的ch3结构域中的氨基酸残基替换为具有较大侧链体积的氨基酸残基,从而在第一亚基的ch3结构域内产生突起,该突起可定位在第二亚基的ch3结构域内的腔中,并且将fc结构域的第二亚基的ch3结构域中的氨基酸残基替换为具有较小侧链体积的氨基酸残基,从而在第二亚基的ch3结构域内产生腔,第一亚基的ch3结构域内的突起可定位到该腔内。优选地,所述具有较大侧链体积的氨基酸残基选自下组:精氨酸(r)、苯丙氨酸(f)、酪氨酸(y)和色氨酸(w)。优选地,所述具有较小侧链体积的氨基酸残基选自下组:丙氨酸(a)、丝氨酸(s)、苏氨酸(t)和缬氨酸(v)。突起和腔可以通过改变编码多肽的核酸来制备,例如通过位点特异性诱变或通过肽合成来制备。
在具体的此类实施方案中,在fc结构域的第一亚基中,将366位的苏氨酸残基替换为色氨酸残基(t366w),并且在fc结构域的第二亚基中,将407位的酪氨酸残基替换为缬氨酸残基(y407v),并且任选地,将366位的苏氨酸残基替换为丝氨酸残基(t366s),并且将368位的亮氨酸残基替换为丙氨酸残基(l368a)(根据kabateu索引编号)。在其他实施方案中,在fc结构域的第一亚基中,另外将354位的丝氨酸残基替换为半胱氨酸残基(s354c)或将356位的谷氨酸残基替换为半胱氨酸残基(e356c)(特别地将354位的丝氨酸残基替换为半胱氨酸残基),并且在fc结构域的第二亚基中,另外将349位的酪氨酸残基替换为半胱氨酸残基(y349c)(根据kabateu索引编号)。在具体的实施方案中,fc结构域的第一亚基包含氨基酸取代s354c和t366w,并且fc结构域的第二亚基包含氨基酸取代y349c、t366s、l368a和y407v(根据kabateu索引编号)。
在一些实施方案中,静电操纵(例如,如在gunasekaranetal.,2010,jbiolchem285(25):19637-46中所述)可用于促进fc结构域的第一和第二亚基的缔合。
在一些实施方案中,fc结构域包含减少与fc受体的结合和/或效应子功能的一个或多个氨基酸取代。
在具体的实施方案中,fc受体是fcγ受体。在一个实施方案中,fc受体是人fc受体。在一个实施方案中,fc受体是活化的fc受体。在具体的实施方案中,fc受体是活化的人fcγ受体,更具体地是人fcγriiia、fcγri或fcγriia,最具体地是人fcγriiia。在一个实施方案中,效应子功能是选自下组的一种或多种:补体依赖性细胞毒性(cdc)、抗体依赖性细胞介导的细胞毒性(adcc)、抗体依赖性细胞吞噬作用(adcp)和细胞因子分泌。在具体的实施方案中,效应子功能是adcc。
通常,在fc结构域的两个亚基的每一个中存在相同的一个或多个氨基酸取代。在一个实施方案中,一个或多个氨基酸取代降低了fc结构域与fc受体的结合亲和力。在一个实施方案中,一个或多个氨基酸取代使fc结构域与fc受体的结合亲和力降低至少2倍、至少5倍或至少10倍。
在一个实施方案中,fc结构域在选自e233、l234、l235、n297、p331和p329(根据kabateu索引编号)的位置处包含氨基酸取代。在更具体的实施方案中,fc结构域在选自l234、l235和p329(根据kabateu索引编号)的位置处包含氨基酸取代。在一些实施方案中,fc结构域包含氨基酸取代l234a和l235a(根据kabateu索引编号)。在一个此类实施方案中,fc结构域是igg1fc结构域,特别是人igg1fc结构域。在一个实施方案中,fc结构域在位置p329处包含氨基酸取代。在更具体的实施方案中,氨基酸取代是p329a或p329g,特别是p329g(根据kabateu索引编号)。在一个实施方案中,fc结构域包含位置p329处的氨基酸取代,以及选自e233、l234、l235、n297和p331(根据kabateu索引编号)的位置处的其他氨基酸取代。在更具体的实施方案中,其他氨基酸取代是e233p、l234a、l235a、l235e、n297a、n297d或p331s。在具体的实施方案中,fc结构域在位置p329、l234和l235(根据kabateu索引编号)处包含氨基酸取代。在更具体的实施方案中,fc结构域包含氨基酸突变l234a、l235a和p329g(“p329glala”、“pglala”或“lalapg”)。具体地,在具体的实施方案中,fc结构域的每个亚基包含氨基酸取代l234a、l235a和p329g(kabateu索引编号),即在fc结构域的第一和第二亚基的每个中,将234位的亮氨酸残基替换为丙氨酸残基(l234a),将235位的亮氨酸残基替换为丙氨酸残基(l235a),将329位的脯氨酸残基替换为甘氨酸残基(p329g)(根据kabateu索引编号)。在一个此类实施方案中,fc结构域是igg1fc结构域,特别是人igg1fc结构域。
本公开的基于单链的双特异性抗体可以是本领域已知的各种类型的基于单链的双特异性抗体中的任一种,例如双特异性t细胞衔接子(bite)、双抗体、串联双抗体(tandab)、双重亲和力重靶向分子(dart)和双特异性杀伤细胞衔接子。参见例如,
在一些实施方案中,本公开的双特异性抗体是双特异性t细胞衔接子(bite)。bite是具有两个抗原结合结构域的单多肽链分子,其中一个与t细胞抗原结合,且其中第二个与靶表面上存在的抗原结合(参见pct公开wo05/061547;baeuerleetal.,2008,drugsofthefuture33:137-147;bargou,etal.,2008,science321:974-977,其通过引用整体并入本文)。因此,本公开的bite具有与t细胞抗原结合的抗原结合结构域和针对糖-muc1的第二抗原结合结构域。
在一些实施方案中,本公开的双特异性抗体是双重亲和力重靶向分子(dart)。dart包含至少两条多肽链,它们结合(特别是通过共价相互作用)形成至少两个可以识别相同或不同表位的表位结合位点。dart的每条多肽链均包含免疫球蛋白轻链可变区和免疫球蛋白重链可变区,但这些区域不发生相互作用形成表位结合位点。而是,dart多肽链中的一条(例如第一条)的免疫球蛋白重链可变区与不同(例如第二条)darttm多肽链的免疫球蛋白轻链可变区相互作用,形成表位结合位点。类似地,dart多肽链中的一条(例如第一条)的免疫球蛋白轻链可变区与不同(例如第二条)dart多肽链的免疫球蛋白重链可变区相互作用,形成表位结合位点。dart可以是单特异性的、双特异性的、三特异性的等,因此能够同时结合一个、两个、三个或更多个不同的表位(它们可以是相同或不同的抗原的)。dart可以另外是一价、二价、三价、四价、五价、六价等,因此能够同时结合一个、两个、三个、四个、五个、六个或更多个分子。dart的这两个属性(即特异性程度和效价)可以组合,例如产生四价的(即能够结合四组表位)双特异性抗体(即能够结合两个表位)等。dart分子公开于pct公开wo2006/113665、wo2008/157379和wo2010/080538,其通过引用整体并入本文。
在本公开的双特异性抗体的一些实施方案中,一种结合特异性针对糖-muc1,而另一种针对免疫效应细胞上表达的抗原。如本文所用的术语“免疫效应细胞”或“效应细胞”是指哺乳动物免疫系统中细胞天然库中的细胞,其可以被激活以影响靶细胞的活力。免疫效应细胞包括淋巴样谱系的细胞,例如自然杀伤(nk)细胞,t细胞,包括细胞毒性t细胞,或b细胞,但髓样谱系的细胞也可以视为免疫效应细胞,例如单核细胞或巨噬细胞、树突状细胞和嗜中性粒细胞。因此,所述效应细胞优选是nk细胞、t细胞、b细胞、单核细胞、巨噬细胞、树突状细胞或嗜中性粒细胞。效应细胞募集到异常细胞意味着免疫效应细胞被带到异常靶细胞附近,使得效应细胞可以直接杀死其被募集到的异常细胞或间接引发其被募集到的异常细胞的杀死。为了避免非特异性相互作用,优选地,本公开的双特异性抗体特异性识别免疫效应细胞上的抗原,其与体内其他细胞相比,至少由这些免疫效应细胞过表达。免疫效应细胞上存在的靶抗原可以包括cd3、cd8、cd16、cd25、cd28、cd64、cd89、nkg2d和nkp46。优选地,免疫效应细胞上的抗原是在t细胞上表达的cd3。
如本文所用,除非另有说明,否则“cd3”是指来自任何脊椎动物来源的任何天然cd3,脊椎动物包括哺乳动物,例如灵长类动物(例如人)、非人灵长类动物(例如食蟹猴)和啮齿动物(例如小鼠和大鼠)。该术语涵盖“全长”未加工的cd3以及在细胞中加工产生的任何形式的cd3。该术语还涵盖cd3的天然存在的变体,例如剪接变体或等位基因变体。免疫效应细胞上最优选的抗原是cd3ε链。该抗原已显示出在将t细胞募集至异常细胞方面非常有效。因此,本公开的双特异性抗体优选地特异性识别cd3ε。人cd3ε的氨基酸序列显示为uniprot(www.uniprot.org)登录号p07766(版本144),或ncbi(www.ncbi.nlm.nih.gov/)refseqnp_000724.1。食蟹猴(macacafascicularis)cd3ε的氨基酸序列显示为ncbigenbankno.bab71849.1。为了用于人的治疗用途,使用其中cd3结合结构域特异性结合人cd3例如人cd3ε链的双特异性抗体。为了在非人动物和细胞系中进行临床前测试,可以使用其中cd3结合结构域特异性结合临床前测试所用物种中的cd3(例如,用于灵长类动物测试的食蟹猴cd3)的双特异性抗体。
如本文所用,“特异性结合”或“特异性识别”来自特定物种的靶抗原的结合结构域不排除与来自其他物种的抗原的结合或识别,因此涵盖其中一个或多个结合结构域具有种间交叉反应性的抗体。例如,“特异性结合”或“特异性识别”人cd3的cd3结合结构域也可以结合或识别食蟹猴cd3,反之亦然。
在一些实施方案中,本公开的双特异性抗体可以与单克隆抗体h2c(描述于pct公开号wo2008/119567)竞争结合cd3的表位。在其他实施方案中,本公开的双特异性抗体可以与单克隆抗体v9(描述于rodriguesetal.,1992,intjcancersuppl7:45-50和美国专利号6,054,297)竞争结合cd3的表位。在其他实施方案中,本公开的双特异性抗体可以与单克隆抗体fn18(描述于nooijetal.,1986,eurjimmunol19:981-984)竞争结合cd3的表位。在其他实施方案中,本公开的双特异性抗体可以与单克隆抗体sp34(描述于pessanoetal.,1985,emboj4:337-340)竞争结合cd3的表位。
本公开的抗糖-muc1抗体包括衍生化抗体。例如但不作为限制,衍生化抗体通常通过糖基化、乙酰化、聚乙二醇化、磷酸化、酰胺化、通过已知的保护/封闭基团衍生化、蛋白水解切割、与细胞配体或其他蛋白质连接来修饰。多种化学修饰中的任何一种都可以通过已知技术进行,包括但不限于特异性化学切割、乙酰化、甲酰化、衣霉素的代谢合成等。此外,衍生物可以包含一种或多种非天然氨基酸,例如,使用ambrx技术(参见,例如,wolfson,2006,chem.biol.13(10):1011-2)。
抗糖-muc1抗体或结合片段可以是其序列已被修饰以改变至少一种恒定区介导的生物学效应子功能的抗体或片段。例如,在一些实施方案中,抗糖-muc1抗体可以被修饰以相对于未经修饰的抗体降低至少一种恒定区介导的生物学效应子功能,例如,降低与fc受体(fcγr)的结合。可以通过在对fcγr相互作用必要的特定区域突变抗体的免疫球蛋白恒定区片段来降低fcγr结合(参见例如,canfield和morrison,1991,j.exp.med.173:1483-1491;和lundetal.,1991,j.immunol.147:2657-2662)。抗体的fcγr结合能力的降低还可降低依赖于fcγr相互作用的其他效应子功能,例如调理作用、吞噬作用和抗原依赖性细胞毒性(“adcc”)。
本文所述的抗糖-muc1抗体或结合片段包括已被修饰以相对于未经修饰的抗体获得或改善至少一种恒定区介导的生物学效应子功能,例如增强fcγr相互作用的抗体和/或结合片段(参见例如us2006/0134709)。例如,本公开的抗糖-muc1抗体可以具有以比相应的野生型恒定区更高的亲和力结合fcγriia、fcγriib和/或fcγriiia的恒定区。
因此,本公开的抗体可具有生物学活性的改变,从而导致调理作用、吞噬作用或adcc增加或降低。此类改变是本领域已知的。例如,在美国专利号5,834,597中描述了降低adcc活性的抗体修饰。示例性降低adcc的变体对应于“突变体3”(示于美国专利号5,834,597的图4,其中残基236被删除,且残基234、235和237(使用eu编号)被丙氨酸取代。另一个示例性降低adcc的变体包含氨基酸突变l234a、l235a和p329g(“p329glala”)。氨基酸取代的“p329glala”组合几乎完全消除了人igg1fc结构域的fcγ受体(以及互补体)结合,如pct公开号wo2012/130831所述,其通过引用整体并入本文。wo2012/130831还描述了制备此类突变体fc结构域的方法和确定其性质例如fc受体结合或效应子功能的方法。
在一些实施方案中,本公开的抗糖-muc1抗体具有低水平的岩藻糖或缺乏岩藻糖。缺乏岩藻糖的抗体与adcc活性增强相关,尤其是在低剂量抗体下。参见shieldsetal.,2002,j.biol.chem.277:26733-26740;shinkawaetal.,2003,j.biol.chem.278:3466-73。制备无岩藻糖抗体的方法包括在大鼠骨髓瘤yb2/0细胞(atcccrl1662)中生长。yb2/0细胞表达低水平的fut8mrna,其编码α-1,6-岩藻糖基转移酶,该酶是多肽岩藻糖基化所必需的酶。
在一些实施方案中,抗糖-muc1抗体或结合片段包括一分为二的寡糖,例如其中附接至fc结构域的双触角寡糖(biantennaryoligosaccharide)被glcnac一分为二。如上所述,此类变体可具有降低的岩藻糖基化和/或改善的adcc功能。此类抗体变体的实例描述于例如,umanaetal.,1999,natbiotechnol17:176-180;ferraraetal.,2006,biotechnbioeng93:851-861;wo99/54342;wo2004/065540;和wo2003/011878。
在另一方面,抗糖-muc1抗体或结合片段包括增加或降低其与胎儿fc受体fcrn的结合亲和力的修饰,例如,通过在参与fcrn相互作用的特定区域突变免疫球蛋白恒定区片段(参见例如wo2005/123780)。在具体的实施方案中,使igg类的抗糖-muc1抗体突变,使得重链恒定区的氨基酸残基250、314和428中的至少一个单独地被取代,或以其任何组合被取代,例如在位置250和428、或在位置250和314、或在位置314和428、或在位置250、314和428,其中位置250和428是特定的组合。对于位置250,取代的氨基酸残基可以是除苏氨酸以外的任何氨基酸残基,包括但不限于丙氨酸、半胱氨酸、天冬氨酸、谷氨酸、苯丙氨酸、甘氨酸、组氨酸、异亮氨酸、赖氨酸、亮氨酸、甲硫氨酸、天冬酰胺、脯氨酸、谷氨酰胺、精氨酸、丝氨酸、缬氨酸、色氨酸或酪氨酸。对于位置314,取代的氨基酸残基可以是除亮氨酸以外的任何氨基酸残基,包括但不限于丙氨酸、半胱氨酸、天冬氨酸、谷氨酸、苯丙氨酸、甘氨酸、组氨酸、异亮氨酸、赖氨酸、甲硫氨酸、天冬酰胺、脯氨酸、谷氨酰胺、精氨酸、丝氨酸、苏氨酸、缬氨酸、色氨酸或酪氨酸。对于位置428,取代的氨基酸残基可以是除甲硫氨酸以外的任何氨基酸残基,包括但不限于丙氨酸、半胱氨酸、天冬氨酸、谷氨酸、苯丙氨酸、甘氨酸、组氨酸、异亮氨酸、赖氨酸、亮氨酸、天冬酰胺、脯氨酸、谷氨酰胺、精氨酸、丝氨酸、苏氨酸、缬氨酸、色氨酸或酪氨酸。合适的氨基酸取代的特定组合在美国专利号7,217,797的表1中鉴定,其通过引用并入本文。此类突变增加与fcrn的结合,从而保护抗体免于降解并延长其半衰期。
在其他方面,本公开的抗糖-muc1抗体或抗原结合片段具有插入到一个或多个其高变区中的一个或多个氨基酸,例如,如jung和pluckthun,1997,proteinengineering10:9,959-966;yazakietal.,2004,proteineng.dessel.17(5):481-9.epub2004aug.17;和美国专利申请号2007/0280931中所述。
在其他方面,特别对于诊断应用有用的是,将本公开的抗糖-muc1抗体或抗原结合片段附接至可检测部分。可检测部分包括放射性部分、比色分子、荧光部分、化学发光部分、抗原、酶、可检测珠(例如磁性珠或电极(例如金)珠)、或与另一分子结合的分子(例如生物素或链霉抗生物素蛋白)。
放射性同位素或放射性核素可包括3h、14c、15n、35s、90y、99tc、111in、125i、131i。
荧光标记可包括罗丹明、镧系元素磷光体、荧光素及其衍生物、荧光染料、gfp(gfp表示“绿色荧光蛋白”)、丹磺酰基、伞形酮、藻红蛋白、藻蓝蛋白、别藻蓝蛋白、邻苯二甲醛和荧光胺。
酶标记可包括辣根过氧化物酶、β半乳糖苷酶、萤光素酶、碱性磷酸酶、葡萄糖-6-磷酸脱氢酶(“g6pdh”)、α-d-半乳糖苷酶、葡萄糖氧化酶、葡萄糖淀粉酶、碳酸酐酶、乙酰胆碱酯酶、溶菌酶、苹果酸脱氢酶和过氧化物酶。
化学发光标记或化学发光剂例如为异鲁米诺,鲁米诺和二氧杂环丁烷。
其他可检测部分包括例如生物素、洋地黄毒苷或5-溴脱氧尿苷的分子。
在某些方面,本公开的抗糖-muc1抗体或抗原结合片段与1ag或包含1ag的重链和轻链可变区(分别为seqidno:1和2)的抗体或抗原结合片段竞争。
在其他方面,本公开的抗糖-muc1抗体或抗原结合片段与4ag或包含4ag的重链和轻链可变区(分别为seqidno:23和24)的抗体或抗原结合片段竞争。
可以对表达被1ag或4ag结合的糖-muc1表位的细胞或对包含被1ag或4ag结合的表位的糖基化muc1肽,例如在以粗体和下划线文本显示的丝氨酸和苏氨酸残基上被galnac糖基化的15-mer肽
可对其进行竞争性测定的细胞包括但不限于乳腺癌细胞系mcf7或t47d,和经工程化改造以表达糖-muc1表位的重组细胞。在一个非限制性实例中,将缺乏udp-gal/galnac差向异构酶并且在缺少外源添加galnac和gal的情况下分别缺少galnaco-糖基化和半乳糖基化的choidid细胞改造成表达muc1并使其在缺少或存在galnac的情况下培养,后者产生表达与1ag和4ag结合的muc1的tn糖型的细胞。表达未糖基化形式的muc1的细胞可用作阴性对照。
竞争性测定包括但不限于放射性物质标记免疫测定(ria)、酶联免疫吸附测定(elisa)、夹心elisa、荧光激活细胞分选(facs)测定和表面等离振子共振(例如biacore)测定。
在参考抗体和测试抗体(不论种类或同种型)之间进行抗体竞争性测定时,可以先用可检测标记例如荧光团、生物素或酶(或甚至放射性)标记,来标记参考物,以便能够进行随后的鉴定。在这种情况下,将表达糖-muc1的细胞与未标记的测试抗体一起孵育,添加标记的参考抗体,并测量结合标记的强度。如果测试抗体通过结合重叠的表位与标记的参考抗体竞争,则相对于没有测试抗体的情况下进行的对照反应,强度将会降低。
在该测定的具体实施方案中,首先确定在测定条件(例如,指定的细胞密度)下产生最大结合的80%(“conc80%”)的标记参考抗体的浓度,并用10xconc80%的未标记测试抗体和conc80%的标记参考抗体进行竞争测定。
抑制可以表示为抑制常数或ki,其根据以下公式计算:
ki=ic50/(1+[参考抗体浓度]/kd),
其中ic50是产生参考抗体的结合50%降低的测试抗体的浓度,且kd是参考抗体的解离常数,是其对糖-muc1的亲和力的度量。在本文所述的测定条件下,与本文公开的抗糖-muc1抗体竞争的抗体可以具有10pm至10nm的ki。
在各种实施方案中,在所使用的特定测定条件下,参考抗体浓度为最大结合的80%,且测试抗体浓度比参考抗体浓度高10倍时,如果测试抗体使参考抗体的结合降低至少约20%或更多,例如降低至少约20%、30%、40%、50%、60%、70%、80%、90%、95%或甚至更多或降低介于上述任何值之间的百分比,则认为测试抗体与参考抗体竞争。
在竞争测定的一个实例中,通过使板与肽溶液接触(例如,在pbs中浓度为1μg/ml,4℃过夜),使糖基化的muc115-mer肽粘附到固体表面,例如微孔板。将板洗涤(例如,在pbs中的0.1%tween20)并封闭(例如,在superblock中,thermoscientific,rockford,il)。将在elisa缓冲液(例如pbs中的1%bsa和0.1%tween20)中系列稀释(例如,浓度为2.8μg/ml,8.3μg/ml或25μg/ml)的亚饱和量的生物素化1ag或4ag(例如,浓度为80ng/ml)和未标记的1ag或4ag(“参考”抗体)或竞争性抗糖-muc1抗体(“测试”抗体)的混合物添加至孔并将板轻轻摇动孵育1小时。洗涤板,将在elisa缓冲液中稀释的1μg/mlhrp缀合的链霉抗生物素蛋白添加至每个孔,并将板孵育1小时。洗涤板并通过添加底物(例如,tmb,biofxlaboratoriesinc.,owingsmills,md)来检测结合的抗体。通过添加终止缓冲液(例如,biofx终止试剂,biofxlaboratoriesinc.,owingsmills,md)来终止反应,并使用酶标仪(例如,versamax,moleculardevices,sunnyvale,ca)在650nm处测量吸光度。
该竞争测定的变型也可以用于测试1ag或4ag与另一种抗糖-muc1抗体之间的竞争。例如,在某些方面,抗糖-muc1抗体用作参考抗体,而1ag或4ag用作测试抗体。另外,代替糖基化的muc115-mer肽,可以使用培养中的在细胞表面上(例如在上述一种细胞类型的表面上)表达的膜结合的糖-muc1。通常,使用约104至106个转染子,例如约105个转染子。用于竞争测定的其他形式是本领域已知的并且可以得以采用。
在各种实施方案中,当抗糖-muc1抗体的使用浓度为0.08μg/ml、0.4μg/ml、2μg/ml、10μg/ml、50μg/ml、100μg/ml或范围介于上述任何值之间的浓度(例如,范围为2μg/ml至10μg/ml的浓度)时,本公开的抗糖-muc1抗体使标记的1ag或4ag的结合降低至少40%、至少50%、至少60%、至少70%、至少80%、至少90%,或降低范围介于任何上述值之间的百分比(例如,本公开的抗糖-muc1抗体使标记的1ag或4ag的结合降低50%至70%)。
在其他实施方案中,当1ag或4ag的使用浓度为0.4μg/ml、2μg/ml、10μg/ml、50μg/ml、250μg/ml或范围介于任何上述值之间的浓度(例如,范围为2μg/ml至10μg/ml的浓度)时,1ag或4ag使本公开的标记的抗糖-muc1抗体的结合降低至少40%、至少50%、至少60%、至少70%、至少80%、至少90%,或降低范围介于任何上述值之间的百分比(例如1ag或4ag使本公开的标记的抗糖-muc1抗体的结合降低50%至70%)。
在前述测定中,可用包含1ag或4ag的cdr或重链和轻链可变区的任何抗体或抗原结合片段(例如1ag或4ag的人源化或嵌合对应物)替换1ag或4ag抗体。
在某些方面,本公开的抗糖-muc1抗体或抗原结合片段具有与1ag或4ag的表位相同或相似的表位。本公开的抗糖-muc1抗体或抗原结合片段的表位可以通过进行例如如实施例9中所述的丙氨酸扫描来表征。实施例9描述了12个糖肽(seqidno:106-117)的文库,每个糖肽与muc1肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在一些实施方案中,如通过elisa所测量的,本公开的抗糖-muc1抗体或抗原结合片段与肽
在某些方面,本公开的抗糖-muc1抗体或抗原结合片段包含表1a或表1b中列出的重链和/或轻链可变区序列(或由核苷酸序列编码)。在其他方面,本公开的抗糖-muc1抗体或抗原结合片段包含表1a、表1b、表1c、表1d、表1e、表2a、表2b、表2c、表3a或表3b中列出的重链和/或轻链cdr序列(或由核苷酸序列编码)。此类抗糖-muc1抗体和抗原结合片段的框架序列可以是表1a或表1b中列出的vh和vl序列的天然鼠框架序列,或者可以是非天然的(例如人源化的或人的)框架序列。
在其他方面,本公开提供了具有重链和轻链可变区的抗muc1抗体或抗原结合片段,该重链和轻链可变区分别与seqidno:1和2具有至少95%、98%、99%或99.5%的序列同一性。
在其他方面,本公开提供了具有重链和轻链可变区的抗muc1抗体或抗原结合片段,该重链和轻链可变区分别与seqidno:23和24具有至少95%、98%、99%或99.5%的序列同一性。
在其他方面,本公开的抗糖-muc1抗体或抗原结合片段是单链可变片段(scfv)。示例性的scfv包含位于轻链可变片段n末端的重链可变片段。在一些实施方案中,scfv重链可变片段和轻链可变片段共价结合至4-15个氨基酸的接头序列。scfv可以是双特异性t细胞衔接子的形式,也可以在嵌合抗原受体(car)内。
6.2抗体-药物缀合物
本公开的另一方面涉及抗体药物缀合物(adc),其包括本公开的抗糖-muc1抗体和抗原结合片段。adc通常包含如本文所述的抗糖-muc1抗体和/或结合片段,其通过一个或多个接头与一种或多种细胞毒性剂和/或细胞抑制剂连接。在具体的实施方案中,adc是根据结构式(i)的化合物或其盐:
[d-l-xy]n-ab
其中每个“d”彼此独立地表示细胞毒性剂和/或细胞抑制剂(“药物”);每个“l”彼此独立地表示接头;“ab”表示抗糖-muc1抗原结合结构域,例如本文所述的抗糖-muc1抗体或结合片段;每个“xy”表示接头上的官能团rx与抗体上的“互补”官能团ry之间形成的连接,并且n代表与adc连接的药物的数目或adc的药物与抗体比(dar)。
可包含adc的各种抗体(ab)的具体实施方案包括上述抗糖-muc1抗体和/或结合片段的各种实施方案。
在结构式(i)的adc和/或盐的一些具体实施方案中,每个d是相同的和/或每个l是相同的。
下面更详细地描述了可包含本公开内容的抗糖-muc1adc的细胞毒性剂和/或细胞抑制剂(d)和接头(l),以及与adc连接的细胞毒性剂和/或细胞抑制剂的数量的具体实施方案。
6.2.1.细胞毒性剂和/或细胞抑制剂
细胞毒性剂和/或细胞抑制剂可以是已知抑制细胞,且特别是癌细胞和/或肿瘤细胞的生长和/或复制和/或杀死细胞,且特别是癌细胞和/或肿瘤细胞的任何试剂。具有细胞毒性和/或细胞抑制特性的许多试剂在文献中是已知的。各类细胞毒性剂和/或细胞抑制剂的非限制性实例包括例如但不限于放射性核素、烷基化剂、拓扑异构酶i抑制剂、拓扑异构酶ii抑制剂、dna嵌入剂(例如,沟结合剂,例如小沟结合剂)、rna/dna抗代谢物、细胞周期调节剂、激酶抑制剂、蛋白质合成抑制剂、组蛋白脱乙酰基酶抑制剂、线粒体抑制剂和抗有丝分裂剂。
下面提供了这些各种类别中某些类别内的试剂的具体非限制性实例。
烷基化剂:asaley((l-亮氨酸,n-[n-乙酰基-4-[双-(2-氯乙基)氨基]-dl-苯丙氨酰基]-,乙酯;nsc167780;cas登记号3577897));azq((1,4-环己二烯-1,4-二氨基甲酸,2,5-双(1-氮丙啶基)-3,6-二氧-,二乙酯;nsc182986;cas登记号57998682));bcnu((n,n’-双(2-氯乙基)-n-亚硝基脲;nsc409962;cas登记号154938));白消安(1,4-丁二醇二甲磺酸盐;nsc750;cas登记号55981);(羧基邻苯二甲酸)铂(nsc27164;cas登记号65296813);cbdca((顺式-(1,1-环丁烷二羧酸)二氨合铂(ii);nsc241240;cas登记号41575944));ccnu((n-(2-氯乙基)-n'-环己基-n-亚硝基脲;nsc79037;cas登记号13010474));chip(异丙铂;nsc256927);苯丁酸氮芥(nsc3088;cas登记号305033);氯脲霉素((2-[[[(2-氯乙基)亚硝基氨基]羰基]氨基]-2-脱氧-d-吡喃葡萄糖;nsc178248;cas登记号54749905));顺铂(cisplatin;nsc119875;cas登记号15663271);氯乙矾(nsc338947;cas登记号88343720);氰基吗啉代阿霉素(ncs357704;cas登记号88254073);甲基二磺酸乙二醇脂(cyclodisone)(nsc348948;cas登记号99591738);去水卫矛醇(5,6-二环氧卫矛醇;nsc132313;cas登记号23261203);氟多潘((5-[(2-氯乙基)-(2-氟乙基)氨基]-6-甲基尿嘧啶;nsc73754;cas登记号834913);hepsulfam(nsc329680;cas登记号96892578);海恩酮(nsc142982;cas登记号23255938);美法仑(nsc8806;cas登记号3223072);甲基ccnu((1-(2-氯乙基)-3-(反式-4-甲基环己烷)-1-亚硝基脲;nsc95441;13909096);丝裂霉素c(nsc26980;cas登记号50077);米托唑酰胺(nsc353451;cas登记号85622953);氮芥((双(2-氯乙基)甲胺盐酸盐;nsc762;cas登记号55867);pcnu((1-(2-氯乙基)-3-(2,6-二氧代-3-哌啶基)-1-亚硝基脲;nsc95466;cas登记号13909029));哌嗪烷基化剂((1-(2-氯乙基)-4-(3-氯丙基)-哌嗪二盐酸盐;nsc344007));哌嗪二酮(nsc135758;cas登记号41109802);哌泊溴烷((n,n-双(3-溴丙酰基)哌嗪;nsc25154;cas登记号54911));泊非霉素(n-甲基丝裂霉素c;nsc56410;cas登记号801525);螺乙内酰脲芥(nsc172112;cas登记号56605164);替罗昔隆(三缩水甘油基异氰脲酸酯;nsc296934;cas登记号2451629);四铂(nsc363812;cas登记号62816982);塞替派(n,n',n”-三-1,2-乙二基硫代磷酰胺;nsc6396;cas登记号52244);曲他胺(nsc9706;cas登记号51183);尿嘧啶氮芥(去甲基多潘(desmethyldopan);nsc34462;cas登记号66751);yoshi-864((双(3-甲磺酰氧基丙基)胺盐酸盐;nsc102627;cas登记号3458228)。
拓扑异构酶i抑制剂:喜树碱(nsc94600;cas登记号:7689-03-4);各种喜树碱衍生物和类似物(例如,nsc100880、nsc603071、nsc107124、nsc643833、nsc629971、nsc295500、nsc249910、nsc606985、nsc74028、nsc176323、nsc295501、nsc606172、nsc606173、nsc610458、nsc618939、nsc610457、nsc610459、nsc606499、nsc610456、nsc364830和nsc606497);吗啉异阿霉素(nsc354646;cas登记号89196043);sn-38(nsc673596;cas登记号86639-52-3)。
拓扑异构酶ii抑制剂:阿霉素(nsc123127;cas登记号25316409);氨萘非特(苯并异喹啉二酮;nsc308847;cas登记号69408817);m-amsa((4'-(9-吖啶基氨基))-3'-甲氧基甲磺酰苯胺;nsc249992;cas登记号51264143));蒽吡唑衍生物(nsc355644);依托泊苷(vp-16;nsc141540;cas登记号33419420);吡唑并吖啶((吡唑并[3,4,5-kl]吖啶-2(6h)-丙胺,9-甲氧基-n,n-二甲基-5-硝基-,一甲磺酸盐;nsc366140;cas登记号99009219);比生群盐酸盐(nsc337766;cas登记号71439684);柔红霉素(nsc821151;cas登记号23541506);脱氧阿霉素(nsc267469;cas登记号63950061);米托蒽醌(nsc301739;cas登记号70476823);美诺立尔(nsc269148;cas登记号71628961);n,n-二苄基道诺霉素(nsc268242;cas登记号70878512);恶烷噻唑(oxanthrazole)(nsc349174;cas登记号105118125);正定苯酰肼(rubidazone)(nsc164011;cas登记号36508711);替尼泊苷(vm-26;nsc122819;cas登记号29767202)。
dna嵌入剂:蒽霉素(cas登记号4803274);奇卡霉素a(cas登记号89675376);托马霉素(cas登记号35050556);dc-81(cas登记号81307246);西比霉素(sibiromycin)(cas登记号12684332);吡咯并苯并二氮杂卓衍生物(cas登记号945490095);sgd-1882((s)-2-(4-氨基苯基)-7-甲氧基-8-(3-4(s)-7-甲氧基-2-(4-甲氧基苯基)-5-氧代-5,11a-二氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-8-基)氧基)丙氧基)-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-5(11ah)-酮);sg2000(sjg-136;(11as,11a's)-8,8'-(丙烷-1,3-二基双(氧基))双(7-甲氧基-2-亚甲基-2,3--二氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-5(11ah)-酮);nsc694501;cas登记号232931576)。
rna/dna抗代谢物:l-阿拉诺新(nsc153353;cas登记号59163416);5-氮杂胞苷(nsc102816;cas登记号320672);5-氟尿嘧啶(nsc19893;cas登记号51218);阿西维辛(nsc163501;cas登记号42228922);氨基蝶呤衍生物n-[2-氯-5-[[((2,4-二氨基-5-甲基-6-喹唑啉基)甲基]氨基]苯甲酰基-]l-天冬氨酸(nsc132483);氨基蝶呤衍生物n-[4-[[(2,4-二氨基-5-乙基-6-喹唑啉基)甲基]氨基]苯甲酰基]l-天冬氨酸(nsc184692);氨基蝶呤衍生物n-[2-氯-4-[[((2,4-二氨基-6-哌啶基)甲基]氨基]苯甲酰基]l-天冬氨酸一水合物(nsc134033);抗叶酸剂((nα-(4-氨基-4-脱氧蝶酰基)-n7-半邻苯二甲酰基-l-鸟氨酸;nsc623017));baker的可溶性抗叶酸剂(nsc139105;cas登记号41191042);二氯烯丙基指甲花醌((2-(3,3-二氯烯丙基)-3-羟基-1,4-萘醌;nsc126771;cas登记号36417160);布喹那(nsc368390;cas登记号96201886);替加氟((前药;5-氟-1-(四氢-2-呋喃基)-尿嘧啶;nsc148958;cas登记号37076689);5,6-二氢-5-氮杂胞苷(nsc264880;cas登记号62402317);甲氨蝶呤(nsc740;cas登记号:59052);甲氨蝶呤衍生物(n-[[4-[[(2,4-二氨基-6-哌啶基)甲基]甲基氨基]-1-萘]羰基]l-谷氨酸;nsc174121);pala((n-(膦酰基乙酰基)-l-天冬氨酸;nsc224131;cas登记号:603425565);吡唑呋喃菌素(nsc143095;cas登记号30868305);三甲曲沙(nsc352122;cas登记号82952645)。
dna抗代谢物:3-hp(nsc95678;cas登记号3814797);2'-脱氧-5-氟尿苷(nsc27640;cas登记号50919);5-hp(nsc107392;cas登记号19494894);α-tgdr(α-2'-脱氧-6-硫鸟苷;nsc71851cas登记号2133815);阿非迪霉素甘氨酸盐(nsc303812;cas登记号92802822);阿糖胞苷(阿拉伯糖胞嘧啶;nsc63878;cas登记号69749);5-氮杂-2'-脱氧胞苷(nsc127716;cas登记号2353335);β-tgdr(β-2'-脱氧-6-硫鸟苷;nsc71261;cas登记号789617);环胞苷(nsc145668;cas登记号10212256);胍唑(nsc1895;cas登记号1455772);羟基脲(nsc32065;cas登记号127071);肌苷糖二醛(nsc118994;cas登记号23590990);macbecinii(nsc330500;cas登记号73341738);吡唑并咪唑(nsc51143;cas登记号6714290);硫鸟嘌呤(nsc752;cas登记号154427);硫嘌呤(nsc755;cas登记号50442)。
细胞周期调节剂:水飞蓟宾(cas登记号22888-70-6);表没食子儿茶素没食子酸酯(egcg;cas登记号989515);原花青素衍生物(例如原花青素a1[cas登记号103883030],原花青素b1[cas登记号20315257],原花青素b4[cas登记号29106512],arecatanninb1[cas登记号79763283]);异黄酮(例如染料木黄酮[4%5,7-三羟基异黄酮;cas登记号446720],黄豆苷元[4',7-二羟基异黄酮,cas登记号486668];吲哚-3-甲醇(cas登记号700061);槲皮素(nsc9219;cas登记号117395);雌莫司汀(nsc89201;cas登记号2998574);诺考达唑(cas登记号31430189);鬼臼毒素(cas登记号518285);酒石酸长春瑞滨(nsc608210;cas登记号125317397);念珠藻素(nsc667642;cas登记号124689652)。
激酶抑制剂:阿法替尼(cas登记号850140726);阿昔替尼(cas登记号319460850);arry-438162(binimetinib)(cas登记号606143899);博舒替尼(cas登记号380843754);卡博替尼(cas登记号1140909483);色瑞替尼(cas登记号1032900256);克唑替尼(cas登记号877399525);达拉非尼(cas登记号1195765457);达沙替尼(nsc732517;cas登记号302962498);厄洛替尼(nsc718781;cas登记号183319699);依维莫司(nsc733504;cas登记号159351696);福他替尼(nsc745942;cas登记号901119355);吉非替尼(nsc715055;cas登记号184475352);依鲁替尼(cas登记号936563961);伊马替尼(nsc716051;cas登记号220127571);拉帕替尼(cas登记号388082788);乐伐替尼(cas登记号857890392);木利替尼(cas366017096);尼洛替尼(cas登记号923288953);尼达尼布(cas登记号656247175);帕博西尼(cas登记号571190302);帕唑帕尼(nsc737754;cas登记号635702646);哌加他尼(cas登记号222716861);帕纳替尼(cas登记号1114544318);雷帕霉素(nsc226080;cas登记号:53123889);瑞戈非尼(cas登记号755037037);ap23573(地磷莫司(ridaforolimus))(cas登记号572924540);incb018424(鲁索替尼)(cas登记号1092939177);arry-142886(司美替尼)(nsc741078;cas登记号606143-52-6);西罗莫司(nsc226080;cas登记号53123889);索拉非尼(nsc724772;cas登记号475207591);舒尼替尼(nsc736511;cas登记号341031547);托法替尼(cas登记号477600752);替西罗莫司(nsc683864;cas登记号163635043);曲美替尼(cas登记号871700173);凡德他尼(cas登记号443913733);维罗非尼(cas登记号918504651);su6656(cas登记号330161870);cep-701(来沙替尼)(cas登记号111358884);xl019(cas登记号945755566);pd-325901(cas登记号391210109);pd-98059(cas登记号167869218);atp竞争性torc1/torc2抑制剂,包括pi-103(cas登记号371935749),pp242(cas登记号1092351671),pp30(cas登记号1092788094),torin1(cas登记号1222998368),ly294002(cas登记号154447366),xl-147(cas登记号934526893),cal-120(cas登记号870281348),etp-45658(cas登记号1198357797),px866(cas登记号502632668),gdc-0941(cas登记号957054307),bgt226(cas登记号1245537681),bez235(cas登记号915019657),xl-765(cas登记号934493762)。
蛋白质合成抑制剂:吖黄素(cas登记号65589700);阿米卡星(nsc177001;cas登记号39831555);阿贝卡星(cas登记号51025855);阿司米星(cas登记号55779061);阿奇霉素(nsc643732;cas登记号83905015);贝卡那霉素(cas登记号4696768);金霉素(nsc13252;cas登记号64722);克拉霉素(nsc643733;cas登记号81103119);克林霉素(cas登记号18323449);氯环素(cas登记号1181540);环己酰亚胺(cas登记号66819);放线菌素(nsc3053;cas登记号50760);达福普丁(cas登记号112362502);地氯环素(cas登记号127333);地贝卡星(cas登记号34493986);二氢链霉素(cas登记号128461);地红霉素(cas登记号62013041);强力霉素(cas登记号17086281);依米丁(nsc33669;cas登记号483181);红霉素(nsc55929;cas登记号114078);氟霉素(cas登记号83664208);弗氏菌丝素(新霉素b;cas登记号119040);庆大霉素(nsc82261;cas登记号1403663);甘氨酰环素,例如替加环素(cas登记号220620097);潮霉素b(cas登记号31282049);异帕米星(cas登记号67814760);交沙霉素(nsc122223;cas登记号16846245);卡那霉素(cas登记号8063078);缩酮类,例如泰利霉素(cas登记号191114484),喹红霉素(cas登记号205110481)和索利霉素(cas登记号760981837);林可霉素(cas登记号154212);莱美环素(cas登记号992212);甲氯环素(nsc78502;cas登记号2013583);甲环素(罗霉素;nsc356463;cas登记号914001);麦迪霉素(cas登记号35457808);米诺环素(nsc141993;cas登记号10118908);米卡霉素(cas登记号55881077);新霉素(cas登记号119040);奈替米星(cas登记号56391561);竹桃霉素(cas登记号3922905);恶唑烷酮,例如伊皮唑胺(cas登记号165800044),利奈唑胺(cas登记号165800033),泼斯唑来(cas登记号252260029),雷地唑来(cas登记号869884786),ranbezolid(cas登记号392659380),sutezolid(cas登记号168828588),特地唑来(cas登记号856867555);土霉素(nsc9169;cas登记号2058460);巴龙霉素(cas登记号7542372);青哌环素(cas登记号4599604);肽基转移酶抑制剂,例如氯霉素(nsc3069;cas登记号56757)和衍生物,例如叠氮氯霉素(cas登记号13838089),氟苯尼考(cas登记号73231342)和甲砜霉素(cas登记号15318453),以及截短侧耳素,例如瑞他帕林(cas登记号224452668),硫姆林(cas登记号55297955),伐奈莫林(cas登记号101312929);吡利霉素(cas登记号79548735);嘌罗霉素(nsc3055;cas登记号53792);奎奴普丁(cas登记号120138503);核糖霉素(cas登记号53797356);罗他霉素(cas登记号74014510);罗利环素(cas登记号751973);罗红霉素(cas登记号80214831);西索米星(cas登记号32385118);大观霉素(cas登记号1695778);螺旋霉素(cas登记号8025818);链霉菌素,例如普那霉素(cas登记号270076603),奎奴普丁/达福普汀(cas登记号126602899)和维吉尼亚霉素(cas登记号11006761);链霉素(cas登记号57921);四环素(nsc108579;cas登记号60548);妥布霉素(cas登记号32986564);醋竹桃霉素(cas登记号2751099);泰乐菌素(cas登记号1401690);维达米星(verdamicin)(cas登记号49863481)。
组蛋白脱乙酰基酶抑制剂:阿贝司他(abexinostat)(cas登记号783355602);贝利司他(nsc726630;cas登记号414864009);西达本胺(cas登记号743420022);恩替司他(cas登记号209783802);吉维司他(givinostat)(cas登记号732302997);莫替司他(mocetinostat)(cas登记号726169739);帕比司他(cas登记号404950807);quisinostat(cas登记号875320299);瑞诺司他(resminostat)(cas登记号864814880);罗米地辛(cas登记号128517077);萝卜硫素(cas登记号4478937);硫脲基丁腈(kevetrintm;cas登记号6659890);丙戊酸(nsc93819;cas登记号99661);伏立诺他(nsc701852;cas登记号149647789);acy-1215(rocilinostat;cas登记号1316214524);cudc-101(cas登记号1012054599);chr-2845(tefinostat;cas登记号914382608);chr-3996(cas登记号1235859138);4sc-202(cas登记号910462430);cg200745(cas登记号936221339);sb939(pracinostat;cas登记号929016966)。
线粒体抑制剂:水鬼蕉碱(nsc349156;cas登记号96281311);罗丹明123(cas登记号63669709);依地福新(nsc324368;cas登记号70641519);d-α-生育酚琥珀酸酯(nsc173849;cas登记号4345033);化合物11β(cas登记号865070377);阿司匹林(nsc406186;cas登记号50782);玫瑰树碱(cas登记号519233);小檗碱(cas登记号633658);浅蓝菌素(cas登记号17397896);gx015-070(
抗有丝分裂剂:别秋水仙碱(nsc406042);澳瑞他汀,例如mmae(一甲基澳瑞他汀e;cas登记号474645-27-7)和mmaf(一甲基澳瑞他汀f;cas登记号745017-94-1);软海绵素b(nsc609395);秋水仙碱(nsc757;cas登记号64868);秋水仙碱衍生物(n-苯甲酰基-去乙酰基苯甲酰胺;nsc33410;cas登记号63989753);尾海兔素10(nsc376128;cas登记号110417-88-4);美登素(nsc153858;cas登记号35846-53-8);rhozoxin(nsc332598;cas登记号90996546);紫杉醇(nsc125973;cas登记号33069624);紫杉醇衍生物((2'-n-[3-(二甲基氨基)丙基]谷氨酸紫杉醇;nsc608832);硫代秋水仙碱(3-去甲基硫代秋水仙碱;nsc361792);三苯甲基半胱氨酸(nsc49842;cas登记号2799077);硫酸长春碱(nsc49842;cas登记号143679);硫酸长春新碱(nsc67574;cas登记号2068782)。
包括或可以被修饰以包括与抗体的附接的位点的任何这些试剂可以包含在本文公开的adc中。
在具体的实施方案中,细胞毒性剂和/或细胞抑制剂是抗有丝分裂剂。
在另一个具体的实施方案中,细胞毒性剂和/或细胞抑制剂是澳瑞他汀,例如一甲基澳瑞他汀e(“mmae”)或一甲基澳瑞他汀f(“mmaf”)。
6.2.2.接头
在本公开的抗糖-muc1adc中,细胞毒性剂和/或细胞抑制剂通过接头与抗体连接。使细胞毒性剂和/或细胞抑制剂与adc的抗体连接的接头可以是短的、长的、疏水的、亲水的、柔性的或刚性的,或者可以由各自独立地具有一种或多种上述性质的区段组成,使得接头可以包括具有不同性质的区段。接头可以是多价的,使得它们将一个以上试剂共价连接至抗体的单个位点,或者可以是单价的,使得它们将单个试剂共价连接至抗体的单个位点。
本领域技术人员将理解,接头通过在一个位置与细胞毒性剂和/或细胞抑制剂形成共价连接并在另一位置与抗体形成共价连接,使细胞毒性剂和/或细胞抑制剂与抗体连接。通过接头上的官能团与试剂和抗体上的官能团之间的反应形成共价连接。如本文所用,表述“接头”旨在包括(i)非缀合形式的接头,其包括能够使接头与细胞毒性剂和/或细胞抑制剂共价连接的官能团,和能够使接头与抗体共价连接的官能团;(ii)部分缀合形式的接头,其包括能够使接头与抗体共价连接的官能团,并且其与细胞毒性剂和/或细胞抑制剂共价连接,反之亦然;和(iii)完全缀合形式的接头,其与细胞毒性剂和/或细胞抑制剂和抗体两者共价连接。在本公开的接头和抗糖-muc1adc以及用于使接头试剂与抗体缀合的合成子的某些具体实施方案中,包含接头上的官能团的部分以及在接头和抗体之间形成的共价连接分别具体表示为rx和xy。
接头优选但不必须是对细胞外部的条件是化学稳定的,并且可以被设计成在细胞内部切割、毁灭和/或以其他方式特异性降解。替代地,可以使用没有被设计成在细胞内特异性切割或降解的接头。选择稳定的接头还是不稳定的接头可取决于细胞毒性即和/或细胞抑制剂的毒性。对于对正常细胞有毒性的试剂,稳定的接头是优选的。可以利用选择性或靶向性并且对正常细胞具有较低毒性的试剂,接头与细胞外环境的化学稳定性不太重要。在adc的背景下,可用于使药物与抗体连接的各种接头在本领域是已知的。任何这些接头以及其他接头可用于使细胞毒性剂和/或细胞抑制剂与本公开的抗糖-muc1adc的抗体连接。
可用于使许多细胞毒性剂和/或细胞抑制剂与单个抗体分子连接的示例性多价接头例如在wo2009/073445、wo2010/068795、wo2010/138719、wo2011/120053、wo2011/171020、wo2013/096901、wo2014/008375、wo2014/093379、wo2014/093394、wo2014/093640,其内容通过引用整体并入本文。例如,mersana等人开发的fleximer接头技术具有使高daradc具有良好理化特性的潜力。如下所示,mersana技术基于通过一系列酯键将药物分子掺入可溶解的聚缩醛主链中。该方法使高负荷adc(dar高达20)成为可能,并同时保持良好的理化特性。
树突型接头的其他实例可以在以下中找到:us2006/116422;us2005/271615;degrootetal.(2003)angew.chem.int.ed.42:4490-4494;amiretal.(2003)angew.chem.int.ed.42:4494-4499;shamisetal.(2004)j.am.chem.soc.126:1726-1731;sunetal.(2002)bioorganic&medicinalchemistryletters12:2213-2215;sunetal.(2003)bioorganic&medicinalchemistry11:1761-1768;kingetal.(2002)tetrahedronletters43:1987-1990,其中的每一个通过引用并入本文。
可以使用的示例性多价接头描述于例如nolting,2013,antibody-drugconjugates,methodsinmolecularbiology1045:71-100;kitsonetal.,2013,cros/cmos--chemicaoggi--chemistrytoday31(4):30-38;ducryetal.,2010,bioconjugatechem.21:5-13;zhaoetal.,2011,j.med.chem.54:3606-3623;美国专利号7,223,837;美国专利号8,568,728;美国专利号8,535,678;和wo2004010957,其中的每一个通过引用并入本文。
作为实例而非限制,以下描述了可包括在本公开的抗糖-muc1adc中的一些可切割接头和不可切割接头。
6.2.3.可切割接头
在某些实施方案中,选择的接头是体内可切割的。可切割接头可以包括化学或酶学上不稳定或可降解的连接。可切割接头通常依赖于细胞内的过程来释放药物,例如细胞质中的还原,暴露于溶酶体中的酸性条件,或被细胞内的特定蛋白酶或其他酶切割。可切割接头通常掺入一个或多个化学或酶促可切割的化学键,而接头的其余部分不可切割。在某些实施方案中,接头包含化学上不稳定的基团,例如腙和/或二硫化物基团。包含化学上不稳定基团的接头利用了血浆和某些细胞质区室之间的差异性。促进含腙接头的药物释放的细胞内条件是内体和溶酶体的酸性环境,而含二硫化物接头在含有高硫醇浓度(例如谷胱甘肽)的胞质溶胶中被还原。在某些实施方案中,可以通过使用化学不稳定基团附近的取代基引入空间位阻来提高包含化学不稳定基团的接头的血浆稳定性。
酸不稳定基团例如腙在血液的中性ph环境(ph7.3-7.5)的系统循环期间保持完整,并在adc被内化至细胞的弱酸性内体(ph5.0-6.5)和溶酶体区(ph4.5-5.0)区室后,发生水解并释放药物。这种ph依赖性释放机制与药物的非特异性释放有关。为增加接头的腙基团的稳定性,可通过化学修饰例如取代来改变接头,从而允许调节以在溶酶体中实现更有效的释放,同时循环中的损失最小。
含腙接头可以含有另外的切割位点,例如另外的酸不稳定的切割位点和/或酶不稳定的切割位点。包括示例性的含腙接头的adc包括以下结构:
其中d和ab分别代表细胞毒性剂和/或细胞抑制剂(药物)和ab,n代表与抗体连接的药物接头的数目。在某些接头如接头(ig)中,接头包含两个可切割基团,即二硫化物和腙部分。对于此类接头,未修饰的游离药物的有效释放需要酸性ph或二硫化物的还原和酸性ph。接头例如(ih)和(ii)已显示出对单个腙切割位点是有效的。
在系统循环期间保持完整并在adc被内化至酸性细胞区室时发生水解并释放药物的其他接头包括碳酸盐/酯。在细胞毒性剂和/或细胞抑制剂可通过氧共价连接的情况下,此类接头可以是有用的。
可以包含在接头中的其他酸不稳定基团包括含顺式乌头酰基的接头。顺式乌头酰基化学使用与酰胺键并列的羧酸,以加速在酸性条件下酰胺的水解。
可切割接头还可以包括二硫化物基团。二硫化物在生理ph下是热力学稳定的,并且被设计为在细胞内部内化后释放药物,其中胞质溶胶与细胞外环境相比提供了明显更加还原的环境。二硫键的断开通常需要胞质硫醇辅因子的存在,例如(还原的)谷胱甘肽(gsh),以使含二硫化物的接头在循环中相当稳定,从而选择性地将药物释放到胞质溶胶中。胞内酶蛋白二硫化物异构酶或能够切割二硫键的类似酶也可有助于细胞内二硫键的优先切割。据报道,gsh以0.5-10mm的浓度范围存在于细胞中,而相比之下在循环中,gsh或半胱氨酸(最丰富的低分子量硫醇)的浓度却明显更低,为约5。肿瘤细胞(其中不规则血流导致缺氧状态)导致还原酶的活性增强,从而导致甚至更高的谷胱甘肽浓度。在某些实施方案中,含二硫化物的接头的体内稳定性可通过接头的化学修饰例如使用与二硫键相邻的位阻而增强。
包括示例性的含二硫化物接头的adc包括以下结构:
其中d和ab分别代表药物和抗体,n代表与抗体连接的药物接头的数目,r在每次出现时独立地选自例如氢或烷基。在某些实施方案中,增加邻近二硫键的空间位阻增加了接头的稳定性。当一个或多个r基团选自低级烷基如甲基时,例如(ij)和(ii)的结构显示出增加的体内稳定性。
可以使用的另一种类型的可切割接头是被酶特异性切割的接头。这类接头通常是基于肽的或包括充当酶底物的肽区。与化学不稳定的接头相比,基于肽的接头在血浆和细胞外环境中往往更稳定。肽键通常具有良好的血清稳定性,因为溶酶体蛋白水解酶由于内源性抑制剂和相比溶酶体的不利的高血液ph值而在血液中具有非常低的活性。药物从抗体的释放特别是由于溶酶体蛋白酶例如组织蛋白酶和纤溶酶的作用而发生。这些蛋白酶在某些肿瘤细胞中可能以升高的水平存在。
在示例性实施方案中,可切割肽选自四肽,例如gly-phe-leu-gly(seqidno:100)、ala-leu-ala-leu(seqidno:101)或二肽,例如val-cit、val-ala、met-(d)lys、asn-(d)lys、val-(d)asp、phe-lys、ile-val、asp-val、his-val、norval-(d)asp、ala-(d)asp5、met-lys、asn-lys、ile-pro、me3lys-pro、phenylgly-(d)lys、met-(d)lys、asn-(d)lys、pro-(d)lys、met-(d)lys、asn-(d)lys、ammet-(d)lys、asn-(d)lys、awmet-(d)lys和asn-(d)lys。在某些实施方案中,由于较长肽的疏水性,二肽优于较长多肽。
已经描述了用于将药物例如阿霉素、丝裂霉素、喜树碱、吡咯并苯并二氮杂卓、他利霉素和澳瑞他汀/澳瑞他汀家族成员与抗体连接的多种基于二肽的可切割接头(参见dubowchiketal.,1998,j.org.chem.67:1866-1872;dubowchiketal.,1998,bioorg.med.chem.lett.8(21):3341-3346;walkeretal.,2002,bioorg.med.chem.lett.12:217-219;walkeretal.,2004,bioorg.med.chem.lett.14:4323-4327;sutherlandetal.,2013,blood122:1455-1463;和franciscoetal.,2003,blood102:1458-1465,其中每一个通过引用并入本文)。所有这些二肽接头或这些二肽接头的修饰形式可以用于本公开的抗糖-muc1adc中。可以使用的其他二肽接头包括在adc中发现的那些,例如seattlegenetics的brentuximabvendotinsgn-35(adcetristm)、seattlegeneticssgn-75(抗cd-70,val-cit-一甲基澳瑞他汀f(mmaf)、seattlegeneticssgn-cd33a(抗cd-33,val-ala-(sgd-1882))、celldextherapeuticsglembatumumab(cdx-011)(抗nmb,val-cit-一甲基澳瑞他汀e(mmae)和cytogenpsma-adc(psma-adc-1301)(抗psma,val-cit-mmae)。
酶促可切割接头可包括自降解间隔物(self-immolativespacer),以使药物与酶促切割位点在空间上分开。药物与肽接头的直接附接可导致药物的氨基酸加合物的蛋白水解释放,从而削弱其活性。自降解间隔物的使用允许消除酰胺键水解后的完全活性的化学未修饰药物。
一个自降解间隔物是双功能的对氨基苄醇基团,其通过氨基与肽连接,从而形成酰胺键,而含胺药物可以通过氨基甲酸酯官能团附接至接头的苄基羟基(pabc)。所得的前药在蛋白酶介导的切割后被激活,从而导致1,6-消除反应,释放出未修饰的药物、二氧化碳和接头基团的残基。以下方案描绘了对氨基苄基醚的片段化和药物的释放:
其中x-d代表未修饰的药物。
还描述了该自降解基团的杂环变体。参见例如美国专利号7,989,434,其通过引用并入本文。
在一些实施方案中,酶促可切割接头是基于β-葡萄糖醛酸的接头。可以通过溶酶体酶β-葡糖醛酸糖苷酶切割β-葡糖苷酸糖苷键来实现药物的轻松释放。该酶大量存在于溶酶体内,并且在某些肿瘤类型中过表达,而细胞外的酶活性较低。基于β-葡糖醛酸的接头可用于避免由于β-葡糖苷酸的亲水性质而使adc发生聚集的趋势。在一些实施方案中,基于β-葡萄糖醛酸的接头优选作为与疏水性药物连接的adc的接头。以下方案描绘了药物从adc释放以及包含基于β-葡萄糖醛酸的接头的adc:
已描述了多种可切割的基于β-葡萄糖醛酸的接头,其可用于将药物如澳瑞他汀、喜树碱和阿霉素类似物、cbi小沟结合剂和psymberin与抗体连接(参见nolting,chapter5"linkertechnologyinantibody-drugconjugates,"in:antibody-drugconjugates:methodsinmolecularbiology,vol.1045,pp.71-100,laurentducry(ed.),springerscience&businessmedica,llc,2013;jeffreyetal.,2006,bioconjug.chem.17:831-840;jeffreyetal.,2007,bioorg.med.chem.lett.17:2278-2280;和jiangetal.,2005,j.am.chem.soc.127:11254-11255,其中每一个通过引用并入本文)。所有这些基于β-葡萄糖醛酸的接头可以用于本公开的抗糖-muc1adc中。
另外,含有酚基的细胞毒性剂和/或细胞抑制剂可以通过酚氧共价键合至接头。在wo2007/089149中描述的一种这样的接头依赖于以下方法,其中二氨基乙烷“spacelink”与传统的基于“pabo”的自降解基团联合使用以递送酚。接头的切割如下图所示,其中d代表具有酚羟基的细胞毒性剂和/或细胞抑制剂。
可切割接头可包括不可切割的部分或区段,和/或可切割的区段或部分可包含在其他不可切割的接头中以使其可切割。仅作为示例,聚乙二醇(peg)和相关聚合物可在聚合物主链中包括可切割基团。例如,聚乙二醇或聚合物接头可包含一个或多个可切割基团,例如二硫化物、腙或二肽。
可以包含在接头中的其他可降解的键包括通过peg羧酸或活化的peg羧酸与生物活性剂上的醇基反应形成的酯键,其中此类酯基通常在生理条件下水解以释放生物活性剂。可水解降解的键包括但不限于碳酸酯键;由胺和醛反应产生的亚胺键;通过使醇与磷酸基团反应形成的磷酸酯键;作为醛和醇的反应产物的乙缩醛键;作为甲酸酯和醇的反应产物的原酸酯键;以及由亚磷酰胺基团(包括但不限于在聚合物末端的亚磷酰胺基团)和寡核苷酸的5'羟基形成的寡核苷酸键。
在某些实施方案中,接头包含酶促可切割的肽部分,例如,包含结构式(iva)或(ivb)的接头或其盐:
其中:肽表示可被溶酶体酶切割的肽(图示了c→n,未显示羧基和氨基“末端”);t表示包含一个或多个乙二醇单元或亚烷基链或其组合的聚合物;ra选自氢、烷基、磺酸盐/酯和甲基磺酸盐/酯;p为范围为0至5的整数;q为0或1;x为0或1;y为0或1;
在某些实施方案中,肽选自三肽或二肽。在具体的实施方案中,二肽选自val-cit;cit-val;ala-ala;ala-cit;cit-ala;asn-cit;cit-asn;cit-cit;val-glu;glu-val;ser-cit;cit-ser;lys-cit;cit-lys;asp-cit;cit-asp;ala-val;val-ala;phe-lys;val-lys;ala-lys;phe-cit;leu-cit;ile-cit;phe-arg和trp-cit。在某些实施方案中,二肽选自cit-val和ala-val。
可以包含在本公开的抗糖-muc1adc中的根据结构式(iva)的接头的具体示例性实施方案包括以下所示的接头(如所示的,接头包括适于将接头共价连接至抗体的基团):
可以包含在本公开的抗糖-muc1adc中的根据结构式(ivb)的接头的具体示例性实施方案包括以下所示的接头(如所示的,接头包括适于将接头共价连接至抗体的基团):
在某些实施方案中,接头包含酶促可切割的肽部分,例如,包含结构式(ivc)或(ivd)的接头或其盐:
其中:肽表示可被溶酶体酶切割的肽(图示了c→n,未显示羧基和氨基“末端”);t表示包含一个或多个乙二醇单元或亚烷基链或其组合的聚合物;ra选自氢、烷基、磺酸盐/酯和甲基磺酸盐/酯;p为范围为0至5的整数;q为0或1;x为0或1;y为0或1;.x
可以包含在本公开的抗糖-muc1adc中的根据结构式(ivc)的接头的具体示例性实施方案包括以下所示的接头(如所示的,接头包括适于将接头共价连接至抗体的基团):
可以包含在本公开的抗糖-muc1adc中的根据结构式(ivd)的接头的具体示例性实施方案包括以下所示的接头(如所示的,接头包括适于将接头共价连接至抗体的基团):
在某些实施方案中,包含结构式(iva)、(ivb)、(ivc)或(ivd)的接头还包含可通过暴露于酸性介质而切割的碳酸酯部分。在具体的实施方案中,接头通过氧附接至细胞毒性剂和/或细胞抑制剂。
6.2.4.不可切割接头
尽管可切割接头可以提供某些优点,但是包含本公开的抗糖-muc1adc的接头不必需是可切割的。对于不可切割接头,药物的释放不取决于血浆和某些细胞质区室之间的差异特性。假定药物的释放发生在adc通过抗原介导的内吞作用内化并递送至溶酶体区室之后,在该区室中抗体通过细胞内蛋白水解降解而降解至氨基酸水平。该过程释放出药物衍生物,该药物衍生物由药物、接头和与接头共价附接的氨基酸残基形成。与具有可切割接头的缀合物相比,来自具有不可切割接头的缀合物的氨基酸药物代谢物具有更大的亲水性和通常更小的膜渗透性,这导致较少的旁观者效应和较小的非特异性毒性。通常,具有不可切割接头的adc比具有可切割接头的adc在循环中具有更高的稳定性。不可切割接头可以是亚烷基链,或者可以本质上是聚合物,例如基于聚亚烷基二醇聚合物、酰胺聚合物,或者可以包括亚烷基链、聚亚烷基二醇和/或酰胺聚合物的区段。
已经描述了用于将药物连接至抗体的多种不可切割接头。参见jeffreyetal.,2006,bioconjug.chem.17;831-840;jeffreyetal.,2007,bioorg.med.chem.lett.17:2278-2280;andjiangetal.,2005,j.am.chem.soc.127:11254-11255,其中每一个通过引用并入本文。所有这些接头可包括在本公开的抗糖-muc1adc中。
在某些实施方案中,接头在体内是不可切割的,例如根据结构式(via)、(vib)、(vic)或(vid)的接头(如所示的,接头包括适于将接头共价连接至抗体的基团)或其盐:
其中:ra选自氢、烷基、磺酸盐/酯和甲基磺酸盐/酯;rx是包括能够将接头与抗体共价连接的官能团的部分;并且
可以包含在本公开的抗糖-mucladc中的根据结构式(via)-(ivd)的接头的具体示例性实施方案包括以下所示的接头(如所示的,接头包括适于将接头共价连接至抗体的基团,并且
6.2.5.用于使接头和抗体附接的基团
可以使用各种基团将接头药物合成子附接至抗体以产生adc。附接基团本质上可以是亲电的并且包括:马来酰亚胺基团,活化的二硫化物,活性酯,酰胺。如下所述,还存在可以根据本公开使用的与“自稳定”马来酰亚胺和“桥联二硫化物”有关的新兴技术。使用的具体基团将部分取决于抗体的附接位点。
在下面的示意图中描绘了“自稳定”马来酰亚胺基团的一个实例,该基团在抗体缀合条件下自发水解,以提供具有改善的稳定性的adc物质。参见us20130309256a1;以及lyonetal.,naturebiotechpublishedonline,doi:10.1038/nbt.2968。
导致随时间的“dar损失”
sgnmaldpr(马来酰亚胺基二丙基氨基)体系:
polytherics公开了桥接一对衍生自天然铰链二硫键还原的巯基的方法。参见badescuetal.,2014,bioconjugatechem.25:1124-1136。反应如下图所示。该方法的优点是能够通过完全还原igg(产生4对巯基),然后与4当量的烷基化剂反应来合成富集的dar4adc。还声称含有“桥联二硫键”的adc具有增加的稳定性。
类似地,如下所述,已经开发了能够桥接一对巯基的马来酰亚胺衍生物(1,下文)。参见wo2013/085925。
6.2.6.接头选择考虑因素
如技术人员已知的,针对特定adc选择的接头可能受多种因素影响,包括但不限于与抗体的附接位点(例如,lys、cys或其他氨基酸残基)、药物药效团的结构限制和药物的亲脂性。针对adc选择的特定接头应设法平衡特定抗体/药物组合的这些不同因素。有关影响adc中接头选择的因素的综述,参见nolting,chapter5“linkertechnologyinantibody-drugconjugates,”in:antibody-drugconjugates:methodsinmolecularbiology,vol.1045,pp.71-100,laurentducry(ed.),springerscience&businessmedica,llc,2013。
例如,已经观察到adc实现杀伤存在于抗原阳性肿瘤细胞附近的旁观者抗原阴性细胞。adc的旁观者细胞杀伤的机制表明,adc的细胞内加工期间形成的代谢产物可能发挥作用。由抗原阳性细胞中adc代谢产生的中性细胞毒性代谢物似乎在旁观者细胞杀伤中发挥作用,而带电荷的代谢物可防止跨膜扩散到介质中,因此不会影响旁观者杀伤。在某些实施方案中,选择接头以减弱由adc的细胞代谢物引起的旁观者杀伤效应。在某些实施方案中,选择接头以增强旁观者杀伤效应。
在使用和/或储存的条件下,接头的性质也可能影响adc的聚集。通常,文献中报道的adc包含每个抗体分子不超过3-4个药物分子(参见例如,chari,2008,accchemres41:98-107)。由于adc的聚集,尝试获得更高的药物与抗体的比率(“dar”)常常失败,尤其是如果药物和接头都是疏水的(kingetal.,2002,jmedchem45:4336-4343;hollanderetal.,2008,bioconjugatechem19:358-361;burkeetal.,2009bioconjugatechem20:1242-1250)。在许多情况下,高于3-4的dar作为提高效价的手段可以是有益的。在细胞毒性剂和/或细胞抑制剂本质上是疏水的情况下,可能希望选择相对亲水的接头作为减少adc聚集的手段,尤其是在需要大于3-4的dar的情况下。因此,在某些实施方案中,接头掺入了减少在储存和/或使用期间adc的聚集的化学部分。接头可掺入极性或亲水基团,例如带电荷基团或在生理ph下带电荷的基团,以减少adc的聚集。例如,接头可掺入带电荷的基团,例如盐或在生理ph下去质子化例如羧酸盐或质子化例如胺的基团。
已报道产生高达20的dar、可用于使许多细胞毒性剂和/或细胞抑制剂与抗体连接的示例性多价接头描述于wo2009/073445、wo2010/068795、wo2010/138719、wo2011/120053、wo2011/171020、wo2013/096901、wo2014/008375、wo2014/093379、wo2014/093394、wo2014/093640,其内容通过引用整体并入本文。
在具体的实施方案中,如通过尺寸排阻色谱法(sec)所确定的,在储存或使用期间adc的聚集小于约10%。在具体的实施方案中,如通过尺寸排阻色谱法(sec)所确定的,在储存或使用期间adc的聚集小于10%,例如小于约5%、小于约4%、小于约3%、小于约2%、小于约1%、小于约0.5%、小于约0.1%或甚至更小。
6.2.7.制备抗糖-muc1adc的方法
可以使用众所周知的化学方法来合成本公开的抗糖-muc1adc。所选择的化学物质尤其将取决于细胞毒性剂和/或细胞抑制剂的身份、接头和用于将接头连接至抗体的基团。通常,可以根据以下方案制备根据式(i)的adc:
d-l-rx+ab-ry→[d-l-xy]n-ab(i)
其中d、l、ab、xy和n如先前所定义,并且rx和ry表示如上所述的能够彼此形成共价连接的互补基团。
rx和ry基团的身份将取决于用于将合成子d-l-rx连接至抗体的化学方法。通常,所用的化学方法不应改变抗体的完整性,例如其结合靶标的能力。优选地,缀合抗体的结合特性将与未缀合抗体的结合特性非常相似。用于使分子与生物分子例如抗体缀合的多种化学方法和技术是本领域已知的,并且特别是对于抗体而言,是众所周知的。参见例如amonetal.,“monoclonalantibodiesforimmunotargetingofdrugsincancertherapy,”in:monoclonalantibodiesandcancertherapy,reisfeldetal.eds.,alanr.liss,inc.,1985;hellstrometal.,“antibodiesfordrugdelivery,”in:controlleddrugdelivery,robinsonetal.eds.,marceldekker,inc.,2nded.1987;thorpe,“antibodycarriersofcytotoxicagentsincancertherapy:areview,”in:monoclonalantibodies'84:biologicalandclinicalapplications,pincheraetal.,eds.,1985;“analysis,results,andfutureprospectiveofthetherapeuticuseofradiolabeledantibodyincancertherapy,”in:monoclonalantibodiesforcancerdetectionandtherapy,baldwinetal.,eds.,academicpress,1985;thorpeetal.,1982,immunol.rev.62:119-58;pct公开wo89/12624。任何这些化学方法均可用于将合成子与抗体连接。
用于将合成子连接至可接近的赖氨酸残基的许多官能团rx和化学物质是已知的,并且包括例如但不限于nhs-酯和异硫氰酸酯。
用于将合成子连接至半胱氨酸残基的可接近的游离巯基的许多官能团rx和化学物质是已知的,并且包括例如但不限于卤代乙酰基和马来酰亚胺。
然而,缀合化学不限于可获得的侧链基团。通过将适当的小分子与胺连接,可以将侧链例如胺转化为其他有用的基团例如羟基。通过将多功能小分子与抗体的可接近氨基酸残基的侧链缀合,该策略可用于增加抗体上可用连接位点的数量。适于将合成子共价连接至这些“转化的”官能团的官能团rx则包含在合成子中。
抗体也可被工程化以包括用于缀合的氨基酸残基。axupetal.,2012,procnatlacadsciusa.109(40):16101-16106描述了工程化改造抗体以包括在adc的背景下用于缀合药物的非遗传编码氨基酸残基的方法,作为用于将合成子连接至非编码氨基酸的化学物质和官能团也是如此。
通常,合成子与抗体的氨基酸残基的侧链连接,该侧链包括例如可接近的赖氨酸残基的伯氨基或可接近的半胱氨酸残基的巯基。游离巯基可通过还原链间二硫键获得。
对于其中ry是巯基的连接(例如,当rx是马来酰亚胺时),通常首先将抗体完全或部分还原以破坏半胱氨酸残基之间的链间二硫化物桥。
不参与二硫化物桥的半胱氨酸残基可通过一个或多个密码子的突变而工程化为抗体。还原这些未配对的半胱氨酸产生适于缀合的巯基。用于掺入工程化半胱氨酸的优选位置包括例如但不限于人igg1重链上的位置s112c、s113c、a114c、s115c、a176c、5180c、s252c、v286c、v292c、s357c、a359c、s398c、s428c(kabat编号)和人igκ轻链上的位置v110c、s114c、s121c、s127c、s168c、v205c(kabat编号)(参见例如,美国专利号7,521,541、美国专利号7,855,275和美国专利号8,455,622)。
如本领域技术人员将理解的,与抗体分子连接的细胞毒性剂和/或细胞抑制剂的数量可以变化,以使得adc的集合在性质上可以是异质的,其中一些抗体包含一种连接剂,一些抗体包含两种,一些抗体包含三种等(并且一些抗体不包含连接剂)。异质性的程度将尤其取决于用于连接细胞毒性剂和/或细胞抑制剂的化学方法。例如,在还原抗体以产生用于附接的巯基的情况下,通常产生每个分子具有零、2、4、6或8个连接剂的抗体的异质混合物。此外,通过限制附接化合物的摩尔比,通常产生每个分子具有零、1、2、3、4、5、6、7或8个连接剂的抗体。因此,将会理解,取决于上下文,所述dar可以是抗体集合的平均值。例如,“dar4”可以指未经过纯化以分离特定dar峰并且可以包含adc分子的异质混合物的adc制剂,其中每个抗体具有不同数量的细胞抑制剂和/或细胞毒性剂(例如,每个抗体0、2、4、6、8个试剂),但平均药物与抗体比为4。类似地,在一些实施方案中,“dar2”是指异质adc制剂,其中平均药物与抗体比为2。
当期望富集的制剂时,可以通过纯化异质混合物,例如通过柱色谱法,例如疏水相互作用色谱法,来获得具有确定数量的连接的细胞毒性剂和/或细胞抑制剂的抗体。
如本领域已知的,可以通过多种方法评估纯度。作为具体的实例,可以通过hplc或其他色谱法来分析adc制剂,并通过分析所得峰的曲线下面积来评估纯度。
6.3嵌合抗原受体
本公开提供了包含本文所述的抗糖-muc1抗体或抗原结合片段的嵌合抗原受体(car)。
本公开的car通常包含可操作地连接至跨膜结构域的胞外结构域,该跨膜结构域又可操作地连接至用于信号传导的胞内结构域。
本公开的car的胞外结构域包含抗糖-muc1抗体或抗原结合片段的序列(例如,如6.1节或实施方案1至145中所述)。
示例性的跨膜结构域序列和胞内结构域序列分别在6.3.1节和6.3.2节中描述。
本文所述的几种融合蛋白(例如,实施方案152和153)是car,并且car相关的公开内容适用于此类融合蛋白。
6.3.1.跨膜结构域
关于跨膜结构域,可以将car设计为包含与car的胞外结构域可操作地连接(例如融合)的跨膜结构域。
跨膜结构域可以源自天然来源或合成来源。如果来源是天然的,则该结构域可以源自任何膜结合蛋白或跨膜蛋白。在本公开中特别使用的跨膜区可以衍生自t细胞受体的α链、β链或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154(即,至少包含上述链的跨膜区)。在某些情况下,也可以使用各种人铰链,包括人ig(免疫球蛋白)铰链。
在一个实施方案中,跨膜结构域是合成的(即,非天然存在的)。合成的跨膜结构域的实例是主要包含疏水残基如亮氨酸和缬氨酸的肽。优选地,在合成的跨膜结构域的每个末端存在苯丙氨酸、色氨酸和缬氨酸的三联体。任选地,短的寡肽或多肽接头,优选长度为2至10个氨基酸的寡肽或多肽接头,可以在car的跨膜结构域和细胞质信号传导结构域之间形成连接。甘氨酸-丝氨酸二联体提供了特别合适的接头。
在一个实施方案中,本公开的car中的跨膜结构域是cd8跨膜结构域。在一个实施方案中,cd8跨膜结构域包含氨基酸序列ylhlgalgrdlwgpspvtgyhpll(seqidno:102)。
在一个实施方案中,本公开的car中的跨膜结构域是cd28跨膜结构域。在一个实施方案中,cd28跨膜结构域包含氨基酸序列fwvlvvvggvlacysllvtvafiifwv(seqidno:103)。
在一些实施方案中,本公开的car中的跨膜结构域包含cd8a铰链结构域。在一个实施方案中,cd8a铰链结构域包含氨基酸序列tttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfac(seqidno:104)。
6.3.2.胞内结构域
本公开的car的胞内信号传导结构域负责激活表达car的免疫细胞的至少一种正常效应子功能。术语“效应子功能”是指细胞的专门功能。例如,t细胞的效应子功能可以是细胞溶解活性或辅助活性,包括细胞因子的分泌。因此,术语“胞内信号传导结构域”是指蛋白质的一部分,其转导效应子功能信号并指导细胞执行专门的功能。尽管通常可以使用整个胞内信号传导结构域,但在许多情况下,不必使用整条链。就使用胞内信号传导结构域的截短部分而言,只要截短部分转导效应子功能信号,就可以使用此类截短部分代替完整链。因此,术语胞内信号传导结构域意在包括足以转导效应子功能信号的胞内信号传导结构域的任何截短部分。
用于本公开的car中的胞内信号传导结构域的优选实例包括t细胞受体(tcr)和协同作用以在抗原受体结合后启动信号转导的共受体的细胞质序列,以及这些序列的任何衍生物或变体和具有相同功能能力的任何合成序列。
仅通过tcr产生的信号可能不足以完全激活t细胞,并且还需要次级信号或共刺激信号。因此,可以说t细胞活化是由两类不同的细胞质信号传导序列介导的:通过tcr启动抗原依赖性初级活化的序列(初级细胞质信号传导序列)和以抗原非依赖性方式作用以提供次级信号或共刺激信号的序列(次级细胞质信号传导序列)。
初级细胞质信号传导序列以刺激性方式或抑制性方式调节tcr复合物的初级活化。以刺激性方式作用的初级细胞质信号传导序列可以包含信号传导基序,该基序被称为基于免疫受体酪氨酸的活化基序或itam。
在本公开的car中特别使用的包含itam的初级细胞质信号传导序列的实例包括衍生自tcrζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d的那些。特别优选地,本公开的car中的细胞质信号传导分子包含来自cd3-ζ的细胞质信号传导序列。
在优选的实施方案中,car的细胞质结构域被设计成本身包括或者与任何其他期望的可用于本公开的car中的细胞质结构域组合包括含有itam的初级细胞质信号传导序列结构域(例如,cd3-ζ的细胞质信号传导序列结构域)。例如,car的细胞质结构域可以包括cd3ζ链部分和共刺激信号传导区。
共刺激信号传导区是指包含共刺激分子的胞内结构域的car的部分。共刺激分子是除淋巴细胞对抗原的有效应答所需的抗原受体或其配体以外的细胞表面分子。此类分子的实例包括cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、与cd83特异性结合的配体等。
本公开的car的细胞质信号传导部分内的细胞质信号传导序列可以以随机或指定顺序彼此连接。任选地,短的寡肽或多肽接头,优选长度为2至10个氨基酸的寡肽或多肽接头,可以形成连接。甘氨酸-丝氨酸二联体提供了特别合适的接头。
在一个实施方案中,细胞质结构域包含cd3-ζ的信号传导结构域和cd28的信号传导结构域。在另一个实施方案中,细胞质结构域包含cd3-ζ的信号传导结构域和4-1bb的信号传导结构域。
6.4核酸、重组载体和宿主细胞
本公开涵盖编码抗糖-muc1抗体的免疫球蛋白轻链和重链基因的核酸分子、包含此类核酸的载体和能够产生本公开的抗糖-muc1抗体的宿主细胞。在某些方面,核酸分子编码并且宿主细胞能够表达本公开的抗糖-muc1抗体和抗体结合片段(例如,如6.1节和实施方案1至145中所述)以及融合蛋白(例如,如实施方案146-151所述)和包含它们的嵌合抗原受体(例如,如6.3节和实施方案152-153所述)。在实施方案166-168中描述了本公开的示例性载体,在实施方案169-172中描述了示例性宿主细胞。
可以通过在宿主细胞中重组表达免疫球蛋白轻链和重链基因来制备本公开的抗糖-muc1抗体。为了重组表达抗体,用一种或多种携带编码抗体的免疫球蛋白轻链和重链的dna片段的重组表达载体转染宿主细胞,以使轻链和重链在宿主细胞中表达,并任选地分泌到培养宿主细胞的培养基中,从该培养基中可以回收抗体。使用标准的重组dna方法来获得抗体的重链和轻链基因,将这些基因整合到重组表达载体中,然后将载体引入宿主细胞中,例如在以下文献中所述的那些:molecularcloning;alaboratorymanual,secondedition(sambrook,fritschandmaniatis(eds),coldspringharbor,n.y.,1989),currentprotocolsinmolecularbiology(ausubel,f.m.etal.,eds.,greenepublishingassociates,1989)和美国专利号4,816,397。
为了产生编码此类抗糖-muc1抗体的核酸,首先获得编码轻链和重链可变区的dna片段。这些dna可以通过扩增和修饰编码轻链和重链可变序列的种系dna或cdna而获得,例如使用聚合酶链反应(pcr)。人重链和轻链可变区基因的种系dna序列是本领域已知的(参见例如“vbase”人种系序列数据库;还参见kabatetal.,1991,sequencesofproteinsofimmunologicalinterest,fifthedition,u.s.departmentofhealthandhumanservices,nihpublicationno.91-3242;tomlinsonetal.,1992,j.mol.biol.22t:116-198;和coxetal.,1994,eur.j.immunol.24:827-836;其中每一个的内容通过引用并入本文。
一旦获得编码抗糖-muc1抗体相关的vh和vl区段的dna片段,就可以通过标准重组dna技术进一步操作这些dna片段,例如将可变区基因转化为全长抗体链基因、转化为fab片段基因或scfv基因。在这些操作中,将编码vh或vl的dna片段可操作地连接至编码另一蛋白质例如抗体恒定区或柔性接头的另一dna片段。在本文中使用的术语“可操作地连接”意在指将两个dna片段连接在一起,以使由两个dna片段编码的氨基酸序列保持在框内。
可以通过将编码vh的dna与编码重链恒定区(ch1、ch2、ch3和任选的ch4)的另一dna分子可操作地连接,使编码vh区的分离的dna转化为全长重链基因。人重链恒定区基因的序列在本领域中是已知的(参见例如,kabatetal.,1991,sequencesofproteinsofimmunologicalinterest,fifthedition,u.s.departmentofhealthandhumanservices,nihpublicationno.91-3242),并且包含这些区的dna片段可以通过标准pcr扩增获得。重链恒定区可以是igg1、igg2、igg3、igg4、iga、ige、igm或igd恒定区,但是在某些实施方案中是igg1或igg4恒定区。对于fab片段重链基因,可以将编码vh的dna与仅编码重链ch1恒定区的另一dna分子可操作地连接。
可以通过将编码vl的dna与编码轻链恒定区cl的另一dna分子可操作地连接,使编码vl区的分离的dna转化为全长轻链基因(以及fab轻链基因)。人轻链恒定区基因的序列在本领域中是已知的(参见例如,kabatetal.,1991,sequencesofproteinsofimmunologicalinterest,fifthedition,u.s.departmentofhealthandhumanservices,nihpublicationno.91-3242),并且包含这些区的dna片段可以通过标准pcr扩增获得。轻链恒定区可以是κ或λ恒定区,但在某些实施方案中是κ恒定区。
为了产生scfv基因,可以将编码vh和vl的dna片段与编码柔性接头例如编码氨基酸序列(gly4~ser)3的另一片段可操作地连接,使得vh和vl序列可以表达为连续的单链蛋白,其中vh和vl区通过柔性接头连接(参见例如birdetal.,1988,science242:423-426;hustonetal.,1988,proc.natl.acad.sci.usa85:5879-5883;mccaffertyetal.,1990,nature348:552-554)。
为了表达本公开的抗糖-muc1抗体,将如上所述获得的编码部分或全长轻链和重链的dna插入表达载体,使得基因可操作地连接至转录和翻译控制序列。在本文中,术语“可操作地连接”意在指将抗体基因连接到载体中,使得载体内的转录和翻译控制序列发挥其预期的调节抗体基因的转录和翻译的功能。选择表达载体和表达控制序列以使其与所使用的表达宿主细胞相容。可以将抗体轻链基因和抗体重链基因插入分开的载体中,或更典型地,将两个基因插入相同的表达载体中。
通过标准方法(例如,抗体基因片段和载体上的互补限制性位点的连接,或者如果不存在限制性位点,则进行平末端连接)将抗体基因插入表达载体中。在插入抗糖-muc1抗体相关的轻链或重链序列之前,表达载体可以已经携带抗体恒定区序列。例如,将抗糖-muc1单克隆抗体相关的vh和vl序列转化为全长抗体基因的一种方法是将它们分别插入已经编码重链恒定区和轻链恒定区的表达载体中,使得vh区段可操作地连接至载体内的ch区段,而vl区段可操作地连接至载体内的cl区段。另外地或替代地,重组表达载体可以编码促进从宿主细胞分泌抗体链的信号肽。可以将抗体链基因克隆到载体中,使得信号肽在框内连接至抗体链基因的氨基末端。信号肽可以是免疫球蛋白信号肽或异源信号肽(即,来自非免疫球蛋白的信号肽)。
除抗体链基因外,本公开的重组表达载体还携带控制抗体链基因在宿主细胞中的表达的调控序列。术语“调控序列”旨在包括启动子、增强子和控制抗体链基因的转录或翻译的其他表达控制元件(例如,聚腺苷酸化信号)。此类调控序列描述于例如goeddel,geneexpressiontechnology:methodsinenzymology185,academicpress,sandiego,calif.,1990。本领域技术人员将认识到,表达载体的设计,包括调控序列的选择,可以取决于例如待转化的宿主细胞的选择、所需蛋白质的表达水平等因素。用于哺乳动物宿主细胞表达的合适调控序列包括指导哺乳动物细胞中高水平蛋白表达的病毒元件,例如衍生自巨细胞病毒(cmv)(例如cmv启动子/增强子)、猿猴病毒40(sv40)(例如sv40启动子/增强子)、腺病毒(例如,腺病毒主要晚期启动子(admlp))和多瘤病毒的启动子和/或增强子。对于病毒调控元件及其序列的进一步描述,参见例如,stinski的美国专利号5,168,062、bell等人的美国专利号4,510,245和schaffner等人的美国专利号4,968,615。
除了抗体链基因和调控序列之外,本公开的重组表达载体还可以携带其他序列,例如调节载体在宿主细胞中的复制的序列(例如复制起点)和可选择标记基因。可选择标记基因有助于选择已引入载体的宿主细胞(参见例如,axel等人的美国专利号4,399,216、4,634,665和5,179,017)。例如,通常,可选择标记基因在已引入载体的宿主细胞上赋予对药物如g418、潮霉素或甲氨蝶呤的抗性。合适的可选择标记基因包括二氢叶酸还原酶(dhfr)基因(用于具有甲氨蝶呤选择/扩增的dhfr-宿主细胞中)和neo基因(用于g418选择)。为了表达轻链和重链,通过标准技术将编码重链和轻链的表达载体转染到宿主细胞中。术语“转染”的各种形式旨在包括通常用于将外源dna引入原核或真核宿主细胞中的多种技术,例如电穿孔、脂质转染、磷酸钙沉淀、deae-葡聚糖转染等。
有可能在原核或真核宿主细胞中表达本公开的抗体。在某些实施方案中,抗体的表达在正确折叠且具有免疫活性的抗体的最佳分泌的真核细胞例如哺乳动物宿主细胞中进行。用于表达本公开的重组抗体的示例性哺乳动物宿主细胞包括中国仓鼠卵巢(cho细胞)(包括dhfr-cho细胞,描述于urlaubandchasin,1980,proc.natl.acad.sci.usa77:4216-4220,与dhfr可选择标记一起使用,例如,如kaufmanandsharp,1982,mol.biol.159:601-621中所述)、nso骨髓瘤细胞、cos细胞和sp2细胞。当将编码抗体基因的重组表达载体引入哺乳动物宿主细胞时,通过将宿主细胞培养足以允许抗体在宿主细胞中表达或允许抗体分泌到宿主细胞生长的培养基中的时间段来产生抗体。可以使用标准蛋白质纯化方法从培养基回收抗体。宿主细胞还可以用于产生完整抗体的部分,例如fab片段或scfv分子。应当理解,以上过程的变型在本公开的范围内。例如,可以期望用编码本公开的抗糖-muc1抗体的轻链或重链(但不是两者)的dna转染宿主细胞。
为了表达本公开的car,例如如6.3节以及实施方案152和153中所述,优选宿主细胞是t细胞,优选人t细胞。在一些实施方案中,当细胞与肿瘤细胞上的muc1交联时,宿主细胞表现出抗肿瘤免疫性。在6.4.1节中描述了产生本公开的t细胞的详细方法。
重组dna技术也可以用于去除编码结合糖muc1所不需要的轻链和重链中的一个或两个的dna的部分或全部。由这种截短的dna分子表达的分子也被本公开的抗体所涵盖。
为了重组表达本公开的抗糖-muc1抗体,可以用本公开的两个表达载体共转染宿主细胞,其中第一载体编码重链衍生的多肽,第二载体编码轻链衍生的多肽。这两个载体可以包含相同的可选择标记,或者它们各自可以包含单独的可选择标记。或者,可以使用编码重链和轻链多肽两者的单个载体。
一旦核酸编码抗糖-muc1抗体一个或多个部分,可以将进一步的改变或突变引入编码序列,例如以产生编码具有不同cdr序列的抗体、对fc受体亲和力降低的抗体、或不同亚类的抗体的核酸。
还可以通过化学合成(例如,通过solidphasepeptidesynthesis,2nded.,1984thepiercechemicalco.,rockford,ill.中描述的方法)产生本公开的抗糖-muc1抗体。还可以使用无细胞平台产生变体抗体(参见例如,chuetal.,biochemiano.2,2001(rochemolecularbiologicals)和murrayetal.,2013,currentopinioninchemicalbiology,17:420-426)。
一旦通过重组表达产生了本公开的抗糖-muc1抗体,就可以通过本领域已知的用于纯化免疫球蛋白分子的任何方法进行纯化,例如,通过色谱法(例如,离子交换色谱、亲和色谱和分级柱色谱(sizingcolumnchromatography))、离心、差异溶解度或通过任何其他用于纯化蛋白质的标准技术。此外,本公开的抗糖-muc1抗体和/或结合片段可以与本文所述或本领域已知的异源多肽序列融合,以促进纯化。
分离后,如果需要,可以例如通过高效液相色谱法(参见例如,fisher,laboratorytechniquesinbiochemistryandmolecularbiology,workandburdon,eds.,elsevier,1980)或通过superdextm75柱上的凝胶过滤色谱(瑞典乌普萨拉pharmaciabiotechab)进一步纯化抗糖-muc1抗体。
6.4.1.t细胞中car的重组产生
在一些实施方案中,使用逆转录病毒或慢病毒载体将编码本公开的抗糖-muc1car的核酸递送到细胞中。可以使用转导的细胞作为运送体或使用包封的、结合的或裸露的载体的无细胞局部或全身递送将表达car的逆转录病毒和慢病毒载体递送到不同类型的真核细胞以及组织和整个生物体。所使用的方法可以用于需要或足以稳定表达的任何目的。
在其他实施方案中,使用体外转录的mrna将car序列递送到细胞中。可以使用转染的细胞作为运送体或使用包封的、结合的或裸露的mrna的无细胞局部或全身递送将体外转录的mrnacar递送到不同类型的真核细胞以及组织和整个生物体。所使用的方法可以用于需要或足以瞬时表达的任何目的。
在另一个实施方案中,所期望的car可以通过转座子在细胞中表达。
本公开的rna转染方法的一个优点在于rna转染基本上是瞬时的且无载体:rna转基因可以被递送至淋巴细胞并在简要的体外细胞活化后作为最小表达盒而不需要任何其他病毒序列在淋巴细胞中表达。在这些条件下,转基因整合到宿主细胞基因组中是不可能的。由于rna的转染效率及其均匀修饰整个淋巴细胞群的能力,因此无需克隆细胞。
用体外转录的rna(ivt-rna)对t细胞进行遗传修饰利用了两种不同的策略,这两种策略已在各种动物模型中进行了连续测试。通过脂质转染或电穿孔用体外转录的rna转染细胞。优选地,期望使用各种修饰来稳定ivt-rna,以实现转移的ivt-rna的延长表达。
一些ivt载体在文献中是已知的,其以标准化方式用作体外转录的模板,并且已经以产生稳定的rna转录物的方式进行了遗传修饰。目前,本领域中使用的方案基于具有以下结构的质粒载体:能够进行rna转录的5'rna聚合酶启动子,随后是在3'和/或5'侧接非翻译区(utr)的目的基因,和包含50-70a核苷酸的3'聚腺苷酸盒。在体外转录之前,通过ii型限制性酶(识别序列对应于切割位点)将环状质粒线性化至聚腺苷酸盒的下游。因此,聚腺苷酸盒对应于转录物中的后面的poly(a)序列。该程序的结果是,一些核苷酸在线性化后保留为酶切割位点的一部分,并在3'端延伸或掩盖了poly(a)序列。尚不清楚这种非生理性的突出是否影响从此类构建体细胞内产生的蛋白质的量。
与更加传统的质粒或病毒方法相比,rna具有多个优势。从rna来源表达基因不需要转录,并且在转染后迅速产生蛋白质产物。此外,由于rna仅需要进入细胞质而不需要进入细胞核,因此典型的转染方法导致极高的转染率。另外,基于质粒的方法要求驱动目的基因表达的启动子在被研究的细胞中具有活性。
在另一个方面,可以通过电穿孔将rna构建体递送至细胞中。参见例如,如us2004/0014645、us2005/0052630a1、us2005/0070841a1、us2004/0059285a1、us2004/0092907a1中所教导的通过电穿孔将核酸构建体递送至哺乳动物细胞中的制剂和方法。在相关研究文献以及该领域中的许多专利和申请中,通常已知各种参数,包括任何已知细胞类型的电穿孔所需的电场强度。参见例如美国专利号6,678,556、美国专利号7,171,264和美国专利号7,173,116。用于电穿孔的治疗应用的装置可商购获得,例如,medpulsertmdna电穿孔治疗系统(inovio/genetronics,sandiego,calif.),并且描述于例如美国专利号6,567,694、美国专利号6,516,223、美国专利号5,993,434、美国专利号6,181,964、美国专利号6,241,701、和美国专利号6,233,482;电穿孔也可用于体外转染细胞,如us20070128708a1中所述。电穿孔也可以用于将核酸体外递送至细胞中。因此,利用本领域技术人员已知的许多可用装置和电穿孔系统中的任何一种,电穿孔介导包括表达构建体的核酸施用至细胞中,提供了用于将目的rna递送至靶细胞的令人兴奋的新手段。
6.4.1.1t细胞的来源
在扩增和遗传修饰之前,从受试者获得t细胞的来源。术语“受试者”旨在包括可以引发免疫应答的活生物体(例如,哺乳动物)。受试者的实例包括人、狗、猫、小鼠、大鼠及其转基因物种。优选地,受试者是人。
t细胞可以从许多来源,包括外周血单个核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸腔积液、脾组织以及肿瘤获得。在本公开的某些实施方案中,可以使用本领域中可用的任何数量的t细胞系。在本公开的某些实施方案中,可以使用本领域技术人员已知的任何数量的技术如ficolltm分离,从采自受试者的单位血液获得t细胞。在一个优选的实施方案中,通过单采术(apheresis)从个体的循环血液中获得细胞。单采术产物通常包含淋巴细胞,包括t细胞、单核细胞、粒细胞、b细胞、其他有核白细胞、红细胞和血小板。在一个实施方案中,可以洗涤通过单采术收集的细胞以去除血浆部分,并将细胞放置于适当的缓冲液或介质中以进行后续处理步骤。在本公开的一个实施方案中,用磷酸盐缓冲盐水(pbs)洗涤细胞。在替代实施方案中,洗涤溶液缺少钙,并且可缺少镁,或者可缺少许多(如果不是全部的话)二价阳离子。再次,令人惊讶地,在不存在钙的情况下,初始活化步骤导致放大的活化。如本领域普通技术人员将容易理解的,洗涤步骤可以通过本领域技术人员已知的方法来完成,例如按照制造商的说明,通过使用半自动“流通式”离心机(例如cobe2991细胞处理器,baxtercytomate或haemoneticscellsaver5)。洗涤后,可将细胞重悬于多种生物相容的缓冲液中,例如无ca、无mg的pbs,plasmalytea或其他含或不含缓冲液的盐溶液。或者,可以去除单采术样品的不期望组分,并将细胞直接重悬于培养基中。
在另一实施方案中,通过溶解红细胞并消耗单核细胞,例如通过percolltm梯度离心或通过逆流离心淘析从外周血单核细胞分离t细胞。可以通过正或负分选技术进一步分离t细胞的特定亚群,例如cd3+、cd28'、cd4+、cd8+、cd45ra+和cd45ro+t细胞。例如,在一个实施方案中,通过与抗cd3/抗cd28(即3×28)缀合的珠,例如
可以使用针对负选择的细胞所特有的表面标志物的抗体组合来完成通过负选择进行的t细胞群富集。一种方法是细胞分选和/或经由负磁性免疫黏附或流式细胞术(其使用针对存在于经负选择的细胞上的细胞表面标志物的单克隆抗体混合物)进行分选。例如,为了通过负选择来富集cd4+细胞,单克隆抗体混合物通常包括针对cd14、cd20、cd11b、cd16、hla-dr和cd8的抗体。在某些实施方案中,可能期望富集或正面选择通常表达cd4+、cd25+、cd62lhi、gitr+和foxp3+的调节性t细胞。替代地,在某些实施方案中,通过抗c25缀合的珠或其他类似的选择方法消耗t调节细胞。
为了通过正或负选择来分离期望的细胞群,可以改变细胞和表面(例如颗粒,如珠)的浓度。在某些实施方案中,可能期望显著降低珠和细胞混合在一起的体积(即,增加细胞的浓度),以确保细胞和珠的最大接触。例如,在一个实施方案中,使用20亿个细胞/ml的浓度。在一个实施方案中,使用10亿个细胞/ml的浓度。在另一个实施方案中,使用大于1亿个细胞/ml。在另一个实施方案中,使用1000、1500、2000、2500、3000、3500、4000、4500或5000万个细胞/ml的细胞浓度。在又一个实施方案中,使用7500万个细胞/ml、8000万个细胞/ml、8500万个细胞/ml、9000万个细胞/ml、9500万个细胞/ml或1亿个细胞/ml的细胞浓度。在其他实施方案中,使用1.25或1.5亿个细胞/ml的浓度。使用高浓度可导致增加的细胞产量、细胞活化和细胞扩增。此外,使用高细胞浓度可以更有效地捕获可能弱表达目的靶抗原的细胞,例如cd28阴性t细胞,或捕获来自存在许多肿瘤细胞(即,白血病血液,肿瘤组织等)的样品的细胞。这样的细胞群可具有治疗价值并且将是期望获得的。例如,使用高浓度的细胞可以更有效地选择通常具有较弱的cd28表达的cd8+t细胞。
在相关的实施方案中,可能期望使用较低的细胞浓度。通过显著稀释t细胞和表面(例如颗粒,例如珠)的混合物,颗粒和细胞之间的相互作用被最小化。这选择了表达大量期望抗原以与颗粒结合的细胞。例如,与稀释浓度的cd8+t细胞相比,cd4+t细胞表达更高水平的cd28,并且更有效地被捕获。在一个实施方案中,所使用的细胞浓度为5x106/ml。在其他实施方案中,所使用的浓度可以为约1x105/ml至1x106/ml,以及介于两者之间的任何整数值。
在其他实施方案中,可以在2-10℃或在室温下在旋转器上以不同的速度将细胞孵育不同的时间长度。
用于刺激的t细胞也可以在洗涤步骤后冷冻。希望不受理论的束缚,冷冻和随后的解冻步骤通过去除细胞群中的粒细胞和某种程度上的单核细胞而提供了更均匀的产物。在去除血浆和血小板的洗涤步骤之后,可以将细胞悬浮于冷冻溶液中。尽管许多冷冻溶液和参数是本领域已知的,并且在此情况下将会是有用的,但一种方法涉及使用包含20%dmso和8%人血清白蛋白的pbs,或包含10%右旋糖酐40和5%右旋糖、20%人血清白蛋白和7.5%dmso的培养基,或31.25%plasmalyte-a、31.25%右旋糖、0.45%nacl、10%右旋糖酐40和5%右旋糖,20%人血清白蛋白和7.5%dmso或含有例如hespan和plasmalytea的其他合适的细胞冷冻培养基,然后以每分钟1°的速率将细胞冷冻至-80℃,并储存在液氮储存罐的气相中。可以使用其他控制冷冻的方法以及在-20℃或在液氮中立即进行非控制冷冻。
在某些实施方案中,如本文所述将冷冻保存的细胞解冻并洗涤,并在使用本公开的方法活化之前使其在室温下静置一小时。
在本公开的上下文中还预期在可能需要如本文所述的扩增细胞之前的时间段从受试者收集血液样品或单采术产物。这样,可以在任何必要的时间点收集待扩增的细胞的来源,并将所需的细胞例如t细胞分离并冷冻,以用于后续的多种疾病或病症(例如本文所述的那些)的t细胞疗法中,该多种疾病或病症受益于t细胞疗法。在一个实施方案中,血液样品或单采术样品取自总体上健康的受试者。在某些实施方案中,血液样品或单采术样品取自总体上健康的受试者,该受试者具有发展为疾病的风险但尚未发展为疾病,并分离和冷冻目的细胞以备后续使用。在某些实施方案中,可以将t细胞扩增、冷冻并在以后的时间使用。在某些实施方案中,在诊断如本文所述特定疾病之后不久但在任何治疗之前从患者收集样品。在另一个实施方案中,在任何数量的相关治疗方式(包括但不限于采用例如那他珠单抗,依法珠单抗,抗病毒剂,化学疗法,放射,免疫抑制剂例如环孢菌素、硫唑嘌呤、甲氨蝶呤、麦考酚酯和fk506,抗体,或其他免疫消融剂例如campath,抗cd3抗体,cytoxan,氟达拉滨,环孢菌素,fk506,雷帕霉素,麦考酚酸,类固醇,fr901228和辐射的试剂进行治疗)之前,从受试者的血液样品或单采术样品分离细胞。这些药物抑制钙依赖性磷酸酶钙调磷酸酶(环孢霉素和fk506)或抑制对生长因子诱导的信号传导重要的p70s6激酶(雷帕霉素)。(liuetal.,cell66:807-815,1991;hendersonetal.,immun.73:316-321,1991;biereretal.,curr.opin.immun.5:763-773,1993)。在另一个实施方案中,为患者分离细胞并冷冻,以供后续(例如,之前、同时或之后)与使用化学治疗剂例如氟达拉滨、外部射束放射疗法(xrt)、环磷酰胺的骨髓或干细胞移植或t细胞消融疗法联合使用。
在本公开的另一个实施方案中,在治疗后直接从患者获得t细胞。在这方面,已经观察到,在某些癌症治疗之后,特别是在用损害免疫系统的药物治疗之后,在患者通常会从治疗中恢复的时期内的治疗后不久,获得的t细胞的质量可能是最佳的或具有改善的离体扩增能力。同样,在使用本文所述的方法进行离体操作后,这些细胞可以处于增强的移植和体内扩增的优选状态。因此,预期在本公开的上下文中在恢复阶段期间收集血细胞,包括t细胞、树突状细胞或造血谱系的其他细胞。此外,在某些实施方案中,动员(例如,用gm-csf动员)和调理方案可用于在受试者中产生其中特定细胞类型的重新聚集、再循环、再生和/或扩增是有利的状态,尤其是在治疗后确定的时间范围内。示例性的细胞类型包括t细胞、b细胞、树突状细胞和免疫系统的其他细胞。
6.4.1.2t细胞的活化和扩增
通常使用例如以下文献中所述的方法活化和扩增t细胞:美国专利号6,352,694;6,534,055;6,905,680;6,692,964;5,858,358;6,887,466;6,905,681;7,144,575;7,067,318;7,172,869;7,232,566;7,175,843;5,883,223;6,905,874;6,797,514;6,867,041;和美国专利申请公开号20060121005。
通常,本公开的t细胞通过与其上附着有刺激cd3/tcr复合物相关信号的试剂和刺激t细胞表面上的共刺激分子的配体的表面接触而扩增。特别地,可以如本文所述刺激t细胞群,例如通过与固定在表面上的抗cd3抗体或其抗原结合片段或抗cd2抗体接触,或通过与同钙离子载体缀合的蛋白激酶c活化剂(例如,苔藓抑素)接触来刺激t细胞群。为了共刺激t细胞表面上的辅助分子,使用结合该辅助分子的配体。例如,可以在适于刺激t细胞增殖的条件下使t细胞群与抗cd3抗体和抗cd28抗体接触。为了刺激cd4+t细胞或cd8+t细胞的增殖,使用抗cd3抗体和抗cd28抗体。抗cd28抗体的实例包括9.3、b-t3、xr-cd28(diaclone,besancon,france),也可以使用本领域中其他通常已知的方法(bergetal.,transplantproc.30(8):3975-3977,1998;haanenetal.,j.exp.med.190(9):13191328,1999;garlandetal.,j.immunolmeth.227(1-2):53-63,1999)。
在某些实施方案中,可以通过不同的方案提供t细胞的初级刺激信号和共刺激信号。例如,提供每个信号的试剂可以在溶液中或偶联至表面。当偶联至表面时,试剂可以偶联至同一表面(即,以“顺式”形式)或偶联至独立的表面(即,以“反式”形式)。或者,一种试剂可偶联至表面,而另一种试剂在溶液中。在一个实施方案中,提供共刺激信号的试剂与细胞表面结合,并且提供初级激活信号的试剂在溶液中或偶联至表面。在某些实施方案中,两种试剂都可以在溶液中。在另一个实施方案中,试剂可以是可溶形式,然后交联至表面,例如表达fc受体的细胞或抗体或将会结合试剂的其他结合剂。就此而言,参见例如,美国专利申请公开号20040101519和20060034810的人工抗原呈递细胞(aapc),该人工抗原呈递细胞(aapc)被设想用于激活和扩增本公开中的t细胞。
在一个实施方案中,两种试剂固定在珠上,固定在同一珠上,即“顺式”,或固定在分开的珠上,即“反式”。例如,提供初级激活信号的试剂是抗cd3抗体或其抗原结合片段,提供共刺激信号的试剂是抗cd28抗体或其抗原结合片段;并将两种试剂以等分子量共固定在同一珠上。在一个实施方案中,针对cd4+t细胞扩增和t细胞生长,使用1:1比例的与珠结合的每种抗体。在本公开的某些方面,使用与珠结合的抗cd3:cd28抗体的比例,使得与使用1:1的比例观察到的扩增相比,观察到t细胞扩增的增加。在一个具体的实施方案中,与使用1:1的比例观察到的扩增相比,观察到约1至约3倍的增加。在一个实施方案中,与珠结合的cd3:cd28抗体的比例在100:1至1:100的范围内,以及它们之间的所有整数值。在本公开的一方面,与抗cd3抗体相比,更多的抗cd28抗体与颗粒结合,即,cd3:cd28的比率小于1。在本公开的某些实施方案中,与珠结合的抗cd28抗体与抗cd3抗体的比例大于2:1。在一个具体的实施方案中,使用1:100的与珠结合的cd3:cd28抗体比例。在另一个实施方案中,使用1:75的与珠结合的cd3:cd28抗体比例。在又一个实施方案中,使用1:50的与珠结合的cd3:cd28抗体比例。在另一个实施方案中,使用1:30的与珠结合的cd3:cd28抗体比例。在一个优选的实施方案中,使用1:10的与珠结合的cd3:cd28抗体比例。在另一个实施方案中,使用1:3的与珠结合的cd3:cd28抗体比例。在又一个实施方案中,使用3:1的与珠结合的cd3:cd28抗体比例。
颗粒与细胞的比例为1:500至500:1,并且介于它们之间的任何整数值均可用于刺激t细胞或其他靶细胞。如本领域普通技术人员可以容易地理解的,颗粒与细胞的比例可以取决于相对于靶细胞的颗粒大小。例如,小尺寸的珠只能结合几个细胞,而更大的珠可以结合许多细胞。在某些实施方案中,细胞与颗粒的比例为1:100至100:1,以及介于它们之间的任何整数值;在其他实施方案中,该比例包括1:9至9:1,并且介于它们之间的任何整数值也可用于刺激t细胞。如上所述,导致t细胞刺激的抗cd3和抗cd28偶联颗粒与t细胞的比例可以变化,但是某些优选值包括1:100、1:50、1:40、1:30、1:20、1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1和15:1,其中一个优选的比例为每个t细胞至少1:1颗粒。在一个实施方案中,使用1:1或更小的颗粒与细胞的比例。在一个特定的实施方案中,优选的颗粒:细胞比例为1:5。在其他实施方案中,颗粒与细胞的比例可以根据刺激的天数而变化。例如,在一个实施方案中,在第一天,颗粒与细胞的比例为1:1至10:1,并且此后每天或每隔一天将另外的颗粒以从1:1到1:10的最终比例(基于添加当天的细胞计数)添加至细胞,直至10天。在一个具体的实施方案中,在刺激的第一天,颗粒与细胞的比例为1:1,并且在刺激的第三和第五天将其调整为1:5。在另一个实施方案中,基于刺激第一天的最终比例1:1以及刺激第三天和第五天的最终比例1:5,每天或每隔一天添加颗粒。在另一个实施方案中,在刺激的第一天,颗粒与细胞的比例为2:1,并且在刺激的第三和第五天调整为1:10。在另一个实施方案中,基于刺激第一天的最终比例1:1以及刺激第三天和第五天的最终比例1:10,每天或每隔一天添加颗粒。本领域技术人员将意识到,各种其他比例可适用于本公开。特别地,比例将根据颗粒大小以及细胞大小和类型而变化。
在本公开的其他实施方案中,将细胞例如t细胞与试剂包被的珠组合,随后分离珠和细胞,然后培养细胞。在替代的实施方案中,在培养之前,没有分离试剂包被的珠和细胞,而是一起培养。在另一个实施方案中,首先通过施加力例如磁力来浓缩珠和细胞,导致细胞表面标志物的连接增加,从而诱导细胞刺激。
例如,可以通过使附着有抗cd3和抗cd28的顺磁性珠(3x28个珠)接触t细胞来连接细胞表面蛋白。在一个实施方案中,将细胞(例如104至109个t细胞)和珠(例如
在本公开的一个实施方案中,可将混合物培养数小时(约3小时)至约14天或介于它们之间的任何小时整数值。在另一个实施方案中,可以将混合物培养21天。在本公开的一个实施方案中,将珠和t细胞一起培养约八天。在另一个实施方案中,将珠和t细胞一起培养2-3天。可能还需要几个刺激周期,以使t细胞的培养时间可以是60天或更长。适用于t细胞培养的条件包括合适的培养基(例如,最小基本培养基或rpmi培养基1640或x-vivo15,(lonza)),该培养基可包含增殖和活力所需的因子,包括血清(例如胎牛血清或人血清)、白介素2(il-2)、胰岛素、ifn-γ、il-4、il-7、gm-csf、il-10、il-12、il-15、tgfβ和tnf-α或技术人员已知的用于细胞生长的任何其他添加剂。用于细胞生长的其他添加剂包括但不限于表面活性剂,血浆制品(plasmanate)和还原剂,例如n-乙酰基半胱氨酸和2-巯基乙醇。培养基可以包括rpmi1640、aim-v、dmem、mem、α-mem、f-12、x-vivo15和x-vivo20、optimizer,其添加了氨基酸、丙酮酸钠和维生素,无血清或补充有足量的血清(或血浆)或一组确定的激素,和/或足以使t细胞生长和扩增的量的细胞因子。抗生素,例如青霉素和链霉素,仅包括在实验培养物中,而不包括在要注入受试者的细胞培养物中。将靶细胞维持在支持生长所必需的条件下,例如合适的温度(例如37℃)和气氛(例如空气加5%co2)。
暴露于不同刺激时间的t细胞可表现出不同的特征。例如,典型的血液或单采术外周血单核细胞产物具有辅助t细胞群(th,cd4+),该辅助t细胞群大于细胞毒性或抑制性t细胞群(tc,cd8+)。通过刺激cd3和cd28受体进行的t细胞离体扩增,产生了以下t细胞群:在约8-9天之前,该t细胞群主要由th细胞组成,而在约8-9天之后,该t细胞群包含逐渐增加的tc细胞群。因此,取决于治疗目的,向受试者输注主要包含th细胞的t细胞群可能是有利的。类似地,如果已经分离了tc细胞的抗原特异性亚组,则将该亚组扩增至更大的程度可能是有益的。
此外,除了cd4和cd8标志物外,其他表型标志物在细胞扩增过程中也显著变化,但在很大程度上是可再现地变化。因此,这种再现性使得能够针对特定目的定制活化的t细胞产物。
6.5组合物
本公开的抗糖-muc1抗体和/或抗糖-muc1adc可以是包含抗糖-muc1抗体和/或adc以及一种或多种载剂、赋形剂和/或稀释剂的组合物形式。可以将组合物配制成用于特定用途,例如用于兽医用途或人类的药物用途。组合物的形式(例如干粉、液体制剂等)以及所用的赋形剂、稀释剂和/或载剂将取决于抗体和/或adc的预期用途以及治疗用途、给药方式。
对于治疗用途,组合物可以作为包括药学上可接受的载剂的无菌药物组合物的一部分提供。该组合物可以是任何合适的形式(取决于将其施用于患者所需的方法)。可以通过多种途径,例如口服、透皮、皮下、鼻内、静脉内、肌内、肿瘤内、鞘内、外用或局部,将药物组合物施用至患者。在任何给定情况下,最合适的施用途径将取决于特定的抗体和/或adc、受试者、疾病的性质和严重程度以及受试者的身体状况。通常,药物组合物将静脉内或皮下施用。
药物组合物可以方便地以每剂量含有预定量的本公开的抗糖-muc1抗体和/或抗糖-muc1adc的单位剂型存在。单位剂量中包含的抗体和/或adc的量将取决于所治疗的疾病以及本领域众所周知的其他因素。此类单位剂量可以是包含适合于单次施用的量的抗体和/或adc的冻干粉的形式,或液体的形式。干粉单位剂型可以包装在试剂盒中,该试剂盒含有注射器、适量的稀释剂和/或其他用于施用的组分。液体形式的单位剂量可以方便地以预填充有适合于单次施用的量的抗体和/或adc的注射器的形式提供。
药物组合物也可以由包含适合于多次施用的量的adc批量形式提供。
可以通过将具有期望纯度的抗体和/或adc与任选的本领域通常使用的药学上可接受的载剂、赋形剂或稳定剂(所有这些在本文中被称为“载剂”),即缓冲剂、稳定剂、防腐剂、等渗剂、非离子型去污剂、抗氧化剂和其他混杂添加剂混合来制备药物组合物以用于以冻干制剂或水溶液形式储存。参见,remington'spharmaceuticalsciences,第16版(osol,ed.1980)。此类添加剂在所采用的剂量和浓度下应该是对接受者无毒的。
缓冲剂有助于将ph维持在接近生理条件的范围。它们可以以多种浓度存在,但通常以约2mm至约50mm的浓度存在。用于本公开的合适的缓冲剂包括有机酸和无机酸及其盐,例如柠檬酸盐缓冲剂(例如,柠檬酸一钠-柠檬酸二钠混合物、柠檬酸-柠檬酸三钠混合物、柠檬酸-柠檬酸单钠混合物等),琥珀酸盐缓冲剂(例如,琥珀酸-琥珀酸一钠的混合物、琥珀酸-氢氧化钠混合物、琥珀酸-琥珀酸二钠混合物等),酒石酸盐缓冲剂(例如,酒石酸-酒石酸钠混合物、酒石酸-酒石酸钾混合物、酒石酸-氢氧化钠混合物等),富马酸缓冲剂(例如,富马酸-富马酸一钠混合物、富马酸-富马酸二钠混合物、富马酸一钠-富马酸二钠混合物等),葡萄糖酸缓冲剂(例如葡萄糖酸-葡萄糖酸钠混合物、葡萄糖酸-氢氧化钠混合物、葡萄糖酸-葡萄糖酸钾混合物等),草酸盐缓冲剂(例如草酸-草酸钠混合物、草酸-氢氧化钠混合物、草酸-草酸钾混合物等),乳酸缓冲剂(例如乳酸-乳酸钠混合物、乳酸-氢氧化钠混合物、乳酸-乳酸钾混合物等)和乙酸盐缓冲剂(例如乙酸-乙酸钠混合物、乙酸-氢氧化钠混合物等)。另外,可以使用磷酸盐缓冲液、组氨酸缓冲液和三甲胺盐,例如tris。
可以添加防腐剂以阻止微生物生长,并且可以以约0.2%-1%(w/v)的量添加。用于本公开的合适的防腐剂包括苯酚、苯甲醇、间甲酚、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、十八烷基二甲基苄基氯化铵、苯扎卤化铵(例如氯化物、溴化物和碘化物),氯化六甲铵、和对羟基苯甲酸烷基酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯、邻苯二酚、间苯二酚、环己醇和3-戊醇。可以添加有时被称为“稳定剂”的等渗剂以确保本公开的液体组合物的等渗性,并且等渗剂包括多元糖醇,例如三元或更高级的糖醇,例如甘油、赤藓糖醇、阿拉伯糖醇、木糖醇、山梨糖醇和甘露糖醇。稳定剂是指广泛的赋形剂,其涵盖范围可以从填充剂到使治疗剂溶解或有助于防止变性或粘附于容器壁的添加剂。典型的稳定剂可以是多元糖醇(上面列举的);氨基酸,例如精氨酸、赖氨酸、甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、丙氨酸、鸟氨酸、l-亮氨酸、2-苯丙氨酸、谷氨酸、苏氨酸等;有机糖或糖醇,例如乳糖、海藻糖、水苏糖、甘露糖醇、山梨糖醇、木糖醇、核糖醇、肌醇、半乳糖醇、甘油等,包括环糖醇如肌醇;聚乙二醇;氨基酸聚合物;含硫的还原剂,例如尿素、谷胱甘肽、硫辛酸、硫代乙醇酸钠、硫代甘油、α-单硫代甘油和硫代硫酸钠;低分子量多肽(例如10个残基或以下的肽);蛋白质,例如人血清白蛋白、牛血清白蛋白、明胶或免疫球蛋白;亲水聚合物,例如聚乙烯吡咯烷酮单糖,例如木糖、甘露糖、果糖、葡萄糖;二糖,例如乳糖、麦芽糖、蔗糖和海藻糖;和三糖苷,例如棉子糖;和多糖,如右旋糖酐。稳定剂可以为每重量adc0.5至10重量%的量存在。
可以添加非离子型表面活性剂或去污剂(也称为“湿润剂”)以帮助溶解糖蛋白,并保护糖蛋白免于搅动引起的聚集,这也使制剂可以暴露于有应力的剪切表面而不会引起蛋白质变性。合适的非离子型表面活性剂包括聚山梨酸酯(20、80等)、polyoxamer(184、188等)和普朗尼克多元醇。非离子型表面活性剂可以以约0.05mg/ml至约1.0mg/ml,例如约0.07mg/ml至约0.2mg/ml存在。
其他混杂赋形剂包括填充剂(例如淀粉)、螯合剂(例如edta)、抗氧化剂(例如抗坏血酸、甲硫氨酸、维生素e)和助溶剂。
6.6使用方法
本文所述的抗糖-muc1抗体或抗原结合片段可用于各种诊断测定中。例如,抗体和结合片段可用于免疫测定,例如竞争性结合测定,直接和间接夹心测定以及免疫沉淀测定,包括免疫组织化学测定、酶联免疫吸附测定(elisa)、荧光激活细胞分选(facs)和蛋白质印迹。
本文所述的抗糖-muc1抗体或结合片段还可用于放射照相的体内成像,其中将用可检测部分(例如不透射线的试剂或放射性同位素)标记的抗体施用于受试者,优选施用至血流,并测定标记抗体在宿主中的存在和位置。此类成像技术可用于恶性肿瘤的分期和治疗。
本文所述的抗糖-muc1抗体或结合片段、adc和car可用于治疗表达糖-muc1的癌症,包括膀胱癌、肺癌、脑癌、乳腺癌、非霍奇金淋巴瘤、宫颈癌、卵巢癌、结肠直肠癌、胃癌、胆管癌、软骨肉瘤、胰腺癌、食道癌、前列腺癌、肾癌、皮肤癌、白血病、甲状腺癌、肝癌、子宫癌和宫颈癌。在一些实施方案中,癌症是上皮癌,例如乳腺癌、卵巢癌、胰腺癌或肺癌。
因此,本公开提供了如本文所述的抗糖-muc1抗体、结合片段、adc和car,其用作药物,例如用于治疗癌症,例如前文中指出的任何癌症,用于诊断测定,以及用于放射照相的体内成像。本公开还提供了如本文所述的抗糖-muc1抗体、结合片段、adc和car在制备药物中的用途,所述药物例如用于治疗癌症,例如,前文中指出的任何癌症。
当使用本公开的car进行治疗时,本公开的治疗方法包括向具有表达糖-muc1的肿瘤的受试者施用有效量的经工程化以表达本公开的car的基因修饰细胞,例如如6.3节或实施方案152或实施方案153中所述。在6.4.1节描述了修饰细胞,特别是t细胞以表达car的方法。
7.实施例
7.1实施例1:抗糖-muc1抗体的鉴定
7.1.1.材料和方法
7.1.1.1tnmuc1糖肽的合成
使用标准合成肽化学和针对糖基化位点的f-moc-galnac-ser/thr合成gst-muc115-mer肽(生物素
7.1.1.2免疫方案
使用戊二醛将gst-糖肽与klh(pierce,rockford,il)偶联。通过使用级分的抗muc1elisa在pd-10色谱柱上进行尺寸排阻色谱分析反应来评估缀合的效率。基本上所有反应性存在于排除的级分中,而预期包含肽的保留的级分的反应性不明显。进一步的评估包括以elisa对具有相应糖肽的klh缀合物进行比较滴定分析。两种分析表明,缀合几乎是完全的,这应导致klh与糖肽的比例为1:300。向雌性balb/c野生型小鼠皮下注射10或15μg(糖)肽,总体积为200μl(与sigma的freunds佐剂1:1混合)。小鼠以14天间隔接受四次免疫接种,并且在第三次和第四次免疫接种后1周通过尾巴或眼睛出血获得血液样品。
7.1.1.3小鼠单克隆抗体抗tn-muc1的产生
使用糖肽elisa,然后用乳腺癌细胞系(mcf7和t47d)进行免疫细胞学检查并用癌组织进行免疫组织学检查来筛选来自经偶联至klh的gst-muc1糖肽免疫的野生型balb/c小鼠的单克隆抗体(mab)。基于与相同小鼠的总血清相似的反应性模式进行选择。选择两种抗体1ag和4ag进行进一步表征。
7.2实施例2:通过elisa对1ag和4ag抗体进行功能表征
7.2.1.概述
通过间接elisa对1ag和4ag进行表征,以测试抗muc1mab对如表4所示的具有不同糖基化位点的滴定的muc1肽(包括非糖基化肽)的反应性。
7.2.2.材料和方法
elisa板用经浓度为0.08μg/ml至10μg/ml、在ph9.4的0.2m碳酸氢盐缓冲液中滴定的muc1肽包被过夜。bsa被用作对照/背景的度量。然后在室温下将板用superblocktm(thermofisher)封闭1小时。板洗涤后,将1ag和4ag杂交瘤上清液在elisa板上孵育1小时。然后洗涤板,然后与二抗(1/3000山羊抗小鼠igg(h+l)hrp(abcam62-6520))一起孵育1小时。然后洗涤板,并用1-steptmultratmb(thermofisher)显影2分钟。然后用2n硫酸停止显影。然后测量450nm的吸光度。
7.2.3.结果
结果示于图1a至图1f和图2a至图2b。如图所示,1ag和4ag特异性结合糖基化肽c3、c4和gst,但不结合糖基化肽c2或非糖基化肽70。
7.3实施例3:通过抗体滴定对1ag和4ag抗体进行功能表征
通过针对恒定浓度的抗原gsta的抗体滴定测定来表征1ag和4ag。
结果示于图3。
7.4实施例4:通过表面等离振子共振对1ag和4ag抗体进行功能表征
7.4.1.材料和方法
通过表面等离振子共振(spr)来评估1ag和4ag抗体与一种糖基化肽和一种非糖基化肽(表5)的结合。
所有spr实验在具有cm5传感器芯片、在每个通道上采用10000ru抗小鼠抗体(gehealthcare)的biacoret200上在25℃下进行,以hbs-p+作为运行样品缓冲液(10mmhepes,ph7.4,150mmnacl,0.05%tween20和1mg/mlbsa),以ph1.7的10mm甘氨酸作为再生缓冲液。
使用标准胺偶联化学(edc/nhs活化),将1ag和4ag抗体以30μg/ml溶液的形式固定在ph5.0的10mm乙酸钠中。使用10x稀释液以5μl/min在反应缓冲液中进行抗体捕获7至10分钟。使用600至1000ru的固定化水平。将肽样品制成在运行缓冲液中的起始浓度为100nm(6.25nm、12.5nm、25nm、50nm和100nm)的两倍稀释系列,并以50μl/min以单循环注射的方式注射2分钟。监测解离5分钟至30分钟。
7.4.2.结果
结果示于表6。如表6所示,1ag对糖基化肽的亲和力在两位数纳摩尔范围内,而4ag对糖基化肽的亲和力在一位数纳摩尔范围内。
7.5实施例5:抗糖-muc1抗体的序列分析
进行cdna末端的快速扩增(race)以确定1ag和4ag的重链和轻链核苷酸序列。
编码1ag的重链和轻链可变区的核苷酸序列分别在seqidno:21和seqidno:22中示出。由seqidno:21和seqidno:22编码的重链和轻链可变区分别在seqidno:1和seqidno:2中示出。预测的重链cdr序列(imgt定义)分别在seqidno:3-5中示出,预测的轻链cdr序列(imgt定义)分别在seqidno:6-8中示出。预测的重链cdr序列(kabat定义)分别在seqidno:9-11中示出,预测的轻链cdr序列(kabat定义)分别在seqidno:12-14中示出。预测的重链cdr序列(chothia定义)分别在seqidno:15-17中示出,预测的轻链cdr序列(chothia定义)分别在seqidno:18-20中示出。
编码4ag的重链和轻链可变区的核苷酸序列分别在seqidno:43和seqidno:44中示出。由seqidno:43和seqidno:44编码的重链和轻链可变区分别在seqidno:23和seqidno:24中示出。预测的重链cdr序列(imgt定义)分别在seqidno:25-27中示出,预测的轻链cdr序列(imgt定义)分别在seqidno:28-30中示出。预测的重链cdr序列(kabat定义)分别在seqidno:31-33中示出,预测的轻链cdr序列(kabat定义)分别在seqidno:34-36中示出。预测的重链cdr序列(chothia定义)分别在seqidno:37-39中示出,预测的轻链cdr序列(chothia定义)分别在seqidno:40-42中示出。
7.6实施例6:使用抗糖-muc1抗体对各种肿瘤组织进行免疫组织化学染色
7.6.1.材料和方法
使用人组织微阵列(tma)bcn721a(美国biomax)来筛选抗体1ag和4ag对各种肿瘤组织染色的能力。tma包含来自12种人器官的组织样品,包括食道、胃、结肠、直肠、肝、肺、肾、乳腺、子宫颈、卵巢、前列腺和胰腺,每种均取自三个正常人类个体,每个案例单个芯片。
表7示出了tma中每个组织的身份。
将切片在冷的10%缓冲中性福尔马林中固定15分钟。通过将载玻片在4℃或室温下与未稀释的杂交瘤上清液或纯化的mab(1ag和4ag)一起孵育24小时进行免疫组织化学(ihc)。用fitc偶联的兔抗小鼠免疫球蛋白(1:100;丹麦dako)或过氧化物酶偶联的兔抗小鼠免疫球蛋白检测结合的mab。用具有dapi(invitrogen)的prolonggold防褪色剂固定载玻片,并在leica宽视野荧光显微镜上获得显微照片。
7.6.2.结果
1ag的结果示于图4。4ag的结果示于图5。mab1ag以及mab4ag与大多数检查过的癌组织发生特异性反应。健康组织的染色显示,尽管尤其在胃组织中看到了一些细胞内结构的标记,但与表面结构的反应性非常有限。
7.7实施例7:使用抗糖-muc1抗体对卵巢肿瘤组织进行免疫组织化学染色
7.7.1.材料和方法
使用人组织微阵列(tma)ov241c(美国biomax)来筛选抗体1ag和4ag对卵巢肿瘤组织染色的能力。
表8示出了tma中每个组织的身份。
将切片在冷的10%缓冲中性福尔马林中固定15分钟。通过将载玻片在4℃或室温下与未稀释的杂交瘤上清液或纯化的mab(1ag和4ag)一起孵育24小时进行免疫组织化学(ihc)。用fitc偶联的兔抗小鼠免疫球蛋白(1:100;丹麦dako)或过氧化物酶偶联的兔抗小鼠免疫球蛋白检测结合的mab。用具有dapi(invitrogen)的prolonggold防褪色剂固定载玻片,并在leica宽视野荧光显微镜上获得显微照片。
7.7.2.结果
1ag的结果示于图6。4ag的结果示于图7。mab4ag与来自卵巢腺癌的大多数检查过的组织发生特异性反应。相邻健康组织的染色显示出细胞内结构的某些标记。在这些条件下,未发现卵巢癌和肿瘤邻近组织的mab1ag具有明显标记。
7.8实施例8:使用抗糖-muc1抗体对肿瘤组织进行免疫组织化学染色
7.8.1.材料和方法
使用人组织微阵列(tma)bc000119(美国biomax)来筛选抗体1ag和4ag对各种肿瘤组织染色的能力。tma包含40例乳腺浸润性导管癌、肺鳞状细胞癌、结肠腺癌、前列腺腺癌和胰腺腺癌。由多器官正常组织阵列评估健康对照样品。
表9示出了tma中每个组织的身份。
将切片在冷的10%缓冲中性福尔马林中固定15分钟。通过将载玻片在4℃或室温下与未稀释的杂交瘤上清液或纯化的mab(1ag和4ag)一起孵育24小时进行免疫组织化学(ihc)。用fitc偶联的兔抗小鼠免疫球蛋白(1:100;丹麦dako)或过氧化物酶偶联的兔抗小鼠免疫球蛋白检测结合的mab。用具有dapi(invitrogen)的prolonggold防褪色剂固定载玻片,并在leica宽视野荧光显微镜上获得显微照片。
7.8.2.结果
1ag的结果示于图8。4ag的结果示于图9。mab1ag与来自大多数检查过的癌组织(包括来自乳腺癌、肺癌、结肠癌和胰腺癌的组织)的比例的肿瘤发生特异性反应。mab4ag与来自大部分检查过的癌症(包括来自乳腺癌、肺癌、结肠癌、前列腺癌和胰腺癌的组织)的显著比例的肿瘤发生强烈的特异性反应。
7.9实施例9:通过丙氨酸扫描对1ag和4ag抗体进行表位作图
7.9.1.材料和方法
7.9.1.1材料
在本实施例中所述的研究中使用了以下试剂。
7.9.1.2步移丙氨酸文库合成
构建了步移丙氨酸文库,该文库包含基于muc1蛋白的28-mer部分
7.9.1.35e5、1ag和4ag的表位作图
该文库用于elisa格式以绘制以下muc1-tn抗体的表位:5e5、1ag和4ag。非糖基化的muc1肽用作阴性对照,而在以粗体下划线显示的丝氨酸和苏氨酸残基上被galnac糖基化的肽
将糖肽和相关对照在ph9.8的0.2m碳酸氢盐缓冲液中稀释至0.25μg/ml,并将100μl铺到高结合elisa板的每个孔中。然后将板在4℃下孵育过夜。弃去包被缓冲液后,在室温下用每孔300μl的封闭缓冲液(1xpbs中的2.5%bsa)封闭板1小时。然后弃去封闭缓冲液,加入100μl每孔的5e5、1ag和4ag的每一个的抗体上清液(在封闭缓冲液中稀释)并在室温下孵育1小时。事先针对每种抗体优化了抗体上清液稀释度(数据未显示)。将生物素化的villavillosa凝集素(每孔100μl,1μg/ml在封闭缓冲液中)加入板中作为对照,以检测肽上galnac修饰的残基的存在。将板用300μl每孔的1xtbs/0.05%tween-20(tbst)洗涤3次。将二抗山羊抗小鼠igg(h+l)-hrp在封闭缓冲液中以1/5000稀释,每孔加入100μl稀释的抗体,并在室温下在板上孵育1小时。将链霉抗生物素蛋白-hrp在封闭缓冲液中以1/3000稀释,并将100μl稀释的链霉抗生物素蛋白-hrp加入含有生物素化凝集素的孔中。二次孵育后,将板用每孔300μl的tbst洗涤4次,然后用75μl室温的1-steptmb底物显影。1分钟后,用75μl的2n硫酸的停止显影。然后用酶标仪(moleculardevicespectramaxi3)在450nm读板。
7.9.1.4数据分析
在microsoftexcel软件中分析数据。通过将每种抗体与“突变”肽的反应性转换为与野生型肽相比的结合百分比来解释数据。使用公式(od_突变肽/od_野生型肽)计算结合百分比。然后以所有值在0-1之间的条形图显示结合百分比。
7.9.2.结果
5e5、1ag和4ag与肽的结合百分比分别示于图10-12。残基17-23区域内的丙氨酸取代极大地降低了1ag和4ag的结合。与5e5相比,1ag和4ag的结合被更多的丙氨酸取代降低。对于肽5-11中的每一种,4ag的结合与“野生型”肽相比大大降低。这表明4ag的结合表位在残基17-23的区域内。1ag的结合甚至限制性更强,其对肽3-12(对应于残基15-24的区域)中的每一种的结合与野生型相比大大降低。在残基19-22的区域,1ag和4ag的结合被肽8上的ser-galnac取代几乎完全抑制(分别为2.23%和1.63%),而5e5仍可以结合(18%)。相比之下,肽9上的thr-galnac取代几乎完全抑制了5e5结合(2.93%),而4ag和1ag仍可以分别以14.62%和6.07%结合。这表明,糖基化的丝氨酸比galnac-thr在1ag和4ag的结合中发挥更大的作用,这对于5e5正好相反。总体而言,丙氨酸扫描的结果表明,1ag和4ag的表位似乎与5e5不同。区别包括与糖-muc1的更大数量的接触,这(不受理论的束缚)被认为赋予了对癌症抗原的更大程度的选择性。
8.具体实施方案、参考文献的引用
尽管已经示出和描述了各种特定的实施方案,但是应当理解,可以在不脱离本公开的精神和范围的情况下进行各种改变。通过以下示出的编号的实施方案来示例本公开。
1.一种与包含以下项的抗体或抗原结合片段竞争结合muc1肽
2.一种与包含以下项的抗体或抗原结合片段竞争结合乳腺癌细胞系mcf7或t47d的抗糖-muc1抗体或抗原结合片段:(i)seqidno:1的重链可变(vh)序列和seqidno:2的轻链可变(vl)序列或(ii)seqidno:23的重链可变(vh)序列和seqidno:24的轻链可变(vl)序列。
3.一种抗糖-muc1抗体或抗原结合片段,其包含含有seqidno:93的氨基酸序列的互补决定区(cdr)h1、含有seqidno:94的氨基酸序列的cdr-h2、含有seqidno:95的氨基酸序列的cdr-h3、含有seqidno:96的氨基酸序列的cdr-l1、含有seqidno:97的氨基酸序列的cdr-l2、和含有seqidno:98的氨基酸序列的cdr-l3。
4.实施方案1或实施方案2的抗糖-muc1抗体或抗原结合片段,其包含含有seqidno:93的氨基酸序列的互补决定区(cdr)h1、含有seqidno:94的氨基酸序列的cdr-h2、含有seqidno:95的氨基酸序列的cdr-h3、含有seqidno:96的氨基酸序列的cdr-l1、含有seqidno:97的氨基酸序列的cdr-l2、和含有seqidno:98的氨基酸序列的cdr-l3。
5.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:3的氨基酸序列。
6.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:9的氨基酸序列。
7.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:15的氨基酸序列。
8.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:25的氨基酸序列。
9.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:31的氨基酸序列。
10.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:37的氨基酸序列。
11.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:45的氨基酸序列。
12.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:51的氨基酸序列。
13.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:57的氨基酸序列。
14.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:63的氨基酸序列。
15.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:69的氨基酸序列。
16.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:75的氨基酸序列。
17.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:81的氨基酸序列。
18.实施方案3或实施方案4的抗糖-muc1抗体或抗原结合片段,其中,cdr-h1包含seqidno:87的氨基酸序列。
19.实施方案3至18中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h2包含seqidno:4的氨基酸序列。
20.实施方案3至18中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h2包含seqidno:10的氨基酸序列。
21.实施方案3至18中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h2包含seqidno:16的氨基酸序列。
22.实施方案3至18中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h2包含seqidno:26的氨基酸序列。
23.实施方案3至18中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h2包含seqidno:32的氨基酸序列。
24.实施方案3至18中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h2包含seqidno:38的氨基酸序列。
25.实施方案3至18中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h2包含seqidno:46的氨基酸序列。
26.实施方案3至18中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h2包含seqidno:52的氨基酸序列。
27.实施方案3至26中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h3包含seqidno:5的氨基酸序列。
28.实施方案3至26中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h3包含seqidno:11的氨基酸序列。
29.实施方案3至26中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h3包含seqidno:27的氨基酸序列。
30.实施方案3至26中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h3包含seqidno:33的氨基酸序列。
31.实施方案3至26中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-h3包含seqidno:47的氨基酸序列。
32.实施方案3至31中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-l1包含seqidno:6的氨基酸序列。
33.实施方案3至31中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-l1包含seqidno:12的氨基酸序列。
34.实施方案3至31中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-l1包含seqidno:18的氨基酸序列。
35.实施方案3至31中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-l1包含seqidno:28的氨基酸序列。
36.实施方案3至31中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-l1包含seqidno:34的氨基酸序列。
37.实施方案3至31中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-l1包含seqidno:40的氨基酸序列。
38.实施方案3至31中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-l1包含seqidno:54的氨基酸序列。
39.实施方案3至31中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-l1包含seqidno:60的氨基酸序列。
40.实施方案3至39中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-l2包含seqidno:13的氨基酸序列。
41.实施方案3至40中任一项的抗糖-muc1抗体或抗原结合片段,其中,cdr-l3包含seqidno:8的氨基酸序列。
42.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:3-5的互补决定区(cdr)的vh和包含seqidno:6-8的cdr的vl。
43.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:9-11的互补决定区(cdr)的vh和包含seqidno:12-14的cdr的vl。
44.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:15-17的互补决定区(cdr)的vh和包含seqidno:18-20的cdr的vl。
45.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:25-27的互补决定区(cdr)的vh和包含seqidno:28-30的cdr的vl。
46.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:31-33的互补决定区(cdr)的vh和包含seqidno:34-36的cdr的vl。
47.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:37-39的互补决定区(cdr)的vh和包含seqidno:40-42的cdr的vl。
48.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:45-47的互补决定区(cdr)的vh和包含seqidno:48-50的cdr的vl。
49.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:51-53的互补决定区(cdr)的vh和包含seqidno:54-56的cdr的vl。
50.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:57-59的互补决定区(cdr)的vh和包含seqidno:60-62的cdr的vl。
51.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:63-65的互补决定区(cdr)的vh和包含seqidno:66-68的cdr的vl。
52.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:69-71的互补决定区(cdr)的vh和包含seqidno:72-74的cdr的vl。
53.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:75-77的互补决定区(cdr)的vh和包含seqidno:78-80的cdr的vl。
54.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:81-83的互补决定区(cdr)的vh和包含seqidno:84-86的cdr的vl。
55.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:87-89的互补决定区(cdr)的vh和包含seqidno:90-92的cdr的vl。
56.实施方案1至55中任一项的抗糖-muc1抗体或抗原结合片段,其为嵌合抗体或人源化抗体。
57.实施方案1至56中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含与seqidno:1具有至少95%序列同一性的氨基酸序列的vh和包含与seqidno:2具有至少95%序列同一性的氨基酸序列的vl。
58.实施方案1至56中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含与seqidno:1具有至少97%序列同一性的氨基酸序列的vh和包含与seqidno:2具有至少97%序列同一性的氨基酸序列的vl。
59.实施方案1至56中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含与seqidno:1具有至少99%序列同一性的氨基酸序列的vh和包含与seqidno:2具有至少99%序列同一性的氨基酸序列的vl。
60.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:1的氨基酸序列的vh和包含seqidno:2的氨基酸序列的vl。
61.实施方案1至56中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含与seqidno:23具有至少95%序列同一性的氨基酸序列的vh和包含与seqidno:24具有至少95%序列同一性的氨基酸序列的vl。
62.实施方案1至56中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含与seqidno:23具有至少97%序列同一性的氨基酸序列的vh和包含与seqidno:24具有至少97%序列同一性的氨基酸序列的vl。
63.实施方案1至56中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含与seqidno:23具有至少99%序列同一性的氨基酸序列的vh和包含与seqidno:24具有至少99%序列同一性的氨基酸序列的vl。
64.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其具有包含seqidno:23的氨基酸序列的vh和包含seqidno:24的氨基酸序列的vl。
65.实施方案1至4中任一项的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
66.实施方案65的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
67.实施方案65的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
68.实施方案65至67中任一项的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
69.实施方案68的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与
70.实施方案68的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与
71.实施方案68至70中任一项的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
72.实施方案71的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
73.实施方案71的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
74.实施方案71的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
75.实施方案71至74中任一项的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
76.实施方案75的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
77.实施方案75的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
78.实施方案75至77中任一项的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
79.实施方案78的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
80.实施方案78的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
81.实施方案78的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
82.实施方案65至81中任一项的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
83.实施方案82的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
84.实施方案82的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
85.实施方案82至84中任一项的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
86.实施方案85的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
87.实施方案85的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
88.实施方案85至87中任一项的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
89.实施方案88的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
90.实施方案88的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
91.实施方案88至90中任一项的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
92.实施方案91的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
93.实施方案91的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
94.实施方案91的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
95.实施方案91的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
96.实施方案91至95中任一项的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
97.实施方案96的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
98.实施方案96的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
99.实施方案96的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
100.实施方案96的抗糖-muc1抗体或抗原结合片段,其中如通过elisa所测量的,所述抗糖-muc1抗体或抗原结合片段与肽
101.实施方案65至100中任一项的抗糖-muc1抗体或抗原结合片段,其中所述elisa包括以0.25μg/ml的浓度使用所述肽的elisa。
102.实施方案65至101中任一项的抗糖-muc1抗体或抗原结合片段,其中所述elisa包括对来自表达所述抗糖-muc1抗体或抗原结合片段的细胞系的细胞培养上清液进行的elisa。
103.实施方案65至101中任一项的抗糖-muc1抗体或抗原结合片段,其中所述elisa包括对来自表达所述抗糖-muc1抗体或抗原结合片段的细胞系的稀释的细胞培养上清液进行的elisa。
104.实施方案103的抗糖-muc1抗体或抗原结合片段,其中所述稀释的细胞培养上清液包括用缓冲液稀释2至20倍的细胞培养上清液。
105.实施方案65至104中任一项的抗糖-muc1抗体或抗原结合片段,其中elisa中抗体或抗原结合片段的浓度为0.1mg/ml至2mg/ml,任选地,其中elisa中抗体或抗原结合片段的浓度为0.5mg/ml至1mg/ml。
106.实施方案65至105中任一项的抗糖-muc1抗体或抗原结合片段,其中elisa中抗体或抗原结合片段的浓度导致与muc1肽
107.实施方案65至106中任一项的抗糖-muc1抗体或抗原结合片段,其中所述elisa如实施例9所述进行。
108.一种与参考抗体或抗原结合片段竞争结合muc1肽
(a)在所述vh序列内具有第一、第二和第三cdr的vh序列;和
(b)在所述vl序列内具有第四、第五和第六cdr的vl序列,
其中所述第一、第二、第三、第四、第五和第六cdr协作以实现与参考抗体或抗原结合片段的结合竞争的抗糖-muc1抗体或抗原结合片段与muc1肽的结合。
109.实施方案108的抗糖-muc1抗体或抗原结合片段,其中所述抗糖-muc1抗体或抗原结合片段与包含seqidno:23的vh序列和seqidno:24的vl序列的参考抗体或抗原结合片段竞争。
110.实施方案108的抗糖-muc1抗体或抗原结合片段,其中所述抗糖-muc1抗体或抗原结合片段与包含seqidno:1的vh序列和seqidno:2的vl序列的参考抗体或抗原结合片段竞争。
111.实施方案1至110中任一项的抗糖-muc1抗体或抗原结合片段,与正常细胞相比,其优先结合在癌细胞上过表达的糖-muc1表位。
112.实施方案1至111中任一项的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的1nm至50nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
113.实施方案112的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的3nm至50nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
114.实施方案112的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的3nm至40nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
115.实施方案112的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的3nm至25nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
116.实施方案112的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的5nm至50nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
117.实施方案112的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的5nm至25nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
118.实施方案112的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的10nm至50nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
119.实施方案112的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的10nm至25nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
120.实施方案112的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的15nm至50nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
121.实施方案112的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的15nm至25nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
122.实施方案112的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的20nm至50nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
123.实施方案112的抗糖-muc1抗体或抗原结合片段,其以通过表面等离振子共振测量的25nm至50nm的结合亲和力(kd)结合在以粗体和下划线显示的丝氨酸和苏氨酸残基被galnac糖基化的muc1肽
124.实施方案1至123中任一项的抗糖-muc1抗体或抗原结合片段,其为多价的。
125.实施方案1至123中任一项的抗糖-muc1抗体或抗原结合片段,其是单链可变片段(scfv)的形式。
126.实施方案125的抗糖-muc1抗体或抗原结合片段,其中所述scfv包含位于轻链可变片段n末端的重链可变片段。
127.实施方案125或实施方案126的抗糖-muc1抗体或抗原结合片段,其中所述scfv重链可变片段和轻链可变片段共价结合至4-15个氨基酸的接头序列。
128.实施方案1至123中任一项的抗糖-muc1抗体或抗原结合片段,其是多特异性抗体的形式。
129.实施方案128的抗糖-muc1抗体或抗原结合片段,其中所述多特异性抗体是与不同于第一表位的第二表位结合的双特异性抗体。
130.实施方案129的抗糖-muc1抗体或抗原结合片段,其中所述双特异性抗体是crossmab、fab臂交换抗体、双特异性t细胞衔接子(bite)或双亲和性重定向分子(dart)。
131.实施方案130的抗糖-muc1抗体或抗原结合片段,其中所述双特异性抗体是crossmab。
132.实施方案131的抗糖-muc1抗体或抗原结合片段,其中所述双特异性抗体是crossmabfab。
133.实施方案131的抗糖-muc1抗体或抗原结合片段,其中所述双特异性抗体是crossmabvh-vl。
134.实施方案131的抗糖-muc1抗体或抗原结合片段,其中所述双特异性抗体是crossmabch1-cl。
135.实施方案130的抗糖-muc1抗体或抗原结合片段,其中所述双特异性抗体是fab臂交换抗体。
136.实施方案130的抗糖-muc1抗体或抗原结合片段,其中所述双特异性抗体是双亲和性重定向分子(dart)。
137.实施方案130的抗糖-muc1抗体或抗原结合片段,其中所述双特异性抗体是双特异性t细胞衔接子(bite)。
138.实施方案129至137中任一项的抗糖-muc1抗体或抗原结合片段,其中所述第二表位是muc1表位。
139.实施方案129至137中任一项的抗糖-muc1抗体或抗原结合片段,其中所述第二表位是与正常细胞相比在癌细胞上过表达的muc1表位。
140.实施方案129至137中任一项的抗糖-muc1抗体或抗原结合片段,其中所述第二表位是t细胞表位。
141.实施方案140的抗糖-muc1抗体或抗原结合片段,其中所述t细胞表位包括cd3表位、cd8表位、cd16表位、cd25表位、cd28表位、或nkg2d表位。
142.实施方案141的抗糖-muc1抗体或抗原结合片段,其中所述t细胞表位包括cd3表位,其任选地是存在于人cd3中表位。
143.实施方案142的抗糖-muc1抗体或抗原结合片段,其中所述cd3表位包括cd3γ表位、cd3δ表位、cd3ε表位或cd3ζ表位。
144.实施方案1至143中任一项的抗糖-muc1抗体或抗原结合片段,其与可检测部分缀合。
145.实施方案144的抗糖-muc1抗体或抗原结合片段,其中所述可检测部分是酶、放射性同位素或荧光标记。
146.一种融合蛋白,其包含至少可操作地连接至第二氨基酸序列的实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段的氨基酸序列。
147.实施方案146的融合蛋白,其中所述第二氨基酸序列是4-1bb、cd3ζ或其片段的氨基酸序列。
148.实施方案146的融合蛋白,其中所述第二氨基酸序列是融合肽的氨基酸序列。
149.实施方案148的融合蛋白,其中所述融合肽是cd28-cd3ζ或4-1bb(cd137)-cd3ζ融合肽。
150.实施方案146的融合蛋白,其中所述第二氨基酸序列是t细胞活化的调节剂或其片段的氨基酸序列。
151.实施方案150的融合蛋白,其中所述t细胞活化的调节剂是il-15或il-15ra。
152.一种嵌合抗原受体(car),其包含实施方案125至127中任一项的scfv。
153.实施方案152的car,其以氨基末端至羧基末端的顺序包含:人cd8前导肽、scfv、人cd8铰链结构域、人cd8跨膜结构域和cd3ζ信号传导结构域。
154.一种抗体药物缀合物,其包含与细胞毒性剂缀合的实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段或实施方案146至151中任一项的融合蛋白。
155.实施方案154的抗体药物缀合物,其中所述细胞毒性剂是澳瑞他汀、dna小沟结合剂、烷化剂、烯二炔、lexitropsin、倍癌霉素(duocarmycin)、紫杉烷、尾海兔素、美登素或长春花生物碱。
156.实施方案155的抗体药物缀合物,其中所述抗糖-muc1抗体或抗原结合片段或双特异性抗体通过接头与细胞毒剂缀合。
157.实施方案156的抗体药物缀合物,其中所述接头在细胞内条件下是可切割的。
158.实施方案157的抗体药物缀合物,其中所述可切割接头可被细胞内蛋白酶切割。
159.实施方案158的抗体药物缀合物,其中所述接头包含二肽。
160.实施方案159的抗体药物缀合物,其中所述二肽是val-cit或phe-lys。
161.实施方案157的抗体药物缀合物,其中所述可切割接头在小于5.5的ph下可水解。
162.实施方案161的抗体药物缀合物,其中所述可水解接头是腙接头。
163.实施方案157的抗体药物缀合物,其中所述可切割接头是二硫化物接头。
164.一种核酸,其包含实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、或实施方案146至151中任一项的融合蛋白、或实施方案152或实施方案153的car的编码区。
165.实施方案164的核酸,其中所述编码区经密码子优化以在人细胞中表达。
166.一种载体,其包含实施方案164或实施方案165的核酸。
167.实施方案166的载体,其是病毒载体。
168.实施方案167的载体,其中所述病毒载体是慢病毒载体。
169.一种宿主细胞,其被工程化以表达实施方案164或实施方案165的核酸。
170.实施方案169的宿主细胞,其是被工程化以表达实施方案152或实施方案153的car的人t细胞。
171.一种宿主细胞,其包含实施方案166至168中任一项的载体。
172.实施方案171的宿主细胞,其是t细胞,并且其中所述载体编码实施方案152或实施方案153的car。
173.一种药物组合物,其包含(a)实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、或实施方案169至172中任一项的宿主细胞,和(b)生理学上合适的缓冲液、佐剂或稀释剂。
174.一种治疗癌症的方法,其包括向有需要的受试者施用有效量的实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物。
175.实施方案174的方法,其中所述受试者患有乳腺癌、肺癌、前列腺癌、胰腺癌、食道癌、结肠直肠癌、卵巢癌、子宫癌、宫颈癌、膀胱癌、脑癌、非霍奇金淋巴瘤,宫颈癌、胃癌、胆管癌、软骨肉瘤、肾癌、皮肤癌、白血病、甲状腺癌或肝癌。
176.实施方案175的方法,其中所述受试者患有乳腺癌。
177.实施方案175的方法,其中所述受试者患有肺癌。
178.实施方案177的方法,其中所述肺癌是非小细胞肺癌。
179.实施方案175的方法,其中所述受试者患有前列腺癌。
180.实施方案175的方法,其中所述受试者患有胰腺癌。
181.实施方案175的方法,其中所述受试者患有食道癌。
182.实施方案175的方法,其中所述受试者患有结肠直肠癌。
183.实施方案175的方法,其中所述受试者患有卵巢癌。
184.实施方案175的方法,其中所述受试者患有子宫癌。
185.实施方案175的方法,其中所述受试者患有宫颈癌。
186.实施方案175的方法,其中所述受试者患有膀胱癌。
187.实施方案175的方法,其中所述受试者患有脑癌。
188.实施方案175的方法,其中所述受试者患有非霍奇金淋巴瘤。
189.实施方案175的方法,其中所述受试者患有宫颈癌。
190.实施方案175的方法,其中所述受试者患有胃癌。
191.实施方案175的方法,其中所述受试者患有胆管癌。
192.实施方案175的方法,其中所述受试者患有软骨肉瘤。
193.实施方案175的方法,其中所述受试者患有肾癌。
194.实施方案175的方法,其中所述受试者患有皮肤癌。
195.实施方案175的方法,其中所述受试者患有白血病。
196.实施方案175的方法,其中所述受试者患甲状腺癌。
197.实施方案175的方法,其中所述受试者患有肝癌。
198.一种检测生物样品中的癌症的方法,其包括使样品与实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段接触,并检测所述抗糖-muc1抗体或抗原结合片段的结合。
199.实施方案198的方法,其还包括对抗糖-muc1抗体或抗原结合片段的结合进行定量。
200.实施方案198或实施方案199的方法,其中将所述结合与作为阴性/基线对照的正常组织对照和/或与作为阳性对照的癌性组织对照进行比较。
201.实施方案198至200中任一项的方法,其中所述癌症是乳腺癌、肺癌、前列腺癌、胰腺癌、食道癌、结肠直肠癌、卵巢癌、子宫癌、宫颈癌、膀胱癌、脑癌、非霍奇金淋巴瘤、宫颈癌、胃癌、胆管癌、软骨肉瘤、肾癌、皮肤癌、白血病、甲状腺癌或肝癌。
202.实施方案201的方法,其中所述癌症为乳腺癌。
203.实施方案201的方法,其中所述癌症为肺癌。
204.实施方案203的方法,其中所述肺癌是非小细胞肺癌。
205.实施方案201的方法,其中所述癌症为前列腺癌。
206.实施方案201的方法,其中所述癌症为胰腺癌。
207.实施方案201的方法,其中所述癌症为食道癌。
208.实施方案201的方法,其中所述癌症为结肠直肠癌。
209.实施方案201的方法,其中所述癌症为卵巢癌。
210.实施方案201的方法,其中所述癌症为子宫癌。
211.实施方案201的方法,其中所述癌症为宫颈癌。
212.实施方案201的方法,其中所述癌症为膀胱癌。
213.实施方案201的方法,其中所述癌症为脑癌。
214.实施方案201的方法,其中所述癌症为非霍奇金淋巴瘤。
215.实施方案201的方法,其中所述癌症为宫颈癌。
216.实施方案201的方法,其中所述癌症为胃癌。
217.实施方案201的方法,其中所述癌症为胆管癌。
218.实施方案201的方法,其中所述癌症为软骨肉瘤。
219.实施方案201的方法,其中所述癌症为肾癌。
220.实施方案201的方法,其中所述癌症为皮肤癌。
221.实施方案201的方法,其中所述癌症为白血病。
222.实施方案201的方法,其中所述癌症为甲状腺癌。
223.实施方案201的方法,其中所述癌症为肝癌。
224.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用作药物。
225.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗癌症,任选地,其中所述癌症为乳腺癌、肺癌、前列腺癌、胰腺癌、食道癌、结肠直肠癌、卵巢癌、子宫癌、宫颈癌、膀胱癌、脑癌、非霍奇金淋巴瘤、宫颈癌、胃癌、胆管癌、软骨肉瘤、肾癌、皮肤癌、白血病、甲状腺癌或肝癌。
226.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗乳腺癌。
227.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗肺癌。
228.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗前列腺癌。
229.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗胰腺癌。
230.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗食道癌。
231.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗结肠直肠癌。
232.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗卵巢癌。
233.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗子宫癌。
234.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗宫颈癌。
235.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗膀胱癌。
236.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗脑癌。
237.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗非霍奇金淋巴瘤。
238.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗宫颈癌。
239.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗胃癌。
240.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗胆管癌。
241.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗软骨肉瘤。
242.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗肾癌。
243.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗皮肤癌。
244.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗白血病。
245.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗甲状腺癌。
246.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物,其用于治疗肝癌。
247.实施方案1至145中任一项的抗糖-muc1抗体或抗原结合片段、实施方案146至151中任一项的融合蛋白、实施方案152或实施方案153的car、实施方案154至163中任一项的抗体药物缀合物、实施方案164或实施方案165的核酸、实施方案166至168中任一项的载体、实施方案169至172中任一项的宿主细胞、或实施方案173的药物组合物在制备用于治疗癌症的药物中的用途,任选地,其中所述癌症为乳腺癌、肺癌、前列腺癌、胰腺癌、食道癌、结肠直肠癌、卵巢癌、子宫癌、宫颈癌、膀胱癌、脑癌、非霍奇金淋巴瘤、宫颈癌、胃癌、胆管癌、软骨肉瘤、肾癌、皮肤癌、白血病、甲状腺癌或肝癌。
248.根据实施方案247的用途,其中所述癌症为乳腺癌。
249.根据实施方案247的用途,其中所述癌症为肺癌。
250.根据实施方案247的用途,其中所述癌症为前列腺癌。
251.根据实施方案247的用途,其中所述癌症为胰腺癌。
252.根据实施方案247的用途,其中所述癌症为食道癌。
253.根据实施方案247的用途,其中所述癌症为结肠直肠癌。
254.根据实施方案247的用途,其中所述癌症为卵巢癌。
255.根据实施方案247的用途,其中所述癌症为子宫癌。
256.根据实施方案247的用途,其中所述癌症为宫颈癌。
257.根据实施方案247的用途,其中所述癌症为膀胱癌。
258.根据实施方案247的用途,其中所述癌症为脑癌。
259.根据实施方案247的用途,其中所述癌症为非霍奇金淋巴瘤。
260.根据实施方案247的用途,其中所述癌症为宫颈癌。
261.根据实施方案247的用途,其中所述癌症为胃癌。
262.根据实施方案247的用途,其中所述癌症为胆管癌。
263.根据实施方案247的用途,其中所述癌症为软骨肉瘤。
264.根据实施方案247的用途,其中所述癌症为肾癌。
265.根据实施方案247的用途,其中所述癌症为皮肤癌。
266.根据实施方案247的用途,其中所述癌症为白血病。
267.根据实施方案247的用途,其中所述癌症为甲状腺癌。
268.根据实施方案247的用途,其中所述癌症为肝癌。
在本申请中引用的所有出版物、专利、专利申请和其他文件通过引用整体并入本文用于所有目的,其程度如同单独指出每个独立的出版物、专利、专利申请或其他文件通过引用而并入用于所有目的。如果并入本文的一个或多个参考文献的教导与本公开之间存在不一致的情况,则遵循本说明书的教导。
序列表
<110>go医疗股份有限公司
<120>抗糖-muc1抗体及其用途
<130>got-002wo
<150>62/691,887
<151>2018-06-29
<150>62/802,865
<151>2019-02-08
<160>118
<170>patentinversion3.5
<210>1
<211>118
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>1
gluvallysleuleugluserglyglyglyleuvalglnproglygly
151015
serleulysleusercysalaalaserglypheasppheserargasp
202530
trpmetsertrpvalargglnalaproglylysglyleuglutrpile
354045
glygluileasnproaspserserthrlysasntyrthrproserleu
505560
lysasplyspheileileserargaspasnalalysasnthrleuphe
65707580
leuglnmetserservalargsergluaspthralaleutyrtyrcys
859095
alathrserhistyrtyrglyleupheglytyrtrpglyglnglythr
100105110
leuvalthrvalserala
115
<210>2
<211>111
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>2
aspilevalleuthrglnserproalaserleuthrvalserleugly
151015
glnargalathrilesercysargalaserlysservalserthrser
202530
glytyrsertyrmethistrptyrglnglnlysproglyglnpropro
354045
lysleuleuiletyrleualasertyrleugluserglyvalproala
505560
argpheserglyserglyserglythraspphethrleuasnilehis
65707580
provalgluglugluaspalaalathrtyrtyrcysglnhisserarg
859095
gluleuproargthrpheglyglyglythrlysleugluilelys
100105110
<210>3
<211>8
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>3
glypheasppheserargasptrp
15
<210>4
<211>8
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>4
ileasnproaspserserthrlys
15
<210>5
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>5
alathrserhistyrtyrglyleupheglytyr
1510
<210>6
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>6
lysservalserthrserglytyrsertyr
1510
<210>7
<211>3
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>7
leualaser
1
<210>8
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>8
glnhisserarggluleuproargthr
15
<210>9
<211>5
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>9
argasptrpmetser
15
<210>10
<211>17
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>10
gluileasnproaspserserthrlysasntyrthrproserleulys
151015
asp
<210>11
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>11
serhistyrtyrglyleupheglytyr
15
<210>12
<211>15
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>12
argalaserlysservalserthrserglytyrsertyrmethis
151015
<210>13
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>13
leualasertyrleugluser
15
<210>14
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>14
glnhisserarggluleuproargthr
15
<210>15
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>15
glypheasppheserargasp
15
<210>16
<211>6
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>16
asnproaspserserthr
15
<210>17
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>17
serhistyrtyrglyleupheglytyr
15
<210>18
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>18
serlysservalserthrserglytyrsertyr
1510
<210>19
<211>3
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>19
leualaser
1
<210>20
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>20
serarggluleuproargthr
15
<210>21
<211>708
<212>dna
<213>人工序列
<220>
<223>合成的核苷酸序列
<400>21
gaggtgaagcttctcgagtctggaggtggcctggtgcagcctggaggatccctgaaattg60
tcctgtgcagcctcaggattcgattttagtagagactggatgagttgggtccggcaggct120
ccagggaaagggctagaatggattggagagattaatccagatagcagtacgaaaaactac180
acgccatctctaaaggataaattcatcatttccagagacaacgccaaaaatacgctgttc240
ctgcaaatgagcagcgtgagatctgaggacacagccctttattactgtgcaacctctcat300
tactacggcctgtttggttactggggccaagggactctggtcactgtctctgcagaggtg360
aagcttctcgagtctggaggtggcctggtgcagcctggaggatccctgaaattgtcctgt420
gcagcctcaggattcgattttagtagagactggatgagttgggtccggcaggctccaggg480
aaagggctagaatggattggagagattaatccagatagcagtacgaaaaactacacgcca540
tctctaaaggataaattcatcatttccagagacaacgccaaaaatacgctgttcctgcaa600
atgagcagcgtgagatctgaggacacagccctttattactgtgcaacctctcattactac660
ggcctgtttggttactggggccaagggactctggtcactgtctctgca708
<210>22
<211>333
<212>dna
<213>人工序列
<220>
<223>合成的核苷酸序列
<400>22
gacattgtgctgacacagtctcctgcttccttaactgtatctctggggcagagggccacc60
atctcatgcagggccagcaaaagtgtcagtacatctggctatagttatatgcactggtac120
caacagaaaccaggacagccacccaaactcctcatctatcttgcttcctacctagaatct180
ggggtccctgccaggttcagtggcagtgggtctgggacagacttcaccctcaacatccat240
cctgtggaggaggaggatgctgcaacctattactgtcagcacagtagggagcttcctcgg300
acgttcggtggaggcaccaagctggaaatcaaa333
<210>23
<211>118
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>23
gluvallysleuleugluserglyglyglyleuvalglnproglygly
151015
serleulysleusercysvalalaserglypheasppheserargtyr
202530
trpmetsertrpvalargglnalaproglylysglyproglutrpile
354045
glygluileasnprogluserasnthrmetasntyrserproserleu
505560
lysglulyspheileileserargaspthralalysasnmetleutyr
65707580
leuglnmetserlysvalargsergluaspthralaleutyrtyrcys
859095
alathrserhishistyrglyleupheasptyrtrpglyglnglythr
100105110
leuvalthrvalserala
115
<210>24
<211>111
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>24
aspilevalleuthrglnserproalaserleualavalserleugly
151015
glnargalathrilesercysargalaserlysservalserthrser
202530
glytyrasntyrilehistrptyrglnglnlysproglyglnpropro
354045
lysleuleuiletyrleualasertyrleugluserglyvalproala
505560
argpheserglyserglyserglythraspphethrleuasnilehis
65707580
provalgluglugluaspalaalathrtyrphecysglnhisserarg
859095
gluleuproargthrpheglyglyglythrlysleugluphelys
100105110
<210>25
<211>8
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>25
glypheasppheserargtyrtrp
15
<210>26
<211>8
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>26
ileasnprogluserasnthrmet
15
<210>27
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>27
alathrserhishistyrglyleupheasptyr
1510
<210>28
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>28
lysservalserthrserglytyrasntyr
1510
<210>29
<211>3
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>29
leualaser
1
<210>30
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>30
glnhisserarggluleuproargthr
15
<210>31
<211>5
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>31
argtyrtrpmetser
15
<210>32
<211>17
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>32
gluileasnprogluserasnthrmetasntyrserproserleulys
151015
glu
<210>33
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>33
serhishistyrglyleupheasptyr
15
<210>34
<211>15
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>34
argalaserlysservalserthrserglytyrasntyrilehis
151015
<210>35
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>35
leualasertyrleugluser
15
<210>36
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>36
glnhisserarggluleuproargthr
15
<210>37
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>37
glypheasppheserargtyr
15
<210>38
<211>6
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>38
asnprogluserasnthr
15
<210>39
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>39
serhishistyrglyleupheasptyr
15
<210>40
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>40
serlysservalserthrserglytyrasntyr
1510
<210>41
<211>3
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>41
leualaser
1
<210>42
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>42
serarggluleuproargthr
15
<210>43
<211>354
<212>dna
<213>人工序列
<220>
<223>合成的核苷酸序列
<400>43
gaggtgaagcttctcgagtctggaggtggcctggtgcagcctggaggatccctgaaactc60
tcctgtgtagcctcaggattcgattttagtagatactggatgagttgggtccggcaggct120
ccagggaaagggccagaatggattggagaaattaatccagaaagcaatacgatgaactat180
tcgccatctctaaaggaaaaattcatcatctccagagacaccgccaaaaatatgttgtac240
ctgcaaatgagcaaagtgagatctgaggacacagccctttattactgtgcaacctctcat300
cactacggcctattcgattactggggccaagggactctggtcactgtctctgca354
<210>44
<211>333
<212>dna
<213>人工序列
<220>
<223>合成的核苷酸序列
<400>44
gacattgtgctgacacagtctcctgcttccttagctgtgtctctggggcagagggccacc60
atctcatgcagggccagcaaaagtgtcagtacttctggctataattatatacactggtac120
caacagaaaccaggacagccacccaaactcctcatctatcttgcatcctacctagaatct180
ggggtccctgccaggttcagtggcagtgggtctgggacagacttcaccctcaacatccac240
cctgtggaggaggaggatgctgcaacctatttctgtcagcacagtagggagcttcctcgg300
acgttcggtggaggcaccaagctggaattcaaa333
<210>45
<211>8
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(7)..(7)
<223>d或y
<400>45
glypheasppheserargxaatrp
15
<210>46
<211>8
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(4)..(4)
<223>d或e
<220>
<221>mod_res
<222>(6)..(6)
<223>s或n
<220>
<221>mod_res
<222>(8)..(8)
<223>k或m
<400>46
ileasnproxaaserxaathrxaa
15
<210>47
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(5)..(5)
<223>y或h
<220>
<221>mod_res
<222>(10)..(10)
<223>g或d
<400>47
alathrserhisxaatyrglyleuphexaatyr
1510
<210>48
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(9)..(9)
<223>s或n
<400>48
lysservalserthrserglytyrxaatyr
1510
<210>49
<211>3
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>49
leualaser
1
<210>50
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>50
glnhisserarggluleuproargthr
15
<210>51
<211>5
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(2)..(2)
<223>d或y
<400>51
argxaatrpmetser
15
<210>52
<211>17
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(5)..(5)
<223>d或e
<220>
<221>mod_res
<222>(7)..(7)
<223>s或n
<220>
<221>mod_res
<222>(9)..(9)
<223>k或m
<220>
<221>mod_res
<222>(12)..(12)
<223>t或s
<220>
<221>mod_res
<222>(17)..(17)
<223>d或e
<400>52
gluileasnproxaaserxaathrxaaasntyrxaaproserleulys
151015
xaa
<210>53
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(3)..(3)
<223>y或h
<220>
<221>mod_res
<222>(8)..(8)
<223>g或d
<400>53
serhisxaatyrglyleuphexaatyr
15
<210>54
<211>15
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(12)..(12)
<223>s或n
<220>
<221>mod_res
<222>(14)..(14)
<223>m或i
<400>54
argalaserlysservalserthrserglytyrxaatyrxaahis
151015
<210>55
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>55
leualasertyrleugluser
15
<210>56
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>56
glnhisserarggluleuproargthr
15
<210>57
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(7)..(7)
<223>d或y
<400>57
glypheasppheserargxaa
15
<210>58
<211>6
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(3)..(3)
<223>d或e
<220>
<221>mod_res
<222>(5)..(5)
<223>s或n
<400>58
asnproxaaserxaathr
15
<210>59
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(3)..(3)
<223>y或h
<220>
<221>mod_res
<222>(8)..(8)
<223>g或d
<400>59
serhisxaatyrglyleuphexaatyr
15
<210>60
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(10)..(10)
<223>s或n
<400>60
serlysservalserthrserglytyrxaatyr
1510
<210>61
<211>3
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>61
leualaser
1
<210>62
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>62
serarggluleuproargthr
15
<210>63
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>63
glypheasppheserargasptrpmetser
1510
<210>64
<211>17
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>64
gluileasnproaspserserthrlysasntyrthrproserleulys
151015
asp
<210>65
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>65
alathrserhistyrtyrglyleupheglytyr
1510
<210>66
<211>15
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>66
argalaserlysservalserthrserglytyrsertyrmethis
151015
<210>67
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>67
leualasertyrleugluser
15
<210>68
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>68
glnhisserarggluleuproargthr
15
<210>69
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>69
glypheasppheserargtyrtrpmetser
1510
<210>70
<211>17
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>70
gluileasnprogluserasnthrmetasntyrserproserleulys
151015
glu
<210>71
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>71
alathrserhishistyrglyleupheasptyr
1510
<210>72
<211>15
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>72
argalaserlysservalserthrserglytyrasntyrilehis
151015
<210>73
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>73
leualasertyrleugluser
15
<210>74
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>74
glnhisserarggluleuproargthr
15
<210>75
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(7)..(7)
<223>d或y
<400>75
glypheasppheserargxaatrpmetser
1510
<210>76
<211>17
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(5)..(5)
<223>d或e
<220>
<221>mod_res
<222>(7)..(7)
<223>s或n
<220>
<221>mod_res
<222>(9)..(9)
<223>k或m
<220>
<221>mod_res
<222>(12)..(12)
<223>t或s
<220>
<221>mod_res
<222>(17)..(17)
<223>d或e
<400>76
gluileasnproxaaserxaathrxaaasntyrxaaproserleulys
151015
xaa
<210>77
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(5)..(5)
<223>y或h
<220>
<221>mod_res
<222>(10)..(10)
<223>g或d
<400>77
alathrserhisxaatyrglyleuphexaatyr
1510
<210>78
<211>15
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(12)..(12)
<223>s或n
<220>
<221>mod_res
<222>(14)..(14)
<223>m或i
<400>78
argalaserlysservalserthrserglytyrxaatyrxaahis
151015
<210>79
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>79
leualasertyrleugluser
15
<210>80
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>80
glnhisserarggluleuproargthr
15
<210>81
<211>2
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>81
argasp
1
<210>82
<211>6
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>82
asnproaspserserthr
15
<210>83
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>83
serhistyrtyrglyleupheglytyr
15
<210>84
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>84
lysservalserthrserglytyrsertyr
1510
<210>85
<211>3
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>85
leualaser
1
<210>86
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>86
serarggluleuproargthr
15
<210>87
<211>2
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>87
argtyr
1
<210>88
<211>6
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>88
asnprogluserasnthr
15
<210>89
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>89
serhishistyrglyleupheasptyr
15
<210>90
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>90
lysservalserthrserglytyrasntyr
1510
<210>91
<211>3
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>91
leualaser
1
<210>92
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>92
serarggluleuproargthr
15
<210>93
<211>2
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(2)..(2)
<223>d或y
<400>93
argxaa
1
<210>94
<211>6
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(3)..(3)
<223>d或e
<220>
<221>mod_res
<222>(5)..(5)
<223>s或n
<400>94
asnproxaaserxaathr
15
<210>95
<211>9
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(3)..(3)
<223>y或h
<220>
<221>mod_res
<222>(8)..(8)
<223>g或d
<400>95
serhisxaatyrglyleuphexaatyr
15
<210>96
<211>10
<212>prt
<213>人工序列
<220>
<223>合成肽
<220>
<221>mod_res
<222>(9)..(9)
<223>s或n
<400>96
lysservalserthrserglytyrxaatyr
1510
<210>97
<211>3
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>97
leualaser
1
<210>98
<211>7
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>98
serarggluleuproargthr
15
<210>99
<211>15
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>99
argproalaproglyserthralaproproalahisglyvalthr
151015
<210>100
<211>4
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>100
glypheleugly
1
<210>101
<211>4
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>101
alaleualaleu
1
<210>102
<211>24
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>102
tyrleuhisleuglyalaleuglyargaspleutrpglyproserpro
151015
valthrglytyrhisproleuleu
20
<210>103
<211>27
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>103
phetrpvalleuvalvalvalglyglyvalleualacystyrserleu
151015
leuvalthrvalalapheileilephetrpval
2025
<210>104
<211>44
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>104
thrthrthrproalaproargproprothrproalaprothrileala
151015
serglnproleuserleuargproglualacysargproalaalagly
202530
glyalavalhisthrargglyleuaspphealacys
3540
<210>105
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>105
thralaproproalahisglyvalthrseralaproaspthrargpro
151015
alaproglyserthralaproproalahisglyval
2025
<210>106
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>106
thralaproproalahisglyvalthrseralaproalathrargpro
151015
alaproglyserthralaproproalahisglyval
2025
<210>107
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>107
thralaproproalahisglyvalthrseralaproaspalaargpro
151015
alaproglyserthralaproproalahisglyval
2025
<210>108
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>108
thralaproproalahisglyvalthrseralaproaspthralapro
151015
alaproglyserthralaproproalahisglyval
2025
<210>109
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>109
thralaproproalahisglyvalthrseralaproaspthrargala
151015
alaproglyserthralaproproalahisglyval
2025
<210>110
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>110
thralaproproalahisglyvalthrseralaproaspthrargpro
151015
glyproglyserthralaproproalahisglyval
2025
<210>111
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>111
thralaproproalahisglyvalthrseralaproaspthrargpro
151015
alaalaglyserthralaproproalahisglyval
2025
<210>112
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>112
thralaproproalahisglyvalthrseralaproaspthrargpro
151015
alaproalaserthralaproproalahisglyval
2025
<210>113
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>113
thralaproproalahisglyvalthrseralaproaspthrargpro
151015
alaproglyalathralaproproalahisglyval
2025
<210>114
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>114
thralaproproalahisglyvalthrseralaproaspthrargpro
151015
alaproglyseralaalaproproalahisglyval
2025
<210>115
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>115
thralaproproalahisglyvalthrseralaproaspthrargpro
151015
alaproglyserthrglyproproalahisglyval
2025
<210>116
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>116
thralaproproalahisglyvalthrseralaproaspthrargpro
151015
alaproglyserthralaalaproalahisglyval
2025
<210>117
<211>28
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>117
thralaproproalahisglyvalthrseralaproaspthrargpro
151015
alaproglyserthralaproalaalahisglyval
2025
<210>118
<211>20
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>118
proprogluargglyalaproproserthrphelysglythrprothr
151015
alagluasnpro
20
- 还没有人留言评论。精彩留言会获得点赞!