与靶向PD-L1的工程化Fc-抗原结合结构域构建体有关的组合物和方法与流程
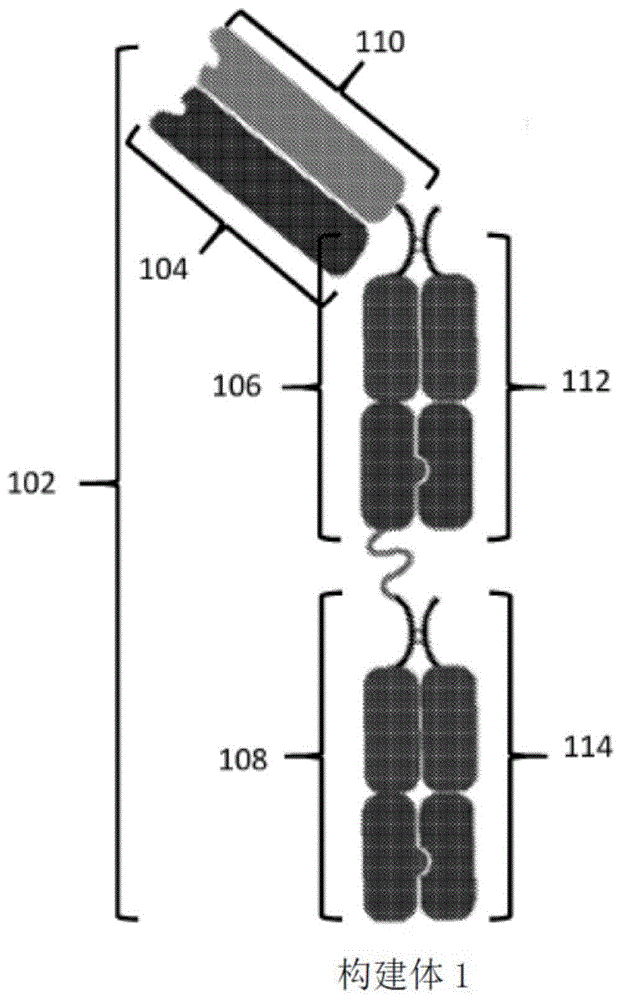
背景技术:
:程序性死亡配体1(pd-l1)是pd-1的配体,pd-l1的上调被认为在某些癌细胞逃避免疫监视的能力中起作用。(阿维鲁单抗)是靶向pd-l1的完全人类抗体,用于治疗转移性麦克尔细胞癌,并且正被考虑用于治疗其他癌症,例如表达pd-l1的癌症。(帕姆单抗)是靶向pd-l1的人源化抗体,用于治疗黑素瘤、某些非小细胞肺癌、头颈癌、经典霍奇金淋巴瘤、某些类型的膀胱癌和泌尿道癌、某些类型的子宫颈癌、某些类型的胃癌以及更普遍的表达pd-l1的癌症。技术实现要素:本公开的特征在于用于将pd-l1结合结构域与至少两个fc结构域组合以产生具有独特生物活性的新治疗剂的组合物和方法。在一些情况下,本公开设想将pd-l1结合结构域(例如,已知治疗性pd-l1抗体的pd-l1结合结构域)与至少两个fc结构域组合以产生具有比已知pd-l1抗体更大的生物活性的新型治疗剂。为了产生此类构建体,本公开提供了用于组装具有至少两个(例如,多个)fc结构域的构建体的各种方法,并且为了控制此类构建体的同二聚化和异二聚化,本公开提供了用于由有限数量的多肽组装不同大小的分子的各种方法。这些构建体的特性允许有效产生基本上同质的药物组合物。药物组合物中的此类同质性是期望的,以便确保药物组合物的安全性、功效、均匀性和可靠性。在第一方面,本公开的特征在于包括增强的效应子功能的fc-抗原结合结构域构建体,其中该fc-抗原结合结构域构建体包括pd-l1结合结构域和通过接头与第二fc结构域连接的第一fc结构域。在第二方面,本公开的特征在于一种组合物,其包括fc-抗原结合结构域构建体的基本上同质的群体,该fc-抗原结合结构域构建体包括pd-l1结合结构域和通过接头与第二fc结构域连接的第一fc结构域。在第三方面,本公开的特征在于一种fc-抗原结合结构域构建体,其包括pd-l1结合结构域和通过接头与第二fc结构域连接的第一fc结构域,其中该fc-抗原结合结构域构建体包括具有单个fc结构域和pd-l1结合结构域的构建体未表现出的生物活性。在第四方面,本公开的特征在于一种组合物,其包括fc-抗原结合结构域构建体的基本上同质的群体,该fc-抗原结合结构域构建体包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的接头;b)第二多肽,其包括第三fc结构域单体;c)第三多肽,其包括第四fc结构域单体;以及d)pd-l1结合结构域,其与第一多肽、第二多肽或第三多肽连接;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第四fc结构域单体组合以形成第二fc结构域。在第四方面的一些实施方案中,pd-l1结合结构域与第一多肽和第二多肽或第三多肽连接,或与第二多肽和第三多肽连接,或者pd-l1结合结构域与第一多肽、第二多肽和第三多肽连接。在第五方面,本公开的特征在于一种fc-抗原结合结构域构建体,其包括增强的效应子功能,其中该fc-抗原结合结构域构建体包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的接头;b)第二多肽,其包括第三fc结构域单体;c)第三多肽,其包括第四fc结构域单体;以及d)pd-l1结合结构域,其与第一多肽、第二多肽或第三多肽连接;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第四fc结构域单体组合以形成第二fc结构域,并且其中该fc-抗原结合结构域构建体相对于具有单个fc结构域和pd-l1结合结构域的构建体在抗体依赖性细胞毒性(adcc)测定、抗体依赖性细胞吞噬作用(adcp)和/或补体依赖性细胞毒性(cdc)测定中具有增强的效应子功能。在第五方面的一些实施方案中,单个fc结构域构建体是抗体。在第六方面,本公开的特征在于一种fc-抗原结合结构域构建体,其包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的接头;b)第二多肽,其包括第三fc结构域单体;c)第三多肽,其包括第四fc结构域单体;以及d)pd-l1结合结构域,其与第一多肽、第二多肽或第三多肽连接;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第四fc结构域单体组合以形成第二fc结构域,并且其中该fc-抗原结合结构域构建体包括具有单个fc结构域和pd-l1结合结构域的构建体未表现出的生物活性。在第六方面的一些实施方案中,生物活性是fc受体介导的效应子功能,诸如adcc、adcp和/或cdc活性(例如,adcc和adcp活性、adcc和cdc活性、adcp和cdc活性,或者adcc、adcp和cdc活性)。在第七方面,本公开的特征在于一种fc-抗原结合结构域构建体,其包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的间隔物;b)第二多肽,其包括第三fc结构域单体;c)第三多肽,其包括第四fc结构域单体;以及d)pd-l1结合结构域,其与第一多肽、第二多肽或第三多肽连接;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第四fc结构域单体组合以形成第二fc结构域。在本公开的第五方面、第六方面和第七方面的一些实施方案中,pd-l1结合结构域与第一多肽和第二多肽或第三多肽连接,或与第二多肽和第三多肽连接,或者pd-l1结合结构域与第一多肽、第二多肽和第三多肽连接。在本公开的第一方面、第二方面、第三方面和第四方面的一些实施方案中,pd-l1结合结构域是fab或fab的vh。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,结合结构域是第一多肽、第二多肽或第三多肽的氨基酸序列的一部分,并且在一些实施方案中,pd-l1结合结构域是scfv。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,pd-l1结合结构域包括vh结构域和ch1结构域,并且其中vh和ch1结构域是第一多肽、第二多肽或第三多肽的氨基酸序列的一部分。在一些实施方案中,pd-l1结合结构域还包括vl结构域,其中在一些实施方案中,fc-抗原结合结构域构建体包括第四多肽,该第四多肽包括vl结构域。在一些实施方案中,vh结构域包括表1中列出的一组cdr-h1、cdr-h2和cdr-h3序列,vh结构域包括包含表2中列出的抗体的序列的vh结构域的cdr-h1、cdr-h2和cdr-h3,vh结构域包括表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3,并且该vh序列不包括cdr-h1、cdr-h2和cdr-h3序列时与表2中列出的抗体的vh序列具有至少95%的同一性、至少97%的同一性、至少99%的同一性或至少99.5%的同一性,或者vh结构域包括表2中列出的抗体的vh序列。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,pd-l1结合结构域包括表1中列出的一组cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列,pd-l1结合结构域包括来自表2中列出的抗体的一组vh和vl序列的cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列,pd-l1结合结构域包括包含表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3的vh结构域以及包含表2中列出的抗体的vl序列的cdr-l1、cdr-l2和cdr-l3的vl结构域,其中vh和vl结构域序列不包括cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列时与表2中列出的抗体的vh和vl序列具有至少有95%的同一性、至少97%的同一性、至少99%的同一性或至少99.5%的同一性,或者pd-l1结合结构域包括表2中列出的抗体的一组vh和vl序列。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,fc-抗原结合结构域构建体还包括iggcl抗体恒定结构域和iggch1抗体恒定结构域,其中iggch1抗体恒定结构域通过接头附接到第一多肽或第二多肽的n末端。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,第一fc结构域单体和第三fc结构域单体包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第一fc结构域单体和第三fc结构域单体之间的二聚化。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,第二fc结构域单体和第四fc结构域单体包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第二fc结构域单体和第四fc结构域单体之间的二聚化。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,二聚化选择性模块包括进入一个fc结构域单体的ch3结构域中的工程化空腔和进入另一个fc结构域单体的ch3结构域中的工程化突起,其中工程化空腔和工程化突起被定位成形成fc结构域单体的突起-进入-空腔对。在一些实施方案中,工程化突起包括选自s354c、t366w、t366y、t394w、t394f和f405w的至少一种修饰,并且工程化空腔包括选自y349c、t366s、l368a、y407v、y407t、y407a、f405a和t394s的至少一种修饰。在一些实施方案中,一个fc结构域单体包括y407v和y349c,而另一个fc结构域单体包括t366w和s354c。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,二聚化选择性模块包括进入一个结构域单体的ch3结构域中的带负电的氨基酸和进入另一个fc结构域单体的ch3结构域中的带正电的氨基酸,其中带负电的氨基酸和带正电的氨基酸被定位成促进fc结构域的形成。在一些实施方案中,第一fc结构域单体和第三fc结构域单体中的每一者包括d399k和k409d或k409e,第一fc结构域单体和第三fc结构域单体中的每一者包括k392d和d399k,第一fc结构域单体和第三fc结构域单体中的每一者包括e357k和k370e,第一fc结构域单体和第三fc结构域单体中的每一者包括d356k和k439d,第一fc结构域单体和第三fc结构域单体中的每一者包括k392e和d399k,第一fc结构域单体和第三fc结构域单体中的每一者括e357k和k370d,第一fc结构域单体和第三fc结构域单体中的每一者包括d356k和k439e,第二fc结构域单体和第四fc结构域单体中的每一者包括s354c和t366w,并且第三多肽和第四多肽各自包括y349c、t366s、l368a和y407v,第三多肽和第四多肽中的每一者包括s354c和t366w,并且第二fc结构域单体和第四fc结构域单体各自包括y349c、t366s、l368a和y407v,第二fc结构域单体和第四fc结构域单体中的每一者包括e357k或e357r,并且第三多肽和第四多肽各自包括k370d或k370e,第二fc结构域单体和第四fc结构域单体中的每一者包括k370d或k370e,并且第三多肽和第四多肽各自包括e357k或357r,第二fc结构域单体和第四fc结构域单体中的每一者包括k409d或k409e,第三多肽和第四多肽各自包括d399k或d399r,或者第二fc结构域单体和第四fc结构域单体中的每一者结构域单体包括d399k或d399r,并且第三多肽和第四多肽各自包括k409d或k409e。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,第二多肽和第三多肽具有相同的氨基酸序列。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,fc-抗原结合结构域构建体中的一个或多个接头是键。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,fc-抗原结合结构域构建体中的一个或多个接头是间隔物。在一些实施方案中,间隔物包括具有以下序列的多肽:gggggggggggggggggggg、ggggs、ggsg、sggg、gsgs、gsgsgs、gsgsgsgs、gsgsgsgsgs、gsgsgsgsgsgs、ggsggs、ggsggsggs、ggsggsggsggs、ggsg、ggsg、ggsgggsg、ggsgggsgggsgggggsggggsggggsggggs、genlyfqsgg、sacycels、rsiat、rpackipndlkqkvmnh、ggsaggsgsgssggssgasgtgtaggtgsgsgtgsg、aaanssidlisvpvdsr、ggsgggsegggsegggsegggsegggsegggsgggs、gggsgggsgggs、sgggsgggsgggsgggsggg、ggsgggsgggsgggsggs、gggg、gggggggg、gggggggggggg或gggggggggggggggg。在一些实施方案中,间隔物是甘氨酸间隔物,例如由4至30、8至30或12至30个甘氨酸残基组成的间隔物,诸如由20个甘氨酸残基组成的间隔物。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,pd-l1结合结构域通过接头与fc结构域单体连接。在一些实施方案中,接头是间隔物。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,至少一个fc结构域在位置i253处包括至少一个氨基酸修饰。在一些实施方案中,位置i253处的每种氨基酸修饰独立地选自i253a、i253c、i253d、i253e、i253f、i253g、i253h、i253i、i253k、i253l、i253m、i253n、i253p、i253q、i253r、i253s、i253t、i253v、i253w和i253y。在一些实施方案中,位置i253处的每种氨基酸修饰是i253a。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,至少一个fc结构域在位置r292处包括至少一个氨基酸修饰。在一些实施方案中,位置r292处的每种氨基酸修饰独立地选自r292d、r292e、r292l、r292p、r292q、r292r、r292t和r292y。在一些实施方案中,位置r292处的每种氨基酸修饰是r292p。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,一个或多个fc结构域单体包括igg铰链结构域、iggch2抗体恒定结构域和iggch3抗体恒定结构域。在一些实施方案中,每个fc结构域单体包括igg铰链结构域、iggch2抗体恒定结构域和iggch3抗体恒定结构域。在一些实施方案中,igg是选自由以下项组成的组的亚型:igg1、igg2a、igg2b、igg3和igg4。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,第四多肽、第五多肽、第六多肽和第七多肽中的每一者中的n末端asp突变为gln。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,第四多肽、第五多肽、第六多肽和第七多肽中的一者或多者缺乏c末端赖氨酸。在一些实施方案中,第四多肽、第五多肽、第六多肽和第七多肽中的每一者缺乏c末端赖氨酸。在本公开的第四方面、第五方面、第六方面和第七方面的一些实施方案中,fc-抗原结合结构域构建体还包括通过接头与一个或多个多肽的n末端或c末端连接的白蛋白结合肽。在第八方面,本公开的特征在于一种细胞培养基,其包括fc-抗原结合结构域构建体的群体,其中以摩尔为基础,至少50%的fc-抗原结合结构域构建体在结构上是相同的,并且其中fc-抗原结合结构域构建体以至少0.1mg/l、10mg/l、25mg/l、50mg/l、75mg/l或100mg/l的浓度存在于培养基中。在本公开的第八方面的一些实施方案中,以摩尔为基础,至少75%、至少85%或至少95%的fc-抗原结合结构域构建体在结构上是相同的。在第九方面,本公开的特征在于一种细胞培养基,其包括fc-抗原结合结构域构建体的群体,其中以摩尔为基础,至少50%的fc-抗原结合结构域构建体包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的接头;b)第二多肽,其包括第三fc结构域单体;c)第三多肽,其包括第四fc结构域单体;以及d)pd-l1结合结构域,其与第一多肽、第二多肽或第三多肽连接;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第四fc结构域单体组合以形成第二fc结构域。在本公开的第九方面的一些实施方案中,以摩尔为基础,至少75%、至少85%或至少95%的fc-抗原结合结构域构建体包括第一fc结构域、第二fc结构域和pd-l1结合结构域。在第十方面,本公开的特征在于一种制造fc-抗原结合结构域构建体的方法,该方法包括:a)培养表达以下项的宿主细胞:(1)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的接头;(2)第二多肽,其包括第三fc结构域单体;(3)第三多肽,其包括第四fc结构域单体;以及(4)pd-l1结合结构域;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第四fc结构域单体组合以形成第二fc结构域;其中pd-l1结合结构域与第一多肽、第二多肽或第三多肽连接,从而形成fc-抗原结合结构域构建体;并且其中以摩尔为基础,细胞培养上清液中至少50%的fc-抗原结合结构域构建体在结构上是相同的,以及b)从细胞培养上清液中纯化fc-抗原结合结构域构建体。在本公开的第九方面和第十方面的一些实施方案中,pd-l1结合结构域与第一多肽和第二多肽或第三多肽连接,或与第二多肽和第三多肽连接,或者pd-l1结合结构域与第一多肽、第二多肽和第三多肽连接。在本公开的第九方面和第十方面的一些实施方案中,pd-l1结合结构域是fab或vh。在本公开的第九方面和第十方面的一些实施方案中,pd-l1结合结构域是第一多肽、第二多肽或第三多肽的氨基酸序列的一部分,并且在一些实施方案中,pd-l1结合结构域是scfv。在本公开的第九方面和第十方面的一些实施方案中,pd-l1结合结构域包括vh结构域和ch1结构域,并且其中vh和ch1结构域是第一多肽、第二多肽或第三多肽的氨基酸序列的一部分。在一些实施方案中,pd-l1结合结构域还包括vl结构域,其中在一些实施方案中,fc-抗原结合结构域构建体包括第四多肽,该第四多肽包括vl结构域。在一些实施方案中,vh结构域包括表1中列出的一组cdr-h1、cdr-h2和cdr-h3序列,vh结构域包括包含表2中列出的抗体的序列的vh结构域的cdr-h1、cdr-h2和cdr-h3,vh结构域包括表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3,并且该vh序列不包括cdr-h1、cdr-h2和cdr-h3序列时与表2中列出的抗体的vh序列具有至少95%的同一性、至少97%的同一性、至少99%的同一性或至少99.5%的同一性,或者vh结构域包括表2中列出的抗体的vh序列。在本公开的第九方面和第十方面的一些实施方案中,pd-l1结合结构域包括表1中列出的一组cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列,pd-l1结合结构域包括来自表2中列出的抗体的一组vh和vl序列的cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列,pd-l1结合结构域包括包含表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3的vh结构域以及包含表2中列出的抗体的vl序列的cdr-l1、cdr-l2和cdr-l3的vl结构域,其中vh和vl结构域序列不包括cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列时与表2中列出的抗体的vh和vl序列具有至少有95%的同一性、至少97%的同一性、至少99%的同一性或至少99.5%的同一性,或者pd-l1结合结构域包括表2中列出的抗体的一组vh和vl序列。在本公开的第九方面和第十方面的一些实施方案中,fc-抗原结合结构域构建体还包括iggcl抗体恒定结构域和iggch1抗体恒定结构域,其中iggch1抗体恒定结构域通过接头附接到第一多肽或第二多肽的n末端。在本公开的第九方面和第十方面的一些实施方案中,第一fc结构域单体和第三fc结构域单体包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第一fc结构域单体和第三fc结构域单体之间的二聚化。在本公开的第九方面和第十方面的一些实施方案中,第二fc结构域单体和第四fc结构域单体包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第二fc结构域单体和第四fc结构域单体之间的二聚化。在本公开的第九方面和第十方面的一些实施方案中,二聚化选择性模块包括进入一个fc结构域单体的ch3结构域中的工程化空腔和进入另一个fc结构域单体的ch3结构域中的工程化突起,其中工程化空腔和工程化突起被定位成形成fc结构域单体的突起-进入-空腔对。在一些实施方案中,工程化突起包括选自s354c、t366w、t366y、t394w、t394f和f405w的至少一种修饰,并且工程化空腔包括选自y349c、t366s、l368a、y407v、y407t、y407a、f405a和t394s的至少一种修饰。在一些实施方案中,一个fc结构域单体包括y407v和y349c,而另一个fc结构域单体包括t366w和s354c。在本公开的第九方面和第十方面的一些实施方案中,二聚化选择性模块包括进入一个结构域单体的ch3结构域中的带负电的氨基酸和进入另一个fc结构域单体的ch3结构域中的带正电的氨基酸,其中带负电的氨基酸和带正电的氨基酸被定位成促进fc结构域的形成。在一些实施方案中,第一fc结构域单体和第三fc结构域单体中的每一者包括d399k和k409d或k409e,第一fc结构域单体和第三fc结构域单体中的每一者包括k392d和d399k,第一fc结构域单体和第三fc结构域单体中的每一者包括e357k和k370e,第一fc结构域单体和第三fc结构域单体中的每一者包括d356k和k439d,第一fc结构域单体和第三fc结构域单体中的每一者包括k392e和d399k,第一fc结构域单体和第三fc结构域单体中的每一者括e357k和k370d,第一fc结构域单体和第三fc结构域单体中的每一者包括d356k和k439e,第二fc结构域单体和第四fc结构域单体中的每一者包括s354c和t366w,并且第三多肽和第四多肽各自包括y349c、t366s、l368a和y407v,第三多肽和第四多肽中的每一者包括s354c和t366w,并且第二fc结构域单体和第四fc结构域单体各自包括y349c、t366s、l368a和y407v,第二fc结构域单体和第四fc结构域单体中的每一者包括e357k或e357r,并且第三多肽和第四多肽各自包括k370d或k370e,第二fc结构域单体和第四fc结构域单体中的每一者包括k370d或k370e,并且第三多肽和第四多肽各自包括e357k或357r,第二fc结构域单体和第四fc结构域单体中的每一者包括k409d或k409e,第三多肽和第四多肽各自包括d399k或d399r,或者第二fc结构域单体和第四fc结构域单体中的每一者结构域单体包括d399k或d399r,并且第三多肽和第四多肽各自包括k409d或k409e。在本公开的第九方面和第十方面的一些实施方案中,第二多肽和第三多肽具有相同的氨基酸序列。在本公开的第九方面和第十方面的一些实施方案中,fc-抗原结合结构域构建体中的一个或多个接头是键。在本公开的第九方面和第十方面的一些实施方案中,fc-抗原结合结构域构建体中的一个或多个接头是间隔物。在一些实施方案中,间隔物包括具有以下序列的多肽:gggggggggggggggggggg、ggggs、ggsg、sggg、gsgs、gsgsgs、gsgsgsgs、gsgsgsgsgs、gsgsgsgsgsgs、ggsggs、ggsggsggs、ggsggsggsggs、ggsg、ggsg、ggsgggsg、ggsgggsgggsgggggsggggsggggsggggs、genlyfqsgg、sacycels、rsiat、rpackipndlkqkvmnh、ggsaggsgsgssggssgasgtgtaggtgsgsgtgsg、aaanssidlisvpvdsr、ggsgggsegggsegggsegggsegggsegggsgggs、gggsgggsgggs、sgggsgggsgggsgggsggg、ggsgggsgggsgggsggs、gggg、gggggggg、gggggggggggg或gggggggggggggggg。在一些实施方案中,间隔物是甘氨酸间隔物,例如由4至30、8至30或12至30个甘氨酸残基组成的间隔物,诸如由20个甘氨酸残基组成的间隔物。在本公开的第九方面和第十方面的一些实施方案中,pd-l1结合结构域通过接头与fc结构域单体连接。在一些实施方案中,接头是间隔物。在本公开的第九方面和第十方面的一些实施方案中,至少一个fc结构域在位置i253处包括至少一个氨基酸修饰。在一些实施方案中,位置i253处的每种氨基酸修饰独立地选自i253a、i253c、i253d、i253e、i253f、i253g、i253h、i253i、i253k、i253l、i253m、i253n、i253p、i253q、i253r、i253s、i253t、i253v、i253w和i253y。在一些实施方案中,位置i253处的每种氨基酸修饰是i253a。在本公开的第九方面和第十方面的一些实施方案中,至少一个fc结构域在位置r292处包括至少一个氨基酸修饰。在一些实施方案中,位置r292处的每种氨基酸修饰独立地选自r292d、r292e、r292l、r292p、r292q、r292r、r292t和r292y。在一些实施方案中,位置r292处的每种氨基酸修饰是r292p。在本公开的第九方面和第十方面的一些实施方案中,一个或多个fc结构域单体包括igg铰链结构域、iggch2抗体恒定结构域和iggch3抗体恒定结构域。在一些实施方案中,每个fc结构域单体包括igg铰链结构域、iggch2抗体恒定结构域和iggch3抗体恒定结构域。在一些实施方案中,igg是选自由以下项组成的组的亚型:igg1、igg2a、igg2b、igg3和igg4。在本公开的第九方面和第十方面的一些实施方案中,第一多肽、第二多肽、第三多肽和第四多肽中的每一者中的n末端asp突变为gln。在本公开的第九方面和第十方面的一些实施方案中,第一多肽、第二多肽、第三多肽和第四多肽中的一者或多者缺乏c末端赖氨酸。在一些实施方案中,第一多肽、第二多肽、第三多肽和第四多肽中的每一者缺乏c末端赖氨酸。在本公开的第九方面和第十方面的一些实施方案中,fc-抗原结合结构域构建体还包括通过接头与一个或多个多肽的n末端或c末端连接的白蛋白结合肽。在本公开的第十一方面的一些实施方案中,第一fc结构域单体和第三fc结构域单体包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第一fc结构域单体和第三fc结构域单体之间的二聚化,其中第二fc结构域单体和第四fc结构域单体包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第二fc结构域单体和第四fc结构域单体之间的二聚化,并且其中第二多肽和第三多肽具有不同的氨基酸序列。在本公开的第十一方面的一些实施方案中,第一pd-l1结合结构域与第一多肽连接,并且第二pd-l1结合结构域与第二多肽和第三多肽连接。在本公开的第十一方面的一些实施方案中,第二fc结构域单体和第四fc结构域单体中的每一者包括e357k和k370d,并且第一fc结构域单体和第三fc结构域单体中的每一者包括k370d和e357k。在本公开的第十二方面的一些实施方案中,第一fc结构域单体和第三fc结构域单体包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第一fc结构域单体和第三fc结构域单体之间的二聚化,其中第二fc结构域单体和第四fc结构域单体包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第二fc结构域单体和第四fc结构域单体之间的二聚化,并且其中第二多肽和第三多肽具有不同的氨基酸序列。在本公开的第十二方面的一些实施方案中,第二fc结构域单体和第四fc结构域单体中的每一者包括d399k和k409d,并且第一fc结构域单体和第三fc结构域单体中的每一者包括e357k和k370d。在本公开的第十一方面和第十二方面的一些实施方案中,第一pd-l1结合结构域是fab或vh结构域。在本公开的第十一方面和第十二方面的一些实施方案中,第一pd-l1结合结构域和第二pd-l1结合结构域是fab。在本公开的第九方面的一些实施方案中,第一pd-l1结合结构域、第二pd-l1结合结构域和第三pd-l1结合结构域是fab或vh结构域。在本公开的第十一方面和第十二方面的一些实施方案中,第一pd-l1结合结构域或第二pd-l1结合结构域是scfv。在本公开的第十一方面和第十二方面的一些实施方案中,第一pd-l1结合结构域和第二pd-l1结合结构域是scfv。在本公开的第九方面的一些实施方案中,第一pd-l1结合结构域、第二pd-l1结合结构域和第三pd-l1结合结构域是scfv。在本公开的第十一方面的一些实施方案中,第一pd-l1结构域或第二pd-l1结构域包括vh结构域和ch1结构域,并且其中vh和ch1结构域是第一多肽、第二多肽或第三多肽的氨基酸序列的一部分。在一些实施方案中,pd-l1结合结构域还包括vl结构域,其中在一些实施方案中,fc-抗原结合结构域构建体包括第四多肽,该第四多肽包括vl结构域。在一些实施方案中,vh结构域包括表1中列出的一组cdr-h1、cdr-h2和cdr-h3序列,vh结构域包括包含表2中列出的抗体的序列的vh结构域的cdr-h1、cdr-h2和cdr-h3,vh结构域包括表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3,并且该vh序列不包括cdr-h1、cdr-h2和cdr-h3序列时与表2中列出的抗体的vh序列具有至少95%的同一性、至少97%的同一性、至少99%的同一性或至少99.5%的同一性,或者vh结构域包括表2中列出的抗体的vh序列。在本公开的第十二方面的一些实施方案中,第一pd-l1结合结构域、第二pd-l1结合结构域或第三pd-l1结合结构域包括vh结构域和ch1结构域,并且其中vh和ch1结构域是第一多肽、第二多肽或第三多肽的氨基酸序列的一部分。在一些实施方案中,pd-l1结合结构域还包括vl结构域,其中在一些实施方案中,fc-抗原结合结构域构建体包括第四多肽,该第四多肽包括vl结构域。在一些实施方案中,vh结构域包括表1中列出的一组cdr-h1、cdr-h2和cdr-h3序列,vh结构域包括包含表2中列出的抗体的序列的vh结构域的cdr-h1、cdr-h2和cdr-h3,vh结构域包括表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3,并且该vh序列不包括cdr-h1、cdr-h2和cdr-h3序列时与表2中列出的抗体的vh序列具有至少95%的同一性、至少97%的同一性、至少99%的同一性或至少99.5%的同一性,或者vh结构域包括表2中列出的抗体的vh序列。在本公开的第十一方面的一些实施方案中,第一pd-l1结合结构域或第二pd-l1结合结构域包括表1中列出的一组cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列,pd-l1结合结构域包括来自表2中列出的抗体的一组vh和vl序列的cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列,pd-l1结合结构域包括包含表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3的vh结构域以及包含表2中列出的抗体的vl序列的cdr-l1、cdr-l2和cdr-l3的vl结构域,其中vh和vl结构域序列不包括cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列时与表2中列出的抗体的vh和vl序列具有至少有95%的同一性、至少97%的同一性、至少99%的同一性或至少99.5%的同一性,或者pd-l1结合结构域包括表2中列出的抗体的一组vh和vl序列。在本公开的第十二方面的一些实施方案中,第一pd-l1结合结构域、第二pd-l1结合结构域或第三pd-l1结合结构域包括表1中列出的一组cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列,pd-l1结合结构域包括来自表2中列出的抗体的一组vh和vl序列的cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列,pd-l1结合结构域包括包含表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3的vh结构域以及包含表2中列出的抗体的vl序列的cdr-l1、cdr-l2和cdr-l3的vl结构域,其中vh和vl结构域序列不包括cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列时与表2中列出的抗体的vh和vl序列具有至少有95%的同一性、至少97%的同一性、至少99%的同一性或至少99.5%的同一性,或者pd-l1结合结构域包括表2中列出的抗体的一组vh和vl序列。在本公开的第十一方面和第十二方面的一些实施方案中,fc-抗原结合结构域构建体还包括iggcl抗体恒定结构域和iggch1抗体恒定结构域,其中iggch1抗体恒定结构域通过接头附接到第一多肽或第二多肽的n末端。在本公开的第十一方面和第十二方面的一些实施方案中,第一fc结构域单体和第三fc结构域单体包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第一fc结构域单体和第三fc结构域单体之间的二聚化。在本公开的第十一方面和第十二方面的一些实施方案中,第二fc结构域单体和第四fc结构域单体包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第二fc结构域单体和第四fc结构域单体之间的二聚化。在本公开的第十一方面和第十二方面的一些实施方案中,二聚化选择性模块包括进入一个fc结构域单体的ch3结构域中的工程化空腔和进入另一个fc结构域单体的ch3结构域中的工程化突起,其中工程化空腔和工程化突起被定位成形成fc结构域单体的突起-进入-空腔对。在一些实施方案中,工程化突起包括选自s354c、t366w、t366y、t394w、t394f和f405w的至少一种修饰,并且工程化空腔包括选自y349c、t366s、l368a、y407v、y407t、y407a、f405a和t394s的至少一种修饰。在一些实施方案中,一个fc结构域单体包括y407v和y349c,而另一个fc结构域单体包括t366w和s354c。在本公开的第十一方面和第十二方面的一些实施方案中,二聚化选择性模块包括进入一个结构域单体的ch3结构域中的带负电的氨基酸和进入另一个fc结构域单体的ch3结构域中的带正电的氨基酸,其中带负电的氨基酸和带正电的氨基酸被定位成促进fc结构域的形成。在一些实施方案中,第一fc结构域单体和第三fc结构域单体中的每一者包括d399k和k409d或k409e,第一fc结构域单体和第三fc结构域单体中的每一者包括k392d和d399k,第一fc结构域单体和第三fc结构域单体中的每一者包括e357k和k370e,第一fc结构域单体和第三fc结构域单体中的每一者包括d356k和k439d,第一fc结构域单体和第三fc结构域单体中的每一者包括k392e和d399k,第一fc结构域单体和第三fc结构域单体中的每一者括e357k和k370d,第一fc结构域单体和第三fc结构域单体中的每一者包括d356k和k439e,第二fc结构域单体和第四fc结构域单体中的每一者包括s354c和t366w,并且第三多肽和第四多肽各自包括y349c、t366s、l368a和y407v,第三多肽和第四多肽中的每一者包括s354c和t366w,并且第二fc结构域单体和第四fc结构域单体各自包括y349c、t366s、l368a和y407v,第二fc结构域单体和第四fc结构域单体中的每一者包括e357k或e357r,并且第三多肽和第四多肽各自包括k370d或k370e,第二fc结构域单体和第四fc结构域单体中的每一者包括k370d或k370e,并且第三多肽和第四多肽各自包括e357k或357r,第二fc结构域单体和第四fc结构域单体中的每一者包括k409d或k409e,第三多肽和第四多肽各自包括d399k或d399r,或者第二fc结构域单体和第四fc结构域单体中的每一者结构域单体包括d399k或d399r,并且第三多肽和第四多肽各自包括k409d或k409e。在本公开的第十一方面和第十二方面的一些实施方案中,fc-抗原结合结构域构建体中的一个或多个接头是键。在本公开的第十一方面和第十二方面的一些实施方案中,fc-抗原结合结构域构建体中的一个或多个接头是间隔物。在一些实施方案中,间隔物包括具有以下序列的多肽:gggggggggggggggggggg、ggggs、ggsg、sggg、gsgs、gsgsgs、gsgsgsgs、gsgsgsgsgs、gsgsgsgsgsgs、ggsggs、ggsggsggs、ggsggsggsggs、ggsg、ggsg、ggsgggsg、ggsgggsgggsgggggsggggsggggsggggs、genlyfqsgg、sacycels、rsiat、rpackipndlkqkvmnh、ggsaggsgsgssggssgasgtgtaggtgsgsgtgsg、aaanssidlisvpvdsr、ggsgggsegggsegggsegggsegggsegggsgggs、gggsgggsgggs、sgggsgggsgggsgggsggg、ggsgggsgggsgggsggs、gggg、gggggggg、gggggggggggg或gggggggggggggggg。在一些实施方案中,间隔物是甘氨酸间隔物,例如由4至30、8至30或12至30个甘氨酸残基组成的间隔物,诸如由20个甘氨酸残基组成的间隔物。在本公开的第十一方面和第十二方面的一些实施方案中,一个或多个pd-l1结合结构域通过接头与fc结构域单体连接。在一些实施方案中,接头是间隔物。在本公开的第十一方面和第十二方面的一些实施方案中,至少一个fc结构域在位置i253处包括至少一个氨基酸修饰。在一些实施方案中,位置i253处的每种氨基酸修饰独立地选自i253a、i253c、i253d、i253e、i253f、i253g、i253h、i253i、i253k、i253l、i253m、i253n、i253p、i253q、i253r、i253s、i253t、i253v、i253w和i253y。在一些实施方案中,位置i253处的每种氨基酸修饰是i253a。在本公开的第十一方面和第十二方面的一些实施方案中,至少一个fc结构域在位置r292处包括至少一个氨基酸修饰。在一些实施方案中,位置r292处的每种氨基酸修饰独立地选自r292d、r292e、r292l、r292p、r292q、r292r、r292t和r292y。在一些实施方案中,位置r292处的每种氨基酸修饰是r292p。在本公开的第十一方面和第十二方面的一些实施方案中,一个或多个fc结构域单体包括igg铰链结构域、iggch2抗体恒定结构域和iggch3抗体恒定结构域。在一些实施方案中,每个fc结构域单体包括igg铰链结构域、iggch2抗体恒定结构域和iggch3抗体恒定结构域。在一些实施方案中,igg是选自由以下项组成的组的亚型:igg1、igg2a、igg2b、igg3和igg4。在本公开的第十一方面和第十二方面的一些实施方案中,第一多肽、第二多肽、第三多肽和第四多肽中的每一者中的n末端asp突变为gln。在本公开的第十一方面和第十二方面的一些实施方案中,第一多肽、第二多肽、第三多肽和第四多肽中的一者或多者缺乏c末端赖氨酸。在一些实施方案中,第一多肽、第二多肽、第三多肽和第四多肽中的每一者缺乏c末端赖氨酸。在本公开的第十一方面和第十二方面的一些实施方案中,fc-抗原结合结构域构建体还包括通过接头与一个或多个多肽的n末端或c末端连接的白蛋白结合肽。在第十三方面,本公开的特征在于一种组合物,其包括fc-抗原结合结构域构建体的基本上同质的群体,该fc-抗原结合结构域构建体包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的第一接头;以及b)第二多肽,其包括i)第三fc结构域单体,ii)第四fc结构域单体,以及iv)连接第三fc结构域单体和第四fc结构域单体的第二接头;以及c)第三多肽,其包括第五fc结构域单体;d)第四多肽,其包括第六fc结构域单体;以及d)pd-l1结合结构域,其与第一多肽、第二多肽、第三多肽或第四多肽连接;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第五fc结构域单体组合以形成第二fc结构域,第四fc结构域单体和第六fc结构域单体组合以形成第三fc结构域。在本公开的第十三方面的一些实施方案中,第一fc结构域单体和第三fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第一fc结构域单体和第三fc结构域单体之间的二聚化,第二fc结构域单体和第五fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第二fc结构域单体和第五fc结构域单体之间的二聚化,并且第四fc结构域单体和第六fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第四fc结构域单体和第六fc结构域单体之间的二聚化。在第十四方面,本公开的特征在于一种组合物,其包括fc-抗原结合结构域构建体的基本上同质的群体,该fc-抗原结合结构域构建体包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的第一接头;以及b)第二多肽,其包括i)第三fc结构域单体,ii)第四fc结构域单体,以及iv)连接第三fc结构域单体和第四fc结构域单体的第二接头;以及c)第三多肽,其包括第五fc结构域单体;d)第四多肽,其包括第六fc结构域单体;以及e)pd-l1结合结构域,其与第一多肽、第二多肽、第三多肽或第四多肽连接;其中第二fc结构域单体和第四fc结构域单体组合以形成第一fc结构域,并且第一fc结构域单体和第五fc结构域单体组合以形成第二fc结构域,第三fc结构域单体和第六fc结构域单体组合以形成第三fc结构域。在本公开的第十四方面的一些实施方案中,第二fc结构域单体和第四fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第二fc结构域单体和第四fc结构域单体之间的二聚化,第一fc结构域单体和第五fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第一fc结构域单体和第五fc结构域单体之间的二聚化,并且第三fc结构域单体和第六fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第三fc结构域单体和第六fc结构域单体之间的二聚化。在第十五方面,本公开的特征在于一种组合物,其包括fc-抗原结合结构域构建体的基本上同质的群体,该fc-抗原结合结构域构建体包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,iii)第三fc结构域单体,iv)连接第一fc结构域单体和第二fc结构域单体的第一接头;以及v)连接第二fc结构域单体和第三fc结构域单体的第二接头;b)第二多肽,其包括i)第四fc结构域单体,ii)第五fc结构域单体,iii)第六fc结构域单体,iv)连接第四fc结构域单体和第五fc结构域单体的第三接头;以及v)连接第五fc结构域单体和第六fc结构域单体的第四接头;c)第三多肽,其包括第七fc结构域单体;d)第四多肽,其包括第八fc结构域单体;e)第五多肽,其包括第九fc结构域单体;f)第六多肽,其包括第十fc结构域单体;以及g)pd-l1结合结构域,其与第一多肽、第二多肽、第三多肽、第四多肽、第五多肽或第六多肽连接;其中第二fc结构域单体和第五fc结构域单体组合以形成第一fc结构域,并且第一fc结构域单体和第七fc结构域单体组合以形成第二fc结构域,第四fc结构域单体和第八fc结构域单体组合以形成第三fc结构域,第三fc结构域单体和第九fc结构域单体组合以形成第四fc结构域,并且第六fc结构域单体和第十fc结构域单体组合以形成第五fc结构域。在本公开的第十五方面的一些实施方案中,第二fc结构域单体和第五fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第二fc结构域单体和第五fc结构域单体之间的二聚化,第一fc结构域单体和第七fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第一fc结构域单体和第七fc结构域单体之间的二聚化,第四fc结构域单体和第八fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第四fc结构域单体和第八fc结构域单体之间的二聚化,第三fc结构域单体和第九fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第三fc结构域单体和第九fc结构域单体之间的二聚化,并且第六fc结构域单体和第十fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第六fc结构域单体和第十fc结构域单体之间的二聚化。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,pd-l1结合结构域是fab或vh结构域。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,pd-l1结合结构域是一种或多种多肽的氨基酸序列的一部分,并且在一些实施方案中,pd-l1结合结构域是scfv。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,pd-l1结合结构域包括vh结构域和ch1结构域,并且其中vh和ch1结构域是第一多肽、第二多肽或第三多肽的氨基酸序列的一部分。在一些实施方案中,pd-l1结合结构域还包括vl结构域,其中在一些实施方案中,fc-抗原结合结构域构建体包括第四多肽,该第四多肽包括vl结构域。在一些实施方案中,vh结构域包括表1中列出的一组cdr-h1、cdr-h2和cdr-h3序列,vh结构域包括包含表2中列出的抗体的序列的vh结构域的cdr-h1、cdr-h2和cdr-h3,vh结构域包括表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3,并且该vh序列不包括cdr-h1、cdr-h2和cdr-h3序列时与表2中列出的抗体的vh序列具有至少95%的同一性、至少97%的同一性、至少99%的同一性或至少99.5%的同一性,或者vh结构域包括表2中列出的抗体的vh序列。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,pd-l1结合结构域包括表1中列出的一组cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列,pd-l1结合结构域包括来自表2中列出的抗体的一组vh和vl序列的cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列,pd-l1结合结构域包括包含表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3的vh结构域以及包含表2中列出的抗体的vl序列的cdr-l1、cdr-l2和cdr-l3的vl结构域,其中vh和vl结构域序列不包括cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列时与表2中列出的抗体的vh和vl序列具有至少有95%的同一性、至少97%的同一性、至少99%的同一性或至少99.5%的同一性,或者pd-l1结合结构域包括表2中列出的抗体的一组vh和vl序列。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,fc-抗原结合结构域构建体还包括iggcl抗体恒定结构域和iggch1抗体恒定结构域,其中iggch1抗体恒定结构域通过接头附接到第一多肽或第二多肽的n末端。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,二聚化选择性模块包括进入一个fc结构域单体的ch3结构域中的工程化空腔和进入另一个fc结构域单体的ch3结构域中的工程化突起,其中工程化空腔和工程化突起被定位成形成fc结构域单体的突起-进入-空腔对。在一些实施方案中,工程化突起包括选自s354c、t366w、t366y、t394w、t394f和f405w的至少一种修饰,并且工程化空腔包括选自y349c、t366s、l368a、y407v、y407t、y407a、f405a和t394s的至少一种修饰。在一些实施方案中,一个fc结构域单体包括y407v和y349c,而另一个fc结构域单体包括t366w和s354c。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,二聚化选择性模块包括进入一个结构域单体的ch3结构域中的带负电的氨基酸和进入另一个fc结构域单体的ch3结构域中的带正电的氨基酸,其中带负电的氨基酸和带正电的氨基酸被定位成促进fc结构域的形成。在一些实施方案中,第一fc结构域单体和第三fc结构域单体中的每一者包括d399k和k409d或k409e,第一fc结构域单体和第三fc结构域单体中的每一者包括k392d和d399k,第一fc结构域单体和第三fc结构域单体中的每一者包括e357k和k370e,第一fc结构域单体和第三fc结构域单体中的每一者包括d356k和k439d,第一fc结构域单体和第三fc结构域单体中的每一者包括k392e和d399k,第一fc结构域单体和第三fc结构域单体中的每一者括e357k和k370d,第一fc结构域单体和第三fc结构域单体中的每一者包括d356k和k439e,第二fc结构域单体和第四fc结构域单体中的每一者包括s354c和t366w,并且第三多肽和第四多肽各自包括y349c、t366s、l368a和y407v,第三多肽和第四多肽中的每一者包括s354c和t366w,并且第二fc结构域单体和第四fc结构域单体各自包括y349c、t366s、l368a和y407v,第二fc结构域单体和第四fc结构域单体中的每一者包括e357k或e357r,并且第三多肽和第四多肽各自包括k370d或k370e,第二fc结构域单体和第四fc结构域单体中的每一者包括k370d或k370e,并且第三多肽和第四多肽各自包括e357k或357r,第二fc结构域单体和第四fc结构域单体中的每一者包括k409d或k409e,第三多肽和第四多肽各自包括d399k或d399r,或者第二fc结构域单体和第四fc结构域单体中的每一者结构域单体包括d399k或d399r,并且第三多肽和第四多肽各自包括k409d或k409e。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,fc-抗原结合结构域构建体中的一个或多个接头是键。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,fc-抗原结合结构域构建体中的一个或多个接头是间隔物。在一些实施方案中,间隔物包括具有以下序列的多肽:gggggggggggggggggggg、ggggs、ggsg、sggg、gsgs、gsgsgs、gsgsgsgs、gsgsgsgsgs、gsgsgsgsgsgs、ggsggs、ggsggsggs、ggsggsggsggs、ggsg、ggsg、ggsgggsg、ggsgggsgggsgggggsggggsggggsggggs、genlyfqsgg、sacycels、rsiat、rpackipndlkqkvmnh、ggsaggsgsgssggssgasgtgtaggtgsgsgtgsg、aaanssidlisvpvdsr、ggsgggsegggsegggsegggsegggsegggsgggs、gggsgggsgggs、sgggsgggsgggsgggsggg、ggsgggsgggsgggsggs、gggg、gggggggg、gggggggggggg或gggggggggggggggg。在一些实施方案中,间隔物是甘氨酸间隔物,例如由4至30、8至30或12至30个甘氨酸残基组成的间隔物,诸如由20个甘氨酸残基组成的间隔物。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,pd-l1结合结构域通过接头与fc结构域单体连接。在一些实施方案中,接头是间隔物。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,至少一个fc结构域在位置i253处包括至少一个氨基酸修饰。在一些实施方案中,位置i253处的每种氨基酸修饰独立地选自i253a、i253c、i253d、i253e、i253f、i253g、i253h、i253i、i253k、i253l、i253m、i253n、i253p、i253q、i253r、i253s、i253t、i253v、i253w和i253y。在一些实施方案中,位置i253处的每种氨基酸修饰是i253a。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,至少一个fc结构域在位置r292处包括至少一个氨基酸修饰。在一些实施方案中,位置r292处的每种氨基酸修饰独立地选自r292d、r292e、r292l、r292p、r292q、r292r、r292t和r292y。在一些实施方案中,位置r292处的每种氨基酸修饰是r292p。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,一个或多个fc结构域单体包括igg铰链结构域、iggch2抗体恒定结构域和iggch3抗体恒定结构域。在一些实施方案中,每个fc结构域单体包括igg铰链结构域、iggch2抗体恒定结构域和iggch3抗体恒定结构域。在一些实施方案中,igg是选自由以下项组成的组的亚型:igg1、igg2a、igg2b、igg3和igg4。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,多肽中的每一者中的n末端asp突变为gln。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,多肽中的一者或多者缺乏c末端赖氨酸。在一些实施方案中,多肽中的每一者缺乏c末端赖氨酸。在本公开的第十三方面、第十四方面和第十五方面的一些实施方案中,fc-抗原结合结构域构建体还包括通过接头与一个或多个多肽的n末端或c末端连接的白蛋白结合肽。在第十六方面,本公开的特征在于一种fc-抗原结合结构域构建体,其包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的接头;b)第二多肽,其包括第三fc结构域单体;c)第三多肽,其包括第四fc结构域单体;以及d)第一pd-l1结合结构域,其与第一多肽连接;以及e)第二pd-l1结合结构域,其与第二多肽和/或第三多肽连接;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第四fc结构域单体组合以形成第二fc结构域,其中第一pd-l1结合结构域和第二pd-l1结合结构域结合不同的抗原,并且其中该fc-抗原结合结构域构建体相对于具有单个fc结构域和pd-l1结合结构域的构建体在抗体依赖性细胞毒性(adcc)测定、抗体依赖性细胞吞噬作用(adcp)和/或补体依赖性细胞毒性(cdc)测定中具有增强的效应子功能。在第二十六方面,本公开的特征在于一种fc-抗原结合结构域构建体,其包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的第一接头;以及b)第二多肽,其包括iv)第三fc结构域单体,v)第四fc结构域单体,以及vi)连接第三fc结构域单体和第四fc结构域单体的第二接头;以及c)第三多肽,其包括第五fc结构域单体;d)第四多肽,其包括第六fc结构域单体;以及d)pd-l1结合结构域,其与第一多肽、第二多肽、第三多肽或第四多肽连接,其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第五fc结构域单体组合以形成第二fc结构域,第四fc结构域单体和第六fc结构域单体组合以形成第三fc结构域,并且其中该fc-抗原结合结构域构建体相对于具有单个fc结构域和pd-l1结合结构域的构建体在抗体依赖性细胞毒性(adcc)测定、抗体依赖性细胞吞噬作用(adcp)和/或补体依赖性细胞毒性(cdc)测定中具有增强的效应子功能。在第二十七方面,本公开的特征在于一种fc-抗原结合结构域构建体,其包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的第一接头;以及b)第二多肽,其包括iv)第三fc结构域单体,v)第四fc结构域单体,以及vi)连接第三fc结构域单体和第四fc结构域单体的第二接头;以及c)第三多肽,其包括第五fc结构域单体;d)第四多肽,其包括第六fc结构域单体;以及e)pd-l1结合结构域,其与第一多肽、第二多肽、第三多肽或第四多肽连接;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第五fc结构域单体组合以形成第二fc结构域,第四fc结构域单体和第六fc结构域单体组合以形成第三fc结构域,并且其中该fc-抗原结合结构域构建体包括具有单个fc结构域和pd-l1结合结构域的构建体未表现出的生物活性。在第二十八方面,本公开的特征在于一种fc-抗原结合结构域构建体,其包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的第一间隔物;以及b)第二多肽,其包括iv)第三fc结构域单体,v)第四fc结构域单体,以及vi)连接第三fc结构域单体和第四fc结构域单体的第二间隔物;以及c)第三多肽,其包括第五fc结构域单体;d)第四多肽,其包括第六fc结构域单体;以及e)pd-l1结合结构域,其与第一多肽、第二多肽、第三多肽或第四多肽连接;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第五fc结构域单体组合以形成第二fc结构域,第四fc结构域单体和第六fc结构域单体组合以形成第三fc结构域。在第二十九方面,本公开的特征在于一种细胞培养基,其包括fc-抗原结合结构域构建体的群体,其中以摩尔为基础,至少50%的fc-抗原结合结构域构建体包括:a)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的第一接头;以及b)第二多肽,其包括iv)第三fc结构域单体,v)第四fc结构域单体,以及vi)连接第三fc结构域单体和第四fc结构域单体的第二接头;以及c)第三多肽,其包括第五fc结构域单体;d)第四多肽,其包括第六fc结构域单体;以及e)pd-l1结合结构域,其与第一多肽、第二多肽、第三多肽或第四多肽连接;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第五fc结构域单体组合以形成第二fc结构域,第四fc结构域单体和第六fc结构域单体组合以形成第三fc结构域。在第三十方面,本公开的特征在于一种制造fc-抗原结合结构域构建体的方法,该方法包括:a)培养表达以下项的宿主细胞:(1)第一多肽,其包括i)第一fc结构域单体,ii)第二fc结构域单体,以及iii)连接第一fc结构域单体和第二fc结构域单体的第一接头;以及(2)第二多肽,其包括iv)第三fc结构域单体,v)第四fc结构域单体,以及vi)连接第三fc结构域单体和第四fc结构域单体的第二接头;以及(3)第三多肽,其包括第五fc结构域单体;(4)第四多肽,其包括第六fc结构域单体;以及(5)pd-l1结合结构域,其与第一多肽、第二多肽、第三多肽或第四多肽连接;其中第一fc结构域单体和第三fc结构域单体组合以形成第一fc结构域,并且第二fc结构域单体和第五fc结构域单体组合以形成第二fc结构域,第四fc结构域单体和第六fc结构域单体组合以形成第三fc结构域,并且其中以摩尔为基础,细胞培养上清液中至少50%的fc-抗原结合结构域构建体在结构上是相同的,以及b)从细胞培养上清液中纯化fc-抗原结合结构域构建体。在本公开的第二十六方面、第二十七方面、第二十八方面、第二十九方面和第三十方面的一些实施方案中,第一fc结构域单体和第三fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第一fc结构域单体和第三fc结构域单体之间的二聚化,第二fc结构域单体和第五fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第二fc结构域单体和第五fc结构域单体之间的二聚化,并且第四fc结构域单体和第六fc结构域单体中的每一者包括互补的二聚化选择性模块,所述互补的二聚化选择性模块促进第四fc结构域单体和第六fc结构域单体之间的二聚化。在本公开的所有方面的一些实施方案中,fc-抗原结合结构域构建体具有减少的岩藻糖基化。因此,在一些实施方案中,包含fc-抗原结合结构域构建体的组合物中少于40%、30%、20%、15%、10%或5%的fc结构域单体被岩藻糖基化。在本公开的所有方面的一些实施方案中,fc结构域单体在ch3结构域中包含图25a(seqidno:43)的具有多至10(9、8、7、6、5、4、3、2或1)个单一氨基酸变化的氨基酸序列。在本公开的所有方面的一些实施方案中,fc结构域单体在ch3结构域中包含图25b(seqidno:45)的具有多至10(9、8、7、6、5、4、3、2或1)个单一氨基酸变化的氨基酸序列。在本公开的所有方面的一些实施方案中,fc结构域单体在ch3结构域中包含图25c(seqidno:47)的具有多至10(9、8、7、6、5、4、3、2或1)个单一氨基酸变化的氨基酸序列。在本公开的所有方面的一些实施方案中,fc结构域单体在ch3结构域中包含图25d(seqidno:42)的具有多至10(9、8、7、6、5、4、3、2或1)个单一氨基酸变化的氨基酸序列。在本公开的所有方面的一些实施方案中,例如,当fc结构域单体在多肽的羧基末端时,fc结构域单体不包括k447。在其他实施方案中,例如,当fc结构域单体不在多肽的羧基末端时,fc结构域单体包括k447。在本公开的所有方面的一些实施方案中,例如,当fc结构域单体在接头的氨基末端时,fc结构域单体不包括从e216到c220(包括端点)的铰链部分,而是包括从d221到l235(包括端点)的铰链部分。在其他实施方案中,例如,当fc结构域单体在ch1结构域的羧基末端时,fc结构域单体包括从e216到l235(包括端点)的铰链部分。在本公开的所有方面的一些实施方案中,铰链结构域(例如,在多肽的氨基末端的铰链结构域)在eu位置221处具有从asp到gln的突变。如上所述,本公开的fc-抗原结合结构域构建体由多肽组装而成,所述多肽包括包含两个或更多个igg1fc结构域单体的多肽,并且此类多肽是本公开的一个方面。在第四十一方面,本公开的特征在于一种多肽,其包含:pd-l1结合结构域;接头;第一igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域;第二接头;第二igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域;任选的第三接头;以及任选的第三igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域,其中至少一个fc结构域单体包含形成工程化突起的突变。在第四十一方面的各个实施方案中:pd-l1结合结构域包含抗体重链可变结构域;pd-l1结合结构域包含抗体轻链可变域;第一igg1fc结构域单体包含两个或四个反向电荷突变,并且第二igg1fc结构域单体包含形成工程化突起的突变;第一igg1fc结构域单体包含形成工程化突起的突变,并且第二igg1fc结构域单体包含两个或四个反向电荷突变;第一igg1fc结构域单体和第二igg恒定结构域单体均包含形成工程化突起的突变;该多肽包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体、第二igg1fc结构域单体和第三igg1fc结构域单体各自包含形成工程化突起的突变;该多肽包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体和第二igg1fc结构域单体各自均包含形成工程化突起的突变,并且第三igg1fc结构域单体包含两个或四个反向电荷突变;该多肽包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体和第三igg1fc结构域单体各自均包含形成工程化突起的突变,并且第二igg1结构域单体包含两个或四个反向电荷突变;该多肽包含第三接头和第三igg1fc结构域单体,其中第二igg1fc结构域单体和第三igg1fc结构域单体各自均包含形成工程化突起的突变,并且第一igg1结构域单体包含两个或四个反向电荷突变。在第四十一方面的各个实施方案中:包含形成工程化突起的突变的igg1fc结构域单体还包含一个、两个或三个反向电荷突变;形成工程化突起的突变和反向电荷突变在ch3结构域中;突变在从eu位置g341到eu位置k447的序列内,包括端点;突变是单一氨基酸变化;第二接头和任选的第三接头包含选自由以下项组成的组的氨基酸序列或由这些氨基酸序列组成:gggggggggggggggggggg、ggggs、ggsg、sggg、gsgs、gsgsgs、gsgsgsgs、gsgsgsgsgs、gsgsgsgsgsgs、ggsggs、ggsggsggs、ggsggsggsggs、ggsg、ggsg、ggsgggsg、ggsgggsgggsgggggsggggsggggsggggs、genlyfqsgg、sacycels、rsiat、rpackipndlkqkvmnh、ggsaggsgsgssggssgasgtgtaggtgsgsgtgsg、aaanssidlisvpvdsr、ggsgggsegggsegggsegggsegggsegggsgggs、gggsgggsgggs、sgggsgggsgggsgggsggg、ggsgggsgggsgggsggs、gggg、gggggggg、gggggggggggg和gggggggggggggggg;第二接头和任选的第三接头是甘氨酸间隔物;第二接头和任选的第三接头独立地由4至30、4至20、8至30、8至20、12至20或12至30个甘氨酸残基组成;第二接头和任选的第三接头由20个甘氨酸残基组成;至少一个fc结构域单体在eu位置i253处包含单一氨基酸突变,eu位置i253处的每个氨基酸突变独立地选自由以下项组成的组:i253a、i253c、i253d、i253e、i253f、i253g、i253h、i253i、i253k、i253l、i253m、i253n、i253p、i253q、i253r、i253s、i253t、i253v、i253w和i253y;i253位置处的每个氨基酸突变是i253a;至少一个fc结构域单体在eu位置r292处包含单一氨基酸突变;eu位置r292处的每个氨基酸突变独立地选自由以下项组成的组:r292d、r292e、r292l、r292p、r292q、r292r、r292t和r292y;r292位置处的每个氨基酸突变是r292p;每个fc结构域单体独立地包含选自由以下项组成的组的氨基酸序列或由这些氨基酸序列组成:epkscdkthtcppcpapell和dkthtcppcpapell;第二fc结构域单体和第三fc结构域单体的铰链部分具有氨基酸序列dkthtcppcpapell;第一fc结构域单体的铰链部分具有氨基酸序列epkscdkthtcppcpapel;第一fc结构域单体的铰链部分具有氨基酸序列epkscdkthtcppcpapel,并且第二fc结构域单体和第三fc结构域单体的铰链部分具有氨基酸序列dkthtcppcpapell;每个fc结构域单体的ch2结构域独立地包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸缺失或置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸缺失或置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过10个单一氨基酸置换;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过8个单一氨基酸置换;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过6个单一氨基酸置换;其中每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过5个单一氨基酸置换;单一氨基酸置换选自由以下项组成的组:t366y、t366w、t394w、t394y、f405w、f405a、y407a、s354c、y349t、t394f、k409d、k409e、k392d、k392e、k370d、k370e、d399k、d399r、e357k、e357r、d356k和d356r;每个fc结构域单体独立地包含seqidno:42、43、45和47中任一者具有多至10个单一氨基酸置换的氨基酸序列;多至6个单一氨基酸置换是ch3结构域中的反向电荷突变或是形成工程化突起的突变;单一氨基酸置换在从eu位置g341到eu位置k447的序列内,包括端点;至少一个形成工程化突起的突变选自由以下项组成的组:t366y、t366w、t394w、t394y、f405w、s354c、y349t和t394f;两个或四个反向电荷突变选自:k409d、k409e、k392d、k392e、k370d、k370e、d399k、d399r、e357k、e357r、d356k和d356r;pd-l1结合结构域是scfv;pd-l1结合结构域包含vh结构域和ch1结构域;pd-l1结合结构域还包含vl结构域;vh结构域包含表1中列出的一组cdr-h1、cdr-h2和cdr-h3序列;vh结构域包含含有表2中列出的抗体的序列的vh结构域的cdr-h1、cdr-h2和cdr-h3;vh结构域包含表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3,并且该vh序列不包括cdr-h1、cdr-h2和cdr-h3序列时与表2中列出的抗体的vh序列具有至少95%或98%的同一性;vh结构域包含表2中列出的抗体的vh序列;pd-l1结合结构域包含表1中列出的一组cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列;pd-l1结合结构域包含来自表2中列出的抗体的一组vh和vl序列的cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列;pd-l1结合结构域包含含有表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3的vh结构域以及含有表2中列出的抗体的vl序列的cdr-l1、cdr-l2和cdr-l3的vl结构域,其中vh结构域和vl结构域序列不包括cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列时与表2中列出的抗体的vh和vl序列具有至少95%或98%的同一性;pd-l1结合结构域包含表2中列出的抗体的一组vh和vl序列;pd-l1结合结构域包含iggcl抗体恒定结构域和iggch1抗体恒定结构域;pd-l1结合结构域包含vh结构域和ch1结构域,并且可以与包含vl结构域和cl结构域的多肽结合以形成fab。还描述了一种多肽复合物,其包含上述多肽的两个拷贝,所述两个拷贝通过第一igg1fc结构域单体或第二igg1fc结构域单体的铰链内的半胱氨酸残基之间的二硫键连接。还描述了一种多肽复合物,其包含与第二多肽连接的上述多肽,该第二多肽包含igg1fc结构域单体,该igg1fc结构域单体包含铰链结构域、ch2结构域和ch3结构域,其中多肽和第二多肽通过多肽的第一igg1fc结构域单体、第二igg1fc结构域单体或第三igg1fc结构域单体的铰链结构域内的半胱氨酸残基与第二多肽的铰链结构域内的半胱氨酸残基之间的二硫键连接。在复合物的各种实施方案中:第二多肽单体包含形成工程化空腔的突变;形成工程化空腔的突变选自由以下项组成的组:y407t、y407a、f405a、t394s、t394w/y407a、t366w/t394s、t366s/l368a/y407v/y349c、s364h/f405a;第二多肽包含seqidno:42、43、45和47中任一者具有多至10个单一氨基酸置换的氨基酸序列。在第四十二方面,本公开的特征在于:一种多肽,其包含:pd-l1结合结构域;接头;第一igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域;第二接头;第二igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域;任选的第三接头;以及任选的第三igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域,其中至少一个fc结构域单体包含一个、两个或三个反向电荷氨基酸突变。在第四十二方面的各个实施方案中:pd-l1结合结构域包含抗体重链可变结构域;pd-l1结合结构域包含抗体轻链可变域;第一igg1fc结构域单体包含选自表4a和表4b的一组两个反向电荷突变或选自表4a和表4b的一组四个反向电荷突变,并且第二igg1fc结构域单体包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变;第一igg1fc结构域单体包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变,并且第二igg1fc结构域单体包含选自表4a和表4b的一组两个反向电荷突变或选自表4a和表4b的一组四个反向电荷突变;第一igg1fc结构域单体和第二igg恒定结构域单体均包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变;该多肽还包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体、第二igg1fc结构域单体和第三igg1fc结构域单体各自包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变;该多肽还包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体和第二igg1fc结构域单体各自均包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变,并且第三igg1fc结构域单体包含选自表4a和表4b的一组两个反向电荷突变或选自表4a和表4b的一组四个反向电荷突变;该多肽还包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体和第三igg1fc结构域单体各自均包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变,并且第二igg1结构域单体包含选自表4a和表4b的一组两个反向电荷突变或选自表4a和表4b的一组四个反向电荷突变;该多肽还包含第三接头和第三igg1fc结构域单体,其中第二igg1fc结构域单体和第三igg1fc结构域单体各自均包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变,并且第一igg1结构域单体包含选自表4a和表4b的一组两个反向电荷突变或选自表4a和表4b的一组四个反向电荷突变;包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变的igg1fc结构域单体具有相同的ch3结构域;选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变在ch3结构域中;突变在从eu位置g341到eu位置k447的序列内,包括端点;突变各自是单一氨基酸变化;突变在从eu位置g341到eu位置k446的序列内,包括端点;突变是单一氨基酸变化;第二接头和任选的第三接头包含选自由以下项组成的组的氨基酸序列或由这些氨基酸序列组成:gggggggggggggggggggg、ggggs、ggsg、sggg、gsgs、gsgsgs、gsgsgsgs、gsgsgsgsgs、gsgsgsgsgsgs、ggsggs、ggsggsggs、ggsggsggsggs、ggsg、ggsg、ggsgggsg、ggsgggsgggsgggggsggggsggggsggggs、genlyfqsgg、sacycels、rsiat、rpackipndlkqkvmnh、ggsaggsgsgssggssgasgtgtaggtgsgsgtgsg、aaanssidlisvpvdsr、ggsgggsegggsegggsegggsegggsegggsgggs、gggsgggsgggs、sgggsgggsgggsgggsggg、ggsgggsgggsgggsggs、gggg、gggggggg、gggggggggggg和gggggggggggggggg;第二接头和任选的第三接头是甘氨酸间隔物;第二接头和任选的第三接头独立地由4至30、4至20、8至30、8至20、12至20或12至30个甘氨酸残基组成;第二接头和任选的第三接头由20个甘氨酸残基组成;至少一个fc结构域单体在eu位置i253处包含单一氨基酸突变,eu位置i253处的每个氨基酸突变独立地选自由以下项组成的组:i253a、i253c、i253d、i253e、i253f、i253g、i253h、i253i、i253k、i253l、i253m、i253n、i253p、i253q、i253r、i253s、i253t、i253v、i253w和i253y;i253位置处的每个氨基酸突变是i253a;至少一个fc结构域单体在eu位置r292处包含单一氨基酸突变;eu位置r292处的每个氨基酸突变独立地选自由以下项组成的组:r292d、r292e、r292l、r292p、r292q、r292r、r292t和r292y;r292位置处的每个氨基酸突变是r292p;每个fc结构域单体独立地包含选自由以下项组成的组的氨基酸序列或由这些氨基酸序列组成:epkscdkthtcppcpapell和dkthtcppcpapell;第二fc结构域单体和第三fc结构域单体的铰链部分具有氨基酸序列dkthtcppcpapell;第一fc结构域单体的铰链部分具有氨基酸序列epkscdkthtcppcpapel;第一fc结构域单体的铰链部分具有氨基酸序列epkscdkthtcppcpapel,并且第二fc结构域单体和第三fc结构域单体的铰链部分具有氨基酸序列dkthtcppcpapell;每个fc结构域单体的ch2结构域独立地包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸缺失或置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸缺失或置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过10个单一氨基酸置换;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过8个单一氨基酸置换;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过6个单一氨基酸置换;其中每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过5个单一氨基酸置换;单一氨基酸置换选自由以下项组成的组:t366y、t366w、t394w、t394y、f405w、f405a、y407a、s354c、y349t、t394f、k409d、k409e、k392d、k392e、k370d、k370e、d399k、d399r、e357k、e357r、d356k和d356r;每个fc结构域单体独立地包含seqidno:42、43、45和47中任一者具有多至10个单一氨基酸置换的氨基酸序列;多至6个单一氨基酸置换是ch3结构域中的反向电荷突变或是形成工程化突起的突变;单一氨基酸置换在从eu位置g341到eu位置k447的序列内,包括端点;至少一个形成工程化突起的突变选自由以下项组成的组:t366y、t366w、t394w、t394y、f405w、s354c、y349t和t394f;两个或四个反向电荷突变选自:k409d、k409e、k392d、k392e、k370d、k370e、d399k、d399r、e357k、e357r、d356k和d356r;pd-l1结合结构域是scfv;pd-l1结合结构域包含vh结构域和ch1结构域;pd-l1结合结构域还包含vl结构域;vh结构域包含表1中列出的一组cdr-h1、cdr-h2和cdr-h3序列;vh结构域包含含有表2中列出的抗体的序列的vh结构域的cdr-h1、cdr-h2和cdr-h3;vh结构域包含表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3,并且该vh序列不包括cdr-h1、cdr-h2和cdr-h3序列时与表2中列出的抗体的vh序列具有至少95%或98%的同一性;vh结构域包含表2中列出的抗体的vh序列;pd-l1结合结构域包含表1中列出的一组cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列;pd-l1结合结构域包含来自表2中列出的抗体的一组vh和vl序列的cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列;pd-l1结合结构域包含含有表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3的vh结构域以及含有表2中列出的抗体的vl序列的cdr-l1、cdr-l2和cdr-l3的vl结构域,其中vh结构域和vl结构域序列不包括cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列时与表2中列出的抗体的vh和vl序列具有至少95%或98%的同一性;pd-l1结合结构域包含表2中列出的抗体的一组vh和vl序列;pd-l1结合结构域包含iggcl抗体恒定结构域和iggch1抗体恒定结构域;pd-l1结合结构域包含vh结构域和ch1结构域,并且可以与包含vl结构域和cl结构域的多肽结合以形成fab。还描述了一种多肽复合物,其包含任何上述多肽的两个拷贝,所述两个拷贝通过第一igg1fc结构域单体或第二igg1fc结构域单体的铰链内的半胱氨酸残基之间的二硫键连接。还描述了一种多肽复合物,其包含与第二多肽连接的上述多肽,该第二多肽包含igg1fc结构域单体,该igg1fc结构域单体包含铰链结构域、ch2结构域和ch3结构域,其中多肽和第二多肽通过多肽的第一igg1fc结构域单体、第二igg1fc结构域单体或第三igg1fc结构域单体的铰链结构域内的半胱氨酸残基与第二多肽的铰链结构域内的半胱氨酸残基之间的二硫键连接。在各种实施方案中:第二多肽单体包含一个、两个或三个反向电荷突变;第二多肽单体包含选自表4a和表4b的一个、两个或三个反向电荷突变,并且与该多肽中选自表4a和表4b的一个、两个或三个反向电荷突变互补;第二多肽包含seqidno:42、43、45和47中任一者具有多至10个单一氨基酸置换的氨基酸序列。在第四十三方面,本公开的特征在于一种多肽,该多肽包含:第一igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域;第二接头;第二igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域;任选的第三接头;以及任选的第三igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域,其中至少一个fc结构域单体包含形成工程化突起的突变。在第四十三方面的各种实施方案中:该多肽还包含:抗体重链可变结构域和第一igg1单体的氨基末端的ch1结构域或第一igg1单体的scfv氨基末端的scfv;第一igg1fc结构域单体包含两个或四个反向电荷突变,并且第二igg1fc结构域单体包含形成工程化突起的突变;第一igg1fc结构域单体包含形成工程化突起的突变,并且第二igg1fc结构域单体包含两个或四个反向电荷突变;第一igg1fc结构域单体和第二igg恒定结构域单体均包含形成工程化突起的突变;该多肽包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体、第二igg1fc结构域单体和第三igg1fc结构域单体各自包含形成工程化突起的突变;该多肽包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体和第二igg1fc结构域单体各自均包含形成工程化突起的突变,并且第三igg1fc结构域单体包含两个或四个反向电荷突变;该多肽包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体和第三igg1fc结构域单体各自均包含形成工程化突起的突变,并且第二igg1结构域单体包含两个或四个反向电荷突变;该多肽包含第三接头和第三igg1fc结构域单体,其中第二igg1fc结构域单体和第三igg1fc结构域单体各自均包含形成工程化突起的突变,并且第一igg1结构域单体包含两个或四个反向电荷突变。在第四十三方面的各个实施方案中:包含形成工程化突起的突变的igg1fc结构域单体还包含一个、两个或三个反向电荷突变;形成工程化突起的突变和反向电荷突变在ch3结构域中;突变在从eu位置g341到eu位置k447的序列内,包括端点;突变是单一氨基酸变化;第二接头和任选的第三接头包含选自由以下项组成的组的氨基酸序列或由这些氨基酸序列组成:gggggggggggggggggggg、ggggs、ggsg、sggg、gsgs、gsgsgs、gsgsgsgs、gsgsgsgsgs、gsgsgsgsgsgs、ggsggs、ggsggsggs、ggsggsggsggs、ggsg、ggsg、ggsgggsg、ggsgggsgggsgggggsggggsggggsggggs、genlyfqsgg、sacycels、rsiat、rpackipndlkqkvmnh、ggsaggsgsgssggssgasgtgtaggtgsgsgtgsg、aaanssidlisvpvdsr、ggsgggsegggsegggsegggsegggsegggsgggs、gggsgggsgggs、sgggsgggsgggsgggsggg、ggsgggsgggsgggsggs、gggg、gggggggg、gggggggggggg和gggggggggggggggg;第二接头和任选的第三接头是甘氨酸间隔物;第二接头和任选的第三接头独立地由4至30、4至20、8至30、8至20、12至20或12至30个甘氨酸残基组成;第二接头和任选的第三接头由20个甘氨酸残基组成;至少一个fc结构域单体在eu位置i253处包含单一氨基酸突变,eu位置i253处的每个氨基酸突变独立地选自由以下项组成的组:i253a、i253c、i253d、i253e、i253f、i253g、i253h、i253i、i253k、i253l、i253m、i253n、i253p、i253q、i253r、i253s、i253t、i253v、i253w和i253y;i253位置处的每个氨基酸突变是i253a;至少一个fc结构域单体在eu位置r292处包含单一氨基酸突变;eu位置r292处的每个氨基酸突变独立地选自由以下项组成的组:r292d、r292e、r292l、r292p、r292q、r292r、r292t和r292y;r292位置处的每个氨基酸突变是r292p;每个fc结构域单体独立地包含选自由以下项组成的组的氨基酸序列或由这些氨基酸序列组成:epkscdkthtcppcpapell和dkthtcppcpapell;第二fc结构域单体和第三fc结构域单体的铰链部分具有氨基酸序列dkthtcppcpapell;第一fc结构域单体的铰链部分具有氨基酸序列epkscdkthtcppcpapel;第一fc结构域单体的铰链部分具有氨基酸序列epkscdkthtcppcpapel,并且第二fc结构域单体和第三fc结构域单体的铰链部分具有氨基酸序列dkthtcppcpapell;每个fc结构域单体的ch2结构域独立地包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸缺失或置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸缺失或置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过10个单一氨基酸置换;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过8个单一氨基酸置换;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过6个单一氨基酸置换;其中每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过5个单一氨基酸置换;单一氨基酸置换选自由以下项组成的组:t366y、t366w、t394w、t394y、f405w、f405a、y407a、s354c、y349t、t394f、k409d、k409e、k392d、k392e、k370d、k370e、d399k、d399r、e357k、e357r、d356k和d356r;每个fc结构域单体独立地包含seqidno:42、43、45和47中任一者具有多至10个单一氨基酸置换的氨基酸序列;多至6个单一氨基酸置换是ch3结构域中的反向电荷突变或是形成工程化突起的突变;单一氨基酸置换在从eu位置g341到eu位置k447的序列内,包括端点;至少一个形成工程化突起的突变选自由以下项组成的组:t366y、t366w、t394w、t394y、f405w、s354c、y349t和t394f;两个或四个反向电荷突变选自:k409d、k409e、k392d、k392e、k370d、k370e、d399k、d399r、e357k、e357r、d356k和d356r。在第四十四方面,本公开的特征在于一种多肽,该多肽包含:第一igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域;第二接头;第二igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域;任选的第三接头;以及任选的第三igg1fc结构域单体,其包含铰链结构域、ch2结构域和ch3结构域,其中至少一个fc结构域单体包含一个、两个或三个反向电荷氨基酸突变。在第四十四方面的各种实施方案中:该多肽还包含抗体重链可变结构域和第一igg1fc结构域单体的氨基末端的ch1结构域或第一igg1fc结构域单体的氨基末端的scfv。第一igg1fc结构域单体包含选自表4a和表4b的一组两个反向电荷突变或选自表4a和表4b的一组四个反向电荷突变,并且第二igg1fc结构域单体包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变;第一igg1fc结构域单体包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变,并且第二igg1fc结构域单体包含选自表4a和表4b的一组两个反向电荷突变或选自表4a和表4b的一组四个反向电荷突变;第一igg1fc结构域单体和第二igg恒定结构域单体均包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变;该多肽还包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体、第二igg1fc结构域单体和第三igg1fc结构域单体各自包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变;该多肽还包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体和第二igg1fc结构域单体各自均包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变,并且第三igg1fc结构域单体包含选自表4a和表4b的一组两个反向电荷突变或选自表4a和表4b的一组四个反向电荷突变;该多肽还包含第三接头和第三igg1fc结构域单体,其中第一igg1fc结构域单体和第三igg1fc结构域单体各自均包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变,并且第二igg1结构域单体包含选自表4a和表4b的一组两个反向电荷突变或选自表4a和表4b的一组四个反向电荷突变;该多肽还包含第三接头和第三igg1fc结构域单体,其中第二igg1fc结构域单体和第三igg1fc结构域单体各自均包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变,并且第一igg1结构域单体包含选自表4a和表4b的一组两个反向电荷突变或选自表4a和表4bb的一组四个反向电荷突变;包含选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变的igg1fc结构域单体具有相同的ch3结构域;选自表4a和表4b的一个、两个或三个反向电荷氨基酸突变在ch3结构域中;突变在从eu位置g341到eu位置k447的序列内,包括端点;突变各自是单一氨基酸变化;突变在从eu位置g341到eu位置k446的序列内,包括端点;突变是单一氨基酸变化;第二接头和任选的第三接头包含选自由以下项组成的组的氨基酸序列或由这些氨基酸序列组成:gggggggggggggggggggg、ggggs、ggsg、sggg、gsgs、gsgsgs、gsgsgsgs、gsgsgsgsgs、gsgsgsgsgsgs、ggsggs、ggsggsggs、ggsggsggsggs、ggsg、ggsg、ggsgggsg、ggsgggsgggsgggggsggggsggggsggggs、genlyfqsgg、sacycels、rsiat、rpackipndlkqkvmnh、ggsaggsgsgssggssgasgtgtaggtgsgsgtgsg、aaanssidlisvpvdsr、ggsgggsegggsegggsegggsegggsegggsgggs、gggsgggsgggs、sgggsgggsgggsgggsggg、ggsgggsgggsgggsggs、gggg、gggggggg、gggggggggggg和gggggggggggggggg;第二接头和任选的第三接头是甘氨酸间隔物;第二接头和任选的第三接头独立地由4至30、4至20、8至30、8至20、12至20或12至30个甘氨酸残基组成;第二接头和任选的第三接头由20个甘氨酸残基组成;至少一个fc结构域单体在eu位置i253处包含单一氨基酸突变,eu位置i253处的每个氨基酸突变独立地选自由以下项组成的组:i253a、i253c、i253d、i253e、i253f、i253g、i253h、i253i、i253k、i253l、i253m、i253n、i253p、i253q、i253r、i253s、i253t、i253v、i253w和i253y;i253位置处的每个氨基酸突变是i253a;至少一个fc结构域单体在eu位置r292处包含单一氨基酸突变;eu位置r292处的每个氨基酸突变独立地选自由以下项组成的组:r292d、r292e、r292l、r292p、r292q、r292r、r292t和r292y;r292位置处的每个氨基酸突变是r292p;每个fc结构域单体独立地包含选自由以下项组成的组的氨基酸序列或由这些氨基酸序列组成:epkscdkthtcppcpapell和dkthtcppcpapell;第二fc结构域单体和第三fc结构域单体的铰链部分具有氨基酸序列dkthtcppcpapell;第一fc结构域单体的铰链部分具有氨基酸序列epkscdkthtcppcpapel;第一fc结构域单体的铰链部分具有氨基酸序列epkscdkthtcppcpapel,并且第二fc结构域单体和第三fc结构域单体的铰链部分具有氨基酸序列dkthtcppcpapell;每个fc结构域单体的ch2结构域独立地包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸缺失或置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸缺失或置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak,其具有不超过两个单一氨基酸置换;每个fc结构域单体的ch2结构域是相同的并且包含以下氨基酸序列:ggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过10个单一氨基酸置换;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过8个单一氨基酸置换;每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过6个单一氨基酸置换;其中每个fc结构域单体的ch3结构域独立地包含以下氨基酸序列:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg,其具有不超过5个单一氨基酸置换;单一氨基酸置换选自由以下项组成的组:t366y、t366w、t394w、t394y、f405w、f405a、y407a、s354c、y349t、t394f、k409d、k409e、k392d、k392e、k370d、k370e、d399k、d399r、e357k、e357r、d356k和d356r;每个fc结构域单体独立地包含seqidno:42、43、45和47中任一者具有多至10个单一氨基酸置换的氨基酸序列;多至6个单一氨基酸置换是ch3结构域中的反向电荷突变或是形成工程化突起的突变;单一氨基酸置换在从eu位置g341到eu位置k447的序列内,包括端点;vh结构域或scfv包含表1中列出的一组cdr-h1、cdr-h2和cdr-h3序列;vh结构域或scfv包含含有表2中列出的抗体的序列的vh结构域的cdr-h1、cdr-h2和cdr-h3;vh结构域或scfv包含表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3,并且该vh序列不包括cdr-h1、cdr-h2和cdr-h3序列时与表2中列出的抗体的vh序列具有至少95%或98%的同一性;vh结构域或scfv包含表2中列出的抗体的vh序列;vh结构域或scfv包含表1中列出的一组cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列;vh结构域或scfv包含来自表2中列出的抗体的一组vh和vl序列的cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列;vh结构域或scfv包含含有表2中列出的抗体的vh序列的cdr-h1、cdr-h2和cdr-h3的vh结构域以及含有表2中列出的抗体的vl序列的cdr-l1、cdr-l2和cdr-l3的vl结构域,其中vh结构域和vl结构域序列不包括cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3序列时与表2中列出的抗体的vh和vl序列具有至少95%或98%的同一性;vh结构域或scfv包含表2中列出的抗体的一组vh和vl序列。还描述了一种核酸分子,其编码第四十一方面、第四十二方面、第四十三方面和第四十四方面的任何前述多肽。还描述了:表达载体,其包括编码任何前述多肽的核酸;以及宿主细胞,其包含核酸或表达载体;宿主细胞,其还包含编码包含抗体vl结构域的多肽的核酸分子(例如,编码包含抗体vl结构域和抗体cl结构域的多肽的核酸分子);宿主细胞,其还包含编码包含抗体vl结构域和抗体cl结构域的多肽的核酸分子;宿主细胞,其还包含编码包含具有不超过10个单一氨基酸修饰的igg1fc结构域单体的多肽的核酸分子;宿主细胞,其还包含编码包含具有不超过10个单一氨基酸修饰的igg1fc结构域单体的多肽的核酸分子。在各个实施方案中:igg1fc结构域单体在ch3结构域中包含seqidno:42、43、45和47中任一者具有不超过10、8、6或4个单一氨基酸修饰的氨基酸序列。还描述了一种药物组合物,其包含本文所述的任何多肽或多肽复合物。在各种实施方案中,少于40%、30%、20%、10%、5%、2%的多肽具有至少一种岩藻糖。本公开的第四十一方面、第四十二方面、第四十三方面和第四十四方面的多肽可用作本文所述的各种fc-抗原结合结构域构建体的组分。因此,第一方面至第四十方面中任一项的多肽(例如,那些可以包含pd-l1结合结构域的多肽)可以包含本公开的第四十一方面、第四十二方面、第四十三方面和第四十四方面中任一项的多肽或由这些多肽组成。用于本公开的所有方面的其他有用的多肽包括包含具有一个、两个或三个形成空腔的突变(例如,选自y407t、y407a、f405a、t394s、t394w:y407t、t394s:y407a、t366w:t394s、f405t、t366s:l368a:y407v:y349c、s364h:f405a)的fc结构域单体(例如,包含seqidno:42、43、45和47中任一者具有不超过8、6、5、4或3个单一氨基酸置换的氨基酸序列或由这些序列组成)的多肽。这些多肽可以任选地包括来自表4a和表4b的一个、两个或三个反向电荷突变。在各种情况下,包含本文所述的构建体或多肽复合物或多肽的组合物被无岩藻糖基化至少某种程度。例如,至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%或95%存在于组合物中的聚糖(例如,fc聚糖)缺乏岩藻糖残基。因此,5%-60%、5%-50%、5%-40%、10%-50%、10%-50%、10%-40%、20%-50%或20%-40%的聚糖缺乏岩藻糖残基。在各种情况下,包含本文所述的构建体或多肽复合物或多肽的组合物被无岩藻糖基化至少某种程度。例如,至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%或95%存在于组合物中的聚糖(例如,fc聚糖)缺乏岩藻糖残基。因此,5%-60%、5%-50%、5%-40%、10%-50%、10%-50%、10%-40%、20%-50%或20%-40%的聚糖缺乏岩藻糖残基。包含本文所述的pd-l1结合构建体的组合物可以用于治疗表达pd-l1的癌症,例如转移性麦克尔细胞癌、黑素瘤、某些非小细胞肺癌、头颈癌、经典霍奇金淋巴瘤、某些类型的膀胱癌和泌尿道癌、某些类型的子宫颈癌、某些类型的胃癌以及更普遍的表达pd-l1的癌症。在本公开的所有方面,一些或全部fc结构域单体(例如,包含seqidno:42、43、45和47中任一者具有不超过10、8、6或4个单一氨基酸置换(例如,仅在ch3域中)的氨基酸序列的fc结构域单体)除了具有其他氨基酸置换或修饰之外,还可以具有e345k和e43g氨基酸置换中的一者或两者。e345k和e43g氨基酸置换可以增加fc结构域多聚化。本文还描述了一种fc-抗原结合结构域构建体,其包含:a)第一多肽,其包含:i)第一fc结构域单体;ii)第二fc结构域单体iii)第一pd-l1重链结合结构域,以及iv)连接所述第一fc结构域单体和所述第二fc结构域单体的接头;b)第二多肽,其包含:i)第三fc结构域单体;ii)第四fc结构域单体iii)第二pd-l1重链结合结构域,以及iv)连接所述第三fc结构域单体和所述第四fc结构域单体的接头;c)第三多肽,其包含第五fc结构域单体;d)第四多肽,其包含第六fc结构域单体;e)第五多肽,其包含第一pd-l1轻链结合结构域;以及f)第六多肽,其包含第二pd-l1轻链结合结构域;其中第一fc结构域单体和第三fc结构域单体一起形成第一fc结构域,第二fc结构域单体和第五fc结构域单体一起形成第二fc结构域,第四fc单体和第六fc单体一起形成第三fc结构域,第一pd-l1重链结合结构域和第一pd-l1轻链结合结构域一起形成第一fab;并且第二pd-l1重链结合结构域和第二pd-l1轻链结合结构域一起形成第二fab。在各种实施方案中:第一多肽和第二多肽在序列上相同;第三多肽和第四多肽在序列上相同;第五多肽和第六多肽在序列上相同;第一多肽和第二多肽在序列上相同,第三多肽和第四多肽在序列上相同,并且第五多肽和第六多肽在序列上相同;每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;与人igg的氨基酸序列相比,每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;每个fc结构域单体独立地包含seqidno:42、43、45和47中任一者具有多至10、8、7、6、5、4、3、2或1个单一氨基酸置换的氨基酸序列;单一氨基酸置换仅在ch3结构域中;第一fc结构域单体和第三fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第一fc结构域单体和第三fc结构域单体之间的同二聚化;第二fc结构域单体和第五fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第二fc结构域单体和第五fc结构域单体之间的异二聚化,并且第四fc结构域单体和第六fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第四fc结构域单体和第六fc结构域单体之间的异二聚化;促进同二聚化的置换选自表4a和表4b中的置换;并且促进异二聚化的置换选自表3中的置换。还描述了一种fc-抗原结合结构域构建体,其包含:a)第一多肽,其包含:i)第一fc结构域单体;ii)第二fc结构域单体iii)第一pd-l1重链结合结构域,以及iv)连接所述第一fc结构域单体和所述第二fc结构域单体的接头;b)第二多肽,其包含:i)第三fc结构域单体;ii)第四fc结构域单体iii)第二pd-l1重链结合结构域,以及iv)连接所述第三fc结构域单体和所述第四fc结构域单体的接头;c)第三多肽,其包含第五fc结构域单体和第一pd-l1轻链结合结构域;以及d)第四多肽,其包含第六fc结构域单体和第二pd-l1轻链结合结构域;其中第一fc结构域单体和第三fc结构域单体一起形成第一fc结构域,第二fc结构域单体和第五fc结构域单体一起形成第二fc结构域,第四fc单体和第六fc单体一起形成第三fc结构域,第一pd-l1重链结合结构域和第一pd-l1轻链结合结构域一起形成第一fab;并且第二pd-l1重链结合结构域和第二pd-l1轻链结合结构域一起形成第二fab。还描述了一种fc-抗原结合结构域构建体,其包含:a)第一多肽,其包含:i)第一fc结构域单体;ii)第二fc结构域单体iii)第一pd-l1重链结合结构域,以及iv)连接所述第一fc结构域单体和所述第二fc结构域单体的接头;b)第二多肽,其包含:i)第三fc结构域单体;ii)第四fc结构域单体iii)第二pd-l1重链结合结构域,以及iv)连接所述第三fc结构域单体和所述第四fc结构域单体的接头;c)第三多肽,其包含第五fc结构域单体;d)第四多肽,其包含第六fc结构域单体;e)第五多肽,其包含第一pd-l1轻链结合结构域;以及f)第六多肽,其包含第二pd-l1轻链结合结构域;其中第一fc结构域单体和第五fc结构域单体一起形成第一fc结构域,第三fc结构域单体和第六fc结构域单体一起形成第二fc结构域,第二fc单体和第四fc单体一起形成第三fc结构域,第一pd-l1重链结合结构域和第一pd-l1轻链结合结构域一起形成第一fab;并且第二pd-l1重链结合结构域和第二pd-l1轻链结合结构域一起形成第二fab。在各种实施方案中:第一多肽和第二多肽在序列上相同;第三多肽和第四多肽在序列上相同;第五多肽和第六多肽在序列上相同;第一多肽和第二多肽在序列上相同,第三多肽和第四多肽在序列上相同,并且第五多肽和第六多肽在序列上相同;每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;与人igg1的氨基酸序列相比,每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;每个fc结构域单体独立地包含seqidno:42、43、45和47中任一者具有多至10、8、7、6、5、4、3、2或1个单一氨基酸置换的氨基酸序列;单一氨基酸置换仅在ch3结构域中;第二fc结构域单体和第四fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第二fc结构域单体和第四fc结构域单体之间的同二聚化;第一fc结构域单体和第五fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第一fc结构域单体和第五fc结构域单体之间的异二聚化,并且第三fc结构域单体和第六fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第四fc结构域单体和第六fc结构域单体之间的异二聚化;促进同二聚化的置换选自表4a和表4b中的置换;并且促进异二聚化的置换选自表3中的置换。还描述了一种fc-抗原结合结构域构建体,其包含:a)第一多肽,其包含:i)第一fc结构域单体;ii)第二fc结构域单体,iii)第三fc结构域单体,iv)第一pd-l1重链结合结构域,v)连接第一fc结构域单体和第二fc结构域单体的接头,以及vi)连接第二fc结构域单体和第三fc结构域单体的接头;b)第二多肽,其包含:i)第四fc结构域单体,ii)第五fc结构域单体,iii)第六fc结构域单体,iv)第二pd-l1重链结合结构域,v)连接第四fc结构域单体和第五fc结构域单体的接头,以及vi)连接第五fc结构域单体和第六fc结构域单体的接头;c)第三多肽,其包含第七fc结构域单体;d)第四多肽,其包含第八fc结构域单体;e)第五多肽,其包含第九fc结构域单体;f)第六多肽,其包含第十fc结构域单体;g)第七多肽,其包含第一pd-l1轻链结合结构域;以及h)第八多肽,其包含第二pd-l1轻链结合结构域;其中第一fc结构域单体和第七fc结构域单体一起形成第一fc结构域,第四fc结构域单体和第八fc结构域单体一起形成第二fc结构域,第二fc结构域单体和第五fc结构域单体一起形成第三fc结构域,第三fc结构域单体和第九fc结构域单体一起形成第四fc结构域,第六fc单体和第十fc单体一起形成第五fc结构域,第一pd-l1重链结合结构域和第一pd-l1轻链结合结构域一起形成第一fab;并且第二pd-l1重链结合结构域和第二pd-l1轻链结合结构域一起形成第二fab。在各种实施方案中:第一多肽和第二多肽在序列上相同;第三多肽和第四多肽在序列上相同;第五多肽和第六多肽在序列上相同;第七多肽和第八多肽在序列上相同;第一多肽和第二多肽在序列上相同,第三多肽和第四多肽在序列上相同,第五多肽和第六多肽在序列上相同,并且第七多肽和第八多肽在序列上相同。每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;与人igg1的氨基酸序列相比,每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;fc结构域单体独立地包含seqidno:42、43、45和47中任一者具有多至10、8、7、6、5、4、3、2或1个单一氨基酸置换的氨基酸序列;单一氨基酸置换仅在ch3结构域中;第二fc结构域单体和第五fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第二fc结构域单体和第五fc结构域单体之间的同二聚化;第一fc结构域单体和第七fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第一fc结构域单体和第七fc结构域单体之间的异二聚化,第四fc结构域单体和第八fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第四fc结构域单体和第八fc结构域单体之间的异二聚化;第三fc结构域单体和第九fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第三fc结构域单体和第九fc结构域单体之间的异二聚化;并且第六fc结构域单体和第十fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第六fc结构域单体和第十fc结构域单体之间的异二聚化;促进同二聚化的置换选自表4a和表4b中的置换;促进异二聚化的置换选自表3中的置换。还描述了一种fc-抗原结合结构域构建体,其包含:a)第一多肽,其包含:i)第一fc结构域单体;ii)第二fc结构域单体,iii)第三fc结构域单体,iv)第一pd-l1重链结合结构域,v)连接第一fc结构域单体和第二fc结构域单体的接头,以及vi)连接第二fc结构域单体和第三fc结构域单体的接头;b)第二多肽,其包含:i)第四fc结构域单体,ii)第五fc结构域单体,iii)第六fc结构域单体,iv)第二pd-l1重链结合结构域,v)连接第四fc结构域单体和第五fc结构域单体的接头,以及vi)连接第五fc结构域单体和第六fc结构域单体的接头;c)第三多肽,其包含第七fc结构域单体;d)第四多肽,其包含第八fc结构域单体;e)第五多肽,其包含第九fc结构域单体和第一pd-l1轻链结合结构域;以及f)第六多肽,其包含第十fc结构域单体和第二pd-l1轻链结合结构域其中第一fc结构域单体和第七fc结构域单体一起形成第一fc结构域,第四fc结构域单体和第八fc结构域单体一起形成第二fc结构域,第二fc结构域单体和第五fc结构域单体一起形成第三fc结构域,第三fc结构域单体和第九fc结构域单体一起形成第四fc结构域,第六fc单体和第十fc单体一起形成第五fc结构域,第一pd-l1重链结合结构域和第一pd-l1轻链结合结构域一起形成第一fab;并且第二pd-l1重链结合结构域和第二pd-l1轻链结合结构域一起形成第二fab。还描述了一种fc-抗原结合结构域构建体,其包含:a)第一多肽,其包含:i)第一fc结构域单体;ii)第二fc结构域单体,iii)第三fc结构域单体,iv)第一pd-l1重链结合结构域,v)连接第一fc结构域单体和第二fc结构域单体的接头,以及vi)连接第二fc结构域单体和第三fc结构域单体的接头;b)第二多肽,其包含:i)第四fc结构域单体,ii)第五fc结构域单体,iii)第六fc结构域单体,iv)第二pd-l1重链结合结构域,v)连接第四fc结构域单体和第五fc结构域单体的接头,以及vi)连接第五fc结构域单体和第六fc结构域单体的接头;c)第三多肽,其包含第七fc结构域单体;d)第四多肽,其包含第八fc结构域单体;e)第五多肽,其包含第九fc结构域单体;f)第六多肽,其包含第十fc结构域单体;g)第七多肽,其包含第一pd-l1轻链结合结构域;以及h)第八多肽,其包含第二pd-l1轻链结合结构域;其中第一fc结构域单体和第四fc结构域单体一起形成第一fc结构域,第二fc结构域单体和第七fc结构域单体一起形成第二fc结构域,第五fc单体和第八fc单体一起形成第三fc结构域,第三fc结构域单体和第九fc结构域单体一起形成第四fc结构域,第六fc单体和第十fc单体一起形成第五fc结构域,第一pd-l1重链结合结构域和第一pd-l1轻链结合结构域一起形成第一fab;并且第二pd-l1重链结合结构域和第二pd-l1轻链结合结构域一起形成第二fab。在各种实施方案中:第一多肽和第二多肽在序列上相同;第三多肽和第四多肽在序列上相同;第五多肽和第六多肽在序列上相同;第七多肽和第八多肽在序列上相同;第一多肽和第二多肽在序列上相同,第三多肽和第四多肽在序列上相同,第五多肽和第六多肽在序列上相同,并且第七多肽和第八多肽在序列上相同。每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;与人igg1的氨基酸序列相比,每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;每个fc结构域单体独立地包含seqidno:42、43、45和47中任一者具有多至10、8、7、6、5、4、3、2或1个单一氨基酸置换的氨基酸序列;单一氨基酸置换仅在ch3结构域中;第一fc结构域单体和第四fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第一fc结构域单体和第四fc结构域单体之间的同二聚化;第二fc结构域单体和第七fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第二fc结构域单体和第七fc结构域单体之间的异二聚化,第五fc结构域单体和第八fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第五fc结构域单体和第八fc结构域单体之间的异二聚化,第三fc结构域单体和第九fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第三fc结构域单体和第九fc结构域单体之间的异二聚化,并且第六fc结构域单体和第十fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第六fc结构域单体和第十fc结构域单体之间的异二聚化;促进同二聚化的置换选自表4a和表4b中的置换;并且促进异二聚化的置换选自表3中的置换。还描述了一种fc-抗原结合结构域构建体,其包含:a)第一多肽,其包含:i)第一fc结构域单体;ii)第二fc结构域单体,iii)第三fc结构域单体,iv)第一pd-l1重链结合结构域,v)连接第一fc结构域单体和第二fc结构域单体的接头,以及vi)连接第二fc结构域单体和第三fc结构域单体的接头;b)第二多肽,其包含:i)第四fc结构域单体,ii)第五fc结构域单体,iii)第六fc结构域单体,iv)第二pd-l1重链结合结构域,v)连接第四fc结构域单体和第五fc结构域单体的接头,以及vi)连接第五fc结构域单体和第六fc结构域单体的接头;c)第三多肽,其包含第七fc结构域单体;d)第四多肽,其包含第八fc结构域单体;e)第五多肽,其包含第九fc结构域单体和第一pd-l1轻链结合结构域;f)第六多肽,其包含第十fc结构域单体和第二pd-l1轻链结合结构域;其中第一fc结构域单体和第四fc结构域单体一起形成第一fc结构域,第二fc结构域单体和第七fc结构域单体一起形成第二fc结构域,第五fc单体和第八fc单体一起形成第三fc结构域,第三fc结构域单体和第九fc结构域单体一起形成第四fc结构域,第六fc单体和第十fc单体一起形成第五fc结构域,第一pd-l1重链结合结构域和第一pd-l1轻链结合结构域一起形成第一fab;并且第二pd-l1重链结合结构域和第二pd-l1轻链结合结构域一起形成第二fab。还描述了一种fc-抗原结合结构域构建体,其包含:a)第一多肽,其包含:i)第一fc结构域单体;ii)第二fc结构域单体,iii)连接第一fc结构域单体和第二fc结构域单体的接头,以及b)第二多肽,其包含:i)第三fc结构域单体;ii)第四fc结构域单体iii)连接第三fc结构域单体和第四fc结构域单体的接头;c)第三多肽,其包含第五fc结构域单体和第一pd-l1重链结合结构域,以及d)第四多肽,其包含第六fc结构域单体和第二pd-l1重链结合结构域;e)第五多肽,其包含第一pd-l1轻链结合结构域;以及f)第六多肽,其包含第二pd-l1轻链结合结构域;其中第一fc结构域单体和第五fc结构域单体一起形成第一fc结构域,第三fc结构域单体和第六fc结构域单体一起形成第二fc结构域,第二fc结构域单体和第四fc结构域单体一起形成第三fc结构域,第一pd-l1重链结合结构域和第一pd-l1轻链结合结构域一起形成第一fab;并且第二pd-l1重链结合结构域和第二pd-l1轻链结合结构域一起形成第二fab。在各种实施方案中:第一多肽和第二多肽在序列上相同;第三多肽和第四多肽在序列上相同;第五多肽和第六多肽在序列上相同;第一多肽和第二多肽在序列上相同,第三多肽和第四多肽在序列上相同,并且第五多肽和第六多肽在序列上相同;每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;与人igg1的氨基酸序列相比,每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;每个fc结构域单体独立地包含seqidno:42、43、45和47中任一者具有多至10、8、7、6、5、4、3、2或1个单一氨基酸置换的氨基酸序列;单一氨基酸置换仅在ch3结构域中;第二fc结构域单体和第四fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第二fc结构域单体和第四fc结构域单体之间的同二聚化;第一fc结构域单体和第五fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第一fc结构域单体和第五fc结构域单体之间的异二聚化,并且第三fc结构域单体和第六fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第三fc结构域单体和第六fc结构域单体之间的异二聚化;促进同二聚化的置换选自表4a和表4b中的置换;促进异二聚化的置换选自表3中的置换。还描述了一种fc-抗原结合结构域构建体,其包含:a)第一多肽,其包含:i)第一fc结构域单体;ii)第二fc结构域单体,iii)第一pd-l1重链结合结构域,以及iv)连接第一fc结构域单体和第二fc结构域单体的接头,b)第二多肽,其包含:i)第三fc结构域单体;ii)第四fc结构域单体,iii)第二pd-l1重链结合结构域,以及iv)连接第三fc结构域单体和第四fc结构域单体的接头,c)第三多肽,其包含第五fc结构域单体和第三pd-l1重链结合结构域;d)第四多肽,其包含第六fc结构域单体和第四pd-l1轻链结合结构域;e)第五多肽,其包含第一pd-l1轻链结合结构域;f)第六多肽,其包含第二pd-l1轻链结合结构域;g)第七多肽,其包含第三pd-l1轻链结合结构域;以及h)第八多肽,其包含第四pd-l1轻链结合结构域;其中第一fc结构域单体和第五fc结构域单体一起形成第一fc结构域,第三fc结构域单体和第六fc结构域单体一起形成第二fc结构域,第二fc单体和第四fc单体一起形成第三fc结构域,第一pd-l1轻链结合结构域和第三pd-l1重链结合结构域一起形成第一fab,第二pd-l1轻链结合结构域和第四pd-l1重链结合结构域一起形成第二fab,第三pd-l1轻链结合结构域和第一pd-l1重链结合结构域一起形成第三fab;并且第四pd-l1轻链结合结构域和第二pd-l1重链结合结构域一起形成第二fab在各种实施方案中:第一多肽和第二多肽在序列上相同;第三多肽和第四多肽在序列上相同;第五多肽、第六多肽、第七多肽和第八多肽在序列上相同;第一多肽和第二多肽在序列上相同,第三多肽和第四多肽在序列上相同,并且第五多肽、第六多肽、第七多肽和第八多肽在序列上相同;每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;与人igg1的氨基酸序列相比,每个fc结构域单体的ch3结构域包括多至8、7、6、5、4、3、2或1个单一氨基酸置换;每个fc结构域单体独立地包含seqidno:42、43、45和47中任一者具有多至10、8、7、6、5、4、3、2或1个单一氨基酸置换的氨基酸序列;单一氨基酸置换仅在ch3结构域中;第二fc结构域单体和第四fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第二fc结构域单体和第四fc结构域单体之间的同二聚化;其中第一fc结构域单体和第五fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第一fc结构域单体和第五fc结构域单体之间的异二聚化,并且第三fc结构域单体和第六fc结构域单体包含多至8、7、6、5、4、3、2或1个单一氨基酸置换,所述置换促进第三fc结构域单体和第六fc结构域单体之间的异二聚化;促进同二聚化的置换选自表4a和表4b中的置换;并且促进异二聚化的置换选自表3中的置换。在各种实施方案中:每个接头包含选自由以下项组成的组的氨基酸序列或由这些氨基酸序列组成:gggggggggggggggggggg、ggggs、ggsg、sggg、gsgs、gsgsgs、gsgsgsgs、gsgsgsgsgs、gsgsgsgsgsgs、ggsggs、ggsggsggs、ggsggsggsggs、ggsg、ggsg、ggsgggsg、ggsgggsgggsgggggsggggsggggsggggs、genlyfqsgg、sacycels、rsiat、rpackipndlkqkvmnh、ggsaggsgsgssggssgasgtgtaggtgsgsgtgsg、aaanssidlisvpvdsr、ggsgggsegggsegggsegggsegggsegggsgggs、gggsgggsgggs、sgggsgggsgggsgggsggg、ggsgggsgggsgggsggs、gggg、gggggggg、gggggggggggg和gggggggggggggggg;至少一个fc结构域单体在eu位置i253处包含置换;eu位置i253处的每个氨基酸置换独立地选自由以下项组成的组:i253a、i253c、i253d、i253e、i253f、i253g、i253h、i253i、i253k、i253l、i253m、i253n、i253p、i253q、i253r、i253s、i253t、i253v、i253w和i253y;至少一个fc结构域单体在eu位置r292处包含置换;eu位置r292处的每个氨基酸置换独立地选自由以下项组成的组:r292d、r292e、r292l、r292p、r292q、r292r、r292t和r292y;至少一个fc结构域单体包含选自由以下项组成的组的置换:t366y、t366w、t394w、t394y、f405w、f405a、y407a、s354c、y349t、t394f、k409d、k409e、k392d、k392e、k370d、k370e、d399k、d399r、e357k、e357r、d356k和d356r;每个fc结构域单体的铰链独立地包含选自由以下项组成的组的氨基酸序列或由这些氨基酸序列组成:epkscdkthtcppcpapell和dkthtcppcpapell。定义:如本文所用,术语“fc结构域单体”是指包括至少铰链结构域以及第二抗体恒定结构域和第三抗体恒定结构域(ch2和ch3)或它们的功能片段(例如,至少铰链结构域或其功能片段、ch2结构域或其功能片段以及ch3结构域或其功能片段)(例如,能够(i)与另一个fc结构域单体二聚化形成fc结构域的片段,并且(ii)与fc受体结合的片段)的多肽。优选的fc结构域单体从氨基到羧基末端包含igg1铰链、igg1ch2结构域和igg1ch3结构域的至少一部分。因此,fc结构域单体(例如,人igg1fc结构域单体)可以从e316延伸到g446或k447,从p317延伸到g446或k447,从k318延伸到g446或k447,从k318延伸到g446或k447,从s319延伸到g446或k447,从c320延伸到g446或k447,从d321延伸到g446或k447,从k322延伸到g446或k447,从t323延伸到g446或k447,从k323延伸到g446或k447,从h324延伸到g446或k447,从t325延伸到g446或k447,或者从c326延伸到g446或k447。fc结构域单体可以是任何免疫球蛋白抗体同种型,包括igg、ige、igm、iga或igd(例如,igg)。另外,fc结构域单体可以是igg亚型(例如,igg1、igg2a、igg2b、igg3或igg4)(例如,人igg1)。人igg1fc结构域单体用于本文所述的实例中。人igg1的全铰链结构域从eu编号e316延伸到p230或l235,ch2结构域从a231或g236延伸到k340,并且ch3结构域从g341延伸到k447。对于铰链结构域的最后一个氨基酸的位置有不同的看法。它是p230或l235。在本文的许多实例中,ch3结构域不包括k347。因此,ch3结构域可以是g341至g446。在本文的许多实例中,铰链结构域可以包括e216至l235。例如,当铰链在ch1结构域或pd-l1结合结构域的羧基末端时,就是如此。在一些情况下,例如当铰链位于多肽的氨基末端时,eu编号221处的asp突变为gln。fc结构域单体不包括免疫球蛋白的能够充当抗原识别区域的任何部分,例如可变结构域或互补决定区(cdr)。fc结构域单体可以包含来自野生型(例如,人)fc结构域单体序列的多达十个变化(例如,1-10、1-8、1-6、1-4个氨基酸置换、添加或缺失),这些变化改变fc结构域与fc受体之间的相互作用。fc结构域单体可以包含来自野生型fc结构域单体序列的多达十个变化(例如,单一氨基酸变化)(例如,1-10、1-8、1-6、1-4个氨基酸置换、添加或缺失),这些变化改变fc结构域单体之间的相互作用。在某些实施方案中,与以下人igg1ch3结构域序列相比,ch3结构域上有多至10、8、6或5个单一氨基酸置换:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg。合适变化的实例是本领域已知的。如本文所用,术语“fc结构域”是指能够结合fc受体的两个fc结构域单体的二聚体。在野生型fc结构域中,两个fc结构域单体通过两个ch3抗体恒定结构域之间的相互作用以及在两个二聚化fc结构域单体的铰链结构域之间形成的一个或多个二硫键而二聚化。在本公开中,术语“fc-抗原结合结构域构建体”是指形成至少两个如本文所述的fc结构域并且包括至少一个“抗原结合结构域”的缔合多肽链。本文所述的fc-抗原结合结构域构建体可以包括具有相同或不同序列的fc结构域单体。例如,fc-抗原结合结构域构建体可以具有三个fc结构域,其中两个包括igg1或igg1衍生的fc结构域单体,并且第三个包括igg2或igg2衍生的fc结构域单体。在另一个实例中,fc-抗原结合结构域构建体可以具有三个fc结构域,其中两个包括“突起-进入-空腔对”,并且第三个不包括“突起-进入-空腔对”。fc结构域形成与fc受体(例如,fcγri、fcγriia、fcγriib、fcγriiia、fcγriiib或fcγriv)结合的最小结构。如本文所用,术语“抗原结合结构域”是指能够特异性结合靶分子的肽、多肽或一组缔合多肽。在一些实施方案中,“抗原结合结构域”是抗体的与抗体所结合的抗原特异性结合的最小序列。表面等离子共振(spr)或本领域已知的各种免疫测定(例如,western印迹或elisa)可以用于评估抗体对抗原的特异性。在一些实施方案中,“抗原结合结构域”包括抗体的可变结构域或互补决定区(cdr),例如表1中列出的抗体的一个或多个cdr、表2中列出的抗体的一个或多个cdr或者表2中列出的抗体的vh和/或vl结构域。在一些实施方案中,pd-l1结合结构域可以包括vh结构域和ch1结构域,任选地具有vl结构域。在其他实施方案中,抗原(例如,pd-l1)结合结构域是抗体或scfv的fab片段。因此,pd-l1结合结构域可以包括包含vh结构域和ch1结构域或由这些结构域组成的“pd-l1重链结合结构域”以及包含vl结构域和cl结构域或由这些结构域组成的“pd-l1轻链结合结构域”。pd-l1结合结构域也可以是特异性结合靶标的合成工程化肽,诸如基于纤连蛋白的结合蛋白(例如,纤连蛋白iii型结构域(fn3)单体)。如本文所用,术语“互补决定区”(cdr)是指抗体可变结构域的氨基酸残基,其存在对于pd-l1结合是必需的。每个可变结构域通常具有三个cdr区,被标识为cdr-l1、cdr-l2和cdr-l3,以及cdr-h1、cdr-h2和cdr-h3。每个互补决定区可包括来自由kabat定义的“互补决定区”的氨基酸残基(即,大约轻链可变结构域中的残基24-34(cdr-l1)、50-56(cdr-l2)和89-97(cdr-l3)以及重链可变结构域中的残基31-35(cdr-h1)、50-65(cdr-h2)和95-102(cdr-h3);kabat等人,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991))和/或来自“高变环”的那些残基(即,大约轻链可变结构域中的残基26-32(cdr-l1)、50-52(cdr-l2)和91-96(cdr-l3)以及重链可变结构域中的残基26-32(cdr-h1)、53-55(cdr-h2)和96-101(cdr-h3);chothia和lesk,j.mol.biol.196:901-917(1987))。在一些情况下,互补决定区可以包括来自根据kabat定义的cdr区以及高变环两者的氨基酸。“骨架区”(下文称为fr)是除cdr残基以外的那些可变结构域残基。每个可变结构域通常具有四个fr,被标识为fr1、fr2、fr3和fr4。如果cdr是根据kabat定义的,则轻链fr残基位于大约残基1-23(lcfr1)、35-49(lcfr2)、57-88(lcfr3)和98-107(lcfr4)处,并且重链fr残基位于大约重链残基中的残基1-30(hcfr1)、36-49(hcfr2)、66-94(hcfr3)和103-113(hcfr4)处。如果cdr包含来自高变环的氨基酸残基,则轻链fr残基位于大约轻链中的残基1-25(lcfr1)、33-49(lcfr2)、53-90(lcfr3)和97-107(lcfr4)处,并且重链fr残基位于大约重链残基中的残基1-25(hcfr1)、33-52(hcfr2)、56-95(hcfr3)和102-113(hcfr4)处。在一些情况下,当cdr包括来自如由kabat定义的cdr以及高变环的cdr两者的氨基酸时,将相应地调节fr残基。“fv”片段是包含完整抗原识别和结合位点的抗体片段。该区域由紧密缔合的一个重链可变结构域和一个轻链可变结构域的二聚体组成,该二聚体在性质上可以是共价的,例如在scfv中。在这种构型中,每个可变结构域的三个cdr相互作用以在vh-vl二聚体的表面上限定pd-l1结合位点。“fab”片段包含轻链的可变结构域和恒定结构域以及重链的可变结构域和第一恒定结构域(ch1)。f(ab')2抗体片段包括一对fab片段,它们通常在其羧基末端附近通过铰链半胱氨酸共价连接。“单链fv”或“scfv”抗体片段在单个多肽链中包括抗体的vh和vl结构域。通常,scfv多肽还包括在vh与vl结构域之间的多肽接头,该接头使得scfv能够形成pd-l1结合所需的结构。如本文所用,术语“抗体恒定结构域”是指对应于抗体的恒定区结构域的多肽(例如,cl抗体恒定结构域、ch1抗体恒定结构域、ch2抗体恒定结构域或ch3抗体恒定结构域)。如本文所用,术语“促进”意指支持且有利于,例如有利于由彼此的结合亲和力比其他不同的fc结构域单体更高的两个fc结构域单体形成fc结构域。如本文所述,组合以形成fc结构域的两个fc结构域单体可以在其各自的ch3抗体恒定结构域的界面处具有相容氨基酸修饰(例如,工程化突起和工程化空腔,以及/或者静电转向突变)。相容氨基酸修饰促进或有利于此类fc结构域单体相对于与缺乏此类氨基酸修饰或具有不相容氨基酸修饰的其他fc结构域单体彼此的选择性相互作用。这是因为,由于两个相互作用的ch3抗体恒定结构域的界面处的氨基酸修饰,fc结构域单体对彼此的亲和力比对缺乏氨基酸修饰的其他fc结构域单体更高。如本文所用,术语“二聚化选择性模块”是指fc结构域单体的促进两个fc结构域单体之间的有利配对的序列。“互补”二聚化选择性模块是促进或有利于两个fc结构域单体彼此的选择性相互作用的二聚化选择性模块。互补二聚化选择性模块可以具有相同或不同的序列。本文描述了示例性的互补的二聚化选择性模块。如本文所用,术语“工程化空腔”是指用侧链体积比原始氨基酸残基更小的不同氨基酸残基置换ch3抗体恒定结构域中的至少一个原始氨基酸残基,从而在ch3抗体恒定结构域中产生三维空腔。术语“原始氨基酸残基”是指由野生型ch3抗体恒定结构域的遗传密码编码的天然存在的氨基酸残基。如本文所用,术语“工程化突起”是指用侧链体积比原始氨基酸残基更大的不同氨基酸残基置换ch3抗体恒定结构域中的至少一个原始氨基酸残基,从而在ch3抗体恒定结构域中产生三维突起。术语“原始氨基酸残基”是指由野生型ch3抗体恒定结构域的遗传密码编码的天然存在的氨基酸残基。如本文所用,术语“突起-进入-空腔对”描述了包括两个fc结构域单体的fc结构域,其中第一fc结构域单体在其ch3抗体恒定结构域中包括工程化空腔,而第二fc结构域单体在其ch3抗体恒定结构域中包括工程化突起。在突起-进入-空腔对中,第一fc结构域单体的ch3抗体恒定结构域中的工程化突起被定位成使得其与第二fc结构域单体的ch3抗体恒定结构域的工程化空腔相互作用,而不显著扰乱二聚体在ch3抗体恒定结构域间界面处的正常缔合。如本文所用,术语“异二聚体fc结构域”是指通过两个fc结构域单体的异二聚化形成的fc结构域,其中所述两个fc结构域单体含有促进这两个fc结构域单体的有利形成的不同反向电荷突变(参见例如,表4a和表4b中的突变)。在具有三个fc结构域的(一个羧基末端“茎”fc结构域和两个氨基末端“分支”fc结构域)fc构建体中,每个氨基末端“分支”fc结构域都可以是异二聚体fc结构域(也称为“分支异二聚体fc结构域”)。如本文所用,关于fc-抗原结合结构域构建体群体的术语“在结构上相同”是指以相同比率和构型组装相同多肽序列的构建体,但不指任何翻译后修饰,诸如糖基化。如本文所用,术语“同二聚体fc结构域”指通过两个fc结构域单体的同二聚化形成的fc结构域,其中所述两个fc结构域单体含有相同的反向电荷突变(参见例如,表5和表6中的突变)。在具有三个fc结构域(一个羧基末端“茎”fc结构域和两个氨基末端“分支”fc结构域)的fc构建体中,羧基末端“茎”fc结构域可以是同二聚体fc结构域(也称为“茎同二聚体fc结构域”)。如本文所用,术语“异二聚化选择性模块”是指可以在fc结构域单体的ch3抗体恒定结构域中产生的工程化突起、工程化空腔和某些反向电荷氨基酸置换,以便促进具有相容异二聚化选择性模块的两个fc结构域单体的有利异二聚化。含有异二聚化选择性模块的fc结构域单体可组合以形成异二聚体fc结构域。异二聚化选择性模块的实例在表3和表4中示出。如本文所用,术语“同二聚化选择性模块”是指ch3结构域之间的界面处的带电残基环内至少两个位置中的fc结构域单体中的促进fc结构域单体的同二聚化以形成同二聚体fc结构域的反向电荷突变。同二聚化选择性模块的实例在表4和表5中示出。如本文所用,术语“连接”用于描述通过包括化学缀合、重组手段和化学键(例如,肽键、二硫键和酰胺键)在内的手段来组合或附接两种或更多种元件、组分或蛋白质结构域(例如,多肽)。例如,可以通过化学缀合、化学键、肽接头或任何其他共价键合手段来连接两种单个多肽以形成一个连续的蛋白质结构。在一些实施方案中,通过从编码pd-l1结合结构域和fc结构域单体两者的连续核酸序列表达来将pd-l1结合结构域与fc结构域单体连接。在其他实施方案中,通过肽接头将pd-l1结合结构域与fc结构域单体连接,其中通过化学键(例如,肽键)将肽接头的n末端与pd-l1结合结构域的c末端连接,并且通过化学键(例如,肽键)将肽接头的c末端与fc结构域单体的n末端连接。如本文所用,术语“缔合”用于描述多肽(或一种单一多肽内的序列)之间的相互作用,例如氢键合、疏水相互作用或离子相互作用,使得多肽(或一种单一多肽内的序列)被定位为形成本文所述的fc-抗原结合结构域构建体(例如,具有三个fc结构域的fc-抗原结合结构域构建体)。例如,在一些实施方案中,四种多肽(例如,各自包括两个fc结构域单体的两种多肽和各自包括一个fc结构域单体的两种多肽)缔合以形成具有三个fc结构域的fc构建体(例如,如图50和图51所描绘)。四种多肽可以通过其各自的fc结构域单体缔合。多肽之间的缔合不包括共价相互作用。如本文所用,术语“接头”是指两个元件(例如,蛋白质结构域)之间的键合。接头可以是共价键或间隔物。术语“键”是指化学键(例如,酰胺键或二硫键)或由化学反应产生(例如,化学缀合)的任何种类的键。术语“间隔物”是指存在于两个多肽或多肽结构域之间以在两个多肽或多肽结构域之间提供空间和/或灵活性的部分(例如,聚乙二醇(peg)聚合物)或氨基酸序列(例如,3-200个氨基酸、3-150个氨基酸或3-100个氨基酸序列)。氨基酸间隔物是多肽一级序列的部分(例如,经由多肽主链与间隔的多肽或多肽结构域连接)。例如在两个铰链区或形成fc结构域的两个fc结构域单体之间形成的二硫键不被认为是接头。如本文所用,术语“甘氨酸间隔物”是指串联连接两个fc结构域单体的仅含有甘氨酸的接头。甘氨酸间隔物可含有至少4、8或12个甘氨酸(例如,4-30、8-30或12-30个甘氨酸;例如,12-30、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个甘氨酸)。在一些实施方案中,甘氨酸间隔物具有序列gggggggggggggggggggg(seqidno:27)。如本文所用,术语“白蛋白结合肽”是指对血清白蛋白具有亲和力并且具有结合血清白蛋白的功能的12至16个氨基酸的氨基酸序列。白蛋白结合肽可以具有不同起源,例如人、小鼠或大鼠。在本公开的一些实施方案中,将白蛋白结合肽与fc结构域单体的c末端融合,以增加fc-抗原结合结构域构建体的血清半衰期。可以直接或通过接头将白蛋白结合肽与fc结构域单体的n末端或c末端融合。如本文所用,术语“纯化肽”是指可以用于纯化、分离或鉴定多肽的任何长度的肽。可以将纯化肽与多肽连接以帮助从例如细胞裂解产物混合物中纯化多肽和/或分离多肽。在一些实施方案中,纯化肽结合对纯化肽具有特异性亲和力的另一部分。在一些实施方案中,将与纯化肽特异性结合的此类部分附接到固体支持物,诸如基质、树脂或琼脂糖珠。可与fc-抗原结合结构域构建体连接的纯化肽的实例在本文中进一步详细描述。如本文所用,术语“多聚体”是指包括至少两个本文所述的缔合fc构建体或fc-抗原结合结构域构建体的分子。如本文所用,术语“多核苷酸”是指寡核苷酸或核苷酸以及它们的片段或部分,并且是指基因组或合成起源的dna或rna,它们可以是单链或双链的,并且代表有义链或反义链。单个多核苷酸被翻译成单个多肽。如本文所用,术语“多肽”描述了其中单体是通过酰胺键连接在一起的氨基酸残基的单个聚合物。多肽旨在涵盖天然存在、重组或合成产生的任何氨基酸序列。如本文所用,术语“氨基酸位置”是指蛋白质或蛋白质结构域中氨基酸的位置编号。在标出地方(例如,对于cdr和fr区)使用kabat编号系统(kabat等人,sequencesofproteinsofimmunologicalinterest,nationalinstitutesofhealth,bethesda,md.,第5版,1991)对氨基酸位置进行编号,否则使用eu编号。图24a-24d描绘了使用eu编号系统编号的人igg1fc结构域。图25a-25d描绘了使用eu编号系统编号的人igg1fc结构域。如本文所用,术语“氨基酸修饰”是指与参考序列(例如,野生型、未突变或未修饰fc序列)相比可对以下项有影响并且可促进改善治疗免疫和炎性疾病的功效的fc结构域多肽序列的改变:fc构建体的药代动力学(pk)和/或药效动力学(pd)特性、血清半衰期、效应子功能(例如,细胞裂解(例如,抗体依赖性细胞介导的毒性(adcc)和/或补体依赖性细胞毒性活性(cdc))、吞噬作用(例如,抗体依赖性细胞吞噬作用(adcp)和/或补体依赖性细胞毒性(cdcc))、免疫激活和t细胞激活)、对fc受体(例如,fc-γ受体(fcγr)(例如,fcγri(cd64)、fcγriia(cd32)、fcγriib(cd32)、fcγriiia(cd16a)和/或fcγriiib(cd16b))、fc-α受体(fcαr)、fc-ε受体(fcεr)和/或新生儿fc受体(fcrn))的亲和力、对参与补体级联的蛋白质(例如,c1q)的亲和力、翻译后修饰(例如,糖基化、唾液酸化)、聚合特性(例如,形成二聚体(例如,同二聚体和/或异二聚体)和/或多聚体的能力)以及生物物理特性(例如,改变ch1与cl之间的相互作用、改变稳定性和/或改变对温度和/或ph的敏感性)。氨基酸修饰包括氨基酸置换、缺失和/或插入。在一些实施方案中,氨基酸修饰是单一氨基酸的修饰。在其他实施方案中,氨基酸修饰是多个(例如,多于一个)氨基酸的修饰。氨基酸修饰可包括氨基酸置换、缺失和/或插入的组合。包括在氨基酸修饰的描述中的是编码fc多肽的核苷酸序列的遗传(即dna和rna)改变,诸如点突变(例如,单个核苷酸与另一个核苷酸的交换)、插入和缺失(例如,一个或多个核苷酸的添加和/或移除)。在某些实施方案中,fc构建体或fc-抗原结合结构域构建体内的至少一个(例如,一个、两个或三个)fc结构域单体包括氨基酸修饰(例如,置换)。在一些情况下,至少一个fc结构域单体包括一个或多个(例如,不超过两个、三个、四个、五个、六个、七个、八个、九个、十个或二十个)氨基酸修饰(例如,置换)。如本文所用,术语“同一性百分比(%)”是指在比对序列并引入缺口(如有需要)以实现最大同一性百分比(即,可以在候选序列和参考序列中的一者或两者中引入缺口以用于最佳比对,并且可以忽略非同源序列以用于比较目的)之后,候选序列(例如,本文所述的fc-抗原结合结构域构建体中的fc结构域单体的序列)的氨基酸(或核酸)残基与参考序列(例如,野生型fc结构域单体的序列)的氨基酸(或核酸)残基相同的百分比。比对以用于确定同一性百分比的目的可以以在本领域技术范围内的各种方式实现,例如使用可公开获得的计算机软件,诸如blast、align或megalign(dnastar)软件。本领域技术人员可以确定用于测量比对的适当参数,包括在待比较的序列的全长上实现最大比对所需的任何算法。在一些实施方案中,如下计算给定候选序列和、与或相对于给定参考序列的氨基酸(或核酸)序列同一性百分比(其可以另选地表达为给定候选序列和、与或相对于给定参考序列具有或包括一定氨基酸(或核酸)序列同一性百分比):100x(a/b的分数)其中a是在候选序列和参考序列的比对中评分为相同的氨基酸(或核酸)残基的数目,并且其中b是参考序列中氨基酸(或核酸)残基的总数。在其中候选序列的长度不等于参考序列的长度的一些实施方案中,候选序列与参考序列的氨基酸(或核酸)序列同一性百分比不等于参考序列与候选序列的氨基酸(或核酸)序列同一性百分比。在特定实施方案中,用于与候选序列比较而进行比对的参考序列可显示,跨越候选序列的全长或候选序列的连续氨基酸(或核酸)残基的选定部分,候选序列显示出50%至100%的同一性(例如,50%至100%、60%至100%、70%至100%、80%至100%、90%至100%、92%至100%、95%至100%、97%至100%、99%至100%或99.5%至100%的同一性)。用于比较目的而比对的候选序列的长度为参考序列长度的至少30%,例如至少40%,例如至少50%、60%、70%、80%、90%或100%。当候选序列中的位置被与参考序列中的相应位置相同的氨基酸(或核酸)残基占据时,则该分子在该位置处是相同的。在一些实施方案中,本文所述的fc构建体(例如,具有三个fc结构域的fc-抗原结合结构域构建体)中的fc结构域单体可具有与野生型fc结构域单体的序列(例如,seqidno:42)具有至少95%同一性(至少97%、99%或99.5%同一性)的序列。在一些实施方案中,本文所述的fc构建体(例如,具有三个fc结构域的fc-抗原结合结构域构建体)中的fc结构域单体可具有与seqidno:44、46、48和50-53中任一者的序列具有至少95%同一性(至少97%、99%或99.5%同一性)的序列。在某些实施方案中,fc构建体中的fc结构域单体可具有与seqidno:48、52和53的序列具有至少95%同一性(至少97%、99%或99.5%同一性)的序列。在一些实施方案中,两个fc结构域单体之间的间隔物可具有与本文进一步描述的seqidno:1-36(例如,seqidno:17、18、26和27)中任一者的序列具有至少75%同一性(至少75%、77%、79%、81%、83%、85%、87%、89%、91%、93%、95%、97%、99%、99.5%或100%同一性)的序列。如本文所用,术语“宿主细胞”是指包括从其对应的核酸表达蛋白质所需的必要细胞组分(例如,细胞器)的媒介物。核酸通常包括在核酸载体中,可以通过本领域已知的常规技术(转化、转染、电穿孔、磷酸钙沉淀、直接显微注射等)将所述核酸载体引入宿主细胞中。宿主细胞可以是原核细胞(例如,细菌细胞)或真核细胞(例如,哺乳动物细胞(例如,cho细胞))。如本文所述,宿主细胞用于表达编码所需结构域的一种或多种多肽,然后可以将所述结构域组合以形成所需fc-抗原结合结构域构建体。如本文所用,术语“药物组合物”是指含有活性成分以及一种或多种赋形剂和稀释剂以使活性成分能够适合于施用方法的医学或药物制剂。本公开的药物组合物包括与fc-抗原结合结构域构建体相容的药学上可接受的组分。药物组合物通常为用于静脉内或皮下施用的水性形式。如本文所用,多肽或fc构建体的“基本上同质的群体”是指组合物(例如,细胞培养基或药物组合物)中至少50%的多肽或fc构建体具有相同数量的fc结构域,如通过非还原sds凝胶电泳或尺寸排阻色谱测定的。多肽或fc构建体的基本上同质的群体可在纯化之前或者在蛋白a或蛋白g纯化之后或者在只进行任何fab或fc特异性亲和色谱之后获得。在各种实施方案中,组合物中至少55%、60%、65%、70%、75%、80%或85%的多肽或fc构建体具有相同数量的fc结构域。在其他实施方案中,组合物中至多85%、90%、92%或95%的多肽或fc构建体具有相同数量的fc结构域。如本文所用,术语“药学可接受的载体”是指药物组合物中的赋形剂或稀释剂。药学可接受的载体必须与制剂的其他成分相容并且对接受者无害。在本公开中,药学上可接受的载体必须为fc-抗原结合结构域构建体提供足够的药物稳定性。载体的性质因施用模式而异。例如,对于经口施用,固体载体是优选的;对于静脉内施用,一般使用水性溶液载体(例如,wfi和/或缓冲溶液)。如本文所用,“治疗有效量”是指有效诱导受试者或患者中的所需生物效应或者有效治疗患有本文所述病症或障碍的患者的量,例如药物剂量。本文还应理解,“治疗有效量”可被解释为以一个剂量或以任何剂量或途径服用、单独或与其他治疗剂组合服用的给予所需治疗效果的量。如本文所用,术语“片段”和术语“部分”可以互换使用。附图说明图1是包含两个fc结构域和一个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体1)的图示。每个fc结构域是两个fc结构域单体的二聚体。两个fc结构域单体(106和108)在其ch3抗体恒定结构域中包含突起,而其他两个fc结构域单体(112和114)在其ch3抗体恒定结构域的并列位置中包含空腔。该构建体由三个包含fc结构域单体的多肽形成。第一多肽(102)包含两个包含突起的fc结构域单体(106和108),这两个fc结构域单体通过间隔物与n末端上包含vh结构域的pd-l1结合结构域(110)串联连接。包含vl的结构域(104)与vh结构域连接。第二多肽和第三多肽(112和114)中的每一者包含含空腔的fc结构域单体。图2是包含三个fc结构域和一个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体2)的图示。该构建体由四个包含fc结构域单体的多肽形成。第一多肽(202)包含三个包含突起的fc结构域(206、208和210),这些fc结构域通过间隔物与n末端上包含vh结构域的pd-l1结合结构域(212)串联连接。包含vl的结构域(204)与vh结构域连接。第二多肽、第三多肽和第四多肽(214、216和218)中的每一者包含含空腔的fc结构域单体。图3是包含两个fc结构域和两个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体3)的图示。该构建体由三个包含fc结构域单体的多肽形成。第一多肽(302)包含两个含突起的fc结构域单体(304和306),这两个fc结构域单体通过间隔物串联连接。第二多肽和第三多肽(320和322)中的每一者包含含空腔的fc结构域单体(310和314),这两个fc结构域单体与n末端上包含vh结构域的pd-l1结合结构域(316和318)串联连接。包含vl的结构域(308和312)与每个vh结构域连接。图4是包含三个fc结构域和三个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体4)的图示。该构建体由四个包含fc结构域单体的多肽形成。第一多肽(402)包含三个含突起的fc结构域单体(404、406和408),这些fc结构域单体通过间隔物串联连接。第二多肽、第三多肽和第四多肽(428、430和432)中的每一者包含含空腔的fc结构域单体(426、420和414),这些fc结构域单体与n末端上包含vh结构域的pd-l1结合结构域(422、416和410)串联连接。包含vl的结构域(424、418和412)与每个vh结构域连接。图5是包含两个fc结构域和三个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体5)的图示。该构建体由三个包含fc结构域单体的多肽形成。第一多肽(502)包含两个包含突起的fc结构域单体(508和506),这两个fc结构域单体通过间隔物与n末端处包含vh结构域的pd-l1结合结构域(510)串联连接。第二多肽和第三多肽(524和526)中的每一者包含含空腔的fc结构域单体(516和522),这两个fc结构域单体与n末端上包含vh结构域的pd-l1结合结构域(512和518)串联连接。包含vl的结构域(504、514和520)与每个vh结构域连接。图6是包含三个fc结构域和四个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体6)的图示。该构建体由四个包含fc单体的多肽形成。第一多肽(602)包含三个包含突起的fc结构域单体(606、608和610),这些fc结构域单体通过间隔物与n末端处包含vh结构域的pd-l1结合结构域(612)串联连接。第二多肽、第三多肽和第四多肽(632、634和636)中的每一者包含含空腔的fc结构域单体(618、624和630),这些fc结构域单体与n末端上包含vh结构域的pd-l1结合结构域(616、622和628)串联连接。包含vl的结构域(604、616、622和628)与每个vh结构域连接。图7是包含三个fc结构域和两个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体7)的图示。该fc-抗原结合结构域构建体包含两个fc结构域单体(706和718)的二聚体,其中两个fc结构域单体在它们的ch3-ch3界面处包含与wt序列不同的带电荷氨基酸以促进这两个fc结构域单体之间的有利静电相互作用。该构建体由四个包含fc结构域单体的多肽形成。两个多肽(702和724)各自包含含突起的fc结构域单体(710和720),这两个fc结构域单体通过间隔物与在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(706和718)和n末端处包含vh结构域的pd-l1结合结构域(712和714)串联连接。第三多肽和第四多肽(708和722)各自包含含空腔的fc结构域单体。包含vl的结构域(704和716)与每个vh结构域连接。图8是包含三个fc结构域和两个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体8)的图示。该构建体由四个含有fc结构域单体的多肽形成。两个多肽(802和828)各自包含含突起的fc结构域单体(814和820),这两个fc结构域单体通过间隔物与在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(810和816)串联连接。第三多肽和第四多肽(804和826)各自包含含空腔的fc结构域单体(808和824),这两个fc结构域单体与n末端处包含vh结构域的pd-l1结合结构域(812和818)串联连接。包含vl的结构域(806和822)与每个vh结构域连接。图9是包含三个fc结构域和四个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体9)的图示。该构建体由四个含有fc结构域单体的多肽形成。两个多肽(902和936)各自包含含突起的fc结构域单体(918和928),这两个fc结构域单体通过间隔物与在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(910和924)和n末端处包含vh结构域的pd-l1结合结构域(908和920)串联连接。第三多肽和第四多肽(904和934)包含含空腔的fc结构域单体(916和932),这两个fc结构域单体与n末端处包含vh结构域的pd-l1结合结构域(912和926)串联连接。包含vl的结构域(906、914、922和930)与每个vh结构域连接。图10是包含五个fc结构域和两个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体10)的图示。该构建体由六个包含fc结构域单体的多肽形成。两个多肽(1002和1032)各自包含含突起的fc结构域单体(1016和1030),这两个fc结构域单体通过间隔物与另一个包含突起的fc结构域单体(1014和1028)、在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(1008和1022)和n末端处包含vh结构域的pd-l1结合结构域(1006和1018)串联连接。第三多肽、第四多肽、第五多肽和第六多肽(1012、1010、1026和1024)各自包含含空腔的fc结构域单体。包含vl的结构域(1004和1020)与每个vh结构域连接。图11是包含五个fc结构域和四个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体11)的图示。该构建体由六个包含fc结构域单体的多肽形成。两个多肽(1102和1148)包含含突起的fc结构域单体(1118和1132),这两个fc结构域单体通过间隔物与另一个含突起的fc结构域单体(1120和1130)以及在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(1124和1126)串联连接。第三多肽、第四多肽、第五多肽和第六多肽(1106、1104、1144和1146)各自包含含空腔的fc结构域单体(1116、1110、1134和1140),这些fc结构域单体与n末端处包含vh结构域的pd-l1结合结构域(1112、1122、1138和1128)串联连接。包含vl的结构域(1108、1114、1135和1142)与每个vh结构域连接。图12是包含五个fc结构域和六个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体12)的图示。该构建体由六个包含fc结构域单体的多肽形成。两个多肽(1202和1256)包含含突起的fc结构域单体(1224和1230),这两个fc结构域单体通过间隔物与另一个包含突起的fc结构域单体(1226和1228)、在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(1210和1244)和n末端处包含vh结构域的pd-l1结合结构域(1250和1248)串联连接。第三多肽、第四多肽、第五多肽和第六多肽(1206、1204、1254和1252)各自包含含空腔的fc结构域单体(1222、1216、1232和1238),这些fc结构域单体与n末端处包含vh结构域的pd-l1结合结构域(1218、1212、1236和1242)串联连接。包含vl的结构域(1208、1214、1220、1234、1240和1246)与每个vh结构域连接。图13是包含三个fc结构域和两个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体13)的图示。该构建体由四个含有fc结构域单体的多肽形成。两个多肽(1302和1324)包含在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(1308和1318),这两个fc结构域单体通过间隔物与包含突起的fc结构域单体(1312和1316)和n末端处包含vh结构域的pd-l1结合结构域(1310和1314)串联连接。第三多肽和第四多肽(1306和1320)包含含空腔的fc结构域单体。包含vl的结构域(1304和1322)与每个vh结构域连接。图14是包含三个fc结构域和两个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体14)的图示。该构建体由四个含有fc结构域单体的多肽形成。两个多肽(1404和1426)包含在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(1308和1318),这两个fc结构域单体通过间隔物与含突起的fc结构域单体(1414和1418)串联连接。第三多肽和第四多肽(1402和1428)各自包含含空腔的fc结构域单体(1410和1422),这两个fc结构域单体与n末端处包含vh结构域的pd-l1结合结构域(1408和1416)串联连接。包含vl的结构域(1406和1424)与每个vh结构域连接。图15是包含三个fc结构域和四个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体15)的图示。该构建体由四个含有fc结构域单体的多肽形成。两个多肽(1502和1536)包含在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(1512和1524),这两个fc结构域单体通过间隔物与包含突起的fc结构域单体(1518和1522)和n末端处包含vh结构域的pd-l1结合结构域(1514和1532)串联连接。第三多肽和第四多肽(1504和1534)包含含空腔的fc结构域单体(1510和1526),这两个fc结构域单体与n末端处包含vh结构域的pd-l1结合结构域(1508和1530)串联连接。包含vl的结构域(1506、1516、1520和1528)与每个vh结构域连接。图16是包含五个fc结构域和两个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体16)的图示。该构建体由六个包含fc结构域单体的多肽形成。两个多肽(1602和1632)包含在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(1610和1624),这两个fc结构域单体通过间隔物与包含突起的fc结构域单体(1612和1622)、第二包含突起的fc结构域单体(1614和1620)和n末端处包含vh结构域的pd-l1结合结构域(1616和1618)串联连接。第三多肽、第四多肽、第五多肽和第六多肽(1608、1606、1626和1628)各自包含含空腔的fc结构域。包含vl的结构域(1604和1630)与每个vh结构域连接。图17是包含五个fc结构域和四个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体17)的图示。该构建体由六个包含fc单体的多肽形成。两个多肽(1702和1748)包含在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(1718和1732),这两个fc结构域单体通过间隔物与含突起的fc结构域单体(1720和1730)和n末端处含突起的fc结构域单体(1722和1728)串联连接。第三多肽、第四多肽、第五多肽和第六多肽(1706、1704、1746和1744)包含含空腔的fc结构域单体(1716、1710、1734和1740),这些fc结构域单体与n末端处包含vh结构域的pd-l1结合结构域(1712、1724、1738和1726)串联连接。包含vl的结构域(1708、1714、1736和1742)与每个vh结构域连接。图18是包含五个fc结构域和六个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体18)的图示。该构建体由六个包含fc结构域单体的多肽形成。两个多肽(1802和1856)包含在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(1818和1838),这两个fc结构域单体通过间隔物与包含突起的fc结构域单体(1820和1836)、第二包含突起的fc结构域单体(1822和1834)和n末端处包含vh结构域的pd-l1结合结构域(1826和1830)串联连接。第三多肽、第四多肽、第五多肽和第六多肽(1806、1804、1854和1852)各自包含含空腔的fc结构域单体(1816、1810、1840和1846),这些fc结构域单体与n末端处包含vh结构域的pd-l1结合结构域(1812、1828、1844和1850)串联连接。包含vl的结构域(1808、1814、1824、1832、1842和1848)与每个vh结构域连接。图19是包含五个fc结构域和两个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体19)的图示。该构建体由六个包含fc结构域单体的多肽形成。两个多肽(1902和1932)包含含突起的fc结构域单体(1912和1930),这两个fc结构域单体通过间隔物与在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(1908和1926)、包含突起的fc结构域单体(1916和1918)和n末端处包含vh结构域的pd-l1结合结构域(1914和1920)串联连接。第三多肽和第四多肽(1910和1928)包含含空腔的fc结构域单体,并且第五多肽和第六多肽(1906和1924)包含含空腔的fc结构域单体。包含vl的结构域(1904和1922)与每个vh结构域连接。图20是包含五个fc结构域和四个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体20)的图示。该构建体由六个包含fc结构域单体的多肽形成。两个多肽(2002和2048)包含含突起的fc结构域单体(2020和2022),这两个fc结构域单体通过间隔物与在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(2012和2030)和n末端处含突起的fc结构域单体(2040和2038)串联连接。第三多肽、第四多肽、第五多肽和第六多肽(2006、2004、2046和2044)各自包含含空腔的fc结构域单体(2018、2010、2024和2032),这些fc结构域单体与n末端处包含vh结构域的pd-l1结合结构域(2014、2042、2028和2036)串联连接。包含vl的结构域(2008、2016、2026和2034)与每个vh结构域连接。图21是包含五个fc结构域和六个pd-l1结合结构域的fc-抗原结合结构域构建体(构建体21)的图示。该构建体由六个包含fc结构域单体的多肽形成。两个多肽(2102和2156)包含含突起的fc结构域单体(2120和2122),这两个fc结构域单体通过间隔物与在ch3-ch3界面处包含与wt序列不同的带电氨基酸的fc结构域单体(2112和2130)、另一个包含突起的fc结构域单体(2144和2142)和n末端处包含vh结构域的pd-l1结合结构域(2148和2138)串联连接。第三多肽、第四多肽、第五多肽和第六多肽(2106、2104、2154和2152)各自包含含空腔的fc结构域单体(2118、2110、2124和2132),这些fc结构域单体与n末端处包含vh结构域的pd-l1结合结构域(2114、2150、2128和2136)串联连接。包含vl的结构域(2108、2116、2126、2134、2140和2146)与每个vh结构域连接。图22是示出利用靶向b细胞的各种抗cd20构建体的cdc、adcp和adcc测定的结果的三个图。第一个图表明,s3yfc-抗原结合结构域构建体可以介导cdc。中间图表明,sai和s3yfc-抗原结合结构域构建体在adcpfcγriia报告基因测定中均表现出>100倍的增强效力。第三个图表明,sai和s3yfc-抗原结合结构域构建体表现出相对于岩藻糖基化mab增强的adcc活性,以及与无岩藻糖基化mab相似的活性。图23是示出利用靶向pd-l1转染的hek细胞的各种抗pd-l1构建体的adcc、adcp和cdc测定的结果的三个图。第一个图表明,sai(具有fc-抗原结合结构域构建体7的结构的构建体(图7))和s3yfc-抗原结合结构域(具有fc-抗原结合域构建体13的结构的构建体(图13))构建体均表现出相对于岩藻糖基化和无岩藻糖基化mab相似的adcc活性。第二个图表明,sai和s3y构建体介导增强的adcp,并且第三个图表明,s3y构建体可以介导cdc。图24是可以将pd-l1结合结构域与fc构建体的fc结构域连接的三种示例性方式的示意性表示。小图a示出了pd-l1结合结构域的重链组分可以表达为fc链的融合蛋白,并且轻链组分可以表达为单独的多肽。小图b示出了表达为长fc链的融合蛋白的scfv。小图c示出了单独表达并且外源添加到fc-抗原结合结构域构建体中并利用化学键与fc-抗原结合结构域构建体连接的重链和轻链组c图25a描绘了具有eu编号的人igg1的氨基酸序列(seqidno:43)。铰链区用双下划线标出,ch2结构域未用下划线标出,而ch3区用下划线标出。图25b描绘了具有eu编号的人igg1的氨基酸序列(seqidno:45)。缺少e216-c220(包括端点)的铰链区用双下划线标出,ch2结构域未用下划线标出,而ch3区用下划线标出并且缺少k447。图25c描绘了具有eu编号的人igg1的氨基酸序列(seqidno:47)。铰链区用双下划线标出,ch2结构域未用下划线标出,而ch3区用下划线标出并且缺少447k。图25d描绘了具有eu编号的人igg1的氨基酸序列(seqidno:42)。缺少e216-c220(包括端点)的铰链区用双下划线标出,ch2结构域未用下划线标出,而ch3区用下划线标出。图26描绘了pd-l1构建体在小鼠肿瘤模型中的作用的研究结果。图27描绘了用抗pd-l1构建体处理的pd-l1转染的hek细胞的cdc的研究结果。图28描绘了用hekpd-l1转染的细胞的adcp测定的研究结果。图29描绘了用抗pd-l1构建体处理的人肺癌h441细胞的adcp的研究结果。图30描绘了用hekpd-l1转染的细胞作为靶细胞的adcc测定的研究结果。图31描绘了用抗pd-l1构建体处理的人肺癌a549细胞的adcc的研究结果。具体实施方式许多治疗性抗体通过fc结构域的效应子功能(诸如抗体依赖性细胞毒性(adcc)、抗体依赖性细胞吞噬作用(adcp)和补体依赖性细胞毒性(cdc))募集先天免疫系统的元件而发挥作用。在一些情况下,本公开设想将已知含单个fc结构域的治疗剂(例如,已知治疗性抗体)的pd-l1结合结构域与至少两个fc结构域组合以产生具有独特生物活性的新型治疗剂。在一些情况下,本文公开的新型治疗剂具有比已知含fc结构域的治疗剂(例如,已知治疗性抗体)更大的生物活性。至少两个fc结构域的存在可以增强效应子功能并激活多种效应子功能,诸如adcc结合adcp和/或cdc,从而提高治疗性分子的功效。为了产生具有一致生物功能的产物,控制fc结构域的数量是至关重要的。本公开的特征在于一组fc工程化工具,以控制编码fc结构域的肽的同二聚化和异二聚化,以由有限数量的多肽链组装离散大小的分子。国际公开号wo/2015/168643、wo2017/151971、wo2017/205436和wo2017/205434公开了用于组装具有两个或更多个fc结构域的分子的fc工程化工具和方法,并且通过引用整体并入本文。这些工程化工具包括可显著改善制造结果的结构特征(例如,甘氨酸接头)。这些构建体的特性允许有效产生基本上同质的药物组合物。药物组合物中的此类同质性是期望的,以便确保药物组合物的安全性、功效、均匀性和可靠性。在药物组合物中具有高度同质性还使由不需要的材料(例如,降解产物和/或聚集产物或多聚体)引起的药物产品的潜在聚集或降解降到最低,以及限制由不需要的材料引起的脱靶效应和不良副作用。如本文详细描述的,我们通过使用以下方法来工程化fc-抗原结合结构域构建体的fc结构域组分改善了组合物的同质性:包括使用仅包含甘氨酸残基的间隔物串联连接两个fc结构域单体,使用移除末端赖氨酸残基的多肽序列,以及使用两组异二聚化选择性模块:(i)具有不同反向电荷突变的异二聚化选择性模块,以及(ii)具有工程化空腔和突起的异二聚化选择性模块。我们使用一条包含多个被接头分开的fc序列的长肽链以及包含单个fc序列的短链的多个拷贝设计了一系列其中fc结构域串联连接的fc-抗原结合结构域构建体(fc-抗原结合域构建体1-6;图1至图6)。将异二聚体化突变引入每个fc序列中,以确保组装成所需的串联构型,而最小化形成较小或较大复合物。可以以这种方式串联连接任意数量的fc结构域,从而允许创建具有2、3、4、5、6、7、8、9、10个或更多个fc结构域的构建体。对于具有n个fc结构域的肽,可以将此类构建体制备成具有1至n+1个pd-l1结合结构域,这分别取决于将pd-l1结合结构域引入长肽链、短肽链还是两者中。在fc-抗原结合结构域构建体1-6(图1至图6)中,fc结构域与fc结构域之间的单个分支点连接。这些构建体包括包含多个被接头分开的fc序列的长肽链的两个拷贝,其中分支fc序列包含同二聚化突变,并且非分支fc结构域包含异二聚化突变。包含单个fc序列且具有与长链中异二聚化突变互补的突变的短链的多个拷贝用于完成多聚体fc支架。异二聚化fc结构域可以与c末端(例如,fc-抗原结合结构域构建体7-12;图7至图12)、n末端(例如,fc-抗原结合结构域构建体13-18;图13至图18)或分支fc结构域的两端(例如,fc-抗原结合结构域构建体19-21;图19至图21)连接。串联的多个fc结构域可以与分支fc结构域的任一端连接。可将pd-l1结合结构域引入长肽链中,使得每个组装蛋白质分子有两个pd-l1结合结构域。另选地,可将pd-l1结合结构域引入短肽链中,使得每个组装蛋白质分子有n-1个pd-l1结合结构域,其中n是组装蛋白质分子中fc结构域的数量。如果将pd-l1结合结构域引入短肽链和长肽链两者中,则所得的组装蛋白分子包含n+1个pd-l1结合结构域。过去针对单克隆抗体(mab)和fc结构域进行的工程化工作包括在fc结构域中进行突变以增强与fcγriiia的结合,从而增强抗体依赖性细胞介导的细胞毒性(adcc)反应,以及对fc结构域进行无岩藻糖基化以增强与fcγriiia的结合,从而增强adcc反应。i.fc结构域单体fc结构域单体包括铰链结构域、ch2抗体恒定结构域和ch3抗体恒定结构域(例如,人igg1铰链、ch2抗体恒定结构域和具有任选氨基酸置换的ch3抗体恒定结构域)的至少一部分。fc结构域单体可以是免疫球蛋白抗体同种型igg、ige、igm、iga或igd。fc结构域单体也可以是任何免疫球蛋白抗体同种型(例如,igg1、igg2a、igg2b、igg3或igg4)。fc结构域单体也可以是杂合体,例如具有来自igg1的铰链和ch2以及来自iga的ch3或者具有来自igg1的铰链和ch2以及来自igg3的ch3。fc结构域单体的二聚体是可以结合fc受体(例如,fcγriiia,一种位于白细胞的表面上的受体)的fc结构域(本文进一步定义)。在本公开中,fc结构域单体的ch3抗体恒定结构域可在ch3-ch3抗体恒定结构域的界面处含有氨基酸置换,以促进它们彼此的缔合。在其他实施方案中,fc结构域单体包括附接到n末端或c末端的附加部分,例如白蛋白结合肽或纯化肽。在本公开中,fc结构域单体不含有任何类型的抗体可变区,例如vh、vl、互补决定区(cdr)或高变区(hvr)。在一些实施方案中,本文所述的fc-抗原结合结构域构建体(例如,具有三个fc结构域的fc-抗原结合结构域构建体)中的fc结构域单体可具有与seqidno:42的序列具有至少95%同一性(至少97%、99%或99.5%同一性)的序列。在一些实施方案中,本文所述的fc-抗原结合结构域构建体(例如,具有三个fc结构域的fc-抗原结合结构域构建体)中的fc结构域单体可具有与seqidno:44、46、48和50-53中任一者的序列具有至少95%同一性(至少97%、99%或99.5%同一性)的序列。在某些实施方案中,fc-抗原结合结构域构建体中的fc结构域单体可具有与seqidno:48、52和53中任一者的序列具有至少95%同一性(至少97%、99%或99.5%同一性)的序列。seqidno:42dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkseqidno:44dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsrdeltknqvslscavkgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkseqidno:46dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsrdeltknqvslscavkgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgseqidno:48dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsrdeltknqvslscavdgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgseqidno:50dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppcrdeltknqvslwclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkseqidno:51dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvlksdgsfflysdltvdksrwqqgnvfscsvmhealhnhytqkslslspgkseqidno:52dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvlksdgsfflysdltvdksrwqqgnvfscsvmhealhnhytqkslslspgseqidno:53dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppcrdkltknqvslwclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkii.fc结构域如本文所定义,fc结构域包括两个fc结构域单体,它们通过ch3抗体恒定结构域之间的相互作用而二聚化。fc结构域形成与fc受体(例如,fc-γ受体(即fcγ受体(fcγr))、fc-α受体(即fcα受体(fcαr))、fc-ε受体(即、fcε受体(fcεr))和/或新生儿fc受体(fcrn))结合的最小结构。在一些实施方案中,本公开的fc结构域与fcγ受体(例如,fcγri(cd64)、fcγriia(cd32)、fcγriib(cd32)、fcγriiia(cd16a)、fcγriiib(cd16b))和/或fcγriv和/或新生儿fc受体(fcrn)结合。iii.pd-l1结合结构域抗原结合结构域包括特异性结合靶分子的一种或多种肽或多肽。pd-l1结合结构域可包括抗体的pd-l1结合结构域。在一些实施方案中,pd-l1结合结构域可以是抗体或抗体构建体的片段,例如抗体的与靶抗原结合的最小部分。pd-l1结合结构域也可以是特异性结合靶标的合成工程化肽,例如基于纤连蛋白的结合蛋白(例如,fn3单体)。片段抗原结合(fab)片段是抗体上与靶抗原结合的区域。它由重链和轻链中每一者的一个恒定结构域和一个可变结构域构成。fab片段包括vh、vl、ch1和cl结构域。可变结构域vh和vl各自在单体的氨基末端处包含一组3个互补决定区(cdr)。fab片段可以是免疫球蛋白抗体同种型igg、ige、igm、iga或igd。fab片段单体也可以是任何免疫球蛋白抗体同种型(例如,igg1、igg2a、igg2b、igg3或igg4)。在一些实施方案中,在对免疫球蛋白进行蛋白酶(例如,胃蛋白酶)处理之后,fab片段可共价附接到第二相同的fab片段,从而形成f(ab’)2片段。在一些实施方案中,fab可表达为单个多肽,该单个多肽包括例如与结构域之间的接头融合的可变结构域和恒定结构域。在一些实施方案中,可仅使用fab片段的一部分作为pd-l1结合结构域。在一些实施方案中,可仅使用fab的轻链组分(vl+cl),或者可仅使用fab的重链组分(vh+ch)。在一些实施方案中,可使用单链可变片段(scfv),该单链可变片段是fab可变区的vh和vl链的融合蛋白。在其他实施方案中,可使用线性抗体,该线性抗体包括一对串联fd区段(vh-ch1-vh-ch1),该对串联fd区段与互补轻链多肽一起形成一对pd-l1结合区。在一些实施方案中,本公开的pd-l1结合结构域包括表1中列出的靶标或抗原,以及表1中针对所列出的靶标或抗原列出的一个、两个、三个、四个、五个或全部六个cdr序列,如下表1进一步详细提供。表1:cdr序列表2:重链和轻链序列fc-抗原结合结构域构建体1的pd-l1结合结构域(图1中的110/104)可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体2的pd-l1结合结构域(图2中的212/204)可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体3的pd-l1结合结构域(图3中的308/316和312/318)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体4的pd-l1结合结构域(图4中的410/412、416/418和422/424)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体5的pd-l1结合结构域(图5中的510/504、512/514和518/520)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体6的pd-l1结合结构域(图6中的612/604、614/616、620/622和626/628)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体7的pd-l1结合结构域(图7中的712/714和714/716)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体8的pd-l1结合结构域(图8中的812/806和818/822)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体9的pd-l1结合结构域(图9中的908/906、920/922、912/914和926/930)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体10的pd-l1结合结构域(图10中的1006/1004和1018/1020)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体11的pd-l1结合结构域(图11中的1112/1114、1122/1108、1128/1142和1138/1136)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体12的pd-l1结合结构域(图12中的1218/1220、1212/1214、1250/1208、1248/1246、1242/1240和1236/1234)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体13的pd-l1结合结构域(图13中的1310/1304和1314/1322)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体14的pd-l1结合结构域(图14中的1408/1406和1416/1424)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体15的pd-l1结合结构域(图15中的1508/1506、1514/1516、1532/1520和1530/1528)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体16的pd-l1结合结构域(图16中的1616/1604和1618/1630)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体17的pd-l1结合结构域(图17中的1712/1714、1724/1708、1726/1742和1738/1736)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体18的pd-l1结合结构域(图18中的1812/1814、1828/1808、1826/1824、1830/1832、1850/1848和1844/1842)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体19的pd-l1结合结构域(图19中的1914/1904和1920/1922)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体20的pd-l1结合结构域(图20中的2014/2016、2042/2008、2036/2034和2028/2026)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。fc-抗原结合结构域构建体21的pd-l1结合结构域(图21中的2114/2116、2150/2108、2148/2146、2138/2140、2136/2134和2128/2126)各自可以包括表1中列出的抗体中的任何一种的三个重链和三个轻链cdr序列。iv.二聚化选择性模块在本公开中,二聚化选择性模块包括fc结构域单体内的组分或选择性氨基酸,所述组分或选择性氨基酸促进两个fc结构域单体的优选配对以形成fc结构域。具体地,二聚化选择性模块是fc结构域单体的ch3抗体恒定结构域的部分,该部分包括位于两个fc结构域单体的相互作用的ch3抗体恒定结构域之间的界面处的氨基酸置换。在二聚化选择性模块中,由于针对氨基酸置换选择的氨基酸的相容性,那些置换使得两个ch3抗体恒定结构域的二聚化变得有利。有利的fc结构域的最终形成选择性超过其他fc结构域,所述其他fc结构域由缺少二聚化选择性模块的fc结构域单体形成或在二聚化选择性模块中具有不相容的氨基酸置换。这种类型的氨基酸置换可以使用本领域众所周知的常规分子克隆技术(诸如诱变)产生。在一些实施方案中,二聚化选择性模块在ch3抗体恒定结构域中包括工程化空腔(或本文进一步描述的“孔洞”)。在其他实施方案中,二聚化选择性模块在ch3抗体恒定结构域中包括工程化突起(或本文进一步描述的“旋钮”)。为了选择性地形成fc结构域,具有相容二聚化选择性模块的两个fc结构域单体(例如,含有工程化空腔的一个ch3抗体恒定结构域和含有工程化突起的另一个ch3抗体恒定结构域)组合以形成fc结构域单体的突起-进入-空腔(或“旋钮和孔洞”)对。工程化突起和工程化空腔是异二聚化选择性模块的实例,它们可以在fc结构域单体的ch3抗体恒定结构域中产生,以便促进具有相容异二聚化选择性模块的两个fc结构域单体的有利异二聚化。表3列出了合适的突变。在其他实施方案中,通过使用具有包含带正电荷的氨基酸置换的二聚化选择性模块的fc结构域单体和具有包含带负电荷的氨基酸置换的二聚化选择性模块的fc结构域单体而实现的异二聚化可通过带电氨基酸的有利静电转向(本文进一步描述)选择性地组合以形成fc结构域。在一些实施方案中,fc结构域单体可以包括下述带正电荷和带负电荷的氨基酸置换之一:k392d、k392e、d399k、k409d、k409e、k439d和k439e。在一个实例中,包含带正电荷的氨基酸置换(例如,d356k或e357k)的fc结构域单体和包含带负电荷的氨基酸置换(例如,k370d或k370e)的fc结构域单体可通过带电氨基酸的有利静电转向选择性地组合以形成fc结构域。在另一个实例中,包含e357k的fc结构域单体和包含k370d的fc结构域单体可通过带电氨基酸的有利静电转向选择性地组合以形成fc结构域。在一些实施方案中,可将反向电荷氨基酸置换用作异二聚化选择性模块,其中包含不同但相容的反向电荷氨基酸置换的两个fc结构域单体组合以形成异二聚体fc结构域。表3列出了用于促进异二聚化的各种带相反电荷的二聚化选择性模块。除了旋钮和孔洞突变以及静电转向突变之外,还存在可以用于促进异二聚化的其他类型的突变。这些突变也在表3中列出。在其他实施方案中,两个fc结构域单体包括在ch3结构域之间的界面处的带电残基环内至少两个位置中包含相同的反向电荷突变的同二聚化选择性模块。同二聚体选择性模块是促进fc结构域单体的同二聚化以形成同二聚体fc结构域的反向电荷氨基酸置换。通过逆转两个fc结构域单体中的两个或更多个互补残基对的两个成员的电荷,突变的fc结构域单体保持与相同突变序列的fc结构域单体互补,但与不含那些突变的fc结构域单体具有更低的互补性。在一个实施方案中,fc结构域包括fc结构域单体,其包括双重突变体k409d/d399k、k392d/d399k、e357k/k370e、d356k/k439d、k409e/d399k、k392e/d399k、e357k/k370d或d356k/k439e。在另一个实施方案中,fc结构域包括fc结构域单体,其包括组合任何一对双重突变体的四重突变体,例如k409d/d399k/e357k/k370e。表4a和表4b列出了促进同二聚化的各种选择性。在其他实施方案中,含有(i)至少一个反向电荷突变和(ii)至少一个工程化空腔或至少一个工程化突起的fc结构域单体可与另一个含有(i)至少一个反向电荷突变和(ii)至少一个工程化突起或至少一个工程化空腔的fc结构域单体选择性地组合以形成fc结构域。例如,含有反向电荷突变k370d和工程化空腔y349c、t366s、l368a和y407v的fc结构域单体以及另一个含有反向电荷突变e357k和工程改化突起s354c和t366w的fc结构域单体可选择性地组合以形成fc结构域。此类fc结构域的形成通过ch3抗体恒定结构域中的相容氨基酸置换来促进。含有不相容氨基酸置换的两个二聚化选择性模块(例如,两者均含有工程化空腔,两者均含有工程化突起,或两者均在ch3-ch3界面处含有相同的带电氨基酸)不会促进异二聚体fc结构域的形成。此外,用于促进具有明确的fc结构域单体的fc结构域的形成的其他方法包括但不限于:luz-y方法(美国专利申请公开号wo2011034605),该方法包括使亮氨酸拉链的单体α-螺旋与每个fc结构域单体进行c末端融合,以允许异二聚体形成;以及链交换工程化结构域(seed)主体方法(davis等人,proteinengdessel.23:195-202,2010),该方法生成具有异二聚体fc结构域单体的fc结构域,这些异二聚体fc结构域单体各自包括iga和iggch3序列的交替区段。v.工程化空腔和工程化突起carter和同事(ridgway等人,proteineng.9:617-612,1996;atwell等人,jmolbiol.270:26-35,1997;merchant等人,natbiotechnol.16:677-681,1998)描述了工程化空腔和工程化突起(或“旋钮-进入-孔洞”策略)的用途。旋钮和孔洞相互作用有利于异二聚体形成,而旋钮-旋钮和孔洞-孔洞相互作用由于空间冲突和有利相互作用的缺失会阻碍同二聚体形成。“旋钮-进入-孔洞”技术也在美国专利号5,731,168中公开。在本公开中,工程化空腔和工程化突起用于制备本文所述的fc-抗原结合结构域构建体。工程化空腔是当用具有较小侧链体积的不同氨基酸替换蛋白质中的原始氨基酸时产生的空隙。工程化突起是当用具有较大侧链体积的不同氨基酸替换蛋白质中的原始氨基酸时产生的突起。具体地,被替换的氨基酸位于fc结构域单体的ch3抗体恒定结构域中,并且涉及两个fc结构域单体的二聚化。在一些实施方案中,产生一个ch3抗体恒定结构域中的工程化空腔,以容纳另一个ch3抗体恒定结构域中的工程化突起,使得两个ch3抗体恒定结构域均充当促进或有利于两个fc结构域单体的二聚化的二聚化选择性模块(例如,异二聚化选择性模块)(上文描述)。在其他实施方案中,产生一个ch3抗体恒定结构域中的工程化空腔,以更好地容纳另一个ch3抗体恒定结构域中的原始氨基酸。在另外其他实施方案中,产生一个ch3抗体恒定结构域中的工程化突起,以与另一个ch3抗体恒定结构域中的原始氨基酸形成另外的相互作用。可以通过用含有较小侧链的氨基酸(诸如丙氨酸、缬氨酸或苏氨酸)替换含有较大侧链(诸如酪氨酸或色氨酸)的氨基酸来构建工程化空腔。具体地,一些二聚化选择性模块(例如,异二聚化选择性模块)(上文进一步描述)含有工程化空腔,诸如ch3抗体恒定结构域中的y407v突变。类似地,可以通过用含有较大侧链的氨基酸替换含有较小侧链的氨基酸来构建工程化突起。具体地,一些二聚化选择性模块(例如,异二聚化选择性模块)(上文进一步描述)含有工程化突起,诸如ch3抗体恒定结构域中的t366w突变。在本公开中,还将工程化空腔和工程化突起与ch3结构域间二硫键工程化组合,以增强异二聚体形成。在一个实例中,含有工程化空腔y349c、t366s、l368a和y407v的fc结构域单体可与含有工程化突起s354c和t366w的另一个fc结构域单体选择性地组合以形成fc结构域。在另一个实例中,含有添加有y349c的工程化空腔的fc结构域单体和含有添加有s354c的工程化突起的fc结构域单体可选择性地组合以形成fc结构域。与二硫键工程化或结构计算(混合ha-tf)组合的其他工程化空腔和工程化突起包括在表3中,但不限于此。用不同的氨基酸残基替换ch3抗体恒定结构域中的原始氨基酸残基可以通过改变编码原始氨基酸残基的核酸来实现。可以被替换的原始氨基酸残基的数量上限是ch3抗体恒定结构域的界面中的残基总数,只要仍维持界面处充分的相互作用。将工程化空腔和工程化突起与静电转向组合可以将静电转向与旋钮-进入-孔洞调节技术组合,以有利于例如两个不同多肽中的fc结构域单体之间的异二聚化作用。下文更详细描述的静电转向利用肽、蛋白质结构域和蛋白质中带相反电荷的氨基酸之间的有利静电相互作用来控制更高级蛋白质分子的形成。可以使用静电转向来促进同二聚化或异二聚化,可以将后者有效地与旋钮-进入-孔洞技术组合。在异二聚化的情况下,将不同但相容的突变引入要异二聚化的每个fc结构域单体中。因此,可以修饰fc结构域单体以包括以下带正电荷和带负电荷的氨基酸置换中的一者:d356k、d356r、e357k、e357r、k370d、k370e、k392d、k392e、d399k、k409d、k409e、k439d和k439e。例如,一个fc结构域单体(例如,具有空腔(y349c、t366s、l368a和y407v)的fc结构域单体)还可以包括k370d突变,并且另一个fc结构域单体(例如,具有突起(s354c和t366w)的fc结构域单体)可以包括e357k。更一般地,可以将以下任何空腔突变(或突变组合)与表3中的静电转向突变组合:y407t、y407a、f405a、y407t、t394s、t394w:y407a、t366w:t394s、t366s:l368a:y407v:y349c和s3364h:f405,并且可以将以下任何突起突变(或突变组合)与表3中的静电转向突变组合:t366y、t366w、t394w、f405w、t366y:f405a、t366w:y407a、t366w:s354c和y349t:t394f。vi.静电转向静电转向是利用肽、蛋白质结构域和蛋白质中带相反电荷的氨基酸之间的有利静电相互作用来控制更高级蛋白质分子的形成。在美国专利申请公开号2014-0024111中公开了使用静电转向效应来改变抗体结构域的相互作用以减少同二聚体形成的方法,有利于在双特异性抗体的生成中的异二聚体形成。在本公开中,使用静电转向来控制fc结构域单体的二聚化和fc-抗原结合结构域构建体的形成。具体地,为了使用静电转向来控制fc结构域单体的二聚化,用带正电荷或带负电的氨基酸残基替换构成ch3-ch3界面的一个或多个氨基酸残基,使得相互作用取决于引入的具体带电氨基酸而变得具有静电有利或不利。在一些实施方案中,用带负电荷的氨基酸(诸如天冬氨酸或谷氨酸)替换界面中带正电荷的氨基酸(诸如赖氨酸、精氨酸或组氨酸)。在其他实施方案中,用带正电荷的氨基酸替换界面中带负电荷的氨基酸。可将带电氨基酸引入相互作用的ch3抗体恒定结构域中的一者或两者。通过将带电氨基酸引入相互作用的ch3抗体恒定结构域,产生二聚化选择性模块(上文进一步描述),这些二聚化选择性模块可以选择性地形成fc结构域单体的二聚体,如由来源于带电氨基酸之间的相互作用的静电转向效应控制。在一些实施方案中,为了产生包括反向电荷的二聚化选择性模块(该二聚化选择性模块可以选择性地形成fc结构域单体的二聚体,如由静电转向效应控制),可通过异二聚化或同二聚化选择性地形成两个fc结构域单体。fc结构域单体的异二聚化可以通过在两个fc结构域单体中引入不同但相容的突变(诸如表3中包括的电荷残基对,但不限于此)来促进fc结构域单体的异二聚化。在一些实施方案中,fc结构域单体可以包括下述带正电荷和带负电荷的氨基酸置换之一:d356k、d356r、e357k、e357r、k370d、k370e、k392d、k392e、d399k、k409d、k409e、k439d和k439e。在一个实例中,包含带正电荷的氨基酸置换(例如,d356k或e357k)的fc结构域单体和包含带负电荷的氨基酸置换(例如,k370d或k370e)的fc结构域单体可通过带电氨基酸的有利静电转向选择性地组合以形成fc结构域。在另一个实例中,包含e357k的fc结构域单体和包含k370d的fc结构域单体可通过带电氨基酸的有利静电转向选择性地组合以形成fc结构域。例如,在具有三个fc结构域的fc-抗原结合结构域构建体中,三个fc结构域中的两个可通过两个fc结构域单体的异二聚化形成,如通过静电转向效应促进。“异二聚体fc结构域”是指通过两个fc结构域单体的异二聚化形成的fc结构域,其中两个fc结构域单体含有促进这两个fc结构域单体的有利形成的不同反向电荷突变(异二聚化选择性模块)(参见例如,表4a和表4b中的突变)。在具有三个fc结构域(一个羧基末端“茎”fc结构域和两个氨基末端“分支”fc结构域)的fc-抗原结合结构域构建体中,每个氨基末端“分支”fc结构域可以是异二聚体fc结构域(也称为“分支异二聚体fc结构域”)(例如,由图1中的fc结构域单体106和114或fc结构域单体112和116形成的异二聚体fc结构域;由图2中的fc结构域单体206和214或fc结构域单体212和216形成的异二聚体fc结构域)。分支异二聚体fc结构域可以由含有e357k的fc结构域单体和另一个含有k370d的fc结构域单体形成。表3.fc异二聚化方法表3.fc异二聚化方法表3.fc异二聚化方法表3.fc异二聚化方法注意:所有残基均按eu编号方案(edelman等人,procnatlacadsciusa,63:78-85,1969)进行编号fc结构域单体的同二聚化可以通过以对称方式在两个fc结构域单体中引入相同的静电转向突变(同二聚化选择性模块)来促进fc结构域单体的同二聚化。在一些实施方案中,两个fc结构域单体包括在ch3结构域之间的界面处的带电残基环内至少两个位置中包含相同的反向电荷突变的同二聚化选择性模块。通过逆转两个fc结构域单体中的两个或更多个互补残基对的两个成员的电荷,突变的fc结构域单体保持与相同突变序列的fc结构域单体互补,但与不含那些突变的fc结构域单体具有更低的互补性。可被引入fc结构域单体中以促进其同二聚化的静电转向突变在表4a和表4b中示出,但不限于此。在一个实施方案中,fc结构域包括两个fc结构域单体,每个单体包括双重反向电荷突变体(表4a和表4b),例如k409d/d399k。在另一个实施方案中,fc结构域包括两个fc结构域单体,每个fc结构域单体包括四重反向突变体(表4a和表4b),例如k409d/d399k/k370d/e357k。例如,在具有三个fc结构域的fc-抗原结合结构域构建体中,三个fc结构域中的一个可通过两个fc结构域单体的同二聚化形成,如通过静电转向效应促进。“同二聚体fc结构域”是指通过两个fc结构域单体的同二聚化形成的fc结构域,其中两个fc结构域单体含有相同的反向电荷突变(参见例如,表5和表6中的突变)。在具有三个fc结构域(一个羧基末端“茎”fc结构域和两个氨基末端“分支”fc结构域)的fc-抗原结合结构域构建体中,羧基末端“茎”fc结构域可以是同二聚体fc结构域(也称为“茎同二聚体fc结构域”)。茎同二聚体fc结构域可由两个fc结构域单体形成,每个fc结构域单体含有双重突变体k409d/d399k。表4a.fc同二聚化方法—每条链中两个突变表4a.fc同二聚化方法—每条链中两个突变表4b.fc同二聚化方法—每条链中四个突变vii.接头在本公开中,接头用于描述多肽或蛋白质结构域和/或结合的非蛋白质部分之间的键合或连接。在一些实施方案中,接头是至少两个fc结构域单体之间的键合或连接,接头将第一fc结构域单体的ch3抗体恒定结构域的c末端与第二fc结构域单体的铰链结构域的n末端连接,使得两个fc结构域单体彼此串联连接。在其他实施方案中,接头是fc结构域单体与附接到其上的任何其他蛋白质结构域之间的键合。例如,接头可以将fc结构域单体的ch3抗体恒定结构域的c末端附接到白蛋白结合肽的n末端。接头可以是简单的共价键(例如,肽键)、合成聚合物(例如,聚乙二醇(peg)聚合物)或由化学反应(例如,化学缀合)产生的任何种类的键。在接头是肽键的情况下,在一个蛋白质结构域的c末端处的羧酸基团可以在缩合反应中与另一个蛋白质结构域的n末端的氨基反应,以形成肽键。具体地,肽键可以通过本领域众所周知的常规有机化学反应由合成手段形成,或通过天然产生由宿主细胞形成,其中编码以串联系列的两种蛋白质的dna序列的多核苷酸序列,例如两个fc结构域的单体,可以通过宿主细胞中的必需分子机器,例如dna聚合酶和核糖体,直接转录且翻译成编码两种蛋白质的连续多肽。在接头是合成聚合物例如peg聚合物的情况下,聚合物可以在每个末端处用反应性化学官能团官能化,以与在两个蛋白质的连接末端处的末端氨基酸反应。在接头(除了上述肽键之外)由化学反应制成的情况下,可以分别将化学官能团(例如,胺、羧酸、酯、叠氮化物或本领域常用的其他官能团)合成地附接到一种蛋白质的c末端和另一种蛋白质的n末端。然后两个官能团可以通过合成化学手段反应,以形成化学键,因此将两种蛋白质连接在一起。此类化学缀合程序对于本领域技术人员是常规的。间隔物在本公开中,两个fc结构域单体之间的接头可以是包括3-200个氨基酸的氨基酸间隔物(例如,3-200、3-180、3-160、3-140、3-120、3-100、3-90、3-80、3-70、3-60、3-50、3-45、3-40、3-35、3-30、3-25、3-20、3-15、3-10、3-9、3-8、3-7、3-6、3-5、3-4、4-200、5-200、6-200、7-200、8-200、9-200、10-200、15-200、20-200、25-200、30-200、35-200、40-200、45-200、50-200、60-200、70-200、80-200、90-200、100-200、120-200、140-200、160-200或180-200个氨基酸)。在一些实施方案中,两个fc结构域单体之间的接头是含有至少12个氨基酸(诸如12-200个氨基酸(例如,12-200、12-180、12-160、12-140、12-120、12-100、12-90、12-80、12-70、12-60、12-50、12-40、12-30、12-20、12-19、12-18、12-17、12-16、12-15、12-14或12-13个氨基酸)(例如,14-200、16-200、18-200、20-200、30-200、40-200、50-200、60-200、70-200、80-200、90-200、100-200、120-200、140-200、160-200、180-200或190-200个氨基酸))的氨基酸间隔物。在一些实施方案中,两个fc结构域单体之间的接头是含有12-30个氨基酸(例如,12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸)的氨基酸间隔物。合适的肽间隔物是本领域已知的,并且包括例如含有柔性氨基酸残基(诸如甘氨酸和丝氨酸)的肽接头。在某些实施方案中,间隔物可以含有gs、ggs、ggggs(seqidno:1)、ggsg(seqidno:2)或sggg(seqidno:3)的基序,例如多个或重复基序。在某些实施方案中,间隔物可以含有2至12个氨基酸,包括gs的基序,例如gs、gsgs(seqidno:4)、gsgsgs(seqidno:5)、gsgsgsgs(seqidno:6)、gsgsgsgsgs(seqidno:7)或gsgsgsgsgsgs(seqidno:8)。在某些其他实施方案中,间隔物可以含有3至12个氨基酸,包括ggs的基序,例如ggs、ggsggs(seqidno:9)、ggsggsggs(seqidno:10)和ggsggsggsggs(seqidno:11)。在另外其他实施方案中,间隔物可以含有4至20个氨基酸,包括ggsg(seqidno:2)的基序,例如ggsgggsg(seqidno:12)、ggsgggsgggsg(seqidno:13)、ggsgggsgggsgggsg(seqidno:14)或ggsgggsgggsgggsgggsg(seqidno:15)。在其他实施方案中,间隔物可以含有ggggs(seqidno:1)的基序,例如ggggsggggs(seqidno:16)或ggggsggggsggggs(seqidno:17)。在某些实施方案中,间隔物是sgggsgggsgggsgggsggg(seqidno:18)。在一些实施方案中,两个fc结构域单体之间的间隔物仅含有甘氨酸残基,例如至少4个甘氨酸残基(例如,4-200、4-180、4-160、4-140、4-40、4-100、4-90、4-80、4-70、4-60、4-50、4-40、4-30、4-20、4-19、4-18、4-17、4-16、4-15、4-14、4-13、4-12、4-11、4-10、4-9、4-8、4-7、4-6或4-5个甘氨酸残基)(例如,4-200、6-200、8-200、10-200、12-200、14-200、16-200、18-200、20-200、30-200、40-200、50-200、60-200、70-200、80-200、90-200、100-200、120-200、140-200、160-200、180-200或190-200个甘氨酸残基)。在某些实施方案中,间隔物具有4-30个甘氨酸残基(例如,4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个甘氨酸残基)。在一些实施方案中,仅含有甘氨酸残基的间隔物可不被糖基化(例如,o-连接糖基化,也称为o-糖基化),或与例如含有一个或多个丝氨酸残基的间隔物(例如,sgggsgggsgggsgggsggg(seqidno:18))相比,可具有降低水平的糖基化(例如,降低水平的o-糖基化)(例如,降低水平的用聚糖(诸如木糖、甘露糖、唾液酸、岩藻糖(fuc)和/或半乳糖(gal)(例如,木糖))进行的o-糖基化)。在一些实施方案中,仅含有甘氨酸残基的间隔物可不被o-糖基化(例如,o-木糖基化),或与例如含有一个或多个丝氨酸残基的间隔物(例如,sgggsgggsgggsgggsggg(seqidno:18))相比,可具有降低水平的o-糖基化水平(例如,降低水平的o-木糖基化)。在一些实施方案中,仅含有甘氨酸残基的间隔物可不经历蛋白水解,或与例如含有一个或多个丝氨酸残基的间隔物(例如,sgggsgggsgggsgggsggg(seqidno:18))相比,可具有降低速率的蛋白水解。在某些实施方案中,间隔物可以含有gggg(seqidno:19)的基序,例如gggggggg(seqidno:20)、gggggggggggg(seqidno:21)、gggggggggggggggg(seqidno:22)或gggggggggggggggggggg(seqidno:23)。在某些实施方案中,间隔物可以含有ggggg(seqidno:24)的基序,例如gggggggggg(seqidno:25)或ggggggggggggggg(seqidno:26)。在某些实施方案中,间隔物是gggggggggggggggggggg(seqidno:27)。在其他实施方案中,间隔物还可以含有除甘氨酸和丝氨酸外的氨基酸,例如genlyfqsgg(seqidno:28)、sacycels(seqidno:29)、rsiat(seqidno:30)、rpackipndlkqkvmnh(seqidno:31)、ggsaggsgsgssggssgasgtgtaggtgsgsgtgsg(seqidno:32)、aaanssidlisvpvdsr(seqidno:33)或ggsgggsegggsegggsegggsegggsegggsgggs(seqidno:34)。在本公开的某些实施方案中,使用12或20个氨基酸肽间隔物串联连接两个fc结构域单体,所述12和20个氨基酸的肽间隔物由序列gggsgggsgggs(seqidno:35)和sgggsgggsgggsgggsggg(seqidno:18)组成。在其他实施方案中,可使用由序列ggsgggsgggsgggsggs(seqidno:36)组成的18个氨基酸肽间隔物。在一些实施方案中,两个fc结构域单体之间的间隔物可具有与上文所述的seqidno:1-36中任一者的序列具有至少75%同一性(例如,至少77%、79%、81%、83%、85%、87%、89%、91%、93%、95%、97%、99%或99.5%同一性)的序列。在某些实施方案中,两个fc结构域单体之间的间隔物可具有与seqidno:17、18、26和27中任一者的序列具有至少80%同一性(例如,至少82%、85%、87%、90%、92%、95%、97%、99%或99.5%同一性)的序列。在某些实施方案中,两个fc结构域单体之间的间隔物可具有与seqidno:18或27的序列具有至少80%同一性(例如,至少82%、85%、87%、90%、92%、95%、97%、99%或99.5%同一性)的序列。在某些实施方案中,fc结构域单体的铰链的氨基末端与同一多肽中的fc单体的羧基末端之间的接头(即,该接头将第一fc结构域单体的ch3抗体恒定结构域的c-末端与第二fc结构域单体的铰链结构域的n-末端连接,使得两个fc结构域单体彼此串联连接)是具有3个或更多个氨基酸(例如,3-200个氨基酸(例如,3-200、3-180、3-160、3-140、3-120、3-100、3-90、3-80、3-70、3-60、3-50、3-45、3-40、3-35、3-30、3-25、3-20、3-15、3-10、3-9、3-8、3-7、3-6、3-5、3-4、4-200、5-200、6-200、7-200、8-200、9-200、10-200、15-200、20-200、25-200、30-200、35-200、40-200、45-200、50-200、60-200、70-200、80-200、90-200、100-200、120-200、140-200、160-200或180-200个氨基酸))的间隔物而不是共价键或含有至少12个氨基酸(诸如12-200个氨基酸,例如12-200、12-180、12-160、12-140、12-120、12-100、12-90、12-80、12-70、12-60、12-50、12-40、12-30、12-20、12-19、12-18、12-17、12-16、12-15、12-14或12-13个氨基酸)(例如14-200、16-200、18-200、20-200、30-200、40-200、50-200、60-200、70-200、80-200、90-200、100-200、120-200、140-200、160-200、180-200或190-200个氨基酸)的氨基酸间隔物。间隔物也可以存在于fc结构域单体的铰链结构域的n-末端与pd-l1结合结构域(例如,pd-l1重链结合结构域的ch1结构域或pd-l1轻链结合结构域的cl结构域)的羧基末端之间,使得这些结构域通过3个或更多个氨基酸(例如,3-200个氨基酸(例如,3-200、3-180、3-160、3-140、3-120、3-100、3-90、3-80、3-70、3-60、3-50、3-45、3-40、3-35、3-30、3-25、3-20、3-15、3-10、3-9、3-8、3-7、3-6、3-5、3-4、4-200、5-200、6-200、7-200、8-200、9-200、10-200、15-200、20-200、25-200、30-200、35-200、40-200、45-200、50-200、60-200、70-200、80-200、90-200、100-200、120-200、140-200、160-200或180-200个氨基酸))的间隔物或含有至少12个氨基酸(诸如12-200个氨基酸,例如12-200、12-180、12-160、12-140、12-120、12-100、12-90、12-80、12-70、12-60、12-50、12-40、12-30、12-20、12-19、12-18、12-17、12-16、12-15、12-14或12-13个氨基酸)(例如14-200、16-200、18-200、20-200、30-200、40-200、50-200、60-200、70-200、80-200、90-200、100-200、120-200、140-200、160-200、180-200或190-200个氨基酸)的氨基酸间隔物连接。viii.血清蛋白结合肽与血清蛋白肽结合可以改善蛋白质药物的药代动力学,并且具体地,可将本文描述的fc-抗原结合结构域构建体与血清蛋白结合肽融合。作为一个实例,可以用于本文所述的方法和组合物中的白蛋白结合肽是本领域一般已知的。在一个实施方案中,白蛋白结合肽包括序列diclprwgclw(seqidno:37)。在一些实施方案中,白蛋白结合肽具有与seqidno:37的序列至少80%同一性(例如,80%、90%或100%同一性)的序列。在本公开中,可将白蛋白结合肽附接到fc-抗原结合结构域构建体中的某些多肽的n末端或c末端。在一个实施方案中,可将白蛋白结合肽附接到包含pd-l1结合结构域的fc构建体中的一个或多个多肽的c末端。在另一个实施方案中,可以将白蛋白结合肽融合到包含pd-l1结合结构域的fc构建体中的编码串联连接的两个fc结构域单体的多肽的c末端。在又一个实施方案中,可以将白蛋白结合肽附接到与编码串联连接的两个fc结构域单体的多肽中的第二fc结构域单体连接的fc结构域单体(例如,图1中的fc结构域单体114和116;图2中的fc结构域单体214和216)的c末端。可以将白蛋白结合肽遗传融合到fc-抗原结合结构域构建体或通过化学手段(例如,化学缀合)附接到fc-抗原结合结构域构建体。如果需要,可以在fc-抗原结合结构域构建体与白蛋白结合肽之间插入间隔物。不受理论束缚,预期在本公开的fc-抗原结合结构域构建体中包括白蛋白结合肽可通过其与血清白蛋白结合延长治疗性蛋白质的保留。vix.fc-抗原结合结构域构建体一般来讲,本公开的特征在于具有2-10个fc结构域以及附接的一个或多个pd-l1结合结构域的fc-抗原结合结构域构建体。这些fc结构域对于fc受体(例如,fcγriiia)可具有比单个野生型fc结构域更高的结合亲和力和/或亲合力。本公开公开了工程化两个相互作用的ch3抗体恒定结构域的界面处的氨基酸的方法,使得fc结构域的两个fc结构域单体彼此选择性地形成二聚体,从而防止形成不需要的多聚体或聚集体。fc-抗原结合结构域构建体包括偶数数量的fc结构域单体,其中每对fc结构域单体形成fc结构域。fc-抗原结合结构域构建体至少包括由四个fc结构域单体和一个pd-l1结合结构域的二聚体形成的两个功能性fc结构域。可例如用接头、间隔物、肽键、化学键或化学部分将pd-l1结合结构域与fc结构域连接。fc-抗原结合结构域构建体可以以许多方式组装。fc-抗原结合结构域构建体可以由不对称串联fc结构域组装而成(图1至图6)。fc-抗原结合结构域构建体可以由单分支的fc结构域组装而成,其中分支点在n末端fc结构域(图7至图12)。fc-抗原结合结构域构建体可以由单分支的fc结构域组装而成,其中分支点在c末端fc结构域(图13至图18)。fc-抗原结合结构域构建体可以由单分支的fc结构域组装而成,其中分支点在n末端或c末端fc结构域(图19至图21)。可以以许多方式将pd-l1结合结构域与fc-抗原结合结构域构建体连接。可以将pd-l1结合结构域表达为fc链的融合蛋白。可以将pd-l1结合fab的重链组分表达为fc链的融合蛋白,并且可以将轻链组分表达为单独的多肽(图24,小图a)。在一些实施方案中,将scfv用作pd-l1结合结构域。可以将scfv表达为长fc链的融合蛋白(图24,小图b)。在一些实施方案中,单独表达重链和轻链组分并将其外源添加到fc-抗原结合结构域构建体中。在一些实施方案中,单独表达pd-l1结合结构域,稍后利用化学键将其与fc-抗原结合结构域构建体连接(图24,小图c)。在一些实施方案中,fc-抗原结合结构域构建体中的一个或多个fc多肽缺乏c末端赖氨酸残基。在一些实施方案中,fc-抗原结合结构域构建体中的所有fc多肽缺乏c末端赖氨酸残基。在一些实施方案中,在fc-抗原结合结构域构建体中的一个或多个fc多肽中不存在c末端赖氨酸可改善fc-抗原结合结构域构建体(例如,具有三个fc结构域的fc-抗原结合结构域构建体)(例如,具有至少85%、90%、95%、98%或99%同质性的具有三个fc结构域的fc-抗原结合结构域构建体群体)的同质性。在一些实施方案中,可将本文所述的fc-抗原结合结构域构建体中的第一多肽、第二多肽、第三多肽、第四多肽、第五多肽或第六多肽(例如,图1中的多肽102、112和114,图2中的202、214、216和218,图3中的302、320和322,图4中的402、428、430和432,图5中的502、524和526,图6中的602、632、634和636,图7中的702、708、722和724,图8中的802、804、826和828,图9中的902、904、934和936,图10中的1002、1010、1012、1024、1026和1032,图11中的1102、1104、1106、1144、1146和1148,图12中的1202、1204、1206、1252、1254和1256,图13中的1302、1306、1320和1324,图14中的1402、1404、1426和1428,图15中的1502、1504、1534和1536,图16中的1602、1606、1608、1626、1628和1632,图17中的1702、1704、1706、1744、1746和1748,图18中的1802、1804、1806、1852、1854和1856,图19中的1902、1906、1910、1924、1928和1932,图20中的2002、2004、2006、2044、2046和2048,图21中的2102、2104、2106、2152、2154和2156)中的一者或多者中的n末端asp突变为gln。对于本文实施例中描述的示例性fc-抗原结合结构域构建体,fc-抗原结合结构域构建体1-21可分别在旋钮和孔洞亚基中包含e357k和k370d电荷对。本文所述的示例性fc-抗原结合结构域构建体(例如,fc-抗原结合结构域构建体1-21)中的任何一种相对于具有单个fc结构域和pd-l1结合结构域的构建体可以在抗体依赖性细胞毒性(adcc)测定、抗体依赖性细胞吞噬作用(adcp)和/或补体依赖性细胞毒性(cdc)测定中具有增强的效应子功能,或可以包括具有单个fc结构域和pd-l1结合结构域的构建体未表现出的生物活性。x.宿主细胞和蛋白质产生在本公开中,宿主细胞指包括从其对应的核酸表达本文所述多肽和构建体所需的必要细胞组分(例如,细胞器)的媒介物。核酸可包括在核酸载体中,可以通过本领域已知的常规技术(转化、转染、电穿孔、磷酸钙沉淀、直接显微注射等)将所述核酸载体引入宿主细胞中。宿主细胞可以是哺乳动物、细菌、真菌或昆虫起源。哺乳动物宿主细胞包括但不限于cho(或cho衍生的细胞株,例如cho-k1、cho-dxb11cho-dg44)、鼠宿主细胞(例如ns0、sp2/0)、very、hek(例如hek293)、bhk、hela、cos、mdck、293、3t3、w138、bt483、hs578t、htb2、bt20和t47d、crl7o3o和hss78bst细胞。还可以选择宿主细胞,其调节蛋白质构建体的表达,或以所需的特定方式修饰且加工蛋白质产物。不同的宿主细胞具有蛋白质产物的翻译后加工和修饰的特征和特异性机制。可以选择合适的细胞系或宿主系统,以确保表达的蛋白质的正确修饰和加工。为了从其相应的dna质粒构建体表达和分泌蛋白质产物,可以用通过本领域已知的适当表达控制元件控制的dna转染或转化宿主细胞,所述表达控制元件包括启动子、增强子、序列、转录终止子、多腺苷酸化位点和可选择标记物。用于表达治疗性蛋白质的方法是本领域已知的。参见例如,paulinabalbas,argelialorence(编辑)recombinantgeneexpression:reviewsandprotocols(methodsinmolecularbiology),humanapress;2004版本第2版(2004年7月20日);vladimirvoynov和justina.caravella(编辑)therapeuticproteins:methodsandprotocols(methodsinmolecularbiology)humanapress;2012版本第2版(2012年6月28日)。xi.无岩藻糖基化每个fc单体在asn297处包括n-糖基化位点。聚糖可以以多种不同形式存在于给定的fc单体上。在含有抗体或本文所述的抗原结合fc构建体的组合物中,聚糖可以是非常异质的,并且存在的聚糖的性质尤其取决于用于产生抗体或抗原结合fc构建体的细胞的类型、细胞的生长条件(包括生长培养基)和产生后纯化。在各种情况下,包含本文所述的构建体或多肽复合物或多肽的组合物被无岩藻糖基化至少某种程度。例如,至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%或95%存在于组合物中的聚糖(例如,fc聚糖)缺乏岩藻糖残基。因此,5%-60%、5%-50%、5%-40%、10%-50%、10%-50%、10%-40%、20%-50%或20%-40%的聚糖缺乏岩藻糖残基。可以通过在1,3,4-三-o-乙酰基-2-脱氧基-2-氟-l-岩藻糖抑制剂存在下培养产生抗体的细胞来产生无岩藻糖基化至少某种程度的组合物。可以使用多种其他方法来产生本文所述的构建体和多肽的相对无岩藻糖基化形式,包括:在fut8表达降低或不表达的细胞中表达(例如,通过敲除fut8或用rnai(sirna、mirna或shrna)降低表达),以及在过表达β-1,4-甘露糖基-糖蛋白4β-n-乙酰氨基葡萄糖转移酶(gnt-iii)的细胞中表达。xii.纯化可以通过蛋白质纯化领域中已知的任何方法来纯化fc-抗原结合结构域构建体,例如通过色谱法(例如,离子交换色谱法、亲和(例如,蛋白a亲和)色谱法和尺寸排阻柱色谱法)、离心、差异溶解度或通过用于蛋白质纯化的任何其他标准技术。例如,可以通过适当选择并组合亲和柱(诸如蛋白a柱)与色谱柱、过滤、超滤、盐析和透析程序来分离和纯化fc-抗原结合结构域构建体(参见例如,processscalepurificationofantibodies,uwegottschalk(编辑)johnwiley&sons,inc.,2009;以及subramanian(编辑)antibodies-volumei-productionandpurification,kluweracademic/plenumpublishers,newyork(2004))。在一些情况下,可以将fc-抗原结合结构域构建体缀合到一种或多种纯化肽,以促进从例如全细胞裂解产物混合物中纯化和分离fc-抗原结合结构域构建体。在一些实施方案中,纯化肽结合对纯化肽具有特异性亲和力的另一部分。在一些实施方案中,将与纯化肽特异性结合的此类部分附接到固体支持物,诸如基质、树脂或琼脂糖珠。可与fc-抗原结合结构域构建体连接的纯化肽的实例包括但不限于六组氨酸肽、flag肽、myc肽和血凝素(ha)肽。六组氨酸肽(hhhhhh(seqidno:38))以微摩尔亲和力结合镍功能化的琼脂糖亲和柱。在一些实施方案中,flag肽包括序列dykddddk(seqidno:39)。在一些实施方案中,flag肽包括串联的整数倍的序列dykddddk,例如3xdykddddk。在一些实施方案中,myc肽包括序列eqkliseedl(seqidno:40)。在一些实施方案中,myc肽包括串联的整数倍的序列eqkliseedl,例如3xeqkliseedl。在一些实施方案中,ha肽包括序列ypydvpdya(seqidno:41)。在一些实施方案中,ha肽包括串联的整数倍的序列ypydvpdya,例如3xypydvpdya。特异性识别并结合flag、myc或ha纯化肽的抗体是本领域众所周知的,并且通常可商购获得。用这些抗体功能化的固体支持物(例如,基质、树脂或琼脂糖珠)可用于纯化包括flag、myc或ha肽的fc-抗原结合结构域构建体。对于fc-抗原结合结构域构建体,可将蛋白a柱色谱法用作纯化过程。蛋白a配体通过fc区与fc-抗原结合结构域构建体相互作用,使得蛋白a色谱法成为能够去除大部分宿主细胞蛋白的高选择性捕获过程。在本公开中,可使用如实施例2中所述的蛋白a柱色谱法来纯化fc-抗原结合结构域构建体。xiii.药物组合物/制剂本公开的特征在于包括一种或多种本文所述的fc-抗原结合结构域构建体的药物组合物。在一个实施方案中,药物组合物包括在结构上相同或基本相同的基本上同质的fc-抗原结合结构域构建体群体。在各种实例中,药物组合物包括fc-抗原结合结构域构建体1-42中的任何一种的基本上同质的群体。可以将本公开的治疗性蛋白质构建体(例如,本文所述的fc-抗原结合结构域构建体(例如,具有三个fc结构域的fc-抗原结合结构域构建体))结合到药物组合物中。包括治疗性蛋白质的药物组合物可以通过本领域技术人员已知的方法进行配制。药物组合物可以以可注射制剂的形式肠胃外施用,所述可注射制剂包括在水或另一种药学可接受的液体中的无菌溶液或悬浮液。例如,药物组合物可以通过以下过程进行配制:将fc-抗原结合结构域构建体与药学可接受的媒介物或介质(诸如无菌注射用水(wfi)、生理盐水、乳化剂、悬浮剂、表面活性剂、稳定剂、稀释剂、粘合剂、赋形剂)适当组合,随后以普遍接受的药学实践所需的单位剂量形式混合。在药物制剂中包括的活性成分的量使得提供在指定范围内的合适剂量。用于注射的无菌组合物可以根据常规药学实践使用注射用蒸馏水作为媒介物进行配制。例如,生理盐水或含有葡萄糖和其他补充剂(诸如d-山梨糖醇、d-甘露糖、d-甘露糖醇和氯化钠)的等渗溶液可用作注射用水溶液,任选与本领域普遍已知的合适的增溶剂(例如,醇诸如乙醇和多元醇诸如丙二醇或聚乙二醇)和非离子表面活性剂(诸如聚山梨醇酯80tm、hco-50)等组合。用于治疗性蛋白质产物的配制方法是本领域已知的,参见例如banga(编辑)therapeuticpeptidesandproteins:formulation,processinganddeliverysystems(第2版)taylor&francisgroup,crcpress(2006)。xiv.使用方法和剂量本文所述的构建体靶向pdl-1,并且可以用于治疗用靶向pd-l1的抗体治疗的障碍。构建体可以用于治疗例如:黑素瘤、非小细胞肺癌、肾细胞癌、霍奇金淋巴瘤、脑癌、胃癌、膀胱癌、睾丸癌、头颈癌、小细胞肺癌、食道癌、非霍奇金淋巴瘤、胰腺癌、卵巢癌、血液癌、乳腺癌、结直肠癌、肉瘤、卵巢癌、前列腺癌、宫颈癌、多发性骨髓瘤、骨髓增生异常综合症、间皮瘤、急性髓性白血病、慢性淋巴细胞白血病、麦克尔细胞癌、各种实体瘤和弥漫性大b细胞淋巴瘤。药物组合物以与剂量制剂相容的方式施用,并且以治疗有效的量施用,以导致症状的改善或纠正。药物组合物以各种剂型施用,例如静脉内剂型、皮下剂型、经口剂型如可摄取溶液、药物释放胶囊等等。用于各个受试者的适当剂量取决于治疗目标、施用途径和患者的状况。一般地,重组蛋白以1-200mg/kg(例如1-100mg/kg,例如20-100mg/kg)给药。相应地,医疗保健提供者有必要根据需要定制且和滴定剂量且修改施用途径,以获得最佳疗效。除了治疗人类之外,构建体还可以用于治疗伴侣动物,诸如狗和猫以及其他兽医对象。xv.补体依赖性细胞毒性(cdc)本公开中描述的fc-抗原结合结构域构建体能够激活各种fc受体介导的效应子功能。免疫系统的一个组分是补体依赖性细胞毒性(cdc)系统,它是先天免疫系统的一部分,可增强抗体和吞噬细胞清除外源病原体的能力。三种生化途径激活补体系统:经典补体途径、替代补体途径和凝集素途径,这些途径都需要一组复杂的激活和信号级联。在经典补体途径中,igg或igm触发补体激活。c1q蛋白与抗原结合后与这些抗体结合,从而形成c1复合物。该复合物产生c1s酯酶,该酯酶将c4和c2蛋白裂解并激活为c4a和c4b以及c2a和c2b。然后,c2a和c4b片段形成称为c3转化酶的蛋白复合物,该蛋白复合物将c3裂解为c3a和c3b,从而使信号放大并形成膜攻击复合物。本公开的fc-抗原结合结构域构建体能够通过免疫系统增强cdc活性。可通过使用比色测定来评估cdc,在该比色测定中,将细胞(例如,raji细胞(atcc)或hek-pdl1)用连续稀释的抗体、fc-抗原结合结构域构建体或ivig包被。可以将人血清补体(quidel)以25%v/v添加到所有孔中,并且在37℃下温育2小时。在添加wst-1细胞增殖试剂(rocheappliedscience)后,可以将细胞在37℃下温育12小时。然后可以将板放置在振荡器上2分钟,并且可以测量450nm处的吸光度。xvi.抗体依赖性细胞介导的细胞毒性(adcc)本公开的fc-抗原结合结构域构建体还能够通过免疫系统增强抗体依赖性细胞介导的细胞毒性(adcc)活性。adcc是适应性免疫系统的一部分,在该系统中,抗体与外源病原体的表面抗原结合并靶向它们以致死亡。adcc涉及通过抗体激活自然杀伤(nk)细胞。nk细胞表达fc受体,这些受体与抗体(诸如igg和igm)的fc部分结合。当抗体与病原体感染的靶细胞表面结合后,它们随后会结合nk细胞并激活它们。nk细胞释放细胞因子(诸如ifn-γ)和蛋白质(诸如穿孔素和颗粒酶)。穿孔素是在钙存在下低聚的成孔溶细胞素。颗粒酶是在靶细胞中诱导程序性细胞死亡的丝氨酸蛋白酶。除nk细胞外,巨噬细胞、嗜中性粒细胞和嗜酸性粒细胞也可以介导adcc。可使用发光测定来评估adcc。将人原代nk效应细胞(hemacare)解冻,并使其在淋巴细胞生长培养基-3(lonza)中以5x105个/ml在37℃下静息过夜。第二天,收获人淋巴母细胞系raji靶细胞(atccccl-86)或a549细胞,将其重悬于测定培养基(无酚红rpmi,10%fbsδ,glutamaxtm)中,并在37℃下在各种浓度的每种目的探针存在下铺板30分钟。然后收获静息nk细胞,将其重悬于测定培养基中,并添加到含有抗cd20包被的raji细胞或抗pdl1包被的a549细胞的板中。将板在37℃下温育6小时,其中效应子与靶细胞的最终比例为5:1(5x104个nk细胞:1x104个raji)。使用cytotox-glotm细胞毒性测定试剂盒(promega)来确定adcc活性。cytotox-glotm测定使用发光肽底物来测量死细胞蛋白酶活性,该蛋白酶活性由已经丧失膜完整性的细胞(例如,裂解的raji或a549细胞)释放。温育6小时后,将制备的试剂(底物)添加到板的每个孔中,并在室温下置于定轨板振荡器上15分钟。使用pherastarf5读板仪(bmglabtech)测量发光。从测试条件中减去对照条件(仅nk细胞+raji/a549)的读数以消除背景后,分析数据。xvii.抗体依赖性细胞吞噬作用(adcp)本公开的fc-抗原结合结构域构建体还能够通过免疫系统增强抗体依赖性细胞吞噬作用(adcp)活性。adcp(也称为抗体调理作用)是吞噬细胞标记病原体摄入和清除的过程。吞噬细胞是通过摄入有害的外源病原体以及死亡或垂死的细胞来保护人体的细胞。该过程被病原体相关分子模式(pamps)激活,从而引起nf-κb激活。然后,调理素(诸如c3b)和抗体可以附着到目标病原体上。当靶标被调理素包被时,fc结构域经由其fc受体吸引吞噬细胞。然后吞噬细胞吞噬细胞,并且摄入物质的吞噬体与溶酶体融合。然后,随后的吞噬溶酶体蛋白水解消化细胞物质。可使用生物发光测定来评估adcp。抗体依赖性细胞介导的吞噬作用(adcp)是治疗性抗体的重要作用机制。adcp可以由单核细胞、巨噬细胞、嗜中性粒细胞和树突细胞经由fcγriia(cd32a)、fcγri(cd64)和fcγriiia(cd16a)介导。三种受体都可以参与抗体识别、免疫受体聚簇和导致adcp的信号事件;但是,阻断研究表明,fcγriia是参与该过程的主要fcγ受体。fcγriia-hadcp报告基因生物测定是一种基于生物发光细胞的测定,可以用于测量抗体和具有fc结构域(特异性结合和激活fcγriia)的其他生物制剂的效力和稳定性。该测定由表达高亲和力人fcγriia-h变体的遗传工程化jurkatt细胞系组成,该变体在氨基酸131处含有组氨酸(h)并且含有由nfat响应元件(nfat-re)驱动的荧光素酶报告基因。当与靶细胞和相关抗体共培养时,fcγriia-h效应细胞结合抗体的fc结构域,从而引起fcγriia信号传导和nfat-re介导的萤光素酶活性。检测生物发光信号并用荧光素酶测定和标准发光计进行定量。实施例提出以下实施例以向本领域普通技术人员提供完整的公开内容以及对如何执行、制备和评估本文所要求保护的方法和化合物的描述,并且这些实施例旨在仅是本公开的示例,并非旨在限制发明人视为其公开的内容的范围。实施例1.具有pd-l1结合结构域的fc-抗原结合结构域构建体7的设计和纯化蛋白质表达fc-抗原结合结构域构建体被设计成提高折叠效率,以最小化不受控制的亚基缔合(不受控制的亚基缔合可产生不需要的高分子量低聚体和多聚体),并产生基本上同质(例如,至少85%、90%、95%、98%或99%同质)的用于药物用途的组合物。考虑到这些目标,如下所述制备由其中分支点在n末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体7(pd-l1)各自包含两个不同的含fc结构域单体的多肽(抗pd-l1长fc链(seqidno:54)的两个拷贝以及短fc链(seqidno:63)的两个拷贝)和抗pd-l1轻链多肽(seqidno:49)的两个拷贝。长fc链包含fc结构域单体和n末端处的抗pd-l1vh和ch1结构域(eu位置1-220)(构建体7(pd-l1)),该fc结构域单体具有e357k电荷突变以及s354c和t366w突起形成突变(以促进异二聚化),并与电荷突变(k409d/d399k突变)fc结构域单体(以促进同二聚化)串联。短fc链包含具有k370d电荷突变和y349c、t366s、l368a和y407v空腔形成突变(以促进异二聚化)的fc结构域单体。也可以将抗pd-l1轻链表达为作为scfv的一部分与长fc链的n末端融合。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。表5中的氨基酸序列由三个单独的质粒(一个质粒编码轻链(抗pd-l1),一个质粒编码长fc链(抗pd-l1),并且一个质粒编码短fc链)编码。表5.构建体7(pd-l1)序列使用porosmabcapturea(lifetechnologies)柱,通过基于蛋白a的亲和柱色谱法从细胞培养上清液中纯化表达的蛋白质。将捕获的fc-抗原结合结构域构建体用磷酸盐缓冲盐水(低盐洗涤液)洗涤,并用100mm甘氨酸(ph3)洗脱。洗脱物通过加入1mtrisph7.4快速中和,并且通过0.2μm过滤器无菌过滤。使用porosxs树脂(appliedbiosciences),通过离子交换色谱法进一步分离蛋白质。用50mmmes(ph6,缓冲液a)预平衡柱,并且使用50mmmes、400mm氯化钠(ph6,缓冲液b)作为洗脱缓冲液,用步进梯度洗脱样品。在离子交换后,在切向流过滤系统上,使用10kda截止聚醚砜(pes)膜滤筒将目标级分缓冲交换到pbs缓冲液中。将样品浓缩至大约30mg/ml,并且通过0.2μm过滤器无菌过滤。非还原性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)将样品在95℃的laemmli样品缓冲液(4%sds,bio-rad)中变性10分钟。使样品在criteriontgx无染色凝胶(4-15%聚丙烯酰胺,bio-rad)上运行。通过uv照射或考马斯蓝染色对蛋白质条带进行可视化。通过chemidocmpimagingsystem(bio-rad)对凝胶进行成像。使用imagelab4.0.1软件(bio-rad)执行条带的定量。实施例2.具有pd-l1结合结构域的fc-抗原结合结构域构建体13的设计和纯化蛋白质表达如下所述制备由其中分支点在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体13(pd-l1)各自包含两个不同的含fc结构域单体的多肽(抗pd-l1长fc链(seqidno:58、59、60和65中的任一者)的两个拷贝以及短fc链(seqidno:63)的两个拷贝)和抗pd-l1轻链多肽(seqidno:49)的两个拷贝。长fc链包含电荷突变(k409d/d399k突变)fc结构域单体(以促进同二聚化)和n末端处的抗pd-l1vh和ch1结构域(eu位置1-220)(构建体13(pd-l1)),该fc结构域单体与具有e357k电荷突变以及s354c和t366w突起形成突变(以促进异二聚化)的fc结构域单体串联。短fc链包含具有k370d电荷突变和y349c、t366s、l368a和y407v空腔形成突变(以促进异二聚化)的fc结构域单体。也可以将pd-l1轻链表达为作为scfv的一部分与长fc链的n末端融合。可以用抗pd-l1重链制备构建体13的四个版本,其中每个版本在长fc链多肽的fc结构域单体之间携带不同大小的甘氨酸间隔物(g4、g10、g15或g20接头)。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。以下构建体中的每一个的氨基酸序列由三个单独的质粒(一个质粒编码轻链(抗pd-l1),一个质粒编码长fc链(抗pd-l1),并且一个质粒编码短fc链)编码:表6.构建体13(pd-l1)序列使用porosmabcapturea(lifetechnologies)柱,通过基于蛋白a的亲和柱色谱法从细胞培养上清液中纯化表达的蛋白质。将捕获的fc-抗原结合结构域构建体用磷酸盐缓冲盐水(低盐洗涤液)洗涤,并用100mm甘氨酸(ph3)洗脱。洗脱物通过加入1mtrisph7.4快速中和,并且通过0.2μm过滤器无菌过滤。使用porosxs树脂(appliedbiosciences),通过离子交换色谱法进一步分离蛋白质。用50mmmes(ph6,缓冲液a)预平衡柱,并且使用50mmmes、400mm氯化钠(ph6,缓冲液b)作为洗脱缓冲液,用步进梯度洗脱样品。在离子交换后,在切向流过滤系统上,使用10kda截止聚醚砜(pes)膜滤筒将目标级分缓冲交换到pbs缓冲液中。将样品浓缩至大约30mg/ml,并且通过0.2μm过滤器无菌过滤。非还原性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)将样品在95℃的laemmli样品缓冲液(4%sds,bio-rad)中变性10分钟。使样品在criteriontgx无染色凝胶(4-15%聚丙烯酰胺,bio-rad)上运行。通过uv照射或考马斯蓝染色对蛋白质条带进行可视化。通过chemidocmpimagingsystem(bio-rad)对凝胶进行成像。使用imagelab4.0.1软件(bio-rad)执行条带的定量。实施例3.fc-抗原结合结构域构建体1的设计和纯化如下所述制备由不对称串联fc结构域形成的无支链构建体。fc-抗原结合结构域构建体1(图1)包括两个不同的含fc结构域单体的多肽(长fc链以及短fc链的两个拷贝)以及一个轻链多肽。长fc链包含两个串联的fc结构域单体和n末端处的pd-l1结合结构域,其中每个fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)(以促进异二聚化)而产生的工程化突起。可将pd-l1结合结构域表达为与长fc链相同的氨基酸序列的一部分(例如,以形成scfv)。短fc链包含fc结构域单体,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的反向电荷突变(例如,k370d)(以促进异二聚化)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。在该实施例中,以及在fc-抗原结合结构域构建体2-42的以下每个实施例中,细胞可包含表达抗体可变轻链的第三质粒。使用porosmabcapturea(lifetechnologies)柱,通过基于蛋白a的亲和柱色谱法从细胞培养上清液中纯化表达的蛋白质。将捕获的fc-抗原结合结构域构建体用磷酸盐缓冲盐水(低盐洗涤液)洗涤,并用100mm甘氨酸(ph3)洗脱。洗脱物通过加入1mtrisph7.4快速中和,并且通过0.2μm过滤器无菌过滤。使用porosxs树脂(appliedbiosciences),通过离子交换色谱法进一步分离蛋白质。用50mmmes(ph6,缓冲液a)预平衡柱,并且使用50mmmes、400mm氯化钠(ph6,缓冲液b)作为洗脱缓冲液用步进梯度洗脱样品。在离子交换后,在切向流过滤系统上,使用10kda截止聚醚砜(pes)膜滤筒将目标级分缓冲交换到pbs缓冲液中。将样品浓缩至大约30mg/ml,并通过0.2μm过滤器进行无菌过滤。将样品在95℃的laemmli样品缓冲液(4%sds,bio-rad)中变性10分钟。使样品在criteriontgx无染色凝胶(4-15%聚丙烯酰胺,bio-rad)上运行。通过uv照射或考马斯蓝染色对蛋白质条带进行可视化。通过chemidocmpimagingsystem(bio-rad)对凝胶进行成像。使用imagelab4.0.1软件(bio-rad)执行条带的定量。实施例4.fc-抗原结合结构域构建体2的设计和纯化如下所述制备由不对称串联fc结构域形成的无支链构建体。fc-抗原结合结构域构建体2(图2)包括两个不同的含fc单体的多肽(长fc链以及短fc链的三个拷贝)以及一个轻链多肽。长fc链包含三个与n末端处的pd-l1结合结构域串联的fc结构域单体,其中每个fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起。短fc链包含fc结构域单体,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例5.fc-抗原结合结构域构建体3的设计和纯化如下所述制备由不对称串联fc结构域形成的构建体。fc-抗原结合结构域构建体3(图3)包括两个不同的含fc单体的多肽(长fc链以及短fc链的两个拷贝)以及一个轻链多肽。长fc链包含两个串联的fc结构域单体,其中每个fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例6.fc-抗原结合结构域构建体4的设计和纯化如下所述制备由不对称串联fc结构域形成的构建体。fc-抗原结合结构域构建体4(图4)包括两个不同的含fc单体的多肽(长fc链以及短fc链的三个拷贝)以及一个轻链多肽。长fc链包含三个串联的fc结构域单体,其中每个fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例7.fc-抗原结合结构域构建体5的设计和纯化如下所述制备由不对称串联fc结构域形成的构建体。fc-抗原结合结构域构建体5(图5)包括两个不同的含fc单体的多肽(长fc链以及短fc链的两个拷贝)以及一个轻链多肽。长fc链包含两个与n末端处的pd-l1结合结构域串联的fc结构域单体,其中每个fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例8.fc-抗原结合结构域构建体6的设计和纯化如下所述制备由不对称串联fc结构域形成的构建体。fc-抗原结合结构域构建体6(图6)包括两个不同的含fc单体的多肽(长fc链以及短fc链的三个拷贝)以及一个轻链多肽。长fc链包含三个与n末端处的pd-l1结合结构域串联的fc结构域单体,其中每个fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例9.fc-抗原结合结构域构建体7的设计和纯化如下所述制备由其中分支点在n末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体7(图7)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的两个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起,并与具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变)的fc结构域单体串联。短fc链包含fc结构域单体,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例10.fc-抗原结合结构域构建体8的设计和纯化如下所述制备由其中分支点在n末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体8(图8)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的两个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体,该fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起,并与具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变)的fc结构域单体串联。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例11.fc-抗原结合结构域构建体9的设计和纯化如下所述制备由其中分支点在n末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体9(图9)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的两个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起,并与具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变)的fc结构域单体串联。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例12.fc-抗原结合结构域构建体10的设计和纯化如下所述制备由其中分支点在n末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体10(图10)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的四个拷贝)以及一个轻链多肽。长fc链包含两个串联的fc结构域单体和n末端处的pd-l1结合结构域,其中每个fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起,并与具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变)的fc结构域单体串联。短fc链包含fc结构域单体,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例13.fc-抗原结合结构域构建体11的设计和纯化如下所述制备由其中分支点在n末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体11(图11)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的四个拷贝)以及一个轻链多肽。长fc链包含两个串联的fc结构域单体,其中每个fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起,并在n末端与具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变)的fc结构域单体串联。短fc链包含fc结构域单体和n末端处的抗原结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例14.fc-抗原结合结构域构建体12的设计和纯化如下所述制备由其中分支点在n末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体12(图12)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的四个拷贝)以及一个轻链多肽。长fc链包含两个串联的fc结构域单体和n末端处的pd-l1结合结构域,其中每个fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起,并与具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变)的fc结构域单体串联。短fc链包含fc结构域单体和n末端处的抗原结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例15.fc-抗原结合结构域构建体13的设计和纯化如下所述制备由其中分支点在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体13(图13)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的两个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变),并与具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起的fc结构域单体串联。短fc链包含fc结构域单体,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例16.fc-抗原结合结构域构建体14的设计和纯化如下所述制备由其中分支点在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体14(图14)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的两个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体,该fc结构域单体具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变),并在n末端与具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起的fc结构域单体串联。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例17.fc-抗原结合结构域构建体15的设计和纯化如下所述制备由其中分支点在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体15(图15)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的两个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变),并与具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起的fc结构域单体串联。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例18.fc-抗原结合结构域构建体16的设计和纯化如下所述制备由其中分支点在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体16(图16)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的四个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变),并与各自具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起的两个fc结构域单体串联。短fc链包含fc结构域单体,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例19.fc-抗原结合结构域构建体17的设计和纯化如下所述制备由其中分支点在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体17(图17)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的四个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体,该fc结构域单体具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变),并在n末端与各自具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起的两个fc结构域单体串联。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例20.fc-抗原结合结构域构建体18的设计和纯化如下所述制备由其中分支点在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体18(图18)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的四个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变),并与各自具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起的两个fc结构域单体串联。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例21.fc-抗原结合结构域构建体19的设计和纯化如下所述制备由其中分支点既不在n末端也不在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体19(图19)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的四个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起,并与具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变)的fc结构域单体和具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起的另一个fc结构域单体串联。短fc链包含fc结构域单体,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例22.fc-抗原结合结构域构建体20的设计和纯化如下所述制备由其中分支点在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体20(图20)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的四个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体,该fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起,并在n末端与具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变)的fc结构域单体和具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起的另一个fc结构域单体串联。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例23.fc-抗原结合结构域构建体21的设计和纯化如下所述制备由其中分支点在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体21(图21)包括两个不同的含fc单体的多肽(长fc链的两个拷贝以及短fc链的四个拷贝)以及一个轻链多肽。长fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起,并与具有选自表4a和表4b的反向电荷突变(例如,k409d/d399k突变)的fc结构域单体、具有通过引入选自表3的至少一个突起形成突变(例如,s354c和t366w突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,e357k)而产生的工程化突起的另一个fc结构域单体串联。短fc链包含fc结构域单体和n末端处的pd-l1结合结构域,该fc结构域单体具有通过引入选自表3的至少一个空腔形成突变(例如,y349c、t366s、l368a和y407v突变)以及任选的选自表4a和表4b的一个或多个反向电荷突变(例如,k370d)而产生的工程化空腔。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。短fc链和长fc链的氨基酸序列由两个单独的质粒编码。按实施例3纯化表达的蛋白质。实施例24.fc-抗原结合结构域构建体对cdc、adcp和adcc的激活使用三种测定来测试亲本mab和各种fc-抗原结合结构域构建体对cdc、adcp和adcc途径的激活。创建了四个构建体,它们包含来自gazyva(奥滨尤妥珠单抗)(抗cd20单克隆抗体)的cdr。制备了岩藻糖基化和无岩藻糖基化mab以及s3y(实施例2中所述的构建体13的结构,图13)和sai(实施例1中所述的构建体7的结构,图7)fc-抗原结合结构域构建体。cdc测定如下进行:1.抗cd20cdc测定中使用的靶细胞是raji淋巴母细胞人b细胞系(atccccl-86)。通过离心从悬浮培养物中除去raji细胞,并将其以6x105个细胞/ml重悬于x-vivo15培养基中。2.将raji细胞以每孔100μl的体积(6x104个细胞/孔)转移到96孔平底测定板中。3.将每种抗cd20单克隆抗体(mab)和sif抗体在x-vivo15培养基中稀释至3.33μm。然后在1.5ml聚丙烯管中分别用抗cd20mab和sif抗体进行1:3连续稀释,得到11点稀释系列。4.将抗cd20mab和sif抗体的每种稀释液以50μl/孔转移到测定板上的适当孔中。5.转移抗cd20mab和sif抗体后,立即将50μl正常人血清补体转移到测定板的每个孔中。6.将测定板在37℃和5%co2下温育2小时。7.温育2小时后,将20μl的wst-1增殖试剂添加到测定板的每个孔中。8.将该板放回到37℃、5%co2的温育箱保持14小时。9.温育14小时后,将板在板振荡器上振荡1分钟,并立即使用分光光度计以600nm校正在450nm处测定孔的吸光度。在靶细胞为raji的cdc测定中(图47,左图),s3y(构建体13(cd20))构建体能够介导细胞毒性,而其他构建体则不能。adcp测定如下进行:fcγriia-hadcp报告基因生物测定完整试剂盒(promega,目录号g9901)是一种基于生物发光细胞的测定,可以用于测量抗体和具有fc结构域(特异性结合和激活fcγriia)的其他生物制剂的效力和稳定性。该测定由表达高亲和力人fcgriia-h变体的遗传工程化jurkatt细胞系组成,该变体在氨基酸131处含有组氨酸(h)并且含有由nfat响应元件(nfat-re)驱动的荧光素酶报告基因。当与靶细胞和相关抗体共培养时,fcγriia-h效应细胞结合抗体的fc结构域,从而引起fcγriia信号传导和nfat-re介导的萤光素酶活性。使用bio-glotm荧光素酶测定系统和标准发光计检测并定量生物发光信号。在图47中图中指定的浓度下将递增浓度的抗cd20ab和构建体7(cd20)或构建体13(cd20)与raji(cd20+)靶细胞和fc一起温育,将递增浓度的抗cd20ab和构建体与raji(cd20+)靶细胞和fcγriia-h效应细胞(2:1e:t比;大约35,000个效应子:15,000个靶细胞)一起温育。在37℃下温育6小时。添加bio-glotm试剂,并在pherastarfs仪器中测量发光。使用graphpadprism软件riia-h效应细胞(2:1e:t比;大约35,000个效应子:15,000个靶细胞)在图47中图中指定的浓度下将数据拟合为4pl曲线。在37℃下温育6小时。添加bio-glotm试剂,并在pherastarfs仪器中测量发光。使用graphpadprism软件将数据拟合为4pl曲线(图47,中图)。sai(构建体7(cd20))和s3y(构建体13(cd20))构建体均显示出相对于mab增强>100倍的效力。adcc测定如下进行:将人原代nk效应细胞(hemacare)解冻,并使其在淋巴细胞生长培养基-3(lonza)中以5x105个/ml在37℃下静息过夜。第二天,收获人淋巴母细胞系raji靶细胞(atccccl-86),将其重悬于测定培养基(无酚红rpmi,10%fbsδ,glutamaxtm)中,并在37℃下在各种浓度的每种目的探针存在下铺板30分钟。然后收获静息nk细胞,将其重悬于测定培养基中,并添加到含有抗cd20包被的raji细胞的板中。将板在37℃下温育6小时,其中效应子与靶细胞的最终比例为5:1(5x104个nk细胞:1x104个raji)。使用cytotox-glotm细胞毒性测定试剂盒(promega)来确定adcc活性。cytotox-glotm测定使用发光肽底物来测量死细胞蛋白酶活性,该蛋白酶活性由已经丧失膜完整性的细胞(例如,裂解的raji细胞)释放。温育6小时后,将制备的试剂(底物)添加到板的每个孔中,并在室温下置于定轨板振荡器上15分钟。使用pherastarf5读板仪(bmglabtech)测量发光。从测试条件中减去对照条件(仅nk细胞+raji)的读数以消除背景后,分析数据(图47,右图)。sai(构建体7(cd20))和s3y(构建体13(cd20))构建体均显示出相对于岩藻糖基化mab增强的细胞毒性,以及相对于无岩藻糖基化mab相似的细胞毒性。使用基于抗体的构建体进行了一组相似的测定。创建了四个构建体,它们包含来自抗pd-l1单克隆抗体的cdr。制备了岩藻糖基化和无岩藻糖基化mab以及s3y(构建体13(pd-l1))和sai(构建体7(pd-l1))fc-抗原结合结构域构建体。使用pd-l1转染的hek靶细胞测定adcc(图23,左图)。sai(构建体7(pd-l1))和s3y(构建体13(pd-l1))构建体均显示出与岩藻糖基化和无岩藻糖基化mab相似的细胞毒性。用靶向pd-l1转染的hek细胞的测定法测试了adcp激活(图23,中图)。sai(构建体7(pd-l1))和s3y(构建体13(pd-l1))构建体均激活了吞噬作用,而mab均未激活。在靶向pd-l1转染的hek细胞的cdc测定中(图23,右图),s3y(构建体13(pd-l1))构建体能够介导细胞毒性,而其他构建体则不能。实施例25.用于表征fc-抗原结合结构域构建体的实验测定肽和糖肽液相色谱-ms/ms将蛋白质在6m胍(sigma)中稀释至1μg/μl。添加二硫苏糖醇(dtt),使浓度为10mm,以在65℃的变性条件下还原二硫键30分钟。在冰上冷却后,将样品与30mm碘乙酰胺(iam)一起在黑暗中温育1小时,以使游离硫醇烷基化(氨甲酰甲基化)。然后将蛋白质通过10-kda膜透析到25mm碳酸氢铵缓冲液(ph7.8)中,以除去iam、dtt和胍。在barocycler(nep2320;pressurebiosciences,inc.)中用胰蛋白酶消化蛋白质。使压力在37℃下在20,000psi与环境压力之间循环,1小时内总共进行30次循环。在ultimate3000(dionex)色谱系统和q-exactive(thermofisherscientific)质谱仪上进行肽的lc-ms/ms分析。使用0.1%fa的水溶液和0.1%fa的乙腈溶液作为流动相,在behpepmap(waters)柱上分离肽。基于双重荷电离子(z=2)m/z842.5与±1.5da的四极分离宽度,靶向单个木糖基化的接头肽。完整的质谱分析在由78.98%水、20%乙腈、1%甲酸(fa)和0.02%三氟乙酸组成的运行缓冲液中将蛋白质稀释至2μg/μl的浓度。尺寸排阻层析分离在串联的两个zenix-csec-300(sepaxtechnologies,newark,de)2.1×350mm上执行,总柱长度为700mm。使用上述运行缓冲液以80μl/min的流速从sec柱中洗脱蛋白质。在以正模式操作的qstarelite(appliedbiosystems)q-tof质谱仪上获得质谱。通过对跨越层析峰的整个宽度的光谱求和,使用贝叶斯峰解卷积,将在各个尺寸级分下的中性质量解卷积。毛细管电泳-十二烷基硫酸钠(ce-sds)测定将样品稀释至1mg/ml,并与htproteinexpress变性缓冲液(perkinelmer)混合。将混合物在40℃下温育20分钟。将样品用70μl水稀释且转移至96孔板。通过配备有htproteinexpresslabchip(perkinelmer)的calipergxii仪器(perkinelmer)分析样品。使用荧光强度来计算每种尺寸变体的相对丰度。非还原性sds-page将样品在95℃的laemmli样品缓冲液(4%sds,bio-rad)中变性10分钟。使样品在criteriontgx无染色凝胶(4-15%聚丙烯酰胺,bio-rad)上运行。通过uv照射或考马斯蓝染色对蛋白质条带进行可视化。通过chemidocmpimagingsystem(bio-rad)对凝胶进行成像。使用imagelab4.0.1软件(bio-rad)执行条带的定量。实施例26.具有pd-l1结合结构域的fc-抗原结合结构域构建体4的设计和纯化蛋白质表达如下所述制备由不对称串联fc结构域形成的构建体。fc-抗原结合结构域构建体4(pd-l1)各自包括两个不同的含fc结构域单体的多肽(长fc链(seqidno:66),以及抗pd-l1fc链(seqidno:68)的三个拷贝)和抗pd-l1轻链多肽(seqidno:49)的三个拷贝。长fc链包含三个串联的fc结构域单体,其中每个fc结构域单体具有e357k电荷突变以及s354c和t366w突起形成突变(以促进异二聚化)。短fc链包含具有k370d电荷突变和y349c、t366s、l368a和y407v空腔形成突变(以促进异二聚化)的fc结构域单体,以及n末端处的抗pd-l1vh和ch1结构域(eu位置1-220)(构建体4(pd-l1))。也可以将pd-l1轻链表达为作为scfv的一部分与短fc链的n末端融合。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。表7中每个构建体的以下氨基酸序列由三个单独的质粒(一个质粒编码轻链(抗pd-l1),一个质粒编码长fc链,并且一个质粒编码短fc链(抗pd-l1))编码:表7.构建体4(pd-l1)序列使用porosmabcapturea(lifetechnologies)柱,通过基于蛋白a的亲和柱色谱法从细胞培养上清液中纯化表达的蛋白质。将捕获的fc-抗原结合结构域构建体用磷酸盐缓冲盐水(低盐洗涤液)洗涤,并用100mm甘氨酸(ph3)洗脱。洗脱物通过加入1mtrisph7.4快速中和,并且通过0.2μm过滤器无菌过滤。使用porosxs树脂(appliedbiosciences),通过离子交换色谱法进一步分离蛋白质。用50mmmes(ph6,缓冲液a)预平衡柱,并且使用50mmmes、400mm氯化钠(ph6,缓冲液b)作为洗脱缓冲液,用步进梯度洗脱样品。在离子交换后,在切向流过滤系统上,使用10kda截止聚醚砜(pes)膜滤筒将目标级分缓冲交换到pbs缓冲液中。将样品浓缩至大约30mg/ml,并且通过0.2μm过滤器无菌过滤。非还原性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)将样品在95℃的laemmli样品缓冲液(4%sds,bio-rad)中变性10分钟。使样品在criteriontgx无染色凝胶(4-15%聚丙烯酰胺,bio-rad)上运行。通过uv照射或考马斯蓝染色对蛋白质条带进行可视化。通过chemidocmpimagingsystem(bio-rad)对凝胶进行成像。使用imagelab4.0.1软件(bio-rad)执行条带的定量。实施例27.具有pd-l1结合结构域的fc-抗原结合结构域构建体8的设计和纯化蛋白质表达如下所述制备由其中分支点在n末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体8(pd-l1)各自包括两个不同的含fc结构域单体的多肽(长fc链(seqidno:69)的两个拷贝以及抗pd-l1短fc链(seqidno:68)的两个拷贝)和抗pd-l1轻链多肽(seqidno:49)的拷贝。长fc链包含具有e357k电荷突变以及s354c和t366w突起形成突变(以促进异二聚化)并与具有反向电荷突变k409d和d399k(以促进同二聚化)的fc结构域单体串联的fc结构域单体。短fc链包含具有k370d电荷突变和y349c、t366s、l368a和y407v空腔形成突变(以促进异二聚化)的fc结构域单体,以及n末端处的抗pd-l1vh和ch1结构域(eu位置1-220)(构建体8(pd-l1))。也可以将pd-l1轻链表达为作为scfv的一部分与短fc链的n末端融合。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。表8中每个构建体的以下氨基酸序列由三个单独的质粒(一个质粒编码轻链(抗pd-l1),一个质粒编码长fc链,并且一个质粒编码短fc链(抗pd-l1))编码:表8.构建体8(pd-l1)序列使用porosmabcapturea(lifetechnologies)柱,通过基于蛋白a的亲和柱色谱法从细胞培养上清液中纯化表达的蛋白质。将捕获的fc-抗原结合结构域构建体用磷酸盐缓冲盐水(低盐洗涤液)洗涤,并用100mm甘氨酸(ph3)洗脱。洗脱物通过加入1mtrisph7.4快速中和,并且通过0.2μm过滤器无菌过滤。使用porosxs树脂(appliedbiosciences),通过离子交换色谱法进一步分离蛋白质。用50mmmes(ph6,缓冲液a)预平衡柱,并且使用50mmmes、400mm氯化钠(ph6,缓冲液b)作为洗脱缓冲液,用步进梯度洗脱样品。在离子交换后,在切向流过滤系统上,使用10kda截止聚醚砜(pes)膜滤筒将目标级分缓冲交换到pbs缓冲液中。将样品浓缩至大约30mg/ml,并且通过0.2μm过滤器无菌过滤。非还原性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)将样品在95℃的laemmli样品缓冲液(4%sds,bio-rad)中变性10分钟。使样品在criteriontgx无染色凝胶(4-15%聚丙烯酰胺,bio-rad)上运行。通过uv照射或考马斯蓝染色对蛋白质条带进行可视化。通过chemidocmpimagingsystem(bio-rad)对凝胶进行成像。使用imagelab4.0.1软件(bio-rad)执行条带的定量。实施例28.具有pd-l1pd-l1结合结构域的fc-抗原结合结构域构建体9的设计和纯化蛋白质表达如下所述制备由其中分支点在n末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体9(pd-l1)包括两个不同的含fc结构域单体的多肽(抗pd-l1长fc链(seqidno:54)的两个拷贝以及抗pd-l1短fc链(seqidno:68)的两个拷贝)和抗pd-l1轻链多肽(seqidno:49)的拷贝。长fc链包含fc结构域单体和n末端处的抗pd-l1vh和ch1结构域(eu位置1-220)(构建体9(pd-l1)),该fc结构域单体具有e357k电荷突变以及s354c和t366w突起形成突变(以促进异二聚化),并与具有反向电荷突变k409d和d399k(以促进同二聚化)的fc结构域单体串联。短fc链包含具有k370d电荷突变和y349c、t366s、l368a和y407v空腔形成突变(以促进异二聚化)的fc结构域单体,以及n末端处的抗pd-l1重链(构建体9(pd-l1))。也可以将pd-l1轻链表达为作为scfv的一部分与长fc链和/或短fc链的n末端融合。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。表9中每个构建体的以下氨基酸序列由三个单独的质粒(一个质粒编码轻链(抗pd-l1),一个质粒编码长fc链(抗pd-l1),并且一个质粒编码短fc链(抗pd-l1))编码:表9.构建体9(pd-l1)序列使用porosmabcapturea(lifetechnologies)柱,通过基于蛋白a的亲和柱色谱法从细胞培养上清液中纯化表达的蛋白质。将捕获的fc-抗原结合结构域构建体用磷酸盐缓冲盐水(低盐洗涤液)洗涤,并用100mm甘氨酸(ph3)洗脱。洗脱物通过加入1mtrisph7.4快速中和,并且通过0.2μm过滤器无菌过滤。使用porosxs树脂(appliedbiosciences),通过离子交换色谱法进一步分离蛋白质。用50mmmes(ph6,缓冲液a)预平衡柱,并且使用50mmmes、400mm氯化钠(ph6,缓冲液b)作为洗脱缓冲液,用步进梯度洗脱样品。在离子交换后,在切向流过滤系统上,使用10kda截止聚醚砜(pes)膜滤筒将目标级分缓冲交换到pbs缓冲液中。将样品浓缩至大约30mg/ml,并且通过0.2μm过滤器无菌过滤。非还原性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)将样品在95℃的laemmli样品缓冲液(4%sds,bio-rad)中变性10分钟。使样品在criteriontgx无染色凝胶(4-15%聚丙烯酰胺,bio-rad)上运行。通过uv照射或考马斯蓝染色对蛋白质条带进行可视化。通过chemidocmpimagingsystem(bio-rad)对凝胶进行成像。使用imagelab4.0.1软件(bio-rad)执行条带的定量。实施例29.具有pd-l1结合结构域的fc-抗原结合结构域构建体10的设计和纯化蛋白质表达如下所述制备由其中分支点在n末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体10(pd-l1)各自分别包括两个不同的含fc结构域单体的多肽(抗pd-l1长fc链(seqidno:71)的两个拷贝以及短fc链(seqidno:63)的四个拷贝)和抗pd-l1轻链多肽(seqidno:49)的拷贝。长fc链包含两个串联的fc结构域单体和n末端处的抗pd-l1vh和ch1结构域(eu位置1-220)(构建体10(pd-l1)),其中每个fc结构域单体具有e357k电荷突变以及s354c和t366w突起形成突变(以促进异二聚化),并与具有反向电荷突变k409d和d399k(以促进同二聚化)的fc结构域单体串联。短fc链包含具有k370d电荷突变和y349c、t366s、l368a和y407v空腔形成突变(以促进异二聚化)的fc结构域单体。也可以将抗pd-l1轻链表达为作为scfv的一部分与长fc链的n末端融合。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。表10中每个构建体的以下氨基酸序列由三个单独的质粒(一个质粒编码轻链(抗pd-l1),一个质粒编码长fc链(抗pd-l1),并且一个质粒编码短fc链)编码:表10.构建体10(pd-l1)序列使用porosmabcapturea(lifetechnologies)柱,通过基于蛋白a的亲和柱色谱法从细胞培养上清液中纯化表达的蛋白质。将捕获的fc-抗原结合结构域构建体用磷酸盐缓冲盐水(低盐洗涤液)洗涤,并用100mm甘氨酸(ph3)洗脱。洗脱物通过加入1mtrisph7.4快速中和,并且通过0.2μm过滤器无菌过滤。使用porosxs树脂(appliedbiosciences),通过离子交换色谱法进一步分离蛋白质。用50mmmes(ph6,缓冲液a)预平衡柱,并且使用50mmmes、400mm氯化钠(ph6,缓冲液b)作为洗脱缓冲液,用步进梯度洗脱样品。在离子交换后,在切向流过滤系统上,使用10kda截止聚醚砜(pes)膜滤筒将目标级分缓冲交换到pbs缓冲液中。将样品浓缩至大约30mg/ml,并且通过0.2μm过滤器无菌过滤。非还原性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)将样品在95℃的laemmli样品缓冲液(4%sds,bio-rad)中变性10分钟。使样品在criteriontgx无染色凝胶(4-15%聚丙烯酰胺,bio-rad)上运行。通过uv照射或考马斯蓝染色对蛋白质条带进行可视化。通过chemidocmpimagingsystem(bio-rad)对凝胶进行成像。使用imagelab4.0.1软件(bio-rad)执行条带的定量。实施例30.具有pd-l1结合结构域的fc-抗原结合结构域构建体16的设计和纯化蛋白质表达如下所述制备由其中分支点在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体16(pd-l1)各自分别包括两个不同的含fc结构域单体的多肽(抗pd-l1长fc链(seqidno:73)的两个拷贝以及短fc链(seqidno:63)的四个拷贝)和抗pd-l1轻链多肽(seqidno:49)的三个拷贝。长fc链包含具有反向电荷突变k409d和d399k(以促进同二聚化)的fc结构域单体和n末端处的抗pd-l1vh和ch1结构域(eu位置1-220)(构建体10(pd-l1)),该fc结构域单体与各自具有e357k电荷突变以及s354c和t366w突起形成突变(以促进异二聚化)的两个串联的fc结构域单体串联。短fc链包含具有k370d电荷突变和y349c、t366s、l368a和y407v空腔形成突变(以促进异二聚化)的fc结构域单体。也可以将抗pd-l1轻链表达为作为scfv的一部分与长fc链的n末端融合。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。表11中每个构建体的以下氨基酸序列由三个单独的质粒(一个质粒编码轻链(抗pd-l1),一个质粒编码长fc链(抗pd-l1),并且一个质粒编码短fc链)编码:表11.构建体16(pd-l1)序列使用porosmabcapturea(lifetechnologies)柱,通过基于蛋白a的亲和柱色谱法从细胞培养上清液中纯化表达的蛋白质。将捕获的fc-抗原结合结构域构建体用磷酸盐缓冲盐水(低盐洗涤液)洗涤,并用100mm甘氨酸(ph3)洗脱。洗脱物通过加入1mtrisph7.4快速中和,并且通过0.2μm过滤器无菌过滤。使用porosxs树脂(appliedbiosciences),通过离子交换色谱法进一步分离蛋白质。用50mmmes(ph6,缓冲液a)预平衡柱,并且使用50mmmes、400mm氯化钠(ph6,缓冲液b)作为洗脱缓冲液,用步进梯度洗脱样品。在离子交换后,在切向流过滤系统上,使用10kda截止聚醚砜(pes)膜滤筒将目标级分缓冲交换到pbs缓冲液中。将样品浓缩至大约30mg/ml,并且通过0.2μm过滤器无菌过滤。非还原性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)将样品在95℃的laemmli样品缓冲液(4%sds,bio-rad)中变性10分钟。使样品在criteriontgx无染色凝胶(4-15%聚丙烯酰胺,bio-rad)上运行。通过uv照射或考马斯蓝染色对蛋白质条带进行可视化。通过chemidocmpimagingsystem(bio-rad)对凝胶进行成像。使用imagelab4.0.1软件(bio-rad)执行条带的定量。实施例31.具有pd-l1结合结构域的fc-抗原结合结构域构建体19的设计和纯化蛋白质表达如下所述制备由其中分支点既不在n末端也不在c末端fc结构域的单分支fc结构域形成的构建体。fc-抗原结合结构域构建体19(pd-l1)分别包括两个不同的含fc结构域单体的多肽(抗pd-l1长fc链(seqidno:75)的两个拷贝以及短fc链(seqidno:63)的四个拷贝)和抗pd-l1轻链多肽(seqidno:49)的拷贝。长fc链包含fc结构域单体和n末端处的抗pd-l1vh和ch1结构域(eu位置1-220)(构建体19(pd-l1)),该fc结构域单体具有e357k电荷突变以及s354c和t366w突起形成突变(以促进异二聚化),并与具有反向电荷突变k409d和d399k(以促进同二聚化)的fc结构域单体串联,并与具有e357k电荷突变以及s354c和t366w突起形成突变(以促进异二聚化)的fc结构域单体串联。短fc链包含具有k370d电荷突变和y349c、t366s、l368a和y407v空腔形成突变(以促进异二聚化)的fc结构域单体。也可以将抗pd-l1轻链表达为作为scfv的一部分与长fc链的n末端融合。将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。表12中每个构建体的以下氨基酸序列由三个单独的质粒(一个质粒编码轻链(抗pd-l1),一个质粒编码长fc链(抗pd-l1),并且一个质粒编码短fc链)编码:表12.构建体19(pd-l1)序列使用porosmabcapturea(lifetechnologies)柱,通过基于蛋白a的亲和柱色谱法从细胞培养上清液中纯化表达的蛋白质。将捕获的fc-抗原结合结构域构建体用磷酸盐缓冲盐水(低盐洗涤液)洗涤,并用100mm甘氨酸(ph3)洗脱。洗脱物通过加入1mtrisph7.4快速中和,并且通过0.2μm过滤器无菌过滤。使用porosxs树脂(appliedbiosciences),通过离子交换色谱法进一步分离蛋白质。用50mmmes(ph6,缓冲液a)预平衡柱,并且使用50mmmes、400mm氯化钠(ph6,缓冲液b)作为洗脱缓冲液,用步进梯度洗脱样品。在离子交换后,在切向流过滤系统上,使用10kda截止聚醚砜(pes)膜滤筒将目标级分缓冲交换到pbs缓冲液中。将样品浓缩至大约30mg/ml,并且通过0.2μm过滤器无菌过滤。非还原性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)将样品在95℃的laemmli样品缓冲液(4%sds,bio-rad)中变性10分钟。使样品在criteriontgx无染色凝胶(4-15%聚丙烯酰胺,bio-rad)上运行。通过uv照射或考马斯蓝染色对蛋白质条带进行可视化。通过chemidocmpimagingsystem(bio-rad)对凝胶进行成像。使用imagelab4.0.1软件(bio-rad)执行条带的定量。实施例32.抗pd-l1fc构建体对补体依赖性细胞毒性(cdc)的激活开发cdc测定以测试抗pd-l1fc构建体相对于抗pd-l1单克隆抗体阿维鲁单抗增强cdc活性的程度。如实施例1、2和51-56中所述产生具有阿维鲁单抗的cdr的抗pd-l1fc构建体7、8、10、13和19。创建了构建体13(pd-l1)的四个版本,这些版本仅在长链的长链fc单体之间的甘氨酸间隔物(g4、g10、g15和g20接头)的大小上有变化。在如下进行的cdc测定中测试每个抗pd-l1fc构建体和阿维鲁单抗单克隆抗体:将转染以稳定表达人pd-l1基因的人胚肾(hek)细胞系(crownbio)在dmem、10%fbs和2μg/ml嘌呤霉素(作为选择标记)中培养。收获细胞并将其在不含基因泰克汀(genetecin)或酚红(lonza)的x-vivo-15培养基中稀释。将100μl6x105个细胞/ml的hek-pd-l1细胞铺在96孔组织培养处理的平底板(bdfalcon)中。将fc构建体和抗体在x-vivo-15培养基中按以1:3连续稀释。将50μl稀释的构建体添加到孔中靶细胞的顶部。将50μl未稀释的人血清补体(quidelcorporation)添加到每个孔中。然后将测定板在37℃下温育2小时。温育2小时后,将20μlwst-1细胞增殖试剂(rochediagnosticscorp)添加到每个孔中,并在37℃下温育过夜。第二天早上,将测定板放置在板振荡器上2-5分钟。在分光光度计(moleculardevicesspectramaxm2)上以600nm校正在450nm处测定吸光度。确定每种构建体的ec50(nm)。如表13中所示,一些抗pd-l1fc构建体在表达人pd-l1的hek细胞中诱导cdc。表13.抗pd-l1fc构建体在表达pd-l1的hek细胞中诱导cdc的效力1除非另有说明,否则所有构建体都包括g20接头。2构建体包含自发e388d突变。3构建体在测定条件下未产生可测量的cdc。表达人pd-l1的hek细胞中的cdc将转染以稳定表达人pd-l1基因的人胚肾(hek)细胞(crownbio)在dmem、10%fbs和2μg/ml嘌呤霉素(作为选择标记)中培养。收获细胞并将其在不含基因泰克汀(genetecin)或酚红(lonza)的x-vivo-15培养基中稀释。将100μl6x10^5个细胞/ml的hek-pd-l1细胞铺在96孔组织培养处理的平底板(bdfalcon)中。将构建体和抗体在x-vivo-15培养基中按以1:3连续稀释。将50μl稀释的构建体添加到孔中靶细胞的顶部。将50μl未稀释的人血清补体(quidelcorporation)添加到每个孔中。然后将测定板在37℃下温育2小时。温育2小时后,将20μl的wst-1细胞增殖试剂(rochediagnosticscorp)添加到每个孔中,并在37℃下温育过夜。第二天早上,将测定板放置在板振荡器上2-5分钟。在分光光度计(moleculardevicesspectramaxm2)上以600nm校正在450nm处测定吸光度。图27示出了用抗pd-l1构建体处理的pd-l1转染的hek细胞的cdc测定的结果。s3y构建体显示出显著的cdc活性,而阿维鲁单抗(s1a-aa-ave-001)以及s3i和s5i构建体未显示任何cdc介导的靶细胞杀伤。图5.用抗pd-l1构建体处理的pd-l1转染的hek细胞的cdc。实施例33.抗pd-l1fc构建体对抗体依赖性细胞吞噬作用(adcp)的激活adcp报告基因测定开发adcp报告基因测定以测试抗pd-l1fc构建体相对于抗pd-l1单克隆抗体阿维鲁单抗激活fcγriia信号传导、从而增强adcp活性的程度。如实施例1、2和51-56中所述产生具有阿维鲁单抗的cdr的抗pd-l1fc构建体4、7、8、9、10、13、16和19。测试了构建体13(pd-l1)的四个版本,其中长链fc单体之间的甘氨酸间隔物(g4、g10、g15和g20接头)的大小上有变化。在如下进行的adcc报告基因测定中测试每个抗pd-l1fc构建体以及岩藻糖基化和无岩藻糖基化阿维鲁单抗单克隆抗体:将hek-pd-l1靶细胞(1.5x104个细胞/孔)和效应jurkat/fcγriia-h细胞(promega)(3.5x104个细胞/孔)重悬于补充有4%低igg血清(promega)的rpmi1640培养基中,并与连续稀释的抗pd-l1fc构建体一起接种到96孔板中。在5%co2中在37℃下温育6小时后,使用pherastarfs发光计(bmglabtech)根据制造商的规程使用bio-glo荧光素酶测定试剂(promega)测量发光。如表14中所示,抗pd-l1fc构建体在adcp报告基因测定中诱导fcγriia信号传导。表14.抗pd-l1fc构建体在adcp报告基因测定中诱导fcγriia信号传导的效力1除非另有说明,否则所有构建体都包括g20接头。2构建体包含自发e388d突变。3构建体在测定条件下未诱导可测量的fcγriia信号传导。adcp二次测定在另外的adcp测定中测试了抗pd-l1fc构建体8、9和13(g20接头),以确认adcp报告基因测定结果。在如下进行的adcc测定中测试每个抗pd-l1fc构建体和岩藻糖基化阿维鲁单抗单克隆抗体:将m2c巨噬细胞以每孔2x105个细胞的浓度接种到96孔u型底超低结合板(costar,7007)中,并使其在37℃、5%co2的加湿温育箱中平衡至少1小时。根据制造商的规程,将hek293pd-l1细胞用钙黄绿素-am(invitrogen,c-3100)进行染色,并与从6.7nm稀释5倍的抗pd-l1构建体一起在室温下预温育15分钟。然后将它们与巨噬细胞以3:1的效应子:靶标比组合,并在37℃、5%co2温育箱中温育2小时。将细胞转移到v型底96孔板中进行染色,然后用facs缓冲液(pbs+2%fbs)洗涤。使用fc阻断剂(biolegend,422302)阻断合并的细胞,并在4℃下用抗cd11b-apcab(biolegend,301310)染色1小时。用facs缓冲液洗涤细胞,并在bdfacsverse上读数。使用flowjo进行分析。通过fsc-h与fsc-a图从计算结果中除去双峰。对钙黄绿素-am和cd11b呈阳性的细胞被认为是吞噬事件或双阳性巨噬细胞(dp)。通过计算(dp细胞/总靶细胞)*100来计算吞噬作用百分比。表15中描绘的结果证明,抗pd-l1fc构建体在二次测定中诱导了adcp,并且相对于岩藻糖基化阿维鲁单抗单克隆抗体在增强adcp活性中具有更大的效力,如较低的ec50值所证明。二次adcp测定的结果与adcp报告基因测定的结果一致。表15.抗pd-l1fc构建体在利用hek-pd-l1细胞和m2c巨噬细胞进行的基于facs的测定中诱导adcp的效力1除非另有说明,否则所有构建体都包括g20接头。2构建体包含自发e388d突变。利用hekpd-l1转染的细胞进行adcp新鲜的pbmc由allcells,llc(alameda,ca)从健康供体中收集并发货。使用pan单核细胞阴性分离试剂盒(miltenyi,130-096-537)从pbmc中分离出单核细胞。在含有10%fbs、1%pen-strep和50ng/mlm-csf(peprotech,300-25)的rpmi-1640培养基中将单核细胞以1x106个细胞/孔接种到6孔培养板中。培养5天后,除去培养基并补充含有20ng/ml重组人il-10(peprotech,200-10)的无巨噬细胞-血清的培养基(gibco,12065074),再培养2天以分化为m2c巨噬细胞。使用含有5mmedta的冷pbs分离细胞。在含有2%超低iggfbs的rpmi-1640培养基中将m2c巨噬细胞以每孔2x105个细胞接种在96孔u型底超低结合板(costar,7007)中,并使其在5%co2的加湿温育箱中在37℃下平衡至少1小时。根据制造商的规程,将hek293pd-l1细胞用钙黄绿素-am(invitrogen,c-3100)进行染色,并与从6.7nm稀释5倍的抗体一起在室温下预温育15分钟。然后将它们以3:1的效应子:靶标比添加到巨噬细胞中,并在5%co2温育箱中在37℃温育2小时。将细胞转移到v型底96孔板中进行染色,然后用facs缓冲液(pbs+2%fbs)洗涤。使用fc阻断剂(biolegend,422302)阻断合并的细胞,并在4℃下用cd11b-apc(biolegend,301310)染色1小时。用facs缓冲液(pbs+2%fbs)洗涤细胞,并在bdfacsverse上读数。使用flowjo进行分析。通过fsc-h与fsc-a图从计算结果中除去双峰。对钙黄绿素-am和cd11b呈阳性的细胞被认为是吞噬事件或双阳性巨噬细胞(dp)。通过计算(dp细胞/总靶细胞)*100来计算吞噬作用百分比。图28示出了与阿维鲁单抗相比的四种不同的构建体,这些构建体显示出与具有更高效力的一些构建体(如s3i)等效的吞噬作用。人肺癌h441细胞中的adcp使用hek转染的细胞进行adcp分析后,使用肿瘤细胞作为靶细胞重复进行测定。将h441人肺癌细胞在具有10%fbs(hyclone)和glutamax的rpmi培养基中培养,然后用accutase(corning)分离细胞,以保留其细胞表面受体。用phrodo红细胞标记试剂盒(essen)在500ng/ml×1小时x37℃下以1x106/ml标记细胞。在96孔平底组织培养板(falcon/corning3072)中,将标记的靶标以10,000个细胞/孔/25μl铺在测定培养基(即2%热灭活的superlowiggfbs(hyclone)的rpmi(atccmodification)培养基(gibco))中。在2-4小时内将pd-l1构建体以2倍连续稀释度(25μl/孔)以4x浓度添加到标记的h441靶细胞中进行调理。然后在存在il-10(r&dsystems)(50ng/ml)的情况下,添加效应巨噬细胞作为m0,以完成它们对m2c的激活,最终体积为100μl/孔。通过活细胞成像系统(essen/sartorius,incucytes3)增加phrodo红色荧光强度来测量吞噬作用。该测定一式三份进行,用10倍物镜捕获每个孔的相和红色荧光的4张图像。每次运行对照进行分析—单独的h441phrodo(以设置背景红色荧光截止值)和单独的m2c(相掩模以识别巨噬细胞)。将扫描时间设置为24小时内的每小时。分析后,用于量化总h441吞噬作用的度量标准是总红色物体积分强度(rcuxμm2/图像)。图29示出了用抗pd-l1构建体处理的表达pd-l1的h441细胞的adcp测定的结果。所有构建体与阿维鲁单抗相比均显示出显著更高的adcp活性,并且s5y显示出最高的吞噬活性。实施例34.抗pd-l1fc构建体对抗体依赖性细胞介导的细胞毒性(adcc)的激活adcc报告基因测定开发adcc报告基因测定以测试抗pd-l1fc构建体相对于抗pd-l1单克隆抗体阿维鲁单抗诱导fcγriiia信号传导并增强adcc活性的程度。如实施例1、2和51-56中所述产生具有阿维鲁单抗的cdr的抗pd-l1fc构建体4、7、8、10、13、16和19。测试了构建体13(pd-l1)的四个版本,其中长链fc单体之间的甘氨酸间隔物(g4、g10、g15和g20接头)的大小上有变化。在如下进行的adcc报告基因测定中测试每个抗pd-l1fc构建体和岩藻糖基化阿维鲁单抗单克隆抗体:将hek-pd-l1靶细胞(1.25x104个细胞/孔)和效应jurkat/fcγriiia细胞(promega)(7.45x104个细胞/孔)重悬于补充有4%低igg血清(promega)的rpmi1640培养基中,并与连续稀释的抗pd-l1构建体一起接种到96孔板中。在5%co2中在37℃下温育6小时后,使用pherastarfs发光计(bmglabtech)根据制造商的规程使用bio-glo荧光素酶测定试剂(promega)测量发光。如表16中所示,抗pd-l1fc构建体在adcc报告基因测定中诱导fcγriiia信号传导。表16.抗pd-l1fc构建体在adcc报告基因测定中诱导fcγriiia信号传导的效力1除非另有说明,否则所有构建体都包括g20接头。2构建体包含自发e388d突变。adcc二次测定在另外的adcc测定中测试了抗pd-l1fc构建体8、9、13(g20接头)和19,以确认adcc报告基因测定结果。在如下进行的adcc测定中测试每个抗pd-l1fc构建体以及岩藻糖基化和无岩藻糖基化阿维鲁单抗单克隆抗体:根据制造商的说明(discoverx)进行adcca549-kilr测定。使用assaycompletetm细胞培养试剂盒-105使a549-kilr细胞系在组织培养瓶中生长。使用assaycompletetm细胞分离试剂收获细胞,将其用assaycompletetm细胞铺板39试剂调节至2x105个细胞/ml,并以50μl/孔(1x104个细胞)分配到96孔白底组织培养处理的板中。在assaycompletetm细胞铺板39试剂中将抗pd-l1构建体稀释至11nm,然后立即进行连续稀释(1:4)。将稀释的构建体以10μl/孔添加到孔中,并将测定板在37℃和5%co2下温育30分钟。将冻存的nk细胞(hemacare)解冻,并使用assaycompletetm细胞铺板39试剂以1x106个细胞/ml重悬。温育30分钟后,将nk细胞以50μl/孔(5x104个细胞/孔)添加到测定板中。还包括使用无岩藻糖基化抗pd-l1igg1抗体的阳性对照和由在不存在抗体的情况下与a549-kilr细胞共培养的nk细胞组成的阴性对照。然后将测定板在37℃和5%co2下温育3小时。温育后,立即将100μl/孔的kilr检测工作溶液(由以4:1:1体积比混合的kilr检测试剂1、2和3组成)添加到每个孔中。随后将测定板在室温下温育30分钟,然后使用pherastarfs发光计(bmglabtech)确定发光水平。表17中描绘的结果证明,抗pd-l1fc构建体在二次adcc测定中诱导了fcγriiia信号传导。二次adcc测定的结果与adcc报告基因测定的结果一致。表17.抗pd-l1fc构建体在kilr-a549细胞中诱导adcc的效力1除非另有说明,否则所有构建体都包括g20接头。2构建体包含自发e388d突变。表达人pd-l1的hek细胞中的adcc将转染以稳定表达人pd-l1基因的人胚肾(hek)细胞(crownbio)在dmem、10%fbs和2μg/ml嘌呤霉素(作为选择标记)中培养。收获细胞并将其在不含基因泰克汀(genetecin)或酚红(lonza)的x-vivo-15培养基中稀释。将hek-pd-l1靶细胞(1.25x104个细胞/孔)和jurkat/fcγriiia效应细胞(promega)(7.45x104个细胞/孔)重悬于补充有4%低igg血清(promega)的rpmi1640培养基中,并与连续稀释的抗pd-l1构建体一起接种到96孔板中。在5%co2中在37℃下温育6小时后使用pherastarfs发光计(bmglabtech)根据制造商的规程使用bio-glo荧光素酶测定试剂(promega)测量发光。图30示出了用抗pd-l1构建体处理的表达pd-l1的hek细胞的adcc测定的结果。s3y构建体(实线)显示出最高的活性,而s3i和s5i构建体的表现与岩藻糖基化阿维鲁单抗抗体s1a-aa-ave-001(自身生成)相似。adcc活性人类a549细胞使用hek转染的细胞进行adcc分析后,使用肿瘤细胞作为靶细胞重复进行测定。从atcc获得人肺腺癌细胞即a549细胞,并在f-12k培养基(gibco)、10%fbs(hyclone)和2mm谷氨酰胺(gibco)中培养。根据制造商的说明(discoverx)进行adcca549-kilr测定。使用assaycompletetm细胞培养试剂盒-105使a549-kilr细胞系在组织培养瓶中生长。使用assaycompletetm细胞分离试剂收获细胞,将其用assaycompletetm细胞铺板39试剂调节至2x105个细胞/ml,并以50·l/孔(1x104个细胞)分配到96孔白底组织培养处理的板中。在assaycompletetm细胞铺板39试剂中将测定测试试剂(阿维鲁单抗抗体和fc-抗原结合构建体)稀释至11nm,然后立即进行连续稀释(1:4)。将稀释的测试试剂以10·l/孔添加到孔中,并将测定板在37℃和5%co2下温育30分钟。将先前从hemacare获得的冻存nk细胞解冻,并使用assaycompletetm细胞铺板39试剂稀释至1x106个细胞/ml。温育后,将天然杀伤(nk)细胞以50·l/孔(5x104个细胞/孔)添加到测定板中。然后将测定板在37℃和5%co2下温育3小时。温育后,立即将100·l/孔的kilr检测工作溶液(由以4:1:1体积比混合的kilr检测试剂1、2和3组成)添加到每个孔中。随后将测定板在室温下温育1小时,然后使用pherastar发光计确定发光水平。图31示出了用抗pd-l1构建体处理的表达pd-l1的a549细胞的adcc测定的结果。s3i和s3y构建体显示出最高的活性,并且s5x和s5y构建体也显示出比岩藻糖基化阿维鲁单抗抗体s1a-aa-ave-001(自身生成)更高的adcc活性。实施例35:pd-l1构建体的体内活性测定将mc38细胞(从kerafast和nci获得)保持在包含10%胎牛血清、0.1mm非必需氨基酸、10mmhepes、50ug/ml硫酸庆大霉素和1xpen/strep的dmem培养基中。收获细胞,并以每只小鼠100ulpbs中500,000个细胞皮下注射到c57bl/6小鼠(charlesriverlaboratories)的侧腹。每周测量三次肿瘤大小,十天后将肿瘤大小介于50-100mm3之间的小鼠随机分组(指定为第0天),并纳入研究。随机分组后,通过腹膜内注射每周两次用盐水、10mg/kg阿维鲁单抗或17mg/kgpd-l1的s3y(针对摩尔浓度进行调节)处理小鼠,持续2周,并在处理开始后第18天处死小鼠。每周测量三次肿瘤大小和体重,直到研究结束。对于任何处理组,均未观察到体重减轻(数据未示出)。图26描绘了不同处理组的肿瘤大小,并且示出了对阿维鲁单抗和s3y构建体的相似功效,与盐水组相比,这两组的肿瘤大小均显著减小。实施例36:构建体中的fc结构域保持与抗体中的fc结构域相似的与fcγ受体的结合使用抗cd20和抗pd-l1构建体来评估同二聚化突变、异二聚化突变、多肽接头和fab结构域的各种组合是否影响与fcγ受体的结合。利用表面等离子体共振(spr)来评估与cd64(fcγ受体i)的1:1结合。将构建体捕获在芯片表面上,并测量与可溶性受体的结合以确保1:1结合。在这种格式下,结合价是对fc功能改变最敏感的读数;动力学常数和平衡常数对fc结构域的子集改变不敏感。细胞培养将dna序列优化以在哺乳动物细胞中表达,并克隆到pcdna3.4哺乳动物表达载体中。将dna质粒构建体经由脂质体转染到人胚肾(hek)293细胞中。抗体由两种不同的质粒表达:一种编码重链,并且第二种编码轻链。sif抗体由三种单独的质粒表达:在大多数情况下,一种质粒编码抗体轻链,一种质粒编码包含附接到氨基末端fc的ch1-vhfab部分的长fc链,并且第三种质粒编码短fc链。s3a和s3wsif抗体除外。对于s3w,一种质粒编码抗体轻链,第二种质粒编码包含两个fc结构域的长链,并且第三种质粒编码包含ch1-vhfab部分的单条fc链。对于s3a,一种质粒编码抗体轻链,第二种质粒编码包含附接到氨基末端fc的ch1-vhfab部分的长fc链,并且一种质粒编码也包含ch1-vhfab部分的短fc链。蛋白质纯化使用porosmabcapturea柱,通过基于蛋白a的亲和柱色谱法从细胞培养上清液中纯化表达的蛋白质。上样后,用磷酸盐缓冲盐水(pbs,ph7.0)洗涤捕获的sif-抗体构建体,并进一步用中间洗涤缓冲液50mm柠檬酸盐缓冲液(ph5.5)洗涤,以除去其他与工艺有关的杂质。用100mm甘氨酸(ph3)洗脱结合的sif抗体物质,并通过添加1mtris(ph7.4)快速中和洗脱液,然后离心并通过0.2μm过滤器进行无菌过滤。使用porosxs树脂,通过离子交换色谱法进一步分离蛋白质。用50mmmes(ph6,缓冲液a)预平衡柱,并且在平衡缓冲液中稀释(1:3)样品以便上样。使用12-15cv线性梯度(50mmmes(100%a)至400mm氯化钠(ph6,100%b))作为洗脱缓冲液洗脱样品。通过分析尺寸排阻色谱法(sec)分析洗脱期间收集的所有级分,并合并目标级分以产生纯化的sif-抗体物质。在离子交换后,在切向流过滤系统上,使用30kda截止聚醚砜(pes)膜滤筒将合并物质缓冲交换到1x-pbs缓冲液中。将样品浓缩至大约10-15mg/ml,并通过0.2μm过滤器进行无菌过滤。物理化学分析将分析尺寸排阻色谱法(sec)用于后蛋白a、合并的离子交换级分和最终的纯化物质的纯度评估。使用1x-pbs将纯化物质稀释至1mg/ml,并在具有uv&fld检测器的agilent1200系统上使用zenixsec-300(4.6x300mm,3μm,sepax,目录号213300-4630)作为分析柱进行分析。在分析前,将柱以0.3ml/min用100mm磷酸钠、200mm精氨酸、300mm氯化钠(ph=6.7)和0.05%w/v叠氮化钠缓冲液平衡一小时。进样量为大约10-15ul,柱温:300c,在280nm处进行uv检测,通过在280mm处激发并且在330nm处发射进行fld,总运行时间为15分钟。尺寸纯度结果在表error!referencesourcenotfound.所有材料仅显示出低水平的更高级物质(hos)。表18:构建体的尺寸纯度结合分析使用cm3seriess传感器芯片在biacoret200仪器(gehealthcare)上进行结合实验。为了进行fcgr结合的价分析,经由直接胺偶联固定天然蛋白a。在运行缓冲液中稀释配体并将其捕获。使人重组cd32a或cd64(r&dsystems)的6点稀释系列流经捕获的配体。如下计算每种配体的价:配体价=rmax/[(mw分析物/mw配体)*配体捕获水平]。cd64与抗cd20和抗pd-l1构建体结合的分析结果在表19中示出。在所有情况下,cd64结合价均等于fc结构域的数量,表明所有fc结构域均具有结合cd64的功能。在序列上与s3y-aa-obi和s3y-aa-ave相同但缺少fab结构域的对照化合物与那些构建体相当地结合cd64,表明包含fab结构域不会改变与fc受体的结合。表19:具有多个fc结构域的各种构建体的价实施例37:构建体与细胞表面fcγ受体更紧密地结合使用抗cd20构建体在时间分辨荧光共振能量转移(tr-fret)测定(cisbio)中评估构建体与细胞表面cd32a的相对结合。测定试剂根据制造商的说明来制备。使用freedomevoware150自动化液体处理机(tecan)为每个样品生成10点、3倍连续稀释系列,将其添加到带有标记受体的细胞中。然后添加标记的竞争抗体,并将板在室温下温育。使用pherastar荧光读取器(bmglabtechgmbh)在665和620nm处读取测定板。将对数转换的样品浓度相对于对应的htrf信号比(665nm/620nm)进行绘图。在xy-绘图上进行四参数非线性回归分析(最小二乘拟合),以计算未标记样品的ec50,其中ec50与样品对fcγ受体的亲和力成反比。通过tr-fret测定的对cd32a的竞争性结合的测量结果在error!referencesourcenotfound.。fc结构域的数量增加极大地提高了构建体与免疫球蛋白竞争cd32a的能力,如降低的ic50值所反映。在序列上与s3y-aa-obi和s3y-aa-ave相同但缺少fab结构域的对照化合物与那些构建体相当地竞争细胞表面cd32a,表明包含fab结构域不会改变与fc受体的结合。表20:通过具有多个fc结构域的各种构建体进行fc结合实施例38:抗原结合保留在构建体中使用spr评估抗原结合。使用先前固定的抗6xhis抗体在传感器上捕获带有组氨酸标签的pd-l1(9049-b7r&dsystems)重组蛋白。使稀释系列的同族抗体和sif抗体通过传感器,在分析物进样之间用低ph甘氨酸溶液对所述传感器进行再生。使用1:1langmuir相互作用模型计算结合。pd-l1与抗pd-l1构建体的结合在表21中示出。通过sec,所有测试的化合物的纯度不低于86%。在有利于1:1结合的测定中,构建体具有与对应单克隆抗体相当的抗原结合。表21:各种pd-l1构建体进行pd-l1结合构建体kd(nm)mab0.042构建体13(s3y)0.023构建体7(s3i)0.065构建体8(s3w)0.027构建体9(s3a)0.034构建体10(s5i)0.095构建体19(s5x)0.057实施例39:抗pd-l11fc构建体结合fc受体。fc受体结合的分析发现抗pd-l1fc构建体13(实施例2;表6)结合fc受体。其他实施方案本说明书中提及的所有出版物、专利和专利申请都以引用的方式并入本文,其程度如同每个独立的出版物或专利申请具体地且个别地指出以引用的方式并入。虽然本公开已结合其具体实施方案进行描述,但应理解,进一步的修改是可能的行,并且本专利申请预期覆盖一般而言遵循本公开的原理的本公开的任何变化、用途或适应,并且包括与本公开的此类偏离,所述偏离在本公开所属领域内的已知或惯常实践内,并且可以应用于上文所述的基本特征,并且落入权利要求的范围内。其他实施方案在权利要求内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1