腺病毒体
本发明涉及其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸,涉及其中腺病毒核苷酸序列以使其不再能够产生外壳蛋白中的一种或多种外壳蛋白的方式突变的重组腺病毒核酸,涉及填充有此类腺病毒物质的细胞囊泡、提供有此类腺病毒物质的细胞,并且涉及它们的方法和用途。
背景技术:
基因治疗是一种其中将遗传物质引入到细胞中的治疗方法,在细胞中其可取代缺陷基因或在细胞中其编码治疗分子(诸如细胞因子)或治疗抗体的表达。
使用合适的媒介物(诸如病毒载体)将这些基因递送到细胞中。病毒载体具有通过将其dna插入细胞并复制到细胞中而感染细胞的天然能力。
腺病毒通常用作病毒载体。腺病毒是一种与呼吸道感染和结膜炎相关的充分表征的无包膜病毒。(chu,r.l.,clinicalcancerresearch,2004,10,5299-5312)。
腺病毒是特别合适的病毒载体,因为它们既能够感染复制细胞也能够感染静止细胞,能够携带大片段dna(高达30kbp)并且不整合到宿主细胞的基因组中。此外,可获得广泛的分子生物学知识,并且病毒可被有效地纯化至高滴度。
存在腺病毒的不同亚型,其中2型和5型最常用于递送媒介物目的。
完全成熟的人腺病毒5型病毒颗粒约为110纳米,形状为二十面体,并且含有由衣壳包围的包含双链dna的核。
形成衣壳的主要蛋白为六邻体、五邻体和纤维蛋白,但衣壳还包括蛋白iiia、vi、viii和ix。本文中,纤维蛋白有利于与宿主细胞受体诸如柯萨奇-ad受体(car)的结合。此外,发现蛋白ix在病毒颗粒的稳定性中起作用。(lee,c.s.等人genes&diseases,2017,4,43-63)。
病毒的核由大小为36kb的双链线性dna基因组和蛋白iva2、v、vii、末端蛋白、μ和腺病毒蛋白酶组成。
基因组由参与病毒dna复制的早期基因e1a、e1b、e2、e3和e4、编码衣壳蛋白的中间基因pix和iva2和晚期基因l1至l5、以及核蛋白v和vii组成。
为了提高病毒载体的安全性,已经开发了不同的世代,每个世代包含对基因组的特异性修饰或缺失,从而改变病毒复制自身或诱导免疫应答的能力。
第一代腺病毒包含e1区域的缺失,以使病毒复制缺乏。然而,此类腺病毒载体的使用仍导致强免疫应答,这与高细胞毒性相关联。
因此,开发了第二代病毒载体,其中除e1区之外,还在e2和/或e4基因中进行特异性突变或缺失。虽然免疫应答显著降低,但仍观察到细胞毒性副作用。
因此,开发了第三代或无肠腺病毒载体,其中编码复制所需的酶或蛋白的所有基因被消除。然而,此类病毒带来纯化问题,因为它们需要存在合适的辅助病毒。(jounaidi,y,currcancerdrugtargets.2007,7(3),285-301)。
在癌症治疗中,溶瘤病毒诸如条件复制腺病毒(crad)已成为选择性靶向癌细胞的强大工具。这种效果可以不同的方式实现。
首先,可在病毒dna中引入特异性突变,诸如e1a基因中24个碱基对的缺失(adδ24)或e1b-55kda基因的缺失(adδ1520),这导致crad在健康细胞中的复制被禁止,而在癌细胞中这种突变被细胞缺陷补偿,从而导致病毒的复制并因此导致癌细胞的裂解。
另选地,可将e1基因置于癌症特异性启动子之下以使得e1区域受控制的转录,从而导致病毒颗粒仅在癌细胞中选择性复制。(yamamoto,m,curiel,d.t.,moleculartherapy2010,18(2),243-250)
此外,在癌细胞裂解时,溶瘤病毒颗粒被释放,其随后可感染相邻(未感染)癌细胞。这种现象被称为旁观者效应,并且有助于改善治疗效果。(lee,c.s.等人,genes&diseases,2017,4,43-63)
然而,腺病毒载体用于基因治疗仍然与主要缺点相关联。例如,由于它们的大尺寸、对细胞的“粘性”、不能经由血液转移、被抗体中和以及结合/摄取到细胞诸如红细胞或肝巨噬细胞中,因此有效递送特别是向转移的肿瘤递送仍然是一个挑战。
细胞外囊泡(ev)是由尺寸通常在约50nm至1000nm范围内的脂质双层制成的细胞器,其从细胞分泌。它们可通过质膜向外出芽(包括凋亡泡)或通过内体膜向内出芽而形成,从而产生多囊泡单元,其继而在与质膜(外来体)融合时释放囊泡。ev通常包含不同种类的运载物,这取决于供体细胞。此类运载物可作为来自细胞的废物进行处理,并因此可由ev处理掉,或者其可用于细胞间通讯,即通过将运载物从一个细胞递送到另一个细胞。(vanderpol,e等人,pharmacologicalreviews,64(3),676-705;maas,s.等人,journalofcontrolledrelease,2015,200,87-96)
此外,肿瘤来源的ev在动物模型中显示通过与相邻细胞及其局部微环境主动通信而在肿瘤进展和转移中起关键作用。肿瘤ev被认为经由若干途径影响免疫系统稳态,尤其是通过抑制cd8+t细胞介导的肿瘤靶向或抑制nk细胞,从而为肿瘤创造保护性微环境。此外,ev似乎促进血管募集以改善氧气供应并促进肿瘤细胞释放到循环中和它们扩散到其他部位。(becker,a.,cancercell,2016,30,836-848)。
此外,ev可为组织特异性的,这取决于它们的表面蛋白组成。例如,在肿瘤分泌的ev上表达的特定整联蛋白导致对特定细胞类型的粘附。(hoshino,a.等人,nature.2015,527(7578):329-335;costa-silva,b,natcellbiol.2015,17(6):816-826)。
由于其将生物内容物转移到受体细胞中的天然能力及其靶标特异性,近年来已出现了开发ev作为治疗媒介物的兴趣。事实上,使用ev作为治疗媒介物提供了许多益处。由于它们天然存在于生物系统中,因此它们能够更深地渗透到组织中,从而改善递送效率。此外,它们能够通过血脑屏障并且因此可用作驻留在脑中的靶标的递送媒介物。
另外,ev能够躲避免疫系统,从而减少ev从系统中的清除,并且ev不诱导免疫原性应答。
然而,还没有建立有效负载ev和包装大dna构建体的可靠和可再现的方法。一般来讲,使用电穿孔或超声处理将小核酸(例如,短发夹rna)引入到ev中。这些方法效率低,并且研究甚至已报道此类策略不导致在ev内的真实包装,而仅导致在外部的聚集。(kooijmans等人jcontrolrelease.2013年11月28日;172(1):229-238)。
因此,仍然需要与腺病毒载体相比表现出改善的递送特性和降低的毒性但具有类似的堆积效率和负载大dna片段的能力的媒介物。
技术实现要素:
本发明人惊奇地发现,当用腺病毒感染细胞时,可获得名为“腺病毒体(adenosome)”的新颗粒,其由负载了腺病毒核级分(即,与病毒核蛋白组合的病毒基因组)的细胞囊泡组成。腺病毒体组合了细胞囊泡的有利特性和腺病毒的有利特性。
因此,本发明提供了在早期基因中具有突变的重组腺病毒核酸,其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下。在一个优选的实施方案中,突变为e1a区中的δ24突变和/或e1b区中的δ55k突变。在另一个优选的实施方案中,重组腺病毒核酸为条件复制型腺病毒和/或复制缺陷型腺病毒载体的腺病毒核酸。还优选的是,在根据本发明的在早期基因中具有突变的重组腺病毒核酸中,编码蛋白v的基因和编码蛋白vii的基因被置于异源启动子的控制下。在一个实施方案中,可将异源基因插入重组腺病毒核酸中。在又一方面,本发明提供了包含此类在早期基因中具有突变的重组腺病毒核酸的细胞囊泡,其中编码蛋白v的基因和/或编码蛋白vii的基因被置于根据本发明的异源启动子的控制下。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。在一个实施方案中,在早期基因中具有突变的重组腺病毒核酸包含被置于异源启动子控制下的编码蛋白v和/或蛋白vii的基因和被置于原始启动子即晚期腺病毒启动子控制下的编码v和/或蛋白vii的基因两者。另选地,在早期基因中具有突变的重组腺病毒核酸仅包含被置于异源启动子控制下的编码蛋白v和/或蛋白vii的基因,而不包含被置于原始启动子即晚期腺病毒启动子控制下的编码v和/或蛋白vii的基因。在一个优选的实施方案中,在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的腺病毒核酸以使得其不再能够产生主要衣壳蛋白中的一种或多种主要衣壳蛋白的方式突变。在另一个优选的实施方案中,编码主要衣壳蛋白的晚期基因中的一种或多种晚期基因从腺病毒核酸的核苷酸序列中部分或完全缺失,该腺病毒核酸在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下。在另一个实施方案中,在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的腺病毒核酸的晚期基因中的一种或多种晚期基因被置于表达调节子的控制下,该表达调节子优选地为用于强力霉素可控基因表达的tet-on或tet-off系统。在另一个优选的实施方案中,在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的腺病毒核酸以使得其不再能够被包装在腺病毒衣壳中的方式突变,优选地通过loxp位点侧接腺病毒包装序列(psi)以建立所述序列的基于cre重组酶的缺失。
在又一方面,本发明提供了包含其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸的细胞囊泡。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。在一个优选的实施方案中,所述核酸不包含早期腺病毒基因并且不包含编码病毒衣壳蛋白的基因。在一个特别优选的实施方案中,所述核酸不包含除编码蛋白v和/或蛋白vii的基因之外的腺病毒核酸。还优选的是,在重组腺病毒核酸中,编码蛋白v的基因和编码蛋白vii的基因被置于异源启动子的控制下。在一个实施方案中,包含其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸的所述细胞囊泡还包含异源基因或在早期基因中具有突变的第二腺病毒核酸,优选地,其中该突变为e1a区中的δ24突变和/或e1b区中的δ55k突变,并且/或者该重组腺病毒核酸为条件复制型腺病毒和/或复制缺陷型腺病毒载体的腺病毒核酸。其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的所述重组腺病毒核酸和在早期基因中具有突变的所述第二腺病毒核酸可存在于同一核酸分子上或存在于两个单独的核酸分子上。在一个优选的实施方案中,在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的腺病毒核酸以使得其不再能够产生主要衣壳蛋白中的一种或多种主要衣壳蛋白的方式突变。在另一个优选的实施方案中,编码主要衣壳蛋白的晚期基因中的一种或多种晚期基因从腺病毒核酸的核苷酸序列中部分或完全缺失,该腺病毒核酸在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下。在另一个实施方案中,在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的腺病毒核酸的晚期基因中的一种或多种晚期基因被置于表达调节子的控制下,该表达调节子优选地为用于强力霉素可控基因表达的tet-on或tet-off系统。在另一个优选的实施方案中,在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的腺病毒核酸以使得其不再能够被包装在腺病毒衣壳中的方式突变,优选地通过loxp位点侧接腺病毒包装(psi)以建立所述序列的基于cre重组酶的缺失。其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的所述重组腺病毒核酸和所述异源基因也可存在于同一核酸分子上或存在于两个单独的核酸分子上。
在又一方面,本发明提供了包含其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下并且其中蛋白v和/或蛋白vii与异源分子融合的重组腺病毒核酸的细胞囊泡,该异源分子特别是编码治疗蛋白、成像蛋白或允许纯化的蛋白。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。在优选的实施方案中,所述核酸不包含早期腺病毒基因并且不包含编码病毒衣壳蛋白的基因。在一个特别优选的实施方案中,所述核酸不包含除编码蛋白v和/或蛋白vii的基因之外的腺病毒核酸。还优选的是,在重组腺病毒核酸中,编码蛋白v的基因和编码蛋白vii的基因被置于异源启动子的控制下。蛋白v和/或vii可与异源分子优选地异源蛋白直接融合,或另选地,蛋白v/蛋白vii与异源分子之间可存在接头序列。用于融合两种蛋白和/或肽序列的合适接头在本领域中是众所周知的。
在又一方面,本发明提供了包含腺病毒蛋白v和/或蛋白vii以及核酸分子的细胞囊泡,该核酸分子包含在早期基因中具有突变的重组腺病毒核酸。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。在一个优选的实施方案中,细胞囊泡包含蛋白v和蛋白vii。在一个优选的实施方案中,突变为e1a区中的δ24突变和/或e1b区中的δ55k突变。在另一个优选的实施方案中,重组腺病毒核酸为条件复制型腺病毒和/或复制缺陷型腺病毒载体的腺病毒核酸。在一个优选的实施方案中,在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的腺病毒核酸以使得其不再能够产生主要衣壳蛋白中的一种或多种主要衣壳蛋白的方式突变。在另一个优选的实施方案中,编码主要衣壳蛋白的晚期基因中的一种或多种晚期基因从腺病毒核酸的核苷酸序列中部分或完全缺失,该腺病毒核酸在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下。在另一个实施方案中,在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的腺病毒核酸的晚期基因中的一种或多种晚期基因被置于表达调节子的控制下,该表达调节子优选地为用于强力霉素可控基因表达的tet-on或tet-off系统。在另一个优选的实施方案中,在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的腺病毒核酸以使得其不再能够被包装在腺病毒衣壳中的方式突变,优选地通过loxp位点侧接腺病毒包装(psi)以建立所述序列的基于cre重组酶的缺失。在一个实施方案中,可将异源基因插入重组腺病毒核酸中。还优选的是,在重组腺病毒核酸中,编码蛋白v的基因和编码蛋白vii的基因被置于异源启动子的控制下。
在又一方面,本发明提供了包含腺病毒蛋白v和/或蛋白vii以及包含异源基因的核酸分子的细胞囊泡。在一个优选的实施方案中,细胞囊泡包含蛋白v和蛋白vii两者。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。
在又一方面,本发明提供了包含腺病毒蛋白v和/或蛋白vii的细胞囊泡,其中蛋白v和/或蛋白vii与异源分子特别是治疗蛋白、成像蛋白或允许纯化的蛋白融合。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。在一个优选的实施方案中,细胞囊泡包含蛋白v和蛋白vii两者,其中蛋白v和/或蛋白vii与异源分子融合,优选地其中蛋白v和蛋白vii两者与异源分子融合。与蛋白v融合的异源分子和与蛋白vii融合的异源分子可相同或不同。蛋白v和/或vii可与异源分子、优选地异源蛋白直接融合,或另选地,蛋白v/蛋白vii与异源分子之间可存在接头。用于融合两种蛋白和/或肽序列的合适接头在本领域中是众所周知的。细胞囊泡还可包含根据本发明的在早期基因中具有突变、任选地其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸。
在又一方面,本发明提供了包含根据本发明的重组腺病毒核酸的核酸分子,诸如核酸载体或质粒。在一个实施方案中,所述重组腺病毒核酸为在早期基因中具有突变、其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸。在另一个实施方案中,所述重组腺病毒核酸为其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下并且优选地不包含早期腺病毒基因并且不包含编码病毒衣壳蛋白的基因、更优选地不包含除编码蛋白v和/或蛋白vii的基因之外的腺病毒核酸的重组腺病毒核酸。
在又一方面,本发明涉及其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸,该异源启动子优选地选自早期腺病毒启动子、蛋白ix的中间启动子或非腺病毒来源的异源启动子,诸如磷酸甘油酸激酶(pgk)或巨细胞病毒启动子。
本发明的另一部分为如上所定义的重组腺病毒核酸,其中病毒核酸以使得其不再能够产生主要衣壳蛋白中的一种或多种主要衣壳蛋白的方式突变,优选地其中编码主要衣壳蛋白的晚期基因中的一种或多种晚期基因从核苷酸序列部分或完全缺失,或者其中晚期基因中的一种或多种晚期基因被置于表达调节子的控制下,该表达调节子诸如用于强力霉素诱导或可控基因表达的tet-on或tet-off系统。
另选地,本发明涉及重组腺病毒核酸,其中腺病毒核苷酸序列以使得其不再能够产生主要衣壳蛋白中的一种或多种主要衣壳蛋白的方式突变,优选地其中编码主要衣壳蛋白的晚期基因中的一种或多种晚期基因从核苷酸序列部分或完全缺失,或者其中晚期基因中的一种或多种晚期基因被置于表达调节子的控制下,该表达调节子诸如用于强力霉素诱导或可控基因表达的tet-on或tet-off系统。在根据权利要求8-10所述的此类重组腺病毒核酸中,其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下,该异源启动子优选地选自早期腺病毒启动子、蛋白ix的中间启动子或非腺病毒来源的异源启动子,诸如磷酸甘油酸激酶(pgk)或巨细胞病毒启动子。
在另一个实施方案中,在本发明的重组腺病毒核酸中,蛋白v和/或蛋白vii与异源分子融合,该异源分子优选地为蛋白,特别是治疗或成像蛋白、或允许纯化的蛋白,或编码治疗或成像蛋白、或允许纯化的蛋白的核酸分子。在一个优选的实施方案中,异源分子选自绿色荧光蛋白、红色荧光蛋白、二氧化铁、snap标签、生物素酰化序列。
在本发明的另一个优选实施方案中,重组腺病毒核酸具有插入的异源基因,优选地其中该异源基因编码选自包含以下各项的组的生物分子:前药转化酶,优选地胸苷激酶;细胞因子,优选地gm-csf、il-2或il-12;检查点抑制剂,优选地靶向ctla-4或pd-1;激动性抗体或配体,以刺激免疫细胞,优选地靶向4-1bb、ox40或cd40;重组双特异性t细胞衔接子抗体,优选地bite;微rna、shrns、cas9导引rna、抑制蛋白激酶的肽和刺激抗肿瘤免疫应答的肽。
在另一个优选的实施方案中,本发明包括如上所述的重组腺病毒核酸,该重组腺病毒核酸在早期基因中具有突变,优选地e1a区中的δ24突变或e1b区中的δ55k突变。还优选的是根据本发明的包含与纤维蛋白融合的rgd序列的重组腺病毒核酸。
本发明的另一部分为包含根据本发明的重组腺病毒核酸或根据本发明的核酸分子的细胞,优选地her911、per.c6或hek293t细胞。
本发明的另一部分为用于产生根据本发明的细胞的方法,该方法包括
-在培养基中培养细胞;
-将如上所述的重组腺病毒核酸引入到所述细胞中。
本发明的另一部分为包含根据本发明的重组腺病毒核酸的重组腺病毒颗粒。
本发明还包括包含根据本发明的重组腺病毒核酸或根据本发明的核酸分子的细胞囊泡,优选地细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分,更优选地细胞外囊泡。本发明还包括填充有根据本发明的重组腺病毒核酸的细胞囊泡,优选地细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分,更优选地细胞外囊泡。优选地,包含或填充有重组腺病毒核酸的此类细胞囊泡用于治疗疾病,优选地其中该疾病为癌症或其中该疾病为遗传障碍,特别是脑、肝脏或胃肠道的遗传障碍,或者其中该疾病选自衰老相关疾病,优选地阿尔茨海默病、帕金森氏病或关节炎,或者其中该疾病为感染性疾病。
在另一个实施方案中,包含或填充有重组腺病毒核酸的细胞囊泡用于监测病毒复制,该细胞囊泡优选地为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分,更优选地细胞外囊泡。
本发明还包括治疗组合物,该治疗组合物包含根据本发明的细胞囊泡或根据本发明的重组腺病毒颗粒以及药物载体或囊泡,该细胞囊泡优选地为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分,更优选地细胞外囊泡。
本发明的另一部分为根据本发明的细胞囊泡作为用于体外组织或细胞培养物和类器官的染料的用途,该细胞囊泡优选地为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分,更优选地细胞外囊泡。
本发明还包括用于产生根据本发明的细胞外囊泡的方法,该方法包括:
-在培养基中培养细胞;
-将根据本发明的重组腺病毒核酸引入到所述细胞中;
-收获包含或填充有重组腺病毒核酸的细胞外囊泡。
在又一个方面,本发明提供了用于制备细胞外囊泡的方法,该方法包括
-在培养基中培养细胞;
-将其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸引入到细胞中;
-将包含早期基因中的突变和/或异源基因的重组腺病毒核酸引入到细胞中;
-任选地使包含重组腺病毒核酸的细胞经受细胞应激;
-收获细胞外囊泡。
此外,本发明涉及用于治疗疾病特别是遗传障碍、癌症或衰老疾病的方法,该方法包括:-向有需要的受试者施用根据本发明的细胞囊泡或根据本发明的治疗组合物,该细胞囊泡优选地为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分,更优选地细胞外囊泡。
本发明还包括用于检测腺病毒核酸的诊断方法,该方法包括:
-向有需要的受试者施用根据本发明的重组腺病毒或填充有根据本发明的重组腺病毒核酸的细胞囊泡;
-从所述受试者收获体液;
-对细胞囊泡中的腺病毒核酸进行定量。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。
附图说明
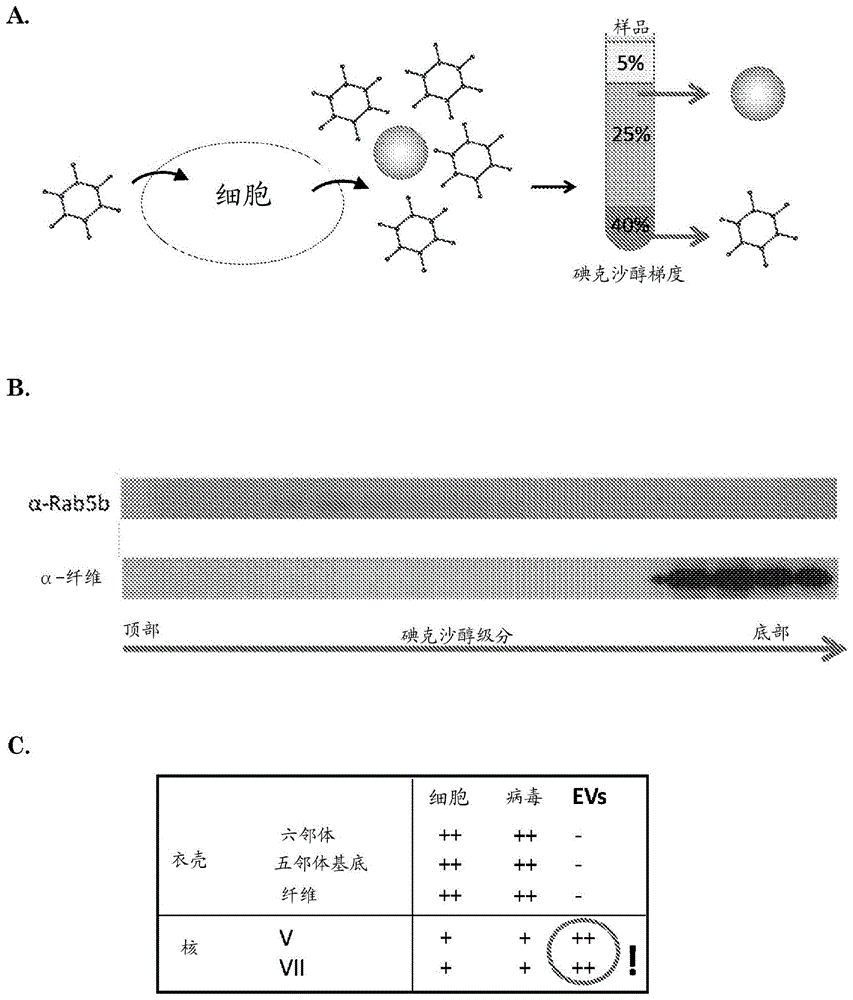
图1-通过质谱法检测ev内的腺病毒核蛋白v和vii。将gs184成胶质细胞瘤细胞用野生型hadv-5感染。a:使用碘克沙醇密度梯度的超速离心来分离ev,并将其与腺病毒颗粒分离(内部开发的方法)。b:western印迹确认了ev(抗-rab27b染色)与病毒颗粒(抗纤维染色)的适当分离。c:进行质谱分析以比较细胞、病毒和ev的蛋白图谱。可以预知,在细胞和病毒中检测到病毒衣壳和核蛋白两者。然而,ev似乎仅含有丰富存在的核蛋白(v和vii)。
图2-来自腺病毒感染的细胞的ev似乎含有病毒dna并且似乎是感染性的。将gs756细胞用条件复制型腺病毒(ad.5.d24.rgd.gfp)感染,并且在72h后,对上清液进行碘克沙醇密度梯度离心,以将ev(顶部区域)与病毒颗粒(底部区域)分离。使不同的级分经受不同的测定:a.ev-quant测定,示出顶部级分中的ev,b.定量pcr(靶向病毒纤维基因的序列),示出在底部(如预期的)但也在顶部c存在病毒dna。对a549细胞的感染性测定,其示出了ev感染细胞的能力。
图3-在用pv.gfp腺病毒感染细胞后ev中与gfp融合的pv的检测。a:使用我们内部开发的ev-quant测定,不仅可检测到红色荧光颗粒(标记的ev膜),而且可观察到绿色荧光颗粒。因此,检测到三种类型的颗粒:仅绿色颗粒=病毒颗粒,仅红色颗粒=空ev,红色+绿色颗粒=负载pv.gfp的ev(腺病毒体)。b:在gs184细胞感染后64小时,在上清液中检测到大量的腺病毒体。c:不同细胞类型(gs562、her911、a549)发生腺病毒体分泌。培养基的类型可影响腺病毒体分泌,例如,对于在无血清dmem中培养的her911细胞,ev产量增加。d:细胞上清液中的腺病毒体浓度随时间推移而增加。
图4-在感染癌细胞后腺病毒体水平与腺病毒的感染性水平相关。这为腺病毒体作为生物标志物平台开辟了机会。a:在用pv.gfp腺病毒感染四种不同的原代成胶质细胞瘤培养物后,通过对上清液的evquant测定(感染后六天)确定腺病毒体水平。用基于atp的细胞活力测定来确定细胞活力。b:腺病毒体浓度和细胞活力的合并线性回归分析。两个图均示出了腺病毒体浓度与细胞活力之间的强负相关性。
图5-腺病毒体和病毒颗粒对成胶质细胞瘤神经球的组织渗透比较。使用碘克沙醇密度梯度程序从用hadv-5δ24.rgd.gfp感染的her911细胞中分离腺病毒体和病毒颗粒。将腺病毒体和病毒颗粒以相等的感染性单位施用于gs神经球。六天后,进行共焦显微镜检查以分析球体中的gfp表达。指示在神经球不同深度处gfp阳性细胞的平均数(每种条件5个球)。
图6-a:pv.pvii的异源表达导致dna向ev中的掺入增强。将her911细胞用质粒dna:puc57.cmv.crimson_cmv.egfp(空质粒)或puc57.cmv.crimson-pvii_cmv.egfp-pv(负载ev的质粒)转染。一天后,将细胞用腺病毒(野生型hadv-5)感染,并且在三天后,通过碘克沙醇密度梯度方法分离ev(ev在级分4至7中)。b:q-pcr用于定量ev中dna的掺入。这清楚地表明pv/pvii的异源表达进一步加强了病毒基因组dna的掺入(上图)。此外,在pv/pvii表达加病毒感染的情况下,puc57dna也以增加的水平掺入到ev中(下图)。
具体实施方式
据发现,当细胞被腺病毒感染时,其分泌细胞外囊泡,该细胞外囊泡包含可用作生物物质递送媒介物的腺病毒物质(aksela,l,universityofhelsinki,deliveryofoncolyticadenovirusviaextracellularvesicles;dourado,m.r.等人,journalofextracellularvesicles,2017年6月(增刊1),extracellularvesiclesderivedfromcancer-associatedfibroblastsmayhavearoleinoralcancerinvasion;garofalo,m.,journalofextracellularvesicles,2017年6月(增刊1),oncolyticadenovirusesencapsulatedintotheextracellularvesiclesascarriersfortargeteddrugdelivery,garofalo,m.,jcontrolrelease.2018,283,223-234。)
本发明人现在惊奇地发现,细胞囊泡,诸如称为“腺病毒体”的细胞外囊泡,具有例如在将生物运载物递送至靶细胞方面的极大治疗价值的独特特性。这一发现是令人惊讶的,因为细胞外囊泡通常表现出有限的堆积容量。当详细评估这些腺病毒体时,观察到该腺病毒体包装有与病毒核蛋白v和vii结合的病毒dna,而衣壳蛋白(诸如六邻体、五邻体和纤维蛋白)则不存在。因此,发明人认识到,蛋白v和vii在病毒dna的紧密堆积中起关键作用,使得其贴合在细胞外囊泡中。实际上,如图6b所示,包含编码pv和pvii的基因的核酸能够增加腺病毒dna向细胞外囊泡的掺入(上图)。
还设想,具有被有效堆积到细胞囊泡中的潜力的腺病毒将具有很大的治疗价值。因此,本发明涉及其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸。根据本发明的重组腺病毒核酸可为具有编码蛋白v和蛋白vii的基因中的一者或两者的腺病毒核酸,即,其可为全长腺病毒核酸或其可仅为编码这两种蛋白中的一者的基因。此外,它可包括相对于天然存在的腺病毒的附加突变和/或缺失。
因此,本发明涵盖若干方面。在一个方面,本发明涉及一种新型溶瘤腺病毒,其基因组通过pv和/或pvii的增强或更早表达而在细胞囊泡中分泌增加,从而提供具有改善的扩散和杀伤的改善的杀癌腺病毒。这种新型腺病毒可为在早期基因中具有突变并且其中编码pv和/或pvii的基因被置于异源启动子的控制下、同时保持原始pv和/或pvii完整或具有无效或缺失的原始pv和/或pvii的腺病毒。另选地,被置于异源启动子控制下的pv和/或pvii以及溶瘤腺病毒单独提供,但也可组合提供。此类腺病毒在细胞早期具有pv和/或pvii的表达,并促进腺病毒核酸包装到细胞囊泡中。
在另一个方面,本发明涉及pv和/或pvii用于将腺病毒或异源dna或异源蛋白或肽或它们的组合负载到细胞囊泡中的用途,其中任选地通过将异源蛋白或肽与pv和/或pvii融合而将这些蛋白或肽序列高水平加载到细胞囊泡中,从而提供细胞囊泡作为多种疾病的治疗剂。在将例如两种单独的重组核酸分子引入到细胞中后,细胞囊泡被分泌。一种核酸分子包含编码pv和/或pvii的基因,其任选地与治疗蛋白的序列融合,其中所述基因被置于异源启动子的控制下。另一种核酸分子包含在早期基因和/或异源基因中具有突变的腺病毒核酸。当引入到细胞中时,生产细胞分泌包含腺病毒核酸和/或异源基因的细胞囊泡。另选地,使用包含编码pv和/或pvii的基因以及任选地与治疗蛋白的序列融合的单个核酸分子,以及在早期基因和/或异源基因中具有突变的腺病毒核酸。不受理论的束缚,据信pv和/或pvii在细胞中由包含编码pv和/或pvii的基因的核酸表达,其中该基因被置于异源启动子下并促进核酸分子包装到细胞囊泡中。
如本文所用,术语“细胞囊泡”是指具有包封内部空间的膜的细胞衍生囊泡。其例如使用如下文和本文实施例中所述的根据本发明的方法来制备和/或获得。
如本文所用的细胞囊泡的一个优选示例为细胞外囊泡。细胞外囊泡(ev)是由尺寸通常在约50nm至1000nm范围内的脂质双层制成的细胞器,其从细胞分泌。它们通过质膜向外出芽(包括凋亡泡)或通过内体膜向内出芽而形成,从而产生多囊泡单元,其继而在与质膜(外来体)融合时释放囊泡。细胞外囊泡可通过以下方式制备:在合适的培养基中培养合适的生产细胞,将根据本发明的重组腺病毒核酸和任选的异源基因引入到细胞中,并收获细胞外囊泡。
另选地,负载的细胞囊泡也可通过的“破坏细胞和囊泡再形成”方案来产生,诸如hoogduijn等人2017(
因此,在一个优选的实施方案中,根据本发明的细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地裂解msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,根据本发明的细胞囊泡为细胞外囊泡。
异源启动子可为在天然存在的情况下不位于该特定位置和/或不驱动其所处位置前面的蛋白表达的任何类型的启动子。它可为异源生物体的启动子,诸如来自巨细胞病毒的启动子或在腺病毒和/或表达腺病毒核酸的宿主细胞中有功能的任何其他组成型启动子。蛋白v和vii中的一者或两者在细胞中的表达使得能够在细胞囊泡中包装与治疗蛋白部分融合的dna以及pv和/或pvii。
另选地,它可为腺病毒启动子,诸如中间启动子pix或任何早期腺病毒启动子。早期启动子是驱动所谓的早期基因(即,在病毒感染后首次表达的基因)的表达的启动子。通过将基因置于早期启动子的控制下,在病毒复制期间,这些基因首先被转录。因此,当将编码蛋白v和vii的基因置于早期启动子的控制下时,可实现病毒dna的有效堆积。
然而,当细胞被此类腺病毒颗粒感染时,仍然产生对于腺病毒体的制备冗余的衣壳(或外壳)蛋白。因此,在另一个另选的实施方案中,重组腺病毒核酸以不再能够产生主要衣壳蛋白中的一种或多种主要衣壳蛋白的方式突变。有利的是,此类腺病毒核酸允许产生不引起免疫应答的腺病毒物质。
有几种方法可以获得不能产生主要衣壳蛋白的重组腺病毒核酸。例如,核酸可被突变,使得编码主要外壳蛋白的晚期基因中的一种或多种晚期基因、优选地所有被完全或部分缺失。从生产经济学的角度来看,缺乏编码这些主要外壳蛋白的基因的腺病毒载体通过消除病毒基因组掺入到病毒颗粒中并促进病毒基因组掺入到ev中而使得系统更有效。此外,从腺病毒的基因组中去除冗余基因,使得实现异源基因的能力更高。
在一个另选的实施方案中,晚期基因的转录通过四环素控制的转录激活可逆地开启或关闭。在不存在四环素的情况下,tet阻遏物与tet操纵子的结合会阻断晚期基因的表达。此类阻遏在四环素或其某些衍生物诸如强力霉素的存在下逆转。因此,本发明还涉及其中晚期基因中的一种或多种晚期基因被置于表达调节子的控制下的重组腺病毒核酸,该表达调节子优选地为用于强力霉素诱导或可控基因表达的tet-on或tet-off系统。
此类腺病毒核酸的优点在于,例如在细胞培养物中,仍可利用晚期基因的表达,从而允许腺病毒有效复制,而例如当用于根据本发明的方法中时,晚期基因的表达可被关闭。
本发明的另一部分为根据本发明的重组腺病毒核酸,其中腺病毒核酸以不再能够被包装在腺病毒衣壳中的方式突变。这优选地通过loxp位点接侧腺病毒包装序列(psi)来实现。这导致psi序列的基于cre重组酶的缺失。cre-lox重组在本领域中是众所周知的,并且经常应用于产生无肠腺病毒构建体。因此,技术人员知道如何实现这一点。可使用导致包装基因的基于cre重组酶缺失的任何方法。合适的示例由parks等人(parksrj,chenl,antonm,sankaru,rudnickima,grahamfl.ahelper-dependentadenovirusvectorsystem:removalofhelpervirusbycre-mediatedexcisionoftheviralpackagingsignal.procnatlacadsciusa.,1996年11月26日;93(24):13565-70)描述。
在一个优选的实施方案中,病毒核酸包含上述突变的组合。因此,在一个实施方案中,本发明优选地涉及其中编码核蛋白v的基因和/或编码核蛋白vii的基因被置于异源启动子下的重组腺病毒核酸,该异源启动子优选地为早期腺病毒启动子、中间蛋白ix启动子或来自异源生物体(特别是巨细胞病毒)的启动子,以确保腺病毒体的有效形成,并且其中该腺病毒核酸以使得其不再能够产生主要外壳蛋白中的一种或多种主要外壳蛋白的方式突变,优选地涉及其中编码主要衣壳蛋白的晚期基因中的一种或多种晚期基因部分或完全缺失或者其中晚期基因中的一种或多种晚期基因被置于表达调节子的控制下的腺病毒核酸,该表达调节子优选地为用于强力霉素诱导或可控基因表达的tet-on或tet-off系统。
如在介绍段落中所讨论的,跟踪记录已证实腺病毒载体为充当将(大尺寸)异源基因递送到细胞中的强力载体。这种递送在病毒和异源序列不整合到宿主基因组中的情况下进行,这提供了附加的安全性。
此外,据显示腺病毒载体是有效的疫苗载体,其在诱导保护性免疫应答方面优于常见的疫苗载体诸如痘病毒载体、裸dna疫苗和α-病毒载体。因此,本发明还涉及用作异源基因的疫苗载体的腺病毒载体,该异源基因具有在受试者中诱导保护性免疫应答的能力。
本领域已知有几种方法将异源基因插入腺病毒dna中。例如,这可通过使用较新一代基因编辑方法(例如crispr-cas)和/或使用经典重组dna技术来实现。技术人员将知道如何这样做。
如本文所用,术语“异源基因”是指与腺病毒核酸异源的任何基因。原则上,可插入被认为有用的任何异源基因,诸如编码具有治疗效果的分子的基因、诱导保护性抗体滴度的基因或编码可用于报告(成像)目的的分子的基因。在一个优选的实施方案中,异源基因编码选自包含以下各项的组的生物分子:前药转化酶,优选地胸苷激酶;细胞因子,优选地gm-csf、il-2或il-12;检查点抑制剂,优选地靶向ctla-4或pd-1;激动性抗体或配体,以刺激免疫细胞,优选地靶向4-1bb、ox40或cd40;重组双特异性t细胞衔接子抗体,优选地bite;微rna、shrns、cas9导引rna、抑制蛋白激酶的肽和刺激抗肿瘤免疫应答的肽。
已引起相当关注的一组治疗基因为前药活化基因(也称为自杀基因)的组。此类基因编码催化(无毒)前药转化为(有毒)药物的酶。
在一个实施方案中,待插入的异源基因为编码单纯疱疹病毒胸苷激酶(hsv-tk)的基因。hsv-tk基因的转移使得细胞对用具有杀伤癌细胞的能力的物质诸如更昔洛韦的治疗敏感。
胸苷激酶参与更昔洛韦的磷酸化,更昔洛韦是一种核苷酸类似物,其在磷酸化时通过阻断dna复制而变成细胞毒性的,从而选择性地杀伤分裂细胞。此外,发现磷酸化的更昔洛韦的细胞毒性效应进一步扩散到紧邻的未转染细胞。因此,hsv-tk基因转移和更昔洛韦的施用特别适用于治疗实体瘤。(sandmair,a-m等人,cancergenetherapy,2000,7(3),413-421)。
此外,根据本发明的腺病毒核酸和细胞囊泡特别适用于治疗遗传障碍,该细胞囊泡优选地为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分,更优选地为包含或填充有该物质的细胞外囊泡。这些遗传障碍可为遗传性的或获得性的,但在任一种情况下,这些障碍都是由基因组中的异常引起的。根据异常情况,可引入功能性基因以校正或抑制缺陷基因。
因此,本发明还涉及其中插入了在遗传障碍中具有治疗活性或换句话讲有益效果的异源基因的重组腺病毒核酸。
具体地,本发明涉及腺病毒核酸,其中异源基因编码选自包含以下各项的组的生物分子:前药转化酶,优选地胸苷激酶或配体,诸如抑制蛋白激酶的肽;细胞因子,优选地gm-csf、il-2或il-12;检查点抑制剂,优选地靶向ctla-4或pd-1;激动性抗体或配体,以刺激免疫细胞、优选地抗肿瘤免疫应答,特别是靶向4-1bb、ox40或cd40;重组双特异性t细胞衔接子抗体,优选地bite;microrna、shrns;编码dna以校正缺陷基因的cas9导引rna。
如实施例中所示,蛋白v和vii促进另外的核酸分子掺入细胞外囊泡中。因此,作为将异源基因插入腺病毒核酸的替代形式,异源基因可与蛋白v和/或蛋白vii(优选地蛋白v和蛋白vii)或编码蛋白v和/或蛋白vii(优选地蛋白v和蛋白vii)的基因组合提供,但也可分开提供。在该实施方案中,异源基因可与根据本发明的其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下并且不包含早期腺病毒基因并且不包含编码病毒衣壳蛋白的基因的重组核酸组合。例如,异源基因可与根据本发明的除被置于异源启动子控制下的编码蛋白v和/或蛋白vii的基因之外不包含腺病毒核酸的重组核酸组合。
因此,本发明还提供了包含核酸分子和异源基因的细胞囊泡,该核酸分子包含其中编码蛋白v的基因和/或编码蛋白vii(优选地蛋白v和蛋白vii)的基因被置于异源启动子的控制下的重组腺病毒核酸。在一个优选的实施方案中,所述核酸不包含早期腺病毒基因并且不包含编码病毒衣壳蛋白的基因。在一个特别优选的实施方案中,所述核酸不包含除编码蛋白v和/或蛋白vii的基因之外的腺病毒核酸。所述异源基因可存在于与编码蛋白v的基因和/或编码蛋白vii的基因相同的核酸分子(诸如载体或质粒)上,或者异源基因可存在于与包含编码蛋白v的基因和/或编码蛋白vii的基因的核酸分子不同的核酸分子上。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。
本发明还涉及包含蛋白v和/或蛋白vii以及包含异源基因的核酸分子的细胞囊泡。任选地,所述蛋白v和/或蛋白vii、优选地蛋白v和蛋白vii与异源分子特别是治疗蛋白、成像蛋白或允许纯化的蛋白融合。这将在下文中进一步详述。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。
原则上,细胞囊泡可包含如上文所详述的被认为有用的任何异源基因,诸如编码具有治疗效果的分子的基因、诱导保护性抗体滴度的基因或编码可用于报告(成像)目的的分子的基因。
将治疗生物分子递送到受体细胞中的另一种方法为通过将病毒蛋白v和/或蛋白vii与异源蛋白特别是治疗蛋白、成像蛋白、允许纯化的蛋白、抑制蛋白激酶的肽或刺激抗肿瘤免疫应答的肽融合。
蛋白v和/或蛋白vii与成像蛋白的融合允许监测受试者中包含融合蛋白的腺病毒或细胞囊泡。基本上,任何可连接至蛋白v或蛋白vii的成像蛋白都可能是合适的。合适的成像分子的示例包括绿色荧光蛋白、红色荧光蛋白、用于磁性分离的亲和标签(诸如氧化铁)、snap标签或生物素酰化序列。连接所述蛋白可通过将蛋白v或蛋白vii的病毒基因与编码感兴趣的蛋白的核酸融合来进行。另外,可使用衔接子系统诸如链霉亲和素-生物素系统将蛋白与融合到衔接子标签的蛋白v或蛋白vii偶联。
成像蛋白,当如上所述与pv/pvii融合或作为来自腺病毒载体核酸的单一蛋白表达时,例如由cmv启动子或组织/细胞特异性启动子驱动,或甚至当包含在相同囊泡中但与腺病毒序列分开时,由于它们的荧光或磁性可在生物系统中被检测到,因此适用于疾病的检测或诊断或适用于监测颗粒的分布。因此,此类标记的腺病毒核酸也适合用作染料或标记分子。具体地,这些可在离体或体外系统诸如细胞和组织培养物中使用。一种有前景的应用是使用本发明的细胞囊泡作为标记组织或细胞培养物和类器官(即组织培养的类器官系统)的染料。在那里,它们可用于定位细胞特异性化合物、识别可能的药物靶标、在特定细胞类型中表达荧光颜色等。
成像设备可为适用于检测标记的任何成像设备。例如,为了检测荧光,可使用荧光显微镜、荧光激活细胞分选或紫外光。发光可用于检测诱导发光信号的标记,诸如萤火虫荧光素酶或海肾荧光素酶。为了检测磁性纳米颗粒或蛋白,可采用磁共振成像(mri)或合适的染色剂诸如锰过氧化物酶。标记也可为可用于将pv和/或pvii与相关dna一起下拉的标签。这种下拉可用于例如为溶瘤腺病毒的复制提供生物标志物。
因此,本发明的另一方面涉及用于检测腺病毒核酸的诊断方法,包括:
-向有需要的受试者施用根据本发明的重组腺病毒核酸或填充有根据本发明的重组腺病毒核酸的细胞囊泡;
-从所述受试者收获体液样品;
-对细胞囊泡中的腺病毒核酸进行定量。
蛋白v和/或蛋白vii与治疗蛋白的融合允许产生包含该治疗蛋白的细胞囊泡。此类细胞囊泡可用于治疗各种疾病,诸如感染疾病、癌症、衰老相关疾病,优选地阿尔茨海默病、帕金森氏病或关节炎,以及遗传障碍,特别是脑、肝脏、心脏和胃肠道的遗传障碍,如下文进一步详述。任何治疗蛋白都可与蛋白v和/或蛋白vii融合。示例为抑制蛋白激酶的肽和刺激抗肿瘤免疫应答的肽。在一个优选的实施方案中,所述治疗蛋白为肿瘤抗原蛋白或肿瘤抗原肽。包含与肿瘤抗原肽融合的蛋白v和/或蛋白vii的细胞囊泡尤其可用于治疗癌症。肿瘤抗原肽为通过肿瘤抗原蛋白的降解而生成的,其为对肿瘤具有特异性的蛋白。肿瘤抗原肽与mhci类抗原(hla抗原)结合,这些抗原被转运至细胞表面以作为抗原递呈。肿瘤可通过使用肿瘤抗原蛋白或肿瘤抗原肽作为所谓的癌症疫苗来治疗,以增强肿瘤患者中的肿瘤特异性ctl。在一个优选的实施方案中,细胞囊泡包含与治疗蛋白(优选地肿瘤抗原蛋白或肿瘤抗原肽)融合的蛋白v和/或蛋白vii、以及根据本发明的重组腺病毒核酸,该重组腺病毒核酸在早期基因中具有突变,优选地其中该突变为e1a区中的δ24突变和/或e1b区中的δ55k突变,更优选地其中该重组腺病毒核酸为条件复制型腺病毒和/或复制缺陷型腺病毒载体的腺病毒核酸。
在另一个实施方案中,本发明涉及在早期基因的核苷酸序列中具有突变的重组腺病毒核酸。此类突变可导致病毒复制缺陷,如腺病毒颗粒的情况一样,其中e1区,e1和e2区两者,e1和e4,e1、e2和e4,或所有早期基因缺失。另选地,早期基因中的特异性突变是已知的,诸如e1a基因中的δ24突变,其仅在癌细胞中引起病毒的特异性复制。此外,特异性突变还可包括引入器官特异性启动子,该器官特异性启动子使病毒对该特定器官诸如脑或前列腺具有特异性。因此,根据本发明并携带此类突变的腺病毒颗粒特别适用于癌症治疗。
优选地,本发明涉及在e1a区包含δ24突变和/或在e1b区包含δ55突变的重组腺病毒核酸,以及包含所述核酸的腺病毒颗粒。
在另一个优选的实施方案中,本发明涉及重组腺病毒核酸,其中该重组腺病毒核酸为条件复制型腺病毒和/或复制缺陷型腺病毒载体的腺病毒核酸,特别是溶瘤腺病毒载体。
在另一个实施方案中,本发明涉及包含重组腺病毒核酸的病毒颗粒,该重组腺病毒核酸具有整联蛋白识别基序诸如rgd序列(arg-gly-asp),其能够使病毒与整联蛋白家族的某些成员结合,这些成员充当病毒进入(哺乳动物)细胞的进入受体。优选地,rgd序列与纤维蛋白融合。
此外,本发明涉及包含根据本发明的任何重组腺病毒核酸的细胞囊泡。在一个实施方案中,本发明还涉及填充有根据本发明的重组腺病毒核酸的细胞囊泡。
在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。
还优选的是包含其中编码蛋白v的基因和/或编码蛋白vii的基因(优选地编码蛋白v和蛋白vii的基因)被置于异源启动子的控制下的重组腺病毒核酸的细胞囊泡。此类ev优选地还包含异源基因或另选地在早期基因中具有突变的腺病毒核酸。因此,本发明还包括细胞囊泡,该细胞囊泡包含
-包含其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸的核酸分子和异源基因;或
-包含其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸的核酸分子以及包含异源基因的核酸分子。
本发明还涉及细胞囊泡,该细胞囊泡包含蛋白v和/或蛋白vii,优选地蛋白v和蛋白vii;以及
-包含在早期基因中具有突变的重组腺病毒核酸的核酸分子;和/或
-异源基因。在一个优选的实施方案中,重组腺病毒核酸的早期基因中的突变为e1a区中的δ24突变和/或e1b区中的δ55k突变。在另一个优选的实施方案中,重组腺病毒核酸为条件复制型腺病毒和/或复制缺陷型腺病毒载体的腺病毒核酸。在一个实施方案中,包含在早期基因中具有突变的所述重组腺病毒核酸的所述核酸分子还包含异源基因。在另一个实施方案中,所述异源基因存在于与包含重组腺病毒核酸的核酸分子不同的核酸分子上。
原则上,细胞囊泡可包含如上文所详述的被认为有用的任何异源基因,诸如编码具有治疗效果的分子的基因、诱导保护性抗体滴度的基因或编码可用于报告(成像)目的的分子的基因。
与标准腺病毒载体相比,根据本发明的这些细胞囊泡(腺病毒体)构成了用作治疗递送媒介物的若干优点。由于它们的脂质双层包覆层,病毒dna在长距离上、深入组织中或在血脑屏障上的递送大大改善。此类效果尤其通过以下事实来实现:细胞囊泡允许屏蔽中和抗体,从而允许在系统中具有更长的循环时间。
此外,细胞囊泡为非免疫原性的,因此与常见病毒载体相比表现出较低的毒性。
因此,本发明的细胞囊泡适用于预防和治疗各种疾病。示例包括感染疾病、癌症、衰老相关疾病,优选地阿尔茨海默病、帕金森氏病或关节炎,以及遗传障碍,特别是脑、肝脏、心脏和胃肠道的遗传障碍。
优选地,本发明的细胞囊泡用于治疗或预防癌症、遗传障碍、感染疾病或年龄相关障碍。
因此,本发明还提供了用于治疗疾病特别是遗传障碍、癌症、感染疾病或衰老疾病的方法,该方法包括:
-向有需要的受试者施用根据本发明的细胞囊泡。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。
在癌症治疗中,细胞囊泡优选地包含条件复制型腺病毒和/或复制缺陷型腺病毒载体。在一个实施方案中,细胞囊泡包含根据本发明的其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸,该重组腺病毒核酸在早期基因中具有突变并且为条件复制型腺病毒和/或复制缺陷型腺病毒载体。在另选的实施方案中,该细胞囊泡包含:
-蛋白v和/或蛋白vii或被置于异源启动子的控制下的编码蛋白v的基因和/或编码蛋白vii的基因;以及
-在早期基因中具有突变的重组腺病毒核酸,该重组腺病毒核酸为条件复制型腺病毒和/或复制缺陷型腺病毒载体。在两种替代形式中,重组腺病毒核酸的早期基因中的突变优选地为e1a区中的δ24突变和/或e1b区中的δ55k突变。
还特别适用于治疗癌症的为根据本发明的其中蛋白v和/或蛋白vii与治疗蛋白、优选地肿瘤抗原蛋白或肿瘤抗原肽融合的细胞囊泡。此类细胞囊泡还可包含根据本发明的在早期基因中具有突变、任选地其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸。
在感染疾病、衰老相关疾病(优选地阿尔茨海默病、帕金森氏病或关节炎)和遗传障碍(特别是脑、肝脏、心脏和胃肠道的遗传障碍)的治疗中,而且还另选地在癌症的治疗中,根据本发明的细胞囊泡优选地包含异源基因。
在一个实施方案中,将异源基因插入根据本发明的其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸中。该重组腺病毒核酸可为下列中的任一个:
-腺病毒核酸,该腺病毒核酸在早期基因中具有突变并且其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下,优选地为条件复制型腺病毒和/或复制缺陷型腺病毒载体,或
-腺病毒核酸,其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下并且该腺病毒核酸不包含早期腺病毒基因并且不包含编码病毒衣壳蛋白的基因,优选地该腺病毒核酸不包含除编码蛋白v和/或蛋白vii的基因之外的腺病毒核酸。
在另一个实施方案中,异源基因存在于与包含其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的腺病毒核酸的核酸分子不同的核酸分子上。
在另一个实施方案中,细胞囊泡包含腺病毒蛋白v和/或蛋白vii以及异源基因,优选地该细胞囊泡包含腺病毒蛋白v和/或蛋白vii以及包含异源基因的核酸分子。
本发明还涉及产生根据本发明的细胞外囊泡的方法,该方法包括:
-在培养基中培养细胞;
-将根据本发明的重组腺病毒核酸引入到所述细胞中;
-收获包含或填充有重组腺病毒核酸的细胞外囊泡。
根据ev的治疗目的,该方法可使用多种细胞系来进行。合适的细胞系包括人胚胎视网膜(her)911、per.c6、间充质干细胞(msc)、神经干细胞(nsc)、hek293t、a549(肺上皮癌)和原代人成胶质细胞瘤细胞。
细胞可根据本领域已知的任何合适的方法来培养,技术人员将知道如何这样做。
细胞可使用适于生长的任何培养基进行培养。当在达尔伯克氏改良伊格尔培养基(dmem)或ns(神经球,无血清)培养基中培养细胞时,获得了特别好的结果。
可将多种添加剂添加到生长培养基以进一步支持细胞的生长。
为了获得最佳性能,在培养箱中优选地在37℃下培养细胞。
重组腺病毒核酸向细胞中的引入可以若干方式实现。
在一个实施方案中,根据本发明的重组腺病毒核酸可稳定整合到细胞的基因组中。整合可用本领域已知的任何合适的方法优选地通过慢病毒转导或crispr-cas来实现。在一个有利的实施方案中,重组腺病毒核酸的仅一部分整合到细胞的基因组中,并且核酸的其余部分通过其他方式(例如,作为质粒或通过细胞的病毒感染)递送到细胞中。在一个优选的实施方案中,将编码pv和pvii的基因整合到细胞的基因组中。以这种方式,关键蛋白pv和pvii由生产细胞高度表达,从而允许细胞中存在的(腺病毒)核酸的有效堆积。
另选地,还可通过转染将腺病毒核酸引入到细胞中。
此外,包含根据本发明的重组腺病毒核酸的细胞优选地保持在低氧(缺氧)或正常(常氧)氧气气氛下。细胞生长优选地在37℃或37℃下进行,伴随暂时的冷或暂时的热冲击。
因此,本发明还提供了包含根据本发明的重组腺病毒核酸的细胞,优选地her911、per.c6或hek293t细胞。这些细胞可用作产生包含重组腺病毒核酸的腺病毒颗粒或细胞外囊泡的生产细胞。优选地,在引入腺病毒核酸后,细胞连续地产生包含重组腺病毒核酸的腺病毒颗粒或细胞外囊泡持续无限量的时间,例如在引入腺病毒核酸后数周。
因此,本发明还涉及用于制备此类生产细胞的方法,该方法包括:
-在培养基中培养合适的细胞;
-将根据本发明的重组腺病毒核酸引入到所述细胞中。
因此,生产细胞包含其中编码蛋白v的基因和/或编码蛋白vii的基因被置于异源启动子的控制下的重组腺病毒核酸。重组核酸可作为质粒存在,或者其可稳定整合到细胞的基因组中。
本发明还包括用于产生细胞外囊泡的方法,该方法包括:
-在培养基中培养合适的细胞;
-将根据本发明的重组腺病毒核酸引入到所述细胞中;
-收获包含腺病毒核酸的细胞外囊泡。该方法的一部分可为验证细胞外囊泡是否含有腺病毒核酸的测定,诸如标记的蛋白v或蛋白vii的基于荧光的检测。换句话讲,此类测试将确定是否产生本发明的正常ev或腺病毒体。
细胞外囊泡包含腺病毒核酸(优选地在早期基因中具有突变)以及蛋白v和/或蛋白vii。
任选地,在该方法中,使包含重组腺病毒核酸的细胞经受细胞应激。通过此类步骤,引发细胞应激反应。原则上,“细胞应激”是指对细胞的任何不利的环境条件。细胞应激的示例包括:细胞感染,例如病毒感染,优选地用腺病毒感染;细胞照射;细胞暴露于毒素、化学药物,包括基因毒性药物和蛋白酶体抑制剂,诸如美法仑、硼替佐米、5-氟尿嘧啶、顺铂和多柔比星;细胞暴露于温差;细胞暴露于低氧条件;细胞暴露于渗透压休克;以及细胞暴露于氧化应激。在一个优选的实施方案中,所述细胞应激为细胞的病毒感染,优选地用野生型或重组腺病毒诸如条件复制型腺病毒和/或复制缺陷型腺病毒载体感染。
在将腺病毒核酸引入到细胞中之后,收获含有腺病毒核酸的ev。通常,在感染或转染后至少48小时后,通过从其中包含腺病毒核酸的细胞或细胞培养基中分离或提取来收获包含腺病毒核酸的ev。
在一个实施方案中,通过悬浮液的离心从上清液中分离ev。离心力将悬浮颗粒带到管的底部,在那里形成沉淀。为了获得良好的结果,将上清液在优选地约100.000xg的高速下离心60至120分钟,优选地70分钟。
任选地,首先离心上清液以从包含ev的上清液中除去较大的颗粒诸如细胞。另外,可将上清液通过合适的过滤器过滤,以除去较大的颗粒诸如细胞碎片。
在分离沉淀后,优选地将沉淀悬浮于合适的溶剂中,并任选地将悬浮液再次离心。再次分离沉淀,并可去除可能含有污染物诸如蛋白的溶剂。可使用任何合适的具有悬浮沉淀和溶解可能污染物的潜力的溶剂。用缓冲液诸如磷酸盐缓冲盐水(pbs)获得了特别好的结果。
然后将沉淀重悬于合适的溶剂中,优选地pbs中,并加载到碘克沙醇梯度上。离心后,分离包含含有腺病毒物质的ev的级分。
本发明还包括包含本发明的腺病毒颗粒或根据本发明的细胞囊泡以及药学上可接受的载体或媒介物的治疗组合物。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。
本发明还涉及用于治疗遗传障碍的方法,包括:
-向有需要的受试者施用根据本发明的治疗组合物、细胞囊泡或腺病毒颗粒。在一个优选的实施方案中,细胞囊泡为细胞外囊泡或来源于裂解细胞(优选地msc)的囊泡,并且包含来自所述细胞的质膜的组分。在一个特别优选的实施方案中,细胞囊泡为细胞外囊泡。
本发明提供了一种方法,其中ev可通过用根据本发明的腺病毒感染细胞离体产生。然后可将ev施用于受试者。在本发明的另一个目的中,直接向受试者提供如本文所述的腺病毒。然后这些病毒感染受试者的靶细胞,在受试者中形成细胞外囊泡并进一步分布在身体中。
施用模式可变化。施用途径包括口服、直肠、经粘膜、肠、肠胃外、肌内、皮下、皮内、髓内、鞘内、直接心室内、静脉内、腹膜内、鼻内、眼内、肿瘤内、吸入、吹入、局部、皮肤、经皮、动脉内、硬膜外或颅内。
在特定实施方案中,本发明的治疗组合物、腺病毒或细胞囊泡可通过侵入性途径诸如通过注射施用。在本发明的另外的实施方案中,本发明的治疗组合物、腺病毒或细胞囊泡通过静脉内、皮下、肌肉内、动脉内、颅内、硬膜外、肿瘤内或通过吸入、气溶胶递送施用。通过非侵入性途径(例如,口服;例如,在丸剂、胶囊或片剂中,局部、直肠)也在本发明的范围内。
临床医生例如使用本领域已知或疑似影响治疗的参数或因素来确定适当的剂量。一般来讲,剂量以略小于最佳剂量的量开始,并且此后以小增量增加,直到相对于任何负面副作用实现期望或最佳效果。重要的诊断量度包括例如炎症的症状或产生的炎性细胞因子的水平的那些。
根据本发明的治疗组合物、细胞囊泡或腺病毒颗粒可为液体或固体剂型。在使用液体剂型的情况下,其可包括喷雾、薄雾、悬浮液、溶液、乳液或气溶胶。固体剂型包括胶囊剂、片剂、颗粒剂、粉剂和凝胶剂。
本文所公开的治疗组合物、腺病毒颗粒和细胞囊泡可通过连续输注提供,或通过例如每日、每周1-7次、每周、每两周、每月、每两月、每季度、每半年、每年等施用的剂量来提供。每周总剂量一般至少为0.05μg/kg体重,更一般地至少为0.2μg/kg、0.5μg/kg、1μg/kg、10μg/kg、100μg/kg、0.25mg/kg、1.0mg/kg、2.0mg/kg、5.0mg/ml、10mg/kg、25mg/kg、50mg/kg或更高(参见例如yang等人(2003)newengl.j.med.349:427-434;herold等人(2002)newengl.j.med.346:1692-1698;liu等人(1999)j.neurol.neurosurg.psych.67:451-456;portielje等人(2003)cancerimmunol.immunother.52:151-144;willis等人frontcardiovasc.med.,2017,4,63)。还可提供剂量以实现受试者血清中腺病毒体或腺病毒颗粒的预定目标浓度,诸如0.1μg/ml、0.3μg/ml、1μg/ml、3μg/ml、10μg/ml、30μg/ml、100μg/ml、300μg/ml或更高、或者约108至1012μg/ml病毒颗粒。在其他实施方案中,本发明的腺病毒体或腺病毒颗粒以10mg/受试者、20mg/受试者、50mg/受试者、80mg/受试者、100mg/受试者、200mg/受试者、500mg/受试者、1000mg/受试者或2500mg/受试者例如通过口服或静脉内每周、每两周、“每4周”、每月、每两月或每季度施用。
如本文所用,术语“有效量”是指当单独施用或与附加治疗剂组合施用于细胞、组织或受治疗者时,有效引起疾病的一种或多种症状的可测量改善的本发明的腺病毒或细胞外媒介物的量。有效剂量还是指足以导致症状的至少部分改善例如肿瘤收缩、肝脏中酶产生恢复、颅内斑块积聚减少和记忆力改善、梗塞后心脏功能改善的腺病毒颗粒或腺病毒体的量。当作为单独施用的活性成分施用于个体时,有效剂量是指单独的该成分。当作为组合施用时,有效剂量是指产生治疗效果的活性成分的组合量,无论是组合施用、连续施用还是同时施用。有效量的治疗剂将导致诊断量度或参数改善至少10%、通常至少20%、优选地至少约30%、更优选地至少40%并且最优选地至少50%。在使用主观量度评估疾病严重程度的情况下,有效量也可导致主观量度的改善。
根据本发明的治疗组合物、腺病毒颗粒或腺病毒体可作为单一疗法或作为组合疗法递送。例如,腺病毒体或腺病毒颗粒可与常见抗癌剂诸如化学治疗剂、放射疗法、免疫检查点抑制剂、靶向小分子(例如激酶抑制剂或蛋白酶体抑制剂)组合施用。
本发明还涉及用于检测疾病的试剂盒。该试剂盒包含含有标记的腺病毒核酸的腺病毒颗粒和/或含有标记的腺病毒核酸的腺病毒体。另选地,该试剂盒包含根据本发明的治疗组合物、腺病毒颗粒或腺病毒体以及对病毒或可由病毒产生的异源化合物具有特异性的标记抗体。
实施例
实施例1:通过质谱法检测ev内的腺病毒核蛋白
将gs184细胞(原代成胶质细胞瘤细胞,得自erasmusmc,神经外科系)铺板于十个t175烧瓶中24h,然后用野生型hadv-5感染。将细胞作为单层在ns培养基(dmem-f12+成纤维细胞生长因子+内皮生长因子+肝素+b27+1%青霉素-链霉素)中的细胞外基质(ecm1:100的dpbs溶液,cultrex,sanbio)涂层上培养。将细胞用野生型人腺病毒5型(hadv-5)感染,其中moi为5个感染性颗粒/细胞。2小时后将培养基更新为ns培养基。感染后40小时收集上清液和细胞。如devrij,2013,nanomedicine(lond),8(9):1443-58中所述,使用基于碘克沙醇的密度梯度(以192,000g超速离心4小时)从细胞培养物上清液中分离ev。碘克沙醇梯度由三层组成:40%碘克沙醇作为底层(2ml),25%碘克沙醇作为中间层(6ml)和5%碘克沙醇作为顶层(2ml)(图1a)。先前示出ev集中在顶部与中间级分之间的界面区域中(devrij,2013,nanomedicine(lond),8(9):1443-58)。已知腺病毒颗粒集中在底部(40%碘克沙醇)级分处。使用针对腺病毒纤维蛋白和rab27a蛋白的抗体对碘克沙醇级分进行sds-page和western印迹(方案描述于devrij,2013,nanomedicine(lond),8(9):1443-58),这些抗体对外来体型的ev具有特异性(图1b)。使用devrij,2015,intjcancer,137(7):1630-42中所述的方案,对细胞沉淀和纯化的ev及病毒制剂进行质谱分析,以获得有关蛋白含量的深入信息(图1c)。简而言之,将样品溶解于50mm碳酸铵中的50μl裂解缓冲液(rapigesttm表面活性剂(1mgml-1;waterscorporation,ma))中。通过向每个样品中添加2ml0.5m二硫苏糖醇,然后在60℃下温育30分钟进行还原和烷基化。冷却至室温后,添加10ml的0.3m碘乙酰胺,然后在黑暗中温育30分钟。随后,向每个样品中添加在3mmtris-hcl溶液(在50mmnh-4hco3中以1:10稀释)中的1.5ml的100ngml-1金制胰蛋白酶(promega,madison,wi),然后在37℃下温育过夜。为了使胰蛋白酶失活,添加3ml的25%的三氟-酸性酸并将样品在37℃下温育30分钟。接下来,将样品在4℃下以10,000×g离心15分钟,并将上清液转移到经lc/ms认证的小瓶(waterscorporation)中。对于每个样品,在纳米液相色谱(nano-lc)系统(ultimate3000nano-lc系统,dionex,thermoscientific,amsterdam,thenetherlands)上测量总体积的一部分(10%)以确定相对浓度。基于这些测量,可调节每个单独样品的进样体积以允许等量消化样品的ms分析。使用具有orbitrapms平台(ltq-orbitrapxl,thermoscientific)的偶联纳米lc系统进行ms分析。从原始数据文件中提取ms质谱,并使用extract-msn(xcalibur(2.0.7版)的一部分,thermoscientific)将其转换成mascot通用格式(mgf)文件。数据文件由mascot(2.3版;matrixscience,london,uk)针对为智人和病毒蛋白选择的uniprotswiss-prot数据库进行搜索。如图1c所示,在细胞和病毒中检测到病毒衣壳和核蛋白两者。然而,ev似乎仅含有丰富存在的核蛋白(v和vii)。
实施例2:通过pcr在ev中检测溶瘤腺病毒dna,并且ev能够感染细胞
在用条件复制腺病毒(crad)ad.5.d24.rgd.gfp(moi=1个感染性颗粒/细胞)感染之前24h,将gs756细胞铺板于两个t175烧瓶中。(virusdetailsincludinggenomicconstructionareprovidedinbalvers,2014,viruses,6(8),3080-3096。)72小时后,收集上清液以用于ev分离。进行低速离心以除去细胞和细胞碎片(150×g持续5分钟加上3000×g持续20分钟),然后以100.000×g超速离心70分钟以沉淀ev和病毒颗粒。对沉淀进行碘克沙醇密度梯度离心,并如上所述分离碘克沙醇级分。
为了确定每个级分内的ev的量,制备用于ev-quant分析的样品。为此,将样品与标记ev的膜的红色荧光染料(最终浓度为0.33ng/μl的若丹明)一起温育。接下来,将ev固定(通过添加temed双丙烯酰胺和aps双丙烯酰胺(1:1))在具有玻璃底部的96孔板中,然后使用共焦显微镜(operaphenix系统,perkinelmer)采集图像。囊泡的膜标记可被可视化为红点。将从opera系统获得的数据在microsoftexcel模板中进行转换,以提供ev计数值和ev浓度。使用graphpadprism6.0绘制曲线图,示出顶部级分中的ev(图2a)。
为了检测ev中病毒基因组的存在,进行定量pcr(qpcr)。为了检测病毒dna,使用与病毒纤维蛋白序列结合的引物(hadv5_fiber_forprim1,序列:caaggacccctcacagtgtc);hadv5_fiber_revprim1,序列:agggtactgctatcggtggt)。使用标准pcr扩增设置,用appliedbiosciencesybrgreen方法进行qpcr。腺病毒log(10)拷贝数通过生成标准曲线来确定,该标准曲线从全长腺病毒dna(线性化病毒基因组)的系列稀释度中得出。基于所生成的标准曲线将ct值转换为log(10)拷贝数,所有样品均双份测量。使用graphpadprism6.0对数据进行绘图,示出在底部(如预期的)但也在顶部存在病毒dna(图2b)。
对于所有碘克沙醇级分,通过将这些级分暴露于a549肺癌细胞来评估感染性。在感染后72小时,进行荧光显微镜检查以确定感染性,如通过gfp阳性细胞的百分比所测量的。通过添加nucbluetm染色剂(thermofisherscientific)促进总细胞数目的计数。使用imagej软件(fiji)进行细胞计数,其显示ev感染细胞的能力(图2c)。
实施例3:ev-quant证明在用pv.gfp病毒感染细胞后pv.gfp掺入ev
将细胞(gs184、gs562、a549和her911)铺板于48孔板上24h,然后用带有绿色荧光蛋白附着于pv蛋白的腺病毒(pv.gfp)感染。在100μl培养基/孔(用于gs184和gs562的ns培养基和用于her911/a549的血清培养基)中,用50个病毒颗粒/细胞的moi感染细胞。(血清培养基:达尔伯克氏改良伊格尔培养基+10%胎牛血清(fbs)+1%青霉素-链霉素)。对于每个细胞系,在2h后将培养基更新为ns培养基、仅dmem培养基和血清培养基。(通过以100,000xg超速离心16h从牛ev预清除血清培养基)。对于所有细胞系,每种培养基条件使用一式三份。感染后64小时收集上清液,并以500xg离心10分钟以除去细胞碎片。对143μl的所有上清液进行ev-quant分析。在gfp与pv蛋白融合的情况下,预期病毒颗粒将在ev-quant测定中表现为绿点。此外,将样品与标记ev的膜的红色荧光染料一起温育。
因此,腺病毒体可被可视化为红点和绿点的组合(由软件伪着色为黄点)。因此,使用ev-quant测定对三种类型的颗粒进行定量:仅红色(空ev)、仅绿色(病毒)、红色+绿色(黄色)(腺病毒体)(图3a)。在gs184细胞感染后64h,在上清液中检测到大量的腺病毒体。(图3b)。还发现,不同细胞类型(gs562、her911、a549)发生腺病毒体分泌,并且培养基的类型可影响腺病毒体分泌,例如,对于在无血清的dmem中培养的her911细胞,产量增加(图3c)。最后,证明细胞上清液中的腺病毒体浓度随时间推移而增加(图3d)。
实施例4:腺病毒体的生物标志物潜力:将腺病毒体水平与溶瘤病毒感染性相关联
用pv-gfp腺病毒感染四种不同的gs培养物,并评估细胞的感染是否与腺病毒体的分泌相关(图4)。在感染后六天,通过ev-quant测定腺病毒体水平,并通过基于发光atp的细胞活力测定(celltiterglo,promega)测量细胞活力。用光度计(infinitem200tecan读取器)测量发光。使用graphpadprism进行线性回归分析和统计测试。
据发现,在感染癌细胞后,腺病毒体水平与腺病毒的感染性水平相关,这是腺病毒体浓度与细胞活力之间的强负相关性的证据(图4a和图4b)。这为腺病毒体作为生物标志物平台开辟了机会。
实施例5:来自ad5.d24.rgd.gfp的腺病毒体和病毒级分对神经球的感染
用cradad5.d24.rgd.gfp感染her911细胞(六个t175烧瓶,在含血清的dmem培养基中生长)。2h后,用dmem无血清培养基更新培养基。48h后,使用基于碘克沙醇的标准程序(如上所述)将腺病毒体与病毒颗粒分离。收集梯度的顶部级分(4ml)和底部级分(4ml)。将各级分加上6mlpbs/级分通过amicon100kd离心过滤器以浓缩颗粒,得到200μl的终体积。在将样品添加到神经球之前,确定单层gs细胞上的感染性颗粒滴度。神经球由gs940原发性肿瘤细胞建立(每孔一个球),并且当它们7日龄时用腺病毒体和病毒颗粒以相等的感染性滴度感染。感染后第6天进行共焦显微镜检查,以分析神经球内部的gfp表达。对于腺病毒体和病毒颗粒,gfp表达的深度看起来相似(图5)。
实施例6:pv.pvii的异源表达导致dna向ev中的掺入增强
将her911细胞铺板于四个t75烧瓶中的血清培养基中。一天后,将细胞用最大制备的dna质粒转染(fugene6方案,其中将850μl培养基+34μlfugene+17μgdna添加到10ml培养基中):两个装有puc57.cmv.crimson_cmv.egfp的烧瓶和两个装有puc57.cmv.crimson-pvii_cmv.egfp-pv的烧瓶(参见图6a)。在合成dna质粒后,进行测序作为质量控制。pv和pvii的序列来源于野生型hadv-5基因组序列。在荧光标签序列(egfp和crimson)和pv/pvii之间,在编码柔性接头(aacggcggagggagc)的框架中引入一个序列。转染后一天,通过显微镜法(nikonwide-field显微镜)在细胞中观察到egfp和crimson(红外)的荧光,在所有情况下转染效率均为约70%。感兴趣的是,在整个细胞中观察到egfp和crimson是均一的(如预期的),而egfp-pv和crimson-pvii信号表现为点。所有烧瓶中的细胞均未显示任何应激/细胞活力丧失的迹象,这也未显示pv/pvii蛋白的毒性。转染后一天,将细胞用野生型hadv-5(moi=5个感染性单位/细胞)感染细胞2h,之后将培养基替换为仅dmem培养基。感染后一天,感染的第一迹象变得明显,这显著地仅可见于装有含crimson-pvii_.egfp-pv的细胞的烧瓶。对于装有含crimson_egfp的细胞的烧瓶,感染在两天后变得明显,这是hadv-5感染的标准。在感染后三天,收获得自四个烧瓶的上清液,并使用基于碘克沙醇的标准程序(如上所述)分离ev。(ev在级分4至7中)。进行qpcr(如上所述)以分析ev中dna的负载。这清楚地表明pv/pvii的异源表达进一步加强了病毒基因组dna的掺入(图6b,上图)。此外,还观察到puc57dna的掺入增加,这不仅需要puc57质粒的存在,而且还需要在这种情况下与腺病毒感染有关的附加因子(图6b,下图)。对于使用pv/pvii作为溶瘤腺病毒内部包装模块的重要性,蛋白模块的表达不会不利地干扰病毒产量,并且病毒的产量甚至略微增加。
- 还没有人留言评论。精彩留言会获得点赞!