一种抗LAG-3单克隆抗体的纯化方法与流程
一种抗lag-3单克隆抗体的纯化方法
技术领域
1.本发明涉及生物医药技术领域,特别涉及一种抗lag-3单克隆抗体的纯化方法。
背景技术:
2.lag-3(淋巴细胞激活基因3,lymphocyte activation gene-3,lag-3,cd223)是一种免疫检查点受体蛋白,它是免疫球蛋白家族中一个重要的负性共刺激分子,并且影响t细胞功能。正常情况下,lag-3主要通过与mhcii配体结合,介导负性信号,调节t细胞增殖和功能,维持机体t细胞的稳态。在肿瘤环境中,lag-3可通过抑制具有抗肿瘤活性的cd8+t细胞的增殖,直接影响其免疫功能。此外,lag-3表达聚集在肿瘤病灶的treg细胞,抑制细胞毒性t细胞。因此,lag-3逐渐被认为是一个颇有潜力的免疫检查点受体,并且临床前证据表明针对该靶点的抗体药物将来有可能成为重要的抗肿瘤药物。
3.目前以lag-3为靶点的药物全球尚无上市,临床在研的药物有二十多个,面对激烈的竞争,产品质量及生产成本都成为市场的焦点。因此,抗lag-3单克隆抗体的制备生产过程越来越受到关注,其中纯化工艺尤为重要。
4.常规的抗体药物制备工艺主要包括抗体捕获和精制纯化两个阶段,由于细胞培养过程中,细胞分泌、破碎后产物复杂,一般采用三步层析法。发酵液上清经亲和层析粗纯后,料液成分仍较复杂,含聚体、宿主dna、宿主细胞蛋白等多种杂质,一般还需经阴离子交换、阳离子交换层析和疏水作用层析进一步除杂。但每一步层析结束后均需通过换液或调整缓冲液来适应下一步的纯化条件,在批量生产中,过多的中间操作步骤很有可能面临新杂质引入的风险,同时生产时间较长,生产成本较高,同时还有可能影响回收率,此外,虽然层析过程中使用的蛋白a层析树脂用于捕获单克隆抗体时,可以清除大部分来自细胞培养液的杂质,但是仍有少量的一种或多种杂质由于与蛋白a树脂非特异结合而无法被清除,因此,急需开发一种能够专门适用于本发明提供的抗lag-3单克隆抗体的纯化方法。
技术实现要素:
5.现有的纯化方法复杂,不仅延长了纯化时间,而且有可能面临新杂质引入的风险,影响回收率,同时还会增加成本,为此,本发明公开了一种抗lag-3单克隆抗体的纯化方法。
6.本发明具体技术方案如下:
7.本发明提供了一种抗lag-3单克隆抗体的纯化方法,所述纯化方法包括以下步骤:
8.s1、亲和层析:
9.s11、使用1-5cv的缓冲液a对亲和层析柱进行平衡,所述亲和层析柱的介质包括mabselect sure、mabselect sure lx、mabselect prisma或eshmuno a中的一种,所述缓冲液a包括tris-hcl缓冲液、hepes缓冲液、磷酸盐缓冲液,所述缓冲液a的电导率为,15-25ms/cm,且所述缓冲液a的ph为7-8;
10.s12、将含有抗lag-3单克隆抗体的细胞上清液以100-300cm/h的流速上样至所述亲和层析柱上,上样载量为20-60mg蛋白/ml树脂,所述亲和层析柱的柱床高度为18-22cm;
11.s13、上样结束后,使用所述缓冲液a进行再平衡,待紫外信号平稳后,使用1-5cv的缓冲液b进行第一次的中间淋洗,直至紫外吸收值的曲线降至平稳后,停止冲洗,再使用2-5cv的所述缓冲液a进行第二次淋洗,所述缓冲液b的浓度为30-60mm,其ph为5-9,;
12.s14、使用缓冲液c对所述亲和层析柱进行洗脱,当所述紫外吸收值上升至100mau时,开始收集蛋白溶液,当所述紫外吸收值降至100mau时结束收集,备用,所述缓冲液c的浓度为20-200mm,其ph为3-4;
13.s15、使用酸溶液将收集的所述蛋白溶液的ph值调节至3.5-3.7,并在此ph条件下室温孵育0.5-2.5h,最后用1m的tris缓冲液将所述蛋白溶液的ph回调至5-7;
14.s2、阴离子交换层析:
15.s21、使用3-5cv的缓冲液d对阴离子交换层析柱进行平衡,待紫外吸收值、ph值和电导率的曲线同时降至平稳后,将亲和层析后的所述蛋白溶液以100-200cm/h的流速上样至所述阴离子交换层析柱上,其上样载量为50-150mg蛋白/ml树脂,所述阴离子交换层析柱的柱床高度为20-24cm,所述缓冲液d的ph为5.0-7.0;
16.s22、当所述蛋白溶液全部上样完成后,继续使用所述缓冲液d洗脱,待所述紫外吸收值上升至100mau时,开始收集流穿液,直至紫外吸收值降到基线,结束收集。
17.本发明根据抗lag-3单克隆抗体的特点专门为其设计两步层析纯化方法,整个纯化方法的操作步骤简单,层析过程中无需使用过多的缓冲液冲洗,避免引入杂质,此外,在本发明中,步骤s13中,在蛋白溶液洗脱之前通过两次不同缓冲液的淋洗,能够去除与亲和层析柱介质非特异性结合的一种或多种hcps杂质,避免了杂质与蛋白溶液共洗脱,本发明中通过洗脱、捕获之后的蛋白溶液可以直接用于后续纯化操作,无需蛋白溶液稀释、换液等预处理过程,大大节省了纯化时间,提高了回收率,节省了经济成本,能够适用于批量生产。
18.进一步的,步骤s1中,所述抗lag-3单克隆抗体包括重链可变区和轻链可变区,所述重链可变区包括3个重链互补决定区,3个所述重链互补决定区分别用hcdr1、hcdr2和hcdr3表示,所述轻链可变区包括3个轻链互补决定区,3个所述轻链互补决定区分别用lcdr1、lcdr2和lcdr3表示,所述单克隆抗体或其抗原结合片段选自以下任意一种:
19.a-1:所述重链互补决定区hcdr1包含如seq id no:1所示的氨基酸序列,所述重链互补决定区hcdr2包含如seq id no:2所示的氨基酸序列,所述重链互补决定区hcdr3包含如seq id no:3所示的氨基酸序列,所述轻链互补决定区lcdr1包含如seq id no:4所示的氨基酸序列,所述轻链互补决定区lcdr2包含如seq id no:5所示的氨基酸序列,所述轻链互补决定区lcdr3包含如seq id no:6所示的氨基酸序列;
20.a-2:所述重链互补决定区hcdr1包含如seq id no:1所示的氨基酸序列,所述重链互补决定区hcdr2包含如seq id no:2所示的氨基酸序列,所述重链互补决定区hcdr3包含如seq id no:3所示的氨基酸序列,所述轻链互补决定区lcdr1包含如seq id no:4所示的氨基酸序列,所述轻链互补决定区lcdr2包含如seq id no:7所示的氨基酸序列,所述轻链互补决定区lcdr3包含如seq id no:8所示的氨基酸序列;
21.a-3:所述重链互补决定区hcdr1包含如seq id no:9所示的氨基酸序列,所述重链互补决定区hcdr2包含如seq id no:10所示的氨基酸序列,所述重链互补决定区hcdr3包含如seq id no:11所示的氨基酸序列,所述轻链互补决定区lcdr1包含如seq id no:12所示的氨基酸序列,所述轻链互补决定区lcdr2包含如seq id no:13所示的氨基酸序列,所述轻
链互补决定区lcdr3包含如seq id no:14所示的氨基酸序列;
22.a-4:所述重链互补决定区hcdr1包含如seq id no:15所示的氨基酸序列,所述重链互补决定区hcdr2包含如seq id no:16所示的氨基酸序列,所述重链互补决定区hcdr3包含如seq id no:17所示的氨基酸序列,所述轻链互补决定区lcdr1包含如seq id no:18所示的氨基酸序列,所述轻链互补决定区lcdr2包含如seq id no:19所示的氨基酸序列,所述轻链互补决定区lcdr3包含如seq id no:20所示的氨基酸序列。
23.本发明中公开的抗lag-3单克隆抗体能够与lag-3特异性结合,结合活性更好,阻断lag-3则可以逆转lag-3对t细胞的抑制作用,增强t细胞活性,并减少调节性t细胞数量,还可以提高t细胞免疫应答的敏感度,从而用于治疗免疫或癌症疾病。
24.进一步的,所述抗lag-3单克隆抗体为嵌合抗体分子,所述嵌合抗体分子包括鼠源抗体可变区和人源抗体恒定区,所述鼠源抗体可变区选自以下任意一种:
25.ma-1:所述重链可变区包含如seq id no:21所示的氨基酸序列,所述轻链可变区包含如seq id no:22所示的氨基酸序列;
26.ma-2:所述重链可变区包含如seq id no:21所示的氨基酸序列,所述轻链可变区包含如seq id no:23所示的氨基酸序列;
27.ma-3:所述重链可变区包含如seq id no:24所示的氨基酸序列,所述轻链可变区包含如seq id no:25所示的氨基酸序列;
28.ma-4:所述重链可变区包含如seq id no:26所示的氨基酸序列,所述轻链可变区包含如seq id no:27所示的氨基酸序列;
29.优选的,所述鼠源抗体可变区为ma-1。
30.进一步的,所述人源抗体恒定区包括人源抗体重链恒定区和人源抗体轻链恒定区,所述人源抗体重链恒定区为人的igg1型、igg2型或igg4型中的一种,所述igg1型的重链恒定区氨基酸序列如seq id no:39所示,所述igg2型的重链恒定区氨基酸序列如seq id no:40所示,所述igg4型的重链恒定区氨基酸序列如seq id no:41所示;所述人源抗体轻链恒定区为氨基酸序列如seq id no:42所示的人的ck链;
31.优选的,所述人源抗体重链恒定区为人的igg4型。
32.嵌合抗体分子包括鼠源抗体分子的可变区序列和人抗体恒定区,嵌合抗体分子的设计用于验证本发明人源化后没有改变cdr的功能,为人源化抗体分子的研究提供了进一步的研发基础。
33.进一步的,所述抗lag-3单克隆抗体为人源化抗体分子,所述人源化抗体分子选自以下任意一种:
34.ha-1:所述重链可变区包含如seq id no:33所示的氨基酸序列,所述轻链可变区包含如seq id no:34所示的氨基酸序列;
35.ha-2:所述重链可变区包含如seq id no:33所示的氨基酸序列,所述轻链可变区包含如seq id no:35所示的氨基酸序列;
36.ha-3:所述重链可变区包含如seq id no:36所示的氨基酸序列,所述轻链可变区包含如seq id no:35所示的氨基酸序列;
37.ha-4:所述重链可变区包含如seq id no:36所示的氨基酸序列,所述轻链可变区包含如seq id no:34所示的氨基酸序列;
38.ha-5:所述重链可变区包含如seq id no:37所示的氨基酸序列,所述轻链可变区包含如seq id no:38所示的氨基酸序列;
39.优选的,所述人源化抗体分子为ha-1。
40.本发明通过人源化筛选后得到了人源化抗体分子,通过体内外的实验验证发现本发明中提供的5种人源化抗体分子中,ha-1的活性较高,药效最为显著,为此本发明优选ha-1。
41.进一步的,所述人源化抗体分子还包括重链恒定区和轻链恒定区,所述重链恒定区为人的igg1型、igg2型或igg4型中的一种,所述igg1型的重链恒定区氨基酸序列如seq id no:39所示,所述igg2型的重链恒定区氨基酸序列如seq id no:40所示,所述igg4型的重链恒定区氨基酸序列如seq id no:41所示,所述轻链恒定区为氨基酸序列如seq id no:42所示的人的ck链;
42.优选的,所述重链恒定区为人的igg4型。
43.进一步的,步骤s11中,使用3cv的缓冲液a对亲和层析柱进行平衡,所述亲和层析柱的介质为mabselect prisma,所述缓冲液a为浓度为30-60mm的tris-hcl缓冲液,所述缓冲液a的ph为7.2-7.8,所述缓冲液a的电导率为18ms/cm;
44.优选的,所述缓冲液a为浓度为50mm的tris-hcl缓冲液,所述tris-hcl缓冲液中含有120-160mm的添加剂,所述添加剂为nacl。
45.本发明通过大量的实验条件摸索,发现mabselect prisma是耐高浓度碱的亲和介质,可增强捕获纯化过程中的生物污染控制能力,且具有基架稳定、使用寿命长、配基脱落少等优点,比较适用于抗lag-3单克隆抗体,此外,缓冲液a主要用于冲洗非特异性结合的杂质,tris-hcl缓冲液能够保证抗lag-3单克隆抗体蛋白的稳定性,同时氯化钠的添加可以防止融合蛋白从层析柱中流穿,从而使柱子能够结合目的蛋白,洗脱除去杂蛋白,同时,为了适应抗lag-3单克隆抗体蛋白的等电点,本发明限定了缓冲液a的ph,在该ph范围内,缓冲液a的缓冲能力更高,同时设定电导率为15-20ms/cm能够提高纯化效率。
46.进一步的,步骤s12中,所述流速为150-200cm/h,所述上样载量为40mg蛋白/ml树脂。
47.进一步的,步骤s13中,上样结束后,使用所述缓冲液a进行再平衡,待紫外信号平稳后,使用3-5cv的缓冲液b进行第一次的中间淋洗,直至紫外吸收值的曲线降至平稳后,停止冲洗,再使用3cv的所述缓冲液a进行第二次淋洗,其中,所述缓冲液b包括tris-hcl缓冲液、hepes缓冲液缓冲液、磷酸盐缓冲液、柠檬酸盐缓冲液、醋酸盐缓冲液中的一种;
48.优选的,所述缓冲液b为50mm的tris-hcl缓冲液,其ph为7.4-7.8,所述tris-hcl缓冲液含有0.005-2m的添加剂,所述添加剂包括以下至少一种:尿素、盐酸胍、吐温80、异丙醇、精氨酸、nacl和edta;
49.优选的,所述添加剂为1m的盐酸胍。
50.两次淋洗能够将与亲和层析柱非特异性结合的杂质再次去除,避免了杂质与蛋白溶液共洗脱,此外,缓冲液b中优选的加入盐酸胍能够降低宿主细胞蛋白(hcp)同抗体及填料基质间的相互作用,最大限度的在亲和纯化步骤中降低hcp的含量,从而减轻后续纯化步骤的压力。
51.进一步的,步骤s14中,所述缓冲液c为甘氨酸-盐酸盐缓冲液、柠檬酸盐缓冲液或
醋酸盐缓冲液中的一种或多种混合,所述缓冲液c的浓度为50mm,其ph为3.6;
52.优选的,所述缓冲液c为醋酸盐缓冲液。
53.缓冲液c为洗脱液,该缓冲液c优选的为醋酸盐缓冲液,能够使抗体的稳定性提高,减少多聚体的产生,既不影响抗体的活性,同时可以提高蛋白溶解性,可大大提高产品的回收率。
54.进一步的,步骤s15中,所述酸溶液包括柠檬酸、乙酸、盐酸,孵育时间为1-2h。
55.进一步的,步骤s21中,所述阴离子交换层析柱的介质包括capto q、capto adhere、poros xq或eshmuno q,所述缓冲液d为含有0.1-0.4mol/l nacl的磷酸盐缓冲液;
56.优选的,所述阴离子交换层析柱的介质为capto adhere,所述上样载量为100-120mg蛋白/ml树脂。阴离子交换层析柱介质选择使用capto adhere能够用于精细纯化蛋白,其基质是高流速琼脂糖,功能基团n-苄基-n-甲基乙醇胺提供了多种交互方式,其中最显著的是离子相互作用、氢键和疏水相互作用,对于抗体的各种聚集体、部分酸性和碱性电荷异构体具有独特而高效的去除能力,同时还可有效去除残留蛋白a、宿主细胞蛋白、宿主dna、内毒素等杂质,对残留的dna具有显著的去除效果,确保最终蛋白液的残留dna符合质量标准。
57.本发明的有益效果如下:本发明提供了一种专门针对抗lag-3单克隆抗体的纯化方法,通过亲和层析捕获目的蛋白,阴离子交换层析去除聚集体及残留杂质。将亲和层析和capto adhere结合起来,通过两步法即可实现对目标抗体的精纯获得最终质量符合要求的抗lag-3单克隆抗体。该方法相对于传统方法而言,本发明易于中试放大生产,适宜连续流工艺生产,工艺衔接顺畅,且处理量高,抗体纯度高,回收率高,减轻工作强度、降低生产成本,缩短工艺周期;此外,本发明中公开的抗lag-3单克隆抗体能够特异性结合lag-3,亲和力较高,且具有很好的生物学活性,能够用于治疗多种癌症或者免疫疾病,癌症包括但不限于白血病、肺癌、胃癌、食道癌、卵巢癌、头颈癌、黑色素瘤、肾癌、乳腺癌、结直肠癌、肝癌、胰腺癌或膀胱癌,免疫疾病包括但不限于银屑病、克罗恩病、类风湿性关节炎、原发性胆汁性肝硬化、系统性红斑狼疮、多发性硬化症、溃疡性结肠炎和自身免疫性肝炎。
附图说明
58.图1为本发明实施例3中pscfv-disb-hs载体的质粒图谱;
59.图2为本发明实施例4中梯度稀释elisa抗lag-3噬菌体单克隆抗体相对亲和力的比较图;
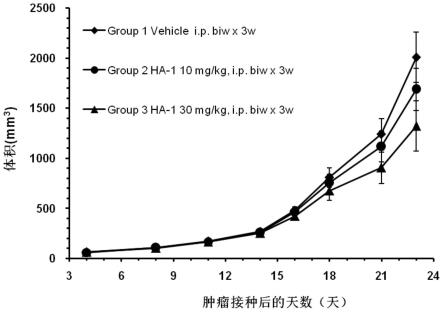
60.图3为本发明实施例6中载体ptse的图谱;
61.图4为本发明实施例6中鼠源抗体分子的变性聚丙烯酰胺凝胶电泳图;
62.图5为本发明实施例7中鼠源抗体与lag-3的结合能力比较图;
63.图6为本发明实施例8中鼠源抗体在混合淋巴细胞反应中对细胞因子il-2分泌情况图;
64.图7为本发明实施例13中人源化抗体分子的变性聚丙烯酰胺凝胶电泳图;
65.图8为本发明实施例14中人源化抗体分子与lag-3的结合能力比较图;
66.图9为本发明实施例15中混合淋巴细胞反应(mlr)测试抗lag-3人源化抗体分子活性;
67.图10为本发明实施例16中抗lag-3单克隆抗体对小鼠体内mc38结直肠癌的抑制试验效果图;
68.图11为本发明实施例17中抗lag-3单克隆抗体ha-1蛋白分子热稳定性评价图。
69.图12为本发明实验一中蛋白收率、蛋白纯度及主峰含量的模型拟合图;
70.图13a为本发明实验一中蛋白收率因子系数图;
71.图13b为本发明实验一中蛋白纯度因子系数图;
72.图13c为本发明实验一中主峰含量因子系数图;
73.图14为本发明实验一中ph=6.0时蛋白收率的响应曲面图,纵坐标为上样载量,横坐标为nacl浓度;
74.图15为本发明实验一中ph=6.0时蛋白纯度的响应曲面图,纵坐标为上样载量,横坐标为nacl浓度;
75.图16为本发明实验一中ph=6.0时主峰含量的响应曲面图,纵坐标为上样载量,横坐标为nacl浓度。
具体实施方式
76.为了更加容易理解本发明,描述实施例之前,先对本发明某些技术和科学术语作以下说明:
77.本文所使用的术语“lag-3”是指淋巴细胞活化因子3,这里的lag-3包括但不限于活化的t细胞、nk细胞和b细胞表面上的二聚物表达的lag-3(例如本领域公知的cd223)和人血清中发现的lag-3的可溶形式,在本文中均称为lag-3。
78.本文所使用的术语“抗体”,包含全抗体及其任一抗原结合片段,抗体包括鼠源抗体、人源化抗体、双特异抗体或嵌合抗体,抗体可以是天然存在的抗体也可以是通过改变(例如突变、缺失、置换等)的抗体。
79.本文所使用的术语“可变区”和“恒定区”,即为抗体重链和轻链靠近n段的序列区为可变区(v区),靠近c段的其余氨基酸序列相对稳定,为恒定区(c区),可变区包括3个互补性决定区(cdr)和4个框架区(fr),每条轻链可变区和重链可变区均有3个cdr区和4个fr区组成,重链的3个cdr区分别通过hcdr1、hcdr2和hcdr3表示,轻链的3个cdr区分别通过lcdr1、lcdr2和lcdr3表示。
80.本文所使用的术语“鼠源抗体分子”,其来源是用lag-3抗原免疫注射小鼠后得到的抗体。
81.本文所使用的术语“嵌合抗体分子”,是将鼠源抗体的可变区与人源抗体的恒定区融合而成的抗体,可以减轻鼠源抗体在人体内诱发的免疫应答反应。嵌合抗体是利用dna重组技术,将鼠源单抗的轻、重链可变区基因插入含有人抗体恒定区的表达载体中,这样表达的抗体分子中轻重链的可变区是鼠源的,而恒定区是人源的,整个抗体分子的近2/3部分都是人源的。这样产生的抗体,减少了鼠源抗体的免疫原性,同时保留了亲本抗体特异性结合抗原的能力。
82.本文所使用的术语“人源化抗体分子”,其是将鼠源单抗的cdr移植至人源抗体可变区,替代人源抗体cdr,使人源抗体获得鼠源单抗的抗原结合特异性,同时减少其异源性。
83.下面结合以下实施例对本发明作进一步详细说明。
84.实施例1
85.本发明实施例1提供了一种抗lag-3单克隆抗体的纯化方法,纯化方法包括以下步骤:
86.细胞澄清:采用离心或深层过滤的方式对含有抗lag-3单克隆抗体的细胞液进行澄清;
87.s1、亲和层析:
88.s11、使用1cv的缓冲液a对亲和层析柱进行平衡,亲和层析柱的介质为eshmuno a,缓冲液a为磷酸盐缓冲液,缓冲液a的电导率为15ms/cm,且缓冲液a的ph为7;
89.s12、将澄清后的含有抗lag-3单克隆抗体的细胞上清液以100cm/h的流速上样至亲和层析柱上,上样载量为60mg蛋白/ml树脂,亲和层析柱的柱床高度为18cm;
90.s13、上样结束后,使用缓冲液a进行再平衡,待紫外信号平稳后,使用1cv的缓冲液b进行第一次的中间淋洗,直至紫外吸收值的曲线降至平稳后,停止冲洗,再使用2cv的缓冲液a进行第二次淋洗,缓冲液b的浓度为30mm,其电导率为50ms/cm,其ph为9,缓冲液b为磷酸盐缓冲液;
91.s14、使用缓冲液c对亲和层析柱进行洗脱,当紫外吸收值上升至100mau时,开始收集蛋白溶液,当紫外吸收值降至100mau时结束收集,备用,缓冲液c的浓度为20mm,其ph为3,缓冲液c为甘氨酸-盐酸盐缓冲液;
92.s15、使用酸溶液将收集的蛋白溶液的ph值调节至3.5,并在此ph条件下室温孵育0.5h,最后用1m的tris缓冲液将蛋白溶液的ph回调至5,酸溶液为盐酸;
93.s2、阴离子交换层析:
94.s21、使用3cv的缓冲液d对阴离子交换层析柱进行平衡,待紫外吸收值、ph值和电导率的曲线同时降至平稳后,将亲和层析后的蛋白溶液以100cm/h的流速上样至阴离子交换层析柱上,其上样载量为50mg蛋白/ml树脂,阴离子交换层析柱的柱床高度为24cm,缓冲液d的ph为5.0,阴离子交换层析柱的介质为capto q,缓冲液d为含有0.1mol/l nacl的磷酸盐缓冲液;
95.s22、当蛋白溶液全部上样完成后,继续使用缓冲液d洗脱,待紫外吸收值上升至100mau时,开始收集流穿液,直至紫外吸收值降到基线,结束收集。
96.实施例2
97.本发明进一步的限定了步骤s1中,抗lag-3单克隆抗体的蛋白含量为10-40mg/ml;抗lag-3单克隆抗体包括重链可变区和轻链可变区,重链可变区包括3个重链互补决定区,3个重链互补决定区分别用hcdr1、hcdr2和hcdr3表示,轻链可变区包括3个轻链互补决定区,3个轻链互补决定区分别用lcdr1、lcdr2和lcdr3表示,抗lag-3单克隆抗体选自以下任意一种。
98.99.实施例3鼠源抗体分子筛选
100.本发明实施例3在实施例2的基础上进一步限定了抗lag-3单克隆抗体为鼠源抗体分子,本发明通过用lag-3抗原免疫小鼠,优化免疫方法,创建噬菌体展示库,具体噬菌体展示库的构建与筛选鉴定如下:
101.步骤一:lag-3抗原免疫小鼠
102.1、实验动物:
103.种属品系:balb/c,雌性,小鼠;
104.体重:18-20g;
105.实验动物提供商:北京华阜康生物科技股份有限公司。
106.2、免疫过程:对小鼠进行免疫,免疫抗原为人lag-3(南京金斯瑞生物科技有限公司合成基因,本公司构建载体并表达纯化)。
107.步骤二:噬菌体抗体库的构建
108.取效价较高的小鼠脾细胞,利用trizol试剂(购买自ambion,货号:15596026),提取小鼠脾细胞中的总rna,rt-pcr获得cdna,以cdna为模板,采用简并引物(所用简并引物参考文献:journal of immunological methods 233(2000)167-177)进行pcr扩增,从而获得免疫小鼠抗体重链可变区基因库(vh)及轻链可变区基因库(vl),轻重链分别双酶切,连接至同样分步骤酶切处理过的载体上,构建pscfv-disb-hs-vh-vl基因库,pscfv-disb-hs载体是采用一系列基因克隆的方法对载体pcomb3载体(购自中国质粒载体菌株细胞株基因保藏中心)进行改造,使之用于噬菌体单链抗体库的构建和表达。改造后的载体命名pscfv-disb-hs载体,获得其质粒图谱如图1所示,并以此载体为基础,构建小鼠免疫噬菌体抗体库。
109.步骤三:以lag-3为抗原包被免疫管,抗原包被量为5μg/500μl/管,4℃包被过夜,再用4%脱脂奶粉/pbst分别封闭免疫管和免疫噬菌体抗体库,室温封闭1h。封闭后的免疫噬菌体抗体库加入免疫管中进行抗原抗体结合,噬菌体投入量约为109~10
12
个,室温反应1h后,使用pbst-pbs洗去未结合的噬菌体,通过0.1m、ph2.2的glycine-hcl洗脱,最后使用1.5m ph 8.8的tris-hcl中和洗脱下来的噬菌体抗体溶液至ph7.0左右。
110.步骤四:将上述中和后的噬菌体感染10ml生长至对数期的tg1菌液,37℃培养箱中静置30min,取出部分菌液进行梯度稀释,涂布于2ytag平板上,用于计算噬菌体产出量。剩余的菌液离心弃上清,将菌体沉淀重悬于少量培养基,吸出后涂布于2ytag大平板,为下一轮筛选做准备。
111.步骤五:将上述感染后涂板的菌体从大平板上刮下,接菌至2ytag液体培养基,摇至对数期后加入m13ko7辅助噬菌体超感染,在28℃条件下,220rpm培养过夜制备噬菌体,peg/nacl沉降纯化噬菌体用于下一轮筛选,共进行一轮噬菌体库富集筛选。
112.步骤六:lag-3噬菌体单链抗体阳性克隆的筛选:经过一轮筛选后,挑取分隔良好的单克隆菌落,接种于加有2ytag液体培养基的96孔深孔板,在37℃条件下,220rpm的条件下培养至其对数生长期,每孔加入约10
10
的辅助噬菌体m13ko7,在37℃的温度条件下静止感染30min。4000rpm,离心15min,弃去上清,菌体用2ytak重悬沉淀,在28℃且220rpm的条件下培养过夜。4000rpm,4℃的条件下离心15min后,吸取扩增后的噬菌体上清进行elisa鉴定,最终筛选得到四个亲和力较高的抗lag-3的鼠源抗体分子,分别命名为ma-1,ma-2,ma-3和
ma-4,将上述得到的单克隆抗体进行基因测序确定为正确的抗体序列,经过测序,上述筛选到的4个单克隆抗体序列如下:
113.鼠源抗体分子重链可变区序列轻链可变区序列ma-1seq id no:21seq id no:22ma-2seq id no:21seq id no:23ma-3seq id no:24seq id no:25ma-4seq id no:26seq id no:27
114.具体的,seq id no:21(ma-1和ma-2的重链可变区的氨基酸序列):
115.evqlqqsgaelvkpgasvklsctasgfnikdtymhwvkqrpeqglewigkidpangntkydpkfqgkatitadtssntaylqlsrltsedtavyycardttvgldywgqgttltvss;
116.seq id no:22(ma-1的轻链可变区的氨基酸序列):
117.divitqstaimsaslgekvtmscrasssvnymywyqqksdaspklwiyytsklasgvparfsgsgsgtsysltissmeaedaatyycqqwssnphtfgggtkleik;
118.seq id no:23(ma-2的轻链可变区的氨基酸序列):
119.divltqtpaimsaslgekvtmscrasssvnymywyqqksdaspklwiyytsnlapgvparfsgsgsgnsysltissmegedaatyycqqftsspsmtfgggtkleik;
120.seq id no:24(ma-3的重链可变区的氨基酸序列):
121.evkleesgpelvkpgasvkisckasgysftsyyihwvkqrpgqglewigwifpgtgntrynekfkgkatltadtssstvymqlsgltsedsavyfcariggrltgdamdywgqgtsvtvss;
122.seq id no:25(ma-3的轻链可变区的氨基酸序列):
123.divltqstaslavslgqratiscrasesvdsygnsfmhwyqqkpgqppklliylasnlesgvparfsgsgsrtdftltidpveaddaatyycqqnnedpwtfgggtkleik;
124.seq id no:26(ma-4的重链可变区的氨基酸序列):
125.qvkleesgpglvqpsqslsitctvsafslttyavhwvrqspgkglewlgviwsggstdyntafisrlnitkdnsksqvffkmnslqandtaiyycarldgtffdywgqgttltvss;
126.seq id no:27(ma-4的轻链可变区的氨基酸序列):
127.divltqtpaimsaslgervtmtctasssvsssylhwyqqkpgsspklwiystsnlasgvparfsgsgsgtsysltissmeaedaatyychqyhrspptfgggtkleik。
128.实施例4梯度稀释elisa比较抗lag-3噬菌体单克隆抗体的亲和力
129.本发明实施例4将实施例3中获得的4个鼠源抗体分子(ma-1,ma-2,ma-3和ma-4)的可变区进行单克隆噬菌体的展示和纯化,然后进行噬菌体梯度稀释elisa实验鉴定亲和力,对照抗体选择专利cn105992595a中的中提供的抗lag-3的单克隆抗体,具体方法如下:
130.用ph9.6的碳酸盐缓冲液包被lag-3,100ng/孔/100μl,在4℃温度条件下包被过夜,使用pbst洗涤三次,将实施例2中筛选得到的4个噬菌体单克隆抗体分别用pbst三倍梯度稀释,每孔加入100μl稀释后的样品,在室温下静置1小时。用pbst洗涤elisa板,将pbst稀释后的hrp-anti-m13单克隆抗体加入elisa板中,在室温放置1h。tmb显色试剂盒显色,室温显色10分钟,用2m h2so4终止后,在450nm/630nm下读数,并计算对应的ec50值,具体数据如下:
131.克隆ma-1ma-2ma-3ma-4对照抗体
ec500.0100.0580.0240.1170.115
132.通过上述数据及如图2所示,实施例3筛选出的4个不同的鼠源抗体分子均能够与lag-3进行结合,本发明提供的单克隆抗体与lag-3均具有较高的亲和力。
133.实施例5
134.本发明实施例5在实施例3基础上进一步限定了鼠源抗体分子还包括重链恒定区和轻链恒定区,重链恒定区为鼠的igg1型、igg2a型、igg2b型、igg3型中的一种,igg1型的重链恒定区氨基酸序列如seq id no:29所示,igg2a型的重链恒定区氨基酸序列如seq id no:30所示,igg2b型的重链恒定区氨基酸序列如seq id no:31所示,igg3型的重链恒定区氨基酸序列如seq id no:32所示;轻链恒定区为氨基酸序列如seq id no:28所示的鼠源ck链,具体序列如下:
135.seq id no:28(鼠源ck链的轻链恒定区序列):
136.adaaptvsifppsseqltsggasvvcflnnfypkdinvkwkidgserqngvlnswtdqdskdstysmsstltltkdeyerhnsytceathktstspivksfnrnec;
137.seq id no:29(鼠的igg1型的重链恒定区序列):
138.akttppsvyplapgsaaqtnsmvtlgclvkgyfpepvtvtwnsgslssgvhtfpavlqsdlytlsssvtvpsstwpsetvtcnvahpasstkvdkkivprdcgckpcictvpevssvfifppkpkdvltitltpkvtcvvvdiskddpevqfswfvddvevhtaqtqpreeqfnstfrsvselpimhqdwlngkefkcrvnsaafpapiektisktkgrpkapqvytipppkeqmakdkvsltcmitdffpeditvewqwngqpaenykntqpimdtdgsyfvysklnvqksnweagntftcsvlheglhnhhtekslshspg;
139.seq id no:30(鼠的igg2a型的重链恒定区序列):
140.akttapsvyplapvcgdttgssvtlgclvkgyfpepvtltwnsgslssgvhtfpavlqsdlytlsssvtvtsstwpsqsitcnvahpasstkvdkkieprgptikpcppckcpapnllggpsvfifppkikdvlmislspivtcvvvdvseddpdvqiswfvnnvevhtaqtqthredynstlrvvsalpiqhqdwmsgkefkckvnnkdlpapiertiskpkgsvrapqvyvlpppeeemtkkqvtltcmvtdfmpediyvewtnngktelnykntepvldsdgsyfmysklrvekknwvernsyscsvvheglhnhhttksfsrtpgk;
141.seq id no:31(鼠的igg2b型的重链恒定区序列):
142.akttppsvyplapgcgdttgssvtlgclvkgyfpesvtvtwnsgslsssvhtfpallqsglytmsssvtvpsstwpsqtvtcsvahpassttvdkklepsgpistinpcppckechkcpapnleggpsvfifppnikdvlmisltpkvtcvvvdvseddpdvqiswfvnnvevhtaqtqthredynstirvvstlpiqhqdwmsgkefkckvnnkdlpspiertiskikglvrapqvyilpppaeqlsrkdvsltclvvgfnpgdisvewtsnghteenykdtapvldsdgsyfiysklnmktskwektdsfscnvrheglknyylkktisrspgk;
143.seq id no:32(鼠的igg3型的重链恒定区序列):
144.atttapsvyplvpgcsdtsgssvtlgclvkgyfpepvtvkwnygalssgvrtvssvlqsgfyslsslvtvpsstwpsqtvicnvahpasktelikriepripkpstppgsscppgnilggpsvfifppkpkdalmisltpkvtcvvvdvseddpdvhvswfvdnkevhtawtqpreaqynstfrvvsalpiqhqdwmrgkefkckvnnkalpapiertiskpkgraqtpqvytipppreqmskkkvsltclvtnffseaisvewerngeleqdykntppildsdgtyflyskltvdtdswlqgeiftcsvvhealhnhhtqknlsrspelelnetcaeaqdgeldglwttitifislfllsvcysasvtlfkvkwifssvvqvkqtaipdyrnmigqga。
145.实施例6抗lag-3鼠源抗体分子的制备
146.本发明实施例6在实施例5的基础上优选的限定了鼠源抗体分子的重链恒定区为鼠的igg1型,igg1型包含如seq id no:29所示的氨基酸序列;轻链恒定区为鼠源ck链,鼠源ck链包含如seq id no:28所示的氨基酸序列。抗体制备方法具体如下:
147.1、在将实施例3筛选出来的4个单克隆抗体的重链vh和轻链vl的编码基因分别克隆至装有重链和轻链恒定区基因的载体ptse(如图3所示),优选的重链恒定区为鼠的igg1型恒定区(氨基酸序列如seq id no:29所示),轻链恒定区为鼠源ck链(氨基酸序列如seq id no:28所示),ptse载体结构如图3所示(ptse载体制备过程参见cn103525868a说明书第3页第[0019]段)。
[0148]
2、瞬时转染hek293e细胞(购自中国医学科学院基础医学研究所,货号为gnhu43),进行抗体表达,使用akta仪器通过protein a亲和柱纯化获得4个单克隆抗体,同时使用bca试剂盒(购买自:北京汇天东方科技有限公司,货号:bca0020)进行蛋白浓度测定,之后通过sds-page鉴定蛋白大小,结果如图4所示,从左侧到右侧依次为非还原ma-1,ma-2,ma-3和ma-4和蛋白质分子量marker1、marker2及还原ma-1,ma-2,ma-3和ma-4鼠源抗lag-3单克隆抗体,每条带的分子量大小与理论一致。
[0149]
实施例7鼠源抗体与lag-3的结合实验
[0150]
用ph9.6的碳酸盐缓冲液包被lag-3,100ng/孔/100μl,在4℃的温度条件下过夜包被。用300μl/孔pbst洗涤五次,再加入1%bsa-pbs在37℃温度条件下封闭2h,加入不同稀释浓度的ma-1,ma-2,ma-3和ma-4鼠源抗体,4种抗体的起始最高浓度均是5μg/ml,分别经过3倍稀释后每个抗体均做12个梯度,在37℃温度条件下孵育1h。用300μl/孔pbst洗涤五次,再加入用1%bsa-pbs 1:10000稀释的anti-mouse fc-hrp,在37℃温度条件下孵育1h。tmb显色试剂盒显色,100μl/孔,室温显色8min,然后用2m h2so4终止显色。在450nm/630nm下读数,并计算对应的ec50值,具体数据如下:
[0151]
克隆ma-1ma-2ma-3ma-4ec50(ng/ml)10.0825.99255.922.12
[0152]
通过上述数据及如图5所示,筛选出的4个不同的鼠源抗体均能与lag-3进行结合,此外,这4个鼠源抗体分子的全抗体中ma-1的ec50值最低,说明其与lag-3结合能力最好,亲和力最高。
[0153]
实施例8鼠源抗体在混合淋巴细胞反应中对细胞因子il-2分泌量的影响
[0154]
按密度梯度离心法分离新鲜外周血pbmc,磁珠分选cd14
+
t细胞;用20ng/ml gm-csf与10ng/ml il-4的培养基培养cd14
+
t细胞,每2天换液,7-10天诱导成为树突状dc细胞。在dc使用前两天,加入25ng/ml的tnf-α诱导dc为成熟的dc细胞,收集成熟的dc细胞,配制成细胞密度为1x105个/ml细胞悬液。从新鲜外周血pbmc中磁珠分选出cd4
+
t细胞,计数,制成细胞密度为1x106个/ml细胞悬液。将cd4
+
t细胞与dc细胞各取100ul,按比例10:1加入96孔板。
[0155]
将实施例6中制备的ma-1,ma-2,ma-3和ma-4鼠源抗体分别进行4倍梯度稀释,每个抗体均设置6个梯度,各取50ul加入到96孔板中,培养5天后检测il-2的浓度,在450nm下读数,并计算对应的ec50值,具体数据如下:
[0156]
克隆ma-1ma-2ma-3ma-4ec50(ug/ml)0.0240.0300.0760.121
[0157]
通过上述数据及如图6所示,本发明筛选出来的4个鼠源抗体分子,均具有较好的
活性,此外,通过上述数据还可以得出,本发明筛选出的4个单克隆抗体中ma-1的ec50值最低,所以其活性最好,为此,本发明可以针对鼠源抗体分子ma-1进行人源化处理。
[0158]
实施例9
[0159]
本发明实施例9进一步的限定了抗lag-3单克隆抗体为嵌合抗体分子,嵌合抗体分子包括实施例3中鼠源抗体分子的重链可变区、鼠源抗体分子的轻链可变区和人源抗体恒定区;人源抗体恒定区包括人源抗体重链恒定区和人源抗体轻链恒定区,人源抗体重链恒定区为人的igg1型、igg2型或igg4型中的一种,igg1型的重链恒定区氨基酸序列如seq id no:39所示,igg2型的重链恒定区氨基酸序列如seq id no:40所示,igg4型的重链恒定区氨基酸序列如seq id no:41所示;人源抗体轻链恒定区为氨基酸序列如seq id no:42所示的人的ck链。
[0160]
seq id no:39(人的igg1型的重链恒定区氨基酸序列):
[0161]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk;
[0162]
seq id no:40(人的igg2型的重链恒定区氨基酸序列):
[0163]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssnfgtqtytcnvdhkpsntkvdktverkccvecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk;
[0164]
seq id no:41(人的igg4型的重链恒定区氨基酸序列):
[0165]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk;
[0166]
seq id no:42(人的ck链的轻链恒定区氨基酸序列):
[0167]
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec。
[0168]
实施例10嵌合抗体分子的制备
[0169]
本发明实施例10在实施例9的基础上进一步限定了嵌合抗体分子的重链恒定区为人的igg4型,igg4型的重链恒定区氨基酸序列如seq id no:41所示;嵌合抗体的轻链恒定区为氨基酸序列如seq id no:42所示的人的ck链。
[0170]
具体的制备方法:
[0171]
将实施例3中免疫噬菌体抗体库筛选得到的抗体分子ma-1的重链可变区vh(seq id no:21)和轻链可变区vl(seq id no:22)保持鼠源序列不变,分别克隆至装有重链恒定区和轻链恒定区基因的载体ptse(如图3所示),重链恒定区为人的igg4型(氨基酸序列如
seq id no:41所示),轻链恒定区为人的ck链(氨基酸序列如seq id no:42所示)。瞬时转染hek293e细胞(购买自:中国医学科学院基础医学研究所,货号为:gnhu43),进行抗体表达,得到嵌合抗体ca-1。
[0172]
实施例11鼠源抗体分子ma-1进行人源化
[0173]
首先,使用实施例3中鼠源抗体分子ma-1的序列和人抗体种系数据库(v-base)比较,寻找同源性较高的人抗体轻、重链种系作为候选序列,然后将鼠源抗体分子ma-1的cdr的序列移植到人源候选序列上进行同源建模。然后通过三维结构模拟计算可能对于维持cdr环状结构起重要作用的关键框架氨基酸残基,从而设计人源化抗体的回复突变。将设计好的包含回复突变的人源化抗体轻、重链可变区分别由南京金斯瑞生物科技有限公司优化合成,然后再连接到瞬时表达载体上,对人源化得到的轻重链组合分析,得到如下人源化抗体分子:ha-1,ha-2,ha-3,ha-4,ha-5,上述筛选到的5个单克隆抗体序列如下:
[0174]
单克隆抗体重链可变区轻链可变区ha-1seq id no:33seq id no:34ha-2seq id no:33seq id no:35ha-3seq id no:36seq id no:35ha-4seq id no:36seq id no:34ha-5seq id no:37seq id no:38
[0175]
具体的,seq id no:33(ha-1和ha-2的重链可变区的氨基酸序列):
[0176]
qvqlvqsgaevkkpgasvkvsckasgytftdtymhwvrqapgqglewigkidpangntkydpkfqgratitadtsistaymelsrlrsddtavyycardttvgldywgqgtlvtvss;
[0177]
seq id no:34(ha-1和ha-4的轻链可变区的氨基酸序列):
[0178]
divitqspaflsvtpgekvtitcrasssvnymywyqqkpdaspklwiyytsklasgvpsrfsgsgsgtdytftissleaedaatyycqqwssnphtfgggtkveik;
[0179]
seq id no:35(ha-2和ha-3的轻链可变区的氨基酸序列):
[0180]
divitqspaflsvtpgekvtitcrasssvnymywyqqkpdqapklliyytsklasgvpsrfsgsgsgtdytftissleaedaatyycqqwssnphtfgggtkveik;
[0181]
seq id no:36(ha-3和ha-4的重链可变区的氨基酸序列):
[0182]
qvqlvqsgaevkkpgasvkvsckasgynitdtymhwvrqapgqglewigkidpangntkydpkfqgratitadtsistaymelsrlrsddtavyycardttvgldywgqgtlvtvss;
[0183]
seq id no:37(ha-5的重链可变区的氨基酸序列):
[0184]
qvqlvqsgaevkkpgasvkvsckasgynikdtymhwvkqapgqglewigkidpangntkydpkfqgkatitadtsistaymelsrlrsddtavyycardttvgldywgqgtlvtvss;
[0185]
seq id no:38(ha-5的轻链可变区的氨基酸序列):
[0186]
divitqspaflsvtpgekvtitcrasssvnymywyqqkpdaspklwiyytsklasgvparfsgsgsgtsytftissleaedaatyycqqwssnphtfgggtkveik。
[0187]
实施例12
[0188]
本发明实施例12在实施例11的基础上进一步的限定了人源化抗体分子还包括重链恒定区和轻链恒定区,重链恒定区为人的igg1型、igg2型或igg4型中的一种,igg1型的重链恒定区氨基酸序列如seq id no:39所示,igg2型的重链恒定区氨基酸序列如seq id no:
40所示,igg4型的重链恒定区氨基酸序列如seq id no:41所示,轻链恒定区为氨基酸序列如seq id no:42所示的人的ck链。
[0189]
实施例13人源化抗体分子的制备
[0190]
本发明实施例13在实施例12的基础上进一步的限定了人源化抗体分子的重链恒定区为人的igg4型,igg4型的重链恒定区氨基酸序列如seq id no:41所示;轻链恒定区为氨基酸序列如seq id no:42所示的人的ck链。
[0191]
将上述实施例11人源化得到的5个人源化抗体分子的重链vh和轻链vl的编码基因分别克隆至装有重链恒定区和轻链恒定区基因的载体ptse(如图3所示),重链恒定区为人的igg4型(氨基酸序列如seq id no:41所示),轻链恒定区为ck链(氨基酸序列如seq id no:42所示)。
[0192]
将嵌合抗体ca-1和人源化抗体瞬时转染hek293e细胞(购自中国医学科学院基础医学研究所,货号为gnhu43),进行抗体表达,使用akta仪器通过protein a亲和柱纯化获得7个单克隆抗体,同时使用bca试剂盒(购买自:北京汇天东方科技有限公司,货号:bca0020)进行蛋白浓度测定,之后通过sds-page鉴定蛋白大小,结果如图7所示,从左侧到右侧依次为非还原蛋白质分子量marker1、ha-1、ha-2、ha-3、ha-4、ha-5、实施例10中制备的嵌合抗体ca-1及核心专利cn105992595a提供的抗lag-3单克隆抗体和还原蛋白质分子量marker2、ha-1、ha-2、ha-3、ha-4、ha-5、嵌合抗体ca-1及核心专利cn 105992595 a提供的抗lag-3单克隆抗体,每条带的分子量大小与理论一致。
[0193]
实施例14人源化抗体分子与lag-3结合实验
[0194]
用ph9.6的碳酸盐缓冲液包被lag-3,100ng/孔/100μl,在4℃的温度条件下过夜包被。用300μl/孔pbst洗涤五次,再加入1%bsa-pbst在37℃温度条件下封闭1h,加入不同稀释浓度的人源化ha-1,ha-2,ha-3,ha-4,ha-5和实施例10中制备的嵌合抗体ca-1及专利cn105992595a中的抗lag-3抗体,7个抗体的起始最高浓度均是5μg/ml,分别经过5倍稀释后每个抗体均做8个梯度,在37℃温度条件下孵育1h。用300μl/孔pbst洗涤五次,再加入用1%bsa-pbst 1∶10000稀释的anti-human fc-hrp,在37℃温度条件下孵育1h。tmb显色试剂盒显色,100μl/孔,室温显色8min,然后用2m h2so4终止显色。在450nm/630nm下读数,并计算对应的ec50值,具体数据如下:
[0195]
克隆ha-1ha-2ha-3ha-4ha-5嵌合抗体ca-1cn105992595aec50(ng/ml)46.25150.7102.5538.8350.352.16747.2
[0196]
通过上述数据及实验结果如图8所示,5个不同的人源化抗体分子均能与lag-3进行结合,本发明提供的5个不同的人源化抗体的ec50值均明显低于专利cn 105992595 a中的抗lag-3抗体,说明本发明提供的单克隆抗体与lag-3的结合能力强,亲和力高。此外,从图8及上述数据中还可以得出,5个不同的单克隆抗体中ha-1的ec50值最低,说明其与lag-3结合能力最好,亲和力最高,同时ha-1的ec50值与嵌合抗体ca-1相似,说明人源化后的ha-1保留了鼠源亲本抗体ma-1与lag-3的高亲和力,亲和力没有下降。
[0197]
实施例15混合淋巴细胞反应(mlr)测试抗lag-3人源化抗体分子活性
[0198]
按密度梯度离心法分离新鲜外周血pbmc,磁珠分选cd14
+
t细胞;用20ng/ml gm-csf与10ng/ml il-4的培养基培养cd14
+
t细胞,每两天换液,7-10天诱导成为树突状dc细胞。在dc细胞使用前两天,加入25ng/ml的tnf-α诱导dc为成熟的dc细胞,收集成熟的dc细
胞,配制成细胞密度为1
×
105个/ml细胞悬液。从新鲜pmbc中磁珠分选出cd14
+
t细胞,计数,制成细胞密度为1
×
106个/ml细胞悬液。将cd14
+
t细胞与dc细胞各取100μl,按比例10∶1加入96孔板。
[0199]
将实施例13制备的5个抗lag-3人源化抗体分子、实施例10制备的嵌合抗体ca-1及专利cn 105992595 a提供的抗lag-3抗体作为阳性对照,分别进行4倍梯度稀释,每个抗体均设置8个梯度,各取50μl加入到96孔板中,5天后,cck8测试cd14
+
t细胞增殖,在450nm/630nm下读数,并计算对应的ec50值,具体数据如下:
[0200]
克隆ha-1ha-2ha-3ha-4ha-5嵌合抗体ca-1cn105992595aec50(ng/ml)6.87527.0915.0133.831.847.22639.59
[0201]
通过上述数据及如图9所示,本发明筛选出的5个不同的抗lag-3抗体的ec50值均明显低于专利cn 105992595 a中提供的抗lag-3的抗体,说明本发明提供的抗lag-3抗体的活性均比较高,同时本发明筛选出的5个单克隆抗体中,抗lag-3全抗体ha-1的ec50值最低,说明其活性最高,此外,从图9还可以看出,嵌合抗体ca-1的亲和力与抗lag-3抗体ha-1的ec50值比较接近,说明人源化抗体ha-1保留了鼠源亲本抗体ma-1的生物活性,其生物活性没有下降。
[0202]
实施例16抗lag-3单克隆抗体ha-1对小鼠体内mc38结直肠癌的抑制试验
[0203]
1、实验动物:
[0204]
种属品系:mus musculus,ncg,小鼠;
[0205]
周龄:6-8周;
[0206]
实验动物提供商:江苏集萃药康生物科技有限公司。
[0207]
2、细胞培养,mc38肿瘤细胞(yk-cl-256-02)(购自:普如汀生物技术(北京)有限公司(biovector ntcc inc.),货号:ntcc-mc38)。用含有灭活的10%胎牛血清(excell bio,货号:fnd500),100u/ml的青霉素和100μg/ml的链霉素以及2mm谷氨酰胺的dmem培养基(购自:赛默飞世尔科技(中国)有限公司(gibco),货号:10566-016)在37℃、5%co2的培养箱中培养肿瘤细胞,每隔3至4天待细胞长满后分瓶传代,将处于对数生长期的肿瘤细胞用于体内肿瘤的接种。
[0208]
3、肿瘤细胞的接种与分组:pbs重悬的mc38肿瘤细胞,浓度为1.0
×
107/ml,接种于实验动物的右侧胁肋部皮下,100μl/只,在肿瘤生长至61mm3左右时分组给药,共3组,每组8只,分别为溶媒对照组、ha-1(10mg/kg,i.p.,biw
×
3w)、ha-1(30mg/kg,i.p.,biw
×
3w)。
[0209]
4、检测指标:每周使用游标卡尺对肿瘤体积进行2次的测量,测量肿瘤的长径和短径,其体积计算公式为:体积=0.5
×
长径
×
短径2;记录肿瘤体积的变化与给药时间的关系,实验结果如图10所示。
[0210]
通过图10数据显示,抗lag-3单克隆抗体ha-1能够抑制肿瘤的生长,且呈现剂量依赖性反应。
[0211]
实施例17抗lag-3单克隆抗体ha-1蛋白分子热稳定性评估
[0212]
将抗lag-3单克隆抗体ha-1蛋白分子超滤换液到pbs缓冲体系中,12000rpm,在4℃条件下,离心5min,使用多功能蛋白热稳定性分析系统(购买自unchained labs)对抗lag-3单克隆抗体ha-1蛋白分子的热稳定性进行评估。通过监测蛋白内源性荧光随温度变化(从25℃开始,以0.3℃/min的升温速度升温至95℃)检测蛋白构象的变化,从而确定蛋白熔解
温度tm,评估蛋白构象稳定性。样品发生聚集时,会导致散射光波发生干涉,散射光信号增加,通过静态光散射测定蛋白的胶体稳定性(以tagg进行表征),结果参加如下表和附图11所示。
[0213][0214]
如上表和图11显示,抗lag-3单克隆抗体ha-1蛋白分子的温度为66.6℃,平均tagg为68.0℃,显示出较好的构象稳定性和胶体稳定性。
[0215]
实施例18
[0216]
本发明实施例18在上述实施例1-17的基础上进一步限定了一种抗lag-3单克隆抗体的纯化方法,具体包括以下方法:
[0217]
通过实施例14-17中选择与lag-3结合能力最高、活性最好的抗lag-3单克隆抗体ha-1作为蛋白分子,然后进行蛋白溶液的纯化,具体步骤如下:
[0218]
细胞澄清:采用离心或深层过滤的方式对含有抗lag-3单克隆抗体ha-1的细胞液进行澄清;
[0219]
s1、亲和层析:
[0220]
s11、使用5cv的缓冲液a对亲和层析柱进行平衡,亲和层析柱的介质为mabselect sure,缓冲液a包括hepes缓冲液,缓冲液a的电导率为25ms/cm,且缓冲液a的ph为8;
[0221]
s12、将澄清后的含有抗lag-3单克隆抗体的细胞上清液以300cm/h的流速上样至亲和层析柱上,上样载量为20mg蛋白/ml树脂,亲和层析柱的柱床高度为22cm;
[0222]
s13、上样结束后,使用缓冲液a进行再平衡,待紫外信号平稳后,使用5cv的缓冲液b进行第一次的中间淋洗,直至紫外吸收值的曲线降至平稳后,停止冲洗,再使用5cv的缓冲液a进行第二次淋洗,缓冲液b的浓度为60mm,其电导率为100ms/cm,其ph为5,缓冲液b为醋酸盐缓冲液;
[0223]
s14、使用缓冲液c对亲和层析柱进行洗脱,当紫外吸收值上升至100mau时,开始收集蛋白溶液,当紫外吸收值降至100mau时结束收集,备用,缓冲液c的浓度为200mm,其ph为4,缓冲液c为柠檬酸盐缓冲液;
[0224]
s15、使用酸溶液将收集的蛋白溶液的ph值调节至3.7,并在此ph条件下室温孵育2.5h,最后用1m的tris缓冲液将蛋白溶液的ph回调至7,酸溶液为柠檬酸;
[0225]
s2、阴离子交换层析:
[0226]
s21、使用5cv的缓冲液d对阴离子交换层析柱进行平衡,待紫外吸收值、ph值和电导率的曲线同时降至平稳后,将亲和层析后的蛋白溶液以200cm/h的流速上样至阴离子交换层析柱上,其上样载量为150mg蛋白/ml树脂,阴离子交换层析柱的柱床高度为20cm,缓冲液d的ph为7.0,阴离子交换层析柱的介质为poros xq,缓冲液d为含有0.1mol/l nacl的磷酸盐缓冲液;
[0227]
s22、当蛋白溶液全部上样完成后,继续使用缓冲液d洗脱,待紫外吸收值上升至100mau时,开始收集流穿液,直至紫外吸收值降到基线,结束收集。
[0228]
实施例19
[0229]
本发明实施例19在上述实施例1-17的基础上进一步限定了一种抗lag-3单克隆抗
体的纯化方法,具体包括以下方法:
[0230]
通过实施例14-17中选择与lag-3结合能力最高、活性最好的抗lag-3单克隆抗体ha-1作为蛋白分子,然后进行蛋白溶液的纯化,具体步骤如下:
[0231]
细胞澄清:采用离心或深层过滤的方式对含有抗lag-3单克隆抗体ha-1的细胞液进行澄清;
[0232]
s1、亲和层析:
[0233]
s11、使用3cv的缓冲液a对亲和层析柱进行平衡,亲和层析柱的介质为mabselect prisma,缓冲液a为50mm的tris-hcl缓冲液,tris-hcl缓冲液中含有150mm的nacl,缓冲液a的电导率为18ms/cm,且缓冲液a的ph为7.2-7.8;
[0234]
s12、将澄清后的含有抗lag-3单克隆抗体的细胞上清液以100-200cm/h的流速上样至亲和层析柱上,上样载量为40mg蛋白/ml树脂,亲和层析柱的柱床高度为20cm;
[0235]
s13、上样结束后,使用缓冲液a进行再平衡,待紫外信号平稳后,使用5cv的缓冲液b进行第一次的中间淋洗,直至紫外吸收值的曲线降至平稳后,停止冲洗,再使用5cv的缓冲液a进行第二次淋洗,缓冲液b的浓度为50mm的tris-hcl缓冲液,tris-hcl缓冲液含有1m的盐酸胍,其ph为7.4-7.8;
[0236]
s14、使用缓冲液c对亲和层析柱进行洗脱,当紫外吸收值上升至100mau时,开始收集蛋白溶液,当紫外吸收值降至100mau时结束收集,备用,缓冲液c的浓度为50mm,其ph为3.6,缓冲液c为醋酸盐缓冲液;
[0237]
s15、使用酸溶液将收集的蛋白溶液的ph值调节至3.7,并在此ph条件下室温孵育1-2h,最后用1m的tris缓冲液将蛋白溶液的ph回调至6,酸溶液为乙酸;
[0238]
s2、阴离子交换层析:
[0239]
s21、使用5cv的缓冲液d对阴离子交换层析柱进行平衡,待紫外吸收值、ph值和电导率的曲线同时降至平稳后,将亲和层析后的蛋白溶液以200cm/h的流速上样至阴离子交换层析柱上,其上样载量为100-120mg蛋白/ml树脂,阴离子交换层析柱的柱床高度为22cm,缓冲液d的ph为6.0,阴离子交换层析柱的介质为capto adhere,缓冲液d为含有0.2-0.25mol/lnacl的磷酸盐缓冲液;
[0240]
s22、当蛋白溶液全部上样完成后,继续使用缓冲液d洗脱,待紫外吸收值上升至100mau时,开始收集流穿液,直至紫外吸收值降到基线,结束收集。
[0241]
实施例20
[0242]
本发明实施例20在上述实施例19的基础上进一步限定了步骤s11中亲和层析柱的介质为mabselect sure lx,其他步骤和参数均与实施例19相同。
[0243]
实施例21-26
[0244]
本发明实施例21-26在上述实施例19的基础上进一步限定了步骤s13中缓冲液b包括以下浓度的具体成分,其他步骤和参数均与实施例19相同。
[0245][0246][0247]
实施例27
[0248]
本发明实施例27在上述实施例19的基础上进一步限定了步骤s21中,阴离子交换层析柱的介质为eshmuno q,其他步骤和参数均与实施例19相同。
[0249]
实施例28-38
[0250]
本发明实施例28-38在上述实施例19的基础上进一步限定了步骤s21中缓冲液d为含有不同浓度的nacl的磷酸盐缓冲液,缓冲液d的不同ph,和不同上样载量,具体数据如下,其他步骤和参数均与实施例19相同,同时考察不同实施例达到的纯化效果。
[0251]
实施例nacl浓度(mol/l)上样载量(mg蛋白/ml树脂)ph值实施例280.1505.0实施例290.4505.0实施例300.11505.0实施例310.41505.0实施例320.1507.0实施例330.4507.0实施例340.11507.0实施例350.41507.0实施例360.251006.0实施例370.251006.0实施例380.251006.0
[0252]
对照例1
[0253]
本发明对照例1在实施例1的基础上提供给了一种抗lag-3单克隆抗体的纯化方法,该方法在实施例1提供的方法基础上,将步骤s13仅去除“使用1cv的缓冲液b进行第一次的中间淋洗,直至紫外吸收值的曲线降至平稳后,停止冲洗,再使用2cv的缓冲液a进行第二次淋洗,缓冲液b的浓度为30mm,其电导率为50ms/cm,其ph为9,缓冲液b为磷酸盐缓冲液”的
限定,其他步骤和参数均与实施例1相同。
[0254]
对照例2
[0255]
本发明对照例2在实施例1的基础上提供给了一种抗lag-3单克隆抗体的纯化方法,该方法在实施例1提供的方法基础上,将步骤s13中“缓冲液b为磷酸盐缓冲液”替换为“缓冲液b为l-组氨酸盐酸盐缓冲液”,其他步骤和参数均与实施例1相同。
[0256]
对照例3
[0257]
本发明对照例3在实施例1的基础上提供给了一种抗lag-3单克隆抗体的纯化方法,该方法在实施例1提供的方法基础上,更换了阴离子交换层析的填料,将本发明中的两步层析法更换为传统的三步层析法,具体的,将步骤s21中的“阴离子交换层析的介质为capto q”更换为“阳离子层析的介质为capto sp和疏水层析的介质为phenyl hp”,其他步骤相同。
[0258]
实验一、阴离子交换层析的doe(design of experiment)设计
[0259]
选择实施例28-38提供的纯化方法进行的doe设计,条件如下:
[0260]
(1)因子及其范围:
[0261]
ph:5.0-7.0,中心点为6.0;
[0262]
nacl:0.1mol/l-0.4mmol/l,中心点为0.25mmol/l;
[0263]
载量:50-150mg蛋白/ml树脂,中心点为100mg/ml;
[0264]
(2)响应值:蛋白纯度(aggregate)、蛋白收率(recovery massout)、电荷异构体主峰含量(additive content);
[0265]
(3)模型:筛选模型(screening);
[0266]
(4)实验设计:将步骤s1中亲和层析后的蛋白溶液样品的ph及电导率与实施例28-38中一致,使用akta avant 150自动层析设备,以100-200cm/h的流速上至柱子上,进行阴离子交换层析分析,结果如下表所示。
[0267][0268]
通过上述数据得知,从实验设计的结果可看出,将亲和层析后的抗lag-3单克隆抗体蛋白溶液进行阴离子交换层析时,在广泛的条件下(ph5.0-7.0,nacl0.1mol/l-0.4mol/l,载量50-150mg蛋白/ml树脂)均能使蛋白纯度和电荷异构体主峰含量提高。
[0269]
从图12模型拟合图分析,其中,r2均大于0.75,q2均大于0.5,模型有效性均大于0.25,重现性均大于0.75,表明蛋白收率模型、蛋白纯度模型及电荷异构体主峰含量模型均有效,模型有预测性。
[0270]
从图13a、图13b和图13c的因子系数图分析,针对蛋白收率模型,蛋白收率与电导及上样载量成正相关,与ph成负相关;针对蛋白纯度模型,蛋白纯度与电导及上样载量成负相关,受电导影响较大,与ph无相关性;针对电荷异构体主峰含量模型,主峰含量与电导及上样载量成负相关,与ph无相关性。
[0271]
从响应曲面图(图14-16)分析,将亲和层析后的抗lag-3单克隆抗体蛋白溶液进行阴离子交换层析时,在ph中心点6.0的条件下,电导越高、上样载量越高的情况下蛋白收率就越高;但是电导越高纯度就越低;载量越高的情况下电荷异构体主峰含量就越低。过低的载量将造成填料、溶液、一次性耗材的浪费,不利于生产。选择载量100-120mg/ml的情形下,实施例19中,nacl浓度宜在0.2-0.25mol/l范围,此时蛋白收率大致在70-80%,蛋白纯度》99.0%,电荷异构体主峰含量》70%。
[0272]
为此,得出结论:抗lag-3单克隆抗体蛋白溶液经过亲和层析及capto adhere阴离子交换层析两步纯化可以在保证蛋白纯度99%以上的前提下,显著提高电荷异构体主峰含量,同时总回收率在65%以上。(备注:总回收率=亲和层析蛋白收率*capto adhere多模式层析蛋白收率)。
[0273]
实验二、抗lag-3单克隆抗体的理化检测
[0274]
针对本发明实施例1、实施例18-27及对照例1-3提供的纯化方法纯化的抗lag-3单克隆抗体,运用凝胶色谱技术手段检测蛋白纯度,分析纯化过程中样品的聚集体、单体及降解产物含量;同时,运用离子色谱技术手段,分析电荷异构体酸碱峰含量。检测结果如下:
[0275]
[0276][0277]
从上表可看出,实施例1和实施例18-27提供的纯化方法制备的抗lag-3单克隆抗体,蛋白纯度可达98%以上,电荷异构体主峰含量达70%以上,同时总回收率可实现60%以上;实施例1和18与实施例19相比,实施例19提供的纯化方法得到的蛋白溶液中,蛋白纯度、主峰含量及回收率最高,为此,实施例19为本发明最优实施例,实施例20与实施例19相比,实施例19中蛋白纯度、主峰含量及回收率高于实施例20,说明本发明优选的亲和层析柱的介质为mabselect prisma;实施例21-26与实施例19相比,实施例19中蛋白纯度、主峰含量及回收率高于实施例21-26,说明本发明提供的缓冲液b优选为浓度为50mm的tris-hcl缓冲液,tris-hcl缓冲液含有1m的盐酸胍;实施例27与实施例19相比,实施例19中蛋白纯度、主峰含量及回收率高于实施例27,说明本发明提供的阴离子交换层析柱的介质优选为capto adhere。
[0278]
对照例1与实施例1相比,去除了中间淋洗缓冲液b的淋洗,蛋白纯度、蛋白收率、主峰含量等理化指标降低,所以本发明优选的使用缓冲液b进行中间淋洗;对照例2与实施例1相比,中间淋洗缓冲液b更换成分后,蛋白纯度、蛋白收率、主峰含量等理化指标降低,为此
本发明提供的缓冲液b包括tris-hcl缓冲液、hepes缓冲液缓冲液、磷酸盐缓冲液、柠檬酸盐缓冲液、醋酸盐缓冲液中的一种能够保证其纯化效果,选择其他缓冲液将有可能造成纯化效果降低;对照例3与实施例1相比,阴离子交换层析更改为阳离子层析填料capto sp和疏水层析填料phenyl hp后,蛋白纯度、主峰含量的影响不大,但是蛋白回收率明显降低,说明本发明提供的抗lag-3单克隆抗体不适用于3步层析法纯化。
[0279]
实验三、抗lag-3单克隆抗体的相关杂质检测
[0280]
针对本发明实施例1、实施例18-27及对照例1-3提供的纯化方法纯化的抗lag-3单克隆抗体,采用专用的试剂盒检测工艺相关杂质的含量,检测结果如下:
[0281]
[0282]
[0283][0284]
从上表可看出,实施例1、18-27提供的纯化方法制备的抗lag-3单克隆抗体,残留hcp、残留dna及残留蛋白a均比较低,相对其他实施例,实施例19提供的纯化方法得到的抗lag-3单克隆抗体中,残留hcp、残留dna及残留蛋白a最低,说明实施例19为本发明最优方案;实施例20与实施例19相比,实施例19中残留hcp、残留dna及残留蛋白a含量低于实施例20,说明本发明优选的亲和层析柱的介质为mabselect prisma;实施例21-26与实施例19相比,实施例19中残留hcp、残留dna及残留蛋白a含量低于实施例21-26,说明本发明提供的缓冲液b优选为浓度为50mm的tris-hcl缓冲液,tris-hcl缓冲液含有1m的盐酸胍;实施例27与实施例19相比,实施例19中残留hcp、残留dna及残留蛋白a含量低于实施例27,说明本发明提供的阴离子交换层析柱的介质优选为capto adhere,介质的改变将影响最终的残留含量。
[0285]
对照例1与实施例1相比,去除了中间淋洗缓冲液b的淋洗,残留杂质含量飙升,所以本发明提供的中间淋洗缓冲液b的淋洗至关重要,对抗lag-3单克隆抗体的纯化起重要作用;对照例2与实施例1相比,中间淋洗缓冲液b成分更改后,对残留杂质有去除作用,但不彻底,不符合纯化要求;对照例3与实施例1相比,阴离子交换层析填料更改为阳离子层析填料capto sp和疏水层析填料phenyl hp后,残留杂质去除未受影响。
[0286]
实验四、抗lag-3单克隆抗体的结合活性及生物学活性检测
[0287]
针对本发明实施例1、实施例18-27及对照例1-3提供的纯化方法纯化的抗lag-3单克隆抗体,本发明采用elisa手段,分析纯化后的抗lag-3单克隆抗体与lag-3的特异性结合能力,以评价纯化后抗体的活性。检测结果如下:
[0288]
实施例结合活性生物学活性实施例182%75%实施例1884%72%实施例1987%78%
实施例2085%76%实施例2182%74%实施例2283%75%实施例2381%72%实施例2468%65%实施例2582%73%实施例2683%74%实施例2781%73%
[0289]
从上表可看出,本发明实施例1、实施例18-27提供的纯化方法制备的抗lag-3单克隆抗体,结合活性及生物学活性均较好,在80%
±
20%范围内,虽然盐酸胍在有些场合被用作蛋白变性剂,但在本发明中,盐酸胍被用在亲和淋洗中对蛋白结合活性及生物学活性均未造成影响。
[0290]
本发明不局限于上述最佳实施方式,任何人在本发明的启示下都可得出其他各种形式的产品,但不论在其形状或结构上作任何变化,凡是具有与本技术相同或相近似的技术方案,均落在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1