人源化ALR人鼠嵌合单克隆抗体在肝癌和多发性骨髓瘤治疗中的应用
人源化alr人鼠嵌合单克隆抗体在肝癌和多发性骨髓瘤治疗中的应用
技术领域
1.本发明属于单克隆抗体技术领域,尤其涉及一种人源化alr人鼠嵌合单克隆抗体在肝癌和多发性骨髓瘤治疗中的应用。
背景技术:
2.肝再生增强因子(augmenter of liver regeneration,alr)是一种支持肝再生蛋白质,与酵母erv蛋白质家族高度同源,erv对于酵母的呼吸和营养生长至关重要。
3.人类alr(halr)有三个亚型23kd、21kd和15kdalr。现有的研究主要集中在23kd和15kdalr上。23kdalr主要定位于细胞线粒体,参与氧化磷酸化等能量代谢过程,是细胞存活所必须的;15kdalr主要分泌到细胞外,与细胞生长、增殖相关。研究发现,15kdalr在正常细胞中表达少,但是在肿瘤细胞中高表达。
4.alr与肝癌的发生、发展存在一定关系。例如,研究发现,alr能够刺激肝癌细胞株增殖,并呈剂量依懒性;将alr表达质粒转入肝癌细胞中,发现alr能明显促进肝癌细胞增殖和增强其抗损伤的能力。发明人在前期的工作也已经证实肝癌细胞自身能分泌halr,并且肝癌细胞膜上halr受体表达明显高于原代肝细胞,说明halr可能通过自分泌循环参与了肝癌的发生、发展。那么基于之前的研究,探究15kdalr的人源化alr人鼠嵌合单克隆抗体是否能够阻断肝癌的发生、发展,可以为肝癌的治疗提供新的研究思路。
5.除了肝癌外,多发性骨髓瘤(multiple myeloma,mm)也是一种来源于浆细胞的血液系统恶性肿瘤,多见于60
‑
70岁老年人,患病的存活期一般为3
‑
5年,发病机制尚不清楚。探究人源化alr人鼠嵌合单克隆抗体在多发性骨髓瘤发生、发展中的作用和作用机制,能够为多发性骨髓瘤的治疗提供新的参考靶点和实验依据。
技术实现要素:
6.本发明的目的在于提供一种人源化alr人鼠嵌合单克隆抗体在肝癌和多发性骨髓瘤治疗中的应用,以至少解决上述技术问题之一。
7.基于以上目的,本发明提供一种人源化alr人鼠嵌合单克隆抗体,重链可变区包括三个cdrs区域,氨基酸序列分别为seq id no:3、seq id no:4和seq id no:5。轻链可变区包括三个cdrs区域,氨基酸序列分别为seq id no:6、seq id no:7和seq id no:8。
8.优选地,重链可变区的氨基酸序列为seq id no:1;轻链可变区的氨基酸序列为seq id no:2。
9.本发明还提供了一种核酸,编码人源化alr人鼠嵌合单克隆抗体的核苷酸序列。
10.本发明还提供一种载体,包括上述核酸。
11.本发明还提供一种宿主细胞,包括上述载体。
12.本发明还提供一种组合物,包括(1)上述人源化alr人鼠嵌合单克隆抗体;(2)上述核酸;(3)上述载体;(4)上述宿主细胞。
13.本发明还提供了上述人源化alr人鼠嵌合单克隆抗体在制备肝癌治疗药物中的应用。
14.本发明还提供了上述人源化alr人鼠嵌合单克隆抗体在制备多发性骨髓瘤治疗药物中的应用。
15.本技术方案的原理和有益效果在于:
16.(1)本技术方案提供的人源化alr人鼠嵌合单克隆抗体具有抑制人类肝癌细胞增殖的巨大潜力,为今后进一步研究halr在肝癌发生、发展过程中的作用奠定基础。具体实验时,本技术方案采用鼠抗halr单克隆抗体作用于hepg2细胞,以终浓度(单位为mg/ml)1:250的鼠抗halr单克隆抗体的抑制肿瘤细胞增殖效果最佳。
17.(2)本技术方案提供的人源化alr人鼠嵌合单克隆抗体在治疗多发性骨髓瘤上具有巨大潜力。具体实验时,发现鼠抗halr单克隆抗体能够抑制u266细胞活力,抑制u266细胞增殖,抑制sp2/0皮下移植瘤,为halr在多发性骨髓瘤发生、发展过程中的作用奠定基础。
18.(3)由于15kdalr在正常细胞中表达少,但是在肿瘤细胞中高表达。23kdalr和15kdalr差异仅在于15kdalr缺少n’端线粒体靶向序列,采用过表达或沉默方式从基因层面进行干预会同时影响到23kdalr和15kdalr。利用单克隆抗体特异结合细胞外的15kdalr则不会影响到存在与线粒体中的23kdalr,有利于单独研究15kdalr的作用。
19.优选地,上述人源化alr人鼠嵌合单克隆抗体首先通过杂交瘤技术制备鼠抗halr单克隆抗体,然后将鼠抗halr单克隆抗体的轻链可变区、重链可变区测序完毕后,分别克隆到pcdna3.4载体上,构建抗halr人鼠嵌合的重组质粒;再将重组质粒在expi293f系统中进行表达,经protein g亲和层析纯化得到人源化alr人鼠嵌合单克隆抗体。
附图说明
20.图1为细胞融合结果图;
21.图2为有限稀释后单克隆杂交瘤形态;a和b是分别从两个孔板中长出的杂交瘤;
22.图3为获得人源化alr人鼠嵌合单克隆抗体过程中构建重组质粒的示意图;
23.图4为akta蛋白纯化时蛋白的吸收峰;
24.图5为人源化alr人鼠嵌合单克隆抗体银染结果;
25.图6为elisa验证人源化alr人鼠嵌合单克隆抗体的亲和力;
26.图7为利用spr技术,测定alr
‑
gst的重组蛋白与人源化alr人鼠嵌合单克隆抗体的亲和力常数;
27.图8为人源化alr人鼠嵌合单克隆抗体对huh7细胞裸瘤移植瘤的影响;
28.图9为人源化alr人鼠嵌合单克隆抗体对小鼠体重、移植瘤体积和瘤体重量的影响;
29.图10为tunel染色结果;
30.图11为he染色结果;
31.图12为免疫细胞化学显示hepg2细胞有halr表达;
32.图13为rt
‑
pcr扩增halr和β
‑
actin编码基因电泳图;
33.图14为不同浓度anti
‑
halr mcab作用48h对人肝癌细胞株hepg2细胞增殖的影响;
34.图15为不同浓度anti
‑
halr mcab作用72h对人肝癌细胞株hepg2细胞增殖的影响;
35.图16为接种肿瘤细胞30天后裸鼠成瘤情况;
36.图17为注射anti
‑
halr mcab组和sp2/0骨髓瘤细胞制备腹水组裸鼠肿瘤体积变化;
37.图18为注射anti
‑
halr mcab组和sp2/0骨髓瘤细胞制备腹水组裸鼠肿瘤重量变化;
38.图19为不同人多发性骨髓瘤细胞系15kdalr的表达情况(*p<0.05);
39.图20为不同浓度鼠抗halr单克隆抗体作用不同时间对细胞活力的影响;
40.图21为鼠抗halr单克隆抗体处理细胞不同时间对细胞计数的影响;
41.图22为鼠抗halr单克隆抗体处理细胞不同时间对细胞活力的影响;
42.图23为鼠抗halr单克隆抗体对细胞增殖影响;
43.图24为接种细胞2周时balb/c小鼠皮下移植瘤生长情况;
44.图25为生存曲线;
45.图26为治疗4周后肿瘤情况;
46.图27为治疗4周后肿瘤的质量和体积。
具体实施方式
47.下面通过具体实施方式进一步详细说明:
[0048]ⅰ.本实施例提供了一种人源化alr人鼠嵌合单克隆抗体。
[0049]
人源化alr人鼠嵌合单克隆抗体的重链可变区的氨基酸序列为seq id no:1;轻链可变区的氨基酸序列为seq id no:2。重链可变区包括三个cdrs区域,氨基酸序列分别为seq id no:3、seq id no:4和seq id no:5。轻链可变区包括三个cdrs区域,氨基酸序列分别为seq id no:6、seq id no:7和seq id no:8。
[0050]ⅱ.制备人源化alr人鼠嵌合单克隆抗体。
[0051]
首先通过杂交瘤技术制备鼠抗halr单克隆抗体,然后将鼠抗halr单克隆抗体的轻链可变区、重链可变区测序完毕后,分别克隆到pcdna3.4载体上,构建抗halr人鼠嵌合的重组质粒;再将重组质粒在expi293f系统中进行表达,经protein g亲和层析纯化得到人源化alr人鼠嵌合单克隆抗体。
[0052]
具体包括以下步骤:
[0053]
(一)获得鼠抗halr单克隆抗体;
[0054]
s1、免疫动物;
[0055]
(1)准备抗原:以15kd
‑
rhalr 300μl(1.2mg/ml)为抗原,与等体积的cfa充分混匀成乳状;cfa可以为美国chondrex生产的货号为7008的完全弗氏佐剂。
[0056]
(2)初次免疫:取3只六周龄健康雌性balb/c小鼠(约15g/只),分别于颈背部及腹股沟处多点皮下注射,200μl/只(约120μg抗原/只)。
[0057]
(3)14天后加强免疫:将300μl抗原与等体积的ifa充分混匀成乳状,每只小鼠仍于颈背部及腹股沟处多点皮下注射200μl。ifa可以为美国chondrex生产的货号为7002的弗氏不完全佐剂。
[0058]
(4)第24天采尾血,按1:1000稀释以elisa方法检测免疫效果(以免疫前血清作对照)。
[0059]
(5)第35天进行第二次加强免疫,方法除抗原剂量减半外同第一次加强免疫。
[0060]
(6)第45天再次采尾血按1:2000稀释以elisa方法检测免疫效果。
[0061]
(7)冲击免疫:在第二次加强免疫后至少一个月后、准备进行细胞融合前5天进行。以15kd
‑
rhalr 300μl(330μg/ml)与等体积的pbs混合,对elisa检测结果最好的一只小鼠进行腹腔注射。pbs为sigma
‑
aldrich西格玛奥德里奇(上海)贸易有限公司生产的pbs磷酸盐缓冲液。
[0062]
研究发现15kdalr在正常细胞中表达少,在肿瘤细胞中高表达。23kdalr和15kdalr差异在于15kdalr缺少n’端线粒体靶向序列,采用过表达或沉默方式从基因层面进行干预会同时影响到23kdalr和15kdalr,所以本实施例利用单克隆抗体特异结合细胞外的15kdalr则不会影响到存在于线粒体中的23kdalr,有利于单独研究15kdalr的作用和应用前景。
[0063]
s2、elisa检测免疫效果;
[0064]
(1)抗原包被:用包被液将15kd
‑
rhalr稀释至2μg/ml,以100μl/孔加入酶标板孔中,于湿盒中4℃包被过夜。包被液为美国agdia生产的货号为acc 00413/0030的碳酸盐抗体包被缓冲液。
[0065]
(2)封闭:弃包被液,加含3%bsa的pbst溶液100μl/孔,于湿盒中37℃封闭不少于2h。bsa为sigma
‑
aldrich西格玛奥德里奇(上海)贸易有限公司生产的cas号为9048
‑
46
‑
8的牛血清白蛋白;pbst为上海裕平生物科技有限公司生产的货号为y1001的磷酸盐缓冲液含吐温20(pbs
‑
t片剂)。
[0066]
(3)加免疫血清:弃封闭液,洗涤三次,将采集的血清及免疫前血清按1:1000或1:2000稀释于pbst溶液中,每个样品加两孔(100μl/孔)。
[0067]
(4)弃抗体液,以pbst溶液洗涤三次。
[0068]
(5)加二抗:hrp标记羊抗鼠igg以含1%bsa的pbst溶液按1:10,000稀释后以100μl/孔加入各孔,于湿盒中37℃孵育45min。hrp为泽叶生物生产的货号为zy131086的辣根过氧化物酶标记亲和素。
[0069]
(6)显色:加入tmb显色液a、b各一滴,室温下显色约2
‑
5min,加入2m硫酸溶液50μl终止显色。tmb为飞净phygene生产的cas号为54827
‑
17
‑
7四甲基联苯胺。
[0070]
(7)酶标仪检测:在450nm波长下读取各孔吸光度值并记录。
[0071]
结果判定:免疫小鼠于24天及45天采尾血,分别以1:1000、1:2000稀释后用elisa法检测,免疫后血清与免疫前血清在450nm波长处的吸光度值之比(s/n)大于2.1为阳性。
[0072]
实验结果s/n值均大于2.1,说明免疫成功,具体实验结果如下表1和表2所示:
[0073]
表1 免疫后24天血清抗rhalr的elisa检测
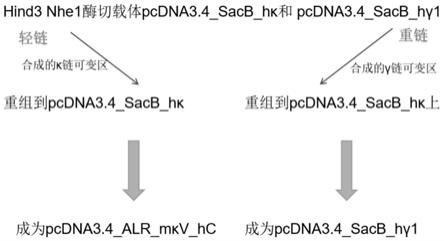
[0074][0075]
表2 免疫后45天血清中抗halr的elisa检测
[0076][0077]
s3、制备杂交瘤细胞;
[0078]
(1)复苏并鉴定骨髓瘤细胞;
[0079]
ⅰ
.细胞融合前二周复苏骨髓瘤细胞sp2/0,以含10%ncs的rpmi
‑
1640培养基培养。ncs为美国agdia生产的cas号为128
‑
09
‑
6的n
‑
氯代丁二酰亚胺。rpmi是roswell park memorial institute的缩写,代指洛斯维
·
帕克纪念研究所。rpmi是该研究所研发的一类细胞培养基,1640是培养基代号。其中含有10%胎牛血清。rpmi
‑
1640培养基为sigma
‑
aldrich西格玛奥德里奇(上海)贸易有限公司生产的mdl编号为mfcd00217820的rpmi
‑
1640培养基。
[0080]
ⅱ
.鉴定:把复苏后的骨髓瘤细胞传代为二瓶,其中一瓶继续进行传代培养,而另一瓶以含hat的选择培养基培养,后者培养三天后细胞全部死亡,证明该细胞为没有突变的骨髓瘤细胞。hat中的“h”代表hypoxanthine次黄嘌呤,“a”代表aminopterin甲氨喋呤,“t”代表thymidine胸腺嘧啶核苷,含hat的选择培养基是含有次黄嘌呤、甲氨喋呤和胸腺嘧啶核苷的细胞培养基。
[0081]
(2)于细胞融合前一天准备饲养细胞;
[0082]
ⅰ
.取二只健康成年balb/c雄鼠,拉颈处死后于75%乙醇浸泡2min。
[0083]
ⅱ
.移至超净台内,剪开腹部皮肤向两侧剥离,暴露腹壁。
[0084]
ⅲ
.用无菌7号针头吸5ml rpmi
‑
1640培养基注入腹腔,反复轻揉腹壁后再吸出rpmi
‑
1640培养基至20ml离心管中。
[0085]
ⅳ
.如此反复三次后剪开腹膜,用吸管吸尽剩下的培养液。
[0086]
ⅴ
.1500rpm离心10min,弃上清,以50ml完全选择培养基(含20%ncs,1
×
hat和1
×
ps的rpmi
‑
1640)重悬于10cm培养皿中;ps为gibco
tm
生产的货号为15140122的ps双抗。
[0087]
ⅵ
.以8道移液器按100μl/孔将细胞悬液转移至5块无菌的96孔细胞培养板中,于37℃、5%co2孵箱中培养。
[0088]
(3)细胞融合前准备;
[0089]
ⅰ
.配制完全选择培养基:吸取ncs 20ml、100
×
hat 2ml及100
×
ps 1ml于87ml rpmi
‑
1640培养基中,充分混匀置37℃水浴备用。
[0090]
ⅱ
.配制42%peg:将经高压消毒的peg 3350于56℃水浴中融化,吸0.5ml与0.7ml pbs混匀后,置37℃水浴备用。peg为sigma
‑
aldrich西格玛奥德里奇(上海)贸易有限公司生产的cas号为25322
‑
68
‑
3的聚乙二醇3350。
[0091]
(4)准备骨髓瘤细胞;
[0092]
将处于对数生长期的三瓶骨髓瘤细胞收集至一支离心管内,以rpmi
‑
1640培养基10ml重悬、离心洗涤一次后重悬于10ml培养液中,以0.2%台盼蓝染色进行细胞计数(1.2
×
107)并计活细胞数(>95%),吸9ml(细胞数为107个)细胞悬液于离心管中,1000rpm离心收集细胞,置室温中备用。
[0093]
(5)制备小鼠脾细胞;
[0094]
ⅰ
.将5天前经过冲击免疫的balb/c小鼠摘眼球放血处死(收集鼠血清备用),在75%乙醇中浸泡2min;
[0095]
ⅱ
.将小鼠置于超净台内,剪开腹部皮肤及腹膜,换新剪刀、镊子取出小鼠脾脏,于培养皿中用培养液洗涤并剪去筋膜组织,然后置于200目筛网上,一边用注射器芯轻轻磨碎,一边以培养液冲洗并收集至20ml离心管;
[0096]
ⅲ
.1000rpm离心10min收集细胞,再以rmpi
‑
1640培养液10ml重悬、离心洗涤二次,重悬于10ml培养液中以0.2%台盼蓝染色,行细胞计数(1.7
×
108)及活细胞计数(>90%),吸6ml(细胞数为108个)细胞悬液经1000rpm离心收集细胞,置于室温备用。
[0097]
(6)细胞融合;
[0098]
ⅰ
.将收集的骨髓瘤细胞和脾细胞移至一支50ml离心管内(细胞数之比为1:10),800rpm离心10min,尽量吸尽上清后轻弹管底部将细胞混匀呈糊状。
[0099]
ⅱ
.将离心管置于37℃水中,取0.6ml经37℃预热的42%peg缓慢滴入细胞糊中(约1min加完),一边滴加一边用吸管轻柔搅拌,加完后继续于37℃水浴中轻轻搅拌1min。
[0100]
ⅲ
.吸取10ml 37℃预热的rpmi0
‑
1640培养液,1min内边摇晃离心管边缓慢滴加1ml培养液,剩下的9ml培养液在2min内边摇边加入。
[0101]
ⅳ
.500rmp离心5min,弃上清,以50ml完全选择培养基重悬于无菌的10cm培养皿中;
[0102]
ⅴ
.以8道移液器将细胞悬液按100μl/孔接种到前一日接种了饲养细胞的5块96孔细胞培养板中;于37℃、5%co2孵箱中培养。
[0103]
(7)融合后培养;
[0104]
ⅰ
.7天后以完全选择培养基半量换液,以后每3-5天半量换液;
[0105]
ⅱ
.10天后开始对培养上清进行elisa检测,并以含20%ncs、1
×
ht和1
×
ps的rpmi
‑
1640半量换液;
[0106]
ⅲ
.20天后以仅含20%ncs与ps的rpmi
‑
1640培养。
[0107]
图1为细胞融合结果图,如图1中的a所示,融合后5天可见杂交瘤细胞呈集落性生长,一周后可见约70%以上的培养孔有杂交瘤细胞生长,如图1中的b所示,10天后已有数十个培养孔中的细胞生长至孔底的近1/3。
[0108]
s4、采用elisa方法筛选阳性杂交瘤细胞;
[0109]
(1)包被抗原:将经iptg诱导4h的大肠杆菌sg13009
‑
pqe30和sg13009
‑
pqe30
‑
halr各10ml离心收集菌体,各以5ml包被缓冲液重悬后于冰浴中,超声破碎10min(235w,破碎6秒,间隔4秒),于台式离心机中全速离心20min后分别取上清(蛋白含量约为300μg/ml)以包被缓冲液按1:200稀释,分别包被于96孔酶标板,100μl/孔,置于湿盒中4℃包被过夜。(2)封闭:次日倒弃包被液,叩干后以含3%bsa的pbs溶液按100μl/孔加入各孔,于湿盒中37℃封闭不少于2h。iptg为上海惠诚生物科技有限公司生产的cas号为367
‑
93
‑
1的异丙基
‑
β
‑
d
‑
硫代半乳糖苷。
[0110]
(3)加细胞培养上清:倒弃封闭液,以含0.05%的pbst溶液洗涤3次(每次静置3min),叩干。吸取杂交瘤细胞生长超过孔底1/3的培养孔上清100μl,以1:2稀释于pbst溶液中,按100μl/孔分别加入包被了sg13009
‑
pqe30及sg13009
‑
pqe30
‑
halr细菌裂解液的酶标
板孔中,同时加两孔等倍稀释的sp2/0骨髓瘤培养上清作为阴性对照,于温盒中37℃孵育1h。pbst为磷酸盐吐温缓冲液的英文缩写。
[0111]
(4)加酶标二抗:倒弃培养上清,洗涤3次,叩干,将hrp标记的羊抗鼠igg按1:20,000稀释于含1%bsa的pbst溶液中(含igg 0.2μg/l),按100μl/孔加入,37℃作用45min。hrp为辣根过氧化物酶的英文缩写。
[0112]
(5)显色:倒弃抗体液,洗涤3次,叩干,依次加入tmb显色剂a、b各一滴,显色合适后(约2-5min)加入2m硫酸50μl中止显色,于酶标仪中读取450nm波长下的吸光度值并记录;
[0113]
(6)结果判定:在450nm波长下测得的杂交瘤细胞培养上清和骨髓瘤细胞sp2/0培养上清分别与包被sg13009
‑
pqe30
‑
halr裂解液作用后的吸光度值之比值(s/n值)>2.1;以及在450nm波长下测得的杂交瘤细胞培养上清分别与包被sg13009
‑
pqe30
‑
halr裂解液和包被sg13009
‑
pqe30裂解液作用后吸光度值的比值(p/n值)>2.1作为阳性判断标准。
[0114]
elisa筛选结果:经反复多次elisa检测,最终确定至少三孔杂交瘤细胞为阳性杂交瘤,择其中一次elisa检测结果见表3所示。
[0115]
表3 阳性杂交瘤的elisa筛选
[0116][0117]
*:od值读数<0.007时以0.007计算p/n值
[0118]
s5、采用有限稀释法进行克隆化培养;
[0119]
(1)在进行有限稀释前一天准备饲养细胞:一只小鼠的腹腔巨噬细胞用含20%ncs的rpmi
‑
1640培养基20ml稀释后,按100μl/孔接种于两块96孔培养板中;
[0120]
(2)待elisa检测阳性结果最好的一孔细胞生长至孔底近2/3时,将细胞全部移至接种有饲养细胞的96孔培养板的第一列第一孔;
[0121]
(3)在培养板第一列中从上向下等倍稀释,然后用8道移液器在每一行中从左至右再进行等倍稀释,置37℃5%co2孵箱中培养3天,其间尽量少移动;
[0122]
(4)第4天在倒置显微镜下以低倍镜观察,对仅有一个细胞克隆生长的培养孔作好标记;
[0123]
(5)7天后半量换液,同时确认单细胞克隆孔;
[0124]
(6)第11天再次半量换液,同时吸出有杂交瘤细胞生长的培养上清用于elisa检测,方法同s4;
[0125]
(7)当杂交瘤细胞生长至孔底近2/3时,选取仅有一个细胞集落生长,且elisa检测结果最强的一孔细胞,重复以上方法进行第二次有限稀释和elisa筛选;
[0126]
(8)重复多次有限稀释,直到所有仅一个细胞集落生长的培养孔上清elisa检测结果均为阳性为止;
[0127]
(9)将最后一次有限稀释后elisa检测效果最好的细胞克隆先后转至24孔、6孔培养板、25ml、50ml及100ml培养瓶中扩增后冻存。
[0128]
如图2为有限稀释后单克隆杂交瘤形态,基于表3选取其中反应最好的一孔(eb6)进行克隆化培养,经连续五次有限稀释,最终达到所有单细胞克隆孔elisa结果均为阳性。如图2所示,经过三个多月的传代培养,杂交瘤细胞仍能稳定地产生鼠抗halr单克隆抗体。
[0129]
(二)制备人源化alr人鼠嵌合单克隆抗体;
[0130]
s1、以小鼠杂交瘤细胞(分泌igg)(至少含3
×
10^6细胞)加入trizol裂解液,进行rna提取和cdna制备,使用pcr方法扩增抗体的轻、重链序列,将扩增后得到的轻、重链片段分别克隆到t载体上,最后将载体进行测序,分析获取抗体重链可变区(seq id no:1)与cdrs区域(seq id no:3、seq id no:4和seq id no:5),以及轻链可变区(seq id no:2)与cdrs区域((seq id no:6、seq id no:7和seq id no:8)的氨基酸序列。
[0131]
trizol裂解液是一种新型总rna抽提试剂,可以直接从细胞或组织中提取总rna,具体可以采用东盛生物生产的货号为r1021的trazol rna提取裂解液。
[0132]
(1)重链可变区及其
[0133]
evqlqqsgasftelvkpgasvkisckasgywvkqshgkgiwelswvkqshgkgiwelsltvelnsltsedsavyydkssstaymcalwgqgtsvtvssakttppsvyplapgcgdttgssvtlgclvkgyfpesvtvtwnsgslpsgvhtfpallqsglytmsssvtvpsstwpsqtvtcsvahpassttvdkkleprgpkidpcppckechkcpapnleggpsvfifppnikdvlmislspmvtcvvvdvseddpdvqiswfvnnvevhtaqtqthredynstlrvvsalpiqhqdwmsgkefkckvnnkdlpapiertiskikglvrapqvyilpppaeqlsrkdvsltclavgfspedisvewtsnghteenykntapvldsdgsyfiyskldiktskwektdsfscnvrheglhsfylkktisrspgk
[0134]
(2)轻链可变区及其divspsslavsvgekvtmscmsqwyqsqgpkqpklliyyycgvpdrftgsgsgtdftltissvkaedlaifgagtklelkradaaptvsifppsseqltsggasvvcflnnfypkdlnvkwkidgserqngvlnswtdqdskdstysmsstltltkdeyerhnsytceathktstspivksfnrnec
[0135]
s2、pcdna3.4
‑
alr
‑
mγv
‑
hγ1c和pcdna3.4
‑
alr
‑
mκv
‑
hc真核表达载体的构建与表达;
[0136]
(1)配制lb固态培养基,具体原料参见下表4:
[0137]
表4 lb固态培养基
[0138]
原料重量酵母提取物5g胰蛋白胨10g氯化钠10g琼脂粉15g
[0139]
称取表4中的原料,然后采用双蒸水定容至1l,加入naoh调节ph到7.0,120℃高温高压后灭菌,4℃保存备用。
[0140]
(2)配制lb液态培养基,具体原料参见下表5:
[0141]
表5 lb液态培养基
[0142]
原料重量酵母提取物5g胰蛋白胨10g氯化钠10g
[0143]
称取表5中的原料,然后采用双蒸水定容至1l,加入naoh调节ph到7.0,120℃高温高压后灭菌,4℃保存备用。
[0144]
(3)使用限制性内切酶hind
ⅲ‑
nhe1对pcdna3.4载体进行酶切,构建pcdna3.4
‑
alr
‑
mγv
‑
hγ1c和pcdna3.4
‑
alr
‑
mκv
‑
hc真核表达载体,具体构建过程如图3所示。
[0145]
图3为获得人源化alr人鼠嵌合单克隆抗体过程中构建重组质粒的示意图。
[0146]
(4)重组质粒的转化:取出10μl的菌液涂于含有amp抗性的固体lb平板中,37℃孵育12
‑
16h。
[0147]
(5)重组质粒菌落的挑选:随机挑选培养基上的单个菌落,将单个菌落分别溶于20ml的含有100μg/ml的lb液体培养基,180
‑
200转/分过夜培养,以菌体浑浊为佳,过夜摇菌12
‑
16h。
[0148]
(6)无内毒素重组质粒小提:
[0149]
ⅰ
.柱平衡:向吸附柱cp4中(吸附柱放入收集管内)加入500μl的平衡液bl,12000rpm,离心1min,弃掉收集管中的废液,将吸附柱重新套入收集管内。
[0150]
ⅱ
.准备菌液:将20ml过夜培养的菌液于告诉离心机上离心,4000rpm,水平离心10min。弃掉上清液,向留有菌体沉淀的离心管中加入500μl的溶液p1,使用枪头吹散细菌沉淀,转移到2ml ep管中。向ep管中加入500μl的溶液p2,温和上下翻转6
‑
8次,使菌体充分裂解。
[0151]
ⅲ
.向2ml ep管中加入500μl的溶液p4,立即温和上下翻转6
‑
8次,充分混匀可见白色絮状沉淀,室温放置10min后以12000rpm,离心10min;将收集的上清液加入过滤柱cs,以12000rpm,离心2min,将滤液收集在干净的2ml ep管内。
[0152]
ⅳ
.向蛋白液滤液中加入0.3倍等体积的异丙醇,上下颠倒混匀后转移到吸附柱cp4中,分次过柱。室温12000rpm,离心1min后倒掉收集管内的滤液。
[0153]
ⅴ
.向吸附柱cp4中加入500μl去蛋白液pd,室温12000rpm,离心1min,倒掉废液。
[0154]
ⅵ
.向吸附柱cp4中加入600μl去蛋白液pw,12000rpm,离心1min,倒掉废液。
[0155]
ⅶ
.重新套回吸附柱,12000rpm,离心2min,去除残存漂洗液,打开吸附柱cp4,置于室温开盖数min,晾干去除乙醇。
[0156]
ⅷ
.将吸附柱cp4置于一个干净的离心管,加入60μl的灭菌双蒸水,室温放置20min,离心1min,将质粒溶液收集到1.5ml的ep管内,测完浓度放于
‑
80℃保存,一部分用于测序。
[0157]
s3、复苏与培养293f细胞;
[0158]
(1)从液氮中迅速取出293f细胞,放置在37℃水浴锅迅速融化。
[0159]
(2)在超净台中打开细胞冻存管,将细胞悬液转移到含有9ml的无血清培养液的离心管中,1000rpm离心3min,弃上清。
[0160]
(3)加入1ml细胞培养液,充分混匀细胞并计数,将细胞密度调整至3x10^5/ml,并转移到无菌摇瓶。
[0161]
(4)将摇瓶置于37℃,8%的co2细胞摇床培养箱中培养,细胞培养密度不超过3x10^6/ml,细胞培养三代后,再用于转染。
[0162]
s4、转染重组质粒;
[0163]
(1)转染前对细胞计数,并将细胞浓度调整为3
×
10^6/ml。
[0164]
(2)准备15ml离心管,用1.5ml的opti
‑
mem培养液稀释15ug重组质粒,室温静置孵育5min。准备15ml离心管,用1.5ml的opti
‑
mem培养液稀释80μl expi 293转染试剂,室温静置孵育5min。
[0165]
(3)将稀释好的质粒加入稀释后的转染试剂,室温静置孵育20min。将重组质粒
‑
转染试剂混合物逐滴均匀加入细胞摇瓶内,放于37℃,8%的co2细胞摇床箱中培养。培养20h后,加入150μl的enhancer1和1.5ml的enhancer2,继续培养5天后,收集细胞培养液。
[0166]
s5、人源化alr人鼠嵌合单克隆抗体的纯化;
[0167]
(1)将摇瓶中的细胞培养液倒入50ml的离心管中,1500g离心15min。
[0168]
(2)将收集的上清液,继续倒入新的50ml的离心管内,5000g,离心20min。
[0169]
(3)收集上清液,用50ml注射器配合0.45μm的过滤器进行过滤,收集过滤后的滤液。
[0170]
(4)打开akat蛋白纯化仪,用20%的乙醇清洗管道,再用双蒸水清洗内循环中的残留乙醇。
[0171]
(5)准备好所有的通道的待跑液体后,打开a1管到,观察压强值。换上protein g的柱子,待压强平后,再用10ml的双蒸水通过柱子。将进样管到放入过滤后的细胞上清液中,让所有细胞上清液通过柱子。将b2管到放入柠檬酸中,用柠檬酸洗脱,中途可见uv值出现峰值,收集到100μl含有tris
‑
hcl的1.5ml ep管内。
[0172]
(6)将抗体吸入到透析袋中,将透析袋放入5l的pbst中进行4℃低温透析48h,中途每隔24h换一次透析液。
[0173]
(7)将装有抗体的透析袋取出,用0.45μm过滤器过滤后,测完浓度后用pbs稀释成1mg/ml的人源化alr人鼠嵌合单克隆抗体后分装保存在
‑
20℃。
[0174]
实验结果:图4为akta蛋白纯化时蛋白的吸收峰。
[0175]ⅲ.人源化alr人鼠嵌合单克隆抗体的相关验证实验
[0176]
a、银染检测人源化alr人鼠嵌合单克隆抗体的性质;
[0177]
(1)配制15%的分离胶后,加入制胶板后用无水乙醇液封,凝固后,倒掉无水乙醇。
[0178]
(2)配制5%的浓缩胶,混匀后缓慢加到分离胶的上面,加满后插入梳子,约20min凝固后,加入电泳缓冲液,拔掉梳子,准备上样品。
[0179]
(3)将已测完浓度的人源化alr人鼠嵌合单克隆抗体加入等体积的x1的loading buffer混匀后,放入蛋白金属浴煮沸10min后,取出备用。
[0180]
(4)加入上样maker和0.5ug的蛋白,电泳选择恒压模式,浓缩胶选择90v,待样本进入分离胶后,电压加到120v继续电泳到分离胶的底部时,结束电泳。
[0181]
(5)电泳结束后,取出凝胶放入100ml的固定液,放入4℃冰箱摇床(60
‑
70转/分)过夜固定。固定液:50ml乙醇+10ml乙酸+40ml双蒸水。
[0182]
(6)取出凝胶,用100ml的30%的乙醇常温摇床上洗涤10min,速度(60
‑
70转/分)。
[0183]
(7)水洗涤:弃30%乙醇,加入200ml milli
‑
q级纯水或双蒸水,在摇床上室温摇动
10min,摇动速度为60
‑
70rpm。如果本步骤用水洗涤更长时间,对降低染色的背景略有帮助。
[0184]
(8)增敏:弃水,加入100ml银染增敏液(1x),在摇床上室温摇动2min,摇动速度为60
‑
70rpm。银染增敏液(1x)的配制:99ml milli
‑
q级纯水或双蒸水中加入1ml银染增敏液(100x),混匀后即为银染增敏液(1x)。银染增敏液(1x)配制后需在2h内使用。
[0185]
(9)水洗涤(共2次):弃原有溶液,加入200ml milli
‑
q级纯水或双蒸水,在摇床上室温摇动1min,摇动速度为60
‑
70rpm。弃水,再加入200ml milli
‑
q级纯水或双蒸水,在摇床上室温摇动1min,摇动速度为60
‑
70rpm。
[0186]
(10)银染:弃水,加入100ml银溶液(1x),在摇床上室温摇动10min,摇动速度为60
‑
70rpm。银溶液(1x)的配制:99ml milli
‑
q级纯水或双蒸水中加入1ml银溶液(100x),混匀后即为银溶液(1x)。银溶液(1x)配制后需在2h内使用。
[0187]
(11)水洗涤:弃原有溶液,加入100ml milli
‑
q级纯水或双蒸水,在摇床上室温摇动1
‑
1.5min,摇动速度为60
‑
70rpm。注意:水洗涤的时间不能超过1.5min。
[0188]
(12)显色:弃水,加入100ml银染显色液,在摇床上室温摇动3
‑
10min,直至出现比较理想的预期蛋白条带,摇动速度为60
‑
70rpm。银染显色液的配制:80ml milli
‑
q级纯水或双蒸水中加入20ml银染基本显色液(5x),再加入0.05ml银染显色加速液(2000x),混匀后即为银染显色液。银染显色液配制后需在20min内使用。
[0189]
(13)终止:弃银染显色液,加入100ml银染终止液(1x),在摇床上室温摇动10min,摇动速度为60
‑
70rpm。终止时有气体产生属正常现象,产生的气体为二氧化碳。银染终止液(1x)的配制:95ml milli
‑
q级纯水或双蒸水中加入5ml银染终止液(20x),混匀后即为银染终止液(1x)。银染终止液(1x)配制后宜当天使用。
[0190]
(14)水洗涤:弃银染终止液,加入100ml milli
‑
q级纯水或双蒸水,在摇床上室温摇动2
‑
5min,摇动速度为60
‑
70rpm。
[0191]
图5为人源化alr人鼠嵌合单克隆抗体银染结果。实验结果如图5所示,人源化alr人鼠嵌合单克隆抗体有轻链、重链,其余位置无杂带,提示本次纯化的抗体纯度高。
[0192]
b、elisa法检测人源化alr人鼠嵌合单克隆抗体与抗原的结合力;
[0193]
(1)包被抗原:包被浓度为5μg/ml,384孔板每个孔加入10μl的重组人的alr抗原,放入4℃冰箱过夜孵育16h。
[0194]
(2)配制pbst(0.05%的tween 20),具体原料参见下表6:
[0195]
表6 配制pbst
[0196][0197][0198]
称取表6中的原料,然后采用双蒸水定容至1l,加入500μl的tween 20,调节ph值至7.4。
[0199]
(3)弃掉包被液体,放入384微孔机,用pbst洗10个循环。用微孔板离心机甩干3min
后,加入用pbst配制的5%的bsa,每孔加入80μl,37℃封闭1h。
[0200]
(4)弃掉封闭液,放入384微孔机,用pbst洗10个循环再甩干。每孔加入10μl不同浓度的人源化alr人鼠嵌合单克隆抗体,浓度梯度为10μg/ml,1μg/ml,100ng/ml、10ng/ml、1ng/ml、0.1ng/ml和0.01ng/ml,同样设置无关抗体孔,每个组重复3个复孔,37℃孵育1h。
[0201]
(5)弃掉一抗,放入384微孔机,用pbst洗10个循环再甩干。用pbst配制浓度为1:2000的羊抗人的igg抗体,每孔加入80μl,37℃孵育1h。
[0202]
(6)弃掉二抗,放入384微孔机,用pbst洗10个循环再甩干。
[0203]
(7)配制pnpp显影剂(50mg pnpp+40ml双蒸水+10ml 5xbuffer)混匀后每孔加入10μl后避光。放入预热到37℃的读板机,每隔5min自动读取波长在405nm处的吸光值。
[0204]
图6为elisa验证人源化alr人鼠嵌合单克隆抗体的亲和力;如图6所示,用halr的抗原包被后,人源化alr人鼠嵌合单克隆抗体在405nm处有明显吸收峰值,提示人源化alr人鼠嵌合单克隆抗体与人的alr的抗原有明显结合,且抗体浓度在1μg/ml达到最大饱和。
[0205]
c、利用spr技术,测定alr
‑
gst的重组蛋白与人源化alr人鼠嵌合单克隆抗体的亲和力常数;
[0206]
(1)配体偶联:配制hepes(10x)缓冲液母液(0.1m hepes,1.5m nacl,30mm edta,0.5%tween
‑
20,ph7.4),用超纯水将hepes母液稀释10倍,作为运行缓冲液(0.01m hepes,0.15m nacl,3mm edta,0.05%tween
‑
20,ph7.4),连接运行缓冲液试剂瓶至biacore t200;将cm5芯片置于芯片仓;运行primer程序,冲洗系统管路。
[0207]
(2)用10mm醋酸钠缓冲液(ph4.0)将配体alr
‑
gst、sigma
‑
alr稀释至5μg/ml,装入ep管,另将氨基偶联相关试剂装入ep管,置于试剂架上,放入biacore t200样品仓,运行手动程序,依次进行芯片活化、偶联配体、封闭三个步骤,将配体共价偶联至cm5芯片的“3”、“4”通道,“1”通道作为参比通道,只进行活化与封闭,不偶联配体。
[0208]
(3)使用hepes运行缓冲液将分析物稀释成不同浓度梯度。
[0209]
(4)将不同浓度的分析物装入ep管,置于试剂架上,将再生液4m mgcl2装入ep管,置于试剂架上,放入biacore t200样品仓,打开亲和力测定程序,芯片流路选择“2
‑
1、3
‑
1、4
‑
1”通道,采用多循环动力学方法(设置参数:分析物进样60s,流速30ul/min,解离300s;再生液再生150s,流速30μl/min。芯片仓与样品仓温度选择25℃,测定分析物与配体亲和力。
[0210]
图7为分析物(anti
‑
alr)与配体(alr
‑
gst)结合动力学拟合曲线,其中灰色为拟合曲线。如图7所示,kd为6.53e
‑
08m,rmax为117.1ru。提示人源化alr人鼠嵌合单克隆抗体与人的带有gst标签的alr重组蛋白有明显亲和力。
[0211]
d、cck
‑
8检测人源化alr人鼠嵌合单克隆抗体对细胞增值的影响;
[0212]
(1)将处于对数期生长的细胞收集计数,调整细胞密度为100个/μl,接种于96孔中,每孔加入100μl完全培养基。同时设置3个空白孔,加入100μl不含细胞的完全培养基。96孔板四周最外层每孔加入pbs,防止培养基蒸发。
[0213]
(3)将人源化alr人鼠嵌合单克隆抗体(1mg/ml)分别按1:10、1:100和1:500用pbs稀释。处理时间分别为24、48和72h,每种处理方式设3个复孔。在22、46和70h加入10μl cck
‑
8试剂,37℃避光孵育2h。
[0214]
(4)孵育结束后,取出96孔板,用酶标仪读取各孔在450nm处的吸光度值,根据下列公式计算细胞活力,确定下一步实验的方案。
[0215]
细胞活力(%)=(a[腹水]
‑
a[空白])/(a[pbs]
‑
a[空白])
×
100。
[0216]
实验结果:分别将1mg/ml的人源化alr人鼠嵌合单克隆抗体按照1:10、1:50、1:100和1:500稀释后,观察不同浓度下的人源化alr人鼠嵌合单克隆抗体对不同细胞增值的影响。人源化alr人鼠嵌合单克隆抗体在1:10浓度稀释下,在24h条件下,对细胞有明显抑制增值作用,但在共孵育72h后,对细胞的增值抑制作用明显减弱,可能与人源化alr人鼠嵌合单克隆抗体结合完细胞内的alr抗原相关(p<0.01)。
[0217]
e、流式细胞仪检测人源化alr人鼠嵌合单克隆抗体对细胞凋亡的影响;
[0218]
(1)将肝癌细胞hep g2、huh 7、97h、多发性骨髓瘤细胞sp2/0接种于6cm一次性培养皿中,细胞生长至底面积60%时,按1:10比例分别加入人源化alr人鼠嵌合单克隆抗体、pbs和0.004mg/ml的盐酸阿霉素,孵育24h,每个组设置2个复孔。
[0219]
(2)收集细胞与上清液于离心管中,再用预冷pbs洗涤细胞1000rpm离心5min洗涤2次,用1
×
binding buffer重悬细胞,并调整细胞密度为1
×
10^6/ml。
[0220]
(3)取100μl细胞悬液加入5μl fitc和5μl pi室温避光孵育10min。分别设一管细胞只加fitc、一管细胞只加pi和一管细胞不加fitc及pi作为阴性对照,通过流式细胞仪检测,分析荧光数据。
[0221]
实验结果:分别用pbs、0.1ug/μl的人源化alr人鼠嵌合单克隆抗体、0.004mg/ml的盐酸阿霉素分别处理细胞24h后,流式检测对凋亡的影响。与pbs对照组相比,人源化alr人鼠嵌合单克隆抗体不能引起细胞的凋亡。但在盐酸阿霉素诱导的损伤条件下,人源化alr人鼠嵌合单克隆抗体与盐酸阿霉素具有协同促进细胞凋亡的作用,表明人源化alr人鼠嵌合单克隆抗体要在细胞损伤条件下才能发挥促凋亡作用(p<0.01)。
[0222]
f、人源化alr人鼠嵌合单克隆抗体对裸鼠皮下移植瘤的影响;
[0223]
(1)7
‑
8周龄的雄性balb/c裸鼠购买于北京华阜康生物股份有限公司,饲养于重庆医科大学spf级动物中心。
[0224]
(2)将人肝癌细胞huh7细胞稳定扩大培养,将处于对数期的细胞用pbs清洗,1000rpm,5min离心收集,调整细胞浓度为5
×
10^6/ml,取1ml单细胞悬液。再次离心,pbs清洗两次后用100μl pbs重悬(操作在冰上进行)。
[0225]
(3)将25只7
‑
8周balb/c裸鼠,分成3组,每组5
‑
6只,按照分组每组裸鼠右侧腋下注入对应的100μl细胞悬液。
[0226]
(4)观察裸鼠的生长速度、存活与体重变化,成瘤时间、肿瘤生长速度与体积。
[0227]
分别在植入第0、12、15、18、21、24和27天对裸鼠进行称重和瘤体积测量,用游标卡尺测量肿瘤的最长(l)和最短(w)部位,计算肿瘤体积,计算公式为v=l
×
w2/2,其中在第12天皮下瘤长出来后(3
‑
4mm),开始每隔3天分别按照2.5mg/kg、5mg/kg剂量注射人源化alr人鼠嵌合单克隆抗体,对照组注射等体积的pbs。
[0228]
(5)第27天,用戊巴比妥麻醉后处死裸鼠,完整剥离出瘤子,测体积、称重,解剖裸鼠观察是否有转移。
[0229]
图8为人源化alr人鼠嵌合单克隆抗体对huh7细胞裸瘤移植瘤的影响;图8为人源化alr人鼠嵌合单克隆抗体对小鼠体重、移植瘤体积和瘤体重量的影响。实验结果如图7和图8所示,以人肝癌细胞huh7细胞注射balb/c裸鼠右侧腋下,12天肉眼可见所以裸鼠成瘤率100%,将所有成瘤裸鼠随机分成3个组,每组5
‑
6只,待裸鼠瘤子长度3
‑
4mm时,每隔3天注射
2.5mg/kg、5mg/kg的人源化alr人鼠嵌合单克隆抗体,对照组注射等体积的pbs。分别在植入第0、12、15、18、21、24和27天对裸鼠进行称重和瘤体积测量。27天时牺牲老鼠,剥离瘤子测量瘤体重量。与对照组相比,注射5mg/kg的人源化alr人鼠嵌合单克隆抗体,可明显减少移植瘤的体积和重量,差异具有统计学意义(p<0.01)。
[0230]
g、石蜡切片荧光tunel染色;
[0231]
(1)石蜡切片脱蜡至水:依次将切片放入二甲苯ⅰ15min
‑
二甲苯ⅱ15min
‑
无水乙醇ⅰ5min
‑
无水乙醇ⅱ5min
‑
85%酒精5min
‑
75%酒精5min
‑
蒸馏水洗(冬天应该适当延长脱蜡时间)。
[0232]
(2)修复:切片稍甩干后用组化笔在组织周围画圈(防止液体流走),在圈内滴加蛋白酶k工作液覆盖组织,37℃温箱孵育25min。将玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。
[0233]
(3)破膜:切片稍甩干后在圈内滴加破膜工作液覆盖组织,常温下孵育20min,将玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。
[0234]
(4)加试剂1和试剂2:按片子数量和组织大小取tunel试剂盒内适量试剂1(tdt)和试剂2(dutp)按1:9混合,加到圈内覆盖组织,切片平放于湿盒内,37℃恒温箱孵育2h,湿盒内加少量水保持湿度。
[0235]
(5)dapi复染细胞核:切片用pbs(ph7.4)洗涤3次,每次5min。去除pbs后在圈内滴加dapi染液,避光室温孵育10min。
[0236]
(6)封片:玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后用抗荧光淬灭封片剂封片。
[0237]
(7)镜检拍照:切片于荧光显微镜下观察并采集图像。
[0238]
图10为tunel染色结果,实验结果如图10所示,与对照比相比,裸鼠注射5mg/kg的抗alr单抗能明显促进移植瘤细胞的凋亡。
[0239]
另外,对切片进行he染色,图11为he染色结果,如图11的染色结果所示,移植瘤的形态与人肝癌病理形态相似,体现为实体肿瘤。注射人源化alr人鼠嵌合单克隆抗体(5mg/kg)后,细胞排列紊乱,细胞核深染,细胞核固缩,部分细胞核碎裂甚至溶解。
[0240]ⅳ、鼠抗halr单克隆抗体对肝癌生物活性的影响
[0241]
a、采用免疫细胞化学及rt
‑
pcr检测halr在hepg2细胞中的表达情况;
[0242]
hepg2细胞购自中科院上海细胞所,由重庆医科大学病毒性肝炎研究所保存。
[0243]
(1)图12为免疫细胞化学显示hepg2细胞有halr表达,如图12所示,免疫细胞化学检测hepg2细胞有鼠抗halr单克隆抗体(anti
‑
halr mcab)表达:dab显色后,一抗为1:500anti
‑
halr mcab的hepg2细胞有大量棕黄色颗粒(图12中的a),而以阴性对照sp2/0骨髓瘤细胞制备腹水作为一抗hepg2细胞dab显色为阴性(图12中的b)。在蛋白质水平证实hepg2细胞有halr表达。
[0244]
(2)图13为rt
‑
pcr扩增halr和β
‑
actin编码基因电泳图;如图13所示,rt
‑
pcr扩增后,2%凝胶琼脂糖电泳结果显示:在379bp左右有一条明显的dna带,与halr的编码基因大小一致;在255bp左右有一条明显的dna带,与β
‑
actin的编码基因大小一致。无非特异性电泳带,证实hepg2细胞有halr表达。
[0245]
b、采用3h
‑
tdr掺入法检测anti
‑
halr mcab作用后48h和72hhepg2细胞增殖情况;
[0246]
(1)方法:
[0247]
ⅰ
.将5
×
103/孔hepg2细胞接种96孔培养板;种板同时分别加入终浓度(单位为mg/ml)为1:125、1:250、1:500、1:1000anti
‑
halr mcab,每一抗体浓度设3个复孔。分别用终浓度(单位为mg/ml)为1:125、1:250、1:500、1:1000的sp2/0骨髓瘤细胞制备腹水做阴性对照;同时设不加处理因素的空白对照;
[0248]
ⅱ
.在37℃,5%co2培养,分别于种板24h或48h后换液,换液同时均按上述浓度加入anti
‑
halr mcab及其阴性对照,36h加3h
‑
tdr 1μci/孔;继续培养12h,采用0.01m pbs清洗三遍;
[0249]
ⅲ
.胰酶消化至细胞变圆,常规培养基终止消化;用细胞收集器将细胞真空抽滤收集至玻璃纤维滤纸;37℃过夜烘干滤纸;每瓶闪烁瓶中加入5ml闪烁液,将烘干的滤纸夹入闪烁瓶中;
[0250]
ⅳ
.将闪烁瓶置于β
‑
液闪仪中,测定3h放射强度(cpm值);cpm值以
±
s表示,应用spss12.0软件包进行处理,两组间差异比较采用t检验,p<0.05被认为有统计学意义。
[0251]
(2)3h
‑
tdr掺入法检测anti
‑
halr mcab作用48h后hepg2细胞增殖;
[0252]
图14为不同浓度anti
‑
halr mcab作用48h对人肝癌细胞株hepg2细胞增殖的影响;如下表5和图14所示,anti
‑
halr mcab作用hepg2细胞48h后,分别与相同浓度的sp2/0骨髓瘤细胞制备腹水比较,浓度为1:250、1:500的anti
‑
halr mcab作用于hepg2细胞后均能够部分抑制肿瘤细胞增殖,尤以1:250时抑制作用最强。
[0253]
表5 不同浓度anti
‑
halr mcab作用48h对人肝癌细胞株hepg2细胞增殖的影响
[0254][0255]
与相同浓度的sp2/0腹水组相比,*p<0.05,#p<0.01
[0256]
(3)3h
‑
tdr掺入法检测anti
‑
halr mcab作用72h后hepg2细胞增殖;
[0257]
图15为不同浓度anti
‑
halr mcab作用72h对人肝癌细胞株hepg2细胞增殖的影响;如下表6和图15所示,anti
‑
halr mcab作用于体外培养的hepg2细胞72h后,分别与相同浓度的sp2/0骨髓瘤细胞制备腹水比较,浓度为1:125、1:250、1:500的anti
‑
halr mcab,作用于hepg2细胞均能够部分抑制肿瘤细胞增殖,尤以1:250时抑制作用最强。
[0258]
表6 不同浓度anti
‑
halr mcab作用72h对人肝癌细胞株hepg2细胞增殖的影响
[0259][0260][0261]
与相同浓度的sp2/0腹水组相比,*p<0.05,#p<0.01
[0262]
c、anti
‑
halr mcab在体内对裸鼠移植瘤生物学活性的影响;
[0263]
(1)荷瘤鼠模型的建立;
[0264]
ⅰ
.采用0.01m pbs轻轻洗去漂浮的死细胞;
[0265]
ⅱ
.胰酶消化至细胞变圆后,常规培养基终止消化;
[0266]
ⅲ
.收集hepg2细胞;
[0267]
ⅳ
.采用0.01m pbs洗涤细胞三次,分别用终浓度(单位为mg/ml)为1:500的anti
‑
halr mcab及1:500的sp2/0骨髓瘤细胞制备腹水重悬hepg2细胞,0.4%台盼蓝染色计活细胞数,调整细胞密度为1.0
×
107/ml。重悬后的细胞混悬液命名为anti
‑
halr mcab/hepg2及sp2/0骨髓瘤细胞制备腹水/hepg2细胞;
[0268]
ⅴ
.将裸鼠随机分为2组,每组五只。一组接种anti
‑
halr mcab/hepg2细胞,另一组接种sp2/0骨髓瘤细胞制备腹水/hepg2细胞,对每只裸鼠上肢腋下进行皮下注射0.2ml细胞悬液(即每只裸鼠注射2.0
×
106个细胞);
[0269]
ⅵ
.每隔一天在两组裸鼠瘤体内分别多点注射1:500的anti
‑
halr mcab和sp2/0骨髓瘤细胞制备腹水0.2ml/只,连续注射及观察30天;
[0270]
ⅶ
.连续观察30天。每隔两天分别测量肿瘤的最长径(a)和最短径(b),计算肿瘤的体积(v=1/6πab2),绘制肿瘤生长曲线,对两组肿瘤体积进行比较。30d处死裸鼠,取出肿瘤组织,测量肿瘤的重量。
[0271]
ⅷ
.体积及重量以
±
s表示,应用spss12.0软件包进行处理,两组间差异比较采用t检验。p<0.05被认为有统计学意义。
[0272]
实验结果:
[0273]
ⅰ
.图16为接种肿瘤细胞30天后裸鼠成瘤情况;如图16所示,经过3~10天的成瘤潜伏期后,肿瘤接种部位形成肉眼可见的瘤块,其成瘤率均为100%。注射sp2/0骨髓瘤细胞制备腹水组经过8天100%成瘤,注射anti
‑
halr mcab组经过8天60%成瘤,经过10天100%成瘤。
[0274]
ⅱ
.局部注射anti
‑
halr mcab组和sp2/0骨髓瘤细胞制备腹水组裸鼠肿瘤体积变化;
[0275]
图17为注射anti
‑
halr mcab组和sp2/0骨髓瘤细胞制备腹水组裸鼠肿瘤体积变化;如表7和图17所示,注射anti
‑
halr mcab组和sp2/0骨髓瘤细胞制备腹水组相比较,接种肿瘤后27天时,体积分别为2.59
±
0.43vs.3.42
±
0.59,p<0.05;接种30天时,体积分别为2.91
±
0.33vs.3.97
±
0.55,p<0.01。从肿瘤接种后的27天开始,注射anti
‑
halr mcab组肿瘤生长受到明显抑制。说明anti
‑
halr mcab中和了halr后,抑制了肿瘤的生长。
[0276]
表7 注射anti
‑
halr mcab组和sp2/0骨髓瘤细胞制备腹水组裸鼠肿瘤体积变化
[0277][0278]
与sp2/0骨髓瘤细胞制备腹水/hepg2组相比,*p<0.05,#p<0.01
[0279]
ⅲ
.注射anti
‑
halr mcab组和sp2/0骨髓瘤细胞制备腹水组裸鼠肿瘤重量变化;
[0280]
图18为注射anti
‑
halr mcab组和sp2/0骨髓瘤细胞制备腹水组裸鼠肿瘤重量变化;如表8和图18所示,接种肿瘤细胞30天后,接种anti
‑
halr mcab/hepg2细胞,并且注射
anti
‑
halr mcab组瘤块重量为2.53
±
0.44,注射sp2/0骨髓瘤细胞制备腹水组瘤块重量为3.28
±
0.43。t检验显示两组瘤块重量具有显著性差异,p<0.01。证实anti
‑
halr mcab在体内中和了halr的表达后,抑制了肿瘤的生长。
[0281]
表8 注射anti
‑
halr mcab组和sp2/0骨髓瘤细胞制备腹水组裸鼠肿瘤重量变化
[0282]
组别anti
‑
halr mcab/hepg2组sp2/0骨髓瘤细胞制备腹水/hepg2组重量(g)2.53
±
0.443.28
±
0.43
[0283]
ⅳ
.荷瘤鼠肿瘤组织he染色;
[0284]
两组裸鼠分别接种anti
‑
halr mcab/hepg2和sp2/0骨髓瘤细胞制备腹水/hepg2细胞后30天,分离肿块,经固定、包埋、切片后he染色可见癌巢,及部分组织坏死;细胞排列紊乱,细胞核大、深染,有核碎裂溶解及白细胞浸润现象。
[0285]
d、总结:
[0286]
(1)终浓度(单位为mg/ml)为1:125、1:250、1:500、1:1000anti
‑
halr mcab(鼠抗halr单克隆抗体)作用于hepg2细胞后,终浓度1:250为anti
‑
halr mcab抑制肿瘤细胞增殖效果最佳;
[0287]
(2)浓度1:250的anti
‑
halr mcab注射于裸鼠皮下移植瘤部位能明显抑制肿瘤生长;
[0288]
(3)本实验证实了鼠抗halr单克隆抗体能够明显抑制肿瘤细胞增殖,说明人源化alr人鼠嵌合单克隆抗体具有抑制人类肝癌细胞增殖的巨大潜力,为今后进一步研究halr在肝癌发生、发展过程中的作用奠定基础。
[0289]
ⅴ
、鼠抗halr单克隆抗体(anti
‑
alr mcab)对多发性骨髓瘤的影响
[0290]
在用balb/c小鼠制备单克隆抗体腹水时,发现抗人15kdalr杂交瘤细胞接种balb/c小鼠腹腔后,在产生一两轮腹水后腹水自行消失,小鼠恢复如初,开腹检查找不到任何接种杂交瘤细胞的痕迹;而sp2/0骨髓瘤细胞接种balb/c小鼠腹腔后,则无此现象,小鼠反复产生腹水,直到死亡。分析原因,我们有三点推测:第一,杂交瘤细胞可能产生和分泌大量alr,而且严重依赖alr来维持其恶性生长,杂交瘤细胞产生和分泌的alr应来自骨髓瘤细胞;第二,骨髓瘤细胞是以自分泌方式产生alr,使用单克隆抗体能阻断肿瘤细胞的自分泌循环从而抑制肿瘤的生长;第三,杂交瘤细胞产生的抗人alr抗体能与小鼠骨髓瘤细胞产生的alr特异性结合,提示人和小鼠的alr存在着交差免疫原性。因而,提出了抗人alr嵌合抗体不仅能用于肝癌的治疗,也能用于人多发性骨髓瘤的治疗,并进一步进行试验验证。
[0291]
a、不同骨髓瘤细胞系15kdalr的表达情况:
[0292]
采用western blot分别检测人多发性骨髓瘤u266、mm1.s和rpmi8226细胞中15kdalr的表达情况。
[0293]
图19为不同人多发性骨髓瘤细胞系15kdalr的表达情况(*p<0.05)。如图19所示,为了明确不同的人骨髓瘤细胞系15kdalr的表达,选取15kdalr表达最高的细胞作为后续实验的细胞系。
[0294]
首先采用western blot对不同人多发性骨髓瘤细胞系的15kdalr的表达情况进行检测,结果表明在没有外界因素干预情况下,在u266、rpmi8226和mm1.s三种人多发性骨髓瘤细胞系中,u266中15kdalr表达最高。
[0295]
b、cck
‑
8检测细胞活性
[0296]
(1)实验设为3个组,分别为pbs组,阴性腹水组anti
‑
alr(
‑
),抗体组anti
‑
alr(+),分别加入pbs,阴性杂交瘤产生的腹水和阳性杂交瘤株产生的腹水处理细胞。处理时间分别为24、48和72h,每种处理方式设3个复孔;
[0297]
(2)将处于对数期生长的细胞收集计数,调整细胞密度为100个/μl,接种于96孔中,每孔加入100μl完全培养基。同时设置3个空白孔,加入100μl不含细胞的完全培养基。96孔板四周最外层孔加入pbs,防止培养基蒸发;
[0298]
(3)将pbs、阴性腹水和anti
‑
alr mcab腹水按1:10、1:50、1:100浓度(腹水:培养基)经0.22μm滤器滤过除菌后加入孔中处理细胞。在22、46和70h加入10μlcck
‑
8试剂,37℃避光孵育2h;
[0299]
(4)孵育结束后,取出96孔板,用酶标仪读取各孔在450nm处的吸光度值,根据下列公式计算细胞活力,确定下一步实验的方案。
[0300]
细胞活力(%)=(a[腹水]
‑
a[空白])/(a[pbs]
‑
a[空白])
×
100。
[0301]
图20为不同浓度鼠抗halr单克隆抗体作用不同时间对细胞活力的影响(*p<0.05,**p<0.01),如图20所示,鼠抗halr单克隆抗体作用细胞后,随着作用浓度增加,作用时间延长,鼠抗halr单克隆抗体对u266细胞活力的影响增加,当抗体浓度为1:10,作用时间为72h,细胞活力降至50%。
[0302]
根据以上实验结果,控制鼠抗halr单克隆抗体的浓度1:10,作用时间72h作为后续实验的实验条件。
[0303]
图21为鼠抗halr单克隆抗体处理细胞不同时间对细胞计数的影响;图22为鼠抗halr单克隆抗体处理细胞不同时间对细胞活力的影响。用1:10的浓度处理u266细胞72h后进行细胞计数,结果发现随作用时间的延长,与阴性腹水处理组anti
‑
alr(
‑
)和pbs组相比,鼠抗halr单克隆抗体实验组anti
‑
alr(+)能减缓u266细胞的生长速度(图21)和明显降低细胞活力(图22),而阴性腹水处理组anti
‑
alr(
‑
)和pbs组相比,两者对细胞计数和细胞活力的差别无统计学差异。
[0304]
c、edu检测细胞增殖;
[0305]
(1)将人多发性骨髓瘤细胞u266按每孔1
×
106个细胞接种于6孔板中,细胞生长至底面积60%时,按1:10比例分别加入pbs、阴性腹水和anti
‑
alr mcab腹水,37℃孵育72h,每个处理组设2个复孔。
[0306]
(2)edu标记:细胞处理至70h,用细胞培养基按1000:1的比例稀释edu溶液,制备适量50μm edu培养基。细胞培养基更换为edu培养基,每孔加入1ml,孵育2h。设置1个不加edu培养基的对照组,以便进行流式检测数据的染料背景分析。
[0307]
(3)细胞处理:2h后将细胞收集至流式管中,350g离心5min,用枪头吸弃上清;用1ml pbs重悬细胞,350g离心5min,弃上清;每管加入1ml 4%多聚甲醛固定15~30min后,600g离心10min,弃上清;每管加入2ml 2mg/ml甘氨酸中和5min,600g离心10min弃上清,2ml pbs清洗1次,600g离心5min弃上清;每管加入1ml 0.5%tritonx
‑
100渗透剂室温孵育10min,600g离心10min弃上清,2ml pbs清洗1次弃上清。
[0308]
(4)apollo染色:按说明书配制染色反应液,室温避光保存;每管加入100~500μl的染色反应液,充分重悬细胞,避光、室温孵育10min后,600g离心10min,弃染色反应液;每管加入3ml 0.5%tritonx
‑
100渗透剂室温清洗1次,600g离心
10min弃上清,500μl pbs重悬。
[0309]
(5)上机检测,最大激发波长643nm,最大发生波长667nm,采样数量1
×
104个细胞,分析荧光数据。
[0310]
图23为鼠抗halr单克隆抗体对细胞增殖影响;如图23所示:阻断分泌到细胞外的15kdalr后会抑制细胞的增殖,这与cck8的结果相一致。
[0311]
d、鼠抗halr单克隆抗体对小鼠多发性骨髓瘤的影响;
[0312]
(1)收集处于对数生长期的sp2/0细胞,用预冷的pbs重悬后800rpm离心5min,洗涤细胞三次。
[0313]
(2)无血清dmem培养基重悬细胞并计数,调整细胞密度至2.0
×
106个/ml,至于冰盒上防止细胞活化,并于1h内注射。
[0314]
(3)balb/c小鼠共20只,于每只小鼠右前肢腋下皮下接种sp2/0骨髓瘤细胞悬液0.5ml,即每只裸鼠接种1.0
×
106个sp2/0细胞。
[0315]
(4)待能于小鼠皮下扪及肿瘤结节时(约8天),根据小鼠体重,结节大小将小鼠平均分为3组,每组6只。分别于结节内及周围多点皮下注射0.22μm滤过除菌后的anti
‑
alr(+)腹水,anti
‑
alr(
‑
)腹水,pbs,注射量为0.2ml/10g。自接种sp2/0细胞之日起,共观察28天。
[0316]
(5)每7天用游标卡尺测量裸鼠皮下肿瘤最长径(a)和最短径(b),计算肿瘤体积,公式为:绘制肿瘤生长曲线,比较三组动物肿瘤体积。
[0317]
(6)28天后处死动物,剥离肿瘤组织,测量并比较肿瘤重量。
[0318]
(7)肿瘤体积及重量以表示,应用统计软件graphpad prism 5.0进行统计分析,多组间差异比较采用单因素方差分析(one
‑
way anova),p<0.05被认为差异有统计学意义。
[0319]
实验结果:
[0320]
20只雌性balb/c小鼠于右前肢腋下接种1.0
×
106个sp2/0细胞后,第8天均能在皮下扪及皮下结节,成瘤率100%,弃掉状态最差的2只小鼠,剩余18只小鼠根据体重和皮下结节大小平均分为3组,每组6只,于第9天开始进行anti
‑
alr(+)腹水,anti
‑
alr(
‑
)腹水或pbs皮下注射。
[0321]
(1)图24为接种细胞2周时balb/c小鼠皮下移植瘤生长情况。每周测量肿瘤体积大小,根据体积大小绘制肿瘤生长曲线。
[0322]
(2)鼠抗halr单克隆抗体能够抑制sp2/0皮下移植瘤。具体地,图25为生存曲线;图26为治疗4周后肿瘤情况;图27为治疗4周后肿瘤的质量和体积。
[0323]
在治疗过程中,pbs组和anti
‑
alr(
‑
)腹水组分别有1只小鼠死亡,生存曲线结果见图25。4周治疗结束时,anti
‑
alr(+)腹水组与pbs组和anti
‑
alr(
‑
)腹水组相比肿瘤大小有明显差异,pbs组和anti
‑
alr(
‑
)腹水组肿瘤更大,影响小鼠前肢活动,部分小鼠肿瘤表面还出现表皮破溃结痂,结果见图26。乙醚麻醉后处死小鼠,完整剥离肿瘤进行体积和重量测量,结果见图27。
[0324]
e、总结:
[0325]
(1)在没有外界因素干预情况下,在u266、rpmi8226和mm1.s三种人多发性骨髓瘤细胞系中,u266细胞中15kdalr表达最高;
[0326]
(2)鼠抗halr单克隆抗体能够抑制u266细胞活力,抑制u266细胞增殖,抑制sp2/0皮下移植瘤生长,为研究人源化alr人鼠嵌合单克隆抗体在多发性骨髓瘤发生、发展过程中的作用奠定基础。
[0327]
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术人员无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1