一种抗人TSLP单克隆抗体及其应用的制作方法
一种抗人tslp单克隆抗体及其应用
技术领域
1.本技术涉及抗体药物领域。具体地,本技术涉及针对人胸腺基质淋巴细胞生成素(tslp)单克隆抗体及其应用。
背景技术:
2.细胞因子和免疫细胞介导特异性的生理机制或通路,例如,导致多种炎性紊乱的通路。人胸腺基质淋巴细胞生成素(tslp)是由人上皮细胞产生的il
‑
7类细胞因子。其促进b细胞分化并且还能够共刺激胸腺细胞和成熟t细胞。tslp结合至人cd11c
+
树突细胞(dc)上的特异性异二聚体受体。该受体异二聚体由普通的γ类似受体链(tslp受体;tslpr)和il
‑
7r
‑
α链的异二聚体组成。参见例如tonozuka等,cytogenet.cellgenet.93:23
‑
25,2001;pandey等,nat.immunol.1:59
‑
64,2000;l.s.park等,j.exp.med.192:659
‑
670,2000;reche等,j.immunol.167:336
‑
343,2001。结合于受体的配体诱导dc分泌吸引th2的化学因子,tarc(胸腺和激活调节的化学因子)和mdc(巨噬细胞衍生的化学因子)。此外,tslp也诱导有效的dc激活、天然cd
4+
t细胞扩展、和随后极化为th2表型,产生前过敏性(pro
‑
allergic)细胞因子白介素4(il
‑
4)、il
‑
5、il
‑
13和肿瘤坏死因子
‑
α。
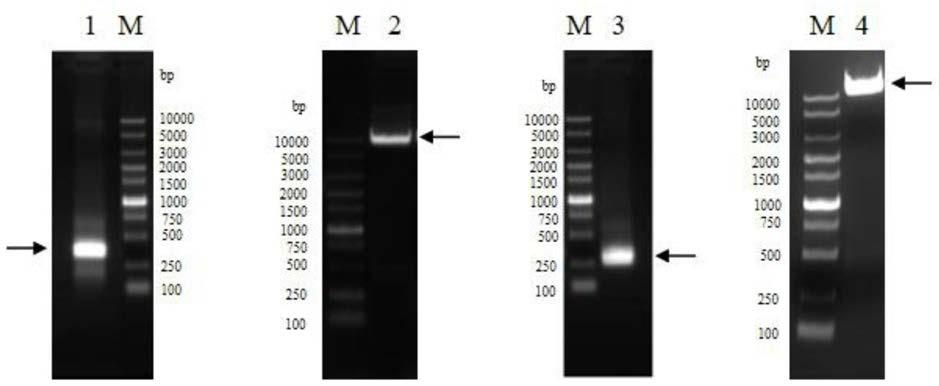
3.还发现tslp信号导致stat5转录因子的激活。而且,已有报道,急性和慢性的特应性皮炎患者在皮肤伤口过表达tslp,表明tslp表达与体内的过敏性炎症有关。除了皮肤的角质细胞,也已经在支气管上皮细胞、平滑肌和肺成纤维细胞中发现高水平的tslp表达,支持tslp在呼吸过敏指征中的可能作用。此外,ige激活的肥大细胞表达非常高水平的tslp,该机制可能参与维持th2表型。
4.在西方国家中约20%的人口患有炎性紊乱,例如,过敏性疾病,其包括哮喘、鼻炎、特应性皮炎和食物过敏。特应性皮炎患者的50%到80%具有或发展哮喘或变态反应性鼻炎。迄今为止,无法治愈过敏诱导的哮喘、特应性皮炎和变态反应性鼻炎。当前的治疗,例如使用β
‑
2肾上腺素受体拮抗物用于哮喘,爱宁达(elidel)用于特应性皮炎,和h1
‑
抗组织胺用于变态反应性鼻炎,来靶向这些征状。因此在本领域越来越需要更好的治疗方法来治疗这些炎性紊乱,特别是,过敏性炎症。本技术解决此问题和其它问题。
技术实现要素:
5.本技术的目的在于提供一种新的抗人tslp单克隆抗体、包含该单克隆抗体的药物组合物以及该单克隆抗体的制药用途。
6.本技术的技术方案如下所述:
7.1.一种抗人tslp单克隆抗体,其包含三个重链互补决定区(cdr
‑
h1、cdr
‑
h2以及cdr
‑
h3)和三个轻链互补决定区(cdr
‑
l1、cdr
‑
l2以及cdr
‑
l3),其中:
8.cdr
‑
h1(在本说明书中cdr
‑
h1表示重链cdr1)的氨基酸序列如seq id no:1(syyms)所示;
9.cdr
‑
h2(在本说明书中cdr
‑
h2表示重链cdr2)的氨基酸序列如seq id no:2
(fisyggsayhatwaqg)所示;
10.cdr
‑
h3(在本说明书中cdr
‑
h3表示重链cdr3)的氨基酸序列如seq id no:3(efrsmtygaewgi)所示;
11.cdr
‑
l1(在本说明书中cdr
‑
l1表示轻链cdr1)的氨基酸序列如seq id no:4(qasesiydtla)所示;
12.cdr
‑
l2(在本说明书中cdr
‑
l2表示轻链cdr2)的氨基酸序列如seq id no:5(sasslas)所示;
13.cdr
‑
l3(在本说明书中cdr
‑
l3表示轻链cdr3)的氨基酸序列如seq id no:6(qqgytmpdvdknp)所示。
14.2.根据项1所述的单克隆抗体,其包含重链可变区和轻链可变区,其中,
15.所述重链可变区的氨基酸序列如seq id no:7所示,其氨基酸序列为evqlvesggglvqpggslrlscaasgfslssyymswvrqapgkglewv gfisyggsayhatwaqgrftiskdnskntlylqmnslraedtavyycar efrsmtygaewgiwgqgtlvtvss;
16.所述轻链可变区的氨基酸序列如seq id no:8所示,其氨基酸序列为ayqmtqspssvsasvgdrvtitcqasesiydtlawyqqkpgkapklliys asslasgvpsrfsgsgsgtdftltisslqpedfatyycqqgytmpdvdkn pfgggtkveik。
17.3.一种分离的核酸,其编码前述任一单克隆抗体。
18.4.一种宿主细胞,其包含根据项3所述的核酸。
19.所述核酸可以存在于载体上。载体可以属于任意类型,例如,重组载体诸如表达载体。可以使用多种宿主细胞中的任一种。在一个实施方案中,宿主细胞是原核细胞,例如,大肠杆菌(e.coli)。在另一个实施方案中,宿主细胞是真核细胞,例如,哺乳动物细胞,诸如中国仓鼠卵巢(cho)细胞。
20.5.一种生产单克隆抗体的方法,所述方法包括培养根据项4所述的宿主细胞从而生产前述任一单克隆抗体。
21.所述方法包括在合适的宿主细胞中表达编码所述抗人tslp单克隆抗体的重组载体,从而生产所述单克隆抗体。在某些实施方案中,所述方法包括培养包含编码所述抗人tslp单克隆抗体的核酸的宿主细胞,从而表达所述核酸。所述方法可以进一步包括从宿主细胞培养物或宿主细胞培养基回收所述抗人tslp单克隆抗体。
22.6.一种药物组合物,其包含前述任一单克隆抗体和药学上可接受的载体。
23.所述药物组合物可以进一步包含另外的治疗剂(例如,不同的抗人tslp抗体)。
24.7.根据项6所述的药物组合物,其用于治疗tslp介导的信号转导相关的疾病。
25.8.根据项7所述的药物组合物,其中,所述tslp介导的信号转导相关的疾病为过敏性哮喘、过敏性皮炎、过敏性鼻炎、过敏性结膜炎、特应性皮炎纤维变性以及炎性肠病等。
26.9.前述任一单克隆抗体在制备用于治疗tslp介导的信号转导相关的疾病的药物中的用途。
27.10.根据项9所述的用途,其中,所述tslp介导的信号转导相关的疾病为过敏性哮喘、过敏性皮炎、过敏性鼻炎、过敏性结膜炎、特应性皮炎纤维变性以及炎性肠病等。
28.11.一种治疗tslp介导的信号转导相关的疾病的方法,其包括:
29.向有此需要的受试者给药根据前述任一项所述的单克隆抗体或根据前述任一项
所述的药物组合物。
30.12.根据项11所述的方法,其中,所述tslp介导的信号转导相关的疾病为过敏性哮喘、过敏性皮炎、过敏性鼻炎、过敏性结膜炎、特应性皮炎纤维变性以及炎性肠病等。
31.本技术提供了一种新的抗人tslp单克隆抗体,其与现有技术中的抗人tslp单克隆抗体(tezepelumab为安进/阿斯利康公司研发的靶向tslp的单克隆抗体药物,tezepelumab治疗重度哮喘的三期临床navigator获得成功)相比,结合tslp的亲和力相当,且细胞水平的中和活性优于tezepelumab。
32.本技术的单克隆抗体,在细胞水平显示出优于tezepelumab(根据专利公开序列表达制备)的中和活性,其有望在预防和治疗相关疾病方面展现出良好的临床效果。
附图说明
33.附图用于更好地理解本技术,不构成对本技术的不当限定。其中:
34.图1是显示构建hzd8g2
‑
57瞬转表达质粒的核酸电泳结果的图。其中,m:marker;条带1:pcr产物8g2vh
‑
hu27;条带2:phzdch,hindiii/nhei;条带3:pcr产物8g2vk
‑
hu14;条带4:phzdck,hindiii/bsiwi。
35.图2是瞬转表达流程图。
36.图3是qx008n(hzd8g2
‑
57)的电泳检测图。
37.图4是显示qx008n和tezepelumab中和人tslp诱导sw756
‑
stat5
‑
luciferase细胞中stat5磷酸化的活性图。
38.图5是显示qx008n和tezepelumab中和天然tslp诱导的sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化活性图。
39.图6是显示qx008n和tezepelumab中和食蟹猴tslp诱导的sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化活性图。
40.图7是显示qx008n和tezepelumab中和人tslp诱导人全血释放tarc(ccl17)活性图。
41.图8是显示qx008n和tezepelumab中和人tslp诱导人pbmc细胞释放tarc(ccl17)活性图。
具体实施方式
42.以下对本技术的示范性实施例做出说明,其中包括本技术实施例的各种细节以助于理解,应当将它们认为仅仅是示范性的。因此,本领域普通技术人员应当认识到,可以对这里描述的实施例做出各种改变和修改,而不会背离本技术的范围和精神。同样,为了清楚和简明,以下的描述中省略了对公知功能和结构的描述。
43.本说明书中提及的科技术语具有与本领域技术人员通常理解的含义相同的含义,如有冲突以本说明书中的定义为准。
44.一般而言,本说明书中采用的术语具有如下含义。
45.在本说明书中,“分离的”抗体是已经与它的天然环境的组分分离的抗体。在某些实施方案中,将抗体纯化至大于95%或99%纯度,所述纯度通过例如电泳(例如,sds
‑
page等电聚焦(ief)、毛细管电泳)或色谱(例如,离子交换或反相hplc)来确定。关于评价抗体纯
度的方法的综述,参见例如flatman等,j.chromatogr.b848:79
‑
87(2007)。
46.在本说明书中,“单克隆抗体”表示得自基本上同源的抗体的群体的抗体,即,构成所述群体的各个抗体是相同的和/或结合相同表位,除了可能的变体抗体(例如,含有天然存在的突变或在单克隆抗体制品的生产过程中产生)以外,这样的变体通常以微量存在。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制品不同,单克隆抗体制品的每种单克隆抗体针对抗原上的单个决定簇。因而,修饰语“单克隆”指示所述抗体得自基本上同源的抗体群体的特征,并且不应解释为需要通过任何特定方法生产所述抗体。例如,要根据本技术使用的单克隆抗体可以通过多种技术来制备,所述技术包括、但不限于杂交瘤方法、重组dna方法、噬菌体展示方法、和使用包含人免疫球蛋白基因座的全部或部分的转基因动物的方法,本文描述了这样的方法和其它示例性的制备单克隆抗体的方法。
47.在本说明书中,“亲和力”表示分子(例如,抗体)的单个结合位点和它的结合配偶体(例如,抗原)之间的非共价相互作用的总和的强度。除非另外指出,否则本说明书中使用的“结合亲和力”表示反映结合对(例如,抗体和抗原)的成员之间的1∶1相互作用的固有结合亲和力。分子x对它的配偶体y的亲和力通常可以由平衡解离常数(k
d
)表示。通过本领域已知的常见方法,可以测量亲和力。
48.在本说明书中,人胸腺基质淋巴细胞生成素(human thymic stromal lymphopoietin,tslp)表示一种源自人的细胞因子,其氨基酸序列如seq id no:9所示,其中,下划线部分表示信号肽。
49.seq id no:9:
50.mfpfallyvlsvsfrkifilqlvglvltydftncdfekikaaylstiskdlitymsgtkstefnntvscsnrphclteiqsltfnptagcaslakemfamktkaalaiwcpgysetqinatqamkkrrkrkvttnkcleqvsqlqglwrrfnrpllkqq
51.在本说明书中,“抗人tslp单克隆抗体”表示这样的单克隆抗体:其能够以足够的亲和力结合人tslp,使得所述单克隆抗体可用作靶向人tslp的诊断剂和/或治疗剂。
52.本技术的抗人tslp单克隆抗体与靶标无关的蛋白不结合。这里,“无关的蛋白”是指除作为靶标的人tslp以外的其他蛋白;这里,“不结合”是指:在将本技术的抗人tslp单克隆抗体与作为其靶标的人tslp的结合能力作为100%的情况下,本技术的抗人tslp单克隆抗体与所述无关蛋白的结合能力小于10%,例如9%、8%、7%、6%、5%、4%、3%、2%、1%或者0。
53.本技术的抗人tslp单克隆抗体与其他动物种属的tslp可以不结合。这里,“其他动物种属”是指除人以外的其他动物种属,例如狨猴、食蟹猴、猪、犬、兔、大鼠、小鼠、豚鼠等;这里,“不结合”是指:在将本技术的抗人tslp单克隆抗体与作为其靶标的人tslp的结合能力作为100%的情况下,本技术的抗人tslp单克隆抗体与其他动物种属的tslp的结合能力小于10%,例如9%、8%、7%、6%、5%、4%、3%、2%、1%或者0。
54.本技术的人tslp单克隆抗体具有≤1μm、≤100nm、≤50nm、≤40nm的平衡解离常数(k
d
)。
55.实验结果显示,本技术的抗人tslp单克隆抗体可以特异性结合人tslp。
56.本技术的抗人tslp单克隆抗体在诸多生物活性方面与上市同类单抗产品相当、或优于上市同类单抗产品。所述生物活性例如中和人、天然、食蟹猴tslp诱导细胞中stat5磷
酸化的活性、中和人tslp诱导人全血、人pbmc细胞释放tarc(ccl17)的活性等。
57.在一个具体实施方式中,本技术的抗人tslp单克隆抗体的重链的氨基酸序列如seq id no:10所示;轻链的氨基酸序列如seq id no:11所示。
58.seq id no:10
59.evqlvesggglvqpggslrlscaasgfslssyymswvrqapgkglewvgfisyggsayhatwaqgrftiskdnskntlylqmnslraedtavyycarefrsmtygaewgiwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
60.seq id no:11
61.ayqmtqspssvsasvgdrvtitcqasesiydtlawyqqkpgkapklliysasslasgvpsrfsgsgsgtdftltisslqpedfatyycqqgytmpdvdknpfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
62.其中,seq id no:10和11均为经人源化的序列。
63.在本说明书中,“分离的”核酸表示已经与它的天然环境的组分分离的核酸分子。分离的核酸包括通常含有核酸分子的细胞中包含的核酸分子,但是所述核酸分子存在于染色体外或在不同于其天然染色体位置的染色体位置。
64.在本说明书中,“分离的编码抗tslp单克隆抗体的核酸”表示编码抗体重链和轻链的一个或多个核酸分子,包括在单个载体或分开的载体中的这样的核酸分子、以及存在于宿主细胞中的一个或多个位置的这样的核酸分子。
65.在本说明书中,“载体”表示能够扩增与其连接的另一核酸的核酸分子。该术语包括作为自我复制的核酸结构的载体以及整合进它已经引入其中的宿主细胞的基因组中的载体。某些载体能够指导与其可操作地连接的核酸的表达。这样的载体在本文被称为“表达载体”。
66.在本说明书中,“宿主细胞”、“宿主细胞系”和“宿主细胞培养”可互换使用,且表示其中已经引入外源核酸的细胞,包括这种细胞的后代。宿主细胞包括“转化体”和“转化的细胞”,其包括原代转化的细胞和由其来源的后代(不考虑传代数)。后代在核酸内容物方面可以与亲本细胞不完全相同,但是可以含有突变。针对最初转化的细胞筛选或选择的具有相同功能或生物活性的突变体后代被包括在本说明书中。
67.在本说明书中,“药物组合物”表示这样的制品:其呈现使得包含在其中的活性成分的生物活性能够发挥效果的形式,并且所述组合物不含有对所述制剂要施用的受试者有不可接受的毒性的额外组分。
68.在本说明书中,“药学上可接受的载体”表示药物组合物中除了活性成分之外的成分,其对受试者无毒。药学上可接受的载体包括、但不限于缓冲剂、赋形剂、稳定剂或防腐剂。
69.在本技术书中,“单克隆抗体”一般为人抗体,其可以使用本领域技术人员公知的技术来制备,例如,人抗体一般描述于van dijk,m.a.and van de winkel,j.g.,curr.opin.pharmacol.5:368
‑
374(2001)及lonberg,n.,curr.opin.immunol.20:450
‑
459
(2008)。
70.可以通过向已经经过修饰而对抗原攻击刺激生产完整人抗体或具有人类可变区的完整抗体的转基因动物施用免疫原来制备抗体,这些动物通常含有一部分或全部的人类免疫球蛋白基因座,其替换了内源免疫球蛋白基因座,或者存在于染色体外或随机整合于动物体内。在此类转基因小鼠中,内源免疫球蛋白基因座一般已经失活,关于自转基因动物获得人抗体的方法的综述,参见lonberg,n.,nat.biotech.(自然生物技术)23:1117
‑
1125(2005)。还可参见例如美国专利no.6,075,181和no.6,150,584描述的xenomouse
tm
技术;美国专利no.5,770,429描述的技术;美国专利no.7,041,870描述的技术,和美国专利申请公开文本no.us 2007/0061900描述的技术。可以例如通过与不同人恒定区组合进一步修饰来自由此类动物生成的完整抗体的人可变区。
71.还可以通过基于杂交瘤的方法来制备人抗体。已描述了用于生产人单克隆抗体的人骨髓瘤和小鼠
‑
人杂交骨髓瘤细胞(参见例如kozbor,d.,j.immunol.133:3001
‑
3005(1984);brodeur,b.r.等,monoclonal antibody production techniques and applications,marcel dekker,inc.,new york(1987),pp.51
‑
63;boerner,p.等,j.immunol.147:86
‑
95(1991))。经由人b细胞杂交瘤技术生产的人抗体也记载于li,j.等,proc.natl.acad.sci.usa103:3557
‑
3562(2006)。其他方法包括那些记载于例如美国专利no.7,189,826(其描述了自杂交瘤细胞系生成单克隆人igm抗体)以及ni,xiandai mianyixue,26(4);265
‑
268(其描述了人
‑
人杂交瘤)的。人杂交瘤技术(trioma技术)也记载于vollmers,h.p.and brandlein,s.,histology and histopathology20:927
‑
937(2005);vollmers,h.p.and brandlein,s.,methods and findings in experimentaland clinical pharmacology 27:185
‑
191(2005)。
72.还可通过分离选自来源于人的噬菌体展示文库的fv克隆可变结构域序列来生成人抗体,然后,可以将此类可变域序列与期望的人恒定域组合。
73.还可以基于自抗体文库选择人抗体,即可以通过对组合文库筛选具有期望的一种或多种活性的抗体来分离人抗体。例如,用于生产噬菌体展示文库及对此类文库筛选拥有期望结合特征的抗体的多种方法是本领域已知的。这种方法综述于例如hoogenboom,h.r.等,methods in molecular biology 178:1
‑
37(2001),并且进一步记载于例如mccafferty,j.等,nature 348:552
‑
554(1990);clackson,t.等,nature 352:624
‑
628(1991);marks,j.d.等,j.mol.biol.222:581
‑
597(1992);marks,j.d.andbradbury,a.,methods in molecular biology 248:161
‑
175(2003);sidhu,s.s.等,j.mol.biol.338:299
‑
310(2004);lee,c.v.等,j.mol.biol.340:1073
‑
1093(2004);fellouse,f.a.,proc.natl.acad.sci.usa 101:12467
‑
12472(2004);及lee,c.v.等,j.immunol.methods 284:119
‑
132(2004)。
74.在某些噬菌体展示方法中,通过聚合酶链反应(pcr)分别克隆vh和vl基因的全集,并在噬菌体文库中随机重组,然后在所述噬菌体文库中筛选抗原结合性噬菌体,如记载于winter,g.等,ann.rev.immunol.12:433
‑
455(1994)。噬菌体通常以单链fv(scfv)片段或以fab片段展示抗体片段。来自经免疫来源的文库提供针对免疫原的高亲和力抗体,而不需要构建杂交瘤。或者,可以(例如自人)克隆未免疫全集以在没有任何免疫的情况中提供针对一大批非自身和还有自身抗原的抗体的单一来源,如由griffiths,a.d.等,embo j,12:
725
‑
734(1993)描述的。最后,也可以通过从干细胞克隆未重排的v基因区段,并使用含有随机序列的pcr引物编码高度可变的cdr3区并在体外实现重排来合成生成未免疫文库,如由hoogenboom,h.r.andwinter,g.,j.mol.biol.227:381
‑
388(1992)所描述的。描述人抗体噬菌体文库的专利公开文本包括例如:美国专利no.5,750,373及美国专利公开文本no.2005/0079574、2005/0119455、2005/0266000、2007/0117126、2007/0160598、2007/0237764、2007/0292936和2009/0002360。
75.所述抗体也可以是多特异性抗体,例如双特异性抗体。双特异性抗体是对至少两种不同位点具有结合特异性的单克隆抗体。用于生成多特异性抗体的技术包括但不限于具有不同特异性的两对免疫球蛋白重链
‑
轻链的重组共表达(参见milstein,c.and cuello,a.c.,nature305:537
‑
540(1983);wo 93/08829;及traunecker,a.等,embo j.10:3655
‑
3659(1991))和“节
‑
入
‑
穴”工程化(参见例如美国专利no.5,731,168)。也可以通过用于生成抗体fc
‑
异二聚体分子的工程化静电操纵效应(wo 2009/089004);交联两种或更多种抗体或片段(参见例如美国专利no.4,676,980及brennan,m.等,science229:81
‑
83(1985));使用亮氨酸拉链来生成双特异性抗体(参见例如kostelny,s.a.等,j.immunol.148:1547
‑
1553(1992));使用用于生成双特异性抗体片段的“双抗体”技术(参见例如holliger,p.等,proc.natl.acad.sci.usa90:6444
‑
6448(1993));及使用单链fv(scfv)二聚体(参见例如gruber,m.等,j.immunol.152:5368
‑
5374(1994));及制备三特异性抗体(如例如tutt,a.等,j.immunol.147:60
‑
69(1991)中所描述的)来生成多特异性抗体。
76.本文中所述的单克隆抗体还包括具有三个或更多个功能性抗原结合位点的工程化改造抗体,包括“章鱼抗体”(参见例如us 2006/0025576)。
77.本文中的抗体还可以包括wo 2009/080251、wo 2009/080252、wo2009/080253、wo 2009/080254、wo 2010/112193、wo 2010/115589、wo2010/136172、wo 2010/145792、及wo 2010/145793、wo 2011/117330、wo 2012/025525、wo 2012/025530、wo 2013/026835、wo2013/026831、wo 2013/164325、或wo 2013/174873中记载的多特异性抗体。
78.本文中所述的单克隆抗体也可以是抗体变体,例如,可能期望改善抗体的结合亲和力和/或其它生物学特性。可以通过将适宜的修饰引入编码抗体的核苷酸序列中,或者通过肽合成来制备抗体的氨基酸序列变体。此类修饰包括例如对抗体的氨基酸序列内的残基的删除、和/或插入和/或替代。可以进行删除、插入、和替代的任何组合以得到最终的构建体,只要最终的构建体拥有期望的特征,例如抗原结合。因此,在某些实施方案中,提供了具有一个或多个氨基酸置换的抗体变体,用于置换突变的感兴趣的位点包括hvr和fr,例如,可将氨基酸置换引入感兴趣的抗体中并筛选具有所需活性的产物,例如,保留/改善的抗原结合性,降低的免疫原性,或改善的adcc或cdc。
79.实施例
80.下述实施例中所使用的实验方法如无特殊要求,均为常规方法。
81.下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
82.实施例1抗人tslp单克隆抗体qx008n的制备
83.从上海近岸科技有限公司采购人胸腺基质淋巴细胞生成素(htslp),用于免疫新西兰兔,运用b细胞克隆技术获得抗原结合特异性抗体克隆,进而筛选出结合人tslp并具有人tslp抑制活性的单克隆抗体。通过binding elisa和blocking elisa检测细胞上清,挑选
出目标克隆。以上免疫和筛选过程委托给商业化公司完成。
84.先后挑选出7个克隆进行重组表达,并测序。经测定,8g2的细胞中和活性最好。因此,对8g2克隆进行人源化改造。利用ncbi igblast进行人igg胚系序列(germline)同源性比对,选择ighv3
‑
66*01作为重链cdr移植模板,将8g2克隆重链的cdr区(即cdr
‑
h1(seq id no:1)、cdr
‑
h2(seq id no:2)和cdr
‑
h3(seq id no:3))移植入ighv3
‑
66*01的骨架区;选择igkv1
‑
12*01作为轻链cdr移植模板,将8g2克隆轻链的cdr区(即cdr
‑
l1(seq id no:4)、cdr
‑
l2(seq id no:5)和cdr
‑
l3(seq id no:6))移植入igkv1
‑
12*01的骨架区;对骨架区特定位点进行回复突变,获得本技术的单克隆抗体qx008n可变区。最终,人源化后的重链可变区序列如seq id no:7所示;人源化后的轻链可变区氨基酸序列如seq id no:8所示。
85.上述重链可变区(seq id no:7)的基因和轻链可变区(seq id no:8)的基因,利用pcr扩增获得。用hindiii和nhei双酶切重链表达质粒phzdch;用hindiii和bsiwi双酶切轻链表达质粒phzdck;用infusion重组酶将pcr扩增基因分别插入对应的表达质粒中,构建重链表达质粒phzdch
‑
8g2vh
‑
hu27和轻链表达质粒phzdck
‑
8g2vk
‑
hu14。
86.通过核酸电泳检测pcr扩增的可变区基因片段和双酶切的质粒结果如图1所示。根据图1的结果可以看出,抗体重链可变区和轻链可变区pcr扩增结果以及双酶切重链和轻链表达质粒的结果,其中,重链和轻链的质粒大小约10000bp,重链可变区约477bp,轻链可变区约447bp。
87.将序列正确的重链表达质粒phzdch
‑
8g2vh
‑
hu27(所表达的重链的氨基酸序列如seq id no:10所示)和轻链表达质粒phzdck
‑
8g2vk
‑
hu14(所表达的轻链的氨基酸序列如seq id no:11所示)共转染expicho
‑
s细胞。转染前一天,将expicho
‑
s细胞稀释成3
×
106个细胞/ml进行转染前传代。转染当天,将细胞密度稀释成6
×
106个细胞/ml,125ml摇瓶装25ml细胞,等待转染。转染和表达过程如图2所示。
88.转染后第6天,收获培养上清,用proteina进行一步纯化。用sds
‑
page电泳检测纯化的抗体,将其命名为qx008n(hzd8g2
‑
57),利用蛋白电泳检测该抗体的结果如图3所示。蛋白电泳用变性还原胶检测,图3的结果显示出有两条带,两个条带的大小分别约50kda和25kda,与重链(49.3kda)和轻链(23.6kda)理论分子量一致。
89.实施例2平衡解离常数(k
d
)的测定
90.用biacore t200检测qx008n(hzd8g2
‑
57)与人tslp的亲和力,所有过程都在25℃进行。采用商品化proteina芯片,通过捕获法固定适量的抗体,使得rmax在50ru左右,捕获流速是10μl/min。将抗原进行梯度稀释,仪器流速切换成30μl/min,按照浓度从低到高的顺序依次流过参比通道和固定抗体的通道,流过缓冲液作为阴性对照。每一个结合、解离完成后用ph1.5甘氨酸再生芯片。用仪器自带分析软件选择kinetics选项中1:1结合模型进行拟合,计算抗体的结合速率常数k
a
,解离速率常数k
d
以及解离平衡常数k
d
值。
91.除此之外,将qx008n(hzd8g2
‑
57)与目前已经处于临床iii期的针对人tslp的单克隆抗体,即tezepelumab的亲和力进行比较,针对已知抗体的检测方法与对qx008n进行检测的方法相同,结果如表1所示。其中tezepelumab根据专利us20110274687a1提供的a5序列,构建表达质粒,瞬转expicho
‑
s细胞自制获得。
92.表1抗人tslp单克隆抗体结合人tslp的亲和力
93.样品名称k
a
(106m
‑1s
‑1)k
d
(10
‑5s
‑1)k
d
(10
‑
11
m)
qx008n1.742.991.75tezepelumab2.706.462.38
94.表中的数据为:每个样品检测三次,计算平均值的数据。
95.实施例3qx008n和tezepelumab中和人tslp诱导的sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化活性
96.利用sw756
‑
stat5
‑
luciferase报告基因细胞系测定qx008n拮抗人tslp通过tslpr
‑
il
‑
7r介导的胞内信号分子stat5磷酸化活性:将培养液中的细胞以每孔4
×
104细胞加入到96孔内,然后在37℃和5%co2条件下培养过夜。向细胞中加入提前孵育的抗体和人tslp混合液,其中qx008n的终浓度范围为0至50ng/ml,tezepelumab的终浓度范围为0至400ng/ml,tslp的终浓度为0.5ng/ml。然后在37℃和5%co2条件下培养24小时,弃除细胞培养上清液,每孔加入120μl one
‑
glo
‑
luciferase reagent检测试剂,作用30min,每孔取100μl至白色96孔板,检测luminescence荧光信号值并绘制剂量效应曲线,进而分析抗体的拮抗活性,剂量效应曲线如图4所示。
97.图4所示的结果显示,qx008n能够抑制人tslp诱导sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化,qx008n抑制人tslp诱导的sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化活性的ic
50
为0.837ng/ml,而tezepelumab抑制人tslp诱导的sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化活性的ic
50
为3.8ng/ml。
98.实施例4qx008n和tezepelumab中和天然tslp诱导的sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化活性
99.利用sw756
‑
stat5
‑
luciferase报告基因细胞系测定qx008n拮抗天然tslp通过tslpr
‑
il
‑
7r介导的胞内信号分子stat5磷酸化活性:将培养液中的细胞以每孔4
×
104细胞加入到96孔内,然后在37℃和5%co2条件下培养过夜。向细胞中加入提前孵育的抗体和天然tslp混合液,其中qx008n的终浓度范围为0至50ng/ml,tezepelumab的终浓度范围为0至400ng/ml,天然tslp的终浓度为原液稀释62.5倍。然后在37℃和5%co2条件下培养24小时,弃除细胞培养上清液,每孔加入120μlone
‑
glo
‑
luciferase reagent检测试剂,作用30min,每孔取100μl至白色96孔板,检测luminescence荧光信号值并绘制剂量效应曲线,进而分析抗体的拮抗活性,剂量效应曲线如图5所示。
100.图5所示的结果显示,qx008n能够抑制天然tslp诱导sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化,qx008n抑制天然tslp诱导的sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化活性的ic
50
为0.462ng/ml,而tezepelumab抑制天然tslp诱导的sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化活性的ic
50
为1.45ng/ml。
101.实施例5qx008n和tezepelumab中和食蟹猴tslp诱导的sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化活性
102.利用sw756
‑
stat5
‑
luciferase报告基因细胞系测定qx008n拮抗食蟹猴tslp通过tslpr
‑
il
‑
7r介导的胞内信号分子stat5磷酸化活性:将培养液中的细胞以每孔4
×
104细胞加入到96孔内,然后在37℃和5%co2条件下培养过夜。向细胞中加入提前孵育的抗体和食蟹猴tslp混合液,其中qx008n的终浓度范围为0至50ng/ml,tezepelumab的终浓度范围为0至400ng/ml,食蟹猴tslp的终浓度为0.5ng/ml。然后在37℃和5%co2条件下培养24小时,弃除细胞培养上清液,每孔加入120μl one
‑
glo
‑
luciferase reagent检测试剂,作用30min,
每孔取100μl至白色96孔板,检测luminescence荧光信号值并绘制剂量效应曲线,进而分析抗体的拮抗活性,剂量效应曲线如图6所示。
103.图6所示的结果显示,qx008n能够抑制食蟹猴tslp诱导sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化,qx008n抑制食蟹猴tslp诱导的sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化活性的ic
50
为0.889ng/ml,而tezepelumab抑制食蟹猴tslp诱导的sw756
‑
stat5
‑
luciferase报告基因细胞stat5磷酸化活性的ic
50
为1.88ng/ml。
104.实施例6qx008n和tezepelumab中和人tslp诱导人全血释放tarc(ccl17)活性
105.利用人全血测定qx008n拮抗人tslp通过tslpr
‑
il
‑
7r诱导的tarc(ccl17)释放活性:将全血按照100μl/孔加入到96孔板中,暂存于37℃和5%co2条件下,向全血中加入提前孵育的抗体和人tslp混合液,其中抗体的终浓度范围为0至10μg/ml,人tslp的终浓度为0.5ng/ml,并加入终浓度为0.5ng/ml的il
‑
33。然后在37℃和5%co2条件下培养48小时,收集细胞培养上清采用夹心elisa法检测上清中tarc(ccl17)的表达及绘制剂量效应曲线,进而分析抗体的拮抗活性,其剂量效应曲线如图7所示。
106.从图7所示的结果显示,qx008n能够抑制人tslp诱导的全血释放tarc(ccl17),qx008n抑制人tslp诱导的全血释放tarc(ccl17)活性的ic
50
为0.839ng/ml,而tezepelumab抑制人tslp诱导的全血释放tarc(ccl17)活性的ic
50
为23.9ng/ml。
107.实施例7qx008n和tezepelumab中和人tslp诱导人pbmc细胞释放tarc(ccl17)活性
108.利用人pbmc细胞测定qx008n拮抗人tslp通过tslpr
‑
il
‑
7r诱导的tarc(ccl17)释放活性:按密度梯度离心法分离出pbmc,将pbmc按照300000个/孔加入到96孔板中,暂存于37℃和5%co2条件下,向pbmc中加入提前孵育的抗体和人tslp混合液,其中抗体的终浓度范围为0至10μg/ml,人tslp的终浓度为0.5ng/ml,并加入终浓度为0.5ng/ml的il
‑
33。然后在37℃和5%co2条件下培养48小时,收集细胞培养上清采用夹心elisa法检测上清中tarc(ccl17)的表达及绘制剂量效应曲线,进而分析抗体的拮抗活性,其剂量效应曲线如图8所示。
109.从图8所示的结果显示,qx008n能够抑制人tslp诱导的pbmc细胞释放tarc(ccl17),qx008n抑制人tslp诱导的pbmc细胞释放tarc(ccl17)活性的ic
50
为77.1ng/ml,而tezepelumab抑制人tslp诱导的pbmc细胞释放tarc(ccl17)活性的ic
50
为216ng/ml。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1