一种基于植物介导的微生物复合菌系的筛选方法
1.本发明属于微生物筛选技术领域,具体涉及一种基于植物介导的微生物复合菌系的筛选方法。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.随着化肥、农药使用在农作物增产方面日渐展现出其劣势,人们也进一步将目光聚焦到绿色、可持续农业发展与维持生态稳定方面。多样化的土壤组成与结构,从多方面对农作物产量及农产品质量产生了影响。与此同时,植物根际促生细菌因其稳定定殖特性,具有促进植物营养吸收和抑制病原菌对植物侵害等促生作用而受到人们的广泛关注。植物根际促生菌在环境友好型的基础上,现已成为发展绿色可持续农业、建立绿色食品安全体系的基础,它作为生物肥料,与有机肥料、化肥一起构成21世纪植物营养资源。
4.一方面,与单菌相比复合菌系微生物种类多样,促生功能也各不相同,在有限的资源与空间条件下,可为植物提供充分的营养与抵抗胁迫,具有更高的稳定性;另一方面,复合菌系微生物间也存在相互作用与生存机制,通过彼此间的互作,共同执行多种功能或者将复杂任务分解为多个步骤,从而有效完成单一物种不可能进行的复杂生化过程,更充分发挥其促生功能。
5.田间实验用于探索自然条件下根系微生物组的组装和变异,温度、风、雨、微生物组和土壤养分等环境因素无法控制。在受控温室内使用天然土壤进行的实验可避免环境变化并提供可重复的结果,但使用此技术无法深入剖析微生物群成员和土壤养分。
6.合成群落(synthetic community,syncom),是指通过人工合成或宿主植物自然筛选后合成的根际菌群。微生物的培养和重组在此过程中发挥着极为重要的作用,在可控的条件下最大程度还原植物根系生存环境,通过宿主介导的选择来获得植株高亲和性促生复合菌系,实现菌株配伍由人为组合向植株自然筛选的转变,使人们充分研究植物和与植物相关的微生物之间的相互作用成为可能。
7.长期以来,人们多以单菌对植物的促生、人工组合菌群对植物的促生为主要研究内容,虽已取得部分研究成果,但由于前者菌株单一、后者人工组合菌群不能长期稳定定殖于植物根际,缺少植物与根际微生物相互选择的关键环节,使得微生物未能充分发挥其促生作用,未达到预期促生效果。
技术实现要素:
8.为了更好地了解并合理应用根际微生物,同时筛选有效的植物根际促生复合菌系,本发明提供一种基于植物介导的微生物复合菌系的筛选方法,本发明以实验室筛选出的9株具有植物根际促生功能的菌株和植物为研究对象,从植物根系聚集的微生物区系中,
通过宿主介导的选择,获得植物高亲和性促生复合菌系,实现菌株配伍由人为组合向植物自然筛选的转变。
9.为了实现上述目的,本发明第一方面提供一种基于植物介导的微生物复合菌系,包括:枯草芽孢杆菌(bacillus subtilis gqjk61)、高地芽孢杆菌(bacillus altitudinis gqyp101)、路德维希肠杆菌(enterobacterludwigii i42)、雷金斯堡预研菌(yokenellaregensburgeibac068)、副色芽孢杆菌(bacillus paranthracispr1)、枯草芽孢杆菌(bacillus subtilispr10)、路德维希肠杆菌(enterobacterludwigiijp6)、路德维希肠杆菌(enterobacterludwigiijp9)、贝莱斯芽孢杆菌(bacillus velezensisfkm10),其中,核心菌种为路德维希肠杆菌(jp6、jp9、i42)、副色芽孢杆菌(pr1)、高地芽孢杆菌(gqyp101)、贝莱斯芽孢杆菌(fkm10);
10.进一步的,路德维希肠杆菌(jp6、jp9、i42):副色芽孢杆菌(pr1):高地芽孢杆菌(gqyp101):贝莱斯芽孢杆菌(fkm10)的比例为1.53:0.27:0.16:0.04。
11.本发明第二方面提供一种基于植物介导的微生物复合菌系的筛选方法,包括:将等菌量菌液混合后定殖于植物根际,利用高通量测序技术对不同时期植物根际菌扩增子及宏基因组测序结果进行分析,得到植物根际优势菌属及比例。
12.本发明的一个或多个实施方式至少具有以下有益效果:
13.(1)本发明所提供的筛选方法,从植物根系聚集的微生物区系中,通过宿主介导的选择,获得植物高亲和性促生复合菌系,实现菌株配伍由人为组合向植物自然筛选的转变。
14.(2)将本发明所提供的筛选方法筛选得到的复合菌系,按优势菌属比例应用于植物盆栽试验,在株高、茎粗及植株鲜干重方面较对照增幅明显,表现出良好的促生效果。
15.(3)该筛选方法在可控实验室条件下可重复操作,避免了田间、温室环境下非生物及不相关生物因素的影响,运用该发明筛选方法可筛选得到不同时期植物根际优势菌属及其比例,同时可探究不同时期根际菌群的动态变化,亦可实现不同土壤不同作物和微生物的自然筛选和组装。
附图说明
16.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
17.图1为细菌群落venn图;其中,y为原始混合样品,0为蘸菌后当天取样,1为蘸菌后5天取样,2为蘸菌后10天取样,3为蘸菌后15天取样。
18.图2为种水平宏基因组细菌物种分布;其中,3表示第一次试验蘸菌后15天收集玉米根际细菌样品,3.1,3.2和3.3为三次重复;为了重复实验结果又进行了第二次试验,d3表示第二次试验蘸菌后15天收集玉米根际细菌样品,d3.1,d3.2和d3.3为第二次试验的三次重复)。
19.图3为复合菌系对玉米农艺性状和生物量的影响;其中,a为treata、treatb、ck在株高方面的对比图,b为treata、treatb、ck在茎粗方面的对比图,c为treata、treatb、ck在地上鲜重、地上干重方面的对比图,d为treata、treatb、ck在地下鲜重、地下干重方面的对比图。
20.图4为复合菌系盆栽促生效果图;
21.图5为植物无菌培养装置图解;
22.图中注释:
23.(a)植物无菌培养瓶:瓶高:30cm,瓶口外径:8cm,瓶身外径:7.5cm,内径:7cm,瓶口处较瓶身向外突出0.5cm,加强封口处皮筋固定,防止瓶外微生物进入。
24.(b)封口纱布:四层,边长18cm。
25.(c)封口玻璃纸:两层,边长18cm,中心区域分散有10个直径3mm左右圆孔(将镊子在酒精灯火焰上方加热后于玻璃纸上扎圆孔)。
26.(d)封口报纸:四层,边长18cm。
27.(e)皮筋:两根,分别绕2
‑
3圈扎紧瓶口(按照纱布、玻璃纸、报纸顺序依次叠放于瓶口上方)
28.(f)带培养基的植物无菌培养装置全图(灭菌后);
29.图6为复合菌系的筛选过程;
30.图7为筛选过程技术路线。
具体实施方式
31.应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
32.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
33.正如背景技术所介绍的,现有技术中,在研究植物和与植物相关的微生物之间相互作用时,多以单菌对植物的促生、人工组合菌群对植物的促生为主要的研究内容,虽已取得部分研究成果,但由于前者菌株单一、后者人工组合菌群不能长期稳定定殖于植物根际,缺少植物与根际微生物相互选择的关键环节,使得微生物未能充分发挥其促生作用,未达到预期促生效果。
34.为了解决如上的技术问题,本发明第一方面提供一种基于植物介导的微生物复合菌系,包括:枯草芽孢杆菌(bacillus subtilis gqjk61)、高地芽孢杆菌(bacillus altitudinis gqyp101)、路德维希肠杆菌(enterobacterludwigii i42)、雷金斯堡预研菌(yokenellaregensburgeibac068)、副色芽孢杆菌(bacillus paranthracispr1)、枯草芽孢杆菌(bacillus subtilispr10)、路德维希肠杆菌(enterobacterludwigiijp6)、路德维希肠杆菌(enterobacterludwigiijp9)、贝莱斯芽孢杆菌(bacillus velezensisfkm10),其中,核心菌种为路德维希肠杆菌(jp6、jp9、i42)、副色芽孢杆菌(pr1)、高地芽孢杆菌(gqyp101)、贝莱斯芽孢杆菌(fkm10);
35.进一步的,路德维希肠杆菌(jp6、jp9、i42):副色芽孢杆菌(pr1):高地芽孢杆菌(gqyp101):贝莱斯芽孢杆菌(fkm10)的比例为1.53:0.27:0.16:0.04。
36.本发明第二方面提供一种基于植物介导的微生物复合菌系的筛选方法,包括:将等菌量菌液混合后定殖于植物根际,利用高通量测序技术对不同时期植物根际菌扩增子及
宏基因组测序结果进行分析,得到植物根际优势菌属及比例。
37.本发明提供的微生物复合菌系的筛选方法,从植物根系聚集的微生物区系中,通过宿主介导的选择,获得植物高亲和性促生复合菌系,实现菌株配伍由人为组合向植物自然筛选的转变。
38.本发明的方法在无杂菌条件下进行筛选,定殖菌液15天玉米根际优势菌种为路德维希肠杆菌(enterobacterludwigii)、副色芽孢杆菌(bacillus paranthracis)、高地芽孢杆菌(bacillus altitudinis)、贝莱斯芽孢杆菌(bacillus velezensis),其平均相对丰度分别为66.39%、11.66%、6.80%、1.80%。宏基因组蛋白功能注释分析表明,本发明方法筛选出的玉米根际促生复合菌系具有利用植物根际分泌物及周围环境无机离子的相关基因、蛋白及酶类。盆栽试验结果表明,将本发明筛选方法得到的复合菌系菌液施于初期玉米幼苗根际,能够对玉米产生很好的促生效果,玉米株高、茎粗及植株鲜干重较对照组增幅明显,达到了显著或极显著差异。本发明提出的植物根际微生物复合菌系的筛选方法避免了自然环境下非生物及不相关生物因素的影响,能够在可控实验室条件下重复操作。
39.而且,本发明所提供的筛选方法在可控实验室条件下可重复操作,避免了田间、温室环境下非生物及不相关生物因素的影响;运用该发明筛选方法可筛选得到不同时期植物根际优势菌属及其比例,同时可探究不同时期根际菌群的动态变化。将该发明筛选方法筛选得到的复合菌系按优势菌属比例应用于植物盆栽试验,在株高、茎粗及植株鲜干重方面较对照增幅明显,表现出良好的促生效果。
40.进一步的,在菌液混合前,需要调试验菌株至单位菌量对应吸光度,具体地,需要调至每种菌菌数达到108cfu/ml时所对应的od
600
值。
41.进一步的,对植物种子进行消毒及无菌催芽处理,形成植物幼苗,进行菌液定殖;
42.具体步骤包括:
43.s1:lb培养基进行菌株培养;
44.具体地,采用固体lb培养基进行活化,再将活化好的单菌落转接于液体lb培养基中,进行培养。
45.固体lb培养基包括:酵母粉5g,蛋白胨10g,氯化钠10g,琼脂15
‑
20g,去离子水1000ml,ph7.0,121℃高压灭菌20min;
46.液体lb培养基:酵母粉5g,蛋白胨10g,氯化钠10g,去离子水1000ml,ph7.0,121℃高压灭菌20min。
47.s2:将每种菌液进行1:1等体积混合均匀,制备混合菌液;
48.具体地,活化实验用菌,接种摇瓶培养,转接发酵,收集菌体,用pbs缓冲液稀释调浓度;再调至每种菌菌数达到108cfu/ml时所对应的od
600
值,分别吸取菌液于灭菌收集瓶中,1:1等体积混合均匀。
49.s3:依次进行种子选取、消毒和催芽,得到无菌幼苗;
50.进一步的,所述种子消毒的方法为:
51.(1)75%乙醇,震荡浸泡5min;
52.(2)5%次氯酸钠溶液,震荡浸泡10min;
53.(3)无菌水震荡浸洗5min,重复三次后将锥形瓶封口;
54.(4)脱毒:将消毒种子置于室温下,脱毒20h,备用。
55.进一步的,种子催芽在无菌1/2ms组培瓶中进行;所述种子催芽的方法为:在无菌操作环境中,将脱毒种子用无菌镊子夹取至无菌1/2ms组培瓶中,每瓶一颗,盖子封口紧密,置于光照培养箱催芽5
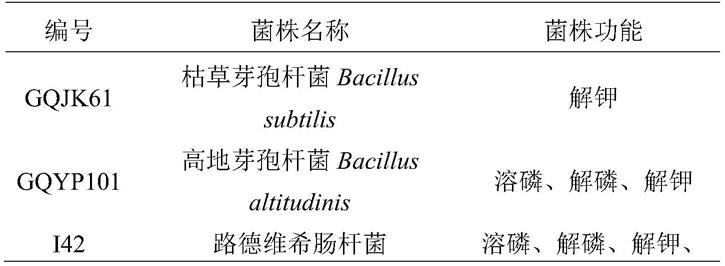
‑
7d。
56.s4:将无菌幼苗放入混合菌液中进行菌液定殖,定殖后在1/2ms育苗培养基进行培育;
57.进一步的,无菌幼苗的根用无菌水洗,洗去表面附着培养基后,再放入混合菌液中,使幼苗根部完全浸没于混合菌液中,进行菌液定殖。
58.进一步的,所述菌液定殖过程的时间为30
‑
60min;
59.进一步的,定殖后将幼苗移栽到无菌育苗培养瓶中,采用无菌镊子夹取幼苗茎部分,根系勿触碰瓶壁,垂直悬空放入,使幼苗直立于底部1/2ms育苗培养基上;
60.进一步的,定殖后培育的条件为:光照条件:16h、25℃,光照强度60%;黑暗条件:8h、25℃、光照强度0%。
61.s5:将不同培育时期的育苗的根部剪下,在无菌水中震荡,提取植株根际菌;
62.s6:复合菌系的筛选:将所收集的植株根际菌进行高通量测序,并进行根际菌宏基因组测序分析,筛选出优势菌。
63.为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
64.实验材料:
65.1、主要仪器和设备
66.立式压力蒸汽灭菌锅、超净工作台、可见光分光光度计、离心机、磁力搅拌器、漩涡振荡器、ph计、摇床、电热鼓风干燥箱、电热恒温培养箱、光照恒温培养箱、超低温冰箱、电泳仪、pcr仪、水浴锅、电子天平、移液枪、培养皿、锥形瓶、组培瓶、无菌育苗培养瓶、镊子、50ml离心管、5ml离心管、涂布棒、接种环
67.2、主要药品试剂
68.75%乙醇、5%次氯酸钠、无菌水、去离子水、磷酸缓冲盐溶液、蛋白胨、酵母粉、氯化钠、琼脂粉、蔗糖、硝酸铵、过磷酸钙、钾长石粉、七水合硫酸镁、四水合硫酸锰、七水合硫酸锌、硼酸、碘化钾、钼酸钠、硫酸铜、氯化钴、乙二胺四乙酸二钠、七水合硫酸铁、肌醇、甘氨酸、烟酸、盐酸吡哆醇、盐酸硫胺
69.3、供试菌株
70.供试菌株选自实验室筛选保藏的具有促生作用的9株植物根际促生菌,具体如表1所示。
71.表1供试菌株
72.[0073][0074]
4、供试植物
[0075]
玉米品种:郑单958玉米杂交种,培养至两片子叶,选取发育健康,长势一致的玉米苗备用,每个处理多个重复。
[0076]
培养基:
[0077]
1、常规培养基
[0078]
固体lb培养基:酵母粉5g,蛋白胨10g,氯化钠10g,琼脂15
‑
20g,去离子水1000ml,ph7.0,121℃高压灭菌20min;
[0079]
液体lb培养基:酵母粉5g,蛋白胨10g,氯化钠10g,去离子水1000ml,ph7.0,121℃高压灭菌20min。
[0080]
2、改良1/2ms培养基
[0081]
①
nh4no
3 1.2g/l,ca3(po4)2(过磷酸钙)660mg/l,钾长石粉3g/l,mgso4·
7h2o 185mg/l;
[0082]
②
cuso
4 0.0125mg/l,mnso4·
4h2o 11.15mg/l,znso4·
7h2o 4.3mg/l,ki 0.415mg/l,硼酸3.1mg/l,氯化钴0.0125mg/l,钼酸钠0.125mg/l;
[0083]
③
乙二胺四乙酸二钠(na2edta
·
2h2o)37.3mg/l,feso4·
7h2o 27.8mg/l;
[0084]
④
肌醇100mg/l,蔗糖15g/l,甘氨酸2mg/l,烟酸0.5mg/l,盐酸吡哆醇0.5mg/l,盐酸硫胺0.1mg/l。
[0085]
注:
[0086]
(1)将配方
①
中的硝酸铵、七水合硫酸镁用去离子水溶解,配制为50
×
的母液一,定容至1000ml;过磷酸钙、钾长石粉不溶,需分装;
[0087]
(2)配方
②
中的所有药品用去离子水溶解,配制成1000
×
的母液二,定容至1000ml;
[0088]
(3)配方
③
配制为100
×
的铁盐母液三(制备铁盐溶液:a溶液:称取3.73gna2edta
·
2h2o溶解于200ml去离子水中,并置于70℃预热;b溶液:称取2.78g feso4·
7h2o溶解于200ml去离子水中;将b溶液缓慢倒入a溶液中混合,边倒边搅拌,置于70℃水浴锅中螯合两小时,冷却完全后定容至1000ml。);
[0089]
(4)配方
④
中甘氨酸、烟酸、盐酸吡哆醇、盐酸硫胺用去离子水溶解,配制为1000
×
的母液四,定容至1000ml;肌醇、蔗糖待四种母液混合后称取加入;
[0090]
(5)配制好的四种母液置于锥形瓶中,用封口膜封口后保存于4℃冰箱备用。
[0091]
(6)催芽培养基的配制,成分含量如表2所示。
[0092]
表2 1/2ms催芽培养基
[0093][0094]
用移液枪各吸取四种母液,待母液混合完全后,加入肌醇0.1g,蔗糖30g,调ph=6.5,定容至1000ml,每一组培瓶中分装过磷酸钙0.033g、钾长石粉0.15g、琼脂0.4g(0.8%),将定容好的溶液分装,每个组培瓶分装50ml。分装完成后,116℃高压灭菌30min。
[0095]
育苗培养基的配制,成分含量如表3所示。
[0096]
表3 1/2ms育苗培养基
[0097][0098][0099]
用移液枪各吸取四种母液,待母液混合完全后,加入肌醇0.1g,蔗糖15g,调ph=6.5,定容至1000ml,每一无菌育苗培养瓶中分装过磷酸钙0.165g、钾长石粉0.75g、琼脂1.5g(0.6%),将定容好的溶液分装,每个无菌育苗培养瓶分装250ml。分装完成后,依次用
四层纱布、两层玻璃纸(用镊子戳10个直径约3mm的孔方便透气)、四层报纸进行封口,116℃高压灭菌30min。
[0100]
实验方法(流程如图6、7所示):
[0101]
本方法中所用到的植物无菌培养装置如图5所示;
[0102]
1、混合菌液制备
[0103]
a:菌株的培养
[0104]
(1)在无菌操作环境中分别从甘油保藏管内吸取2μl菌体保藏液于固体lb培养基平板一侧边缘,用灭菌接种环进行三区划线后,倒置平板于37℃电热恒温培养箱培养12h,至培养出分离纯化单菌落,分别将单菌落转接于新固体lb培养基平板进行二次活化,步骤同第一次。
[0105]
(2)在无菌操作环境中用接种环挑取已活化好的单菌落分别转接于50ml液体lb培养基中,作为种子液,置于37℃、180r/min摇床摇瓶培养10h;
[0106]
(3)10h后,分别以10%的接种量,将菌液接种于新的50ml液体lb培养基中,作为发酵液,置于37℃、180r/min摇床摇瓶培养4h,取出待用。
[0107]
b:细菌活菌数测定
[0108]
(1)摇瓶培养4h后,在无菌操作环境中用50ml离心管多次收集菌体,用15ml pbs缓冲液洗三次,离心三次,倒掉上清液,加入5ml pbs缓冲液后用漩涡振荡器振荡回旋,使所收集菌体均匀混合于pbs缓冲液中,备用;
[0109]
(2)在无菌操作环境中用pbs缓冲液将菌液进行稀释,分光光度计测出od
600
值,无菌水稀释至10
‑5、10
‑6两个梯度,分别取100μl在lb平板上涂布,每个梯度设置三个平行,涂布完成,将平板放入37℃培养箱中培养12h,12h后取出计数,根据稀释梯度计算每毫升发酵液中活菌数量,当梯度10
‑5所涂每个平板菌数过百或梯度10
‑6所涂每个平板菌数过十,即找到活菌数达到108cfu/ml时对应的od
600
值,记录在表格中。
[0110]
c:菌液混合
[0111]
(1)分别活化9株实验用菌,接种摇瓶培养,转接发酵,收集菌体,用pbs缓冲液稀释调浓度;
[0112]
(2)调至每种菌菌数达到108cfu/ml时所对应的od
600
值,分别吸取菌液于灭菌收集瓶中,1:1等体积混合均匀后备用。
[0113]
2、无菌幼苗培养
[0114]
(1)种子选取
[0115]
玉米品种为郑单958(郑58/昌7
‑
2(选))杂交选育的一代杂玉米新品种,选取籽粒饱满、外形一致的玉米种子于灭菌锥形瓶中备用。
[0116]
(2)种子消毒
[0117]
1)75%乙醇,震荡浸泡5min;
[0118]
2)5%次氯酸钠溶液,震荡浸泡10min;
[0119]
3)无菌水震荡浸洗5min,重复三次后将锥形瓶封口;
[0120]
4)脱毒:将消毒种子置于室温下,脱毒20h,备用。
[0121]
(3)种子催芽
[0122]
在无菌操作环境中,将脱毒玉米种子用无菌镊子夹取至无菌1/2ms组培瓶中,每瓶
一颗,盖子封口紧密,置于光照培养箱催芽5
‑
7d。
[0123]
光照条件:16h、25℃、光照强度60%;黑暗条件:8h、25℃、光照强度0%。
[0124]
3、菌液定殖
[0125]
(1)在无菌操作环境中,将混合菌液倒入灭菌大平板,用无菌镊子夹取催芽成功(萌发7d)的幼苗,将其根用无菌水洗三遍,洗去表面附着培养基后,放入混合菌液中,使幼苗根部完全浸没于混合菌液中,定殖30
‑
60min;
[0126]
(2)定殖后用无菌镊子将幼苗移栽到无菌育苗培养瓶中,镊子夹取幼苗茎部分,根系勿触碰瓶壁,垂直悬空放入,使幼苗直立于底部1/2ms育苗培养基上,0d、5d、10d、15d取样处理各10瓶,依次用边长为18cm的四层纱布、两层玻璃纸(中心区域分散有10个直径3mm左右圆孔方便透气)、四层报纸进行封口,皮筋绕2
‑
3圈扎紧瓶口,封口后在光照培养箱中培养。
[0127]
光照条件:16h、25℃、光照强度60%;黑暗条件:8h、25℃、光照强度0%。
[0128]
4、取样及菌体富集
[0129]
(1)吸取一定体积的9株菌等比例混合菌液于50ml离心管中,8000rpm、2min离心收集,并用pbs缓冲液洗涤三次,作为原混合菌体编号为y。
[0130]
(2)当玉米植株在无菌育苗培养瓶中生长到0d、5d、10d、15d时,选取每一时期处理10瓶,在无菌操作环境中,将玉米植株用无菌镊子取出,用无菌剪刀将其根部剪下,置于装有玻璃珠和200ml无菌水的收集瓶中,充分震荡,必要时可使用超声波振荡器,使植株根际菌充分释放在无菌水中,用50ml离心管收集菌体,8000rpm、2min多次离心收集,所收集菌体样品按照时间顺序分别编号为0、5、10、15,待菌体收集完全,将瓶中根取出洗净,用吸水纸吸干根表水分,茎叶与根分别装袋保存。
[0131]
5、复合菌系的筛选
[0132]
(1)根际菌扩增子测序分析
[0133]
将所收集原混合菌体、0d、5d、10d、15d玉米根际菌体编号为y、0、5、10、15,送上海派森诺生物科技公司进行高通量测序,使用第二代测序技术(second
‑
generation sequencing,sgs),以illuminamiseq测序平台为基础,对16s rdna的v3
‑
v4区测序,普查群落的具体组成结构,掌握其多样性变化规律,并揭示其中的优势物种,总结不同时期玉米根际细菌群落组成的演替变化。
[0134]
(2)根际菌宏基因组测序分析
[0135]
将所收集的部分15d玉米根际菌体送上海派森诺生物科技公司进行宏基因组测序,运用鸟枪法测序技术(shotgun sequencing),联合全微生物组关联探究(microbiome
‑
wide association studies,miwas)的策略,分别从dna和rna水平更全面精细地展示整个群落的功能代谢谱和表达谱,从而通过对作用机理的研究揭示微生物群落在生态系统中所扮演角色的原理。
[0136]
6、盆栽试验
[0137]
(1)试验设计
[0138]
将筛选所得优势菌株用lb培养基活化,接种摇瓶培养,转接发酵,收集菌体,用pbs缓冲液稀释调浓度,调至每种菌菌数达到108cfu/ml时所对应的od
600
值,将菌液按照筛选所得比例混合均匀后备用。
[0139]
将供试土壤均匀混合,除去明显的大土块,装至直径15cm,高20cm的花盆中,每盆装土量约1.5kg,挑选大小一致的健康玉米种子每盆栽种两颗,待玉米发芽长出两片子叶,选取长势一致的玉米苗,每盆仅保留一株,将混合菌液稀释至200ml水中对玉米根部进行浇灌,后期管理过程保持相同浇水量,使湿度保持在40%
‑
50%,每个处理三个重复。
[0140]
(2)指标测定及方法
[0141]
1)在第45天玉米有明显差异后测定农艺性状:株高、茎粗。具体操作如下:
①
标记玉米幼苗株高的测定:用米尺测量标记幼苗盆土到心叶的距离,进行记录。
②
标记玉米幼苗茎粗的测定:用游标卡尺测量无根毛离地3cm部位的茎围,进行记录。
[0142]
2)标记玉米幼苗鲜干重的测定,采集后将各个处理的根、茎分开,洗净根土,用滤纸吸干水分,分别称取地上鲜重和地下鲜重。再放入烘箱,105℃杀青,85℃烘干,称地上干重和地下干重。
[0143]
所有统计计算均使用spass19.0软件进行。为了比较平均值,duncan多范围测试以5%的概率水平使用。最后,使用graphpad prism6软件绘制图形。
[0144]
结果与分析
[0145]
1、玉米根际菌扩增子及宏基因组测序分析
[0146]
如图1所示otu聚类分析,可以得到植物根际细菌群落随着时间的变化逐渐简化并趋于稳定,可以说明该微生物复合菌系的筛选方法在筛选复合菌系的同时可探究不同时期根际菌群的动态变化。在种分类水平上对各样本进行物种注释和丰度分析(图2),得到在该筛选方法下15天取样根际样品的核心菌种为路德维希肠杆菌(enterobacterludwigii)、副色芽孢杆菌(bacillus paranthracis)、高地芽孢杆菌(bacillus altitudinis)、贝莱斯芽孢杆菌(bacillus velezensis),其平均相对丰度分别为66.39%、11.66%、6.80%、1.80%。比例为路德维希肠杆菌(jp6、jp9、i42):副色芽孢杆菌(pr1):高地芽孢杆菌(gqyp101):贝莱斯芽孢杆菌(fkm10)=1.53:0.27:0.16:0.04。通过宏基因组分析,表明通过植物介导的微生物复合菌系的筛选方法得到的植物根际优势复合菌系具有利用植物根际分泌物及周围环境无机离子的相关基因、蛋白及酶类,这是其能稳定定殖于植物根际,与植物互作发挥促生作用,并能够通过该方法被筛选出来的重要原因。
[0147]
2、复合菌系玉米盆栽效果分析
[0148]
基于植物介导的微生物复合菌系的筛选方法筛选得到玉米根际优势菌种及其比例为路德维希肠杆菌(jp6、jp9、i42):副色芽孢杆菌(pr1):高地芽孢杆菌(gqyp101):贝莱斯芽孢杆菌(fkm10)=1.53:0.27:0.16:0.04。根据筛选结果设计盆栽试验如表4所示。
[0149]
表4复合菌系促生效果盆栽试验设计
[0150]
[0151]
由图3a可知,用该发明筛选方法筛选出的复合菌系处理玉米幼苗,在株高方面,复合菌系处理后较ck均有显著增加,treata、treatb较ck株高分别增加29.46%、28.94%,且均与ck达到极显著性差异(p<0.01)。
[0152]
由图3b可知,复合菌系处理的玉米幼苗茎粗较ck均有不同程度增加,treata、treatb较ck茎粗分别增加13.05%、7.88%,虽与ck相比差异不显著,但仍有较大增幅。
[0153]
如图3c所示,在地上鲜重、地上干重方面,复合菌系处理的玉米幼苗与ck相比均有显著增加,treata、treatb较ck地上鲜重分别增加33.96%、47.65%,且与ck相比均达到显著性差异(p<0.05),其中treatb较ck达到极显著性差异(p<0.01)。treata、treatb较ck地上干重分别增加48.37%、50.61%,且均与ck达到极显著性差异(p<0.01)。
[0154]
如图3d所示,在地下鲜重、地下干重方面,复合菌系处理的玉米幼苗与ck相比均有不同程度增加,treata、treatb较ck地下鲜重分别增加14.67%、8.07%,但与ck相比差异不显著。treata、treatb较ck地下干重分别增加51.20%、35.20%,其中treata较ck达到显著性差异(p<0.05)。
[0155]
与图3对应的数据示于表5中。
[0156]
图4示出了复合菌系盆栽促生效果,清晰可见复合菌系处理的玉米幼苗相对于ck的在茎粗、株高方面的生长优势。
[0157]
表5复合菌系盆栽促生效果
[0158][0159]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1