骨髓血管内皮细胞在骨髓增生异常综合征中的应用
1.本发明涉及生物医学领域,具体涉及骨髓血管内皮细胞在骨髓增生异常综合征中的应用。
背景技术:
2.骨髓增生异常综合征(mds)是一组异质性的髓系克隆性疾病,以髓系细胞发育异常为特征,并有向急性髓系白血病(aml)转化的倾向。mds发病机制复杂多样,目前治疗mds的策略依赖于异基因造血干细胞移植、低甲基化药物、免疫抑制剂和化疗,但这些治疗的临床疗效有限,以异基因造血干细胞移植为例,只有40%-50%的患者能存活5年。因此,mds发病机制的进一步阐明及其新型治疗策略的建立是亟待解决的重要临床科学问题。
3.无效造血是mds的主要病理生理过程。mds伴多系血细胞发育异常(mds-mld)、mds伴原始细胞增多(mds-eb)到急性髓系白血病(aml)是mds进展的典型过程。同时,免疫失调作为mds的另一个重要发病机制,表现出不同的t细胞亚群与mds的进展相关。
4.骨髓血管内皮细胞作为骨髓微环境的重要组分,在不同临床阶段的mds患者中同时对正常造血、异常造血、免疫调节的多重作用尚不明确。此外,骨髓血管内皮细胞的这些作用与mds的进展之间的关系仍是未知的。因此,提供一种骨髓微环境细胞与mds进展的相关性对mds的临床治疗具有十分重要的意义。
技术实现要素:
5.本发明的目的是提供骨髓血管内皮细胞在骨髓增生异常综合征中的应用。
6.第一方面,本发明要求保护骨髓血管内皮细胞作为标记物在如下任一中的应用:
7.(a1)制备用于检测或者辅助检测骨髓增生异常综合征的病程进展情况的产品,或检测或者辅助检测骨髓增生异常综合征的病程进展情况;
8.(a2)制备用于诊断或者辅助诊断骨髓增生异常综合征的产品,或诊断或者辅助诊断骨髓增生异常综合征;
9.(a3)制备用于区分或者辅助区分骨髓增生异常综合征患者和非骨髓增生异常综合征患者的产品,或区分或者辅助区分骨髓增生异常综合征患者和非骨髓增生异常综合征患者。
10.第二方面,本发明要求保护物质a和/或物质b和/或物质c和/或物质d和/或物质e和/或物质f在如下任一中的应用:
11.(a1)制备用于检测或者辅助检测骨髓增生异常综合征的病程进展情况的产品,或检测或者辅助检测骨髓增生异常综合征的病程进展情况;
12.(a2)制备用于诊断或者辅助诊断骨髓增生异常综合征的产品,或诊断或者辅助诊断骨髓增生异常综合征;
13.(a3)制备用于区分或者辅助区分骨髓增生异常综合征患者和非骨髓增生异常综合征患者的产品,或区分或者辅助区分骨髓增生异常综合征患者和非骨髓增生异常综合征
患者。
14.所述物质a为用于检测骨髓中血管内皮细胞数量的物质。
15.所述物质b为用于检测骨髓中血管内皮细胞损伤情况的物质。
16.所述物质c为用于检测骨髓中血管内皮细胞功能状态的物质。
17.所述物质d为用于检测骨髓中血管内皮细胞对造血干细胞的支持能力的物质。
18.所述物质e为用于检测骨髓中血管内皮细胞是否会导致t细胞向免疫耐受方向分化的物质。
19.所述物质f为用于检测骨髓中血管内皮细胞对白血病细胞支持能力的物质。
20.进一步地,所述骨髓中血管内皮细胞损伤情况可体现为如下中的全部或部分(下同):骨髓血管内皮细胞的凋亡率、骨髓血管内皮细胞中ros水平、骨髓血管内皮细胞中凋亡相关基因的表达量。骨髓血管内皮细胞的凋亡率越高、胞内ros水平越高、凋亡相关基因(如casp2、casp3、bax)的表达量越高,说明骨髓血管内皮细胞的损伤情况越严重。
21.进一步地,所述骨髓中血管内皮细胞功能状态可体现为如下中的全部或部分(下同):骨髓血管内皮细胞的成管能力、骨髓血管内皮细胞的迁移能力。骨髓血管内皮细胞的成管能力越强、迁移能力越强,说明骨髓血管内皮细胞的功能障碍越严重。
22.进一步地,所述骨髓中血管内皮细胞对造血干细胞的支持能力可体现为如下中的全部或部分(下同):将健康人来源的骨髓cd34
+
细胞与供试骨髓血管内皮细胞共培养后,骨髓cd34
+
细胞凋亡率、骨髓cd34
+
细胞中的ros水平、骨髓cd34
+
细胞cfu-e、bfu-e、cfu-gm和/或cfu-gemm形成能力。骨髓cd34
+
细胞凋亡率越高、胞内ros水平越高、cfu-e、bfu-e、cfu-gm和cfu-gemm形成能力越低,说明骨髓中血管内皮细胞对造血干细胞的支持能力越低。
23.进一步地,所述骨髓中血管内皮细胞是否会导致t细胞向免疫耐受方向分化可体现为如下中的全部或部分(下同):将健康人来源的骨髓cd3
+
t细胞与供试骨髓血管内皮细胞共培养后,骨髓cd3
+
t细胞的分化情况,包括th1/cd4
+
t细胞、th17/cd4
+
t细胞、th2/cd4
+
t细胞、treg/cd4
+
t细胞、th1/th2比值。骨髓cd3
+
t细胞向th1/cd4
+
t细胞和th17/cd4
+
t细胞分化的越少、向th2/cd4
+
t细胞和treg/cd4
+
t细胞分化的越多、th1/th2比值越低,越说明骨髓血管内皮细胞会导致t细胞向免疫耐受方向分化。
24.进一步地,所述骨髓中血管内皮细胞对白血病细胞支持能力可体现为如下中的全部或部分(下同):将白血病细胞与供试骨髓血管内皮细胞共培养后,所述白血病细胞的增殖、凋亡、细胞内ros水平、白血病细胞集落单位(cfu-leukemia,cfu-l)形成效率、细胞内凋亡和/或细胞周期相关基因的表达。白血病细胞的增殖越强、凋亡率越低、细胞内ros水平越低、白血病细胞集落单位(cfu-leukemia,cfu-l)形成效率越高、细胞内凋亡和/或细胞周期相关基因(如ccne1,mcl1)的表达量越高、细胞内凋亡和/或细胞周期相关基因(如casp2,casp3,bax,tp53,cdkn1a)的表达量越低,说明骨髓中血管内皮细胞对白血病细胞支持能力越强。
25.在本发明的一个具体实施方式中,所述白血病细胞具体为hl-60细胞。
26.在上述各方面中,所述非骨髓增生异常综合征患者需满足如下条件:与骨髓增生异常综合征患者相比,骨髓中血管内皮细胞数量降低、骨髓中血管内皮细胞损伤情况减轻或者未发生损伤、骨髓中血管内皮细胞功能障碍减轻或者未发生功能障碍、骨髓中血管内皮细胞对造血干细胞的支持能力增强、骨髓中血管内皮细胞不会导致t细胞向免疫耐受方
向分化、骨髓中血管内皮细胞对白血病细胞支持能力降低或者对白血病细胞没有支持能力。
27.在本发明的具体实施方式中,所述非骨髓增生异常综合征患者为健康人。
28.在本发明的具体实施方式中,所述髓增生异常综合征的病程进展具体可体现为如下三个阶段(下同):mds伴多系血细胞发育异常(mds-mld)、mds伴原始细胞增多(mds-eb)到急性髓系白血病(aml)。
29.在上述各方面的(a3)中,所述骨髓增生异常综合征患者可为mds伴多系血细胞发育异常(mds-mld)患者、mds伴原始细胞增多(mds-eb)患者或急性髓系白血病(aml)患者。
30.在上述两方面中,所述产品具体可为试剂盒。
31.在本发明中,前文所述的各物质(物质a、b、c、d、e、f)可为能够与具体检测物特异性结合的物质或者用于检测各指标的仪器设备及配套试剂。
32.第三方面,本发明要求保护一种用于检测骨髓增生异常综合征的病程进展情况的系统,包括:
33.(b1)试剂和/或仪器;
34.所述试剂和/或仪器具有如下功能中的全部或部分:检测骨髓中血管内皮细胞数量、检测骨髓中血管内皮细胞损伤情况、检测骨髓中血管内皮细胞功能状态、检测骨髓中血管内皮细胞对造血干细胞的支持能力、检测骨髓中血管内皮细胞是否会导致t细胞向免疫耐受方向分化、检测骨髓中血管内皮细胞对白血病细胞支持能力。
35.(b2)装置;
36.所述装置包括数据输入模块、阈值存储模块、数据比较模块,以及判断模块。
37.所述数据输入模块被配置为输入(b1)检测得到的如下各数值中的全部或部分:来自于骨髓增生异常综合征患者的待测骨髓中的血管内皮细胞数量值;所述待测骨髓中的血管内皮细胞损伤情况值;所述待测骨髓中的血管内皮细胞功能障碍值;所述待测骨髓中的血管内皮细胞对造血干细胞的支持能力值;所述待测骨髓中的血管内皮细胞导致t细胞向免疫耐受方向分化值;所述待测骨髓中的血管内皮细胞对白血病细胞支持能力值。
38.所述阈值存储模块被配置为存储如下阈值中的全部或部分:阈值a、阈值b、阈值c、阈值d、阈值e和阈值f;所述阈值a为健康人骨髓中的血管内皮细胞数量值;所述阈值b为健康人骨髓中的血管内皮细胞损伤情况值;所述阈值c为健康人骨髓中的血管内皮细胞功能障碍值;所述阈值d为健康人骨髓中的血管内皮细胞对造血干细胞的支持能力值;所述阈值e为健康人骨髓中的血管内皮细胞导致t细胞向免疫耐受方向分化值;所述阈值f为健康人骨髓中的血管内皮细胞对白血病细胞支持能力值。
39.所述数据比较模块被配置为接收来自于所述数据输入模块发送的所述(b1)检测得到的各数值中的全部或部分(即所述待测骨髓中的血管内皮细胞数量值;所述待测骨髓中的血管内皮细胞损伤情况值;所述待测骨髓中的血管内皮细胞功能状态值;所述待测骨髓中的血管内皮细胞对造血干细胞的支持能力值;所述待测骨髓中的血管内皮细胞导致t细胞向免疫耐受方向分化值;所述待测骨髓中的血管内皮细胞对白血病细胞支持能力值),并调用所述阈值存储模块中的各阈值,将所述待测骨髓中的血管内皮细胞数量值与所述阈值a进行比较,将所述待测骨髓中的血管内皮细胞损伤情况值与所述阈值b进行比较,将所述待测骨髓中的血管内皮细胞功能障碍值与所述阈值c进行比较,将所述待测骨髓中的血
管内皮细胞对造血干细胞的支持能力值与所述阈值d进行比较,将所述待测骨髓中的血管内皮细胞导致t细胞向免疫耐受方向分化值与所述阈值e进行比较,和/或将所述待测骨髓中的血管内皮细胞对白血病细胞支持能力值与所述阈值f进行比较。
40.所述判断模块被配置为接收所述数据比较模块发送的比较结果,然后按照如下进行结果判定:所述待测骨髓中的血管内皮细胞数量值大于所述阈值a,所述待测骨髓中的血管内皮细胞损伤情况值大于所述阈值b(即所述待测骨髓的血管内皮细胞损伤情况更严重),所述待测骨髓中的血管内皮细胞功能障碍值大于所述阈值c(即所述待测骨髓的血管内皮细胞功能障碍更严重),所述待测骨髓中的血管内皮细胞对造血干细胞的支持能力值小于所述阈值d(即所述待测骨髓的血管内皮细胞对造血干细胞的支持能力更弱),所述待测骨髓中的血管内皮细胞导致t细胞向免疫耐受方向分化值大于所述阈值e(即所述待测骨髓的血管内皮细胞导致t细胞向免疫耐受方向分化),和/或所述待测骨髓中的血管内皮细胞对白血病细胞支持能力值大于所述阈值f(即所述待测骨髓的血管内皮细胞对白血病细胞的支持能力更强),且各数值与对应阈值的差值的绝对值越大,则所述骨髓增生异常综合征患者的病情越严重。
41.第四方面,本发明要求保护一种用于诊断或者辅助诊断骨髓增生异常综合征的系统,包括:
42.(c1)试剂和/或仪器;
43.所述试剂和/或仪器具有如下功能中的全部或部分:检测骨髓中血管内皮细胞数量、检测骨髓中血管内皮细胞损伤情况、检测骨髓中血管内皮细胞功能状态、检测骨髓中血管内皮细胞对造血干细胞的支持能力、检测骨髓中血管内皮细胞是否会导致t细胞向免疫耐受方向分化、检测骨髓中血管内皮细胞对白血病细胞支持能力。
44.(c2)装置;
45.所述装置包括数据输入模块、阈值存储模块、数据比较模块,以及判断模块。
46.所述数据输入模块被配置为输入(b1)检测得到的如下各数值中的全部或部分:来自于待测者的待测骨髓中的血管内皮细胞数量值;所述待测骨髓中的血管内皮细胞损伤情况值;所述待测骨髓中的血管内皮细胞功能障碍值;所述待测骨髓中的血管内皮细胞对造血干细胞的支持能力值;所述待测骨髓中的血管内皮细胞导致t细胞向免疫耐受方向分化值;所述待测骨髓中的血管内皮细胞对白血病细胞支持能力值。
47.所述阈值存储模块被配置为存储如下阈值中的全部或部分:阈值a、阈值b、阈值c、阈值d、阈值e和阈值f;所述阈值a为健康人骨髓中的血管内皮细胞数量值;所述阈值b为健康人骨髓中的血管内皮细胞损伤情况值;所述阈值c为健康人骨髓中的血管内皮细胞功能障碍值;所述阈值d为健康人骨髓中的血管内皮细胞对造血干细胞的支持能力值;所述阈值e为健康人骨髓中的血管内皮细胞导致t细胞向免疫耐受方向分化值;所述阈值f为健康人骨髓中的血管内皮细胞对白血病细胞支持能力值。
48.所述数据比较模块被配置为接收来自于所述数据输入模块发送的所述(c1)检测得到的各数值中的全部或部分(即所述待测骨髓中的血管内皮细胞数量值;所述待测骨髓中的血管内皮细胞损伤情况值;所述待测骨髓中的血管内皮细胞功能状态值;所述待测骨髓中的血管内皮细胞对造血干细胞的支持能力值;所述待测骨髓中的血管内皮细胞导致t细胞向免疫耐受方向分化值;所述待测骨髓中的血管内皮细胞对白血病细胞支持能力值),
并调用所述阈值存储模块中的各阈值,将所述待测骨髓中的血管内皮细胞数量值与所述阈值a进行比较,将所述待测骨髓中的血管内皮细胞损伤情况值与所述阈值b进行比较,将所述待测骨髓中的血管内皮细胞功能障碍值与所述阈值c进行比较,将所述待测骨髓中的血管内皮细胞对造血干细胞的支持能力值与所述阈值d进行比较,将所述待测骨髓中的血管内皮细胞导致t细胞向免疫耐受方向分化值与所述阈值e进行比较,和/或将所述待测骨髓中的血管内皮细胞对白血病细胞支持能力值与所述阈值f进行比较。
49.所述判断模块被配置为接收所述数据比较模块发送的比较结果,然后按照如下进行结果判定:若所述待测骨髓中的血管内皮细胞数量值大于所述阈值a,所述待测骨髓中的血管内皮细胞损伤情况值大于所述阈值b(即所述待测骨髓的血管内皮细胞损伤情况更严重),所述待测骨髓中的血管内皮细胞功能障碍值大于所述阈值c(即所述待测骨髓的血管内皮细胞功能障碍更严重),所述待测骨髓中的血管内皮细胞对造血干细胞的支持能力值小于所述阈值d(即所述待测骨髓的血管内皮细胞对造血干细胞的支持能力更弱),所述待测骨髓中的血管内皮细胞导致t细胞向免疫耐受方向分化值大于所述阈值e(即所述待测骨髓的血管内皮细胞导致t细胞向免疫耐受方向分化),和/或所述待测骨髓中的血管内皮细胞对白血病细胞支持能力值大于所述阈值f(即所述待测骨髓的血管内皮细胞对白血病细胞的支持能力更强),则所述待测者为骨髓增生异常综合征患者。
50.本发明研究发现从mds-mld、mds-eb到aml患者,骨髓血管内皮细胞(bm ec)数量逐渐增加,但功能异常逐渐加重。此外,随着疾病进展,mds患者的bm ec在体外对正常造血细胞的支持能力下降,对恶性造血细胞的支持能力升高。与t细胞共培养后,th2、treg比例升高,th1、th17比例降低。转录组测序显示mds-mld患者骨髓血管内皮细胞与健康供者(hd)的表达谱更相似,mds-eb与aml更相似。机制上,骨髓血管内皮细胞造血调控相关基因cxcl12、scf、nfkb水平随mds进展而升高。本发明对于检测mds的发生发展,特别是监控mds的病程进展具有重要意义。本发明提供了针对mds的诊断服务。
附图说明
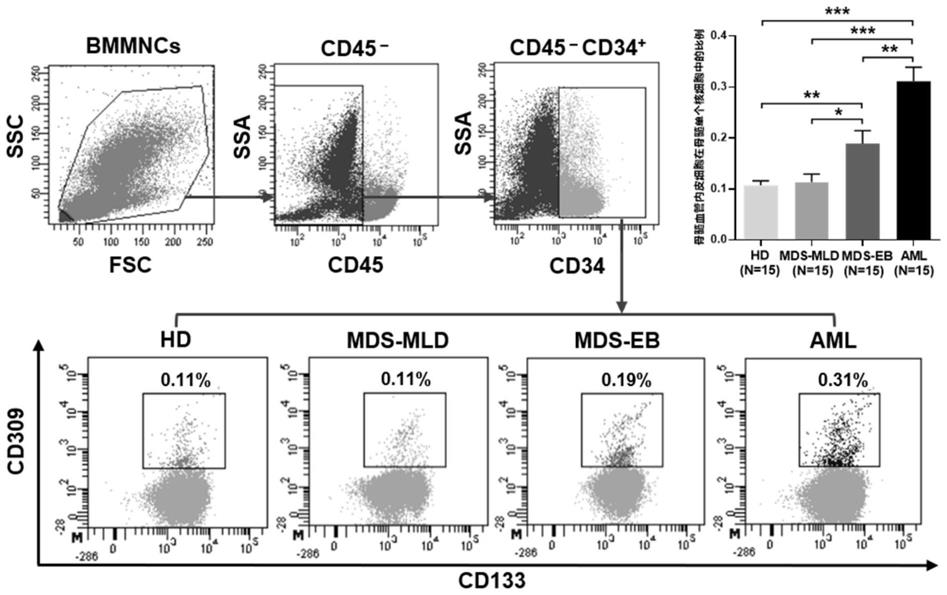
51.图1为hd、mds-mld、mds-eb、aml患者骨髓血管内皮细胞在单个核细胞中的比例。流式细胞术检测cd34、cd309和cd133阳性内皮细胞在hd、mds伴多系血细胞发育异常(mds-mld)、mds伴原始细胞增多(mds-eb)和急性髓系白血病(aml)骨髓单个核细胞中的比例。p《0.05被认为有统计学差异。*代表p《0.05;**代表p《0.005;***代表p《0.001。
52.图2为hd、mds-mld、mds-eb、aml患者骨髓血管内皮细胞双染实验。a为典型图;b为hd、mds-mld、mds-eb、aml患者骨髓血管内皮细胞双染数量统计学分析图。
53.图3为mds患者骨髓血管内皮细胞的损伤情况。a为hd、mds-mld、mds-eb和aml患者骨髓血管内皮细胞凋亡情况统计学分析图;b为hd、mds-mld、mds-eb和aml患者骨髓血管内皮细胞ros水平统计学分析图;c为hd、mds-mld、mds-eb和aml患者骨髓血管内皮细胞中casp2、casp3和bax的相对mrna水平。
54.图4为mds患者骨髓血管内皮细胞功能损伤。a为hd、mds-mld、mds-eb、aml患者骨髓血管内皮细胞的成管能力(原始放大倍数,10倍);b为hd、mds-mld、mds-eb、aml患者骨髓血管内皮细胞的迁移能力(原始放大倍数,10倍);c为成管长度统计学分析图;d为跨膜迁移的细胞数统计学分析图(每个视野的管像素)。随机统计三个视野,并对每个样本取平均值。比
例尺代表200μm。
55.图5为mds、aml患者骨髓血管内皮细胞对造血干细胞的支持能力。a为hd、mds-mld、mds-eb、aml患者骨髓来源的血管内皮细胞共培养5天后cd34
+
细胞的凋亡率;b为共培养后cd34
+
细胞内ros水平;c为共培养后cd34
+
细胞的cfu形成能力。
56.图6为mds-mld、mds-eb和aml患者骨髓血管内皮细胞导致cd3+细胞分化异常。a为共培养后th1细胞比例;b为共培养后th2细胞比例;c为共培养后th17细胞比例;d为共培养后treg细胞比例;e为共培养后th1/th2比值。
57.图7为mds-mld、mds-eb和aml患者骨髓血管内皮细胞共培养后hl-60细胞的增殖、凋亡、ros水平。a为hl-60细胞的增殖情况;b为hl-60细胞的凋亡情况;c为hl-60细胞edu阳性细胞比例的统计学分析;d为hl-60细胞凋亡比例的统计学分析;e为hl-60细胞ros水平(平均荧光强度)的统计学分析;f为mds-mld、mds-eb和aml患者骨髓血管内皮细胞共培养后hl-60细胞cfu-l形成效率;g为共培养后hl-60细胞凋亡、细胞周期相关基因表达水平。
58.图8为hd、mds、aml患者骨髓血管内皮细胞的转录组测序分析结果。a为12个转录组测序文库的主成分分析图;b为基因表达热图,并按欧氏距离进行层次聚类;c为各组之间的差异基因计数;d为转录组测序结果中凋亡、造血和免疫相关基因差异表达;e为采用qrt-pcr验证造血相关基因mrna水平;f为采用qrt-pcr验证免疫相关基因mrna水平。
具体实施方式
59.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
60.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
61.实施例1、骨髓血管内皮细胞在mds中的应用
62.一、实验材料
63.1.egm-2-mv-singlequots液体培养基:美国lonza公司。
64.2.rpmi 1640液体培养基:美国gibco公司。
65.3.methocult h4434 classic:加拿大stemcell technologies公司。
66.4.stemspan sfem:加拿大stemcell technologies公司。
67.5.人外周血淋巴细胞分离液(ficoll):美国ge healthcare公司。
68.6.单克隆抗体:cd3-apc/h7(becton dickinson(bd)),cd8-bv510(biolegend),cd25-pe/cy7(invitrogen),ifn-γ-percp/cy5.5(biolegend),il-4-pe(bd),il17a-fitc(bd),foxp3-apc(invitrogen),cd34-percp/cy5.5(biolegend),cd34-fitc(biolegend),cd133-apc(miltenyi),cd45-v500(bd),vascular endothelial growth factor receptor 2(vegfr2,cd309)-pe(bd biosciences),annexin-v and 7-amino-actinomycin d(7-aad),mouse anti-human cd34(bd),rabbit anti-human cd133(abcam)。
69.7.dapi溶液:北京索来宝公司。
70.8. 2’,7
’‑
dichlorofluorescein diacetate(dcfh-da):中国碧云天公司。
71.9.活性氧检测试剂盒(reactive oxygen species assay kit):中国碧云天公司
72.10.纤粘连蛋白(fibronectin):美国sigma公司
73.11. 5-ethynyl-20-deoxyuridine(edu):中国锐博生物公司
74.12.重组人flt-3:美国peprotech公司
75.13.重组人tpo:美国peprotech公司
76.14.重组人scf:美国peprotech公司
77.15.人cd34分选磁珠:德国miltenyi公司
78.16.人cd3分选磁珠:德国miltenyi公司
79.17.溶血素:bd facstm lysing solution,美国bd公司
80.18.胎牛血清(fbs):美国gibco公司
81.19.荆豆凝集素i-fitc标记:fitc-labelled lectin from ulex europaeus(fitc-uea-i):美国sigma-aldrich公司
82.20.二乙酰化低密度脂蛋白:dii-acldl,美国life technologies公司
83.21.基底胶:matrigel matrix,美国corning公司
84.22.transwell小室:transwell chamber,美国corning公司
85.23.rna提取试剂盒:rneasy mini kit,德国qiagen公司
86.24.逆转录酶:rt reagent kit with gdna eraser,日本takara公司
87.25.荧光定量耐热反转录试剂盒:sybr-green qrt-pcr kit,美国thermo fisher scientific公司
88.26.hl-60细胞系:人原髓细胞白血病细胞系,中国科学院细胞库/干细胞库
89.27.此队列研究共纳入初诊mds-mld、mds-eb或aml患者各15例及15例hd的骨髓样本作为健康对照。其中mds的诊断按照2016版的who分型标准;初诊aml患者为原发性aml,诊断为m2、m4或m5亚型。各组患者基本特征如性别、年龄等类似。
90.二、实验方法
91.1、骨髓血管内皮细胞的培养
92.采用密度梯度离心法分离骨髓单个核细胞:骨髓1:1加入淋巴细胞分离液(美国ge healthcare),以1800rpm室温梯度离心18分钟。轻轻吸取中间层白色雾状混合液,即单个核细胞,用pbs洗两遍。把骨髓单个核细胞种在fibronectin预先包被好的6孔板中,加入内皮细胞诱导培养基egm-2-mv-singlequots和10%胎牛血清,37℃、5%co2的培养箱中培养7天,第四天换一次液。
93.2、骨髓血管内皮细胞数量检测
94.①
人源骨髓单个核细胞,用抗人-cd45,抗人-cd34,抗人-cd133,抗人-cd309,室温避光标记15分钟。用pbs洗两遍,离心1500rpm,5分钟,待测。数据采用bd lsrfortessa软件进行分析。
95.②
人源骨髓单个核细胞用内皮细胞(ec)诱导培养基(egm-2-mv-singlequots)培养7天后,用pbs清洗三遍贴壁细胞,加入10μg/ml dii-ac-ldl在37℃孵育4小时。细胞用pbs再次洗三次,用4%多聚甲醛固定10分钟。pbs洗两次,每次5分钟。固定的细胞用fitc-uea-1 10μg/ml室温避光孵育1小时。染色后的细胞在荧光显微镜下观察(olympus,tokyo,japan)。dil-ac-ldl染色为红色,fitc-uea-1染色为绿色,双阳性的细胞颜色重合后为黄色,即ec。
cd25,抗人-ifn-γ,抗人-il-4,抗人-foxp3,抗人-il-17a,通过流式细胞仪量化淋巴细胞亚群。th1、th2、th17和treg细胞分别为cd3
+
cd8-ifn-γ
+
、cd3
+
cd8-il-4
+
、cd3
+
cd8-il-17a
+
和cd3
+
cd8-cd25
+
foxp3
+
。数据均采用bd lsrfortessa软件进行分析。
113.10、edu实验
114.收获共培养后的hl-60细胞,用50μm edu在37℃、5%co2的培养箱中孵育1小时,剩余步骤根据产品说明书进行。最终在bd lsrfortessa上检测并分析细胞荧光强度。
115.11、rna测序(rna-seq)和实时定量pcr(qrt-pcr)
116.对hd、mds-mld、mds-eb和aml患者培养第7天的骨髓来源的血管内皮细胞进行rna-seq分析。利用r(1.16.1)中的heatmap和deseq2包进行层次聚类分析和差异基因表达分析。为验证rna-seq结果,采用sybr green-based qrt-pcr(viia7real-time pcr system,thermo fisher scientific,usa)检测casp2、casp3、bax、ccne1、mcl1、p53、p21、cxcl12、kitlg和nfkb1的mrna水平,并将上述基因用18s mrna水平归一化。
117.12、统计分析
118.使用graphpad prism 6.0(usa)进行统计分析。两组件比较采用mann-whitney u检验。结果表示为平均值
±
sem,p《0.05被认为有统计学意义。
119.三、结果与分析
120.1、mds患者骨髓血管内皮细胞的数量随着疾病进展逐渐增多
121.hd、mds-mld、mds-eb、aml患者骨髓单个核细胞提取当天(第0天)利用流式抗体cd34、cd309、cd133圈定血管内皮细胞。骨髓血管内皮细胞在单个核细胞中的比例见图1,mds-eb组显著高于mds-mld组,而aml组显著高于mds-eb组(图1)。
122.培养7天的人骨髓血管内皮细胞鉴定通过dil-ac-ldl/fitc-uea-1双标实验(图2中a)双标实验是鉴定血管内皮细胞的经典实验,同时标记dil-ac-ldl(红色荧光)和fitc-uea-1(绿色荧光),具有双阳性染色的细胞为血管内皮细胞(黄色荧光)。通过对荧光显微镜视野下的双阳性细胞计数进行统计学分析。aml患者中双阳性骨髓血管内皮细胞的数量明显多于mds-eb患者(图2)。
123.综上所述,mds、aml患者骨髓血管内皮细胞的数量增多,且随着疾病进展,从mds-mld、mds-eb、aml,其数量逐渐增多。
124.2、mds患者骨髓血管内皮细胞损伤随着疾病进展逐渐加重
125.为了研究骨髓血管内皮细胞的损伤情况,我们检测了hd、mds-mld、mds-eb、aml患者骨髓血管内皮细胞的凋亡,ros以及凋亡相关基因的表达水平。凋亡,ros的测定都是通过对第0天的骨髓血管内皮细胞进行流式测定。凋亡相关基因的表达水平通过培养7天的人骨髓血管内皮细胞测定。
126.mds-eb组骨髓血管内皮细胞凋亡率显著高于mds-mld组(图3中a)。aml患者骨髓血管内皮细胞ros水平明显高于mds-eb患者(图3中b)。进一步采用qrt-pcr分析骨髓血管内皮细胞casp2、casp3、bax凋亡相关基因表达量。相比mds-eb患者,aml患者骨髓血管内皮细胞casp2的mrna水平显著升高(图3中c),casp3和bax在mds-eb患者骨髓血管内皮细胞的表达量比mds-mld显著升高(图3中c)。综上所述,这些数据提示mds、aml骨髓血管内皮细胞损伤,并且随着mds的进展,骨髓的血管内皮细胞损伤逐渐加重。
127.3、mds患者骨髓血管内皮细胞功能障碍随着疾病进展逐渐加重
128.hd、mds-mld、mds-eb和aml患者骨髓来源的血管内皮细胞的功能将从其血管生成能力评估。在培养第7天分析骨髓来源的血管内皮细胞的成管能力(图4中a)和迁移能力(图4中b)。随机统计三个视野,并对每个样本取平均值。通过对成管长度的统计学分析显示,mds-eb患者的骨髓血管内皮细胞比mds-mld患者的成管能力显著提高(图4中c)。人骨髓血管内皮细胞在小室迁移实验中具有跨膜迁移能力,aml患者的骨髓血管内皮细胞比mds-mld患者迁移能力更强(图4中d)。这些结果表明,mds、aml患者骨髓血管内皮细胞存在功能障碍,且随着mds的进展,骨髓血管内皮细胞功能障碍日益严重。
129.4、骨髓血管内皮细胞对造血干细胞的支持能力随mds进展减弱
130.为了研究骨髓血管内皮细胞对造血干细胞的影响,我们将供者来源的骨髓单个核细胞分选,将hd的cd34
+
细胞与培养第7天的hd、mds-mld、mds-eb、aml患者骨髓来源的血管内皮细胞共培养,5天后检测cd34
+
细胞的凋亡、细胞内ros水平和造血干细胞-集落形成单位(cfu)形成能力。凋亡、细胞内ros水平通过流式细胞仪检测。cfu形成能力的通过评估2
×
103个共培养5天后的cd34
+
细胞均匀种植在特殊半固体培养基14天,计数不同类型集落获得。与mds-mld组相比,与mds-eb骨髓血管内皮细胞共培养时,骨髓cd34
+
细胞凋亡水平明显升高(图5中a)。aml组cd34
+
细胞ros水平相较mds-mld组升高(图5中b)。与mds-mld组相比,mds-eb和aml组cfu-e、bfu-e、cfu-gm、cfu-gemm形成能力均降低(图5中c)。这些数据表明,mds、aml患者骨髓血管内皮细胞导致造血干细胞功能障碍,且随着mds进展,血管内皮细胞支持正常造血干细胞的能力越来越弱。
131.5、随着mds进展,骨髓血管内皮细胞导致t细胞逐渐向免疫耐受方向分化
132.考虑mds与免疫相关的发病机制,我们进一步研究骨髓血管内皮细胞的体外免疫调节作用,我们将hd来源的骨髓cd3
+
t细胞与mds-mld、mds-eb和aml患者骨髓血管内皮细胞共培养,3天后分析t细胞亚群的差异。与mds-eb组相比,aml组的th1在cd4
+
t细胞中的比例明显降低(图6中a)。aml组的th2在cd4
+
t细胞中的比例(图6中b)高于mds-mld组。与mds-mld组相比,mds-eb组的th17在cd4
+
t细胞中的比例显著降低(图6中c)。mds-eb组treg在cd4
+
t细胞中的比例(图6中d)高于mds-mld组。aml组th1/th2比值低于mds-eb组,mds-eb组th1/th2比值明显低于mds-mld组(图6中e)。这些数据提示,mds、aml患者骨髓血管内皮细胞是mds免疫调节异常的原因,且随着疾病的进展,骨髓血管内皮细胞可能更倾向于诱导t细胞分化为免疫耐受细胞。
133.6、mds患者骨髓血管内皮细胞对白血病细胞的支持能力随疾病进展增强
134.为了探讨骨髓血管内皮细胞对体外aml细胞的影响,我们检测了与骨髓血管内皮细胞共培养5天后hl-60细胞的增殖、凋亡、细胞内ros水平和白血病细胞集落单位(cfu-leukemia,cfu-l)形成效率以及共培养后hl-60细胞中凋亡及细胞周期相关基因mrna的相对表达量。hl-60细胞的增殖采用edu(5-ethynyl-20-deoxyuridine)实验进行检测。hl-60细胞凋亡、细胞内ros水平使用流式细胞仪进行检测。cfu-l形成能力通过将103个共培养5天后的hl-60细胞均匀种植在特殊半固体培养基14天,计数白血病细胞集落数量获得。mds-eb组hl-60细胞edu阳性率显著高于mds-mld组(图7中a和c)。细胞凋亡率(图7中b和d)aml组显著低于mds-mld组,ros水平(相对于hd的倍数)mds-eb组显著低于mds-mld组(图7中e)。此外,aml组的cfu-l形成效率显著高于mds-eb组(图7中f)。与mds-mld相比,mds-eb组tp53,cdkn1a显著降低,mcl1显著升高,aml组casp2,casp3,bax,tp53,cdkn1a显著下降。与mds-eb
相比aml组casp2,tp53,cdkn1a显著下降,ccne1,mcl1显著升高(图7中g)。这些数据提示mds、aml患者骨髓血管内皮细胞对白血病细胞的支持能力增强。更重要的是,随着疾病进展,对白血病细胞的支持能力逐渐增强。
135.7、骨髓血管内皮细胞在mds进展中的异质性及潜在的受损机制
136.为了在转录组层面确认mds、aml患者骨髓血管内皮细胞的异质性,并进一步探索mds、aml患者骨髓血管内皮细胞受损机制,我们将培养第7天的骨髓来源的内皮细胞进行转录组测序并进行了主成分分析(图8中a),层次聚类分析(图8中b)和差异基因分析(图8中c)。结果显示12个样本明显分为两个不同的亚群,hd和疾病组(图8中a,b)。更重要的是热图(图8中b)显示了骨髓血管内皮细胞rna表达谱从hd到aml的进展。hd和患者之间的差异基因计数(图8中的c)(例如:hd与mds-mld(3448))远高于患者间(例如:mds-mld vs.mds-eb(722))。这些结果从转录组层面揭示了骨髓来源内皮细胞在hd和mds-mld、mds-eb、aml中的异质性。进一步分析转录组测序结果,发现凋亡(casp2、casp3、bax),造血(cxcl12、kitlg、nfkb1)及免疫(havcr2、lgals9、ciita)相关基因在mds及aml患者骨髓来源内皮细胞中升高,如(图8中d)。并用qrt-pcr验证了造血相关基因cxcl12、kitlg、nfkb1的升高(图8中e)以及免疫相关基因(havcr2、lgals9、ciita)随疾病进展而升高(图8中f)。这些数据进一步揭示了骨髓血管内皮细胞在mds,aml中调节造血和免疫的作用,并提示相关基因可能mds,aml骨髓血管内皮细胞受损的原因。
137.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1