中脑类器官及其高速大规模制造方法、利用它筛选神经毒性物质和筛选多巴胺能神经元相关疾病药物的方法与流程
1.本发明涉及中脑(midbrain)类器官的高速大规模制造方法、利用它的神经毒性物质的筛选方法以及多巴胺能神经元相关疾病治疗的药物筛选(drug screening)方法,更具体地,涉及制造中脑类器官所需的初始细胞数(starting cell number)和培养方式(culture format),通过调节,可以高速大规模制造质量优良、个体间变异少的中脑类器官。
背景技术:
2.类器官是一种新的干细胞分化技术,利用干细胞的分化能力(differentiation)、自我再生能力(self-renewal)、自我组织能力(self-organization),通过三维培养再现与体内器官相似的细胞组成和结构。此外,通过生产患者定制的类器官,可以低成本、短期内生产对多种疾病的患者定制的治疗药物,该技术被评价为有前景的技术。
3.最近报告了反映各种脑部特性的脑类器官的生产,使用脑类器官研究寨卡病毒(zika virus)或利用患者来源的脑类器官的疾病模拟研究和新药开发研究正在积极进行。
4.但是,生产患者定制的类器官需要很多费用和很长时间。如图1所示,真正患者来源的诱导多能干细胞(induced pluripotent stem cell;ipscs)的生产通常需要6~8周以上,其效率通常也很低,达到0.02%左右。此外,生产类器官所需的时间因各器官而异,但大部分需要3至6个月以上。因此,对患有退行性脑病年龄较高的患者和其他急需药物治疗的患者来说,开发患者定制新药等在现实上是困难的。另外,包括脑类器官在内的大部分类器官生产都存在以下问题,这些问题是类器官研究的实用化或产业化必须解决的问题。
5.第一,生产类器官需要很多费用和很长时间。
6.为了分化和成熟,需要氧气和营养物质供应到类器官内部,为此,大多数情况下使用震荡生物反应器(shaking bioreactor),以提供必不可少的co2孵化器内持续的震荡和分化,为了类器官长期的特异性分化,必须用昂贵的分化促进因子长期处理。因此,生产长期特异的类器官需要花费大量的费用(图1)。
7.第二,类器官间个体间变异(batch variation)非常严重(图2),因此,在利用类器官进行疾病模拟研究和新药筛选研究中,可能会产生不准确的结果。
8.第三,类器官分化时会产生称为“异常分化(out-growth)”的异常组织,这是阻碍类器官质量和功能性等的严重问题(图2)。
9.第四,目前类器官内部没有血管,因此氧气和营养物质无法正常传递到类器官的核心,导致内部细胞死亡的“死核”(dead core)现象很普遍,这阻碍了类器官的成熟,因此是必须解决的问题(图2)。
10.第五,基于类器官的高速批量筛选(high throughput screening;hts);为了通过hts进行药物筛选(drug screening)或药物再制造(drug repositioning)研究,需要开发符合hts模式(format)的类器官大规模生产系统。此外,在hts模式中类器官的生产和药物
筛选一体化、可进行的一步式类器官生产及新药开发系统的开发是今后通过类器官自动化生产建立实用化基础的必要部分。
技术实现要素:
11.技术挑战
12.因此,本发明人为了高速/大规模生产中脑类器官,将使用96或384孔板等微孔板,不使用震荡生物反应器(shaking bioreactor),利用高速批量筛选(high throughput screening;hts)平台(platform)生产中脑类器官。这样,除了在hts平台上生产中脑类器官(如图3所示)外,hts平台上还可以实现个体间变异少、异常分化和死核受到抑制的正常水平中脑类器官的高速、大规模生产,在高速、大规模生产中脑类器官的情况下,与现有方法生产的中脑类器官相比,显示出明显提高的均匀性和功能性。进一步发现,可以节省生产中脑类器官所需的时间和费用。
13.因此,本发明的目的是提供三维细胞集合体的高速大规模培养方法,所述方法是从人类干细胞高速培养三维细胞集合体的方法,包括以下步骤:
14.从与人类分离的细胞形成胚状体(embryoid body)的步骤;
15.从所述胚状体诱导分化为特定组织,形成三维细胞集合体的步骤;和
16.诱导所述三维细胞集合体成熟的步骤,
17.其特征在于,从形成所述胚状体的步骤到诱导所述三维细胞集合体成熟的步骤,在同一个微孔板中连续地进行培养大规模。
18.本发明的另一个目的是提供由三维细胞集合体的高速大规模培养方法制造的三维细胞集合体。
19.本发明的另一个目的是提供三维细胞集合体培养套件,其包括三维细胞集合体的凹培养部;和包括覆盖所述凹培养部的覆盖部。
20.本发明的另一个目的是提供三维中脑细胞集合体,其是从人类胚胎干细胞、人类诱导多能干细胞和成体干细胞中的任何一种培养出来的三维中脑细胞集合体;
21.所述三维中脑细胞集合体是形成神经黑色素的三维中脑细胞集合体。
22.本发明的另一个目的是提供从人类干细胞到三维细胞集合体的高速培养方法,包括以下步骤:
23.从与人类分离的细胞形成胚状体的步骤;
24.从所述胚状体诱导分化为特定组织,形成三维细胞集合体的步骤;和
25.诱导所述三维细胞集合体成熟的步骤;
26.从形成所述胚状体的步骤到诱导所述三维细胞集合体成熟的步骤,在同一个微孔板中连续非震荡培养;
27.所述高速培养方法的特征在于,是以包括移液器机器人、自动搬运、平板运输工具的自动化方式进行的三维细胞集合体的高速培养方法。
28.本发明的另一个目的是提供多巴胺能神经元相关疾病药物的筛选方法,包括:
29.从多巴胺能神经元相关疾病患者来源的诱导多能干细胞生成三维细胞集合体的步骤;
30.用候选物质处理所述三维细胞集合体的步骤;
31.从所述三维细胞集合体中确定多巴胺能神经元存活率的步骤。
32.本发明的另一个目的是提供为治疗多巴胺能神经元相关疾病提供信息的方法,包括以下步骤:
33.从多巴胺能神经元相关疾病患者来源的细胞培养三维细胞集合体的步骤;
34.用候选物质处理所述三维细胞集合体的步骤;
35.从所述三维细胞集合体中确定多巴胺能神经元存活率的步骤;
36.根据所述多巴胺能神经元存活率,为患者提供合适的治疗药物信息的步骤。
37.本发明的另一个目的是提供用于药物测试的三维细胞集合体的判别方法,包括以下步骤:
38.(i)用候选物质处理三维细胞集合体的步骤:
39.所述用候选物质处理的步骤,在三维细胞集合体的高速大规模培养方法包括的一个或多个步骤中进行;和
40.(ii)用于药物测试的三维细胞集合体的判别方法,其中包括对所述各步骤的三维细胞集合体在候选物质存在和不存在情况下产生的反应进行比较的步骤。
41.本发明的另一个目的是提供利用三维细胞集合体进行药物体外毒性筛选的方法,包括以下步骤:
42.(i)在三维细胞集合体的高速大规模培养方法包括的一个或多个步骤中,用候选物质处理三维细胞集合体的步骤;
43.(ii)对所述各步骤的三维细胞集合体在候选物质存在和不存在情况下产生的反应进行比较的步骤;
44.(iii)确定所述三维细胞集合体内存在的细胞是否死亡的步骤;
45.以提供利用三维细胞集合体进行药物体外毒性筛选的方法。
46.解决问题的技术方法
47.本发明涉及中脑(midbrain)类器官的高速和大规模制造方法、利用它的神经毒性物质的筛选方法以及多巴胺能神经元相关疾病治疗的药物筛选(drug screening)方法。根据本发明的类器官制造方法,可以高速大规模生产类器官,能够快速进行药物筛选,阻断异常分化(out-growth),最大限度地减少死核(dead core)现象,减少类器官之间的变异,通过中脑类器官的迅速成熟,诱导其优秀的功能性。本发明人在制造类器官的过程中,应用50至3,000个的初始起始细胞数(starting cell number),从而取得了将制造类器官所需的时间从现有的3至6个月以上缩短到最多30天以内的成果。
48.以下将对本发明作更详细的说明。
49.本发明的一个方面是从人类干细胞高速培养三维细胞集合体的方法,包括:
50.从与人类分离的细胞形成胚状体(embryoid body)的步骤;
51.从所述胚状体诱导分化为特定组织,形成三维细胞集合体的步骤;和
52.诱导所述三维细胞集合体成熟的步骤;
53.其特征在于,从形成所述胚状体的步骤到诱导所述三维细胞集合体成熟的步骤,在同一个微孔板中连续地进行培养。
54.在本发明中,与人类分离的细胞为人类胚胎干细胞(human embryonic stem cell;hesc)、诱导多能干细胞(induced pluripotent stem cell)和成体干细胞中的其中
一种。
55.本说明书中的术语“干细胞”是指具有自我复制能力,同时具备分化为两个或更多细胞的能力的细胞,包括万能干细胞(totipotent stem cell)、全能性干细胞(pluripotent stem cell)和多分化干细胞(multipotent stem cell)以及诱导多能干细胞。
56.在本发明中,三维细胞集合体可以是类器官,例如脑类器官。
57.本说明书中的术语“类器官”是指通过3d培养法重新聚集或重组从干细胞或器官起源细胞分离出来的细胞而形成的细胞集合体,可以包括从悬浮细胞培养物形成的类器官或细胞簇。所述类器官也可以命名为小型相似器官、器官相似体、相似器官。所述类器官具体包括构成器官或组织的多种细胞中的一种或多种细胞,该类器官必须能够再现组织或器官的结构和功能。
58.在本发明的实施例中,制造的脑类器官的直径大部分在0.9至1.4mm左右的范围内,其形状和大小均一,因此个体之间变异较少,且呈现较好的质量。
59.在本发明中,三维细胞集合体可以是在20到50天或20至40天内形成,例如,在20至30天内形成,但不限于此。
60.在本发明的实施例中,在根据本发明的方法培养了7天的情况下,中脑基因的活性得到了确认。如果培养了14天,出现特异性中脑多巴胺能神经元(midbrain dopaminergic neuron;mda neuron),在培养了21天的情况下,所述mda神经元的数量增加。
61.在本发明中,三维细胞集合体形成后,可以进一步进行震荡培养。通过所述进一步的震荡培养,可以长期培养。
62.在本发明的实施例中,通过在三维细胞集合体形成后进行300天以上的震荡培养,培养了三维细胞集合体。
63.在本发明中,微孔板可以是具有凹部的多孔板。所述具有凹部的多孔板为96孔板、384孔板,或者是1,536孔板。
64.在本发明中,从人类分离的细胞的初始起始细胞数,可以是50至3,000个。
65.如果使用96孔板,所述初始起始细胞数优选是300至3,000个,优选是300至1,000个,优选是500个,但不限于此。
66.如果使用384孔板,所述初始起始细胞数优选是50至500个,优选是50至200个,优选是100个,但不限于此。
67.在本发明中,高速大规模培养的方法,可以在形成三维细胞集合体的整个过程中不使用生物反应器,例如不进行震荡(shaking)过程。
68.在本发明中,三维细胞集合体可以是中脑细胞集合体。
69.在本发明中,三维细胞集合体可以是从肝脏、心脏和肺组成的群中选择的经过消化的器官制备。
70.在本发明中,形成三维细胞集合体的步骤可以包括外胚层形成步骤或中脑组织分化步骤。
71.所述外胚层形成步骤可以是在包括chir99021、二氢脱氧吗啡(dorsomorphin)和a83-01(双重smad抑制剂,dual smad inhibitors)的培养基中进行。
72.所述中脑组织分化步骤可以是在包括chir99021、二氢脱氧吗啡(dorsomorphin)、
a83-01、iwp、sag和fgf-8b的培养基中进行。
73.在本发明中,诱导三维细胞集合体成熟的步骤可以是在培养基中进行,所述培养基包括sag、fgf-8b、胰岛素(insulin)、层粘连蛋白(laminin),并进一步包括抑制生长因子的可溶性基质胶(growth factor reduced matrigel)。
74.在本发明的实施例中,在执行诱导三维细胞集合体成熟的步骤时,使用了在培养基中直接添加基质胶进行培养的方法。但是,根据现有的已知方法,通常的方法是在平板上将细胞嵌入到基质胶中,这与本发明的培养方法是不同的。
75.在本发明中,形成三维细胞集合体的步骤中,在组织分化诱导后7天内,可能没有表达内胚层标记,表达外胚层形成因子。所述外胚层形成因子可以选自但不限于n-cad、plzf、sox1、sox2和nestin中的一种或多种。
76.在本发明中,形成三维细胞集合体的步骤中,在组织分化诱导后14天内,可能没有表达前脑或后脑标记,表达中脑标记。所述中脑标记可以选自但不限于lmx1b、ascl1和th中的一种或多种。
77.在本发明中,执行诱导三维细胞集合体成熟的步骤后,可能表达中脑多巴胺能神经元的标记。
78.在本发明的实施例中,中脑标记在第14天或之前表达,但在第21天标记的表达水平更高。可以看出,在诱导三维细胞集合体成熟的步骤后,中脑多巴胺能神经元标记th等会高水平表达。
79.在本发明的实施例中,从形成胚状体的步骤到诱导三维细胞集合体成熟的步骤,在同一个微孔板中连续进行,无需微孔板的移动,可以利用多微孔板进行30天内的高速大规模培养。
80.本发明的第二方面是由三维细胞集合体的高速大规模培养方法制造的三维细胞集合体。
81.本发明的另一个方面是三维细胞集合体培养套件,其包括三维细胞集合体的凹培养部;和包括覆盖所述凹培养部的覆盖部。
82.在本发明中,三维细胞集合体培养套件,可以包括保存液。
83.本发明的另一个方面是三维中脑细胞集合体,其是从人类胚胎干细胞、人类诱导多能干细胞和成体干细胞中的其中一种培养出来的三维中脑细胞集合体;
84.所述三维中脑细胞集合体是形成神经黑色素的三维中脑细胞集合体。
85.所述三维中脑细胞集合体可以是在培养后20至50天、20至40天、20至35天、25至50天、或25至40天形成神经黑色素,例如在培养后25至35天形成神经黑色素,但不限于此。
86.在本发明中,三维中脑细胞集合体可以不包括中脑以外的其他脑组织。
87.在本发明中,三维中脑细胞集合体的异常分化(out growth)发生率可以在5%以下。
88.在本发明中,三维中脑细胞集合体的深部细胞死亡现象发生率可以低于所述细胞集合体总面积的40%。
89.在本发明中,三维中脑细胞集合体的直径可以是0.9至1.4mm,其具有均匀的大小和均匀的形态。
90.在本发明中,三维中脑细胞集合体可以包括10%以上的中脑多巴胺能神经元。
91.所述三维中脑细胞集合体可以包括30%以上的中脑多巴胺能神经元或者50%以上的中脑多巴胺能神经元。在早期阶段,可以包括大约80%的中脑多巴胺能神经元,但在成熟的三维中脑细胞集合体中,会形成多种中脑细胞,在整个细胞群中,多巴胺能神经元的含量可能会减少。
92.在本发明中,三维中脑细胞集合体是均匀形成的基因表达的变异率可以在10%以下的三维中脑细胞集合体。
93.在本发明的实施例中,三维中脑细胞集合体的基因表达质量非常好,表现出约90%以上的同质性。剩下约10%观察到的情况,与传统方法制造的情况相比具有对等或更好的基因表达均匀性。
94.在本发明中,三维中脑细胞集合体可以包括抑制性神经和兴奋性神经。
95.在本发明实施例中,三维中脑细胞集合体包括抑制性神经和兴奋性神经,其被确认为占整个细胞集合体的10%至30%以上。这可以从本说明书中图11和15a的组织染色数据的实验结果中得到确认。
96.在本发明中,三维中脑细胞集合体从细胞分化后15天开始可以观察到电生理活性。传统方法的情况是,细胞分化数月后开始出现电生理活性,由此可以证明,成熟模式非常迅速的本发明方法具有明显的优势。
97.在本发明中,三维中脑细胞集合体可以包括选自以下任何一种:黑质、蓝斑、赤核、中心灰质、内测母带、动眼神经核和滑车神经核。
98.在本发明中,三维中脑细胞集合体中,神经胶质细胞可能包括少突神经胶质细胞,所述三维中脑细胞集合体可能包括1%至10%的神经胶质细胞和少突神经胶质细胞。
99.在本发明的实施例中,三维中脑细胞集合体包括神经胶质细胞和少突神经胶质细胞的程度可以从本说明书上图11和15a的组织染色数据的实验结果中得到确认。
100.本发明的另一个方面是从人类干细胞到三维细胞集合体的高速培养方法,包括以下步骤:
101.从与人类分离的细胞形成胚状体的步骤;
102.从所述胚状体诱导分化为特定组织,形成三维细胞集合体的步骤;和
103.诱导所述三维细胞集合体成熟的步骤;
104.从形成所述胚状体的步骤到诱导所述三维细胞集合体成熟的步骤,在同一个微孔板中连续非震荡培养;
105.所述高速培养方法的特征在于,其是以包括移液器机器人、自动搬运、平板运输工具的自动化方式进行的三维细胞集合体的高速培养方法。
106.本发明的另一个方面是多巴胺能神经元相关疾病药物的筛选方法,包括:
107.从多巴胺能神经元相关疾病患者来源的诱导多能干细胞形成三维细胞集合体的步骤;
108.用候选物质处理所述三维细胞集合体的步骤;
109.从所述三维细胞集合体中确定多巴胺能神经元存活率的步骤。
110.在本发明中,多巴胺能神经元相关疾病包括但不限于帕金森病(parkinson’s disease)、阿尔茨海默病(alzheimer’s disease)、脑溢血、中风、亨廷顿病(huntington’s disease)、皮克病、克罗伊茨费尔特-雅各布病、自闭症和脑发育障碍中的其中一种。
111.所述信息提供方法可以通过将三维细胞集合体应用于多巴胺能神经元相关疾病药物的筛选用途,作为评价药物毒性和有效性的方法。
112.根据所述候选物质预防、治疗多巴胺能神经元相关疾病的发病,或与对照组物质相比提高预后的情况,可以决定所述候选物质作为多巴胺能神经元相关疾病的治疗药物是具有疗效的。
113.本发明的另一个方面是为治疗多巴胺能神经元相关疾病提供信息的方法,包括以下步骤:
114.从多巴胺能神经元相关疾病患者来源的细胞培养三维细胞集合体的步骤;
115.用候选物质处理所述三维细胞集合体的步骤;和
116.从所述三维细胞集合体中确定多巴胺能神经元存活率的步骤;
117.根据所述多巴胺能神经元存活率为患者提供合适的治疗药物信息的步骤。
118.在本发明中,候选物质包括天然化合物、合成化合物、rna、dna,其可以选自但不限于多肽、酶、蛋白质、配体、抗体、抗原、细菌或真菌的代谢产物和生物活性分子中的其中一种。
119.本发明的另一个方面是用于药物测试的三维细胞集合体的判别方法,包括以下步骤:
120.(i)用候选物质处理三维细胞集合体的步骤:
121.所述用候选物质处理的步骤,在三维细胞集合体的高速大规模培养方法包括的一个或多个步骤中进行;和
122.(ii)用于药物测试的三维细胞集合体的判别方法,包括对所述各步骤的三维细胞集合体在候选物质存在和不存在情况下产生的反应进行比较的步骤。
123.本发明的另一个方面是利用三维细胞集合体进行药物体外毒性筛选的方法,包括以下步骤:
124.(i)在三维细胞集合体的高速大规模培养方法包括的一个或多个步骤中,用候选物质处理三维细胞集合体的步骤;
125.(ii)对所述各步骤的三维细胞集合体在候选物质存在和不存在的情况下产生的反应进行比较的步骤;
126.(iii)确定所述三维细胞集合体内存在的细胞是否死亡的步骤;
127.以上是利用三维细胞集合体进行药物体外毒性筛选的方法。
128.本说明书中的术语“筛选”是指以多种物质组成的候选群为目的,以特定的操作或评价方法筛选具有特定性质的物质。
129.所述体外毒性筛选的方法可用作药物毒性评估平台,用于确认有毒物质或确认新药候选物质的神经毒性。
130.发明的效果
131.本发明涉及中脑类器官及其制造方法、利用它的神经毒性物质的筛选方法以及多巴胺能神经元相关疾病治疗的药物筛选(drug screening)方法,所述制造方法能够高速生产类器官,能够快速进行药物筛选,阻断异常分化,最大限度地减少死核现象,减少类器官之间的变异,诱导中脑类器官的高功能性,将有效地转化为可用于生产的类器官。
附图说明
132.图1是用于患者定制类器官生产的诱导多能干细胞(induced pluripotent stem cell;ipscs)的制作及类器官分化过程的模拟图。
133.图2是表示类器官生产中各种问题的模拟图。
134.图3是与现有技术相比,表示本发明的类器官生产战略的模拟图。
135.图4是根据本发明的实施例,在96孔板中生产的分化第7天的中脑类器官的形态照片(上)、分化率和形态分类图(中)和标准形态照片(下)。
136.图5a是根据本发明的实施例,在96孔板中生产的分化第7天的中脑类器官的全分化功能(pluripotency)标记基因表达情况的图表。
137.图5b是根据本发明的实施例,在96孔板中生产的分化第7天的中脑类器官的中内胚层(mesoendoderm)标记基因表达情况的图表。
138.图5c是根据本发明的实施例,在96孔板中生产的分化第7天的中脑类器官的神经外胚层(neuroectoderm)标记基因表达情况的图表。
139.图6是根据本发明的实施例,在96孔板中生产的分化第14天的中脑类器官的形态照片(上)、分化率和形态分类图(中)和标准形态照片(下)。
140.图7a是根据本发明的实施例,在96孔板中生产的分化第14天的中脑类器官的细胞凋亡标记基因表达情况的图表。
141.图7b是根据本发明的实施例,在96孔板中生产的分化第14天的中脑类器官的前脑(forebrain)标记基因表达情况的图表。
142.图7c是根据本发明的实施例,在96孔板中生产的分化第14天的中脑类器官的中脑(midbrain)标记基因表达情况的图表。
143.图7d是根据本发明的实施例,在96孔板中生产的分化第14天的中脑类器官的后脑(hindbrain)标记基因表达情况的图表。
144.图8是根据本发明的实施例,在500个以下的初始起始细胞数条件下,在96孔板中生产的分化第14天的中脑类器官的形态照片(上)、分化率和形态分类图(中)和标准形态照片(下)。
145.图9a是根据本发明的实施例,在500个以下的初始起始细胞数条件下,在96孔板中生产的分化第7天的中脑类器官的体内神经外胚层标记基因表达情况的图表。
146.图9b是根据本发明的实施例,在500个以下的初始起始细胞数条件下,在96孔板中生产的分化第14天的中脑类器官的中脑标记基因表达情况的图表。
147.图9c是根据本发明的实施例,在500个以下的初始起始细胞数条件下,在96孔板中生产的分化第14天的中脑类器官的后脑标记基因表达情况的图表。
148.图10a是根据本发明的实施例,在384孔板中,不同初始起始细胞数形成的中脑类器官大小的比较照片。
149.图10b是根据本发明的实施例,在384孔板中生产的中脑类器官的中脑标记基因表达情况的图表。
150.图11是显示根据本发明的实施例,在分化第14天的中脑类器官中,特异性中脑多巴胺能神经元(midbrain dopaminergic neuron;mda神经元)用酪氨酸氢氧化物酶(tyrosine hydroxylase;th)进行免疫染色分析的结果照片。
151.图12是根据本发明的实施例,分化第21天的中脑类器官的形态照片(上)、分化率和形态分类图(中)和标准形态照片(下)。
152.图13a是根据本发明的实施例,分化第21天的细胞凋亡标记基因表达情况的图表。
153.图13b是根据本发明的实施例,分化第21天的前脑标记基因表达情况的图表。
154.图13c是根据本发明的实施例,分化第21天的中脑标记基因表达情况的图表。
155.图13d是根据本发明的实施例,分化第21天的后脑标记基因表达情况的图表。
156.图14a是根据本发明的实施例,不同初始起始细胞数形成的中脑类器官大小按日期比较的照片。
157.图14b是根据本发明的实施例,不同初始起始细胞数形成的中脑类器官大小按日期比较的图表。
158.图15a是根据本发明的实施例,不同初始起始细胞数形成的分化第21天的中脑类器官中的特异性中脑多巴胺能神经元以th显示的免疫染色分析结果照片。
159.图15b是免疫染色分析结果图,该图显示了根据本发明的实施例,不同初始起始细胞数形成的分化第21天的中脑类器官中的特异性中脑多巴胺能神经元的比例。
160.图16a是根据本发明的实施例,不同初始起始细胞数形成的分化第21天的中脑类器官中,显示死核大小的免疫染色分析结果照片。
161.图16b是根据本发明的实施例,不同初始起始细胞数形成的分化第21天的中脑类器官中,显示死核大小的免疫染色分析结果图表。
162.图17是根据本发明的实施例,在500个初始起始细胞数条件下生产的中脑类器官的神经元类型和其他细胞组成的免疫染色分析结果照片。
163.图18是根据本发明的实施例,在96、384孔板高速批量筛选(high throughput screening;hts)平台生产的中脑类器官,以高内涵成像(high content imaging;hci)显示分析结果的照片。
164.图19是根据本发明的实施例,用现有方法生产的中脑类器官和高速、大规模生产的中脑类器官的形态(上)和大小(下)的照片和结果图表。
165.图20是根据本发明的实施例,为了确认高速、大规模生产的中脑类器官个体之间的变异,比较了各中脑类器官个体之间基因表达情况的图表。
166.图21是根据本发明的实施例,对高速、大规模生产的中脑类器官中神经黑色素的生成结果进行分析的照片。
167.图22是根据本发明的实施例,高速、大规模生产的中脑类器官中,通过黑色素染色法(fontana-masson)染色技术确认神经黑色素生成的照片。
168.图23是根据本发明的实施例,用现有方法生产的中脑类器官与高速、大规模生产的中脑类器官的电生理学活性的比较结果。
169.图24是表示根据本发明的实施例,用神经毒性物质6-ohda和mptp处理的高速、大规模生产的中脑类器官的形态和大小变化的照片(上)和图表(下)。
170.图25是根据本发明的实施例,用神经毒性物质6-ohda和mptp处理的高速、大规模生产的中脑类器官的细胞凋亡标记(上)和中脑标记(下)基因表达情况的图表。
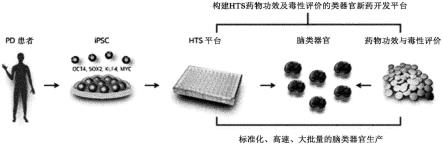
171.图26是根据本发明的实施例,构建hts药物功效及毒性评价的类器官新药开发平台的示意图。
具体实施方式
172.根据本发明的实施例作进一步的说明。但是,这些实施例只是为了举例说明本发明,本发明的范围并不是由这些实施例限定的。
173.在本说明书中,除非另有说明,否则用于表示特定物质浓度的“%”,固体/固体为(重量/重量)%,固体/液体为(重量/体积)%,液体/液体为(体积/体积)%。
174.实施例1.制备类器官
175.按以下过程制备类器官。
176.(第0天)细胞数分别为5
×
101、1
×
102、2.5
×
102、5
×
102、1
×
103、3
×
103、5
×
103、7
×
103、1
×
104的人类胚胎干细胞(human embryonic stem cell;hesc)与cob1培养基—起:在具有50μm y-27632和4ng/ml基本纤维母细胞生长因子(bfgf)的u形96孔板中接种。(gob1:包括以下补充物的dmem/f12(corning)和neurobasal培养基(gibco)的1:1混合物:100
×
n2补充剂(gibco)、50
×
b27w/o维生素a(gibco)、1%青霉素/链霉素(penicillin/streptomycin;ps)(gibco)、1%glutamax
tm
(gibco)、1%neaa(非必需氨基酸;gibco)、55μmβ-疏基乙醇(mercaptoethanol;gibco)、1μg/ml肝素(sigma)。
177.(第1~4天)胚状体(embryoid body;eb)的形成,在cob1中添加3μm chir99021、2μm二氢脱氧吗啡(dorsomorphin)、2μm a83-01、1μm wnt信号传达系统抑制剂iwp2。此时期的处理时间仅限于第2天、第3天至第4天。
178.(第4~7天)cob1中添加3μm chir99021、2μm dorsomorphin、2μm a83-01、1μmwnt信号传达系统抑制剂iwp2、2μg/ml sag(statoacoustic ganglion)和100ng/ml fgf8(成纤维细胞生长因子8;fibroblast growth factor 8)。到第7天为止更换上述培养基,此时期的处理时间是第5天、第6天至第7天。
179.(第7天)在冰中溶解基质胶(matrigel)约4个小时。在cob1培养基中加入100ng/ml fgf8、2μg/ml sag、2.5μg/ml胰岛素(insulin)和200ng/ml层粘连蛋白(laminin)。将溶解后的基质胶(matrigel)添加到培养基中。然后更换类器官的培养基。
180.(第9天)用包括10ng/ml脑源性神经营养因子(brain-derivedneurotrophic factor;bdnf)、10ng/ml胶质细胞源性神经营养因子(glial cell line-derivedneurotrophic factor;gdnf)、200μm抗坏血酸,以及125μm camp的bmm(基础矿物培养基;basal mineral medium)培养基与cob2培养基一起对培养基进行更换。每两天更换一次培养基。(cob2:包括以下补充物的dmem/f12(corning)和neurobasal培养基(gibco)的1:1混合物:100
×
n2补充剂(gibco)、50
×
b27w/o维生素a(gibco)、1%ps(gibco)、1%glutamax
tm
(gibco)、1%neaa(gibco)、55μmβ-疏基乙醇(gibco)、1μg/ml肝素(sigma)。
181.实施例2.确认分化第7天的类器官特性
182.2-1.确定类器官的生存率和质量
183.利用高速批量筛选(high throughput screening;hts)平台(platform),即从96孔板中形成eb,诱导中脑类器官分化,是成熟和新药开发等作为实现应用研究一元化的第一阶段,测试了不同的初始细胞数(starting cell number)。为此,将分离的单个细胞hesc按每孔500、1,000、3,000、5,000、7,000以及10,000个,接种到96孔板中。观察分化情况,结果显示在图4中。类器官的质量区分为:第1类(发育的早期神经干细胞(developing neural rosette))、第2类(亮圆形eb)和第3类(破裂的eb)。
184.从图4中可以看出,对第7天的存活率和eb质量进行了比较,结果显示,接种的分离细胞数分别为500、1,000和3,000个时,虽然类器官的体积大小略小,但是整体质量较好;但是接种的分离细胞数为5,000以上时,类器官多为第2类。判定标准,以第1类为最优秀。
185.2-2.确定类器官的基因表达特征
186.为了了解类器官基因的表达情况,全分化功能(pluripotency)标记包括oct4和nanog,中内胚层(mesoendoderm)标记包括eomes、mxl1和t,神经外胚层(neuroectoderm)标记包括n-cad、plzf、sox1、sox2和nestin。对于所述标记,确认了其在类器官中的表达量,结果如图5a至图5c所示。qpcr使用的引物序列如表1所示。
187.表1
188.序号名称序列(5
’→3’
)1oct4_f引物gacagggggagggagggaggctagg2oct4_r引物cttccctccaaccagttgccccaaac3nanog_f引物tgcaacctgaagacgtgtga4nanog_r引物ctatgagggatgggagga5eomes_f引物ctcaaaaggcatgggagggta6eomes_r引物caccaccaagtccatctgcaa7mxl1f引物acaacgctcttgaacgacgaa8mxl1r引物cggcaacatcaactgacaac9t_f引物cgcctcatagcctcatggac10t_r引物cactggctgccacgacaaa11ncad-f引物tgatgaagaaggtggaggagaaga12ncad-r引物attcgtcggattcccacagg13plzf-f引物tcccgcccgactggaggata14plzf-r引物ttctttcctgtgctccccgctc15sox1-f引物gccgagtggaaggtcatgtc16sox1-r引物ttcttgagcagcgtcttggtc17sox2-f引物agactgcacatgagccagaca18sox2-r引物cgtctccagccagcttcaac19nestin-f引物aggaaaaagaccatctgcccg20nestin-r引物gcctcttcagccagaaaccat
189.从图5a至5c可以看出,基因的表达方式大体上也呈现出相似的模式。全分化功能及中内胚层标记未表达,仅表达神经外胚层标记,确认了hts平台生产的中脑类器官中早期神经分化正常。
190.实施例3.确认分化第14天的类器官特性
191.3-1.类器官的生存率和质量鉴定
192.按照实施例1的方法制造的分化第14天的类器官,在生存率和形态方面因初始起始细胞数不同而出现不同的情况。类器官的质量包括第1类(明亮的边缘的早期神经干细胞(bright edge with neural rosette))、第2类(异常分化形成)、第3类(被异常的分化覆盖)和第4类(又深又暗的eb)。结果显示在表2、图6中。
193.表2
194.细胞数5001,0003,0005,0007,00010,000第1类(个)302526161515第2类(个)051131第3类(个)003111211第4类(个)000203合计303030303030
195.从表1、图6可以看出,在细胞数量大于5,000个的情况下,中脑类器官表面出现了大量异常分化(out-growth),但在使用500至3,000个分离细胞的情况下,在没有异常分化的情况下,产生了高质量的中脑类器官。
196.3-2.确定类器官的基因表达特征
197.另外,为了了解基因的表达情况,细胞凋亡(apoptosis)标记包括bax、bad和pma1p1,前脑(forebrain)标记包括foxgl、lhx2和six3,中脑(midbrain)标记包括lmx1b、ascl1、th,以及后脑(hindbrain)标记包括ha1、hb4和hc9。结果分别显示在图7a至7d中,qpcr中使用的引物序列如表3所示。
198.表3
199.[0200][0201]
从图7可以看出,在所有情况下,只有中脑标记被特异性地表达,确认了随着初始细胞数的增加,细胞凋亡标记的表达也增加。
[0202]
3-3.确定初始细胞数对类器官形成的影响
[0203]
如果使用500个以下的细胞,为了调查对中脑类器官形成的影响,使用100、250和500个细胞再次进行了上述实验,结果显示在图8、9a至9c中。qpcr中使用的引物序列显示在表1、3和表4中。
[0204]
表4
[0205]
序号名称序列(5
’→3’
)45krox20-f引物accgcctctctctctcttatt46krox20-r引物gggtaggccagagaggaaga
[0206]
从图8中可以看出,分化第14天的类器官与分化第7天的类器官相比,形态上没有太大差异。但是,从图9a至9c可以看出,细胞数为100和250的类器官中,在早期(第7天)发现神经外胚层标记n-cad、sox2和plzf的表达,发现第14天中脑标记lmx1b、ascl1和th的表达较低,相反,后脑标记hc9、hal、hb4和krox20的表达有所增加。因此,上述结果表明,使用500个细胞的情况下,中脑类器官的生产效率最高。
[0207]
3-4.384孔板中初始起始细胞数对类器官形成的影响
[0208]
为了大规模生产中脑类器官,确认了基于384孔板的中脑类器官的生产条件。为了在384孔板(~90μl)的体积比96孔板(~330μl)少的情况下生产中脑类器官,将起始细胞数以50、100、200、300和500来确认其效果,结果显示在图10a和10b中。
[0209]
从图10a中可以看出,分化第30天的中脑类器官无论起始细胞的数量如何,都显示出相似的形态和大小。
[0210]
但是,如图10b所示,在起始细胞数为50、100和200个的情况下,与500个的情况相比,中脑标记th、acsl1、lmx1b的表达更高。因此,上述结果表明,如果使用384孔板生产中脑类器官,使用50、100和200个起始细胞的效率最高。
[0211]
3-5.确定类器官特异性中脑多巴胺能神经元数
[0212]
分化第14天的中脑类器官中,观察特异性中脑多巴胺能神经元(midbrain dopaminergic neuron;mdaneuron),结果显示在图11中。如图11所示,如果使用了500个初始起始细胞,则通过酪氨酸氢氧化物酶(tyrosine hydroxylase;th)的表达确定了mda神经元最均匀地存在。
[0213]
实施例4.确定分化第21天的类器官特性
[0214]
4-l.确定类器官的生存率和质量
[0215]
根据实施例1的方法,调查了制造的分化第21天的中脑类器官的生存率和质量。类器官的质量分为第1类(早期神经干细胞发育(neural rosette development))、第2类(光滑的类器官)、第3类(以异常分化覆盖)和第4类(破裂的类器官)。结果显示在表5和图12中。
[0216]
表5
[0217]
细胞数5001,0003,0005,0007,00010,000第1类(个)2480000第2类(个)61710101116第3类(个)052015148第4类(个)000556合计303030303030
[0218]
如表5和图12所示,使用了500或1,000个时完全减少了异常分化的可能性,观察到由神经上皮细胞层形成的中脑类器官的生成,而使用3,000个以上的情况下,异常分化现象非常严重,仅生成低质量的中脑类器官。
[0219]
4-2.确定类器官的基因表达特征
[0220]
为了了解基因的表达情况,选择细胞凋亡标记为bax、bad和pma1p1,前脑标记为foxg1、lhx2和six3,中脑标记为lmx1b、ascl1和th,后脑标记为ha1、hb4和hc9。确认表达量后,结果分别显示在图13a至13d中,qpcr中使用的引物序列在表3中显示。
[0221]
图13a至图13d显示,使用3,000个细胞时,细胞凋亡标记的表达增加,使用3,000至10,000个细胞时,部分中脑基因中的表达量有所减少。
[0222]
因此,在hts平台上确认了在生产中脑类器官时初始起始细胞数量起着非常重要的作用。
[0223]
4-3.比较类器官的大小
[0224]
比较分化第7、14和21天的使用500至10,000个细胞形成的中脑类器官的大小,结果显示在图14a和14b中。
[0225]
如图14a和14b所示,在500至10,000个的条件下,大小都差不多,这意味着对于中脑类器官的生产,500至1,000个初始起始细胞数已经足够。
[0226]
4-4.确定类器官特异性中脑多巴胺能神经元的数量
[0227]
在分化第21天的中脑类器官中,确定了特异性中脑多巴胺能神经元的数量,结果显示在表6、图15a和15b中。
[0228]
表6
[0229]
细胞数5001,0003,0005,0007,00010,000细胞内的比率(%)12.67.04.93.03.91.4
[0230]
如表6、图15a和15b所示,500、1,000个细胞数时,特异性中脑多巴胺能神经元更
多,且均质地存在。这表明在hts平台上,最合适的初始起始细胞数为500、1,000个。
[0231]
特别是,如图16a和16b所示,在初始起始细胞数1,000个以下的情况下,证实了类器官中出现的共同问题“死核”现象受到了非常有效的抑制。
[0232]
另外,如图17所示,500个初始起始细胞生产的中脑类器官均含有th阳性的mda神经元,也有表达girk2(g蛋白激活内流钾通道蛋白2;gprotein-activated inward rectifier potassium channel 2)的成熟a9型(type)mda神经元。更进一步地发现星形胶质细胞(astrocyte),确认了少突胶质细胞(oligodendrocyte)和多种子类型神经元的存在。
[0233]
4-5.确定类器官的形态
[0234]
最终使用500个细胞,在96、384孔hts平台上生产类器官,用高内涵成像(high content imaging;hci)设备观察其形态,如图18所示。
[0235]
从图19中可以看出,培养第30天96孔板的所有类器官中,大部分类器官的直径在0.9至1.4mm的范围内,非常均匀地生产了相同的中脑类器官。相反,在不使用微孔板的情况下,用一般传统方法生产的中脑类器官,发现其形态和大小呈现非常不均匀的状态。在其他种类的人类胚胎干细胞或人类诱导多能干细胞中也得到了类似的结果。
[0236]
从图20可以看出,高速、大规模生产的96孔板中的中脑类器官的基因表达情况在单个中脑类器官中得到确认,观察到90%以上的中脑类器官比现有技术生产的中脑类器官更好,其余约10%的情况也与现有技术生产的中脑类器官有相似水平的基因表达情况。这意味着高速、大规模生产的中脑类器官具有非常均匀的特性,没有个体间变异。因此,中脑类器官高速、大规模生产技术可以作为今后中脑类器官技术产业化的标准化技术。
[0237]
实施例5.高速、大规模生产中脑类器官的功能性验证
[0238]
为了验证高速、大规模生产中脑类器官的功能性,进行了神经黑色素生成和电生理分析,结果如图21和22所示。
[0239]
从图21可以看出,在高速、大规模生产中脑类器官的情况下,分化第30天产生神经黑色素。考虑到用一般方法生产的中脑类器官中神经黑色素的形成在诱导分化超过100天的情况下才被观察到,从而确认了高速、大规模生产的在30天内诱导分化的中脑类器官与一般方法超过数月的中脑类器官具有相似的功能性。
[0240]
如图22所示,通过fontana-masson染色再次确认了高速、大规模生产的中脑类器官内神经黑色素的形成。
[0241]
作为高速、大规模生产的中脑类器官功能性验证的一部分,通过测量神经信号放电率进行了电生理分析。结果显示,正如图23所示,用一般方法生产的中脑类器官的情况是分化第70天之前没有电生理活性,但高速、大规模生产的中脑类器官的情况是从分化第20天开始,神经放电率明显提高,分化第30天,神经放电率急剧增加。
[0242]
这意味着与传统方法相比,通过本技术生产的高速、大规模生产的中脑类器官的功能成熟模式非常快,因此,通过本技术,在分化第30天就可以生产功能成熟的中脑类器官。
[0243]
实施例6.以高速、大规模生产中脑类器官为基础的体外药物毒性评价。
[0244]
作为药物疗效和毒性评价平台,为了验证高速、大规模生产中脑类器官的应用可能性,进行了以高速、大规模生产的中脑类器官为基础的体外药物毒性评价硏究,结果如图
24和25所示。
[0245]
具体地,在高速、大规模生产的中脑类器官中,用诱导多巴胺神经细胞凋亡的神经毒性物质6-ohda(6-羟基多巴胺;6-hydroxydopamine)和mptp(1-甲基-4-苯基-1,2,3,6-四氢吡啶;l-methyl-4-phenyl-l,2,3,6-tetrahydropyridine)进行处理,分别以浓度100、250、500μm处理10天后,测定中脑类器官的面积。
[0246]
从图24中可以看出,根据各神经毒性物质的浓度,中脑类器官的大小减少了。
[0247]
另外,如图25所示,在用神经毒性物质对中脑类器官进行处理的情况下,与毒性物质的浓度成正比,细胞凋亡相关标记的表达增加,确认了中脑标记表达的减少。上述结果表明,作为体外药物疗效及毒性评价的新药开发平台,中脑类器官具有其利用潜力。
[0248]
总之,如图26所示,基于中脑类器官超高速、大规模生产和标准化技术,开发用于评价药物功效和毒性的新药开发平台等多种以中脑类器官技术为基础的产业化联动技术是可行的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1